CAPITOLO SECONDO
L’attività cerebrale nei soggetti con ictus
2. 1 Il Sistema Nervoso Centrale: cenni di anatomia e
fisiologia
Figura 43. L’encefalo
Il sistema nervoso, sede della raccolta, dell‟elaborazione e della trasmissione delle informazioni relative all‟ambiente esterno ed interno al corpo umano è anatomicamente suddiviso in due parti: il Sistema Nervoso Centrale o nevrasse (SNC) e il Sistema Nervoso
Periferico (SNP).
Il Sistema Nervoso Centrale è costituito dal cervello o encefalo, racchiuso nella scatola cranica, e dal midollo spinale, contenuto nel canale vertebrale. Ogni segmento midollare ha la capacità di controllare autonomamente delle funzioni motorie specifiche. Il SNC è responsabile dell'analisi e della coordinazione dei dati sensoriali e dei comandi motori. E' anche la sede di funzioni più importanti quali l'intelligenza, la memoria, l'apprendimento e le emozioni.
A differenza del Sistema Nervoso Periferico, il SNC non è solo in grado di raccogliere e trasmettere informazioni, ma anche di integrarle.
Il Sistema Nervoso Periferico è costituito dal tessuto nervoso al di fuori del SNC. Esso svolge la funzione di trasmissione, attraverso fasci di conduzione, dei segnali afferenti da
un‟unità periferica (organi) verso il Sistema Nervoso Centrale, o dal Sistema Nervoso Centrale in uscita (efferenti) verso un‟unità periferica.
Il Sistema Nervoso Centrale è una struttura bilaterale e simmetrica, tradizionalmente divisa in sei regioni, ciascuna delle quali può essere ulteriormente suddivisa in aree anatomicamente e funzionalmente distinte. Le principali regioni sono il bulbo, il ponte, il cervelletto, il
mesencefalo, il diencefalo, e gli emisferi cerebrali o telencefalo.
Figura 44. Le principali regioni in cui è suddiviso il cervello
Gli emisferi cerebrali sono la regione più vasta del Sistema Nervoso Centrale e comprendono la corteccia cerebrale, la sostanza bianca sottostante e tre formazioni nucleari profonde: i nuclei della base, l‟amigdala e la formazione dell‟ippocampo. Gli emisferi cerebrali sono implicati in funzioni percettive, motorie e cognitive.
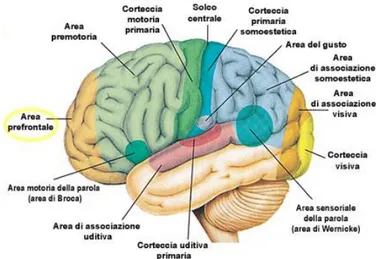
La maggior parte delle funzioni cerebrali trova una localizzazione nella corteccia che ricopre gli emisferi cerebrali e nella quale tutte le informazioni sono elaborate ed integrate. La corteccia cerebrale è una struttura molto complessa la cui morfologia, intensamente irregolare, è il risultato della particolare evoluzione cerebrale dei primati, durante la quale il volume dell‟encefalo è aumentato più rapidamente del volume del cranio, portando alla formazione di un gran numero di fenditure dette solchi e di circonvoluzioni, le cui creste prendono il nome di giri. Alcuni solchi sono comuni a tutti gli individui, tanto che si è deciso di usarli come zone di riferimento; la corteccia di ogni emisfero è stata così divisa in quattro
lobi: frontale, parietale, temporale ed occipitale. Il solco di Rolando (o centrale) decorre
verticalmente a metà distanza tra il polo occipitale e quello frontale dell'emisfero. Anteriormente al solco di Rolando si estende il lobo frontale, sede delle funzioni motorie. Posteriormente, invece, è presente il lobo parietale sede della percezione ed interpretazione delle sensazioni. Il lobo occipitale è sito posteriormente al lobo parietale, in esso sono
localizzare le aree visive. Il lobo temporale è posto al di sotto dei lobi frontale e parietale ed è da essi separato dalla scissura di Silvio. In questo lobo è presente la corteccia uditiva. Il lobo dell' insula, sito internamente al di sotto della scissura di Silvio, ha forma grossolanamente triangolare ed è la sede delle emozioni.
Figura 45. Raffigurazione delle aree in cui è suddivisa la corteccia
Nel corso degli studi anatomo-fisiologici, si è scoperto che determinate aree della corteccia cerebrale sovrintendono specifici compiti cognitivi e motori. Punto fermo di questa teoria è il lavoro dell‟anatomista Brodmann, autore, già agli inizi del „900, di una classificazione della superficie corticale in aree omogenee dal punto di vista citoarchitettonico. La rappresentazione non è la trasposizione diretta delle diverse parti del corpo, ma è somatotopica, vale a dire l'ampiezza delle diverse porzioni corticali dedicati ai singoli distretti corporei non corrisponde alle dimensioni delle corrispondenti parti periferiche. Le dimensioni e l‟ordine delle diverse parti corporee dipendono dall‟ampiezza del tessuto cerebrale motorio dedicato. Ne risulta un corpo umano distorto, un così detto homunculus con bocca, mani e piedi molto sviluppati.
Il tessuto nervoso comprende due distinte popolazioni cellulari. La prima di queste è costituita dalle cellule nervose o neuroni, cui è affidato il compito di generare e propagare i segnali nervosi, responsabili, quindi, del trasferimento e dell‟elaborazione delle informazioni. L‟altra popolazione è formata dalle cellule di sostegno o neuroglia, che rappresentano gli elementi di supporto, tali da fornire forma e consistenza al tessuto stesso (anche se ultimamente il ruolo di queste cellule è stato riconsiderato). A causa dello scarso contributo fornito dalle cellule gliali alla generazione del segnale elettroencefalografico, si focalizzerà l‟attenzione sulla prima classe.
Figura 46. Rappresentazione delle parti corporee nella corteccia: l’homunculus di Penfield.
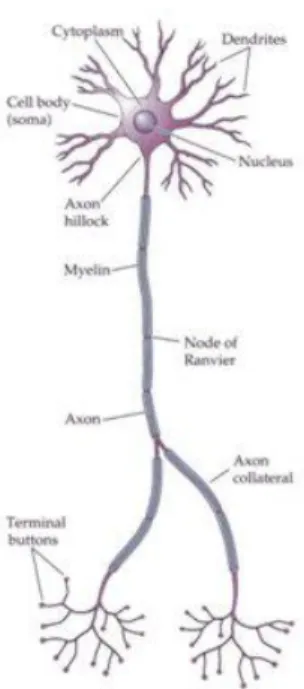
In ogni neurone si distinguono quattro parti: il corpo cellulare o soma, i dendriti (molteplici sottili ramificazioni del soma), una lunga fibra nervosa detta assone o neurite, e le
terminazioni presinaptiche dell’assone. Gli assoni sono spesso ricoperti da cellule gliali, le
cellule di Schwann, che formano un rivestimento, chiamato guaina mielinica, interrotto all‟incirca ogni millimetro da un tratto di assone non mielinizzato, della lunghezza di circa 10 μm, chiamato nodo di Ranvier. In tali fibre (dette mieliniche) l‟impulso nervoso viaggia per salti da un nodo di Ranvier al successivo.
Il passaggio delle informazioni da un neurone agli altri avviene mediante punti di contatto che prendono il nome di sinapsi. Il bottone presinaptico rappresenta la terminazione dell‟ assone: tra il bottone terminale del neurone presinaptico e il soma del neurone postsinaptico vi è la fessura sinaptica di pochi nanometri. L‟impulso elettrico viene trasmesso da un neurone ad un altro tramite una trasduzione chimica. Normalmente la cellula nervosa, quando si trova in stato di riposo, presenta un voltaggio negativo di circa -70 mV. Tale potenziale di membrana a riposo, dipende dal fatto che la membrana neuronale è più permeabile ad alcuni ioni rispetto ad altri. Quando un neurone è stimolato e raggiunge un valore soglia (di circa -55 mV), allora è in grado di scaricare (lungo l'assone) verso un altro neurone, un muscolo o una ghiandola. Quando il potenziale d'azione raggiunge l'estremità di un assone, il messaggio che veicola è convertito da segnale elettrico a segnale chimico, in modo che sia possibile trasmetterlo alla cellula successiva. Le sostanze chimiche che garantiscono il collegamento sono i neurotrasmettitori, molecole sintetizzate nel corpo cellulare del neurone, e
immagazzinate nelle vescicole sinaptiche: ad esempio l'acetilcolina, la noradrenalina, la dopammina, la serotonina, il glutammato e il GABA.
Figura 47. Struttura del neurone.
Quando il potenziale d‟azione raggiunge il bottone terminale le vescicole sinaptiche liberano i neurotrasmettitori che attraversano lo spazio sinaptico, raggiungono e si legano ai recettori di membrana presenti sul soma del neurone ricevente o postsinaptico. Il neurotrasmettitore legandosi ai recettori-canale ne causa l‟apertura, quindi nella membrana postsinaptica avviene uno spostamento di ioni e si crea una differenza di potenziale di tipo elettrotonico; se tale differenza di potenziale supera una certa soglia si avrà la creazione di un nuovo potenziale d‟azione che si propagherà lungo l‟assone della cellula.
Per comprendere l‟origine, a livello cellulare, dei segnali cerebrali, occorre conoscere l‟elettrofisiologia del neurone. In tale ottica è necessaria una descrizione dei modelli spaziali e temporali delle correnti che attraversano le membrane neuronali e di quelle secondarie da esse indotte, oltre che dei fattori biofisici che influenzano il modo in cui tali correnti si propagano ai siti di registrazione.
In condizioni basali, la membrana cellulare di un neurone presenta una permeabilità diversa ai vari tipi di ioni, in particolare agli ioni Sodio (Na+), Potassio (K+) e Cloruro (Cl-),
cosicché si stabilisce una differenza di potenziale elettrico tra l‟ambiente intracellulare e quello extracellulare pari a circa -70 mV. Se un impulso (potenziale d’azione) raggiunge una sinapsi, si sviluppa, attraverso la membrana cellulare, un potenziale postsinaptico (PPS), il quale può assumere un comportamento inibitorio od eccitatorio a seconda che incrementi (iperpolarizzazione) o decrementi (depolarizzazione) la differenza di potenziale ai capi della membrana del neurone a valle. Il potenziale d‟azione si genera nel caso in cui si abbia, in corrispondenza della porzione dell‟assone più vicina al soma, una depolarizzazione che supera un determinato valore di soglia (circa 10 mV) e consiste in un improvviso cambiamento della permeabilità della membrana dell‟ assone ai differenti ioni. Mentre, la trasmissione del segnale attraverso i dendriti è di tipo decrementale, ovvero l‟ampiezza del potenziale elettrico tende a ridursi durante il suo viaggio verso il corpo cellulare, per quanto concerne l‟assone, il segnale trasmesso ha ampiezza costante e indipendente dal valore di partenza (purché quest‟ultimo sia al di sopra della soglia). L‟uniformità dell‟ampiezza del segnale condotto lungo l‟assone (il potenziale d‟azione) deriva dal fatto che il segnale si autorigenera mentre viene trasmesso, ed è una caratteristica estremamente importante, che assicura il raggiungimento, da parte dell‟informazione, anche delle sinapsi più distali. Il potenziale d‟azione ha, dunque, sempre la stessa forma: una depolarizzazione seguita da un rapido fronte di ripolarizzazione.
Il cervello umano è formato da una rete estremamente complessa di neuroni (circa 1010), variamente interconnessi fra loro per mezzo di numerose fibre nervose.
La corteccia cerebrale contiene diversi tipi di neuroni che, in base alla morfologia, alla disposizione laminare e ai neurotrasmettitori che utilizzano, possono essere raggruppati in due classi principali: quella delle cellule piramidali e quella delle cellule genericamente indicate come non piramidali. Caratteristica peculiare dei neuroni piramidali è la disposizione corticale: i dendriti apicali attraversano diversi strati corticali e sono sempre orientati perpendicolarmente alla superficie della corteccia. Questa organizzazione dendritica facilita l‟integrazione dei vari segnali afferenti.
Figura 49. Il potenziale d’azione
I neuroni piramidali possiedono anche collaterali assoniche ricorrenti che proiettano localmente all‟interno dell‟area da cui originano; alcune di queste collaterali possono decorrere per molti millimetri in piani paralleli agli strati corticali. Le connessioni stabilite dalle collaterali assoniche svolgono un importante ruolo funzionale nella genesi dell‟attività elettrica complessiva degli aggregati neurali corticali. I campi elettrici generati dalle cellule piramidali, se sincroni, possono sommarsi ed essere registrati mediante elettrodi posti sullo scalpo (analogamente, i campi magnetici possono sommarsi ed essere registrati da sensori magnetoencefalografici). Le cellule non piramidali hanno assoni corti, che non lasciano la corteccia, ma proiettano a neuroni locali e, pertanto, sono chiamate interneuroni. Dal punto di vista morfologico, gli interneuroni costituiscono una popolazione eterogenea. Tali cellule sono spesso disposte radialmente o con orientamento casuale, quindi non preferenziale rispetto alla superficie della corteccia; questo fa sì che i campi da loro generati non si sommino e che, quindi, le correnti intracellulari ed extracellulari da cui sono interessati non producano campi elettrici e magnetici misurabili dall‟esterno.
2. 2 Patologia trattata: emiparesi dovuta ad ictus
Secondo la definizione dell‟Organizzazione Mondiale della Sanità (OMS), l‟ictus è l'improvvisa comparsa di segni e/o sintomi riferibili a deficit focale e/o globale delle funzioni cerebrali, di durata superiore alle 24 ore o ad esito infausto, non attribuibile ad altra causa apparente se non a vasculopatia cerebrale. L'ictus è un‟ emergenza medica (“attacco cerebrale”) e deve essere prontamente diagnosticato e trattato in ospedale per l‟elevato rischio di disabilità e di morte che esso comporta. La definizione di ictus comprende, sulla base dei
dati morfologici, l'ictus ischemico, più frequente, l'ictus emorragico, nel 15% dei casi, e alcuni casi di emorragia subaracnoidea (ESA). L'errore nel diagnosticare l'ictus non supera il 5% dei casi, ed è raro anche se il medico non è uno specialista neurologo.
L‟ictus ischemico è una condizione caratterizzata dall‟ occlusione di un vaso (ischemia) a causa di una trombosi o di un‟embolia o, meno frequentemente, da un‟improvvisa e grave riduzione della pressione di perfusione del circolo ematico. Si distinguono diversi tipi di ictus ischemico: da patologia delle arterie di maggiore calibro (arterie carotidi, arterie vertebrali o arteria basilare), responsabili di infarti che colpiscono la corteccia e le strutture sottocorticali, da patologie dei vasi di piccolo calibro (arterie perforanti) che causano infarti sottocorticali o lacune, e da patologie cardiache (cardioembolico), causati da emboli a partenza cardiaca. L‟ictus emorragico (emorragia intracerebrale primaria) è una condizione determinata dalla presenza di un‟emorragia intracerebrale non traumatica. L‟emorragia cerebrale primaria rappresenta l‟80% circa di tutte le emorragie cerebrali ed è causata più frequentemente dall‟ipertensione arteriosa. Un terzo circa dei sanguinamenti cerebrali nelle persone anziane è causato invece dall‟angiopatia amiloide, caratterizzata da emorragie cerebrali a carattere ricorrente e con localizzazione lobare.
Talvolta l‟ictus ischemico può presentare emorragie nel proprio ambito, dovute alla lesione dei vasi secondaria all‟ischemia.
L‟attacco ischemico transitorio (TIA) si differenzia dall‟ictus per la durata, nel TIA inferiore alle 24 ore, di solito pochi minuti.
Infine l‟emorragia subaracnoidea (ESA) è una condizione in cui si verifica la presenza di sangue nello spazio subaracnoideo. L‟ESA spontanea (non traumatica) è dovuta nell‟85% dei
casi alla rottura di un aneurisma, nel 10% dei casi si tratta di un‟ESA idiopatica, non aneurismatica, caratteristicamente a localizzazione perimesencefalica, e nel restante 5% da cause rare (per esempio dissezione arteriosa, malformazioni venose, fistole artero-venose durali).
Nei soggetti adulti normali, i movimenti motori del lato destro e sinistro del corpo vengono controllati controlateralmente nel cervello (ad esempio il movimento del braccio destro è controllato dal lato sinistro del cervello). Quindi se un ictus colpisce un‟area sensoria o motoria del cervello, si osserveranno deficit sensoriali e motori nel lato del corpo controlaterale alla lesione cerebrale.
I deficit motori si possono manifestare come emiparesi, emiplegia e afasia motoria. Nell‟emiparesi i muscoli non sono più in grado di generare forza e movimenti veloci così che l‟arto si mostra debole e lento nell‟eseguire movimenti, l‟emiplegia invece è la paralisi totale
di un lato del corpo. I soggetti che presentano afasia possono avere problemi nell‟esecuzione dei movimenti, ma hanno anche problemi cognitivi.
Ogni anno si verificano in Italia circa 196.000 ictus, di cui circa il 20% è costituito da recidive (39.000), circa il 20% muore entro il primo mese successivo all‟intervento e il 30% dei sopravvissuti si trova con esiti gravemente invalidanti.. L‟ictus cerebrale rappresenta la
seconda causa di morte a livello mondiale e la terza causa di morte nei paesi industrializzati,
dopo le malattie cardiovascolari ed i tumori. Stime per l‟anno 2005 hanno attribuito all‟ictus cerebrale 6 milioni di morti nel mondo. Entro l‟anno 2020 la mortalità per ictus sarà duplicata a causa dell‟aumento dei soggetti anziani e della persistenza dell‟abitudine al fumo di sigaretta. L‟ictus rappresenta anche la prima causa di disabilità nell‟anziano con un rilevante impatto individuale, familiare e sociosanitario. L‟incidenza dell‟ictus aumenta progressivamente con l‟età raggiungendo il valore massimo negli ultra ottantacinquenni. Il 75% degli ictus colpisce i soggetti di oltre 65 anni. Il tasso di prevalenza di ictus nella popolazione anziana (età 65-84 anni) italiana è pari al 6,5%, ed è leggermente più alto negli uomini (7,4%) rispetto alle donne (5,9%). In particolare negli ultraottantenni l‟incidenza di ictus raggiunge il 24,23% con una prevalenza maschile (28,25%) rispetto a quella femminile (21,79%). L‟ictus colpisce, sia pure in misura minore, anche persone giovani e si stima che ogni anno il numero di persone in età produttiva (<65 anni) colpite da ictus sia intorno a 27.000 [36]. La stima del costo delle cure di ospedalizzazione a causa di ictus nel 1998 è stato di $3,6 miliardi negli USA.
L‟ictus ischemico rappresenta la forma più frequente di ictus (80% circa), mentre le emorragie intraparenchimali riguardano il 15%-20% e le emorragie subaracnoidee il 3% circa. L‟ictus ischemico colpisce soggetti di età media superiore a 70 anni, più spesso uomini che donne; quello emorragico intraparenchimale colpisce soggetti leggermente meno anziani, sempre con lieve prevalenza per il sesso maschile; l‟emorragia subaracnoidea colpisce più spesso soggetti di sesso femminile, di età media sui 50 anni circa. La mortalità acuta (a 30 giorni) dopo ictus è pari a circa il 20% mentre quella ad un anno è pari al 30% circa; le emorragie (parenchimali e sub-aracnoidee) hanno tassi di mortalità precoce più alti (30% e 40% circa dopo la prima settimana; 50% e 45% ad un mese). Ad un anno dall‟evento acuto, un terzo circa dei soggetti sopravvissuti ad un ictus indipendentemente dal fatto che sia ischemico od emorragico presenta un grado di disabilità elevato, tanto da poterli definire totalmente dipendenti.
Gli studi epidemiologici hanno individuato molteplici fattori che aumentano il rischio di ictus. Alcuni di questi fattori, tra cui l'età, non possono essere modificati, ma costituiscono
tuttavia importanti indicatori per definire le classi di rischio. Altri fattori possono essere modificati con misure non farmacologiche o farmacologiche. Il loro riconoscimento costituisce la base della prevenzione sia primaria sia secondaria dell‟ictus. I fattori di rischio modificabili ben documentati sono: l‟ipertensione arteriosa, alcune cardiopatie (in particolare, fibrillazione atriale), il diabete mellito, l‟iperomocisteinemia, l‟ipertrofia ventricolare sinistra, la stenosi carotidea, il fumo di sigaretta, l‟eccessivo consumo di alcol e la ridotta attività fisica. La prevenzione primaria per tutti, ma specialmente per le persone a rischio, si basa su una opportuna informazione e su un‟ educazione a stili di vita adeguati. È stato infatti dimostrato che le modifiche degli stili di vita possono produrre una diminuzione dell‟incidenza e della mortalità dell‟ictus.
Il trattamento degli esiti dell‟ictus stabilizzato deve contemplare un approccio integrato (farmacologico, riabilitativo, antalgico, psicologico) mirante alla prevenzione delle recidive, al trattamento delle complicanze internistiche e psichiatriche e al trattamento riabilitativo.
Numerosi studi neurofisiologici hanno dimostrato come l‟esercizio fisico frutto di movimenti volontari produca risultati estremamente positivi a livello di neurogenesi e plasticità neurale perchè promuove il recupero funzionale dopo lesioni traumatiche del sistema nervoso centrale. La plasticità cerebrale è la capacità posseduta dal sistema nervoso di modificare la propria organizzazione funzionale a seguito di vari stimoli ambientali, alla pratica di compiti cognitivi e motori, in risposta ad agenti farmacologici ed a lesioni del sistema nervoso centrale e periferico.
La corteccia motoria primaria non è una struttura di controllo statica, ma è estremamente dinamica: è in grado di modificare la propria organizzazione anche solo dopo 30-40 minuti di esercizio attivo. Sfruttando la caratteristica di plasticità del sistema nervoso, la riabilitazione è preferibile al recupero spontaneo, indipendentemente dal tipo di fisioterapia scelto.
2. 2. 1 La valutazione funzionale dell’emiparesi dovuta ad ictus
mediante l’analisi dell’attività cerebrale (EEG)
Tutti i dispositivi robotici utilizzati per la riabilitazione motoria dei pazienti colpiti da ictus, come il MIT-Manus, l‟ARM Guide e il Lokomat, hanno dimostrato di apportare benefici terapeutici e di migliorare la funzionalità motoria degli arti superiori ed inferiori, ma è necessario approfondire lo studio degli effetti dei danni motori e cognitivi a seguito di una lesione neurologica.
Per capire i meccanismi alla base delle disabilità dei soggetti che hanno subito un ictus, è utile indagare l‟attività cerebrale, integrando le nuove informazioni con quelle mediche fornite dal terapista e biomeccaniche provviste dal sistema robotico, mappando l‟attività cerebrale durante movimenti controllati di reaching, e studiandone l‟evoluzione durante il corso della terapia.
L‟attività corticale che controlla e genera l‟attività motoria è diventata un importante campo di ricerca con l‟obiettivo di decodificare l‟attività elettrica del cervello ed utilizzarla come segnale di controllo per le brain-computer interfaces (BCI) o per le brain-machine interfaces (BMI) [37], [38], [39].
L‟impiego di queste interfacce è rivolto a migliorare la qualità della vita delle persone che soffrono di lesioni spinali e di malattie degenerative come la sclerosi laterale amiotrofica (SLA), che possono immaginare correttamente di compiere i movimenti, ma sono impossibilitate nell‟eseguirli: l‟attività neurale del cervello viene rilevata mentre i movimenti vengono immaginati, e tradotta in segnali di controllo per protesi o in movimenti del cursore del mouse a scopi comunicativi.
L‟attività neurale esiste e può essere rilevata anche nei soggetti con lesioni cerebrali, come i soggetti che hanno subito un ictus, nonostante l‟ischemia che colpisce il cervello. Proprio per studiare il danneggiamento neurale che causa un‟attività elettrica alterata, attualmente si stanno compiendo studi sull‟interpretazione del segnale EEG nei soggetti colpiti da ictus e il suo possibile utilizzo per BCI o BMI. I pazienti colpiti da ictus sono gli unici che possono beneficiare di questi dispositivi perché hanno possibilità di recupero motorio rispetto ai pazienti con lesioni spinali o a quelli colpiti da malattie degenerative; possono utilizzare BCI e BMI non solo come tecnologie per comandare protesi o dispositivi, ma come strumenti per la riabilitazione che possano permettere terapie mirate ad accertare ed incentivare la plasticità cerebrale per ristabilire il controllo motorio.
I dispositivi robotici devono essere dotati di BMI così da permettere lo studio dei meccanismi neurali che generano disabilità motoria e, sulla base di queste conoscenze, pianificare e realizzare una terapia mirata a recuperare i meccanismi ad alto livello, che lavori sulla plasticità cerebrale oltre che a ristabilire le funzionalità motorie. L‟integrazione di BMI e robot per la riabilitazione potrebbe permettere al terapista di compiere misure quantitative e di ristabilire corticalmente le abilità motorie perse, anziché solo funzionalmente a livello muscolare.
A questo scopo possono essere integrate alla terapia robotica non solo le tecniche di monitorizzazione dell‟attività cerebrale (EEG), ma anche le tecniche di imaging (fMRI, PET).
Nel campo della bioingegneria della riabilitazione accade quello che si verifica più in generale nel campo della robotica medica, come si può osservare nell‟evoluzione che interessa la chirurgia: in pochi anni dalla chirurgia tradizionale si è passati alla chirurgia mininvasiva (MIS) con l‟introduzione di strumenti miniaturizzati e dei laparoscopi, e quindi alla chirurgia computer assistita (CAS) dove le immagini non sono più solo uno strumento diagnostico o di pianificazione, ma diventano parte integrante della procedura chirurgica operativa [40]. Allo stesso modo, nella bioingegneria della riabilitazione si osserva come dalla terapia tradizionale effettuata dal terapista e valutata mediante le scale di valutazione, si sia passati alla realizzazione di robot come strumenti per il miglioramento della terapia, e infine all‟integrazione di dati multimodali, costituiti dai dati cinematici forniti dal robot e dati ottenuti mediante la registrazione di biopotenziali, o dalle tecniche di imaging.
In questo lavoro di tesi vengono utilizzati i segnali EEG per studiare e caratterizzare l‟attività cerebrale durante movimenti di reaching in soggetti sani e in soggetti colpiti da emiparesi dovuta ad ictus, utilizzando il sistema robotico MIT-Manus, per individuare le caratteristiche da impiegare per valutare quantitativamente il riapprendimento motorio e gli effetti della terapia riabilitativa verso l‟obiettivo finale della realizzazione di una terapia personalizzata che permetta il recupero funzionale.
2.
2.
2 Cenni di neuroimaging funzionale del recupero motorio
post ictus
I meccanismi e le basi biologiche del processo di recupero motorio nell‟uomo sono ancora sconosciuti [41]. Molte conoscenze sul recupero cerebrale e motorio di soggetti che hanno subito un ictus derivano dall‟osservazione diretta, perché solo da pochi anni sono possibili studi sulla funzionalità cerebrale grazie alla disponibilità di nuove sofisticate tecniche di imaging, come la tomografia ad emissione di positroni (PET), la risonanza magnetica funzionale (fMRI) e nuove tecniche elettrofisiologiche come la stimolazione elettrica transcranica (TMS).
Si trovano molti studi in letteratura ottenuti con la PET o la fMRI su pazienti con lesioni corticali o subcorticali dovute ad ictus.
Gli studi inizialmente si basavano sul confronto tra i pattern di attivazione di pazienti con ictus e di soggetti normali allo scopo di capire come il cervello che abbia subito un danno si
adatti alla lesione. In realtà molti di questi studi non si sono dimostrati efficaci a causa della variabilità tra soggetti sani e malati, e tra i soggetti malati.
La tendenza attuale è lo studio longitudinale nel tempo dello stesso paziente: viene monitorizzata l‟ attivazione neurale di uno stesso soggetto nel tempo.
Gli indici quantitativi ritenuti più significativi sono: l‟indice di lateralità (LI), lo spostamento delle coordinate di attivazione della corteccia sensomotoria, e il confronto dell‟attività cerebrale coi soggetti sani nel tempo: utilizzando questi indici sono state evidenziate le correlazioni tra i cambiamenti nel tempo e il concomitante recupero delle funzioni motorie. La fMRI e la PET hanno un‟alta risoluzione spaziale e sono sicuramente le tecnologie di imaging che meglio si prestano allo studio funzionale del recupero motorio a livello cerebrale, ma il loro utilizzo comporta dei problemi che spesso le rendono inutilizzabili: problemi di claustrofobia per i pazienti, la rappresentazione non in real time, la presenza di artefatti dovuta a movimenti involontari non controllati dai pazienti, la compromissione dei principi di funzionamento delle tecniche di imaging a causa della lesione stessa (PET), nonché l‟elevato costo dell‟esame.
Gli studi cross-sezionali [41] hanno mostrato, utilizzando la PET e la fMRI, le differenze tra i pattern di attivazione cerebrale in soggetti con ictus subcorticale e corticale. Nei pazienti completamente riabilitati con ictus striatocapsulare si è vista un‟aumentata attivazione bilaterale nei percorsi motori, il reclutamento di strutture addizionali sensorie e motorie secondarie di solito non richieste nel task motorio, e l‟estensione dell‟attivazione della regione sensomotoria. Nei pazienti con ictus corticali si sono notati pattern di superattivazione di aree non motorie o collegate alle aree motorie dell‟emisfero bilaterale non lesionato.
Gli studi longitudinali [41] hanno mostrato dei risultati in accordo con gli studi cross-sezionali. I risultati in particolare rivelano la superattivazione di aree motorie e non motorie in entrambi gli emisferi, sia che il task sia attivo o passivo, inoltre permettono di mostrare e seguire cambiamenti dinamici: un‟osservazione comune in tutti gli studi è che la superattivazione di entrambi gli emisferi diminuisce nel tempo, con una variabilità individuale. Alcune strutture, come la regione premotoria controlesionale, sviluppano una superattivazione successiva, come si era osservato anche negli studi cross-sezionali. Queste scoperte suggeriscono che il processo di recupero tende a smorzare la superattivazione per ripristinare un‟attività con intensità normale, e a reclutare altre aree in modo da “sostenere” il recupero. In caso di ictus corticale l‟attivazione delle regioni nell‟emisfero non lesionato può essere originata in parte dalla ridotta inibizione dalla corteccia sensomotoria lesionata. La sinkinesia controlaterale potrebbe essere una conseguenza, e non la causa, dell‟attivazione
dell‟emisfero non lesionato [41]. L‟attivazione controlesionale potrebbe verificarsi solo nella fase acuta o subacuta e diminuire durante il corso del recupero.
La superattivazione della corteccia sensomotoria ipsilesionale con il reclutamento bilaterale delle aree motorie secondarie avviene spesso negli ictus corticali e subcorticali, compreso il reclutamento di aree non coinvolte generalmente del movimento come la prefrontale, la parietale posteriore, la corteccia cingolata anteriore; il loro coinvolgimento riflette il tentativo di mettere in atto strategie cognitive compensatorie: la diminuzione del reclutamento nel tempo suggerisce il minor bisogno di compensazione man mano che il processo di recupero progredisce.
Due studi hanno preso in esame pazienti con ictus corticale e subcorticale. In uno di questi, sono stati osservati differenti pattern di attivazione dinamica, tra cui la focalizzazione dell‟attivazione nell‟area sensomotoria ipsilesionale rilevata sia nella prima fMRI (in accordo con l‟ictus subcorticale) che nel corso del tempo, e il reclutamento di pattern di attivazione prevalentemente al di fuori dell‟area sensomotoria ipsilesionale (osservata soprattutto nell‟ictus corticale). In un altro studio, fMRI effettuate in quattro periodi successivi rilevano un‟attivazione della corteccia motoria bilaterale che si evolve in attivazione ipsilesionale con l‟attivazione di altre aree oltre a quella esclusivamente motoria, come la regione motoria prefrontale e l‟area motoria supplementare. I dati mostrano che, a volte, la focalizzazione nell‟attivazione dell‟emisfero lesionato svanisce, anche se alcuni pazienti continuano a mostrare il reclutamento.
L‟attività nell‟emisfero controlesionale è più evidente nel periodo immediatamente successivo all‟ictus, quando le funzioni sensomotorie sono compromesse, mentre col tempo aumenta l‟attivazione della corteccia ipsilesionale permettendo l‟aumento parziale delle funzioni sensomotorie.
Per effettuare misure quantitative negli studi di imaging neurofunzionale è stato introdotto un indice, “Laterality Index” (LI), che rapporta l‟attivazione della regione sensomotoria lesionata e non lesionata.
LI= (C-I)/(C+I)
dove C è il volume di attivazione della corteccia sensomotoria controlaterale e I è il volume di attivazione della corteccia sensomotoria ipsilaterale; LI assume valori tra +1 (attivazione esclusivamente ipsilesionale) e -1 (attivazione esclusivamente controlesionale).
In genere i pazienti con ictus mostrano un LI significativamente più basso rispetto ai soggetti normali, indicando una maggior attivazione della corteccia sensomotoria controlesionale, in accordo con le considerazioni generali sull‟evoluzione dei pattern. E‟ interessante, tuttavia, come alcuni individui mostrino valori di LI simili ai soggetti sani. E‟ stata studiata anche la variazione di LI nel tempo [41]; questi studi hanno riportato una significativa diminuzione di LI al primo studio (circa una settimana dopo l‟ictus) ed un aumento tra i 3 e i 6 mesi successivi, mentre alcuni riportano valori LI simili ai soggetti sani nel primo studio (entro i primi 2 mesi dall‟ictus) con una diminuzione al secondo studio (circa 6 mesi dopo). La discrepanza è dovuta ai diversi task motori utilizzati nello studio dagli autori: nel primo caso erano task self-placed e poco controllati, nel secondo task fissi e controllati (clenching, apertura e chiusura ritmica della mano). Un‟altra differenza che potrebbe indicare la discrepanza è che nel primo caso LI è stato calcolato esclusivamente nella corteccia sensomotoria, mentre nel secondo caso in tutti gli emisferi. Dagli studi emerge una frequente attivazione controlesionale nei pazienti, di cui una larga percentuale mostra valori di LI nella norma, si osserva cioè un‟attivazione bilanciata degli emisferi. Le differenze nei valori individuali di LI possono implicare differenze proporzionali nel recupero.
Si registra inoltre una variazione nelle coordinate di attivazione delle aree interessate; in un gruppo di pazienti con ictus subcorticale è stato osservato uno spostamento posteriore del centro di attivazione nella regione sensomotoria che potrebbe risultare da un meccanismo adattativo intrinseco nella riorganizzazione funzionale della corteccia motoria, forse una diminuzione locale dell‟inibizione. Altri studi mostrano che questo spostamento posteriore dell‟ attivazione dell‟emisfero lesionato non sembra correlato significativamente con il recupero motorio.
Gli studi si sono poi incentrati sulla ricerca di correlazioni tra le mappe di attivazione e il recupero motorio. Negli studi cross-sezionali non sono state trovate correlazioni tra i dati funzionali e i punteggi motori, tra i deficit motori residui e il volume di attivazione della corteccia sensomotoria ipsilaterale.
Gli studi longitudinali invece mostrarono una correlazione tra il recupero della performance motoria e l‟evoluzione di LI nel tempo: più l‟attivazione si verifica in prossimità dell‟emisfero non lesionato, minore è il recupero motorio. Sebbene l‟attivazione della corteccia ipsilaterale possa contribuire al processo di recupero, questa ha una minor efficacia nel processo di riorganizzazione. Sebbene queste osservazioni si riferiscano ad un piccolo gruppo di pazienti con ictus subcorticale le conclusioni sono consistenti con alcuni rapporti descrittivi dell‟afasia e con considerazioni ottenute da studi su animali, e suggerisce che il recupero delle funzioni
potrebbe essere collegato ad un graduale ripristino dei campi neuronali rappresentativi e al reclutamento di reti perilesionali.
E‟ stata riscontrata inoltre una piccola ma significativa correlazione non lineare tra la performance motoria e il volume di attivazione ipsilaterale: più grande è il volume di attivazione ipsilaterale migliore si dimostra il recupero.
Non sono state trovate correlazioni tra il recupero motorio e l‟attivazione controlaterale o l‟attivazione di altre aree motorie. Una maggiore attività delle aree ipsilaterali in seguito a ictus riflette il processo di motor learning.
Un altro studio [42] con fMRI quantificò l‟evoluzione dei pattern di attivazione con due indici, “IndexSMC” e “IndexHEM”, non trovando una relazione chiara tra il grado di recupero e i pattern di attivazione; i tre pattern (“focalizzazione iniziale”, “focalizzazione progressiva” e “reclutamento persistente”) erano ugualmente distribuiti tra i diversi pazienti con ottimo, moderato e scarso recupero.
Figure 50. A sinistra quantificazione e classificazione dei pattern di attivazione corticali in tre pazienti mediante indice SMC e HEM; a destra i tre pattern evolutivi nel tempo ottenuti mediante fMRI.
L‟indice SMC indica il rapporto tra l‟attivazione della corteccia sensomotoria controlaterate e l‟attivazione totale (quando questo indice assume il valore “1” l‟attivazione è esclusivamente controlaterale, il valore “0” indica invece che non c‟è attività nella regione controlaterale). L‟indice HEM invece è il rapporto tra 4 regioni della corteccia controlaterale e l‟emisfero ipsilaterale (il valore “1” indica un‟attivazione puramente controlaterale, “-1” un‟attivazione puramente ipsilaterale). Le tre immagini si riferiscono a 3 successive fMRI
ottenute ad un mese, quattro mesi e sei mesi dopo l‟ictus: i pazienti sono stati divisi in tre gruppi a seconda della gravità della lesione. Lo studio è molto importante perché mostra l‟evoluzione della riorganizzazione cerebrale nel tempo, in questo caso rapportata alla diversa gravità della lesione.
Come si può vedere dalle immagini della fMRI (figura 50), l‟immagine A è relativa al paziente che non presentava una lesione nella regione motoria e che ha recuperato rapidamente. L‟attivazione neurale prodotta dai movimenti del braccio paretico (destro) è centrata nell‟emisfero controlaterale (sinistro) e rimane focalizzata in questa regione, come per i soggetti normali. L‟immagine B è relativa al paziente con la lesione in prossimità della regione motoria, che ha raggiunto un recupero motorio progressivo. A causa dell‟ictus il paziente presentava un‟emiplegia destra ma dopo tre mesi ha recuperato il movimento. Le immagini mostrano una focalizzazione progressiva dell‟attivazione nelle regioni motorie controlaterali. Nella prima sessione l‟attivazione avveniva in entrambi gli emisferi, comprese le regioni ipsilaterali sensomotorie, premotorie e prefrontali, nelle successive sessioni l‟attivazione si è focalizzata principalmente nelle regioni controlaterali. L‟immagine C è relativa al paziente che presentava una severa lesione nella regione motoria e che recuperò meno le abilità motorie. Nella prima sessione l‟attivazione fu bilaterale e nelle successive rimase bilaterale con un aumento del coinvolgimento delle regioni ipsilaterali.
La figura 50 mostra le misure quantitative dei pattern di attivazione corticale.
Non è semplice trovare una relazione tra la variazione dei pattern di attivazione neurale e il recupero motorio, perché si ipotizza che esso dipenda anche dalla gravità della lesione causata dall‟ictus.
I risultati suggeriscono un‟ipotesi sull‟evoluzione dell‟attivazione corticale: essa potrebbe risultare da due processi: il reclutamento e la focalizzazione [42]. Il reclutamento avviene quando si utilizza l‟arto con deficit (si può osservare anche nei soggetti sani quando compiono un movimento complesso per la prima volta) come estensione nell‟attivazione di aree generalmente non coinvolte se si effettua il movimento con l‟arto sano, come la corteccia sensomotoria ipsilaterale, la premotoria frontale e le aree parietali superiori. Quest‟iniziale reclutamento delle aree perdura durante le sessioni anche per parecchi mesi, e si osserva in tutti i casi sia di recupero ottimo che moderato e lieve.
La focalizzazione consiste nella diminuzione del reclutamento nel tempo per alcuni soggetti, soprattutto per i pazienti che non hanno lesioni centrate nella regione motoria: in essi il reclutamento diminuisce col tempo e si ha la focalizzazione dell‟attività ristretta alle regioni controlaterali.
Un altro dato importante fornito dallo studio è che la relazione tra la degenerazione Walleriana del tratto piramidale (WD) è inversamente proporzionale al grado di recupero, cioè nei casi dove si verifica una consistente degenerazione non si riesce ad avere il recupero. L‟impressione sviluppata anche con altri studi è che l‟attivazione ipsilaterale sia un fenomeno di transizione. Il reclutamento persistente (osservato generalmente nei pazienti con lesioni nell‟area motoria) potrebbe essere dovuto alla diminuzione dell‟inibizione causata dalla lesione nella regione motoria e delle connessioni corticali reciproche dalla corteccia motoria alle aree motorie secondarie, inducendo un‟attivazione estensiva ipsilaterale e controlaterale. La focalizzazione, cioè l‟inibizione del reclutamento nel tempo (osservata anche nei soggetti sani) potrebbe essere dovuta alla graduale inibizione esercitata dalla corteccia motoria sulle aree motorie reclutate inizialmente. L‟espansione e lo spostamento dell‟attivazione nella corteccia sensomotoria a seguito di una lesione corticale o subcorticale potrebbe riflettere la disinibizione causata dalla lesione delle preesistenti rappresentazioni normalmente latenti: questo potrebbe rappresentare una ridondanza intrinseca. Come spiegazione alternativa queste osservazioni potrebbero rappresentare un reclutamento di neuroni o connessioni non generalmente rivolte a questa funzione, una sorta di plasticità dovuta ai meccanismi di riparazione nel tentativo di creare nuove sinapsi [41]. Comunque non è ancora evidente se lo spostamento e l‟estensione dell‟attivazione della corteccia sensomotoria sia un beneficio per il recupero delle funzioni motorie.
In caso di focalizzazione iniziale l‟attivazione può rimanere controlaterale sin dall‟inizio, o si può focalizzare in quest‟area nel tempo. Il reclutamento e la focalizzazione potrebbero essere dei meccanismi adattativi del Sistema Nervoso Centrale alla lesione causata dall‟ictus. Inizialmente il reclutamento aumenterebbe la popolazione di neuroni disponibili per vincere la perdita di controllo dovuta alla lesione e successivamente la focalizzazione selezionerebbe i neuroni che aumentano l‟efficienza del comando motorio rilegato nel tratto corticospinale. Secondo questa ipotesi il recupero funzionale non dipenderebbe dalla plasticità, ma dall‟efficacia del reclutamento o della focalizzazione in termini di recupero delle funzioni che a loro volta dipendono dalla quantità di fibre nel tratto corticospinale lesionato: se è rimasto un numero insufficiente di assoni corticospinali, la plasticità corticale e il reclutamento e la focalizzazione si dimostrano inefficaci.
Quindi, anche se i meccanismi e le basi biologiche del recupero post-ictus rimangono ancora in gran parte sconosciute, l‟imaging funzionale ha permesso di ricavare nuove importanti informazioni sul recupero motorio post ictus. Gli studi hanno confermato: la posizione e l‟estensione dell‟attivazione della corteccia sensomotoria lesionata, la bilateralità
dell‟attivazione della corteccia sensomotoria primaria immediatamente succesiva all‟ictus, l‟aumento di attività nelle aree motorie primarie e secondarie (area premotoria bilaterale nell‟ultima fase di recupero e alcune aree non motorie), il cambiamento nel bilanciamento dell‟attivazione tra l‟emisfero lesionato e non lesionato a mano a mano che aumenta il recupero insieme alla diminuzione della superattivazione da entrambi i lati, e un miglior recupero per i pazienti con ictus subcorticale se diventa predominante l‟attivazione nel tempo dell‟emisfero lesionato.
La superattivazione della corteccia motoria ipsilaterale osservata a seguito di un ictus subcorticale potrebbe riflettere un eccessivo reclutamento per eseguire il task nonostante il danno. Il recupero riesce ad essere ottimale quando la regione motoria non solo è preservata strutturalmente ma anche quando non è completamente disconnessa [41].
Per quanto riguarda il reclutamento delle regioni dell‟emisfero controlaterale per compensare il danno dell‟emisfero lesionato, contrariamente a quello che ci si aspetterebbe, l‟attivazione controlesionale della corteccia sensomotoria permette un recupero meno efficiente rispetto all‟attivazione ipsilesionale. E‟ stato trovato infatti che tutte le connessioni funzionali dalla corteccia motoria ai muscoli nel recupero dei pazienti con ictus subcorticale derivano dalla corteccia motoria controlaterale. Una diversa ipotesi che spiega le attivazioni controlesionali si basa sugli studi sui soggetti sani che hanno riportato l‟attivazione della corteccia sensomotoria ipsilaterale durante task motori complessi eseguiti con la mano non dominante, evidenziando l‟attivazione in entrambi gli emisferi. A seguito della lesione dovuta all‟ictus, l‟esecuzione di task motori anche semplici può richiedere il reclutamento bilaterale. Il recupero cerebrale classifica un semplice task motorio in difficile, utilizzando una procedura adattativa che sfrutti tutte le risorse a disposizione (ridondanza).
L‟indice LI indica esclusivamente il bilancio di attivazione tra l‟emisfero lesionato e quello non lesionato, non fornisce un‟informazione assoluta sull‟attivazione ipsilesionale o controlesionale. Tuttavia si è dimostrato come un miglior recupero sia accompagnato da variazioni in LI nel tempo come quelle che il normale bilancio tra i due emisferi tende a stabilire: il recupero motorio avviene meglio se le regioni cerebrali che normalmente genererebbero quella funzione vengono reintegrate nella rete neurale attiva. L‟attivazione controlesionale rappresenterebbe quindi una plasticità “cattiva”.
Studi con la TMS (stimolazione magnetica transcranica) [43] hanno riscontrato un‟anomala eccitabilità della corteccia motoria ipsilesionale, che tende a normalizzarsi nel corso del recupero motorio. Nelle prime settimane successive all‟ictus la corteccia motoria ipsilesionale mostra una minore eccitabilità rispetto alla corteccia motoria controlesionale, verificabile
perché si osserva un‟elevata soglia, un‟ampiezza ridotta e una latenza prolungata. Il follow up dopo un anno mostra un‟aumentata intensità di attivazione nella parte lesionata, che coincide o precede il recupero motorio, mentre l‟intensità di attivazione riscontrata nell‟emisfero controlesionale rimane stabile in questo periodo di tempo, suggerendo come la normalizzazione dell‟eccitabilità della corteccia motoria ipsilesionale sia funzionalmente legata al recupero delle funzioni motorie dell‟arto paretico. Traversa osservò che due mesi dopo l‟ictus l‟eccitabilità della corteccia motoria ipsilesionale e la dimensione delle aree attive erano ridotte. Dopo alcuni mesi (circa quattro mesi) si osservò un miglioramento motorio riscontrato con le scale di valutazione tradizionali, e contemporaneamente l‟eccitabilità della corteccia motoria ipsilesionale e la dimensione dell‟area attiva aumentarono raggiungendo l‟eccitabilità e la dimensione delle aree dei soggetti sani.
Grazie alla TMS è stato possibile distinguere l‟attività neurale che controlla la muscolatura distale, prossimale ed assiale [44]. L‟aumento di attività nell‟area corticale motoria ipsilaterale è differente a seconda se l‟area lesionata contiene neuroni motori che controllano la muscolatura distale, prossimale o assiale. Alcuni studi che hanno indagato il controllo dei muscoli della parte distale degli arti hanno rilevato che la presenza di attività ipsilaterale dava un minor recupero della funzionalità motoria.
Invece studi sull‟attività muscolare assiale hanno riscontrato una correlazione positiva tra l‟attività ipsilaterale e il livello di recupero motorio. La relazione differente tra attività ipsilaterale e recupero motorio fra i due gruppi muscolari analizzati potrebbe trovare una spiegazione nel fatto che i muscoli distali sono innervati primariamente dalle proiezioni corticospinali controlaterali, mentre i muscoli assiali ricevono input bilaterali dai pathway neurali cortico-bulbospinali. Quindi anche quando le proiezioni controlaterali sono lesionate, i muscoli assiali sono in grado di dipendere dalle proiezioni ipsilesionali e mostrano un maggior recupero funzionale rispetto ai muscoli distali.
Attualmente la relazione tra l‟attività ipsilaterale e il recupero motorio dei muscoli prossimali è stato indagato esclusivamente dallo studio [44]. In seguito ad ictus emiparetico l‟arto prossimale è meno “colpito” rispetto all‟arto distale, anche se comunque la funzionalità motoria è compromessa. Il danno all‟arto prossimale è caratterizzato da paresi e da un‟anomala coordinazione tra i muscoli della spalla e del gomito che diminuiscono le abilità motorie. Lo studio ha messo in evidenza la correlazione tra il livello di disabilità (misurato con l‟indice Fugl-Meyer) è l‟indice di lateralità: i pazienti che avevano subito un ictus più grave mostravano maggiori proiezioni ipsilaterali che controlaterali.
L‟indice di lateralità inoltre era correlato con il momento flettente secondario del gomito durante l‟adduzione della spalla riflettendo una maggiore sinergia estensoria nei soggetti con più basso punteggio nella Fugl-Meyer. Il risultato è in accordo coi precedenti studi sui muscoli distali del braccio che avevano mostrato come l‟attivazione ipsilaterale è correlata ad un minor recupero motorio. Al contrario di altri studi questo mostra come una grande regolazione dell‟attività corticale ipsilaterale e l‟aumento di eccitabilità dei pathways corticofugali ipsilaterali possano giocare un ruolo importante nel preservare alcuni gradi di funzionalità motoria. E‟ abbastanza evidente che l‟emisfero ipsilaterale contribuisce al controllo dei movimenti volontari normali e che le lesioni unilaterali in seguito ad ictus sfociano in deficit nel controllo del movimento nel lato ipsilesionale. Comunque utilizzando il pathway ipsilaterale potrebbe verificarsi un aumento del controllo indipendente del giunto che limita la funzionalità motoria dell‟estremità dell‟arto paretico.
In accordo con queste considerazioni la diminuzione di abilità durante una performance in un task complesso della mano dovrebbe essere correlata ad un aumento dell‟attività ipsilaterale negli individui normodotati.
Gli studi effettuati con neuroimaging suggeriscono che l‟attività di tutta la rete sensomotoria, non solamente quella della corteccia ipsilesionale, è alterata nei primi periodi dopo l‟ictus e il recupero motorio è collegato alla normalizzazione dell‟attività.
Il grado di recupero funzionale nel tempo è correlato alla diminuzione dell‟attività cerebrale rispetto al pattern normale. Nei pazienti con ictus, alcune aree cerebrali mostrano un aumento di attivazione in relazione al recupero funzionale, differenze che non sono riscontrabili nel tempo per i soggetti sani. Gli studi mostrano che la normalizzazione dell‟attivazione nella rete sensomotoria, dopo una prima eccessiva attivazione, è generalmente collegata ad un miglior recupero motorio.
La normalizzazione non riguarda solamente l‟intensità di attivazione delle aree e la dimensione, ma anche la loro posizione. Ad esempio Marshall osservò che subito dopo l‟ictus (nella prima settimana), l‟attivazione della corteccia sensomotoria primaria durante i movimenti con braccio paretico si concentrava nell‟emisfero ipsilaterale (controlesionale), e si osservava una maggiore attivazione controlaterale durante i movimenti dell‟arto sano. Dopo alcuni mesi (3-6 mesi) quando i pazienti mostrarono un buon recupero motorio, l‟attivazione della corteccia sensomotoria primaria durante i movimenti dell‟arto paretico era tornata normale, cioè era aumentata l‟attivazione nella corteccia sensomotoria primaria ipsilesionale ed era diminuita l‟attivazione della corteccia controlesionale., mentre l‟attivazione della corteccia sensomotoria durante i movimenti eseguiti con l‟arto sano era rimasta stabile. Allo
stesso modo Jang trovò che un buon recupero motorio (ottenuto in 5-15 mesi successivi all‟ictus) era parallelo allo spostamento della lateralità dell‟attivazione della corteccia sensomotoria primaria durante i movimenti dell‟arto paretico da bilaterale ad unicamente ipsilesionale, mentre l‟attivazione della corteccia durante i movimenti dell‟arto sano era stabilmente concentrato nell‟emisfero controlaterale.
Questi studi suggeriscono quindi che la normalizzazione della lateralità è collegata ad un buon recupero delle funzioni motorie nei pazienti che abbiano subito un ictus.
Altri studi invece suggeriscono che la normalizzazione dell‟attività cerebrale a seguito di un ictus potrebbe essere collegata maggiormente all‟integrità della corteccia sensomotoria e del tratto corticospinale più che al recupero motorio; nei pazienti in cui l‟integrità del tratto corticospinale è insufficiente per permettere un buon recupero, il reclutamento della corteccia sensomotoria controlesionale potrebbe essere utilizzato per raggiungere il recupero motorio. Per capire quale delle due teorie sia più valevole bisognerebbe capire fino a che punto la corteccia sensomotoria controlesionale possa compensare le lesioni della corteccia motoria e del tratto corticospinale. Si pensa che l‟attività della corteccia sensomotoria controlesionale non sia in grado di rimpiazzare completamente l‟attività della corteccia motoria ipsilesionale, anche se la corteccia sensomotoria controlesionale aiuta a promuovere il recupero motorio. Le procedure riabilitative dovrebbero quindi incentrarsi sul ripristino dell‟attivazione ipsilesionale e sulla sua verifica quantitativa. In questo sono importanti allo stesso modo esercizi attivi o passivi. La terapia riabilitativa migliora sostanzialmente le performance motorie nei pazienti con ictus cronico, inoltre permette un aumento della dimensione di attivazione dell‟area motoria e delle ampiezze del potenziale evocate dal movimento, aumentando anche l‟eccitabilità neurale dell‟emisfero danneggiato. Si conosce già come il training passivo influenzi le rappresentazioni sensomotorie corticali nei soggetti normali. E‟ possibile influenzare la riorganizzazione della rete neurale motoria dopo l‟ictus con l‟esercizio motorio e con un training che induca la plasticità cerebrale non solo nella fase subacuta, ma anche nei pazienti cronici: il tempo non è un fattore limitante per l‟effetto della terapia. La variazione nel pattern di attivazione indotta dagli esercizi dovrebbe essere incentrata sull‟emisfero lesionato.
E‟ risaputo come aumentando l‟intensità della terapia dopo un ictus migliori il recupero motorio; il sistema nervoso centrale a seguito di una lesione si riorganizza in funzione del recupero delle funzioni motorie.
2. 3 Il segnale elettroencefalografico (EEG)
2. 3. 1 Introduzione
L‟elettroencefalografia è una tecnica non invasiva e poco costosa per rilevare l‟attività elettrica del cervello: permette di misurare direttamente il funzionamento del cervello e di fare deduzioni circa l‟attività delle diverse regioni cerebrali
.
La traccia prodotta viene chiamata elettroencefalogramma (EEG). Questo segnale è utilizzato clinicamente per la valutazione di possibili danni al cervello in seguito a traumi, per diagnosticare patologie come l‟epilessia, per attestare la morte clinica, per eseguire un monitoraggio continuo e per stabilire il giusto dosaggio dell‟anestetico per gli interventi in sala operatoria.
Negli ultimi anni il segnale elettroencefalografico è stato oggetto di studio in vari campi di ricerca che indagano la funzionalità fisiologica e patologica del cervello; questo è stato possibile grazie al miglioramento della tecnologia di acquisizione del segnale che ha permesso di realizzare nuovi elettroencefalografi in grado di effettuare un‟acquisizione rapida, pulita, con buona risoluzione spaziale, libera da artefatti anche per soggetti non immobilizzati che effettuano movimenti.
Il segnale EEG è stato scelto per meglio studiare e comprendere i meccanismi neurobiologici e neurofisiologici che caratterizzano l‟attivazione cerebrale nei soggetti che hanno subito un ictus mentre si apprestano ad eseguire un task motorio, per la sua alta risoluzione temporale e per la proprietà di poter monitorizzare l‟attività cerebrale in real time. Gli studi con il segnale elettroencefalografico si affiancano a quelli già effettuati con la PET e la risonanza magnetica funzionale, e, nonostante fMRI e EEG misurino attività differenti (la fMRI misura il segnale BOLD dipendente dal livello di ossigenazione del sangue, mentre l‟EEG rileva direttamente l‟attività neuronale sincrona), uno studio che ha preso in esame i due sistemi [47] ha messo in evidenza una correlazione tra la potenza normalizzata del segnale EEG e i parametri peso della fMRI, permettendo di applicare, con alcune dovute considerazioni, le conoscenze acquisite con gli studi mediante fMRI all‟analisi del segnale EEG. Durante la pianificazione e l‟esecuzione del movimento si registra l‟attivazione sia in termini emodinamici che elettrici, di aree del sistema motorio quali l‟area Supplementare Motoria (SMA Supplementary Motor Area), l‟area Premotoria (preMotor Cortex), l‟area
Parietale supero-inferiore (supero and inferior Parietal Cortex), le aree Motoria e Sensitiva Primaria (M1 e S1).
La misurazione dell‟attività elettrica del cervello è di recente sviluppo.
Circa settant‟anni fa venne pubblicata la prima dimostrazione di registrazione dell‟attività elettrica. Questa notizia venne accolta con molto scetticismo dalla comunità scientifica e non fu accettata fino al 1935 quando, ad un meeting della Società di Psicologia a Londra, venne fatta una registrazione dal vivo sulla testa del neuroscienziato Adrian. Dopo questa prova, la misura elettroencefalografica divenne ampiamente accettata: negli anni successivi ci fu un rapido aumento nella raccolta dei dati che segnò un importante progresso in questa area. Un importante contributo fu quello di Berger. Egli, nel suo studio iniziale, utilizzò due elettrodi imbevuti in una soluzione salina: uno posto sopra la fronte e l‟altro dietro la testa. Berger osservò che quando i soggetti erano rilassati, il segnale EEG si presentava come onde ritmiche regolari a circa 10 Hertz e che queste onde erano più evidenti quando i soggetti tenevano gli occhi chiusi in assenza di stimolazione o di altre attività mentali come immaginare o risolvere problemi. A queste onde venne dato il nome di onde alfa. Successivamente, Berger ebbe l‟opportunità di registrare direttamente dalla superficie corticale e confermò che la registrazione diretta della superficie corticale e quella sul cuoio capelluto erano essenzialmente identiche nella forma, ad eccezione dell‟ampiezza del segnale, che sul cuoio capelluto era attenuata.
Un altro importante evento nella storia dell‟elettroencefalografia fu il lancio della rivista “Electroencephalography and Clinical Neurophysiology” nel 1949. Nel primo volume, Moruzzi e Magoun mostrarono che stimolando la formazione reticolare dei gatti si verificava una desincronizzazione nell‟EEG.
Questo ed altri esperimenti dimostrarono l‟importante ruolo dell‟EEG come indice di attivazione cerebrale, ma la scoperta di un‟attivazione corticale globale ebbe anche la conseguenza di rafforzare l‟idea che l‟EEG non potesse informare sull‟attività di una specifica area cerebrale.
2. 3. 2 Il substrato fisiologico dell’EEG
Oggi molti ricercatori sostengono che il segnale elettroencefalografico non sia prodotto dalla somma dei potenziali d‟azione, ma quasi esclusivamente dai potenziali post sinaptici (PPS), eccitatori o inibitori, delle cellule piramidali (e dalle correnti extracellulari associate). Esistono due motivi principali alla base dello scarso contributo dei potenziali d‟azione: in
primo luogo l‟ampiezza del campo elettrico prodotto dalla loro propagazione diminuisce molto più rapidamente rispetto all‟ampiezza dei campi prodotti dai PPS; inoltre, la durata dei potenziali d‟azione è molto breve, dell‟ordine del millisecondo, quindi, per produrre un‟attività registrabile in modo non invasivo, si dovrebbe avere un alto livello di sincronizzazione tra i diversi neuroni tale da rendere possibile una somma spaziotemporale dei potenziali.
I flussi di correnti sinaptiche sono più lenti (hanno durate di 10÷40 ms) e, pertanto, anche in assenza di una perfetta sincronizzazione, possono sommarsi più efficacemente dei potenziali d‟azione, creando campi elettrici e magnetici sufficientemente ampi da poter essere rilevati. Inoltre, le cellule piramidali, come già sottolineato, essendo dotate di un gran numero di dendriti organizzati in fasci paralleli, rivestono un ruolo predominante nella creazione dei potenziali registrati in superficie. Il numero di sinapsi che devono essere simultaneamente attive, per generare un campo misurabile all‟esterno della testa, si aggira attorno al milione. Come osservato la somma dei potenziali post sinaptici (PPS) è sostenuta da un flusso di correnti ioniche (correnti primarie) che attraversano le membrane sinaptiche; queste correnti inducono un simile flusso di cariche esterne (correnti secondarie) nello spazio extracellulare, le quali, scorrendo attraverso tutti i tessuti encefalici, raggiungono la superficie della testa, sebbene sostanzialmente attenuate dalla bassa conducibilità delle ossa craniche.
Anche se la somma dei potenziali post-sinaptici si ritiene la causa dell‟attività che si registra sulla superficie della testa, rimane ancora l‟incertezza riguardo i meccanismi responsabili della misurazione EEG.
Varie prove indicano il talamo il sito critico per la regolazione dell‟attività ritmica della corteccia. Verso il 1930, fu proposta una teoria sul ruolo del talamo che suggerisce come l‟attività ritmica non sia dovuta ad un particolare pacemaker ma piuttosto sia una conseguenza del movimento circolare di impulsi tra il tessuto corticale e il talamo.
Varie osservazioni effettuate negli studi animali nel decennio successivo fecero cadere questa teoria: il primo tra questi fu condotto da Adriano nel 1941. Egli registrò direttamente dal talamo e dalla corteccia e trovò che la ritmicità del talamo non dipendeva dall‟integrità della corteccia. Nel 1945 Morison e Basset trovarono che la decorticazione non abolisce l‟attività ritmica del talamo. Se l‟attività ritmica fosse dipendente da un circuito talamo-corticale allora queste manipolazioni avrebbero dovuto interferire con l‟espressione dell‟attività del talamo. Queste osservazioni furono, tuttavia, compatibili con l‟ipotesi che il talamo è il maggior pacemaker per l‟attività ritmica della corteccia.
L‟idea che il talamo fosse il maggior contribuente dell‟attività ritmica corticale fu sostenuta anche nei lavori di Andersen e colleghi negli studi su animali anestetizzati. Essi dimostrarono che nei gatti anestetizzati, utilizzando il barbiturico, l‟attività corticale era maggiormente correlata all‟attività nel talamo. L‟influenza causale dell‟attività del talamo sulla corteccia fu stabilita con esperimenti che utilizzavano raffreddamenti selettivi per produrre lesioni reversibili.
Questi studi dimostrarono che se la corteccia è raffreddata, l‟ampiezza dei ritmi corticali è attenuata ma non cambia in frequenza. Tuttavia, se il talamo è raffreddato si producono drammatici cambiamenti nella frequenza dell‟attività del ritmo corticale. Andersen e colleghi ipotizzarono l‟esistenza di multipli pacemakers talamici. In accordo con questa visione, ogni nucleo talamico era in grado di produrre oscillazioni ritmiche che potessero poi essere imposte sulle relative regioni della corteccia attraverso le cellule talamo corticali.
Più recentemente, Steriade e colleghi proposero un modello aggiornato dei contributi talamici all‟attività ritmica corticale. In contrasto con il modello di Andersen, che suggerisce che ogni nucleo talamico è in grado di esibire oscillazioni ritmiche e di imporre questo ritmo su altri nuclei, Steriade propose che il nucleo reticolato del talamo è il vero pacemaker. Danni selettivi a questo nucleo, nei ratti e nei gatti, aboliscono l‟attività ritmica del talamo e della corteccia. Inoltre, ci sono poche connessioni tra la maggior parte dei nuclei talamici. Solo il nucleo reticolato proietta virtualmente a tutti gli altri nuclei talamici. Quindi venne proposto che il nucleo reticolato servisse da pacemaker e imponesse le sue ritmiche oscillazioni sugli altri nuclei del talamo e cellule talamocorticali.
Pochi studi hanno esaminato la relazione tra l‟attività del talamo e il tracciato EEG negli esseri umani. In un recente studio si provò a misurare il metabolismo del glucosio a livello regionale utilizzando la tomografia ad emissione di positroni (PET) e simultaneamente l‟EEG. Si trovò che il talamo era il sito maggiormente correlato (inversamente) alla potenza nella banda alfa. Così, i soggetti che mostrarono la maggior attività metabolica nel talamo mostravano minor potenza nella banda alfa nella totalità della testa, indicando una maggior attività corticale. In altre parole, l‟attivazione del talamo è associata con la desincronizzazione dell‟EEG.
In due libri molto importanti, il fisico Paul Nunez sfidò la visione del talamo come il principale contribuente alla regolazione della ritmicità della corteccia, sottolineando le proprietà intrinseche dell‟interazione intracorticale nella produzione della ritmicità corticale. Le cellule piramidali rappresentano tra i due terzi e i tre quarti di tutti i neuroni corticali. Queste cellule occupano le colonne cilindriche e sono posizionate in modo che i loro assoni e
dendriti siano allineati perpendicolarmente alla superficie corticale. Le due forme più importanti di interconnessione fra i neuroni corticali sono: quelli a raggio corto (short-range, meno di 1mm negli esseri umani) e quelli cortico-corticali (cortico-cortical), che si estendono per diversi centimetri. Nell‟uomo, il numero di connessioni cortico-corticali è considerevolmente maggiore delle connessioni afferenti alla corteccia o efferenti dalla corteccia.
Il talamo, che è il maggiore input subcorticale alla corteccia, non fornisce più dell‟uno per cento delle fibre che costituiscono qualsiasi regione della corteccia. Nunez (1981) sostenne che l‟ EEG fosse particolarmente sensibile ai collegamenti cortico-corticali a lungo raggio. Per ora, tuttavia, esistono limitati dati a sostegno di questo modello. Nel suo libro più recente, Nunez sostenne che la neocorteccia determina l‟attività oscillatoria risonante del cervello mentre il talamo registra la sua frequenza oscillatoria per essere sincrono con la frequenza risonante neocorticale. Nunez considerò il lavoro sperimentale di Steriade e colleghi per sostenere il suo argomento. In questo studio, Steriade e colleghi (1976) stimolarono elettricamente la corteccia motoria con un impulso a 10 Hertz ogni 2 secondi. Dopo 28 stimolazioni, i nuclei talamici iniziarono a produrre spontaneamente scatti di attività ritmica vicina ad una frequenza di 10 Hertz. Nunez notò anche che le oscillazioni talamiche coincidenti con il ritmo neocorticale producevano una maggior risposta corticale rispetto ad un ritmo talamico che è indipendente dalla frequenza di risonanza neocorticale. Nunez suggerì che la combinazione della maggior risposta neocorticale e la frequenza plastica del talamo inducessero il ritmo talamico a coincidere con il ritmo neocorticale.
Per concludere il segnale EEG, quindi, è un potenziale che risulta dalla sovrapposizione di segnali provenienti da diverse regioni corticali e/o subcorticali; il potenziale registrato da un certo sito elettronico, quindi, non è necessariamente generato dalla sottostante corteccia, e questo determina la bassa risoluzione spaziale della tecnica elettroencefalografica.
2. 3. 3 Caratteristiche del segnale EEG
Il segnale EEG si ottiene misurando le differenze di potenziale con elettrodi posti sullo scalpo. In questo modo le ampiezze del segnale si estendono nel range dei microvolt (20-100 μV). Talvolta gli elettrodi sono applicati direttamente sulla corteccia, nel qual caso i segnali hanno un‟ampiezza di 100-200 μV. Per poter rilevare i segnali è necessaria un‟area di rilevazione di almeno 6 cm2. Un tracciato EEG è un segnale quasi periodico, costituito da