4. RISULTATI
4.1 Disegno sperimentale
I sieri di pazienti HCV positivi in fase cronica di infezione sono stati impiegati nell’allestimento di un test di neutralizzazione finalizzato a misurare NAb anti-HCV. Per la messa a punto del saggio sono state prodotte particelle virali esprimenti le glicoproteine E1 ed E2 di HCV e veicolanti come gene reporter la GFP, a partire da costrutti FIV-derivati e costrutti MLV-derivati (quest’ultimi utilizzati come controllo positivo). Infine, per un’ulteriore ottimizzazione del test, è stato prodotto un costrutto vettore FIV-derivato esprimente la luciferasi necessario per la produzione di particelle virali pseudotipizzate con E1 ed E2 e contenenti il gene luc come gene reporter alternativo a GFP.
4.2 Produzione di pseudovirus FIV ed MLV-derivati
Per lo studio sono state prodotte particelle virali MLV-derivate e FIV-derivate pseudotipizzate con le glicoproteine E1 E2 di HCV e veicolanti GFP come gene reporter (MLVgfpE1E2 e FIVgfpE1E2) (vedi §3.2 e 3.3). Questi pseudovirus sono stati prodotti mediante co-trasfezione di 3 plasmidi (packaging, vettore ed envelope) su cellule 293T come descritto in § 3.6 e MLVgfpE1E2 è stato utilizzato come controllo positivo.
In modo analogo sono stati prodotti pseudovirus FIV ed MLV veicolanti GFP e pseudotipizzati con la proteina G del virus VSV. Queste particelle virali (MLVgfpVSV e FIVgfpVSV) sono state utilizzate come controllo positivo nei saggi di trasduzione in quanto la proteina G utilizza come recettore cellulare un fosfolipide di membrana ubiquitario e che conferisce quindi ampio tropismo alle pseudoparticelle.
L’efficienza di trasfezione è stata valuta mediante lettura al citofluorimetro e la percentuale di cellule trasfettate è stimata come percentuale di cellule GFP positive (FIG. 4.1). 0 20 40 60 80 100 k cell MLV FIV % e sp re ss io n e G F P E1E2 VSV-G
FIG. 4.1: Percentuale di trasfezione delle cellule 293T con i costrutti FIV ed MLV-derivati.
Come si può osservare tutti i costrutti sono in grado di trasfettare 293T e di esprimere il relativo gene reporter.
4.3 Valutazione dell’espressione di E1 E2
Per verificare che il costrutto pE1E2 esprimesse la relativa proteina è stato effettuato un western blot utilizzando l’anticorpo monoclonale AP33 e un anticorpo secondario antimouse coniugato con perossidasi (vedi § 3.9). Come campioni sono state perciò utilizzate cellule 293T trasfettate o con il solo costrutto envelope esprimente E1 E2 o contemporaneamente con i tre costrutti packaging, vettore ed envelope. Gli esperimenti sono stati condotti sia col sistema FIV che MLV (quest’ultimo utilizzato come controllo positivo). Come si può vedere dalla FIG. 4.2 il costrutto envelope esprime in modo efficiente la relativa proteina sia quando è stato usato singolarmente che in associazione con gli altri costrutti al pari del controllo positivo.
FIG. 4.2: Western blot su 293T a due giorni dalla trasfezione con i costrutti FIV ed MLV-derivati. Per la detection è stato utilizzato l’anticorpo monoclonale AP33 ed un anticorpo antimouse secondario coniugato con perossidasi.
4.4 Valutazione della capacità di trasduzione degli
pseudovirus
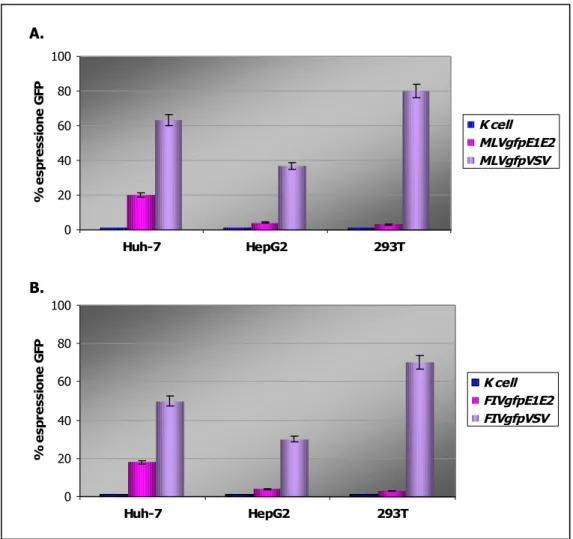
Per valutare la capacità di trasduzione degli pseudovirus MLVgfpE1E2 e FIVgfpE1E2 precedentemente concentrati mediante ultracentrifugazione, sono stati eseguiti saggi di trasduzione su cellule Huh-7, HepG2 ed 293T. Le particelle virali MLVgfpVSV e FIVgfpVSV sono state utilizzate come controllo positivo. La percentuale delle cellule trasdotte viene misurata mediante lettura al citofluorimetro ed è indicata come percentuale di cellule GFP positive.
I risultati dimostrano una sostanziale equivalenza dei sistemi basati su FIV o MLV. In particolare, mentre le pseudoparticelle VSV-G trasducono con elevata efficienza le tre linee cellulari, le particelle pseudotipizzate con HCV trasducono solo Huh-7 mentre 293T e HepG2 sono sostanzialmente refrattarie (FIG. 4.3).
1 2 3 4 5 6 Marker 70 KDa 60 KDa 1 2 3 4 5 6 Marker 70 KDa 60 KDa 1, 2: cellule trasfettate con il costrutto
envelope esprimente E1 E2, il costrutto
packaging e costrutto vettore del sistema MLV
3, 4: cellule trasfettate con il solo
costrutto envelopeesprimente E1 E2
5, 6: cellule trasfettate con il costrutto envelope esprimente E1 E2, il costrutto
packaging e il costrutto vettore del sistema FIV 1 2 3 4 5 6 Marker 70 KDa 60 KDa 1 2 3 4 5 6 Marker 70 KDa 60 KDa 1, 2: cellule trasfettate con il costrutto
envelope esprimente E1 E2, il costrutto
packaging e costrutto vettore del sistema MLV
3, 4: cellule trasfettate con il solo
costrutto envelopeesprimente E1 E2
5, 6: cellule trasfettate con il costrutto envelope esprimente E1 E2, il costrutto
packaging e il costrutto vettore del sistema FIV
FIG. 4.3: Percentuali di trasduzione delle cellule Huh-7, HepG2 e 293T con gli pseudotipi del sistema MLV (A) e del sistema FIV (B).
4.5 Valutazione dell’inibizione di infettività dello
pseudovirus E1E2 con anticorpo neutralizzante
Gli pseudovirus MLV e FIV sono stati saggiati per suscettibilità alla neutralizzazione con l’anticorpo monoclonale AP33. Il test è stato condotto sia con le particelle virali pseudotipizzate con le glicoproteine E1 E2 di HCV sia con la proteina G di VSV. Gli pseudovirus sono stati incubati con diverse dosi di Ab e sono stati utilizzati per trasdurre Huh-7 (vedi § 3.11). In FIG. 4.4 viene mostrata la percentuale di riduzione dell’entry in cellule Huh-7, valutata come riduzione
0 20 40 60 80 100 Huh-7 HepG2 293T % es p re ss io n e G FP K cell MLVgfpE1E2 MLVgfpVSV 0 20 40 60 80 100 Huh-7 HepG2 293T % es p re ss io n e G FP K cell FIVgfpE1E2 FIVgfpVSV A. B. 0 20 40 60 80 100 Huh-7 HepG2 293T % es p re ss io n e G FP K cell MLVgfpE1E2 MLVgfpVSV 0 20 40 60 80 100 Huh-7 HepG2 293T % es p re ss io n e G FP K cell FIVgfpE1E2 FIVgfpVSV A. B.
percentuale di espressione di GFP delle cellule trasdotte con i due diversi pseudovirus FIV-derivati pre-incubati con le varie concentrazioni di AP33 rispetto ai relativi controlli (cellule trasdotte con lo pseudovirus non pre-incubato con l’Ab). Lo stesso test è stato effettuato anche con gli pseudovirus MLV-derivati ottenendo risultati equiparabli (dati non mostrati). Da questi risultati è stato osservato che AP33 riduce l’infettività virale con modalità dose-dipendente delle sole particelle pseudotipizzate con E1 E2 di HCV, mentre non modifica in modo apprezzabile l’infettività delle particelle pseudotipizzate con la proteina G di VSV. Questo risultato suggerisce che la neutralizzazione è E1-E2 specifica e che queste ultime sono correttamente esposte sulla superficie esterna dell’envelope.
FIG 4.4: Percentuali di riduzione dell’entry degli pseudovirus FIV-derivati pre-incubati con diverse concentrazioni di AP33 calcolate rispetto allo stesso pseudovirus non trattato.
4.6 Valutazione attività neutralizzante in soggetti con
epatite C cronica
Sono stati reperiti 10 sieri di pazienti HCV positivi in fase cronica di infezione presso l’Unità Operativa Gastroenterologia dell’AUOP diretta dal Prof. S. Marchi (vedi § 3.1). 0 10 20 30 40 50 60 70 80 90 100
FIVgfpE1E2 + AP33 FIVgfpVSV + AP33
% R id u zi o n e en tr y 5 ug/ml 1 ug/ml 0.5 ug/ml AP33 0 10 20 30 40 50 60 70 80 90 100
FIVgfpE1E2 + AP33 FIVgfpVSV + AP33
% R id u zi o n e en tr y 5 ug/ml 1 ug/ml 0.5 ug/ml AP33
Per ogni campione sono stati misurati in un altro laboratorio sia la viremia che i valori di transaminasi (Tab 4.1).
I valori di transaminasi vengono espressi in base ai livelli standard di enzima nel sangue mentre la viremia viene considerata alta se superiore a 8X105 copie di
RNA/ml di sangue.
Tab 4.1: Valori di transaminasi e viremia relativi ai 10 campioni.
Diluizioni seriali di questi campioni ed un campione di siero HCV negativo (Ks) usato come controllo negativo, sono stati incubati con quantità fisse di pseudovirus (vedi § 3.12) ed il saggio di neutralizzazione effettuato come descritto in § 3.13. Il test è condotto sia con gli pseudovirus MLV che FIV-derivati e l’infettività residua è stata valutata mediante lettura al citofluorimetro. Da questi valori è stata poi calcolata la percentuale di riduzione dell’entry virale (vedi § 3.12). I dati ottenuti con gli pseudovirus FIV derivati (FIG. 4.5) sono del tutto paragonabili a quelli rilevati con gli pseudovirus MLV (dati non mostrati), sottolineando l’efficacia e la sensibilità del saggio messo a punto.
Bassa > 2 volte 10 Alta > 2 volte 9 Alta Entro 2 volte 8 Alta Entro 2 volte 7 Alta Entro 2 volte 6 Bassa Normali 5 Alta Normali 4 Alta Entro 2 volte 3 Alta Entro 2 volte 2 Alta > 2 volte 1 Viremia Valori transaminasi Campione Bassa > 2 volte 10 Alta > 2 volte 9 Alta Entro 2 volte 8 Alta Entro 2 volte 7 Alta Entro 2 volte 6 Bassa Normali 5 Alta Normali 4 Alta Entro 2 volte 3 Alta Entro 2 volte 2 Alta > 2 volte 1 Viremia Valori transaminasi Campione
FIG 4.5: Percentuali di riduzione dell’entry virale alle diverse diluizioni seriali di siero
Per i campioni che hanno dimostrato una chiara scalarità in linea con le diluizioni di siero, è stato stabilito, come riportato anche in letteratura (Mascola et al., 2005), di esprimere il titolo neutralizzante come l’ultima diluizione alla quale è stata osservata una riduzione dell’infettività dello pseudovirus ≥ 50%. Questi dati sono stati riportati in Tab 4.2.
Tab 4.2: Titolo neutralizzante dei campioni. 0 20 40 60 80 100 1 2 3 4 5 6 7 8 9 10 11 % R id u zi o n e e n tr y 1:10 1.50 1:100 1 2 3 4 5 6 7 8 9 10 Ks 0 20 40 60 80 100 1 2 3 4 5 6 7 8 9 10 11 % R id u zi o n e e n tr y 1:10 1.50 1:100 1 2 3 4 5 6 7 8 9 10 Ks 1 2 3 4 5 6 7 8 9 10 Ks 1:10 10 1:50 9 < 1:10 8 1:100 7 1:10 5 1:10 4 < 1:10 3 Titolo neutralizzante Campione 1:10 10 1:50 9 < 1:10 8 1:100 7 1:10 5 1:10 4 < 1:10 3 Titolo neutralizzante Campione
4.7 Produzione del costrutto vettore FIV-derivato
esprimente luciferasi
Per un’ulteriore ottimizzazione del saggio di neutralizzazione è stato prodotto uno pseudovirus FIV-derivato esprimente luciferasi. A tal scopo è stato costruito un costrutto vettore contenente luc come gene reporter (vΔenvluc) sostituendo la GFP nel vettore vΔenvGFP.
La sequenza codificante luciferasi è stata amplificata a partire dal plasmide commerciale pGL3 con i primers NruI S e SacII AS contenenti rispettivamente alla estremita 5’ un sito di taglio per l’enzima di restrizione NruI e SacII (§ 3.4.1).
Il prodotto di PCR è stato controllato su gel di agarosio all’1% mediante corsa elettroforetica (FIG. 4.6).
FIG. 4.6: Amplificazione di luc e verifica dell’amplificato su gel di agarosio all’1%.
Dopodiché l’inserto amplificato ed il vettore vΔenvGFP sono stati sottoposti a digestione con NruI e SacII. L’inserto viene digerito alle due estremità in cui sono presenti le code dei primers utilizzati nell’amplificazione contenenti i siti di taglio per questi enzimi, mentre il vettore viene tagliato ai due lati del gene codificante GFP (FIG. 4.7).
pGL3 Amplificazione luciferasi eleffroforeticaCorsa
luciferasi 1600 bp NruI S
SacIIAS
pGL3 Amplificazione luciferasi eleffroforeticaCorsa
luciferasi luciferasi 1600 bp NruI S SacIIAS 1600 bp K- Marker luc (1 Kb)
FIG. 4.7: A destra è rappresentata la digestione del vettore vΔenvGFP mentre a sinistra quella dell’inserto amplificato.
A questo punto l’inserto ed il vettore privo di GFP sono stati ligati ottenendo così il costrutto vettore detto vΔenvluc codificante luciferasi (FIG. 4.8).
Per verificare l’avvenuta ligazione è stata effettuata una trasformazione e le colonie ottenute sono state analizzate mediante PCR con i primers NruI S e SacII AS che amplificano un frammento di 1600 bp (dati non mostrati).
FIG. 4.8: costrutto vettore vΔenvluc.
CMV R U5 CMV luciferasi Δenv RRE U3 R U5
CMV
CMV RR U5U5 CMVCMV luciferasi Δenv RRE U3U3 RR U5U5
Digestione CMV R U5 CMV GFP Δenv RRE U3 R U5 NruI SacII GFP CMV R U5 CMV Δenv RRE U3 R U5 + luciferasi luciferasi NruI SacII. Digestione NruI SacII. NruI SacII ΔGFP Digestione CMV CMV RR U5U5 CMVCMV GFPGFP Δenv RRE U3U3 RR U5U5 NruI SacII GFP GFP CMV CMV RR U5U5 CMVCMV Δenv RRE U3U3 RR U5U5 + luciferasi luciferasi NruI SacII. Digestione NruI SacII. NruI SacII ΔGFP
4.8 Produzione di pseudovirus FIV-derivati esprimenti
luc
Il costrutto vettore vΔenvluc con il costrutto di packaging pΔenv ed il costrutto envelope pE1E2 (o alternativamente pVSV-G) sono stati co-trasfettati in cellule 293T per formare particelle virali FIV-derivate pseudotipizzate con le glicoproteine di HCV (oppure con la proteina G) esprimenti come gene reporter la luciferasi.
In questo caso l’efficienza di trasfezione è stata valutata mediante lettura al luminometro e misurata come espressione di luciferasi (FIG. 4.9).
FIG. 4.9: Espressione della luciferasi di 293T co-trasfettate con il costrutto vettore
vΔenvluc, il costrutto packaging pΔenv ed i due costrutti envelope.
Gli pseudovirus prodotti sono state testati per traduzione su cellule Huh-7 e 293T. L’efficienza di trasduzione è stata valutata mediante l’utilizzo del luminometro (FIG.
4.10). FIVlucVSV è stato capace di trasdurre le due linee cellulari mentre come
atteso FIVlucE1E2 è stato capace di trasdurre solo la linea cellulare Huh-7.
1 10 100 1000 10000 100000 1000000 10000000
kcell FIVlucE1E2 FIVlucVSV
R L U R LU ( Sc al a L og ) 1 10 100 1000 10000 100000 1000000 10000000
kcell FIVlucE1E2 FIVlucVSV
R L U R LU ( Sc al a L og ) R LU ( Sc al a L og )
1 10 100 1000 10000 Huh-7 293T R L U ( sca la L o g ) K cell FIVlucE1E2 FIVlucVSV
FIG. 4.10: Espressione di luciferasi di Huh-7 e 293T trasdotte con gli pseudovirus FIVlucE1E2 e FIVlucVSV.