UNIVERSITÀ DEGLI STUDI DI SASSARI
Dipartimento di Chimica e Farmacia
Dottorato di Ricerca in Scienze e Tecnologie Chimiche
Indirizzo Scienze Farmaceutiche
XXVII ciclo
Progettazione e Sviluppo di Sistemi di Veicolazione Non Invasivi per
Neuro-farmaci
Tesi di dottorato di
Dott.ssa Elena Soddu
Direttore Supervisore
Prof. Stefano Enzo Prof.ssa Elisabetta Gavini
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Ringraziamenti
Desidero ringraziare tutte le persone che hanno contribuito direttamente alla realizzazione di questo lavoro tramite suggerimenti, critiche ed osservazioni. La Prof.ssa Elisabetta Gavini, relatrice e guida nella progettazione e sviluppo di tutto il lavoro; la Dott.ssa Giovanna Rassu, fonte di consigli ed aiuti; il Sig. Massimo Cossu per il suo preziosissimo aiuto nella pratica di laboratorio; i colleghi di dottorato, per i suggerimenti e la compagnia, con un particolare ringraziamento ad Andrea per l’aiuto, i consigli, le risate ed il supporto morale e psichico. Grazie a tutto il gruppo di ricerca tecnologico-farmaceutico coordinato dal Prof. Giunchedi e dalla Prof.ssa Gavini.
Un grazie doveroso e di cuore a tutta la mia famiglia e soprattutto ai miei genitori Pina e Giovanni, che hanno contribuito indirettamente alla realizzazione di questo lavoro.
Niki, ma maman Belge et Grecque, merci beaucoup! Merci pour tous ces jours où tu as été à mes côtés, merci de ta compréhension et de tout ce que tu as fait pour moi! Merci Léopold!
Stefano, grazie!!! Grazie per la tua costante presenza, la pazienza e l’affetto. Non posso che dedicare questo lavoro a te ed a tutta la mia famiglia.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Indice
Introduzione ...1
Il SNC: barriere ...2
La BEE: anatomia ...2
La BEE: funzione ...5
Il trasporto dei farmaci al SNC: problematiche ...6
Il trasporto dei farmaci al SNC: strategie ...7
Elenco delle abbreviazioni ...15
Bibliografia ...16
PARTE I: TARGETING CEREBRALE MEDIATO DA VETTORI SITO-SPECIFICI E STRATEGIA NOSE-TO-BRAIN: RASSEGNE BIBLIOGRAFICHE ...21
Capitolo I. Da Agenti Neurotossici a Shuttle per il Trasporto di Farmaci al SNC ...22
Abstract ...23
Introduzione ...24
Shuttle virali ...26
Shuttle batterici ...31
Shuttle animali ...38
Conclusioni e prospettive future ...42
Bibliografia ...44
Tabelle ...53
Figure ...56
Capitolo II. Polveri Farmaceutiche a Base di Chitosano per la Veicolazione di Farmaci mediante Strategia Nose-to-Brain ...57
Abstract ...58
Introduzione ...59
Farmaci contenuti in formulazioni nasali impieganti chitosano ...61
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Chitosano non modificato ...67
Sali del chitosano ...70
Derivati del chitosano ...71
Metodi di preparazione ...72
Conclusioni e prospettive future ...74
Bibliografia ...76
Tabelle ...84
Figure ...86
PARTE II: PROGETTAZIONE E SVILUPPO PRELIMINARE DI NANO-CARRIER PER IL TARGETING CEREBRALE ...87
Capitolo I. Influenza dei Parametri Formulativi sulle Dimensioni e sulla Stabilità Fisica di SLN a Base di Componenti “Green” ...88
Abstract ...89 Introduzione ...90 Metodi ...94 Risultati ...97 Discussione ...103 Conclusioni ...105 Ringraziamenti ...106 Bibliografia ...107 Tabelle ...112 Figure ...114
Capitolo II. Nanoparticelle Polimeriche per la Veicolazione di Quercetina come Agente Neuroprotettivo ...120
Abstract ...121
Introduzione ...122
Metodi ...124
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Discussione ...132
Conclusioni ...133
Bibliografia ...134
Tabelle ...137
Figure ...140
Capitolo III. SLN come carrier per la Veicolazione di Materiale Oligonucleotidico come Agente nel Trattamento della Patologia di Alzheimer ...145
Abstract ...146 Introduzione ...147 Metodi ...150 Risultati ...153 Discussione ...156 Conclusioni ...157 Bibliografia ...159 Tabelle ...162 Figure ...163
Parte III: PROGETTAZIONE E SVILUPPO DI STRATEGIE PER IL NOSE-TO-BRAIN ...166
Capitolo I. Progettazione e Sviluppo di Nanoparticelle Solide Lipidiche come Carrier per la Vaccinazione Nose-to-Brain ...167
Abstract ...168 Introduzione ...169 Metodi ...171 Risultati ...177 Discussione ...180 Conclusioni ...181 Bibliografia ...182 Tabelle ...185
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Figure ...187
Capitolo II. Somministrazione Nasale di Microsfere Veicolanti Idrossipropil-β-Ciclodestrina in Modelli Animali di Neurotossicità Indotta da β-Amiloide (1-42): Effetto Neuro-Protettivo ...191 Abstract ...192 Introduzione ...193 Metodi ...196 Risultati ...200 Discussione ...202 Conclusioni ...204 Ringraziamenti ...204 Bibliografia ...205 Figure ...210
Capitolo III. Microparticelle Solide di Chitosano o Metil-β-ciclodestrina per il Trasporto Nose-to-Brain della Deferoxamina Mesilato: il Primo Approccio Formulativo ...214 Abstract ...215 Introduzione ...216 Metodi ...220 Risultati ...228 Discussione ...233 Conclusioni ...236 Bibliografia ...238 Tabelle ...244 Figure ...245
Schema delle principali fasi del lavoro “Progettazione e sviluppo di sistemi di
veicolazione non invasivi per neuro-farmaci”
NANO-CARRIER PER IL TARGETING CEREBRALE STRATEGIE PER IL NOSE-TO-BRAIN SLN per la Veicolazione di Oligonucleotidi per il Trattamento della Patologia di Alzheimer Nanoparticelle Polimeriche per la Veicolazione di Quercetina come Agente Neuroprotettivo Studio Parametri Formulativi di Dimensioni e Stabilità Fisica di SLN a Base di Componenti “Green” Microparticelle di Chitosano o Metil-β-ciclodestrina: Nose-to-Brain della Deferoxamina Mesilato Nanoparticelle Solide Lipidiche come Carrier per la Vaccinazione Nose-to-Brain Microsfere Veicolanti Idrossipropil-β-Ciclodestrina: Nose-to-Brain in Modelli Animali di Neurotossicità Indotta da β-Amiloide(1-42)
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari Il SNC: barriere
Il sistema nervoso centrale (SNC) è un delicato distretto dell’organismo nel quale vengono dirette molteplici funzioni vitali. Affinché esso possa funzionare correttamente, è necessario che l’ambiente circostante venga finemente controllato. Il SNC si trova così protetto da tre barriere di cui due barriere epiteliali: la barriera emato-liquorale (BEL) e la barriera aracnoidea ed una barriera endoteliale: la barriera emato-encefalica (BEE). La BEL è composta dalle cellule epiteliali del plesso coroideo a diretto contatto con il liquido cerebrospinale (LCS), o liquor, prodotto nei ventricoli cerebrali. L’aracnoide, invece, è una delle tre meningi insieme alla dura madre ed alla pia madre a circondare completamente il SNC. Questa è interposta tra le altre due meningi, ed è nel suo strato esterno localizzato in prossimità della dura madre, in cui viene esercitata la funzione di barriera [Abbott 2010;Nieuwenhuys et al., 2010].
La BEE: anatomia
Il termine Blut-Hirn-Schranke indicante la barriera emato-encefalica (BEE) fu coniato da Lewandowsky nel 1900 [Lewandowsky, 1900], e l’esistenza della BEE fu ufficialmente riconosciuta solo negli anni ‘60 benché Edwin Goldmann ne ipotizzò la presenza già nel 1913 [Goldmann, 1913;Ribatti et al., 2006].
A Broman (1941) e Friemman (1942) spetta il merito di aver riconosciuto che la sede anatomica della BEE fosse localizzata nella parete dei capillari cerebrali. Essa è infatti composta dalle cellule endoteliali formanti la vasta rete di capillari che irrorano il cervello ed ha un’area superficiale di 180 cm2 per grammo di cervello [Pardridge, 2001]. La sua localizzazione è compresa tra la membrana luminale ed abluminale delle cellule endoteliali, separate dal citoplasma endoteliale per una distanza di 200 nm [Brightman and Reese, 1969]. A differenza della maggior parte dei capillari sanguigni dell’organismo, le cellule endoteliali che formano la parete dei capillari cerebrali sono fortemente unite da giunzioni serrate e da giunzioni aderenti, meglio conosciute rispettivamente come tight junctions (TJ) ed adherens junctions (AJ). Il complesso giunzionale delle AJ è collocato sul lato basolaterale ed è composto per lo più dalle proteine caderine e catenine. Le caderine ne sono i costituenti transmembrana principali ed il loro dominio citoplasmatico è messo in comunicazione con l’actina del citoscheletro per via del legame con le catenine. Le AJ hanno il compito di assicurare l’adesione tra le cellule endoteliali dei capillari cerebrali, di garantire un supporto cellulare e di avere un ruolo essenziale per il mantenimento delle TJ, in quanto una loro rottura porta alla rottura della barriera stessa [Wolburg and Lippoldt, 2002]. Sono coinvolte anche in funzioni differenti quali l’inibizione da contatto durante la crescita ed il
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
rimodellamento vascolare, l’avvio della polarità cellulare e la regolazione della permeabilità paracellulare [Cardoso et al., 2010]. Le TJ si trovano invece sul versante apicale e consistono di un complesso di proteine transmembrana (occludine, claudine, molecole di adesione cellulare (JAM)) e di proteine citoplasmatiche (zonula occludens [ZO] e cinguline), queste ultime creano l’ancoraggio con il citoscheletro. Le claudine sono fondamentali per la funzione di barriera, ed i loro livelli di espressione ne determinano l’integrità. Le claudine e le occludine sono collegate tra loro attraverso le [ZO] le quali, in seguito al legame con la cingulina, interagiscono con l’actina e la miosina del citoscheletro [Alyautdin et al., 2014]. Sono principalmente le TJ a limitare il movimento di ioni attraverso la BEE e quindi a determinare l’elevato valore di resistenza elettrica (∼1800 Ω cm2) dell’endotelio cerebrale [Butt et al., 1990]. In realtà, le TJ sono delle complesse strutture delle quali fanno parte più di 40 proteine, includendo in queste quelle transmembrana, di supporto e di segnale [González-Mariscal et al., 2003]. Oltre alla funzione essenziale di barriera paracellulare, si ritiene che le TJ siano implicate in differenti compiti quali controllo dell’espressione genica, della proliferazione e della differenziazione cellulare [González-Mariscal et al., 2008].
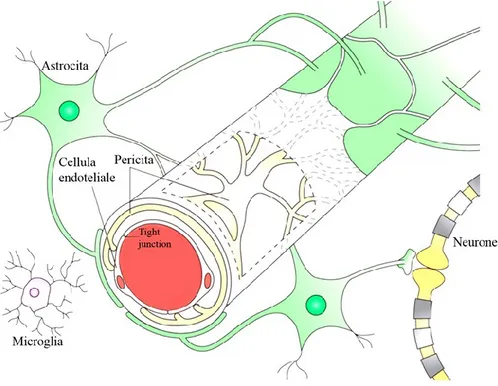
Tra le cellule endoteliali microvascolari cerebrali (BMVEC: brain microvascular endothelial cells) che costituiscono la BEE (unità vascolare) ed il tessuto nervoso (unità nervosa) si creano delle interazioni che nell’insieme formano l’unità neuro-vascolare (NVU) [Hawkins and Davis, 2005]. Queste interazioni partecipano alla regolazione delle funzioni del SNC [Abbott, 2006] nonché della barriera. I compiti principali della NVU sono quelli di limitare l’accesso degli xenobiotici, tra cui i farmaci, nel SNC ed esercitare un controllo sul flusso sanguigno cerebrale [Neuwelt et al., 2011] dimostrando come, attraverso la NVU, il cervello sia in grado di regolare il suo flusso sanguigno, il metabolismo e l’ambiente elettrofisiologico [Neuwelt et al., 2011]. La NVU è formata dalle BMVEC, dalla matrice extracellulare e dalle circostanti cellule della glia (periciti e microglia), dai peduncoli astrocitari e da neuroni [Abbott, 2006].
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Figura 1. Unità neurovascolare. Relazione tra la componente neuronale (astrociti, periciti, microglia e neuroni) e quella vascolare (tight junction delle cellule endoteliali). Immagine adattata (Obermeier B et al., Nature Medicine. 2013;19, 1584-96).
I periciti si distribuiscono in modo discontinuo lungo i capillari cerebrali, circondando parzialmente l’endotelio cerebrale. I periciti e le BMVEC cooperano per controllare meccanismi di sviluppo, stabilità, rimodellamento e maturazione vascolare [Choi and Kim, 2008]. Gli astrociti, con i loro peduncoli, ricoprono circa il 98% della parete vascolare [Neuwelt et al., 2011], formando una rete complessa attorno ai capillari, importante nell’indurre ed aumentare la funzione di barriera fisica (formazione di TJ più serrate), di trasporto (espressione di specifici trasportatori, tra cui la glicoproteina-P di efflusso_P-gp) e metabolica (presenza di un numeroso sistema enzimatico) [Abbott, 2006]. Le proiezioni assonali dei neuroni che vanno sulla muscolatura liscia arteriolare, per mezzo del rilascio di neurotrasmettitori e peptidi, regolano il flusso sanguigno cerebrale e la permeabilità della BEE [Hawkins and Davis, 2005]. Le cellule della microglia sono le cellule immunocompetenti del SNC [Kreutzberg, 1996]. La matrice extracellulare, prodotta dalle cellule della membrana basale, è un sito di ancoraggio e regolazione del segnale tra le cellule [Abbott, 2006]. Neuwelt et al. (2011) include nella NVU anche cellule ematiche circolanti quali cellule polimorfonucleate, linfociti e monociti che svolgono un controllo del segnale neuronale e dell’attività cellulare.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Nell’insieme le cellule della NVU partecipano nel regolare finemente l’influsso dei nutrienti e l’efflusso di sostanze di scarto, tossine e farmaci in modo da assicurare l’omeostasi del SNC.
La BEE: funzione
Le complesse caratteristiche anatomo-fisiologiche possedute dalla BEE e dalla NVU, portano a molteplici e differenti funzioni di barriera schematicamente raggruppate in: barriera fisica, metabolica, immunologica e di trasporto [Alyautdin et al., 2014].
Il compito di barriera fisica è riconducibile alla presenza delle TJ e delle AJ le quali prevengono il trasporto paracellulare di macromolecole e composti polari idrofili; si comportano, così, da filtro altamente selettivo impedendo un libero scambio tra soluti presenti nel sangue ed il fluido cerebrospinale. Solo piccole molecole lipofile (peso molecolare (PM) inferiore a 400 Da) come O2 e CO2 diffondono liberamente attraverso la membrana plasmatica seguendo il loro gradiente di concentrazione [Grieb et al., 1985;Pardridge, 2001]. Il trasporto transcellulare viene limitato dalle cellule perivascolari presenti attorno ai capillari della barriera, quali astrociti, microglia, periciti, che creano un ulteriore strato lipidico cellulare ed aumentano l’ingombro spaziale che una sostanza deve sormontare per passare attraverso la BEE [Bernacki et al., 2008]. Inoltre, il passaggio transcellulare è sfavorito a causa dell’assenza di fenestrature [Fenstermacher et al., 1988] e per la scarsità di canali transendoteliali e vescicole endocitotiche [Sedlakova et al., 1999] nell’endotelio capillare.
La funzione di barriera metabolica è data dalla presenza di numerosi enzimi intra- (monoamminoossidasi, citocromo P450) ed extracellulari (nucleasi, peptidasi) [El-Bacha, 1999] e di un elevato numero di organelli mitocondriali [Oldendorf et al, 1977], mentre cellule quali microglia, mastociti e macrofagi creano una barriera immunologica limitando il passaggio di linfociti ed altri componenti del sistema immunitario. Nella membrana dell’endotelio capillare e dei peduncoli astrocitari sono inoltre espressi elevati livelli di proteine di efflusso ABC (ATP-binding cassette) responsabili del riconoscimento e della successiva estrusione di vari substrati. Tra queste proteine di trasporto ATP-dipendenti vi è la glicoproteina P (P-gp), espressa soprattutto nella membrana apicale di numerose cellule epiteliali, tra cui quelle dell’endotelio capillare cerebrale. È responsabile dell’allontanamento di numerosi farmaci (ivermectina, ciclosporina A e loperamide), che una volta riconosciuti, vengono rimandati nel circolo ematico ed impedito il loro accesso al parenchima cerebrale [Schinkel et al., 1994;Schinkel et al., 1995;Schinkel and van Deemter, 1996], esercitando così la funzione di barriera di trasporto.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
La BEE è una struttura dinamica [Carvey et al., 2009] che funziona come un sistema di filtraggio neurovascolare con il compito fisiologico di garantire un ambiente omeostatico indispensabile per il corretto funzionamento del SNC, ostacolando l’ingresso di sostanze tossiche o agenti infettivi presenti nel sangue e permettendo il passaggio selettivo delle molecole essenziali. Il passaggio di queste ultime nel cervello è garantito dalla presenza di trasportatori selettivi, quali trasportatori degli amminoacidi [Hawkins, et al., 2006], di acidi organici, di cationi, di nucleosidi, del glucosio e degli esosi ed ormoni [Pardridge, 1981;1991].
Alcune sedi del SNC sono tuttavia prive della BEE che si interrompe a livello di particolari strutture chiamate organi circumventricolari (CVO), collocati nelle regioni ventricolari paramediane. Fanno parte dei CVO l’area postrema, l’eminenza mediana, la neuroipofisi, la ghiandola pineale, l’organo subfornicale e la lamina terminale. I vasi sanguigni dei CVO sono caratterizzati da un maggiore spazio perivascolare, dall’assenza di TJ tra le cellule endoteliali e dalla presenza di fenestrature. Per tali caratteristiche, molecole polari e con elevato PM, possono diffondere indisturbate dal sangue allo spazio perivascolare e perciò i CVO vengono spesso indicati come “finestre del cervello” [Johnson and Gross, 1993;Ballabh et al., 2004]. Grazie alla loro collocazione e alle caratteristiche anatomiche, i CVO tengono sotto controllo i livelli degli ormoni circolanti e di altre sostenze trasportate dal sangue o dal LCS, fungendo quindi da organi chemosensitivi e neuroematici [Nieuwenhuys et al., 2010]
Il trasporto dei farmaci al SNC: problematiche
Se, da un punto di vista fisiologico, il ruolo della BEE è di fondamentale importanza, questo diventa un impedimento dal punto di vista terapeutico e/o diagnostico in quanto limita il raggiungimento del SNC alla maggior parte dei farmaci. Circa il 98% di piccole molecole (PM>400 Da) farmacologicamente attive e la totalità di quelle con grosse dimensioni (PM>1 kDa) è incapace di attraversare la BEE [Pardridge, 2001].
Affinché un medicinale diretto al SNC (neuro-farmaco) possa avere una selettività ottimale, biodisponibilità e perciò attività, questo deve superare la BEE e pertanto sormontare la barriera fisica, metabolica, immunologica e di trasporto che vi viene esercitata [Alyautdin et al., 2014]. Accade spesso, però, che molti dei neuro-farmaci sviluppati non possano essere impiegati poiché incapaci di attraversare la BEE, portando ad un’ingente perdita sia in termini di tempo (12-16 anni, tempo medio per lo sviluppo) che economica (0,8-1,7 miliardi di dollari USA) [Matschay et al., 2008].
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Nel 2013, il Center for Drug Evaluation della Food and Drug Administration (FDA) ha approvato 27 nuovi principi attivi di cui solo 11% neuro-farmaci (Tab. 1), in particolare 7% rientranti nell’area terapeutica neurologica e 4% in quella psichiatrica [Mullard, 2014]. Tali risultati indicano come la maggior parte della ricerca sia indirizzata verso lo sviluppo di altre categorie di farmaci, come quelle degli antitumorali e dei farmaci orfani, che rappresentano rispettivamente il 30% ed il 33% della lista delle molecole approvate.
Tabella 1. Elenco dei nuovi neuro-farmaci approvati dalla FDA nel 2013.
Farmaco Principio attivo Utilizzo
Dotarem Gadoterato di meglumina
Risonanza magnetica del cervello (MRI), spina dorsale e tessuti associati in pazienti con età uguale o superiore ai
due anni.
Tecfidera Dimetilfumarato Terapia forme recidive sclerosi multipla. Brintellix Vortioxetina Terapia disturbi depressivi nell’adulto.
Aptiom Eslicarbazepina
acetato Terapia aggiuntiva crisi convulsive epilessia.
http://www.fda.gov/downloads/drugs/developmentapprovalprocess/druginnovation/ucm381803.pdf
A ciò va aggiunto che, attualmente, le patologie della sfera centrale che godono di un maggior trattamento terapeutico riguardano i disturbi dell’umore e del comportamento (depressione, schizofrenia, epilessia) in quanto prevedono l’utilizzo di principi attivi a basso PM, mentre la terapia di patologie neurodegenerative (Parkinson, Alzheimer, Huntington, sclerosi multipla) o di tumori a carico del SNC, è limitata dal fatto che le molecole, che hanno dimostrato un potenziale terapeutico, sono caratterizzate da elevati PM e spesso elevata idrofilia, fattori che ne complicano l’applicazione clinica [Pardridge, 2005].
Una maggiore comprensione dei meccanismi fisiologici, della funzione e dinamiche della BEE, della comunicazione intercellulare nella NVU, della biologia di trasporto, del neuro-sviluppo e dell’imaging strutturale potrebbero contribuire all’evoluzione delle strategie atte al trasporto di neuro-farmaci al cervello per garantirne una loro applicazione [Neuwelt et al., 2012].
Il trasporto dei farmaci al SNC: strategie
Gli approcci esistenti per il trasporto dei farmaci al SNC derivano dalla conoscenza delle caratteristiche anatomiche e fisiologiche della BEE.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
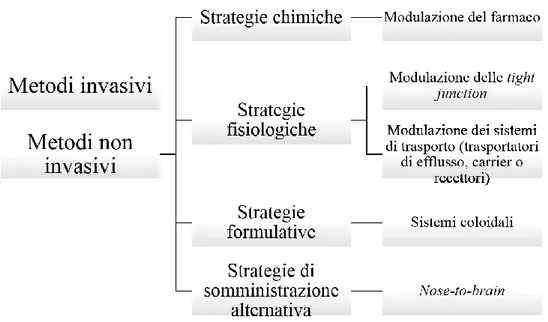
I sistemi attualmente utilizzabili per superare la BEE rientrano in due principali categorie: metodi invasivi e metodi non invasivi [Jones and Shusta, 2007;Lu et al., 2014;Upadhyay, 2014], (Fig. 2).
Figura 2. Rappresentazione schematica sui principali metodi di veicolazione di farmaci destinati al SNC.
Metodi invasivi
I metodi invasivi permettono un superamento meccanico della barriera, fisicamente sormontata mediante somministrazione diretta del farmaco nel SNC, ciò permette l’utilizzo di basse concentrazioni di principio attivo e la riduzione nella comparsa di eventuali effetti collaterali indesiderati dovuti ad un’azione periferica. Tuttavia, a causa della loro natura invasiva presentano numerosi svantaggi, quali: scarsa idoneità per patologie croniche richiedenti ripetute somministrazioni di farmaco; danneggiamento della BEE; alto rischio ed aumentata suscettibilità del SNC ad infiammazioni ed infezioni; intervento da parte di personale medico specializzato; elevati costi; uso di anestesia; ospedalizzazione e bassa compliance da parte dei pazienti.
L’infusione intracerebro-ventricolare, l’iniezione intracerebrale e l’utilizzo di impianti intracerebrali sono alcuni esempi di metodi invasivi per la somministrazione di farmaci al SNC. In tutti questi, però, si evidenza un altro grosso svantaggio di tali strategie legato alla lenta diffusione del farmaco verso il sito di azione. La somministrazione locale del principio attivo prevede che questo migri nel parenchima cerebrale attraverso il LCS. Nonostante il
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
passaggio di un farmaco dal LCS al torrente circolatorio avvenga velocemente attraverso un moto di tipo convettivo, il passaggio dal LCS al tessuto cerebrale avviene per lenta diffusione: la diffusione di un farmaco dal LCS al tessuto cerebrale diminuisce con il quadrato della distanza [Pardridge, 2012]. Più esattamente, la concentrazione cerebrale di un farmaco di piccole dimensioni diminuisce in maniera logaritmica ogni mm di distanza percorso dalla superficie del LCS. Se una piccola molecola di principio attivo è liposolubile, questa subisce una diminuzione nella concentrazione cerebrale di circa dieci volte ogni 500 μm percorsi, mentre se il farmaco di piccole dimensioni è idrosolubile, la diminuzione nella concentrazione è di circa 10 volte ogni mm percorso. Di conseguenza, man mano che aumenta l’idrofilia o il peso molecolare di un farmaco diminuisce il suo coefficiente di diffusione [Pardridge, 2012]. Se da un lato per risolvere il problema diffusivo si potrebbe pensare di utilizzare elevati quantitativi di principio attivo tali da permettere che questo raggiunga sedi del cervello poste a differente distanza, dall’altro si favorirebbe l’insorgenza di tossicità acuta nel SNC.
Un altro metodo di somministrazione invasivo diretto, il convection-enhanced diffusion, è stato concepito con lo scopo di ovviare al problema della lenta diffusione del farmaco. I sistemi reservoir, contenenti un principio attivo e collegati con cateteri transcraniali furono inizialmente progettati ipotizzando che con questa strategia il farmaco potesse muoversi con un flusso in bulk. In realtà, anche con questo metodo il farmaco si sposta lentamente per diffusione [Pardridge, 2012].
Metodi non invasivi
Un farmaco che viene somministrato per via vascolare, ed in grado di passare la BEE, si distribuisce velocemente nell’intero cervello annullando così il fenomeno della lenta diffusione che si manifesta quando il passaggio avviene dal LCS piuttosto che dal sangue [Pardridge, 2012]. Grazie alla vasta area superficiale della barriera ed al fatto che la distanza massima tra una cellula cerebrale e l’endotelio della BEE è di circa 25 µm, il raggiungimento del target avviene tempestivamente [Abbott, 2010].
I metodi non invasivi sono molteplici e possono venire distinti in differenti categorie basate su strategie chimiche, fisiologiche, formulative (uso di sistemi colloidali) e su alternative vie di somministrazione (nasale).
Strategie chimiche
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Modulazione del farmaco: lipidizzazione. In letteratura è una tecnica che viene talvolta indicata come un approccio del tipo farmacologico [Gabathuler, 2010] causando una certa ambiguità. Di fatto, si potrebbe intendere una modifica sulla farmacologia del principio attivo, mentre in realtà si agisce sulla chimica del farmaco, senza cambiarne l’azione terapeutica. Spesso, la strategia si basa sulla sintesi di profarmaci ottenuti dalla coniugazione del principio attivo con un vettore di natura lipidica (ad esempio esterificazione di gruppi – COOH, −OH e –SH). In seguito alla dissociazione in vivo del profarmaco, raggiunto il target d’azione, il farmaco rimane qui intrappolato grazie alla riconquistata idrofilia.
Il loro sviluppo deriva dal principio che una sostanza più lipofila ha maggiore possibilità di passare attraverso la BEE per trasporto transcellulare. Per una buona permeazione nel SNC i valori di log P richiesti dovrebbero essere compresi tra 1,5 e 2,5 [Lu et al., 2014]. Soddisfare il solo requisito di liposolubilità non è tuttavia sufficiente poiché la BEE può essere attraversata solo da molecole che rispondano anche alle caratteristiche dimensionali (PM<400 Da). Infatti, la diffusione di un soluto in un lipide è in dipendenza del volume molecolare che è proporzionale al PM [Levin, 1980;van de Waterbeemd et al., 1998]. Sono pochi i farmaci attualmente disponibili che rispettano entrambe le caratteristiche così come lo sono i farmaci in cui un aumento della lipofilia porti ad un effettivo incremento nel passaggio cerebrale, che viene in realtà ridotto a causa di un’aumentata affinità nei confronti del sistema di efflusso P-gp [Gabathuler, 2010] e dalla maggiore distribuzione tissutale.
Strategie fisiologiche
Agiscono sui meccanismi fisiologici della barriera.
Modulazione della BEE: modulazione delle tight junction. Strategia spesso indicata con il termine disruption, comporta l’apertura temporanea e reversibile delle TJ. Il fenomeno viene promosso in seguito all’utilizzo di mezzi chimici tra cui soluzioni iperosmotiche di mannitolo, capaci di creare una contrazione delle cellule endoteliali, [Kroll and Neuwelt, 1998;Doolittle et al., 2000] ed analoghi della bradichinina, capaci di modulare il recettore B2 della bradichinina il quale è responsabile di cambiamenti nell’architettura delle claudine e delle occludine e quindi delle TJ [Dean et al., 1999;Borlongan and Emerich, 2003] o fisici, quali gli ultrasuoni o le onde elettromagnetiche che aumentano la permeabilità delle TJ [Hynynen et al., 2001;2006]. La disruption può essere responsabile di stress fisiologici, aumento temporaneo della pressione intracranica ed il passaggio di sostanze indesiderate.
Modulazione dei sistemi di trasporto. Un tipo di modulazione dei sistemi di trasporto prevede la regolazione dei trasportatori di efflusso implicati nell’allontanamento di un
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
farmaco dal SNC. La sovra-espressione delle proteine di estrusione riscontrata in alcune condizioni patologiche come l’ictus, l’epilessia, i tumori cerebrali, la neuro-AIDS e le patologie neurodegenerative [Miller et al., 2008] è responsabile di una mancata o minore efficacia terapeutica, in quanto limita la concentrazione del farmaco al sito di azione. La P-gp è una delle proteine principalmente coinvolta in questo meccanismo ed è uno dei fattori predominanti nel fallimento della terapia chemioterapica del SNC [Miller et al., 2008].
La co-somministrazione di sostanze quali la ciclosporina A, il verapamil, il tamoxifene, il diltiazem, in grado di inibire l’attività della P-gp, è stata utilizzata per incrementare il trasporto di farmaci antivirali, antifungini ed antitumorali [Alyautdin et al., 2014].
Tuttavia, anche tale strategia non è priva di svantaggi. I modulatori della Pg-p di prima generazione (verapamil, ciclosporina) inibiscono gli enzimi epatici metabolici CYP3A e sono causa di tossicità da elevate dosi di somministrazione vista la loro bassa affinità con P-gp. Con i modulatori delle generazioni successive si sono ridotte tali problematiche, ma è risultata ambigua la loro capacità di favorire il raggiungimento del SNC dei farmaci substrato dei sistemi di efflusso [Miller et al., 2008]. Inoltre, l’utilizzo cronico degli inibitori della P-gp potrebbe favorire il passaggio anche di sostanze indesiderate e tossiche per il SNC.
Un altro tipo di modulazione dei sistemi trasportatori consiste nello sfruttare i carrier o i recettori espressi nella BEE per le sostanze endogene in modo da ottenere, tramite un trasporto mediato da carrier (CMT) o da recettori (RMT), il passaggio di un farmaco nel SNC. Nei sistemi CMT, le proteine di trasporto permettono il movimento bidirezionale sangue-cervello di ioni, piccole molecole idrosolubili e nutrienti. Sono saturabili e specifici per una categoria di substrati: vengono distinti in CMT per glucosio, amminoacidi, acidi carbossilici, colina, nucleosidi, ormoni tiroidei e vitamine liposolubili [Pardrige 2002]. Alcuni farmaci terapeuticamente in uso (L-DOPA, gabapentin, melphalan) vengono internalizzati nell’endotelio cerebrale con un meccanismo CMT grazie alla similitudine strutturale con un substrato endogeno [Pardridge, 2012]. La coniugazione di un principio attivo con un vettore dotato di affinità per un determinato carrier è un’altra strategia ampiamente indagata nel campo dei sistemi CMT [Pardridge, 2012]. A causa della natura stereospecifica dei carrier, la strategia CMT è limitata all’impiego di piccole molecole [Jones and Shusta, 2007].
Sia nel lato luminale che abluminale dell’endotelio cerebrale, sono espressi specifici sistemi di trasporto recettoriali responsabili del passaggio bidirezionale di proteine e peptidi circolanti come l’insulina e la transferrina (Tf). Nel RMT l’interazione del ligando con uno
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
specifico recettore porta all’internalizzazione del complesso ligando-recettore per transicitosi con il conseguente rilascio del ligando all’interno della cellula endoteliale.
L’identificazione e la comprensione dei meccanismi fisiologici di RMT ha portato allo sviluppo dei sistemi di veicolazione in cui i composti terapeutici vengono coniugati o con ligandi endogeni per il recettore o con ligandi modificati ma dotati di affinità recettoriale oppure ancora con anticorpi in grado di riconoscere con specificità una struttura recettoriale della BEE [Pardridge, 2002]. La coniugazione tra la molecola terapeutica ed il vettore può essere del tipo covalente (via ammine primarie o legame tioestere) o non covalente (streptavidina/biotina, PEG); l’interazione non deve comunque modificare l’attività del farmaco. L’ampia espressione del recettore della transferrina (Tfr) a livello dell’endotelio cerebrale [Jefferies et al., 1984], ha permesso che questo venisse ampiamente indagato nello sviluppo di sistemi RMT. Per prevenire la competizione con il substrato endogeneo ed evitare la saturazione del Tfr, i sistemi di veicolazione documentati in letteratura riguardano l’uso di anticorpi diretti contro il Tfr tra cui uno dei maggiormente impiegati è l’anticorpo monoclonale murino diretto contro il Tfr di ratto (OX26). Questo ha inizialmente dimostrato di avere azioni di targeting cerebrale senza alterare l’attività farmacologica del cargo ad esso associato; ciononostante, il suo impiego nel garantire l’accumulo del farmaco nel parenchima cerebrale è risultato spesso fallimentare. Una giustificazione potrebbe essere ricercata nel fatto che l’espressione del Tfr si estende anche ai tessuti periferici il ché ne limita la sito-specificità e l’accumulo nel cervello [Gabathuler, 2010]. Tale svantaggio si manifesta ugualmente nei sistemi RMT aventi come target il recettore dell’insulina (Ir). Anche in questi, il vettore è rappresentato da anticorpi poiché il ligando endogeno è instabile a livello ematico (emivita 10 min) ed è causa di un effetto ipoglicemizzante. Molteplici studi su modelli animali hanno comunque confermato l’efficaci nel trasportare un neuro-farmaco al cervello attraverso il recettore dell’insulina [Pardridge, 2012; Boado et al., 2014].
Strategia formulativa: uso dei sistemi colloidali
Le nanoparticelle (NP), i liposomi, le emulsioni, le micelle e i dendrimeri sono alcuni esempi di sistemi colloidali (SC) accomunati tutti dall’avere dimensioni rientranti nel range nanometrico (1-1000 nm).
Il più delle volte, il passaggio dei nanosistemi nel SNC viene promosso dalla presenza di agenti che operano sui meccanismi di trasporto fisiologicamente presenti nella BEE (sistemi di efflusso, TJ, RMT, CMT); l’attraversamento spontaneo per transcitosi e/o endocitosi è infatti limitato a causa delle scarse proprietà di permeazione della barriera.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
La versatilità nella natura delle NP, dettata dalla composizione della matrice quale elemento costitutivo, e le numerose modifiche di superficie apportabili, permettono alle NP di poter essere adattate nell’impiego di una ampia gamma di farmaci, e quindi di patologie, rendendole strutture appetibili nell’ambito della ricerca dei sistemi per il trasporto cerebrale di farmaci. Uno degli svantaggi principali associati all’uso delle NP è la loro rapida rimozione ematica (clearance) ad opera del sistema reticolo endoteliale (RES), fenomeno che influenza negativamente la biodistribuzione particellare ed il raggiungimento del target d’azione. D’altro canto, una risposta alla problematica viene data mediante il controllo delle caratteristiche dimensionali e di superficie delle NP che consente di aumentarne l’emivita plasmatica. In riferimento a ciò, è stato appurato che le dimensioni medie ideali cadono nel range dei 200-500 nm e che il fenomeno di clearance splenico, con passaggio nelle fessure dei seni venosi, si riduce se, le particelle vicine al limite massimo dei 500 nm, sono capaci di deformarsi. Per dimensioni minori di 200 nm prevale invece la clearance renale [Gastaldi et
al., 2014]. In aggiunta, la presenza nella superficie particellare di surfattanti e/o polimeri rende le NP stealth, cioè meno riconoscibili da parte dei componenti del RES poiché meno soggette a fenomeni fagocitotici o di opsonizzazione promossi dalla lipofilia e dalla carica negativa superficiale del colloide.
La manipolazione delle caratteristiche di superficie consente di assolvere ad un altro importante compito: il targeting sito-specifico. La scelta del ligando sito-specifico viene effettuata a seconda della a) problematica del passaggio legata al farmaco; b) via preferenziale per l’attraversamento della BEE (RMT, CMT, transcitosi per adsorbimento, inibizione dei sistemi di efflusso, fluidizzazione di membrana ed apertura delle TJ); c) patologia (condizioni alterate della BEE, durata, tipologia ed entità del trattamento). Largo impiego trovano i ligandi destinati ad un RMT; questi raramente sono i substrati endogeni dei recettori, che creerebbero competizione con gli stessi presenti fisiologicamente nel plasma, ma piuttosto anticorpi o molecole che interagiscono in siti allosterici [Kreuter, 2014].
Tra le NP studiate per la veicolazione di farmaci al cervello rientrano quelle a matrice polimerica e quelle a matrice lipidica, passate recentemente in rassegna rispettivamente da
Kreuter (2014) e Gastaldi et al. (2014). Il polimero dell’acido lattico (PLA) ed il co-polimero dell’acido lattico con l’acido glicolico (PLGA) trovano ampia applicazione nella preparazione di NP polimeriche poiché biodegradabili, atossici, approvati dalla FDA; essi inoltre, tramite semplici metodi preparativi quali l’emulsionamento con evaporazione del solvente, portano facilmente all’ottenimento di NP [Lu et al., 2014]. NP lipidiche, meglio conosciute come SLN, sono ottenute impiegando lipidi solidi a temperatura ambiente
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
(gliceridi, acidi grassi, cere), principalmente mediante la tecnica di omogeneizzazione a caldo, che può venire sostituita da altre che prevedono meno stress meccanici e termici, come l’emulsionamento seguito da evaporazione del solvente. Le SLN, rispetto alle polimeriche hanno maggiori capacità di caricamento di farmaco e stabilità, minore costo e tossicità; numerosi studi hanno comunque dimostrato che entrambe sono capaci di veicolare al SNC molecole terapeuticamente problematiche quali peptidi, proteine, materiale genico, oligonucleotidi [Alyautidin et al., 2014], anche se finora, le concentrazioni di farmaco rinvenute nel cervello, sono state sempre troppo basse per rendere i sistemi farmacologicamente applicabili [Masserini, 2013].
Strategia della via di somministrazione: il nose-to-brain
È una strategia che unisce i vantaggi dei metodi invasivi, aggirando la BEE, con quelli dei metodi non invasivi, evitando la messa in atto di interventi chirurgici. La BEE viene bypassata in quanto è il naso, l’unico distretto dell’organismo, ad essere a diretto contatto con il SNC. Dal bulbo olfattivo, sito nelle regioni limbiche cerebrali, si diramano i filamenti nervosi del XII nervo cranico (nervo olfattivo) che vanno a proiettarsi nella mucosa olfattiva nasale collocata nella parte postero-superiore dell’omonima cavità [Lochhead and Thorne, 2012]. Il naso è in comunicazione con il SNC anche per mezzo del V nervo cranico (trigemino) di cui il ramo oftalmico e quello mascellare innervano rispettivamente la mucosa olfattiva e quella respiratoria. Grazie al trigemino si crea una diretta comunicazione con il tronco encefalico. Dalla cavità nasale si origina così una via di accesso per il trattamento mirato delle patologie localizzate nelle sedi limbiche (disordini mentali, neurodegenerazione) e nel tronco encefalico.
La validità e la rapidità della strategia nose-to-brain nel garantire il passaggio di farmaci al SNC è stata ampiamente dimostrata da più di un centinaio di studi riguardanti la sperimentazione animale [Djupesland et al., 2014]. Da questi sono stati ottenuti risultati incoraggianti per la successiva applicazione in campo umano. Tuttavia, la pratica clinica è stata rallentata da differenti fattori tra cui soprattutto una difficile traslazione agli umani dei risultati degli studi animali per le differenze anatomo/fisiologiche intercorrenti tra le specie, [Lochhead and Thorne, 2012]. Inizialmente si è ritenuto che la mucosa olfattiva dei ratti e topi avesse una più ampia superficie rispetto a quella umana. Dettagliate analisi anatomiche su campioni di biopsie umane hanno però dimostrato come il nose-to brain si possa estendere anche alla mucosa respiratoria abbondantemente innervata dal trigemino. La complessa anatomia e fisiologia nasale dell’uomo richiede maggiori accorgimenti. Per evitare un effetto sistemico ed avere un’azione mirata al SNC, le modalità di
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
somministrazione, le proprietà chimico fisiche del materiale somministrato (dimensione, morfologia, aerodinamicità, ecc.) così come i dispositivi di dispensazione sono da considerarsi fattori determinanti al successo.
Il meccanismo del rapido passaggio dei farmaci al SNC si compie tramite una migrazione extra-cellulare in cui si ha inizialmente l’attraversamento dei canali creati dalle cellule di rivestimento disposte lungo il nervo trigemino ed olfattivo, il conseguente raggiungimento del bulbo olfattivo, da cui si osserva, infine, una migrazione alle varie aree cerebrali per mezzo della forza di spinta impartita dalle pulsazioni arteriorali, la così detta pompa perivascolare [Djupesland et al., 2013]. Il movimento nel LCS, che bagna il bulbo olfattivo, giocherebbe quindi un ruolo marginale in quanto, a causa del fenomeno della lenta diffusione, impedirebbe ad un farmaco di raggiungere le sedi distanti dalle aree limbiche [Djupesland et al., 2013; Pardridge, 2011]. Anche il meccanismo della lenta migrazione intra-assonale, dovuto all’up-take da parte dei neuroni sensoriali olfattivi, sembra non avere peso [Chapman et al., 2013]. Tuttavia, rimangono ancora dei punti oscuri nel percorso di un farmaco al SNC mediante questa modalità di trattamento [Lochhead and Thorne, 2012].
La via nasale è una via non priva di svantaggi tra i quali attiva clearance mucociliare, pseudo metabolismo di primo passaggio per la presenza di sistemi enzimatici metabolici nonché variabilità interindividuale ed una possibile alterazione della mucosa nasale in seguito alla somministrazione stessa del farmaco. Numerosi sono i vantaggi quali sicurezza, rapidità, facilità di esecuzione, possibilità nell’evitare il metabolismo di primo passaggio epatico, ricca vascolarizzazione e presenza di cellule immuno-competenti. Inoltre si presta alla veicolazione di differenti categorie di farmaci come ormoni [Nathan, 2011], fattori neurotrofici [Alcalá-Barraza et al., 2010], cellule staminali [Joyce et al., 2010] e peptidi [Brown and Liu, 2014], macrolidi [Gavini et al., 2011], derivati purinici [Dal Piaz et al., 2008] e triptani [Gavini et al., 2013].
Elenco delle abbreviazioni
AJ: adherens junctions; BEE: barriera ematoencefalica; BMVEC: cellule endoteliali micro vascolari cerebrali; CMT: trasporto mediato da carriers; CVO: organi circumventricolari; JAM: molecole di adesione cellulare; LCS: liquido cerebrospinale; NP: nanoparticelle; NVU: unità neuro vascolare; P-gp: glicoproteina-P; PLA: acido polilattico; PLGA: acido polilattico-co-glicolico; RES: sistema reticolo-endoteliale; RMT: trasporto mediato da recettori; SC: sistemi colloidali; SLN: nanoparticelle solide lipidiche; SNC: sistema nervoso centrale; Tf: transferrina; Tfr: recettore della transferrina; TJ: tight junctions; ZO: zonula occludens.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari Bibliografia
Alcalá-Barraza SR, Lee MS, Hanson LR, McDonald AA, Frey WH 2nd, McLoon LK. Intranasal delivery of neurotrophic factors BDNF, CNTF, EPO, and NT-4 to the CNS. J Drug Target. 2010;18(3):179-90.
Alyautdin R, Khalin I, Nafeeza MI, Haron MH, Kuznetsov D. Nanoscale drug delivery systems and the blood-brain barrier. Int J Nanomedicine. 2014;9:795-811.
Ballabh P, Braun A, Nedergaard M. The blood–brain barrier: an overview Structure, regulation, and clinical implications. Neurobiol Dis. 2004;16(1):1-13.
barrier in the rabbit. J Submicrosc Cytol Pathol. 1999;31(1):149-61.
Bernacki J, Dobrowolska A, Nierwińska K, Malecki A. Physiology and pharmacological role of the blood–brain barrier. Pharmacol Rep. 2008;60:600-22.
Boado RJ, Lu JZ, Hui EK, Pardridge WM. Insulin receptor antibody-sulfamidase fusion protein penetrates the primate blood-brain barrier and reduces glycosoaminoglycans in Sanfilippo type A cells. Mol Pharm. 2014;11(8):2928-34.
Borlongan CV, Emerich DF. Facilitation of drug entry into the CNS via transient permeation of blood–brain barrier: laboratory and preliminary clinical evidence from bradykinin receptor agonist, Cereport. Brain Res Bull. 2003;60(3):297-306.
Brightman MW, Reese TS. Junctions between intimately apposed cell membranes in the vertebrate brain. J Cell Biol. 1969;40:648-77.
Broman T. The possibilities of the passage of substances from the blood to the central nervous system. Acta Psych Neurol 1941;16:1-16.
Brown V, Liu F. Intranasal Delivery of a Peptide with Antidepressant-Like Effect. Neuropsychopharmacology. 2014;39, 2131-41.
Butt AM, Jones HC, Abbott NJ. Electrical resistance across the blood–brain barrier in anaesthetised rats: a developmental study. J Physiol. 1990;429:47-62.
Cardoso FL, Brites D, Brito MA. Looking at the blood-brain barrier: molecular anatomy and possible investigation approaches. Brain Res Rev. 2010;64(2):328-63.
Carvey PM, Hendey B, Monahan AJ. The blood-brain barrier in neurodegenerative disease: a rhetorical perspective. J Neurochem. 2009;111:291-314.
Chapman CD, Frey WH 2nd, Craft S, Danielyan L, Hallschmid M, Schiöth HB, Benedict C. Intranasal treatment of central nervous system dysfunction in humans. Pharm Res. 2013;30(10):2475-84.
Chen Y, Liu L. Modern methods for delivery of drugs across the blood–brain barrier. Advanced Drug Delivery Reviews. 2012;64:640.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Dalpiaz A, Gavini E, Colombo G, Russo P, Bortolotti F, Ferraro L, Tanganelli S, Scatturin A, Menegatti E, Giunchedi P. Brain uptake of an antiischemic agent by nasal administration of microparticles. J Pharm Sci. 2008;97(11):4889-903.
Dean RL, Emerich DF, Hasler BP, Bartus RT. Cereport (RMP-7) increases carboplatin levels in brain tumors after pretreatment with dexamethasone. Neuro Oncol. 1999;1(4):268-74.
Djupesland PG, Mahmoud RA, Messina JC. Accessing the brain: the nose may know the way. J Cereb Blood Flow Metab. 2013;33(5):793-4.
Djupesland PG, Messina JC, Mahmoud RA. The nasal approach to delivering treatment for brain diseases: an anatomic, physiologic, and delivery technology overview. Ther Deliv. 2014;5(6):709-33.
Doolittle ND, Miner ME, Hall WA, Siegal T, Jerome E, Osztie E, McAllister LD, Bubalo JS, Kraemer DF, Fortin D, Nixon R, Muldoon LL, Neuwelt EA. Safety and efficacy of a multicenter study using intraarterial chemotherapy in conjunction with osmotic opening of the blood–brain barrier for the treatment of patients with malignant brain tumors. Cancer. 2000;88(3):637-47.
El-Bacha RS, Minn A. Drug metabolizing enzymes in cerebrovascular endothelial cells afford a metabolic protection to the brain. Cell Mol Biol (Noisy-le-grand). 1999;45(1):15-23.
Fenstermacher J, Gross P, Sposito N, Acuff V, Pettersen S, and Gruber K. Structural and functional variations in capillary systems within the brain. Ann N Y Acad Sci. 1988;529:21-30.
Friedemann U. Blood-brain barrier. Physiol Rev. 1942;22:125-45.
Gabathuler R. Approaches to transport therapeutic drugs across the blood-brain barrier to treat brain diseases. Neurobiol Dis. 2010;37:48-57.
Gastaldi L, Battaglia L, Peira E, Chirio D, Muntoni E, Solazzi I, Gallarate M, Dosio F. Solid lipid nanoparticles as vehicles of drugs to the brain: current state of the art. Eur J Pharm Biopharm. 2014;87(3):433-44.
Goldmann E. Vitalfarbung am zentralnervensystem. Abhandl Konigl preuss Akad Wiss; 1913.
Gavini E, Rassu G, Ferraro L, Generosi A, Rau JV, Brunetti A, Giunchedi P, Dalpiaz A. Influence of chitosan glutamate on the in vivo intranasal absorption of rokitamycin from microspheres. J Pharm Sci. 2011;100(4):1488-502.
Gavini E, Rassu G, Ferraro L, Beggiato S, Alhalaweh A, Velaga S, Marchetti N, Bandiera P, Giunchedi P, Dalpiaz A. Influence of polymeric microcarriers on the in vivo intranasal
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
uptake of an anti-migraine drug for brain targeting. Eur J Pharm Biopharm. 2013;83(2):174-83.
González-Mariscal L, Betanzos A, Nava P, Jaramillo BE. Tight junction proteins. Prog Biophys Mol Biol. 2003;81(1):1-44.
González-Mariscal L, Tapia R, Chamorro D. Crosstalk of tight junction components with signaling pathways. Biochim Biophys. Acta. 1778;729-56.
Hawkins BT, Davis TP, The blood–brain barrier/neurovascular unit in health and disease. Pharmacol Rev. 2005;57: 73-85.
Hawkins RA, O'Kane RL, Simpson IA, Viña JR. Structure of the blood-brain barrier and its role in the transport of amino acids. J Nutr. 2006;136(1 Suppl):218S-26S.
Hynynen K, McDannold N, Vykhodtseva N, Jolesz FA. NoninvasiveMR imagingguided focal opening of the blood–brain barrier in rabbits. Radiology. 2001;220(3):640-6.
Hynynen K, McDannold N, Vykhodtseva N, Raymond S, Weissleder R, Jolesz FA, Sheikov N. Focal disruption of the blood-brain barrier due to 260-kHz ultrasound bursts: a method for molecular imaging and targeted drug delivery. J Neurosurg. 2006;105(3):445-54.
Jefferies WA, Brandon MR, Hunt SV, Williams AF, Gatter KC, Mason DY. Transferrin receptor on endothelium of brain capillaries. Nature. 1984;312:162-3.
Johnson AK, Gross PM. Sensory circumventricular organs and brain homeostatic pathways. FASEB J. 1993;7(8): 78-86.
Jones AR, Shusta EV. Blood-Brain Barrier Transport of Therapeutics via Receptor-Mediation. Pharm Res. 2007;24(9):1759-71.
Joyce N, Annett G, Wirthlin L, Olson S, Bauer G, Nolta JA. Mesenchymal stem cells for the treatment of neurodegenerative disease. Regen Med. 2010;5(6):933-46.
Kreuter J. Drug delivery to the central nervous system by polymeric nanoparticles: what do we know? Adv Drug Deliv Rev. 2014;71:2-14.
Kreutzberg GW. Microglia: a sensor for pathological events in the CNS. Trends Neurosci. 1996;19(8):312-8.
Kroll RA, Neuwelt EA. Outwitting the blood–brain barrier for therapeutic purposes: osmotic opening and other means. Neurosurgery. 1998;42(5):1083-99.
Levin VA. Relationship of octanol/water partition coefficient and molecular weight to rat brain capillary permeability. J Med Chem. 1980;23:682-4.
Lewandovsky M. Zur lehre von der cerebrospinal flüssigkeit. Z Klin Med 1900;40:480-94. Lochhead JJ, Thorne RG. Intranasal delivery of biologics to the central nervous system. Adv Drug Deliv Rev. 2012;15;64(7):614-28.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Lu CT, Zhao YZ, Wong HL, Cai J, Peng L, Tian XQ. Current approaches to enhance CNS delivery of drugs across the brain barriers. Int J Nanomedicine. 2014;9:2241-57.
Masserini M. Nanoparticles for Brain Drug Delivery. ISRN Biochemistry. 2013: Consultabile al: (http://www.hindawi.com/journals/isrn/2013/238428/cta/).
Matschay A, Nowakowska E, Hertmanowska H, Kus K, Czubak A. Cost analysis of therapy for patients with multiple sclerosis (MS) in Poland. Pharmacol Rep. 2008;60(5):632-44.
Matter K, Balda MS. Signalling to and from tight junctions. Nat Rev Mol Cell Biol. 2003;4:225-36.
Miller DS, Bauer B, Hartz AMS. Modulation of P-glycoprotein at the Blood-Brain Barrier: Opportunities to Improve CNS Pharmacotherapy. Pharmacol Rev. 2008;60(2):196-209.
Mullard A. 2013 FDA drug approvals. Nat Rev Drug Discov. 2014;13:85-9.
Nathan RA. Intranasal steroids in the treatment of allergyinduced rhinorrhea. Clin Rev Allergy Immunol. 2011;41(1):89-101.
Neuwelt EA, Bauer B, Fahlke C, Fricker G, Iadecola C, Janigro D, Leybaert L, Molnár Z, O'Donnell ME, Povlishock JT, Saunders NR, Sharp F, Stanimirovic D, Watts RJ, Drewes LR. Engaging neuroscience to advance translational research in brain barrier biology. Nat Rev Neurosci. 2011;12(3):169-82.
Nieuwenhuys R, Voogd JD, Huijzen C [II ed. ita. A cura di Papa M]. Il sistema nervoso centrale. Springer-Verlag Italia; 2010: p.97-99.
Oldendorf WH, Cornford ME, Brown WJ. The large apparent work capability of the blood-brain barrier: a study of the mitochondrial content of capillary endothelial cells in brain and other tissues of the rat. Ann Neurol. 1977;1(5):409-17.
Pardridge WM. Blood-brain barrier transport of glucose, free fatty acids, and ketone bodies. Adv Exp Med Biol. 1991;291:43-53.
Pardridge WM. Brain drug targeting: the future of brain drug development. Cambridge: Cambridge University Press; 2001.
Pardridge WM. Drug and gene targeting to the brain with molecular trojan horses. Nat Rev Drug Discov 2002;1:131-9.
Pardridge WM. Drug transport across the blood–brain barrier. J Cereb Blood Flow Metab. 2012;32(11):1959-72.
Pardridge WM. Drug transport in brain via the cerebrospinal fluid. Fluids Barriers CNS. 2001;8(1):7.
Pardridge WM. The Blood-Brain Barrier: Bottleneck in Brain Drug Development. NeuroRx. 2005;2(1):3-14.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Pardridge WM. Transport of nutrients and hormones through the blood-brain barrier. Diabetologia. 1981;20 Suppl:246-54.
Ribatti D, Nico B, Crivellato E, Artico M. Development of the blood–brain barrier: a historical point of view. Anat Rec B New Anat. 2006;289(1):3-8.
Rip J, Schenk GJ, de Boer AG. Differential receptor-mediated drug targeting to the diseased brain. Expert Opin Drug Deliv. 2009;6(3):227-37.
Schinkel AH and van Deemter. L. P-glycoprotein in the blood-brain barrier of mice influences the brain penetration and pharmacological activity of many drugs. J Clin Investig. 1996;97:2517-24.
Schinkel AH, Smit JJ, van Tellingen O, Beijnen JH, Wagenaar E, van Deemter L, Mol CA, van der Valk MA, Robanus-Maandag EC, te Riele HP, et al. Disruption of the mouse mdr1a P-glycoprotein gene leads to a deficiency in the blood-brain barrier and to increased sensitivity to drugs. Cell. 1994;77:491-502.
Schinkel AH, Wagenaar E, van Deemter L, Mol CA, Borst P. Absence of the mdr1a P-Glycoprotein in mice affects tissue distribution and pharmacokinetics of dexamethasone, digoxin, and cyclosporin A. J Clin Investig. 1995;96:1698-705.
Sedlakova R, Shivers RR, and Del Maestro RF. Ultrastructure of the bloodbrain
Upadhyay RK. Drug Delivery Systems, CNS Protection, and the Blood Brain Barrier.
Biomed Res Int 2014; ID 869269. Consultabile al:
(http://www.hindawi.com/journals/bmri/2014/869269/)
van de Waterbeemd H, Camenisch G, Folkers G, Chretien JR, Raevsky OA. Estimation of blood-brain barrier crossing of drugs using molecular size and shape, and H-bonding descriptors. J Drug Target. 1998;6:151-65.
Wolburg H, Lippoldt A. Tight junctions of the blood–brain barrier: development, composition and regulation. Vascul Pharmacol. 2002;38(6):323-37.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Parte Prima
TARGETING CEREBRALE MEDIATO DA VETTORI
SITO-SPECIFICI E STRATEGIA NOSE-TO-BRAIN: RASSEGNE
BIBLIOGRAFICHE
Le rassegne bibliografiche trattate di seguito sono frutto di un mirato approfondimento di parte della letteratura raccolta ed impiegata durante la Parte Sperimentale del lavoro (Parte seconda e terza).
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
Capitolo I
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari Abstract
Le patologie situate nel sistema nervoso centrale (SNC) sono un difficile bersaglio terapeutico e diagnostico. In tal senso, la barriera emato-encefalica (BEE) gioca un ruolo fondamentale perché impedisce alla maggior parte dei farmaci di raggiungere il loro sito d’azione all’interno del SNC. I sistemi per il trasporto di farmaci al cervello sono stati concepiti per rispondere a questa problematica. Molti originano dall’analisi anatomo-funzionale della BEE e sono stati sviluppati in modo da sfruttare la fisiologia della membrana endoteliale cerebrale e consentire l’accesso dei farmaci. Sia delle sostanze endogene che esogene posseggono recettori o carrier che mediano il loro ingresso nel SNC. Una strategia ampiamente utilizzata per il trasporto al cervello di rimedi terapeutici consiste nel combinare i principi attivi con sostanze in grado di sfruttare i meccanismi di internalizzazione cerebrali. Si ottiene il vantaggio di disporre di un metodo indiretto che consente di superare la BEE senza invasività e quindi con minor pericolo e costo.
Tra le sostanze presenti in natura come potenziali vettori di neuro-farmaci si distinguono le neurotossine. Questa review passa in rassegna i principali sistemi di veicolazione, attualmente presenti, composti da frammenti atossici di neurotossine usate per permettere il passaggio della BEE ed il raggiungimento del SNC. L’obiettivo è stato quello di stimolare la ricerca nello sviluppo di nuove tipologie di sistemi di trasporto improntati all’uso di sostanze comunemente considerate pericolose, ma dietro alle quali si nascondono anche numerosi vantaggi.
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari Introduzione
Le patologie del SNC sono spesso una sfida terapeutica e diagnostica dal momento che la BEE nega l’accesso alla maggior parte dei farmaci. La BEE è un sistema cerebrovascolare altamente complesso composta nel totale da circa 100 miliardi di capillari le cui cellule endoteliali sono strettamente unite da tight junction (TJ) [Brightman, 1969], circondate da astrociti, periciti e macrofagi che nell’insieme formano la complessa barriera che protegge il SNC. È responsabile della protezione fisiologica di quest’ultimo ma al contempo la sua presenza impedisce il passaggio di molecole terapeutiche. A causa di quest’ostacolo, è risaputo che più del 98% di farmaci con peso molecolare inferiore a 400 Da e la totalità di quelli aventi un peso superiore non attraversano la barriera [Pardridge, 2003;2005]. Il trattamento di patologie quali l’emicrania, l’insonnia, i disturbi dell’umore, il dolore e l’epilessia è basato su agenti ben caratterizzati ed a basso peso molecolare. D’altra parte, le patologie più devastanti del SNC come i tumori cerebrali, l’ictus e la neurodegenerazione sono in attesa di una cura o trattamento. Ciò è da ricondurre al fatto che, molecole che hanno mostrato di essere attive contro lo sviluppo di queste malattie, sono di grosse dimensioni e quindi incapaci di superare la BEE. In tal contesto, vi è un’urgente necessità nello sviluppo di strategie che consentano a nuovi composti terapeutici di raggiunere il SNC. Di fatto, la ricerca nell’ambito dei neuro-farmaci da parte dell’industria farmaceutica è fortemente rallentata e le sperimentazioni cliniche si fermano alla fase I o II, dopo ingenti costi di sviluppo, principalmente a causa dello scarso raggiungimento del tessuto nervoso [Khrestchatisky and Tokay, 2014]. In aggiunta, sono insufficienti gli investimenti volti al progresso tecnologico per l’ottenimento di sistemi atti al trasporto sito-specifico di questa categoria farmaceutica.
Teoricamente la strategia più immediata per arrivare alle sedi nervose centrali consiste nel superamento fisico dell’ostacolo attraverso la somministrazione diretta di un farmaco nel SNC per via intratecale, intraventricolare od intracerebrale [Alam et al., 2010]. In tal modo si ricorre all’uso di metodi invasivi e quindi dolorosi, pericolosi e costosi, perché richiedono personale specializzato ed idonea strumentazione, pertanto di complessa applicazione. La somministrazione nasale rappresenta un approccio non invasivo per trasportare farmaci al cervello; in realtà, la comunicazione diretta tra naso e cervello può offrire la possibilità di aggirare la BEE. Il passaggio dal naso al cervello può avvenire attraverso il neuro-epitelio olfattivo tramite una via di trasporto paracellulare, transcellulare o neuronale [Pires et al., 2009]. Nell’ultimo decennio sono stati studiati diversi sistemi di veicolazione, come le micro e le nanoparticelle, per la somministrazione nasale di un neuro-farmaco, in alternativa alla via orale o parenterale. È stato documentato un aumento della quantità di farmaco nelle sedi
Tesi di Dottorato di Elena Soddu
“Progettazione e sviluppo di sistemi di veicolazione non invasivi per neuro-farmaci” Dottorato in Scienze e Tecnologie Chimiche, indirizzo Scienze Farmaceutiche
Università degli Studi di Sassari
centrali rispetto allo stesso libero [Dalpiaz et al., 2008;Gavini et al., 2011;2013;Fazil et al., 2012;Josea et al., 2013;Kumar et al., 2013].
D’altra parte, con gli approcci indiretti è necessario che il farmaco sia capace di attraversare la BEE. Questi possono venire classificati in: I) Metodi farmaceutici. Adattano le caratteristiche chimico-fisiche della molecola per assicurare il passaggio della barriera. Possono essere basati su modifiche strutturali del farmaco (profarmaco) o sulla formulazione in sistemi quali liposomi e nanoparticelle [Witt et al., 2000;Tiwari and Amiji, 2006]; II) Metodi di modifica della barriera. Cambiano la struttura della BEE aumentando temporaneamente la sua permeabilità tramite l’impiego di agenti osmotici, biochimici, ultrasuoni o onde elettromagnetiche [Doolittle et al., 2000;Plank et al., 2011;Huang et al., 2012]. III) Metodi fisiologici. Sfruttano la presenza fisiologica nella BEE di trasportatori e recettori che mediano l’ingresso dei loro substrati.
Grazie alla loro versatilità, i metodi fisiologici si rendono le strategie tra le più interessanti. Di fatto, possono essere impiegati con diversi stratagemmi per veicolare farmaci di varia natura per il targeting selettivo, sicuro e non invasivo del SNC. Sfruttare le strutture fisiologicamente presenti significa utilizzare meccanismi di trasporto endogeni che permettono alle sostanze di passare indisturbate indipendetemente dalle loro caratteristiche chimico-fisiche (Fig. 1). Con il tempo sono stati sviluppati sistemi di trasporto come “cavalli di Troia”, peptidi chimerici, proteine cationiche, profarmaci e vettori. La tecnologia del “cavallo di Troia” molecolare utilizza proteine geneticamente ingegnerizzate per muovere un farmaco alla superficie della BEE; il complesso viene quindi trasportato con meccanismo mediato da recettore [Pardridge, 2006]. Il sistema del peptide chimerico viene ottenuto tramite legame covalente di una sostanza farmaceutica con un peptide o proteina vettoriale abile nell’attraversare la BEE per transcitosi di adsorbimento, recettore o trasportatore mediata [Prokai and Prokai-Tatrai, 2003]. Il sistema delle proteine cationiche è stato disegnato per favorire la penetrazione encefalica di farmaci proteici tramite un’interazione elettrostatica con i gruppi funzionali negativi presenti nella barriera e successiva internalizzazione per endocitosi transcellulare da adsorbimento [Bradbury et al., 2000]. I profarmaci vengono ottenuti accoppiando un farmaco con uno spezzone vettoriale sito-specifico in modo da ottenere un sistema privo di attività intrinseca, ma, che in seguito a una bio-reazione, rigenera in vivo l’agente farmacologicamente attivo. Questo viene reso possibile dalla presenza di specifici enzimi sull’endotelio cerebrale. Un farmaco può venire coniugato con sostanze che passano normalmente la BEE e venire internalizzato con queste: si ottiene la strategia conosciuta come trasporto mediato da vettori. Tra le sostanze vettoriali che provengono dalla natura e capaci di varcare la BEE vi sono le neurotossine. Queste