R
ISULTATI
C
C
Ca
a
a
r
r
r
a
a
a
t
tt
t
t
te
e
er
r
r
i
i
i
s
st
s
t
t
i
ic
i
c
c
h
he
h
e
e
d
de
d
e
e
i
i
i
s
s
s
o
o
o
g
g
g
g
g
g
e
et
e
t
tt
t
ti
i
i
s
s
st
t
tu
u
ud
d
d
i
ia
i
a
a
t
t
t
i
i
i
Lo studio è stato realizzato in 730 pazienti con diabete tipo 2 ed in 160 soggetti sani di controllo. Le principali caratteristiche cliniche dei soggetti studiati sono illustrate in tabella 8. Anche dopo opportuna correzione per le differenze nell'età, i diabetici tipo 2 presentavano maggior BMI (28.7±5.3 vs 24.3±4.2 kg/m2) e più elevati valori di pressione arteriosa sistolica e diastolica (148/83±20/11 vs 124±13/10 mmHg).
Tabella 8 - Caratteristiche cliniche delle popolazioni in studio.
CONTROLLI DIABETICI TIPO 2
Sesso, M/F% 55/45 63/37
Età, anni 47±8 61±8
Età di insorgenza/diagnosi del diabete, anni - 47.9±11.5
Durata di malattia, anni - 13.0±10.2
BMI, kg/m2
24.3±4.2 28.7±5.3
HbA1c,% 4.1-6.1 8.7±1.8
Pressione arteriosa sistolica, mmHg 124±12.8 148.4±20.3
Pressione arteriosa diastolica, mmHg 79.7±9.8 83.1±10.6
Distribuzione delle complicanze
Nella coorte di diabetici tipo 2 la distribuzione delle complicanze microangiopatiche e macrovascolari era la seguente: presentava microalbuminuria il 34% dei pazienti, macroalbuminuria il 21%; retinopatia background era presente nel 38% dei casi, retinopatia proliferante nel 18%; aveva ipertensione l’80% dei soggetti studiati, patologia coronarica il 26%.
Complicanze e fattori di rischio tradizionali
Durata del diabete
Nefropatia e durata del diabete
L'età è risultata lievemente ma significativamente maggiore nei microalbuminurici (62±8 anni) e nei macroalbuminurici (63±8 anni) rispetto ai soggetti con normale escrezione urinaria di albumina (60±8 anni; p=0.004).
La durata del diabete, corretta per l'età, è maggiore nei macroalbuminurici (16±11 anni) rispetto ai microalbuminurici (13±9 anni, p<0.02) e sia nei macro- che nei microalbuminurici rispetto ai normoalbuminurici (11±9 anni, p<0.0001 e p<0.05 rispettivamente). L’associazione tra durata del diabete e nefropatia è simile nei maschi (p=0.002) e nelle femmine (p=0.04).
Retinopatia e durata del diabete
La durata del diabete aumenta dai non retinopatici (9±9 anni) ai soggetti con retinopatia non proliferante (14±9 anni, p<0.0001) a quelli con retinopatia proliferante (21±10 anni, p<0.0001), mentre nessuna differenza può essere rilevata tra i tre gruppi per quanto riguarda l’età (61±8, 60±9, 62±7 anni, rispettivamente). L'associazione tra durata del diabete e retinopatia è simile nei maschi e nelle femmine (p<0.0001, per entrambi).
Ipertensione e durata del diabete
L'età (58±9 vs 62±8 anni, p<0.0001), ma non la durata del diabete (12±11 vs 13±10 anni, p=0.27), è risultata maggiore negli ipertesi rispetto ai normotesi.
Patologia cardiovascolare e durata del diabete
Sia l’età (64±7 vs 60±9 anni, p<0.0001) che la durata del diabete (15±10 vs 12±10 anni, p<0.0015) sono maggiori nei soggetti con cardiopatia ischemica rispetto ai non coronaropatici; la differenza tra i due gruppi nella durata del diabete rimane significativa anche dopo correzione per l’età.
Dati antropometrici: il BMI
Nefropatia e BMI
Nessuna forte associazione è stata osservata tra grado di nefropatia e BMI (p=0.045); solo i diabetici tipo 2 con nefropatia conclamata presentano BMI sensibilmente più elevato dei normoalbuminurici (30±5 vs 28±5 Kg/m2
, p=0.023). Tra le femmine, il BMI è risultato simile nei tre gruppi; tra i maschi, sia i micro- (28.8±4.8 kg/m2
) che i macroalbuminurici (29.2±5.0 kg/m2 ) presentano BMI superiore a quello dei normoalbuminurici (27.1±4.0 kg/m2
; p=0.0037).
Retinopatia e BMI
Nessuna differenza nel BMI è rilevata tra soggetti con retinopatia proliferante e background rispetto ai diabetici senza segni di retinopatia. Nessuna differenza emerge dopo suddivisione per sesso.
Ipertensione e BMI
Il BMI risulta più alto negli ipertesi rispetto ai non ipertesi: 29±5 vs 27±5 Kg/m2, p<0.0001). Tale differenza è più evidente nelle femmine (30.5±6.2 vs 26.8±4.7 Kg/m2
, p=0.005) che nei maschi (28.1±4.4 vs 26.1±4.0 Kg/m2
, p=0.02).
Cardiopatia ischemica e BMI
Nessuna differenza nel BMI è stata osservata tra coronaropatici e non coronaropatici, anche dopo stratificazione per sesso.
Ipertensione arteriosa
Nefropatia ed ipertensione arteriosa
La pressione sistolica aumenta progressivamente dalla normo- (144±19 mmHg) alla micro-(150±19 mmHg) e alla macroalbuminuria (158±22 mmHg, p<0.0001); la pressione diastolica è più alta nei macroalbuminurici (86±13 mmHg) rispetto ai normoalbuminurici (82±10 mmHg, p<0.005), mentre nessuna differenza emerge tra normoalbuminurici e microalbuminurici (83±9 mmHg). La prevalenza di ipertensione arteriosa definita come pressione ≥ 140 e/o ≥ 90 mmHg e/o l'essere in trattamento con farmaci anti-ipertensivi aumenta dalla normo- (71%) alla micro-(83%) alla macroalbuminuria (96%; p<0.0001).
Retinopatia ed ipertensione arteriosa
Solo i valori della pressione sistolica tendono ad aumentare nei soggetti con retinopatia background (150±21 mmHg) o proliferante (154±23 mmHg) rispetto ai soggetti senza segni di retinopatia (145±18 mmHg, p<0.005). La prevalenza di ipertensione è del 75% tra i soggetti senza retinopatia ed aumenta all'82% e all'88% rispettivamente nei diabetici con retinopatia background e con retinopatia proliferante (p=0.026).
Cardiopatia ischemica ed ipertensione arteriosa
La pressione sistolica e diastolica non differiscono tra coronaropatici e non coronaropatici, mentre la prevalenza di ipertensione è sia pur modestamente più elevata tra i soggetti con patologia coronarica (76% nei soggetti senza patologia coronarica vs 86%, p=0.044).
Controllo glicemico
Nefropatia ed HbA1c
I valori di emoglobina glicata (HbA1c) sono più elevati nei microalbuminurici (8.9±2.1%, p=0.045) e solo marginalmente nei macroalbuminurici (8.8±1.8%, p=0.097) rispetto ai soggetti con normale escrezione urinaria dell'albumina (8.5±1.6%).
Retinopatia ed HbA1c
Nessuna differenza (Anova one way) nei valori di HbA1c è stata osservata tra diabetici tipo 2 con retinopatia background (8.7±1.8%), con retinopatia proliferante (9.0±1.8%) e tra soggetti senza retinopatia (8.5±2.0%; p=0.13). Solo tra soggetti con retinopatia proliferante e diabetici senza retinopatia emergeva una differenza sia pur debolmente significativa (p=0.049) nei valori della HbA1c.
Ipertensione, coronaropatia ed HbA1c
Nessuna differenza nei valori di HbA1c è stata osservata tra normotesi (8.7±1.9%) ed ipertesi (8.7±1.9%) così come tra coronaropatici (8.6±2.0%) e non coronaropatici (8.8±1.6%).
P
P
Po
o
o
l
l
l
i
im
i
m
m
o
o
o
r
r
r
f
fi
f
i
is
s
sm
m
m
o
o
o
ε
ε
ε
2
2
2
/
/
/
ε
ε
ε
3
3
3
/
/
/
ε
ε
ε
4
4
4
d
de
d
e
e
l
ll
l
l
l'
'
'A
A
A
p
po
p
o
o
E
E e
E
e
e
cc
c
o
o
o
m
m
m
p
pl
p
l
li
i
ic
c
ca
a
a
n
n
n
z
z
z
e
e
e
d
de
d
e
e
l
l
l
d
d
di
i
i
a
a
a
b
be
b
e
e
t
te
t
e
e
t
t
ti
i
ip
p
po
o
o
2
2
2
L'analisi del polimorfismo ε2, ε3, ε4 dell' ApoE è stata effettuata su 730 pazienti con diabete tipo 2 e sui 160 soggetti sani di controllo.
La frequenza degli alleli ε2, ε3, ε4 è stata 0.068, 0.876, 0.056 nei diabetici tipo 2 e 0.014, 0.914, 0.071 nei soggetti di controllo.
La distribuzione del polimorfismo triallelico dell’ApoE, valutata sia nella popolazione con diabete tipo 2 sia nei soggetti di controllo, è illustrata in tabella 8. In entrambe le coorti la distribuzione dei genotipi rispetta l’equilibrio di Hardy-Weinberg (popolazione di controllo: χ2=2.7, p=0.75; diabetici tipo 2: χ2=2.1, p=0.83).
Tabella 8: Distribuzione genotipica nella popolazione di controllo e nella popolazione con diabete tipo 2. 2/2 % 2/3 % 3/3 % 2/4 % 3/4 % 4/4 % CONTROLLI 0 2.8 82.9 0 14.3 0 DIABETE TIPO 2 0.5 11.9 76.8 0.8 9.7 0.3
Non si osserva nessuna differenza statisticamente significativa nella distribuzione dei genotipi ε2ε2 - ε2ε3 - ε3ε3 - ε2ε4 - ε3ε4 - ε4ε4 nei controlli (0 - 2.8 – 82.9 - 0 - 14.3 - 0%) rispetto ai pazienti con diabete tipo 2 (0.5 - 11.9 – 76.8 – 0.8 - 9.7 - 0.3%). E' tuttavia necessario notare come il genotipo ε2ε3 sia relativamente più frequente nei diabetici (11.9%) rispetto ai non diabetici (2.8%; X2
=6.9, p=0.008). Nessuna differenza nella distribuzione dei genotipi emerge tra maschi e femmine (X2
=2.97, p=0.70). La distribuzione dei genotipi non è influenzata dall’età inquanto sovrapponibile nei diabetici con età inferiore o pari a 50 anni (11% dell’intera coorte), nei soggetti con età di 51-60 anni (27%), in quelli con età di 61-70 anni (45%) e negli ultrasettantenni (17%; X2
=14.3, p=0.49). Analogamente, nessuna differenza nella distribuzione dei genotipi poteva essere rilevata stratificando la popolazione in funzione della durata del diabete (<5 anni, 22% dell’intera coorte; 6-10 anni, 22%; 11-15 anni, 18%; 16-20 anni, 12% e ≤21 anni, 26%; X2
Data la prevalenza estremamente bassa di alcuni genotipi (ε2ε2, ε2ε4 ed ε4ε4) per descrivere le caratteristiche generali in funzione del genotipo i soggetti studiati sono stati suddivisi in portatori di ε3 (ε3ε3; n. 508, 77%), portatori di ε2 (ε2ε2 + ε2ε3; n. 116, 12%) e portatori di ε4 (ε2ε4 + ε3ε4 + ε4ε4; n. 106, 11%) (figura 26).
Figura 26 – Distribuzione dei genotipi di ApoE in ε3 carriers, ε2 carriers e ε4 carriers.
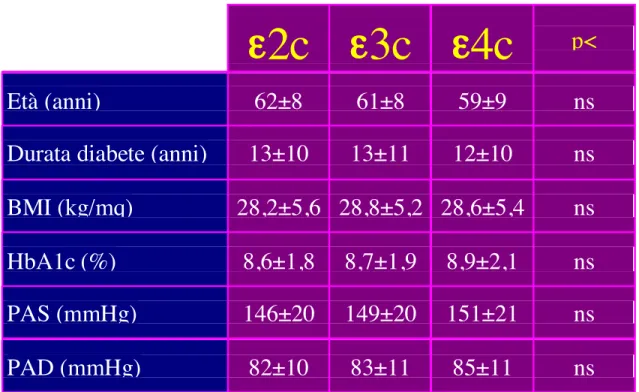
I tre gruppi non differivano per età, durata del diabete, BMI, HbA1c, pressione sistolica e diastolica (tabella 9). Dopo stratificazione per sesso, tra i maschi, i portatori ε4 presentavano valori marginalmente più elevati di pressione sistolica (155±19 mmHg) rispetto ai portatori di ε2 (144±18 mmHg) e agli omozigoti per ε3 (149±20 mmHg, p=0.09), mentre tra le femmine, i portatori di ε4 erano sensibilmente più giovani (56±10 anni di età) rispetto ai portatori di ε2 (63±6 anni) e agli omozigoti per ε3 (60±8 anni, p<0.01).
2/2
2/3
3/3
2/4
3/4
4/4
Diabetici tipo 2 (%)
0.5
11.9
76.8
0.8
9,7
0.3
ε
3c, n. 466
ε
2c, n. 74
ε
4c, n. 65
508 116 106Tabella 9 – Caratteristiche cliniche dei diabetici tipo 2 studiati suddivisi in ε3 carriers, ε2 carriers e ε4 carriers.
•
NefropatiaLa distribuzione dei genotipi dell'ApoE è risultata sovrapponibile tra soggetti con normoalbuminuria (0.4 - 12.9 - 76.0 – 0.9 - 10.9 - 0.4%), microalbuminuria (0.6 - 12.0 - 75.5 – 1.1 - 10.9 - 0%) e macroalbuminuria (0 - 15.2 - 75.9 – 0.9 - 8.0 - 0%, X2
=3.05, p=0.98) (figura 27). I risultati rimangono immodificati anche dopo aver escluso tra i soggetti con normoalbuminuria quelli con durata del diabete inferiore a 15 anni, cioè quei soggetti che avendo breve durata del diabete sono ancora potenzialmente a rischio pieno di sviluppare la nefropatia. Risultati simili si osservavano tra i maschi (p=0.31) e tra le femmine (p=0.63).
Analoghi risultati si ottengono studiando la distribuzione dei carriers di ε2, ε3 e ε4 (X2 =1.12, p=0.89). E’ interessante tuttavia osservare che i soggetti con elevati valori di escrezione urinaria di albumina (micro + macroalbuminurici) portatori dell’allele ε4 presentano durata del diabete (corretta per età) significativamente più breve dei non portatori dell’allele ε4 (11.1±8.7 vs 14.6±10.2 anni, p=0.07) e soprattutto dei portatori di ε2 (15.8±9.4 anni, p=0.05), quasi a suggerire un ruolo di ε4 nell’esporre alla comparsa di nefropatia nonostante una più breve durata del diabete.
ε2c ε3c ε4c
p<
Età (anni)
62±8
61±8
59±9
ns
Durata diabete (anni)
13±10
13±11
12±10
ns
BMI (kg/mq)
28,2±5,6 28,8±5,2 28,6±5,4
ns
HbA1c (%)
8,6±1,8
8,7±1,9
8,9±2,1
ns
PAS (mmHg)
146±20
149±20
151±21
ns
Figura 27 - Polimorfismo dell’ApoE e complicanze microvascolari nel diabete tipo 2: nefropatia.
Nessuna altra variabile tra cui BMI, emoglobina glicata, pressione sistolica e diastolica differiva in funzione del genotipo sia tra i soggetti con nefropatia conclamata che tra tutti coloro che presentavano aumentati valori dell’escrezione urinaria dell’albumina. Nessuna differenza nella distribuzione dei genotipi (o dei portatori degli alleli ε2, ε3 e ε4) emerge tra soggetti con normale escrezione urinaria di albumina, microalbuminurici e diabetici con nefropatia conclamata anche dopo stratificazione in funzione della mediana dei valori di HbA1c (8.4%).
•
RetinopatiaNessuna associazione è stata rilevata tra il polimorfismo dell’ApoE e presenza e/o severità della retinopatia (χ2
=13.154, p=0.21) (figura 28). I pazienti senza retinopatia non differivano nella distribuzione genotipica (0 -10.9 - 79.6 – 1.4 - 7.7 - 0.5%) né dai pazienti con retinopatia background (1.1 - 13.9 - 70.6 – 1.1 - 13.3 - 0%) né da quelli con retinopatia proliferante (0 - 16.3 - 77.2 – 0 - 6.5 - 0%). Nessuna differenza emergeva dopo stratificazione per sesso.
Figura 28 - Polimorfismo dell’ApoE e complicanze microvascolari nel diabete tipo 2: retinopatia
Analoghi risultati si ottengono analizzando in funzione della retinopatia la distribuzione dei carriers di ε2, ε3 e ε4 (χ2
=7.06, p=0.13). I soggetti con retinopatia (background o proliferante) portatori dell’allele ε4 presentano durata del diabete (corretta per età) più breve dei non portatori dell’allele ε4 (13.7±8.6 vs 16.9±10.2 anni, p=0.08). Nessuna altra variabile tra BMI, HbA1c, pressione sistolica e diastolica differiva in funzione del genotipo sia tra i soggetti con retinopatia proliferante che tra tutti coloro che presentavano segni riferibili a retinopatia diabetica. Nessuna differenza nella distribuzione dei genotipi (o dei portatori di ε2, ε3 e ε4) emerge tra i soggetti non retinopatici, quelli con retinopatia background e quelli con retinopatia proliferante anche dopo stratificazione per la mediana (8.4%) dell’HbA1c.
•
Ipertensione e malattia coronaricaNessuna associazione emerge tra genotipo dell’ApoE ed ipertensione (χ2
=8.009, p=0.16). Nei soggetti normotesi la distribuzione genotipica (1.0 - 19.0 - 71.4 - 1.9 - 6.7 - 0 %) era sovrapponibile a quella osservata nei soggetti ipertesi (0.3 - 11.2 - 76.4 - 0.7 - 10.6 - 0.5 %, p=0.16) (figura 29) e nessuna differenza veniva rilevata quando l’analisi era ripetuta separatamente per maschi e femmine.
Figura 29 - Polimorfismo dell’ApoE e ipertensione nel diabete tipo 2.
Solo marginalmente significativa la differenza nella distribuzione dei portatori di ε2, ε3 ed ε4 tra normotesi ed ipertesi (χ2
=5.58, p=0.061) con un eccesso di portatori di ε2 tra i normotesi (20% vs 11.6%) e di portatori di ε4 tra gli ipertesi di sesso maschile (10.9% vs 3.3%, χ2
Infine, nessuna associazione è stata rilevata tra polimorfismo dell’ApoE e malattia cardiovascolare (χ2
=2.063, p=0.84). In presenza di malattia cardiovascolare la distribuzione genotipica (0 - 14.6 - 74.6 - 1.5 - 9.2 - 0 %) è sovrapponibile a quella osservata in pazienti senza malattia cardiovascolare (0.5 - 13.3 - 75.6 - 0.8 - 9.3 - 0.5%) (figura 30). Anche per la patologia cardiovascolare, nessuna differenza emergeva dopo suddivisione in maschi (p=0.56) e femmine (p=0.62). Nessuna differenza emerge nella distribuzione dei portatori di ε2, ε3 ed ε4 (p=0.99).
P
P
P
o
o
o
l
l
l
i
i
i
m
m
m
o
o
o
r
r
r
f
f
f
i
i
i
s
s
s
m
m
m
o
o
o
d
d
d
e
e
e
l
l
l
l
l
l
'
'
'
A
A
A
p
p
p
o
o
o
E
E
E
e
e
e
a
a
a
l
l
l
t
t
t
r
r
r
i
i
i
f
f
f
a
a
a
t
t
t
t
t
t
o
o
o
r
r
r
i
i
i
d
d
d
i
i
i
r
r
r
i
i
i
s
s
s
c
c
c
h
h
h
i
i
i
o
o
o
p
p
p
e
e
e
r
r
r
l
l
l
e
e
e
c
c
c
o
o
o
m
m
m
p
p
p
l
l
l
i
i
i
c
c
c
a
a
a
n
n
n
z
z
z
e
e
e
d
d
d
e
e
e
l
l
l
d
d
di
i
i
a
a
a
b
be
b
e
e
t
t
t
e
e:
e
:
:
a
a
a
n
n
n
a
a
a
l
li
l
i
i
s
si
s
i
i
m
m
m
u
ul
u
l
lt
t
ti
i
iv
v
v
a
a
a
r
ri
r
i
ia
a
a
t
ta
t
a
a
Il significato del polimorfismo del gene della ApoE è stato ulteriormente valutato in una analisi di regressione logistica in cui variabili indipendenti, oltre al genotipo ApoE (modello 1) o, in alternativa l’essere portatore di ε2, ε3 ed ε4 (modello 2), erano il sesso, l’età e la durata del diabete, il BMI, la pressione sistolica e diastolica e l’HbA1c (tabella 9).
Tabella 9 – Fattori associati alle complicanze del diabete: analisi di regressione logistica. NEFROPATIA p = RETINOPATIA p = CHD p = IPERTENSIONE M/F 0.01 0.66 0.41 0.17 Età 0.69 0.003 0.003 < 0.0001
Durata del diabete 0.03 < 0.0001 0.04 0.64
BMI 0.09 0.18 0.41 0.0002
PAS < 0.0001 0.0008 0.99 _
PAD 0.70 0.32 0.32 _
HbA1c 0.01 0.01 0.13 0.98
ApoE 0.54 0.49 0.58 0.08
In nessuno dei due modelli il polimorfismo dell’ApoE emerge quale correlato indipendente di complicanze del diabete quali la nefropatia, la retinopatia e la cardiopatia ischemica. Inoltre, né il genotipo ε2/ε3 (p=0.08) relativamente più rappresentato tra i soggetti normotesi (19% vs 11.9%), nè l’essere portatore dell’allele ε2 (p=0.06), emergono in maniera statisticamente significativa come correlati indipendenti dell’ipertensione arteriosa (rispettivamente modello 1 e modello 2). Pressione sistolica, controllo glicemico (HbA1c), sesso maschile, durata del diabete e, seppur marginalmente, il BMI, rappresentano fattori di rischio indipendenti per la nefropatia diabetica.
L’inserimento della retinopatia quale variabile indipendente nel modello di regressione logistica (p<0.0001), annulla il significato della durata del diabete quale fattore di rischio indipendente (p=0.46), impoverisce quello dell’HbA1c (p=0.078), mentre non altera il ruolo del sesso maschile (p= 0.01) e della pressione sistolica (p=0.0004). Età, durata del diabete, pressione sistolica ed HbA1c sono fattori indipendentemente associati con la retinopatia diabetica. Cardiopatia ischemica ed ipertensione correlano con l’età e, rispettivamente con la durata del diabete e il BMI (tabella 9). L’inserimento della nefropatia quale variabile indipendente nell’analisi di regressione logistica che vede l’ipertensione quale variabile dipendente, mette in evidenza il ruolo dell’allele ε2 quale fattore associato in maniera indipendente all’assenza di ipertensione arteriosa (p=0.025; modello 2).
P
P
Po
o
o
l
li
l
i
im
m
m
o
o
o
r
r
r
f
fi
f
i
i
s
s
s
m
m
m
o
o
o
d
de
d
e
e
l
l
l
l
l'
l
'
'A
A
Ap
p
po
o
o
E
E
E
e
e
e
p
p
p
r
r
r
o
o
o
f
fi
f
i
il
l
lo
o
o
l
l
li
i
ip
p
pi
i
id
d
di
i
i
c
c
c
o
o
o
La bassa prevalenza di alcuni genotipi dell’ApoE ci ha indotto, come già detto, a raggruppare i soggetti con diabete tipo 2 come segue:
•
ε3 omozigote: 76.8%•
ε2 carriers (ε2/ε2+ε2/ε3): 12.4%•
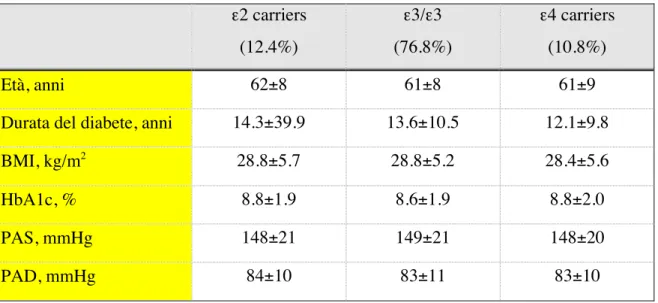
ε4 carriers (ε2/ε4+ε3/ε4+ε4/ε4): 10.8%Come già descritto, i tre gruppi così individuati non differivano per età, durata del diabete, BMI ed HbA1c. Nessuna differenza emergeva nei livelli della pressione arteriosa sistolica e diastolica (tabella 10).
Tabella 10 - Caratteristiche cliniche dei soggetti con diabete tipo 2 stratificati in omozigote ε3, ε2 carriers e ε4 carriers. ε2 carriers (12.4%) ε3/ε3 (76.8%) ε4 carriers (10.8%) Età, anni 62±8 61±8 61±9
Durata del diabete, anni 14.3±39.9 13.6±10.5 12.1±9.8
BMI, kg/m2 28.8±5.7 28.8±5.2 28.4±5.6
HbA1c, % 8.8±1.9 8.6±1.9 8.8±2.0
PAS, mmHg 148±21 149±21 148±20
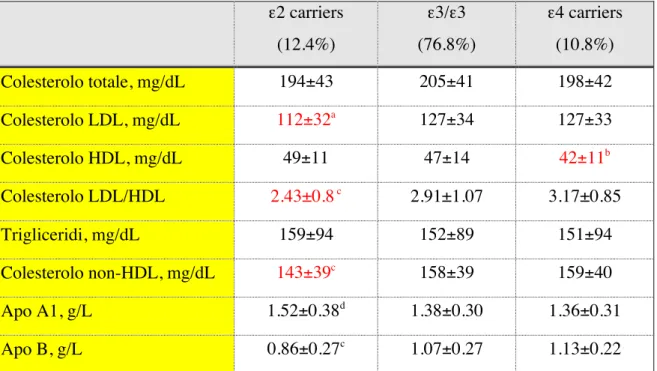
Il profilo lipidico in funzione del genotipo è riportato in tabella 11.
Tabella 11 - Profilo lipidico dei soggetti con diabete tipo 2 stratificati in omozigoti ε3, ε2 carriers e ε4 carriers.
ε2 carriers (12.4%) ε3/ε3 (76.8%) ε4 carriers (10.8%) Colesterolo totale, mg/dL 194±43 205±41 198±42 Colesterolo LDL, mg/dL 112±32a 127±34 127±33 Colesterolo HDL, mg/dL 49±11 47±14 42±11b Colesterolo LDL/HDL 2.43±0.8 c 2.91±1.07 3.17±0.85 Trigliceridi, mg/dL 159±94 152±89 151±94 Colesterolo non-HDL, mg/dL 143±39c 158±39 159±40 Apo A1, g/L 1.52±0.38d 1.38±0.30 1.36±0.31 Apo B, g/L 0.86±0.27c 1.07±0.27 1.13±0.22 a= p<0.001 vs ε3/ε3 e p=0.02 vs ε4 carriers b= p<0.02 vs ε2 carriers e p<0.05 vs ε3/ε3 c= p<0.001 vs ε3/ε3 e ε4 carriers d=p<0.05 vs ε3/ε3 e ε4 carriers
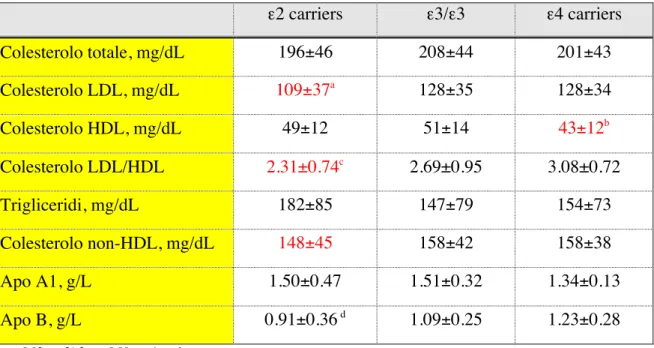
I soggetti portatori dell'allele ε2 (ε2 carriers) presentano il profilo lipidico più favorevole (più bassi livelli di colesterolo LDL e di colesterolo non-HDL associati a più elevati livelli di colesterolo HDL), mentre i portatori dell'allele ε4 (ε4 carriers) presentano il profilo lipidico più sfavorevole (più elevati livelli di colesterolo LDL e non-HDL e più bassi livelli di colesterolo HDL). Il rapporto colesterolo LDL/HDL è più basso nei portatori di ε2, più alto nei portatori di ε4 ed intermedio negli omozigoti ε3. ApoB è più bassa ed ApoA1 più elevata nei portatori di ε2. Nessuna differenza veniva osservata nei livelli dei trigliceridi (tabella 11). Maschi e femmine differivano per BMI (maggiore nelle femmine, p=0.0017), HbA1c (M 8.3±1.8 vs F 9.2±1.9%, p<0.0001) e colesterolo HDL (>F, p<0.0001), ma non per età, durata del diabete, pressione arteriosa, colesterolo totale, colesterolo LDL e trigliceridi. Le differenze genotipo correlate per colesterolo LDL e colesterolo HDL permanevano dopo stratificazione per sesso, ed erano altrettanto evidenti nelle femmine (tabella 12) rispetto ai maschi (tabella 13).
Tabella 12 - Profilo lipidico dei soggetti con diabete tipo 2 di sesso femminile stratificati in omozigoti ε3, ε2 carriers e ε4 carriers. ε2 carriers ε3/ε3 ε4 carriers Colesterolo totale, mg/dL 196±46 208±44 201±43 Colesterolo LDL, mg/dL 109±37a 128±35 128±34 Colesterolo HDL, mg/dL 49±12 51±14 43±12b Colesterolo LDL/HDL 2.31±0.74c 2.69±0.95 3.08±0.72 Trigliceridi, mg/dL 182±85 147±79 154±73 Colesterolo non-HDL, mg/dL 148±45 158±42 158±38 Apo A1, g/L 1.50±0.47 1.51±0.32 1.34±0.13 Apo B, g/L 0.91±0.36 d 1.09±0.25 1.23±0.28 a= p<0.02 vs ε3/ε3 e p=0.09 vs ε4 carriers b= p<0.05 vs ε3/ε3 c= p<0.01 vs ε4 carriers e p<0.05 vs ε3/ε3 d=p<0.05 vs ε3/ε3 e ε4 carriers
Tabella 13 - Profilo lipidico dei soggetti con diabete tipo 2 di sesso maschile stratificati in omozigoti ε3, ε2 carriers e ε4 carriers. ε2 carriers ε3/ε3 ε4 carriers Colesterolo totale, mg/dL 190±40 202±41 202±44 Colesterolo LDL, mg/dL 113±28a 127±34 129±34 Colesterolo HDL, mg/dL 47±12 44±12 41±8b Colesterolo LDL/HDL 2.52±0.85 c 3.04±1.11 3.24±0.95 Trigliceridi, mg/dL 143±102 154±89 160±100 Colesterolo non-HDL, mg/dL 143±39d 158±38 159±42 Apo A1, g/L 1.65±0.38c 1.35±0.21 1.34±0.19 Apo B, g/L 0.80±0.16c 1.13±0.32 1.20±0.27 a= p<0.02 vs ε3/ε3 e p=0.05 vs ε4 carriers b= p<0.05 vs ε2 carriers c= p<0.01 vs ε3/ε3 e ε4 carriers d=p<0.05 vs ε3/ε3
D’altra parte, soltanto nei soggetti di sesso maschile le concentrazioni di apoA1 erano più elevate e quelle di apoB più basse nei portatori dell’allele ε2 rispetto agli omozigoti ε3 ed ai portatori di ε4. La concentrazione plasmatica delle LDLox aumenta progressivamente dai portatori ε2 (46±22 U/l) agli omozigoti ε3 (55±25 U/l) e ai portatori di ε4 (60±27 U/l, p=0.006) (figura 31).
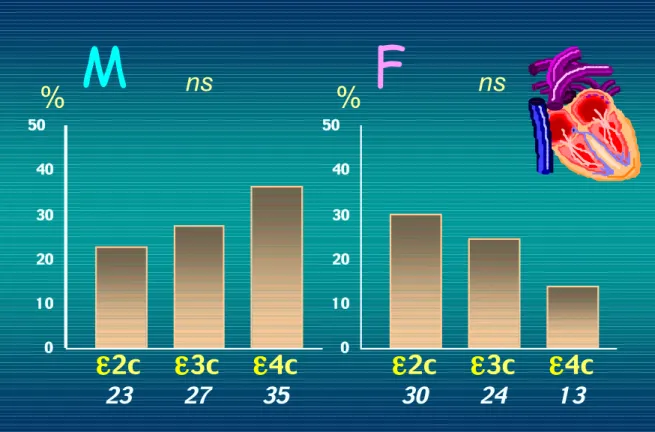
Figura 31 – Livelli di LDL ossidate e polimorfismo di ApoE.
Tali differenze pur presenti anche nei soggetti di sesso maschile, sono particolarmente evidenti nelle femmine (ε2c: 44±20; ε3/ε3: 56±25 U/l e ε4c: 69±25 U/l, p=0.004) (figura 32). La prevalenza di cardiopatia ischemica è risultata simile in ε2c (25.7%), ε3/ε3 (25.6%) e ε4c (25.9%) con tendenza ad andamento opposto nei maschi (23%, 27% e 35% in ε2c, ε3/εe e ε4c rispettivamente) e nelle femmine (30%, 24% e 13% in ε2c, ε3/ε3 e ε4c rispettivamente) (figura 33). 0 20 40 60 80 100
ε
2c
46±22
ε
3c
55±25
ε
4c
60±27
U/L
ANOVA oneway, p=0.006
Figura 32 – Livelli di LDL ossidate e polimorfismo di ApoE nei maschi e nelle femmine.
Figura 33 – Prevalenza di cardiopatia ischemica e polimorfismo di ApoE nei maschi e nelle femmine.
0 20 40 60 80 100 0 20 40 60 80 100
ε
2c
48±23
55±24
ε
3c
54±26
ε
4c
U/L
ε
2c
44±20
56±25
ε
3c
69±25
ε
4c
U/L
p=0.10
p=0.003
M
F
0 10 20 30 40 50 0 10 20 30 40 50ε
2c
23
ε
27
3c
ε
35
4c
%
ε
2c
30
ε
24
3c
ε
13
4c
%
ns
ns
M
F
L
L
L
D
D
D
L
L
L
o
o
o
s
s
s
s
s
s
i
i
i
d
d
d
a
a
a
t
t
t
e
e
e
e
e
e
p
p
p
r
r
r
o
o
o
f
f
f
i
i
i
l
l
l
o
o
o
l
l
l
i
i
i
p
p
p
i
i
i
d
d
d
i
i
i
c
c
c
o
o
o
n
n
n
e
e
e
l
l
l
d
d
d
i
i
i
a
a
a
b
b
b
e
e
e
t
t
t
e
e
e
t
t
t
i
i
i
p
p
p
o
o
o
2
2
2
C
CCaaarrraaatttttteeerrriiissstttiiiccchhheeecccllliiinnniiiccchhheeedddeeeiiisssoooggggggeeettttttiiissstttuuudddiiiaaatttiii
L’analisi del profilo lipidico e la determinazione della concentrazione delle LDL ossidate è stata effettuata su 500 dei 730 pazienti con diabete tipo 2 reclutati nello studio e sui 160 soggetti sani di controllo. Le caratteristiche cliniche dei diabetici tipo 2 e dei controlli sono simili a quelle dell’intera coorte reclutata e sono già state descritte in tabella 8. In tabella 19 sono invece riportati per i diabetici tipo 2 e per i soggetti di controllo i valori medi dei parametri lipidici. Dal confronto tra diabetici tipo 2 e soggetti di controllo emergono le differenze attese: i diabetici presentano più elevati livelli dei trigliceridi, più basse concentrazioni di colesterolo HDL e più elevato rapporto LDL/HDL. Colesterolo totale e LDL sono simili nei due gruppi.
Tabella 19 – Profilo lipidico delle popolazioni in studio.
CONTROLLI DIABETICI TIPO 2
N. 160 500 Colesterolo totale, mg/dl 217±41 212±42 Colesterolo LDL, mg/dl 144±38 135±35 Colesterolo HDL, mg/dl 57±15 46±13* Colesterolo non-HDL, mg/dl 160±45 166±40 Rapporto LDL/HDL 2.52±0.96 2.87±1.03* Trigliceridi, mg/dl 119±74 153±87* * unpaired t-test, p<0.005
La concentrazione plasmatica delle LDL ossidate (figura 34) è risultata pari a 49.0±11.1 U/L (media±ds) nei soggetti di controllo e sensibilmente più elevata nei soggetti con diabete tipo 2, (55.6±25.3 U/L), ma tale differenza non risulta statisticamente significativa (p=0.156). Tra i soggetti con diabete tipo 2, colesterolo totale, colesterolo LDL e trigliceridi non differivano tra maschi e femmine, mentre i livelli del colesterolo HDL erano significativamente più elevati nelle femmine rispetto ai maschi ( 49.4±13.9 vs 44.2±12.1, p< 0.0001).
Figura 34 - Livelli plasmatici delle LDLox nei soggetti di controllo e nei diabetici tipo 2 (box plot). Ciascun box mostra la mediana e il 25° e 75° percentile della concentrazione delle LDL ossidate. I punti contraddistinguono singolarmente i valori esterni al 10°-90° percentile a loro volta individuati dalle barre trasversali.
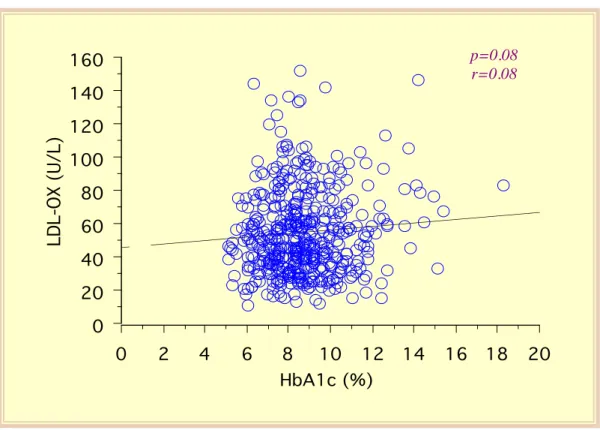
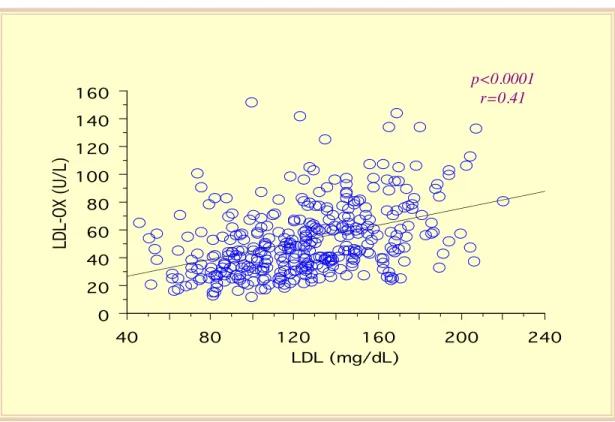
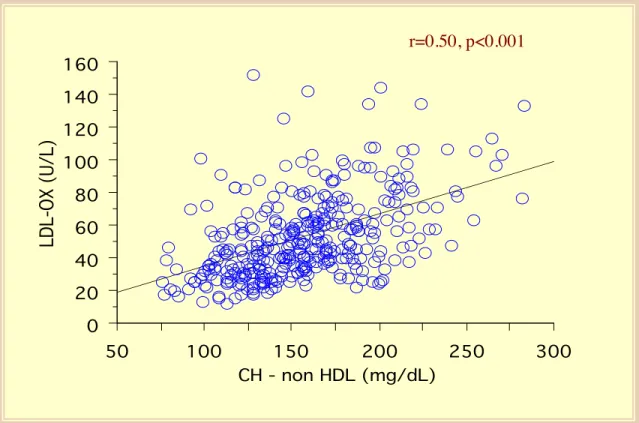
Nessuna differenza tra i due sessi è stata osservata nei livelli delle LDL ossidate (M: 54±24 U/L, vs F: 57±26 U/L, p=0.24). I livelli delle LDL ossidate non sono influenzati dall’età (r=0.069, p=0.13) né dalla durata del diabete (r=0.021, p=0.64). La concentrazione delle LDL ossidate non correla significativamente con l’emoglobina glicata (r=0.08, p=0.08; figura 35) o con la glicemia a digiuno (r=0.093, p=0.07), né con i livelli della pressione arteriosa sistolica (r=0.034, p=0.48) o diastolica (r=0.081, p=0.09), mentre una correlazione debole, ma significativa, emerge con il BMI (r=0.14, p=0.004; figura 36). La concentrazione delle LDL ossidate è risultata correlata, in maniera statisticamente significativa, con i livelli di colesterolo totale (r=0.43, p<0.0001, figura 37) e con quelli del colesterolo LDL (r=0.41, p=0.0001; figura 38), ma solo debolmente in maniera inversa con la concentrazione del colesterolo HDL (r=-0.107, p=0.04; figura 39). Una regressione lineare significativa esiste tra la concentrazione delle LDL ossidate e i livelli dei trigliceridi (r=0.30, p=0.0001; figura 40). Infine, una stretta regressione lineare può essere descritta tra LDL ossidate e colesterolo non-HDL (r=0.50, p<0.001) (figura 41).
0 20 40 60 80 100 120 140 160 LDL-OX 0 1 CTR Tipo 2 (U/L)
Figura 35 - Regressione lineare tra concentrazione plasmatica delle LDL ossidate e HbA1c.
Figura 36 - Regressione lineare tra concentrazione plasmatica delle LDL ossidate e BMI.
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 0 2 4 6 8 10 12 14 16 18 20 HbA1c (%) p=0.08 r=0.08 0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 15 20 25 30 35 40 45 50 BMI (kg/m2) p=0.004 r=0.14
Figura 37 - Regressione lineare tra concentrazione plasmatica delle LDL ossidate e colesterolo totale.
Figura 38 - Regressione lineare tra concentrazione plasmatica delle LDL ossidate e colesterolo LDL. 0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 100 150 200 250 300 350 CH-TOT (mg/dL) p<0.0001 r=0.43 0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 40 80 120 160 200 240 LDL (mg/dL) p<0.0001 r=0.41
Figura 39 - Regressione lineare tra concentrazione plasmatica delle LDL ossidate e colesterolo HDL.
Figura 40 - Regressione lineare tra concentrazione plasmatica delle LDL ossidate e trigliceridi.
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) -100 0 100 200 300 400 500 600 700 TG (mg/dL) p<0.0001 r=0.30 0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 0 20 40 60 80 100 120 HDL (mg/dL) p=0.044 r=-0.107
Figura 41: Regressione lineare tra concentrazione plasmatica delle LDL ossidate e CH- non-HDL.
L’analisi di regressione eseguita separatamente per maschi e femmine, descrive una correlazione debole, ma significativa delle LDL ossidate con l’HbA1c nei maschi (r=0.126, p=0.028) ma non nelle femmine (r=0.011, p=0.88), e con il BMI nelle femmine (r=0.190, p=0.02) ma non nei maschi (r=0.108, p=0.08). In tabella 20 sono riportate le regressioni semplici tra LDL ossidate e parametri lipidici separatamente nei maschi e nelle femmine.
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 50 100 150 200 250 300 CH - non HDL (mg/dL) r=0.50, p<0.001
Tabella 20 - Regressioni semplici tra LDL ossidate e parametri lipidici nei maschi e nelle femmine. Maschi r p Femmine r p CH-TOT 0.433 <0.0001 0.461 <0.0001 LDL 0.407 <0.0001 0.463 <0.001 HDL -0.057 0.39 -0.153 =0.083 TG 0.271 <0.0001 0.382 <0.0001 CH-non HDL 0.472 <0.0001 0.548 <0.0001 CH-LDL/HDL 0.373 <0.0001 0.493 <0.0001
P
PPrrrooofffiiilllooollliiipppiiidddiiicccooo,,,LLLDDDLLLooossssssiiidddaaattteeeeeennneeefffrrrooopppaaatttiiiaaadddiiiaaabbbeeetttiiicccaaa
I pazienti con micro e soprattutto quelli con macroalbuminuria, presentano aumentati livelli dei trigliceridi (p=0.036), nessuna differenza significativa emerge nei livelli di colesterolo totale, LDL, HDL, non-LDL e nel rapporto tra colesterolo LDl e coleserolo HDL (tabella 21).
Tabella 21 - Parametri lipidici e nefropatia diabetica.
Normo Micro Macro Anova OneWay p=
Età, anni 60±8 62±8 63±8 0.004 Durata del diabete, anni 11±9 13±8 16±11 0.002 PAS, mmHg 144±19 150±19 159±20 0.0001 PAD, mmHg 82±10 83±9 86±13 0.009 HbA1c, % 8.5±1.6 8.9±2.1 8.9±1.8 0.08 BMI, kg/mq 28.1±5.3 29.1±5.1 29.6±5.5 0.05 CH-totale 199±38 205±43 207±45 0.34 LDL 124±33 128±35 126±34 0.49 HDL 48±13 45±13 46±15 0.23 CH non-LDL 152±39 159±40 160±42 0.16 TG 142±74 154±90 172±106 0.036 CH-LDL/HDL 2.78±1.05 2.96±0.96 2.94±1.07 0.25
Le concentrazioni plasmatiche delle LDL ossidate presentano una stretta associazione con lo stadio di nefropatia (p<0.0001). Nei pazienti normoalbuminurici la concentrazione delle LDL ossidate è risultata 44.4±20.3 U/L, (media±ds); nei microalbuminurici 60.1±25.8 U/L e nei pazienti con macroalbuminuria 63.1±27.4 U/L. La concentrazione plasmatica delle LDL ossidate era sensibilmente più alta nei microalbuminurici e nei macroalbuminurici rispetto ai normoalbuminurici senza differenze significative tra i due gruppi con aumentati valori di albuminuria (figura 42a). L’associazione tra nefropatia ed LDL ossidate è risultata sovrapponibile nei maschi e nelle femmine (figura 42b).
Figura 42 - Concentrazione delle LDL-ox in relazione agli stadi di nefropatia (nA=normoalbuminuria, mA=microalbuminuria, MA=macroalbuminuria) - (box plot). Ciascun box mostra la mediana e il 25° e 75° percentile della concentrazione delle LDL-ox. I punti contraddistinguono singolarmente i valori esterni al 10°-90° percentile, a loro volta individati dalle barre trasversali.
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 0 1 2 nA mA MA
a
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 0 1 2 nA mA MA M Fb
P
PPrrrooofffiiilllooollliiipppiiidddiiicccooo,,,LLLDDDLLLooossssssiiidddaaattteeeeeerrreeetttiiinnnooopppaaatttiiiaaadddiiiaaabbbeeetttiiicccaaa
Nessuno dei parametri lipidici differiva nei soggetti con retinopatia (proliferante e background) rispetto ai pazienti senza alterazioni retiniche. Solo la concentrazione dei trigliceridi era marginalmente più elevata (p=0.052) nei soggetti con retinopatia proliferante (171±95 mg/dL) rispetto ai pazienti con retinopatia background (144±86 mg/dL) e ai soggetti senza retinopatia (151±92 mg/dL).
Inoltre non è stata rilevata alcuna associazione tra i livelli delle LDL ossidate e lo stadio di retinopatia (p=0.27); le concentrazioni delle LDL ossidate dei non retinopatici (52.12±23.1 U/L) sono risultate simili a quelle dei pazienti con retinopatia background (54.92±27.77 U/L) e dei soggetti con lesioni retiniche avanzate (57.25±26.54 U/L) (figura 43a). Il risultato non differisce dopo analisi separata per maschi e femmine (figura 43b).
Figura 43a - Concentrazione delle LDL-ox in relazione agli stadi di retinopatia (nR=assente, bR=background, pR=proliferante). Ciascun box descrive la mediana e il 25° e 75° percentile della concentrazione delle LDL ossidate. I punti contraddistinguono singolarmente i valori esterni al 10°-90° percentile, a loro volta rappresentati dalle barre trasversali.
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 0 1 2 nR bR pR
a
Figura 43b - Concentrazione delle LDL-ox in relazione agli stadi di retinopatia nei maschi e nelle femmine (nR=assente, bR=background, pR=proliferante). Ciascun box descrive la mediana e il 25° e 75° percentile della concentrazione delle LDL ossidate. I punti contraddistinguono singolarmente i valori esterni al 10°-90° percentile, a loro volta rappresentati dalle barre trasversali.
P
PPrrrooofffiiilllooollliiipppiiidddiiicccooo,,,LLLDDDLLLooossssssiiidddaaattteeeeeeiiipppeeerrrttteeennnsssiiiooonnneeeeeecccaaarrrdddiiiooopppaaatttiiiaaaiiisssccchhheeemmmiiicccaaa
Tutti i parametri lipidici non differiscono tra normotesi ed ipertesi, sia nell’intera popolazione che dopo stratificazione per sesso. Nell’intera coorte, solo i livelli dei trigliceridi sono marginalmente più elevati negli ipertesi rispetto ai normotesi (155±93 vs 133±71 mg/dL, p=0.08). Il colesterolo HDL (44±12 vs 48±14 mg/dL) è risultato lievemente più basso (p=0.035) ed il rapporto colesterolo - LDL/HDL (2.8±1.1 vs 3.0±0.9 mg/dL) più elevato (p=0.02) nei soggetti con cardiopatia ischemica rispetto ai non cardiopatici. Tali differenze erano evidenti nelle femmine (HDL, p=0.01; CH-LDL/HDL, p=0.006), ma non nei maschi. Nessuna differenza statisticamente significativa nei livelli delle LDL ossidate è stata osservata nei pazienti con ipertensione (54.47±25.18 U/L), rispetto a quelli senza ipertensione (49.21±25.28 U/L; p=0.07), così come nessuna differenza è stata osservata tra diabetici con malattia coronarica (54.71±26.23 U/L) e senza malattia coronarica (52.24±24.77 U/L, p=0.37) (figure 44 e 45). Nessuna differenza tra ipertesi e normotesi o tra coronaropatici e non coronaropatici è stata rilevata dopo analisi separata per maschi e femmine.
0 20 40 60 80 100 120 140 160 LDL-OX (U/L) 0 1 2 2 1
nR
bR
pR
M FFigura 44 - Concentrazione delle LDL-ox in relazione alla presenza di ipertensione (Hyp - = normotesi; Hyp + = ipertesi). Ciascun box descrive la mediana e il 25° e 75° percentile della concentrazione delle LDL ossidate. I punti contraddistinguono singolarmente i valori esterni al 10°-90° percentile, a loro volta rappresentati dalle barre trasversali.
Figura 45 - Concentrazione delle LDL-ox in relazione alla presenza di malattia coronarica (CHD - = non coronaropatici; CHD + = coronaropatici). Ciascun box descrive la mediana e il 25° e 75° percentile della concentrazione delle LDL ossidate. I punti contraddistinguono singolarmente i valori esterni al 10°-90° percentile, a loro volta rappresentato dalle barre trasversali.
0 20 40 60 80 100 120 140 160
LDL-OX (U/L)
0 1CHD -
CHD +
0 20 40 60 80 100 120 140 160LDL-OX (U/L)
0 1 Hyp - Hyp +P
PPaaarrraaammmeeetttrrriiillliiipppiiidddiiiccciii,,,LLLDDDLLLooossssssiiidddaaattteeeeeecccooommmpppllliiicccaaannnzzzeeedddeeellldddiiiaaabbbeeettteee:::aaannnaaallliiisssiiimmmuuullltttiiivvvaaarrriiiaaatttaaa
Il significato delle alterazioni del profilo lipidico e soprattutto delle LDL ossidate quali fattori di rischio per le complicanze del diabete, in particolare per la nefropatia diabetica, è stato valutato in una analisi di regressione logistica in cui variabili indipendenti, oltre i parametri lipidici e le LDL ossidate, sono l’età e la durata del diabete, il BMI, il controllo glicemico (HbA1c) e i valori della pressione arteriosa sistolica e diastolica. Variabile dipendente è stata considerata, di volta in volta, la nefropatia, la retinopatia, l’ipertensione e infine, la cardiopatia ischemica (tabella 22).
•
•
•
NNNeeefffrrrooopppaaatttiiiaaaSesso maschile (marginalmente), HbA1c, pressione arteriosa sistolica, ma soprattutto la concentrazione delle LDL ossidate sono parametri associati in maniera indipendente con la presenza di nefropatia. L’inclusione del polimorfismo dell’ApoE tra le variabili indipendenti non induce modificazioni sensibili nel valore predittivo dei parametri inclusi nella regressione. La successiva inclusione della retinopatia (p=0.0007) annulla il significato, quale fattore indipendente, dell’HbA1c (p=0.36), mentre permangono il valore predittivo indipendente della pressione sistolica (p=0.0016) e delle LDL ossidate (p<0.0001) (tabella 23).
•
•
•
RRReeetttiiinnnooopppaaatttiiiaaaIl rischio di retinopatia è modulato da età e durata del diabete, HbA1c, pressione sistolica, ma anche dai livelli delle LDL ossidate (tabella 22), mentre l’inclusione del polimorfismo dell’ApoE tra le variabili indipendenti, non altera il profilo di rischio per retinopatia.
•
•
•
IIIpppeeerrrttteeennnsssiiiooonnneeeaaarrrttteeerrriiiooosssaaaLa presenza di ipertensione correla con l’età, il BMI, il colesterolo totale ed LDL e anche con la concentrazione delle LDL ossidate (tabella 22). Il polimorfismo del gene dell’ApoE, incluso in un nuovo modello di regressione, tra le variabili indipendenti, assume un ruolo marginalmente significativo nel modulare il rischio di ipertensione (p=0.056) senza alterare sostanzialmente il peso di età (p=0.0006), BMI (p=0.019), colesterolo totale (p=0.009), colesterolo LDL (p=0.007) e LDL ossidate (p=0.08).
•
•
•
CCCaaarrrdddiiiooopppaaatttiiiaaaiiisssccchhheeemmmiiicccaaaEtà e colesterolo-HDL, correlano in maniera indipendente con la presenza della cardiopatia ischemica (tabella 22); l’inclusione del polimorfismo del gene dell’ApoE nella regressione logistica non induce alcuna modificazione.
Tabella 22 - Fattori di rischio per le complicanze del diabete: analisi di regressione logistica.
NEFROPATIA RETINOPATIA IPERTENSIONE CHD
Sesso, M vs F 0.086 0.96 0.27 0.93
Età, anni 0.16 0.01 0.002 0.027
Durata del diabete, anni 0.23 <0.0001 0.17 0.14
BMI, Kg/m2 0.17 0.19 0.015 0.50 PAS, mmHg 0.0028 0.003 - 0.89 PAD, mmHg 0.70 0.24 - 0.22 HbA1c, % 0.04 0.006 0.93 0.62 Ch-tot, mg/dL 0.97 0.33 0.02 0.15 Ch-LDL, mg/dL 0.41 0.09 0.013 0.53 Ch-HDL, mg/dL 0.48 0.97 0.31 0.03 Ch-tot/HDL 0.26 0.78 0.97 0.22 TG, mg/dL 0.92 0.61 0.13 0.54 LDL-ox, U/L <0.0001 0.019 0.04 0.60
Tabella 23 - Fattori di rischio per la nefropatia diabetica: analisi di regressione logistica.
Modello
1
Modello
2
Modello
1
Modello
2
Sesso
0.06
0.06
CH tot
0.74
0.95
età
0.23
0.24
LDL
0.47
0.86
DD
0.22
0.39
HDL
0.99
0.99
PAS
0.002
0.004
TG
0.97
0.95
PAD
0.72
0.79
ox LDL
<0.0001 <0.0001
HbA1c
0.02
0.18
Retino-patia
---
0.0009
P
P
P
a
a
a
r
r
r
a
a
a
o
o
o
x
x
x
o
o
o
n
n
n
a
a
a
s
s
s
e
e
e
(
(
(
P
P
P
O
O
O
N
N
N
1
1
1
)
)
)
e
e
e
d
d
d
i
i
i
a
a
a
b
b
b
e
e
e
t
t
t
e
e
e
t
t
t
i
i
i
p
p
p
o
o
o
2
2
2
:
:
:
a
a
a
t
t
t
t
t
t
i
i
i
v
v
v
i
i
i
t
t
t
à
à
à
s
s
s
i
i
i
e
e
e
r
r
r
i
i
i
c
c
c
a
a
a
,
,
,
p
p
p
o
o
o
l
l
l
i
i
i
m
m
m
o
o
o
r
r
r
f
f
f
i
i
i
s
s
s
m
m
m
i
i
i
g
g
g
e
e
e
n
n
n
i
i
i
c
c
c
i
i
i
e
e
e
c
c
c
o
o
o
m
m
m
p
p
p
l
l
l
i
i
i
c
c
c
a
a
a
n
n
n
z
z
z
e
e
e
m
m
m
i
i
i
c
c
c
r
r
r
o
o
o
-
-
-
e
e
e
m
m
m
a
a
a
c
c
c
r
r
r
o
o
o
v
v
v
a
a
a
s
s
s
c
c
c
o
o
o
l
l
l
a
a
a
r
r
r
i
i
i
Tra i meccanismi che possono spiegare le proprietà anti-aterogene delle HDL, la paraoxonase (PON1), una esterasi legata alla frazione delle HDL che veicola la apolipoproteina A1 (apoA1), ha attratto recentemente una particolare attenzione.
La PON1 inibisce l’ossidazione delle LDL prevenendo o ritardando l’accumulo di lipoperossidi e distruggendo le LDL modificate dalla ossidazione della loro componente fosfolipidica.
Bassi livelli della attività della PON1 potrebbero da una parte contribuire all’aumentato rischio aterosclerotico associato al diabete tipo 2 riducendo la capacità delle HDL di evitare l’ossidazione delle LDL, dall’altra rappresentare un importante fattore di induzione e/o progressione del danno microvascolare soprattutto a livello glomerulare.
Alcuni polimorfismi genici di PON1 sono strettamente correlati alla attività della PON1 e potrebbero essere associati al rischio di sviluppare le complicanze del diabete.
•
•
•
P
P
P
o
o
o
l
l
l
i
i
i
m
m
m
o
o
o
r
r
r
f
f
f
i
i
i
s
s
s
m
m
m
o
o
o
L
L
L
e
e
e
u
u
u
5
5
5
5
5
5
M
M
M
e
e
e
t
t
t
d
d
d
i
i
i
P
P
P
O
O
O
N
N
N
1
1
1
e
e
e
c
c
c
o
o
o
m
m
m
p
p
p
l
l
l
i
i
i
c
c
c
a
a
a
n
n
n
z
z
z
e
e
e
d
d
d
e
e
e
l
l
l
d
d
d
i
i
i
a
a
a
b
b
b
e
e
e
t
t
t
e
e
e
t
t
t
i
i
i
p
p
p
o
o
o
2
2
2
L'analisi del polimorfismo Leu55Met di PON1 (L55M) è stata effettuata su 450 dei 730 pazienti con diabete tipo 2 reclutati nello studio e su 160 soggetti sani di controllo.
Nei soggetti sani di controllo la frequenza dell'allele L è stata 0.652, quella dell'allele M è stata 0.348.
Nei pazienti con diabete tipo 2 la frequenza dell'allele L è stata 0.572, quella dell'allele M è stata 0.428. La distribuzione dei genotipi rispettava l’equilibrio di Hardy-Weinberg nei soggetti di controllo (χ2
=0.782, p=0.676), ma non nei soggetti con diabete tipo 2 (χ2
=23.239, p<0.0001). La distribuzione dei genotipi L/L, L/M, M/M osservata nei controlli era 40.0, 50.0, 10.0%, quella osservata nei diabetici era 23.4, 67.6, 9.0% (tabella 24).
Tabella 24 - Distribuzione genotipica ed allelica al locus PON1-55. Diabete tipo 2 % (n=450) Controlli % (n=160) Genotipi L/L 23.4 40.0 L/M 67.6 50.0 M/M 9.0 10.0 M+ 76.6 60.0 Alleli L 0.572 0.652 M 0.428 0.348
In tabella 25 sono riportate le principali caratteristiche cliniche dei soggetti con diabete tipo 2 in funzione del genotipo PON1 Leu55Met. I tre gruppi non differivano per età e pressione arteriosa diastolica. I soggetti con genotipo M/M tendono ad avere più breve durata del diabete (M/M vs L/L; p=0.07), più elevato BMI (M/M vs L/L; p=0.031) e più bassi valori di pressione sistolica (M/M vs L/L; p=0.06). Infine, i livelli di HbA1c sono risultati maggiori negli eterozigoti rispetto agli omozigoti L/L (p=0.008).
Tabella 25 - Caratteristiche cliniche e genotipo PON1 Leu55Met nei soggetti con diabete tipo 2.
L/L L/M M/M Anova, pvalue=
Età, anni 60±9 61±9 60±6 0.67
Durata del diabete, anni 15±10 14±11 10±8 0.17
BMI, kg/m2 27.5±4.8 28.7±5.0 30.4±6.6
0.096
PAS, mmHg 151±21 148±22 141±19 0.17
PAD, mmHg 85±9 83±12 83±8 0.64
•
•
•
NNNeeefffrrrooopppaaatttiiiaaaNessuna differenza nella distribuzione dei genotipi è rilevabile tra soggetti con normo-albuminuria (12.7 - 80.3 - 7.0%), quelli con micronormo-albuminuria (25.5 - 64.7 - 9.8%) e i quelli con macroalbuminuria (24.6 - 60.6 - 14.8%; χ2
=7.76, p=0.10) (figura 46, pannello A).
Figura 46 - Polimorfismo Leu55Met e nefropatia (A); polimorfismo Leu55Met e distribuzione genotipica (confronto diretto) tra soggetti normoalbuminurici e microalbuminurici (B).
Nessuna differenza emerge anche dopo stratificazione dei soggetti normoalbuminurici per la durata del diabete (χ2=5.61, p=0.23); in questa analisi sono stati inclusi tra i soggetti con normoalbuminuria soltanto quelli con durata del diabete maggiore di 15 anni. Risultati simili si osservavano tra i maschi (p=0.472) e tra le femmine (p=0.381).
Il confronto diretto della distribuzione genotipica tra i normoalbuminurici e i microalbuminurici mette in evidenza una differenza marginalmente significativa (χ2
=5.19, p=0.074) (figura 46, pannello B) con una maggior frequenza del genotipo LL tra i soggetti con microalbuminuria (25.5% vs 12.7%).
Analogamente, il confronto diretto della distribuzione dei genotipi tra i normoalbuminurici ed i soggetti con nefropatia conclamata mette in evidenza una differenza statisticamente significativa (figura 46, pannello C) (χ2
=6.18, p=0.045) con una maggior frequenza tra i macroalbuminurici del genotipo L/L (24.6% vs 12.7%) e una minor frequenza degli eterozigoti (60.6% vs 80.3%).
Infine, una differenza significativa (χ2
=6.74, p=0.0343) emerge confrontando i soggetti normoalbuminurici con l'insieme dei soggetti con elevati valori di escrezione urinaria di albumina (micro- e macroalbuminuria) (figura 46, pannello D). Il genotipo L/L è più frequente nei soggetti con albuminuria sovra-normale (25.1% vs 12.7%), mentre i portatori dell'allele M sono più frequenti tra i normoalbuminurici (87.3% vs 74.9%; χ2
=4.58, p=0.026).
L'analisi di regressione logistica dimostra che la pressione arteriosa sistolica (p=0.040), la coesistenza di retinopatia (p=0.046) soprattutto nella forma più avanzata della retinopatia proliferante (p=0.019), l'HbA1c (p=0.012), così come il genotipo L/L (p=0.005), ma non l'età, la durata del diabete, la pressione arteriosa diastolica ed il BMI, sono associati in maniera indipendente alla presenza di aumentati valori di albuminuria (microalbuminuria + macroalbuminuria) nel diabete tipo 2 (tabella 25).
Figura 35: Polimorfismo Leu55Met e distribuzione genotipica distribuzione genotipica tra normoalbuminurici e macroalbuminurici (C) e distribuzione genotipica tra normoalbuminurici e l’insieme dei micro- e macroalbuminurici (D).
•
•
•
RRReeetttiiinnnooopppaaatttiiiaaaNessuna differenza nella distribuzione dei genotipi di PON1 L55M si osserva tra pazienti non retinopatici (17.0 -70.2 - 12.8%), con retinopatia background (24.3 - 66.2 - 9.5%) e con retinopatia proliferante (21.4 - 67.9 – 10.7%) (χ2=1.62, p=0.805) (figura 47). La percentuale dei portatori del genotipo L/L, infatti, era simile nei soggetti con una qualche forma di retinopatia (23.1%) e nei non retinopatici (17.0%; p=0.27).
Figura 47 - Polimorfismo Leu55Met di PON1 e retinopatia.
Inoltre, nessuna differenza emergeva dopo stratificazione per sesso (p=0.71 nei maschi, p=0.47 nelle femmine). L'analisi di regressione logistica dimostra che solo la durata del diabete (p<0.0001) e la coesistenza di nefropatia (p=0.04), principalmente la coesistenza di nefropatia conclamata (p=0.003), ma non l'età, la pressione arteriosa sistolica e diastolica (o la coesistenza di ipertensione), il BMI e neppure i livelli di HbA1c così come il polimorfismo PON1 L55M rappresentano correlati indipendenti della retinopatia nel diabete tipo 2 (tabella 25).
Tabella 25 - Polimorfismo L55M di PON1 e complicanze microvascolari nel diabete tipo 2 (analisi di regressione logistica): p value.
Nefropatia Retinopatia
Sesso, M/F 0.11 0.58
Età, anni 0.44 0.19
Durata del diabete, anni 0.22 <0.0001
BMI, kg/m2 0.17 0.82 PAS, mmHg 0.04 0.80 PAD, mmHg 0.98 0.84 HbA1c, % 0.012 0.56 Coesistenza di nefropatia - 0.04 Coesistenza di retinopatia 0.046 -PON1 - L55M, L/L vs altri 0.005 0.71
•
•
•
IIIpppeeerrrttteeennnsssiiiooonnneeeeeepppaaatttooolllooogggiiiaaacccooorrrooonnnaaarrriiicccaaaNei soggetti normotesi la distribuzione dei genotipi L/L, L/M ed M/M di PON1 (13.3 77.8 -8.9%) era sovrapponibile a quella osservata nei soggetti ipertesi (20.7 - 67.9 - 11.4%; χ2
=1.72, p=0.423) (figura 48).
Nessuna differenza era rilevata tra pazienti senza patologia coronarica (21.3 - 68.6 - 10.1%) e pazienti con patologia coronarica (15.1 - 71.7 - 13.2%, χ2=1.209, p=0.546) (figura 49).
Nessuna differenza emergeva dopo suddivisione in maschi e femmine sia per l'ipertensione arteriosa (p=0.33 nei maschi, p=0.97 nelle femmine) che per la coronaropatia (p=0.40 nei maschi, p=0.99 nelle femmine).
Figura 48 - Polimorfismo Leu55Met di PON1 e ipertensione.