1. RIASSUNTO
In questo lavoro di Tesi sono stati sintetizzati i derivati olefinici di rame (I) [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf (olefina = nbe, van) per reazione di Cu(OTf)·0,5(PhCH3), CH2(3,5-Me2Pz)2 e olefina in toluene a temperatura ambiente. I complessi ottenuti sono stati caratterizzati mediante analisi elementare, spettroscopia IR, 1H-NMR e 13C-NMR.
La reazione di Cu(OTf)·0,5(PhCH3) con fumaronitrile in presenza di CH2 (3,5-Me2Pz)2 ha portato all’isolamento di [Cu(CH2(3,5-Me2Pz)2)](OTf), non contenente fumaronitrile coordinato.
I complessi olefinici di ferro (II), di formula generale [FeCp(CO)2(olefina)]BF4 (olefina = 1-esene, coe), sono stati ottenuti per reazione di FeCp(CO)2I con AgBF4 in presenza di olefina a temperatura ambiente. I composti sono stati caratterizzati mediante spettroscopia IR e 1H-NMR.
Il composto carbonilico [FeCp(CO)3]BF4 è stato ottenuto, con rese del 50 %, da [FeCp(CO2)(THF)]BF4 spostando il THF con CO in presenza di BF3Et2O a temperatura ambiente.
Per reazione di CoCp(C2H4)2 con olefina in toluene a temperatura ambiente, sono stati preparati i complessi olefinici di cobalto (I) di formula generale CoCp(L) (L = COD, fn, C14H10), i quali sono stati caratterizzati mediante analisi elementare, spettroscopia IR e 1H-NMR.
Le reazioni di scambio sono state effettuate mediante tecnica gas-volumetrica sui composti di rame (I), ferro (II) e cobalto (I). Sono state determinate le costanti di equilibrio a temperatura variabile per la reazione riportata nell’equazione 1.
[Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf + CO (1) [Cu(CH2(3,5-Me2Pz)2)(CO)]OTf + olefina Olefina = nbe, van.
Nel caso dei sistemi Fe(II) e Co(I) non è stato possibile ottenere dati di equilibrio relativi alle reazioni di scambio CO/olefina a causa di una estrema lentezza delle reazioni stesse o della scarsa solubilità dei composti utilizzati (M = Fe, equazione 2), o perché le reazioni di scambio risultavano completamente spostate a destra (M = Co, equazione 3).
[FeCp(CO)2(olefina)]BF4 + CO [FeCp(CO)3]BF4 + olefina (2) Olefina = 1-esene, coe.
CoCp(L) + 2 CO CoCp(CO)2 + L (3)
2. INTRODUZIONE
La combinazione di monossido di carbonio e alcheni è impiegata nelle sintesi organiche di rilevanza industriale promosse da metalli di transizione, come ad esempio l’idroformilazione e la co-polimerizzazione CO/olefina. In questo ambito, lo studio della coordinazione competitiva di CO ed alcheni è importante per rendere più chiaro il ruolo del centro metallico e razionalizzare gli andamenti dell’efficienza catalitica osservati.
Principalmente, lo studio degli equilibri di competizione tra CO e le olefine nei complessi dei metalli di transizione è interessante sotto tre aspetti.
2.1 Natura del legame metallo - CO e metallo - olefina
Il legame metallo – monossido di carbonio
La formulazione di complessi con uno o più gruppi CO legati a metalli attraverso l’atomo di carbonio è una proprietà caratteristica dei metalli di transizione, e la composizione è generalmente in accordo con la regola dei 18 elettroni.
Al contrario di una molecola isoelettronica come N2, il CO ha una chimica molto vasta grazie alla natura particolare del legame M–CO, che può essere considerato come dovuto a due componenti:
1 – Donazione σ dal carbonio al metallo (M ← CO):
2 – Retrodonazione π dagli orbitali d del metallo agli orbitali π* vuoti di CO (M → CO)
Figura 2: Schema della retrodonazione M → CO.
Vi è da notare che un tale tipo di legame è sinergico nel senso che la retrodonazione del metallo al CO, in virtù del conseguente incremento di densità elettronica sul legante, aumenta la tendenza di quest’ultimo a donare elettroni al metallo; a sua volta, questo trasferimento di elettroni renderà più positivo il gruppo CO aumentandone il potere accettore. In altre parole, all’aumentare della donazione elettronica M → CO aumenterà l’ordine del legame M-C ed in corrispondenza si avrà una diminuzione dell’ordine di legame C-O.
La componente di retrodonazione è massima al centro della transizione, con metalli sufficientemente ricchi di elettroni, mentre spostandosi a destra l’energia degli orbitali d diminuisce e la sovrapposizione con gli orbitali π di CO necessaria per la retrodonazione non è più ottimale.
Anche la presenza di altri leganti π acidi nel complesso, che sottrae elettroni al metallo, inibisce la retrodonazione e abbassa l’ordine di legame M – CO.
La complessa natura del legame M – CO e quindi la presenza di una maggiore o minore retrodonazione si riflette su una caratteristica importante dei complessi carbonilici: la frequenza di stiramento CO. Infatti tale frequenza aumenta all’aumentare dell’ordine di legame CO, quindi quando tale frequenza è alta, per quanto detto in precedenza, il contributo di retrodonazione sarà basso. In alcuni casi, come ad esempio le specie cationiche [Pt(CO)4]2+ e [Pd(CO)4]2+, sono state registrate bande di stiramento a frequenze addirittura superiori a quelle del monossido di
carbonio libero (2143 cm-1), e sono stati descritti come complessi nei quali il contributo di retrodonazione è pressoché assente.
La spettroscopia IR risulta quindi essere il metodo di indagine principe della chimica dei metallo carbonili, tanto più che il range di frequenze (da 2300 a 1600 cm-1) corrisponde ad una zona dello spettro generalmente libera da bande dovute ad altri gruppi.
Il legame metallo – olefina
Il primo complesso olefinico, il sale di Zeise, K[PtCl3(C2H4)], risale al 1827, ma fino al 1950 sono stati pubblicati pochi studi su tale argomento. La prima descrizione del legame M - (η2-C2H4) fu sviluppata da M. J. S. Dewar su complessi di Cu(I) e fu poi estesa agli altri metalli di transizione ed alle altre olefine.
Analogamente al legame M – CO sono presenti due contributi:
1 – Donazione π dal doppio legame dell’olefina al metallo.
2 – Retrodonazione π dagli orbitali d del metallo agli orbitali di antilegame dell’olefina.
Figura 4: Schema della retrodonazione M →olefina.
In presenza di metalli elettronricchi, sostituenti elettrondonatori sull’olefina o leganti basici il contributo di retrodonazione sarà grande. Con metalli a sinistra della transizione la retrodonazione può essere tale da indebolire il legame C=C al punto di poterlo assimilare ad un legame singolo, con conseguente descrizione del complesso come un metallaciclo (figura 5).
M
M
(A) (B)
Figura 5: Modello di legame M-olefina con basso contributo di retrodonazione (A) e con elevato contributo di retrodonazione (B).
Viste le analogie nella descrizione del tipo di legame, lo studio dello scambio CO/olefina permette di capire quali sono i fattori che influenzano la maggiore o minore stabilità dell’uno rispetto all’altro nei confronti di uno stesso centro metallico.
2.2 Cicli catalitici che coinvolgono CO ed olefine
La coordinazione di CO ed olefine a centri metallici costituisce un passaggio fondamentale di molti cicli catalitici, tra i quali possiamo citare le reazioni di copolimerizzazione di CO ed etilene e di idroformilazione.
Copolimerizzazione CO/etilene
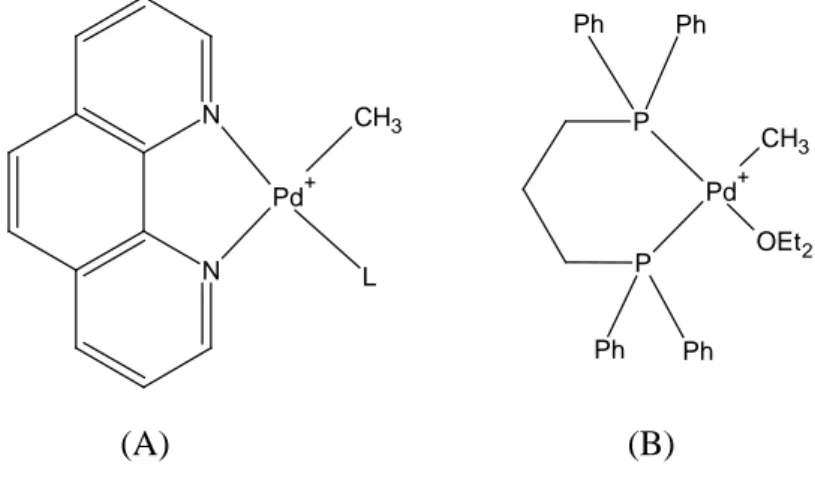
Brookhart e collaboratori1 in un loro studio descrivono il meccanismo della copolimerizzazione di CO ed etilene catalizzata da complessi di palladio (II) del tipo riportato in Figura 6. N N CH3 Pd+ L Ph Ph Ph Ph P P OEt2 CH3 Pd+ (A) (B)
Figura 6: Precursori dei catalizzatori impiegati per la copolimerizzazione di CO ed etilene; L = CO, C2H4, S(Me)Ph, CH3CN, C6H5CN.
In questo ciclo catalitico si ha un’inserzione migratoria alternata di CO ed etilene che porta alla formazione del copolimero attraverso intermedi alchil-carbonilici (I), acil-carbonilici (II), acil-etilenici (III) ed alchil-etilenici (IV). Come è stato
dimostrato2 l’inserzione multipla di olefina è inibita dalla maggiore affinità del monossido di carbonio per il palladio rispetto all’etilene. D’altra parte la doppia carbonilazione è termodinamicamente sfavorita, e la specie acil-carbonilica (II) che si forma quando si coordina la seconda molecola di monossido di carbonio è in equilibrio con l’intermedio acil-etilenico (III), il quale subisce inserzione migratoria di etilene, e torna in equilibrio con il complesso alchil-carbonilico (I). Tale complesso potrà poi nuovamente coordinare una molecola di monossido di carbonio, ricominciando il ciclo (Figura 7).
O Pd Pol. CO CO O Pd CO O Pol. C2H4 - CO O Pd O Pol. C2H4 O Pd O Pol. (I) (II) (III) (IV)
Figura 7: Inserzione alternata di CO ed etilene.
Idroformilazione
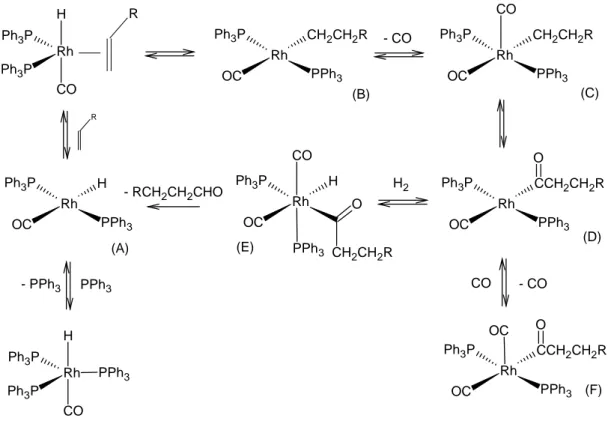
Il processo industriale di idroformilazione impiega catalizzatori a base di cobalto o di rodio. Nel caso del catalizzatore a base di rodio, RhH(CO)(PPh3)3, Il primo passaggio consiste nella formazione di un intermedio quadrato planare a 16 elettroni
(A), il quale coordina un’olefina e forma una specie alchilica (B) tramite trasferimento di idruro. Nel passaggio successivo si ha la coordinazione di CO a dare la specie (C), la quale subisce inserzione a dare la specie acilica (D). Questa subisce addizione ossidativa di idrogeno molecolare a dare la specie (E), dalla quale si dissocia l’aldeide dopo eliminazione riduttiva con trasferimento di idruro, e si rigenera la specie cataliticamente attiva (A).
E’ interessante notare che la specie (D) è in equilibrio con un complesso acil-carbonilico (F) (derivante da una doppia reazione con CO) il quale non può reagire con idrogeno molecolare. Ne segue che un eccesso di CO favorisce la formazione del complesso (F) e inibisce la reazione di idroformilazione (Figura 8).
H Rh Ph3P Ph3P CO R Rh OC Ph3P CH2CH2R PPh3 Rh OC Ph3P CH2CH2R PPh3 CO Rh OC Ph3P CCH2CH2R PPh3 O Rh OC Ph3P CCH2CH2R PPh3 O OC O Rh OC Ph3P H CO CH2CH2R PPh3 Rh OC Ph3P H PPh3 H Rh Ph3P Ph3P CO PPh3 (A) (B) (C) (D) (E) (F) R - CO H2 - RCH2CH2CHO - PPh3 PPh3 CO - CO
Figura 8: Ciclo catalitico semplificato dell’idroformilazione catalizzata da RhH(CO)(PPh3)3.
In questi due esempi si può notare che la comprensione di questi meccanismi catalitici è strettamente connessa con i parametri termodinamici relativi al legame
M-(olefina), M-CO ed agli equilibri di competizione eventualmente coinvolti. L’approfondimento delle conoscenze in questo ambito è fondamentale per la progettazione di nuovi sistemi catalitici.
2.3 Sistemi biologici in grado di legare “piccole molecole insature”
Il rame è il terzo elemento metallico più abbondante nel corpo umano, dopo ferro e zinco, ma si trova anche in tutte le altre forme di vita, e gioca un ruolo di primo piano nell’azione di di molti enzimi che catalizzano una grande varietà di reazioni. Nei sistemi biologici i centri di rame (I) mostrano una forte reattività come π-donatori, per la presenza di leganti fortemente basici nella sfera di coordinazione. D’altra parte il carattere σ-accettore di Cu (I) può essere incrementato in presenza di acidi di Lewis. E’ stato mostrato3 che CuCl non reagisce con etilene o monossido di carbonio a bassa pressione, mentre CuAlCl4 è in grado di assorbire più di 200 mL/g di gas a temperatura ambiente e pressione atmosferica.
Quindi le interazioni tra etilene, propilene, acetilene, CO e Cu(I) sono state proposte come modello interpretativo per gli effetti di tali molecole sul metabolismo delle piante. Infatti sembra che in tali organismi siano presenti metalloenzimi a base di Cu (I), per i quali monossido di carbonio e olefine siano in competizione coordinativa. E’ inoltre noto4,5 che i pirazolilborati di rame sono stati impiegati per sintetizzare modelli di proteine come la plastocianina ed emocianina.
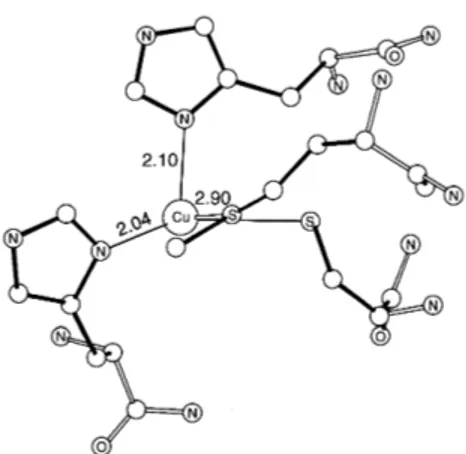
La plastocianina6 (Figura 9) si trova nella fase acquosa dei cloroplasti ed ha, assieme ai citocromi f e P700, una funzione fondamentale nella fotosintesi delle piante. Essa rientra nella classe di proteine di tipo I dette “blue copper”. Infatti in questa classe di proteine il rame presenta una geometria inusuale, ed il colore blu di questi siti è dovuto ad un forteassorbimento nella regione visibile del rosso, che può essere assegnata al trasferimento di carica S→Cu.
Figura 9: Struttura del sito attivo della plastocianina determinata ai raggi X; Le distanze Cu-legante sono riportate in Ångstrom.
L’emocianina7 (Figura 10) svolge la stessa funzione dell’emoglobina in alcuni invertebrati, come molluschi ed artropodi. Questa proteina rientra nella classe di tipo III, dette “dicopper” a causa della presenza, in ciascuna sub-unità, di due centri metallici di rame per i quali l’accoppiamento antiferromagnetico porta al
diamagnetismo: la forma deossigenata contiene Cu (I) ed è incolore, mentre la forma ossigenata è blu e contiene Cu (II).
Figura 10: Struttura del sito binucleare di rame dell’emocianina nella forma ossigenata
In un recente studio J. Shaw e collaboratori8 hanno esteso questi studi impiegando difenilpirazolilmetano come legante in complessi cationici di rame (II), e ne hanno studiato l’uso come precursori di tiolati di rame che possano riprodurre più
2.4 Reazioni di scambio CO/olefina a scopi sintetici
I primi studi sulla sostituzione di CO da parte di olefine, a partire dagli anni ’30, erano sostanzialmente finalizzati alla sintesi. Ad esempio tra i primi dati che si ritrovano in letteratura9 possiamo citare la sintesi di complessi dienici del tipo Fe(CO)3(diene) ottenuti per sostituzione di CO a partire da Fe(CO)5 (equazione 4).
Fe(CO)5 + diene Fe(CO)3(diene) + 2 CO (4)
diene = butadiene, isoprene, dimetilbutadiene.
Alla fine degli anni ’50 tale reazione fu estesa anche al complesso CoCp(CO)210, operando in etilcicloesano a riflusso per 90 ore (equazione 5).
CoCp(CO)2 + diene CoCp(diene) + 2 CO (5)
In seguito si ritrovano anche esempi di sostituzioni analoghe su Fe3(CO)12, Fe(CO)5 e CoCp(CO)2 con trieni, quali 1,3,5 cicloottatriene 11 (equazioni 6 e 7), bis-(trifluorometil)-biciclo-[2,2,2]-ottatriene12 (equazione 8).
Fe3(CO)12 + 3 C8H10 3 Fe(CO)3(η4-C8H10) + 3 CO (6)
CoCp(CO)2 + C8H10 CoCp(η4-C8H10) + 2 CO (7)
M*(CO)2 + C14H14F6 M*( η2, η2’- C14H14F6) + 2 CO (8) M* = Fe(CO)3, CoCp.
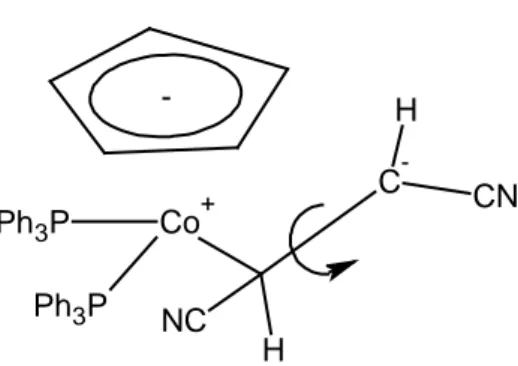
Sempre sul sistema CoCp(CO)2, e parallelamente sul sistema CoCp(PPh3)2, sono state effettuate reazioni di sostituzione con fumaronitrile, dimetilfumarato e dimetilmaleato13 (equazioni 9, 10 e Schema 1). In particolare è interessante notare che la sostituzione con fumaronitrile sul complesso fosfinico produce sia
CoCp(PPh3)(fn) che il prodotto di isomerizzazione CoCp(PPh3)(mn). Al contrario la sostituzione con dimetilfumarato e dimetilmaleato produce esclusivamente i complessi corrispondenti senza isomerizzazione:
CoCp(CO)2 + fn CoCp(CO)(fn) (9) CoCp(PPh3)2 + L CoCp(PPh3)(L) + PPh3 (10) L = dimetilmaleato, dimetilfumarato. -Co Ph3P PPh3
+
fn -Co Ph3P fn+
-Co Ph3P mnSchema 1: Reazione di sostituzione di PPh3 da parte di fn sul complesso CoCp(PPh3)2.
Tali reazioni generalmente procedono per via dissociativa, attraverso la formazione di una specie insatura a 16 elettroni, [CoCp(CO)] o [CoCp(PPh3)], sulla quale va a coordinarsi il nuovo legante.
Quando il legante sostituente è particolarmente π-acido (fumaronitrile) ed il complesso di cobalto è particolarmente basico (complesso fosfinico), la reazione non procede per via dissociativa, ma attraverso un intermedio (Figura 11) nel quale il legame C-C dell’olefina non può più essere considerato doppio. Questo permette la libera rotazione attorno al legame C-C dell’olefina, con possibile isomerizzazione del fumaronitrile a maleonitrile.
-NC H H CN Ph3P Ph3P Co+ C
-Figura 11: Intermedio ipotizzato della reazione tra CpCp(PPh3)2 e fumaronitrile.
Per quanto riguarda il vanadio, è nota la reazione di VCp(CO)414 con butadiene o 1,3-cicloesadiene, la quale avviene in bassa resa, a 70 °C in presenza di mercurio e luce ultravioletta.
Complessi del tipo M(CO)5(η2-olefina) e M(CO)4(η2-olefina)2 sono stati ottenuti fotochimicamente da complessi esacarbonilici di molibdeno e tungsteno15. La fotolisi di Cr(CO)6 in presenza di cicloottene porta alla formazione di Cr(CO)5(η2-olefina)16, tuttavia tale prodotto è stabile soltanto al di sotto di -40°C in presenza di una largo eccesso di olefina.
I complessi del tipo M(CO)4(η2-olefina)2 (M = Cr, Mo, W) sono invece stabili in presenza di leganti σ-donatori17 o di olefine con sostituenti elettron-attrattori (tetracianoetilene o fumaronitrile)18.
2.5 Studi termodinamici dell’equilibrio di scambio CO/olefina
Fin qui è stata presentata una serie di reazioni sostituzione di CO da parte di olefina, dieni e trieni finalizzate alla sintesi. Prendiamo ora in considerazione gli studi termodinamici di reazioni di scambio CO/olefina presenti in letteratura.
Per quanto riguarda i metalli a sinistra nella transizione, recentemente è stato studiata la reazione di VCp2(CO) con olefine (equazione 11).
VCp2(CO) + olefina VCp2(olefina) + CO (11)
Per tale la suddetta reazione è stato osservato che:
- Olefine contenenti gruppi elettronattrattori (tetracianoetilene, fumaronitrile) danno luogo a completa sostituzione di CO.
- Acrilonitile e dietilfumarato danno luogo a parziale spostamento di CO. - Cicloottene e norbornene non spostano CO.
Per quanto riguarda la reazione di sostituzione di olefina da parte di CO su VCp2(defu)19, è stato che essa procede verso una situazione di equilibrio a 25 °C. Per la reazione riportata nell’equazione 12, è stata trovata una costante di equilibrio pari a 55 ± 8, la quale mostra che il complesso carbonilico è termodinamicamente favorito rispetto al complesso con dietilfumarato.
VCp2(defu) + CO VCp2(CO) + defu (12)
Per quanto riguarda elementi al centro della transizione è stato studiato lo spostamento di etilene nel complesso Rh(acac)(C2H4)220 da parte di CO (equazione 13) (costante di equilibrio superiore a 100) e lo spostamento di CO nel complesso Co2(CO)8 da parte di norbornadiene (equazione 14): in questo caso Markò e collaboratori21 ottennero una costante di equilibrio K pari a (6,7 ± 0,4)·10-4 a 35 °C. In entrambi i casi questi complessi mostrano una maggiore affinità per il monossido di carbonio rispetto alle olefine.
Rh(acac)(C2H4)2 + CO Rh(acac)(CO)2 + 2 C2H4 (13)
Spostandosi verso la fine della transizione, è stato studiato il sistema cis-PtX2(CO)(olefina)22 (X = Cl, Br; olefina = cicloesene, ciclopentene), il quale in atmosfera di monossido di carbonio dà il complesso cis-PtX2(CO)2 (equazione 15).
PtX2(CO)(olefina) + CO cis-PtX2(CO)2 + olefina (15)
Recentemente23 è stata studiata anche la reazione inversa di spostamento di CO da parte di alcheni (cicloesene, 1-ottene) e dieni (cicloottadiene, norbornadiene) nel complesso cis-PtX2(CO)2. La sostituzione con dieni ha portato in entrambi i casi a completo spostamento di CO, mentre la reazione di sostituzione con alcheni ha costanti di equilibrio pari a (2,4 ± 0,5) · 10-3 nel caso del cicloesene e (2,8 ± 0,4)·10-3 nel caso dell’1-ottene. Quindi in questi sistemi la coordinazione del monossido di carbonio al centro metallico è favorita rispetto agli alcheni e sfavorita rispetto ai dieni.
Sempre rimanendo nell’ambito dei metalli a destra nella transizione è noto che AuCl(CO) reagisce con cicloottene e norbornene a dare i complessi AuCl(coe) e AuCl(nbe)24. Nel caso della reazione con norbornene (equazione 16) è stata ricavata la costante di equilibrio, K = 4 ± 1 a 21,5 °C. In questo caso il complesso olefinico risulta favorito rispetto al complesso carbonilico.
AuCl(CO) + nbe AuCl(nbe) + CO (16)
Tuttavia non è stato osservato spostamento di CO in AuCl(CO) per reazione con olefine contenenti gruppi elettronattrattori (acrilonitrile e tetracianoetilene). Questo è in accordo con i risultati ottenuti per i complessi di palladio (II)25, per il quale è stato dimostrato che la stabilità termodinamica del complesso in Figura 12 diminuisce all’aumentare del potere elettron-attrattore del gruppo Y.
OAc Ph O O O F3C Pd CH2 Y
Figura 12: Struttura schematica di Pd(p-Y-C6H4CH=CH2)(5-acetossinortriciclenil)(benzoiltrifluoroacetato).
Ancora a destra nella transizione, studi approfonditi sono stati condotti su complessi di Cu(I).
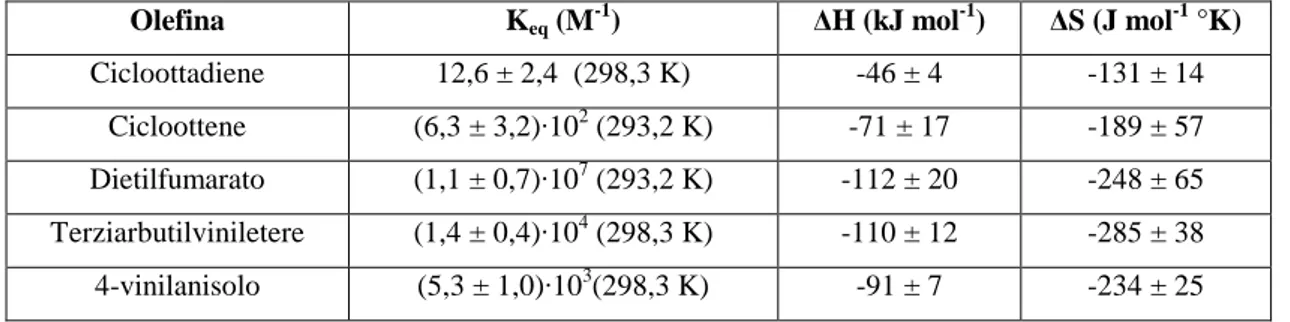
Il primo riguarda trifluoroacetati di formula generale Cu(CF3CO2)(olefina)26 (equazione 17), i cui risultati sono riportati in Tabella 1:
2 Cu(CF3CO2)(olefina) + 2 CO [Cu(CF3CO2)(CO)]2 + 2 olefina (17)
Olefina Keq (M-1) ∆H (kJ mol-1) ∆S (J mol-1 °K)
Cicloottadiene 12,6 ± 2,4 (298,3 K) -46 ± 4 -131 ± 14 Cicloottene (6,3 ± 3,2)·102 (293,2 K) -71 ± 17 -189 ± 57 Dietilfumarato (1,1 ± 0,7)·107 (293,2 K) -112 ± 20 -248 ± 65 Terziarbutilviniletere (1,4 ± 0,4)·104 (298,3 K) -110 ± 12 -285 ± 38 4-vinilanisolo (5,3 ± 1,0)·103(298,3 K) -91 ± 7 -234 ± 25
Tabella 1: Dati relativi alle reazioni di sostituzione con CO su complessi del tipo Cu(CF3CO2)(olefina).
In secondo luogo è stata studiata la sostituzione di olefina da parte di CO su esafluoroacetilacetonati di formula generale Cu(hfacac)(olefina)27 (equazione 18), i cui risultati sono riportati in Tabella 2:
Cu(hfacac)(olefina) + CO Cu(hfacac)(CO) + olefina (18)
Olefina Keq (M-1) (298,3 K) ∆H (kJ mol-1) ∆S (J mol-1 °K)
Norbornene 0,86 ± 0,15 -8,3 ± 0,7 -29 ± 2
Cicloottene 2,80 ± 0,40 -12,0 ± 0,2 -31,7 ± 0,7
4-vinilanisolo 0,40 ± 0,08 -28 ± 2 -69 ± 7
Tabella 2: Dati relativi alle reazioni di sostituzione con CO su complessi del tipo Cu(hfacac)(olefina).
Infine è stata riportata la sostituzione di olefina da parte di CO su derivati Cu[BH2(3,5-(CF3)2Pz)2](olefina)28 (equazione 19), i cui risultati sono riportati in tabella 3:
Cu[BH2(3,5-(CF3)2Pz)2](olefina) +CO (19)
Cu[BH2(3,5-(CF3)2Pz)2](CO) + olefina
Olefina Keq (M -1 ) (298,3 K) ∆H (kJ mol-1) ∆S (J mol-1 °K) Cicloottene 1,4 ± 0,2 -27 ± 2 -88 ± 8 4-clorostirene 59 ± 15 -45 ± 6 -116 ± 20 4-vinilanisolo 6,3 ± 3,0 -57 ± 11 -172 ± 36 trietilvinilsilano 2,2 ± 0,3 -29 ± 3 -89 ± 9
Tabella 3: Dati relativi alle reazioni di sostituzione con CO su complessi del tipo Cu[BH2(3,5-(CF3)2Pz)2](olefina).
Dai dati riportati nelle tabelle precedenti si ricava che in generale il complesso carbonilico è termodinamicamente favorito rispetto a quello olefinico a pressione atmosferica; tuttavia in alcuni casi (esafluoroacetilacetonati) i complessi Cu(hfacac)(olefina) (olefina = norbornene, 4-vinilanisolo) sono risultati favoriti rispetto al complesso carbonilico, per lo meno a 298,3 K. Dato che parte di questo lavoro di Tesi verte su complessi olefinici e carbonilici di Cu (I) si rimanda alle Conclusioni una discussione più generale su queste reazioni di scambio CO/olefina su complessi di rame (I).
2.6 Scopo della Tesi
Sulla base dei dati riportati è stato considerato interessante indagare ancora più a fondo la dipendenza dal legante ancillare della stabilità dei complessi olefinici di rame (I). Per fare questo abbiamo scelto di usare come legante il bis-(3,5-dimetil)pirazolilmetano. In questo caso, trattandosi di un legante neutro, avrebbe portato alla formazione di composti cationici di formula generale [Cu(CH2(3,5-Me2Pz)2)(olefina)]+. Un tale studio ci avrebbe quindi permesso di vedere la rilevanza che può assumere la carica del complesso sulla reazione di scambio CO/olefina.
D’altra parte la scarsità di dati presenti in letteratura riguardo a complessi di metalli al centro della transizione, e la necessità di ampliare il quadro degli andamenti generali muovendosi nella transizione, ha portato alla scelta di indagare la possibilità di effettuare reazioni di scambio CO/olefina in complessi di ferro e cobalto e di studiare i loro eventuali equilibri.
3. RISULTATI E DISCUSSIONE
Allo scopo di rendere più chiara la presentazione degli argomenti trattati, questo capitolo della tesi sarà discusso in tre parti, riguardanti rispettivamente i complessi di rame (I), ferro (II) e cobalto (I).
3.1 Rame(I) bis(3,5-dimetilpirazolil)metano
3.1.1 Sintesi di Cu(OTf)·0,5(PhCH3)
Il composto Cu(OTf)·0,5(PhCH3) è stato ottenuto da Cu2O e (CF3SO2)2O in toluene in presenza di acqua, secondo l’equazione 20.
Cu2O + (CF3SO2)2
H2O/PhCH3
2 Cu(OTf)·0,5(PhCH3) (20)
Il composto incolore così ottenuto diventa bruno se tenuto a temperatura ambiente, ma può essere conservato indefinitamente a -30 °C:
La struttura allo stato solido di questo composto non è nota, ma si può ragionevolmente assumere che possa essere simile a quella descritta in letteratura29 per il composto tetranucleare Cu4(CF3CO2)4(C6H6)2 riportato in Figura 13. Avremmo quindi una struttura contenente gruppi triflato a ponte fra due atomi di rame a loro volta coordinati al doppio legame della molecola di toluene che quindi si comporterebbe da legante η4- a ponte fra due atomi di rame (Figura 14).
Figura 13: Diagramma ORTEP30 del complesso Cu4(CF3COO)2(C6H6)2. SOCF3 O O O O SOCF3 Cu Cu Cu Cu O O O O SOCF3 SOCF3 CH3 C H3
Figura 14: Disegno schematico della struttura proposta per Cu(OTf)·0,5(PhCH3).
3.1.2 Sintesi di CH2(3,5-Me2Pz)2
Mentre i poli(pirazolil)borati sono stati ampiamente usati come leganti in numerosi studi31, la chimica di coordinazione dei loro analoghi neutri, i poli(pirazolil)metani, è molto meno sviluppata, come riportato in alcune review recenti 32. Inoltre, i lavori riportati in letteratura sono rivolti alla sintesi, caratterizzazione e proprietà di sistemi
anche se sono presenti due studi interessanti su complessi di rame(I) effettuati da Chou e collaboratori34,35. Nel primo34 è riportato uno studio di diffrazione di raggi X su cristallo singolo di un composto di rame contenente, nello stesso cristallo, un derivato di rame(I), [CuI(H2CPz2)(MeCN)2](ClO4), e uno di rame(II), [CuII(H2CPz2)2(ClO4)2], (Figura 15A). Nello stesso lavoro si riporta anche la sintesi di un complesso bis-chelato di Cu(I), [Cu(H2CPz2)2](ClO4), ottenuto a partire da [Cu(MeCN)4](ClO4) e H2CPz (Figura 15B).
(A) (B)
Figura15: Diagrammi ORTEP del “co-cristallo” [CuI(H2CPz2)(MeCN)2](ClO4)/
[CuII(H2CPz2)2(ClO4)2] (A), e del complesso [Cu(H2CPz2)2](ClO4) (B);
Gli ioni ClO4- sono omessi per maggiore chiarezza.
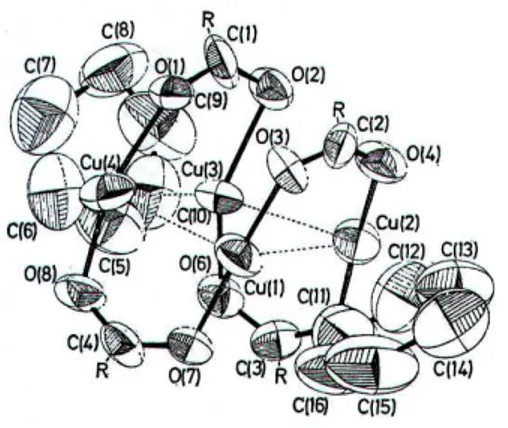
Il lavoro successivo35 descrive la sintesi di due complessi carbonilici di rame (I) con 3,5-dimetilbispirazolilmetano come legante, [Cu(H2CPz2’)(CO)(OClO3)] e [(Cu(H2CPz2’)(CO))2(µ-pirazina)](ClO4)2, ottenuti per carbonilazione a temperatura ambiente dei corrispondenti complessi Cu(I)–acetonitrile, [Cu(H2CPz2’)(MeCN)](ClO4), equazione 21, Figura 16A, e [(Cu(MeCN)(H2CPz2’))2(µ-pirazina)](ClO4)2 (equazione 22, Figura 16B).
[Cu(H2CPz2’)(MeCN)](ClO4) + CO (21) [Cu(H2CPz2’)(CO)(OClO3)] + MeCN
[(Cu(H2CPz2’)(CO))2(µ-pirazina)](ClO4)2 + CO (22) [(Cu(H2CPz2’)(CO))2(µ-pirazina)](ClO4)2 + MeCN
(A) (B)
Figura 16: Diagrammi ORTEP dei complessi [Cu)(H2CPz2’)(CO)(OClO3)] (A), e
[(Cu(H2CPz2’)(CO))2(µ-pirazina)](ClO4)2 (B); Gli ioni ClO4- sono omessi per maggiore chiarezza.
Da notare che la distanza Cu-Operclorato è di 2,240(3) Å, un valore appena superiore a quello massimo riportato36 per un legame singolo Cu(I)-ossigeno, che risulta pari a 2,230 (4) Å.
Il bispirazolilmetano usato in questo lavoro di Tesi è stato ottenuto trattando il 3,5-dimetilpirazolo (dmp) commerciale con Bu4NBr, KOH, e K2CO3 in CH2Cl2 al riflusso del solvente per 45 ore, secondo la seguente reazione (equazione 23).
2 3,5-Me2Pz + 2 Bu4NBr + CH2Cl2 + KOH
K2CO3
(23)
K2CO3
Tale sintesi è stata condotta secondo una modifica della procedura riportata in letteratura, impiegando Bu4NBr al posto di Bu4N(HSO4): il solido ottenuto è stato separato dal Bu4NCl per ricristallizzazione da eptano a caldo.
3.1.3 Sintesi dei complessi [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf
In letteratura 37 sono noti da lungo tempo complessi di formula generale Cu[BH(RnPz)3](L) (L = CO, etilene)38. Recentemente, nel laboratorio dove è stato eseguito questo lavoro di Tesi sono stati effettuati numerosi tentativi di preparare complessi tris(pirazolil)borati di rame (I) contenenti olefine quali cicloottene, norbornene, etc, usando due diverse strategie: preparazione del complesso carbonilico, seguito da sostituzione di CO da parte dell’olefina; sintesi diretta da alogenuri di rame (I), tris(pirazolil)borato e olefina. Nel primo caso non è stata osservata alcuna reazione, mentre nel secondo caso si è formata la specie dinucleare Cu2[BH(3,5-Me2Pz)3]2, come mostrato in equazione 24.
2CuI + 2 K[BH(3,5-Me2Pz)3] Cu2[BH(3,5-Me2Pz)3]2 + 2 KI (24)
L’insuccesso di tali preparazioni è stato attribuito all’ingombro sterico dell’anione tris(pirazolil)borato, il quale impedisce la coordinazione di olefine più grandi dell’etilene. D’altra parte, come già anticipato nell’Introduzione, complessi contenente il legante bis(pirazolil)borato, di formula generale Cu[BH2 (3,5-Me2Pz)2](olefina)28 sono stati preparati in buone rese.
Alla luce di questo ci è sembrato opportuno preferire il legante bis(pirazolil)metano al tris(pirazolil)metano per ottenere complessi olefinici stabili con i quali studiare le reazioni di carbonilazione.
I derivati olefinici del rame(I) bis(3,5-dimetilpirazolil)metano sono stati preparati per reazione di Cu(OTf)·0,5(PhCH3) con il legante CH2(3,5-Me2Pz)2 in presenza di olefina (equazione 25).
Cu(OTf)·0,5(PhCH3) + CH2(3,5-Me2Pz)2 + olefina (25) [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf + 0,5 PhCH3 olefina = norbornene, 4-vinilanisolo.
Per quanto riguarda il norbornene, la reazione è stata condotta in toluene, con immediata precipitazione del prodotto. Il solido, ottenuto con alta resa (82 %) è stato ricristallizzato da una miscela CH2Cl2 / eptano ed è risultato moderatamente sensibile all’aria.
La reazione con il 4-vinilanisolo è stata invece condotta in CH2Cl2, solvente nel quale il composto è ben solubile, ed il solido è stato ricristallizzato da una miscela CH2Cl2 / eptano. Abbiamo osservato che utilizzando toluene o eptano, come nella reazione precedente con norbornene, il prodotto precipita come un olio verde di difficile purificazione.
Un altro composto utilizzato come prodotto di partenza è stato il complesso [Cu(CH2(3,5-Me2Pz)2)](OTf), isolato recentemente nel laboratorio dove è stato condotto questo lavoro di Tesi, secondo la reazione riportata nell’equazione 26.
Cu(OTf)·0,5(PhCH3) + CH2(3,5-Me2Pz)2 (26)
[Cu(CH2(3,5-Me2Pz)2)](OTf) + 0,5 PhCH3
La determinazione della struttura allo stato solido mediante diffrazione di raggi X su cristallo singolo39, ha mostrato che il composto è dinucleare coni due leganti pirazolilmetano a ponte tra i due atomi di rame, coordinazione che non era mai stata osservata in precedenza per complessi di metalli di transizione con tale tipo di legante.
Figura 17: Struttura del complesso [Cu2(CH2(3,5-Me2Pz)2)2](OTf)2 CH2Cl2. Un anione triflato, gli
atomi di idrogenoe la molecola di diclorometano sono stai omessi per chiarezza.
La sintesi dei complessi olefinici a partire da [Cu(CH2(3,5-Me2Pz)2)](OTf) secondo la reazione riportata nell’equazione 27 purtroppo non ha dato i risultati sperati dato che in nessun caso è stata osservata reazione ed è sempre stato recuperato il prodotto di partenza (identificato via 1H-NMR).
[Cu(CH2(3,5-Me2Pz)2)](OTf) + olefina (27)
[Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf olefina = norbornene, 4-vinilanisolo, fumaronitrile.
Allo scopo di indagare ulteriormente la reattività di tale composto, abbiamo deciso di provare la reazione di carbonilazione a 25 °C in sim-tetracloroetano ma anche in questo caso il complesso dimerico si è dimostrato scarsamente reattivo, in quanto il rapporto COass/Cu è risultato pari a 0,2.
Visto che sia il complesso carbonilico sia i complessi olefinici sono stati preparati e caratterizzati40 per altra via, si deve concludere che la scarsa reattività del complesso [Cu(CH2(3,5-Me2Pz)2)](OTf) può essere dovuta al fatto che, anche in solventi di
bassa polarità come sim-tetracloroetano o idrocarburi, esso mantiene la struttura dinucleare dotata di una reattività molto limitata.
3.1.4 Caratterizzazione dei complessi [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf
Stato solido
La struttura dei composti [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf può essere ritenuta analoga a quella del complesso [Cu(CH2(3,5-Me2Pz)2)(cicloottene)]OTf riportata in Figura 18 40:
Figura 18: Struttura ai raggi X del complesso [Cu(CH2(3,5-Me2Pz)2)(cicloottene)]OTf.
La coordinazione dell’atomo di rame è trigonale planare distorta, con 2 legami Cu-N, il legame con il doppio legame olefinico, ed un legame Cu-Otriflato che si dispone quasi perpendicolarmente al piano di coordinazione del rame. In particolare è interessante notare che la distanza Cu-Otriflato pari a 2,437(2) Å: questo fa si che il complesso possa essere considerato una specie neutra. Nonostante ciò, il composto [Cu(CH2(3,5-Me2Pz)2)(cicloottene)](OTf) in sim-tetracloroetano ha una conducibilità
pensare che in soluzione sia il composto con il cicloottene che quelli con il norbornene e il 4-vinilanisolo siano presenti come coppia ionica parzialmente dissociata.
Spettri IR
Gli spettri IR dei composti olefinici (Figure 19 e 20) sono caratterizzati dalle bande di assorbimento tipiche del legante pirazolilmetano (2926, 1556, 1465, 1420, 1390, 1152, 1027, 966, 677 cm-1) e dell’olefina coordinata; le bande intense nella zona tra 1290 e 1020 cm-1 sono state assegnate alla specie “CF3SO3” coordinata al rame.
4000,0 3600 3200 2800 2400 2000 1800 1600 1400 1200 1000 800 650,0 67,2 68 70 72 74 76 78 80 82 84 86 88 90 92 94 96 98,3 cm-1 %T 2925,63 1608,10 1557,60 1509,04 1465,33 1392,87 1243,28 1151,52 828,15 755,17 734,23 681,13 660,38
Figura 20: Spettro IR di [Cu(CH2(3,5-Me2Pz)2)(van)]OTf.
Mentre non è stato possibile assegnare la banda di stiramento del legame C=C del norbornene coordinato, la banda di assorbimento a 1608 cm-1 nello spettro IR di [Cu(CH2(3,5-Me2Pz)2)(van)]OTf (Figura 20) è stata attribuita al doppio legame del 4-vinilanisolo. La frequenza di stiramento C=C risulta quindi spostata di 38 cm-1 rispetto a quanto riportato per il 4-vinilanisolo libero. Questo abbassamento della frequenza nell’olefina coordinata è dovuto alla retrodonazione dal metallo agli orbitali di antilegame dell’olefina, che conseguentemente porta ad un indebolimento del legame C=C.
Spettri 1H-, 13C-NMR
Gli spettri NMR dei composti olefinici sono caratterizzati dai segnali relativi all’olefina coordinata e dai segnali tipici del legante bis(pirazolil)metano (tabelle 4 e 5). Lo spettro 1H-NMR di quest’ultimo presenta due picchi nella zona tra compresa
tra 2, 5 e 2,0 ppm relativi ai protoni dei gruppi CH3, un picco relativo ai protoni dei gruppi CH nella zona compresa tra 6,5 e 6,0 ppm, ed un picco relativo ai protoni dei gruppi CH2 a circa 5,9 ppm. Analogamente, le risonanze presenti nello spettro 13 C-NMR sono state completamente assegnate come mostrato nella tabella 5.
Nelle Figure 21 e 22 sono riportati gli spettri 1H-NMR e 13C-NMR del complesso con norbornene:
H1 H1 H2 H2 H4 H4 H4 H4 H3 H3 N N N N Hc Hc Hc Ha Ha Ha Hd Hd Hc Hc Hc Ha Ha Ha Hb Hb Cu O H1 H1 H1 H6 H5 H4 H3 H2 H2 H3 N N N N Hc Hc Hc Ha Ha Ha Hd Hd Hc Hc Hc Ha Ha Ha Hb Hb Cu (A) (B)
(A) [Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf (B) [Cu(CH2(3,5-Me2Pz)2)(van)]OTf
Gruppo Atomi di idrogeno δ (ppm) Gruppo Atomi di idrogeno δ (ppm) Ha,c 12 2,45-2,10 Ha,c 12 2,39-2,12 Hb 2 6,29 Hb 2 6,15 Hd 2 5,91 Hd 2 5,89 H1 2 5,33 H1 3 3,78 H2 2 3,17 H2 3 7,34 H3, H4 6 1,8-1,0 H3 3 6,83 H4 1 6,44 H5 1 4,78 H6 1 5,08
Tabella 4: Assegnazione delle risonanze degli spettri 1H-NMR
Cf Ca Ca Cf Cd Cc Cb N N Ce N N Cd Cc Cb Cu C1 C1 C2 C3 C2 C4 C4 Cf Ca Ca Cf Cd Cc Cb N N Ce N N Cd Cc Cb Cu C1 O C7 C6 C5 C4 C3 C2 C3 C4 (A) (B)
(A) [Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf (B) [Cu(CH2(3,5-Me2Pz)2)(van)]OTf
Gruppo Atomi di Carbonio δ (ppm) Gruppo Atomi di carbonio δ (ppm) Ca,f 2 11,3-13,8 Ca,f 2 13,5-10,9 Cb,d 2 150,9-142,0 Cb,d 2 150,9-142,1 Cc 2 107,2 Cc 2 106,9 Ce 1 57,7 Ce 1 57,7 C1 2 104,5 Cf 2 13,5 C2 2 45,3 C1 1 55,4 C3 1 43,9 C2 1 158,7 C4 2 25,1 C3,4,5 5 129,3-114,6 C6 1 58,6 C7 1 24,5-26,1
Tabella 5: Assegnazione delle risonanze degli spettri 13C-NMR
per i complessi [Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf e [Cu(CH2(3,5-Me2Pz)2)(van)]OTf.
Analizzando lo spettro 1H-NMR del complesso con il norbornene coordinato, è interessante notare che il picco relativo ai protoni vinilici (H1, δ = 5,3 ppm) risulta spostato a campi alti rispetto a quello del norbornene libero che, nello stesso solvente, appare a δ = 6,0 ppm. Questo fatto è spiegabile ricordando che nel norbornene non coordinato i protoni si trovano nel cono di deschermo creato dagli elettroni π del doppio legame; allorché il norbornene si coordina al rame, la donazione di elettroni π
dall’olefina al metallo diminuisce questo effetto di deschermo, cosìcché i protoni risuonano a campi più alti rispetto all’olefina non coordinata.
Questo effetto si registra anche per quanto riguarda il complesso con il 4-vinilanisolo, per il quale i picchi relativi ai protoni vinilici (H4, δ = 6,4 ppm; H6, δ = 5,1 ppm; H5,
δ = 4,8 ppm) risultano spostati a campi alti rispetto a quelli del 4-vinilanisolo libero che, nello stesso solvente, appaiono a δ = 6,6 ppm, 5,5 ppm e δ = 5,0 ppm rispettivamente.
Analogamente a quanto detto per gli spettri 1H-NMR, anche nel caso degli spettri 13
C-NMR è possibile osservare uno spostamento a campi più alti del segnale relativo agli atomi di carbonio del doppio legame olefinico. In particolare, per quanto riguarda il complesso con il norbornene, il segnale relativo agli atomi di carbonio suddetti si trova a 104,5 ppm, mentre per il norbornene libero, nello stesso solvente, tale segnale cade a 135 ppm. Nel caso del complesso con il 4-vinilanisolo invece non è stato possibile fare un confronto completo, in quanto il segnale relativo ad uno dei due atomi di carbonio olefinici è parzialmente sovrapposto a quello del solvente (THF-d8).
3.1.5 Reazioni di scambio CO/olefina
Gli studi delle reazioni di scambio CO/olefina (equazione 28) sono stati condotti misurando il volume di monossido di carbonio sviluppato durante la carbonilazione. In particolare tali misure sono state effettuate introducendo una quantità nota del complesso [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf in una beuta contenente solvente presaturato con monossido di carbonio alla temperatura voluta, la cui pressione parziale è mantenuta costante tramite rifornimento continuo dalla bombola.
Per ragioni di solubilità dei complessi, il solvente scelto è stato il sim-tetracloroetano, La reazione considerata per il calcolo delle costanti di equilibrio è quella riportata nell’equazione (28).
[Cu(CH2(3,5-Me2Pz)2)(olefina)]OTfsolv + COsolv (28) [Cu(CH2(3,5-Me2Pz)2)(CO)]OTfsolv + olefinasolv
La costante di equilibrio relativa alla carbonilazione dei complessi olefinici è data dall’equazione 29: eq ] solv [CO eq ] solv OTf (olefina)] 2 Pz) 2 Me (3,5 2 [[Cu(CH eq ] solv [olefina eq ] solv (CO)]OTf 2 Pz) 2 Me (3,5 2 [[Cu(CH eq K − − = (29)
La tensione di vapore del sim-tetracloroetano, Ptce, è stata calcolata usando l’equazione di Clapeyron con i coefficienti ricavati dalla letteratura41 (equzione 30):
T tce e P 6 , 4988 58 , 18 − = (30)
La pressione parziale di monossido di carbonio (PCO) è stata ricavata per differenza tra la pressione atmosferica al momento della misura (Patm) e la tensione di vapore del sim-tetracloroetano (Ptce) alla temperatura impostata (equazione 31).
tce atm
CO P P
P = − (31)
Le concentrazioni molari all’equilibrio di olefina, [olefinasolv]eq, e del complesso
carbonilico, [[Cu(CH2(3,5-Me2Pz)2)(CO)]OTfsolv]eq, sono state ricavate direttamente
dal volume di CO assorbito dal sistema (VCO) tenendo conto della pressione parziale
di CO (PCO), della temperatura e del volume della soluzione (Vsol) (equazione 32).
sol CO CO eq solv 2 2 2 eq solv RT V P V ] (CO)]OTf Pz) Me (3,5 [Cu[(CH ] [olefina ⋅ ⋅ = − = (32)
La concentrazione molare all’equilibrio di [Cu(CH2(3,5-Me2Pz)2)(olefina)]OTf,
[composto olefinico]eq, è stata calcolata per differenza tra la sua concentrazione
molare iniziale, [composto olefinico]in, e la concentrazione molare all’equilibrio del
complesso carbonilico formatosi, [composto carbonilico]eq (equazione 33).
eq in
eq [compostoolefinico] [compostocarbonilico]
olefinico]
[composto = − (33)
La concentrazione di monossido di carbonio in soluzione usata per i calcoli è pari a 4,9 x 10-3 M 42 e questo valore è stato considerato costante dato il range piuttosto ristretto di temperature esaminate.
Sia nel caso del norbornene che del 4-vinilanisolo si è deciso di effettuare la misura della costante di equilibrio, Keq, a diverse temperature, in maniera tale da poter
ricavare i parametri termodinamici di reazione ∆G°r, ∆H°r e ∆S°r dal grafico di Van’t
Hoff, secondo le equazioni 34 e 35:
∆G°r = -RT × ln Keq (34)
∆G°r = ∆H°r - T ∆S°r (35)
Dato che le misure di conducibilità di una soluzione di [Cu(CH2
(3,5-Me2Pz)2)(cicloottene)]OTf in sim-tetracloroetano hanno mostrato una conducibilità
paragonabile a quella di una soluzione di Bu4NBr nello stesso solvente alla stessa
concentrazione, possiamo ritenere che le misure di scambio avvengano su composti formalmente cationici di rame (I).
Per le reazioni di carbonilazione dei complessi con norbornene e 4-vinilanisolo sono stati ricavati i dati riportati nelle tabelle 6 e 7 rispettivamente:
T (K) [[Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf]in (M) CO/Cu 278,6 13,4 · 10-3 0,63 288,2 11,0 · 10-3 0,64 298,2 11,2· 10-3 0,62 307,7 11,0 · 10-3 0,58 318,3 9,0 · 10-3 0,58
Tabella 6: Risultati ottenuti per la reazione di carbonilazione di [Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf.
T (K) [[Cu(CH2(3,5-Me2Pz)2)(van)]OTf]in (M) CO/Cu
278,6 6,4 · 10-3 0,94
288,2 9,4 · 10-3 0,86
298,2 10,6· 10-3 0,85
307,7 7,8 · 10-3 0,73
Tabella 7: Risultati ottenuti per la reazione di carbonilazione di [Cu(CH2(3,5-Me2Pz)2)(van)]OTf.
R2 = 0,9471 -3 -2,5 -2 -1,5 -1 -0,5 0 275 285 295 305 315 325 T (K) ∆ G ( k J m o l-1 )
Figura 23: Grafico di Van’t Hoff per la reazione di carbonilazione di [Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf.
Dal grafico di Van’t Hoff per i complessi presi in esame sono stati ricavati i parametri termodinamici riportati in tabella 8:
Olefina ∆H° (kJ mol-1) ∆S° (J mol-1 K-1)
Norbornene -13 ± 1 -38 ± 5
4-vinilanisolo - 40 ± 10 -120 ± 36
Tabella 8: Parametri termodinamici ricavati per i complessi [Cu(CH2(3,5-Me2Pz)2)(nbe)]OTf e [Cu(CH2(3,5-Me2Pz)2)(van)]OTf.
Come si può notare dall’analisi dei dati ottenuti le reazioni sono esotermiche in entrambi i casi, e questo è in accordo con i dati relativi alle reazioni di scambio CO/olefina per tutti gli altri complessi di rame (I) presenti in letteratura (Vedi Conclusioni). E’ quindi confermato il fatto che il legame Cu-CO sia più forte del legame Cu-olefina.
Il valore entalpico è più negativo per il 4-vinilanisolo rispetto al norbornene, ad indicare una minore stabilità relativa del primo rispetto al secondo. Questo è in accordo con quanto trovato per i complessi di formula generale Cu(hfacac)(olefina), e, tenendo contro dell’analogia tra norbornene e cicloottene, per i complessi di formula generale Cu(CF3CO2)(olefina) e Cu[BH2(3,5-(CF3)2Pz)2](olefina).
Per il resto della discussione sui dati di equilibrio di complessi si rimanda ad una trattazione completa che verrà riportata nelle Conclusioni di questo lavoro di Tesi.
3.2 [FeCp(CO)
2L]BF
4, L = CO, olefina
3.2.1 Derivati olefinici e carbonilici di Fe(II)
Come già anticipato nell’Introduzione, la scarsità di dati presenti in letteratura riguardo a complessi di metalli al centro della transizione e la necessità di ampliare il quadro degli andamenti generali muovendosi nella transizione, ha portato alla scelta di indagare la possibilità di effettuare reazioni di scambio CO/olefina con complessi di ferro (II). In letteratura infatti non si trovano studi di scambi CO/olefina su questo centro metallico, mentre sono note le sintesi dei complessi [FeCp(CO)3]+ e dei
complessi [Fe(CO)2(olefina)]+. Ci è quindi sembrata interessante la possibilità di
indagare la reazione di scambio CO/olefina su entrambi questi complessi (equazioni 36 e 37).
[Fe(CO)2(olefina)]+ + CO [FeCp(CO)3]+ + olefina (36)
[FeCp(CO)3]+ + olefina [FeCp(CO)2(olefina)]+ + CO (37)
Nello Schema 2 sono riportate le procedure sintetiche utilizzate per la preparazione dei vari composti di ferro. Il prodotto di partenza è stato il derivato commerciale Fe2Cp2(CO)4, dal quale è stato preparato FeCp(CO)2I, impiegato come precursore dei
derivati olefinici, [FeCp(CO)2(olefina)]+. Per reazione di FeCp(CO)2I con AgBF4 in
THF è stato ottenuto il derivato cationico [FeCp(CO)2(THF)]+, utilizzato come
Schema 2: Sintesi di derivati olefinici e carbonilici di Fe(II)
3.2.2 Sintesi di FeCp(CO)2I
La sintesi del complesso FeCp(CO)2I è stata effettuata secondo quanto suggeritoci
dal Prof. Zanotti dell’Università di Bologna (equazione 38).
Fe2Cp2(CO)4 + I2 2 FeCp(CO)2I (38)
La reazione è stata condotta per 30 minuti al riflusso del solvente (CHCl3), e ha
portato al recupero di un solido nero stabile all’aria, che è stato caratterizzato via 1 H-NMR. Questo prodotto è stato impiegato come precursore per tutte le sintesi successive.
3.2.3 Sintesi di [FeCp(CO)2(olefina)]BF4
In letteratura esistono diversi metodi di sintesi dei complessi di formula generale Fe[Cp(CO)2(olefina)]BF4.
Il primo di questi 43 consiste in una sintesi da Fe2Cp2(CO)4 in tre stadi: durante il
primo si effettua una pre-ossidazione del composto iniziale con [Ph3C]BF4, il cui
eccesso viene poi distrutto nel corso del secondo stadio per aggiunta di cicloeptatriene (con formazione di trifenilmetano e sale di tropilio); infine il
Fe2Cp2(CO)4
FeCp(CO)2I
[FeCp(CO)2(THF)]BF4
composto intermedio ottenuto viene trattato con l’olefina per dare il composto finale (equazione 39).
Fe2Cp2(CO)4
Ph3CBF4 CHT olefina
[FeCp(CO)2(olefina)]BF4 (39)
Olefina = norbornadiene, 1-eptene.
Tuttavia le rese di questa sintesi non superano il 30 %, in quanto assieme al prodotto desiderato si forma, con rese attorno al 50 %, il composto carbonilico [FeCp(CO)3]BF4, probabilmente in seguito alla decomposizione di Fe2Cp2(CO)4
nello stadio di ossidazione.
Il secondo metodo44 impiega come precursore del complesso olefinico il composto [FeCp(CO)2(THF)]BF4 secondo la reazione riportata nell’equazione 40.
[FeCp(CO)2(THF)]BF4 + olefina [FeCp(CO)2(olefina)]BF4 + THF (40)
Olefina = 1,5-cicloottadiene, 1,4-cicloesadiene, norbornadiene, cicloottatetraene,cicloottene, cicloesene, etilene.
Tuttavia, per ottenere rese soddisfacenti, è necessario l’uso di BF3 gassoso
nell’ambiente di reazione: con questo accorgimento la resa con cicloesene passa dal 17 al 92 %.
In un recente lavoro, H. S. Clayton e collaboratori45 hanno effettuato la sintesi dei complessi olefinici suddetti trattando FeCpCO2I con AgBF4 in CH2Cl2 per generare
la specie insatura FeCp(CO)2+, la quale viene poi trattata con olefina a dare
[FeCp(CO)2(olefina)]BF4, secondo quanto riportato nello Schema 3.
FeCpCO2I AgBF4 [FeCp(CO)2]+ olefina [FeCp(CO)2(olefina)]BF4 Schema 3
Impiegando quest’ultimo metodo si ha anche formazione di [(FeCp(CO))2I][BF4];
tuttavia la semplicità del metodo, che non prevede stadi di preossidazione o impiego di specie gassose, ha fatto preferire questa via di sintesi per i composti olefinici di ferro(II).
Sintesi di [FeCp(CO)2(1-esene)]BF4
La sintesi di questo complesso ha portato all’isolamento di un solido cristallino giallo moderatamente stabile all’aria con una resa del 23 %.
Lo spettro IR in CH2Cl2, che mostra bande a 2079 e 2031 cm-1 assegnate alle
vibrazioni di stiramento del CO coordinato, e lo spettro 1H-NMR corrispondono a quelli riportati in letteratura45.
Sintesi di [FeCp(CO)2(cicloottene)]BF4
Il complesso con cicloottene, che non è noto in letteratura, è stato preparato con lo stesso metodo impiegato per il complesso con 1-esene. La resa è pari al 31 % ed il solido giallo risulta moderatamente stabile all’aria. Lo spettro IR in CH2Cl2 mostra
due bande assegnate alle vibrazioni di stiramento carbonilico a 2069 e 2029 cm-1. Lo spettro 1H-NMR in CDCl3 mostra un singoletto relativo ai protoni del sistema
ciclopentadienilico a 5,5 ppm ed un multipletto tra 5,3 e 5,1 ppm relativo ai protoni vinilici; i protoni allilici ed alifatici mostrano risonanze nella zona compresa tra 1,7 e 1,2 ppm.
3.2.4 Sintesi di Fe[Cp(CO)2(THF)]BF4
Il complesso [FeCp(CO)2(THF)]BF4 è stato sintetizzato secondo la reazione riportata
nell’equazione 41.
In questa reazione AgBF4 è usato per generare il composto coordinativamente ed
elettronicamente insaturo [FeCp(CO)2]+, il quale in presenza di THF porta alla specie
satura [FeCp(CO)2(THF)]+. In letteratura sono riportate varie reazioni che utilizzano
questo complesso come intermedio per la sintesi di altri derivati ciclopentadienilici di ferro(II). Ad esempio, il THF coordinato può essere spostato da fosfine, anilina, e in alcuni casi da olefine (meglio se in presenza di BF3) con alte rese.
La reazione è stata condotta con una leggera modifica rispetto alla procedura riportata in letteratura, in quanto AgI è stato allontanato subito dopo la reazione per filtrazione, ed il solido rosso è stato ricristallizzato da eptano.
Lo spettro IR di stato solido del prodotto isolato, che mostra due bande di stiramento carbonilico a 2065 cm-1e 2019 cm-1, e lo spettro 1H-NMRcorrispondono a quelli riportati in letteratura.
3.2.5 Sintesi di [FeCp(CO)3]BF4
In letteratura sono riportati diversi metodi di sintesi del catione tricarbonilico di ferro (II) a partire da Fe2Cp2(CO)4; tuttavia tutte le reazioni sono caratterizzate da basse
rese e tempi lunghi.
Kumar e collaboratori46 hanno trattato il composto di partenza con Hg(BF4)2 in
acetone gorgogliando monossido di carbonio nell’ambiente di reazione (equazione 42).
Fe2Cp2(CO)4 + Hg(BF4)2
CO
2[FeCp(CO)3]BF4 + Hg (42)
Nonostante siano necessari tempi superiori a 48 ore la resa è di circa il 90 %.
In un ulteriore studio, Callan e collaboratori47 hanno impiegato AgBF4 per ossidare
Fe2Cp2(CO)4 + 2 AgBF4 2 Ag + [FeCp(CO)3]BF4 + “FeCp(CO)BF4”
Schema 4
La reazione è rapida, ma la resa è inferiore al 30 % a causa della formazione di un composto non ben determinato indicato come “FeCp(CO)BF4”.
Infine, Johnson e collaboratori48 hanno riportato una reazione nella quale viene impiegato Fe(ClO4)3 come ossidante (equazione 43).
Fe2Cp2(CO)4 + Fe(ClO4)3 + NaBPh4 (43)
[FeCp(CO)3]BPh4 + Fe(ClO4)2 + NaClO4
Anche in questo caso, nonostante la reazione sia rapida, la resa non supera mai il 30%.
In questo lavoro di Tesi abbiamo condotto le reazioni di Callan e di Johnson ossia quelle che usano AgBF4 o Fe(ClO4)3 come ossidante di Fe2Cp4(CO)4, senza però
ottenere risultati soddisfacenti, in quanto gli spettri IR delle soluzioni dopo reazione non mostrano le bande degli stiramenti carbonilici tipici del complesso [FeCp(CO)3]BF4 a 2074 e 2124 cm-1 (in CH2Cl2).
Abbiamo quindi ipotizzato di poter ottenere il complesso tricarbonilico a partire da FeCp(CO)2I, spostando lo ioduro con AgBF4 in atmosfera di monossido di carbonio
(equazione 44).
FeCp(CO)2I + AgBF4
CO
[FeCp(CO)3]BF4 + AgI (44)
La reazione è stata inizialmente condotta in due stadi: prima si è trattato lo ioduro con AgBF4 in THF ottenendo [FeCp(CO)2(THF)]BF4, la cui presenza in soluzione è
evidenziata da bande di stiramento CO a 2070 e 2022 cm-1. Quindi la soluzione tetraidrofuranica ottenuta è stata posta in atmosfera di monossido di carbonio, ma
dopo 24 ore lo spettro IR risultava praticamente inalterato suggerendo quindi che lo scambio THF/CO non aveva avuto luogo (Figura 24).
Figura 24: Spettro IR (THF) della soluzione di [FeCp(CO)2(THF)]BF4
dopo 24 h in atmosfera di CO.
Al fine di evitare che il THF potesse in qualche modo influenzare la reazione di scambio CO/THF, la sintesi è stata ripetuta in CH2Cl2, ma anche in questo caso il
prodotto di partenza rimaneva l’unico derivato carbonilico presente in soluzione. In effetti, è noto il letteratura49 che la conversione di [FeCp(CO)2(THF)]BF4 in
[FeCp(CO)3]BF4 richiede condizioni di reazione piuttosto drastiche sia di
temperatura (100 °C) che di pressione (90 atm) ed inoltre è piuttosto lenta.
Ritenendo comunque che il derivato [FeCp(CO)2(THF)]BF4 fosse un buon
precursore del composto tricarbonilico, abbiamo pensato di facilitare lo scambio THF/CO utilizzando un acido di Lewis in grado di estrarre il THF dalla sfera di coordinazione del ferro.
A questo proposito, abbiamo tenuto conto di quanto osservato da Reger e Coleman44 (vide infra) e dell’uso di BF3·OEt2 come acido di Lewis nella sintesi di complessi
arenici di molibdeno(I) a partire da fac−Mo(CO)3(DMF)3 con arene (equazione 45)50.
fac−Mo(CO)3(DMF)3 + 3 BF3·Et2O + arene (45)
Mo(η6−arene)(CO)3 + 3 BF3·DMF + 3 Et2O
arene = difenile, 1,3,5–trifenilbenzene, C6H5F,C6H5CF3.
Da notare poi che il composto BF3·Et2O è stato ulteriormente impiegato anche per la
preparazione dei complessi di formula generale Cr(η6−arene)(CO)3 (arene = bromo−
e iodobenzene) a partire da Cr(CO)3(γ−picolina)3. 51
Abbiamo quindi deciso di impiegare BF3·Et2O come acido di Lewis per spostare il
THF coordinato conducendo la reazione in CH2Cl2 (equazione 46).
[FeCp(CO)2(THF)]BF4 + BF3·Et2O CO (46) CO [FeCp(CO)3]BF4 + BF3·(THF) + Et2O
L’analisi dello spettro della soluzione, effettuato più volte nell’arco di 24 ore (Figura 25) evidenziava un aumento relativo di intensità della banda a 2127 cm-1, tipica di [FeCp(CO)3]BF4, ed una diminuzione di intensità della banda a 2024 cm-1, relativa a
[FeCp(CO)2(THF)]BF4. La banda a 2071 cm-1 presente nellospettro è invece dovuta
Figura 25: Spettro IR (CH2Cl2) dell’andamento della reazione di carbonilazione
di [FeCp(CO)2(THF)]BF4 in presenza di BF3·Et2O.
Dopo aver constatato che l’intensità delle bande di stiramento CO non mostravano più nessuna variazione di intensità e che la miscela di reazione mostrava abbastanza precipitato, abbiamo recuperato il solido e l’abbiamo identificato come [FeCp(CO)3]BF4 (Figura 26).
Con questo metodo il complesso tricarbonilico è stato recuperato come solido marrone moderatamente stabile all’aria, con una resa pari al 50%. Lo spettro IR allo stato solido presentava due bande di stiramento CO a 2124 e 2074 cm-1, come riportato in letteratura per [FeCp(CO)3]BF446.
3.2.6 Tentativo di reazione di [FeCp(CO)3]BF4 con olefine
Una volta ottenuto il complesso tricarbonilico di ferro (II), abbiamo indagato la reazione di scambio con olefina (equazione 47).
[FeCp(CO)3]BF4 + 1-esene [FeCp(CO)2(1-esene)]BF4 + CO (47)
Purtroppo, sia operando in CH2Cl2 che in CHCl3, lo spettro IR della soluzione
presentava soltanto le bande di stiramento CO (2074 e 2123 cm-1) relative al complesso tricarbonilico di partenza, mentre erano completamente assenti le bande relative al complesso olefinico [FeCp(CO)2(1-esene)]BF4.
3.2.7 Tentativo di carbonilazione di [FeCp(CO)2(olefina)]BF4
Vista l’impossibilità di indagare la reazione del tricarbonile di ferro (II) con olefina a causa di una probabile reazione di scambio molto lenta a temperatura ambiente, abbiamo deciso di studiare la reazione inversa (equazione 48), cioè lo spostamento dell’olefina coordinata da parte di CO.
[FeCp(CO)2(olefina)]BF4 + CO [FeCp(CO)3]BF4 + olefina (48)
Olefina = 1-esene, cicloottene.
La reazione è stata inizialmente eseguita in CH2Cl2, sia per [FeCp(CO)2
(1-esene)]BF4 che per [FeCp(CO)2(cicloottene)]BF4 ma l’analisi dello spettro IR della
ore in agitazione, ha evidenziato che lo spostamento dell’olefina coordinata non è avvenuto: lo spettro IR della soluzione mostrava infatti solamente le bande di assorbimento relative al composto olefinico di partenza.
Quindi la reazione è stata ripetuta in cloroformio a 25 °C registrando l’eventuale assorbimento di gas con l’apparecchiatura gas-volumetrica descritta nella Parte Sperimentale. Il risultato, contrariamente a quanto previsto, è stato un lento sviluppo di gas, probabilmente attribuibile alla decomposizione del complesso olefinico nel solvente di reazione [un leggero di sviluppo di gas si osserva a tempi lunghi anche nel trattamento di [FeCp(CO)3]BF4 con solventi clorurati]. A conferma del mancato
spostamento di 1-esene, lo spettro IR della soluzione non presenta bande di stiramento CO relative al complesso tricabonilico di ferro (II) ma solo quelle del composto olefinico introdotto.
Infine abbiamo eseguito la reazione in THF, solvente nel quale il composto olefinico è soltanto parzialmente solubile. Dopo aver saturato la soluzione con CO ed aver lasciato il tutto in agitazione per 15 ore, lo spettro IR del filtrato evidenziava la presenza delle bande di stiramento CO a 2123 e 2066 cm-1 relative a [FeCp(CO)3]BF4.
L’impossibilità di utilizzare THF (sia a causa della sua elevata volatilità, Pvap= 129
mmHg a 20 °C, che a causa del suo scarso potere solvente) come solvente per le misure gas-volumetriche, e l’instabilità dei complessi in idrocarburi alogenati quali cloroformio, non ci ha permesso di ricavare alcun dato termodinamico sulle reazioni di scambio CO/olefina per tali tipi complessi.
3.3 CoCpL
2, L = CO, olefina
3.3.1 Derivati olefinici e carbonilici di Co(I)
Ancora in seguito alla necessità di ampliare il quadro degli andamenti generali delle reazioni di scambio CO/olefina muovendosi nella transizione, abbiamo scelto di studiare complessi di cobalto. Come già riportato nell’Introduzione, in letteratura è stata ricavata la costante di equilibrio relativa allo spostamento di CO in Co2(CO)8 da
parte di norbornadiene a dare il complesso Co2(CO)6(nbd), pari a (6,7 ± 0,4)·10-4 a
35 °C. Per quanti riguarda i sistemi di cobalto (I) non sono noti studi termodinamici su derivati che danno equilibri di scambio CO/olefina. Proprio per questo abbiamo deciso di porre la nostra attenzione su composti di formula generale CoCp(diene) e CoCp(olefina)2, analizzando la possibilità di studiare la reazione di sostituzione
dell’olefina da parte di CO (equazioni 49 e 50), a dare il complesso CoCp(CO)2, un
prodotto ben noto, oppure la reazione di sostituzione di CO da parte di dieni sul complesso dicarbonilico (equazione 51).
CoCp(diene) + 2 CO CoCp(CO)2 + diene (49)
CoCp(olefina)2 + 2 CO CoCp(CO)2 + 2 olefina (50)
CoCp(CO)2 + diene CoCp(diene) + 2 CO (51)
Come riportato da Spencer e collaboratori52, il complesso dicarbonilico CoCp(CO)2
non è un buon precursore per la sintesi di complessi di cobalto (I), in quanto è inerte rispetto alla sostituzione di CO e spesso richiede temperature elevate o luce ultravioletta. Inoltre in queste condizioni spesso si ha formazione di derivati carbonilici bi- o poli-nucleari53.
Risulta invece più labile e quindi più utile il complesso CoCp(C2H4)2. Dai dati
riportati in letteratura circa la sua reattività, si evince che l’etilene coordinato può essere facilmente spostato da CO, fosfine, acetileni o olefine quali propilene. Inoltre il complesso bis-etilenico è impiegato come catalizzatore di ciclizzazione di alchini per ottenere areni (Schema 5A), e di co-ciclizzazione alchini/nitrili per ottenere piridine (schema 5B)54. CH R R' N R N R R' R N R R' N R' R R
+
+
CpCo(C2H4)+
CpCo(C2H4) 3 R R R R R R R R 2 (A) (B)Schema 5: Ciclizzazione di alchini (A) e co-ciclizzazione alchini/nitrili (B) catalizzata da CoCp(C2H4)2.
Un’ulteriore via per la sintesi di complessi olefinici e dienici di cobalto (I) è quella che prevede la riduzione di [CpCoI2]2 con amalgama di sodio in presenza di dieni
(1,3-butadiene; 1,3-cicloesadiene; 1,4 cicloottadiene) (Schema 6) 53:
[CoCpI2]2 I CpCo I CoCp - I2 solv [CoCp(solv)]
+
[CoCpI2] CoCp2+
CoI2 CoCp(diene) diene (A) (B) (C) (D)Come si può vedere la presenza di diene nell’ambiente di reazione interviene nel cammino di decomposizione di [CpCoI2]2 che porterebbe a cobaltocene e CoI2. Il
complesso (A) è in equilibrio con il complesso (B), il quale in presenza di solvente porta ad una specie di cobalto (I) (C), ed uno di cobalto (III) (D). In assenza di un legante stabilizzante, il frammento (C) attacca l’anello ciclopentadienilico della specie (A) o (B), portando a cobaltocene e CoI2. Tuttavia, se è presente un legante
coordinante come un diene si forma la specie stabile CoCp(diene). D’altra parte il frammento (D) può tornare in ciclo riformando il dimero (A) e producendo ulteriori frammenti di cobalto (I).
3.3.2 Sintesi di CoCp(C2H4)2
La sintesi di CoCp(C2H4)2 è stata realizzata in tre stadi, a partire da cloruro di cobalto
(II) esaidrato, CoCl2·6H2O, il quale è stato fatto reagire55 con ammoniaca gassosa in
acqua a 60 °C per ottenere Co(NH3)6Cl2, secondo l’equazione 52.
CoCl2·6H2O + 6 NH3
60 °C
Co(NH3)6Cl2 + 6 H2O (52)
Il solido marrone così ottenuto è stato fatto reagire con NaCp, preparato in situ da NaH e CpH, a 65 °C in THF, a dare cobaltocene (equazione 53)55.
Co(NH3)6Cl2 + 2 NaCp 65 °C
CoCp2 + 6 NH3 + 2 NaCl (53)
Durante la reazione si osserva sviluppo di ammoniaca gassosa. La soluzione così ottenuta è stata portata a secco ed il cobaltocene è stato recuperato per sublimazione come solido cristallino marrone scuro.
Infine CoCp2 è stato ridotto con potassio in presenza di etilene gassoso a -20 °C,
](https://thumb-eu.123doks.com/thumbv2/123dokorg/7237733.79267/18.892.166.799.799.934/tabella-dati-relativi-reazioni-sostituzione-complessi-tipo-olefina.webp)
![Figura 16: Diagrammi ORTEP dei complessi [Cu)(H 2 CPz 2 ’)(CO)(OClO 3 )] (A), e](https://thumb-eu.123doks.com/thumbv2/123dokorg/7237733.79267/23.892.197.782.371.597/figura-diagrammi-ortep-complessi-cu-cpz-co-oclo.webp)
 2 CH 2 Cl 2](https://thumb-eu.123doks.com/thumbv2/123dokorg/7237733.79267/26.892.367.597.169.462/figura-struttura-del-complesso-cu-ch-me-otf.webp)
![Figura 19: Spettro IR di [Cu(CH 2 (3,5-Me 2 Pz) 2 )(nbe)]OTf.](https://thumb-eu.123doks.com/thumbv2/123dokorg/7237733.79267/28.892.178.755.514.880/figura-spettro-ir-cu-ch-me-pz-otf.webp)