Diparti Diretto Diparti Diretto Diparti Diretto __________________________
CORSO D
M
“Ricostruzione
aortica con la t
c
CANDIDATO
Federico Del Re
ANNO
rtimento di Medicina Clinica e Sperimentale ttore Prof. Mario Petrini
rtimento di Patologia Chirurgica, Medica, Molecolare e de ttore Prof. Paolo Miccoli
rtimento di Ricerca Traslazionale e delle Nuove Tecnologi ttore Prof. Giulio Guido
__________________________________________
DI LAUREA SPECIALISTICA IN
MEDICINA E CHIRURGIA
ne dell’aorta ascendente e del
la tecnica di T. David: esperie
cardiochirurgia pisana”
RELATORE
CHIAR.MO PROF. Ube
NO ACCADEMICO 2013/2014
dell'Area Critica
gie in Medicina e Chirurgia _________________
IN
della valvola
rienza della
RE
berto Bortolotti
1
INDICE ANALITICO
INTRODUZIONE...3
CAPITOLO 1:
L’ANATOMIA CHIRURGICA DELLA RADICE AORTICA
Introduzione………...…...…..7 Anatomia………...…7 Dinamica………...18
CAPITOLO DUE:
LE PATOLOGIE DELLA RADICE AORTICA
Introduzione………...………..23 Dissezione aortica………....…...25 Aneurisma aortico………...42 CAPITOLO TRE: LE TECNICHE CHIRURGICHE Introduzione………...………..64 Tecniche chirurgiche………...65 Intervento di David-Feindel (TDI)……….75
2 CAPITOLO QUATTRO: ESPERIENZA PISANA Introduzione……….…….83 Materiale e metodi………....84 Risultati………..…...85 Discussione………88 Conclusioni………....91 Appendice……….93 INDICE BIBLIOGRAFICO………...98
3
INTRODUZIONE
7 settembre 1896: a seguito del coinvolgimento in una rissa in un parco a Francoforte, il ventiduenne Wilhelm Justus riportò una coltellata al torace. Ricoverato all’Ospedale Municipale inizialmente in buone condizioni, cominciò ad aggravarsi nell’arco di qualche ora. I medici diagnosticarono una ferita del cuore basandosi esclusivamente sull’esame fisico e, due giorni più tardi, il primario Ludwig Rehn decise di operarlo per cercare di salvargli la vita. Dopo aver inciso il torace e aperto il pericardio, il sangue e i coaguli ivi raccolti fuoriuscirono esponendo la superficie cardiaca su cui era ben visibile una lacerazione di un centimetro e mezzo dalla quale, ad ogni battito, usciva un getto di sangue. Rehn applicò tre punti di seta, chiuse il torace e il ragazzo si avviò verso una completa guarigione.
Era stato compiuto il primo intervento di cardiochirurgia.[1]
Nonostante fosse stata ormai sfatata la diffusa credenza che il cuore fosse stato messo oltre i limiti della chirurgia, dovettero passare svariati decenni perché la
cardiochirurgia diventasse una realtà consolidata e riproducibile.
Fra i problemi principali vi erano la mancanza di tecniche diagnostiche attendibili, non esistevano le trasfusioni di sangue, non era stato risolto il problema di come garantire la ventilazione dei polmoni a torace aperto e i chirurghi non padroneggiavano ancora le tecniche per suturare i vasi.
A partire dal 1894 Alexis Carrel iniziò i suoi studi sulla sutura dei vasi, fino a perfezionare la sua tecnica negli anni successivi, tanto che gli fu conferito il Premio Nobel nel 1912. Nei primi del ‘900 il patologo viennese Karl Landsteiner identificò i gruppi sanguigni, chiarendo così le basi immunologiche che stanno dietro la pratica delle trasfusioni. Per quanto concerne il problema della ventilazione polmonare a torace aperto, nel 1904 Ferdinand Sauerbruch introdusse il metodo della ventilazione “a pressione negativa”: questa consisteva nel mantenere espansi i polmoni del paziente ponendo il corpo del paziente stesso all’interno di una camera a pressione inferiore a quella atmosferica, mentre la testa rimaneva all’esterno consentendo di respirare aria ambiente. Modificando questa tecnica, Willy Meyer progettò la camera universale, che poteva funzionare sia secondo il modello di Sauerbruch, sia all’inverso: ponendo la testa del paziente all’interno di una scatola con aria a pressione superiore a quella atmosferica, i polmoni potevano essere insufflati mantenendo il corpo del paziente – e quindi l’équipe medica – all’esterno a normale pressione. Si dovette aspettare il 1909 perché Samuel Meltzer e John Auer
4
pubblicassero i loro risultati sulla tecnica dell’insufflazione oro-tracheale a pressione positiva; l’adozione di questa tecnica venne favorita dall’introduzione del laringoscopio. Per quanto riguarda invece le metodiche diagnostiche, nel 1929 Werner Forssmann eseguì su se stesso il primo cateterismo cardiaco, cosa che ebbe un notevole impatto non solo sulla diagnostica, ma anche sulla conoscenza della fisiologia e della fisiopatologia
cardiaca. Come spesso accade, però, la sua iniziativa non fu accolta con l’importanza che meritava, anzi, in ambito accademico fu severamente criticata, tanto che la sua carriera accademica fu troncata. Negli anni successivi i suoi studi furono ripresi da André Cournard Dickinson Richards, che dagli anni quaranta agli anni sessanta condussero ricerche sulla fisiopatologia del cuore e della circolazione polmonare, ricerche che gli valsero il Nobel nel 1956; Cournard fece in modo che il Nobel fosse assegnato anche a Forssmann dal momento che aveva ripreso i suoi studi e questo, anche se con qualche anno di ritardo, diede a Forssmann la gloria che meritava.
Nonostante la risoluzione di questi problemi, la cardiochirurgia ancora era limitata dal fatto che non era pensabile eseguire interventi a cuore aperto; la chirurgia del torace aveva avuto un grandissimo sviluppo nei primi decenni del ‘900, ma la terapia delle patologie acquisite del cuore si limitava alla resezione del pericardio per il trattamento della pericardite costrittiva.
Negli anni successivi cominciò ad affacciarsi a nuovi orizzonti, attraverso il trattamento chirurgico dell’embolia polmonare e della stenosi mitralica; per quanto riguarda
quest’ultima, nonostante i primi tentativi di dilatazione valvolare risalissero all’inizio del ‘900, si dovettero aspettare oltre 40 anni perché venisse accettata questa procedura. Fra gli anni trenta e la fine degli anni cinquanta, la legatura del dotto di Botallo di Robert Gross, la palliazione delle cardiopatie congenite cianogene realizzata
contemporaneamente da Crafoord e Blalock, assieme alla commissurotomia mitralica introdotta da Bailey, Harken e Brock, rappresentarono la massima espressione della cardiochirurgia.
Nonostante i progressi raggiunti fino a questo momento, la riparazione delle malattie delle valvole cardiache era ancora fuori dalla portata della chirurgia a cuore chiuso, se si fa eccezione per stenosi mitralica non complicata.
Fu solo con l’introduzione della circolazione extracorporea che la cardiochirurgia ebbe una nuova spinta raggiungendo nuovi obiettivi: il primo intervento in tal senso fu eseguito il 16 maggio 1953 a Filadelfia da John Gibbon.
5
Dopo una serie di insuccessi, la speranza verso questa tecnica si riaccese grazie a Walton Lillehei che corresse diverse cardiopatie congenite utilizzando la “circolazione crociata”: questa consisteva nell’utilizzare il cuore e i polmoni di un individuo adulto per pompare sangue ossigenato nel bambino sul cui cuore, temporaneamente escluso dalla circolazione, si stava intervenendo.
John Kirklin prima, e Richard DeWall dopo, misero a punto un’apparecchiatura per la circolazione extracorporea che semplificava molto l’esecuzione degli interventi, aprendo così le porte alla cardiochirurgia.
Iniziò così la chirurgia riparativa dei vizi valvolari; la correzione dell’insufficienza mitralica secondaria a prolasso dei lembi è stata realizzata da Carpentier, Duran e da altri, con un intervento di riposizionamento delle commissure della valvola associato a plicatura e rinforzo dei margini liberi dei lembi valvolari.
Con l’aumentare dell’esperienza si venne a dimostrare che la correzione di una particolare forma di insufficienza aortica secondaria a dilatazione degenerativa del tratto iniziale dell’aorta ascendente - condizione nota come ectasia anulo-aortica – con la tecnica classica era gravata da importanti complicanze a lungo termine: sostituendo infatti la valvola aortica con valvola artificiale e il tratto di aorta dilatato con un tubo protesico, si aveva a distanza di tempo la dilatazione del tratto residuo di aorta non rimosso.
L’innovazione arrivò nel 1968 con l’intervento di Bentall-De Bono, che consiste nella sostituzione in blocco di valvola aortica e aorta attraverso l’impianto di un tubo protesico valvolato, su cui vengono connessi gli osti coronarici [2]. Questa tecnica nel tempo ha subito alcune modifiche, fra cui una molto importante apportata da De Paulis che consiste nell’utilizzo di una protesi tubulare costruita in modo tale che la porzione prossimale riproduca la presenza dei seni di Valsalva, rendendo più fisiologica la struttura e la funzione della protesi.
Con l’introduzione degli studi ecocardiografici si è reso evidente che certi casi di insufficienza aortica sono secondari alla mancata coaptazione dei lembi valvolari a causa della dilatazione della radice aortica, mentre i lembi valvolari sono integri; sono state così introdotte tecniche che mirano alla sostituzione della radice aortica, risparmiando la valvola aortica, la cui continenza è ristabilita attraverso la ricostruzione di una normale geometria.
Il primo a proporre tale approccio fu Yacoub nel 1983, che ideò il rimodellamento della radice aortica: questo consiste nella rimozione dell’aorta ascendente salvaguardando
6
valvola aortica e un colletto di pochi millimetri di aorta, a cui viene suturato il tubo protesico opportunamente sagomato, e sul quale vengono reimpiantati gli osti coronarici. Nel 1992 Tirone David ha descritto la tecnica del reimpianto della valvola aortica [3]: questa consiste nella rimozione del tratto aneurismatico dell’aorta ascendente, con salvataggio della valvola aortica che viene reimpiantata all’interno del tubo protesico in modo da ricostruirne la normale geometria; anche in questo caso gli osti coronarici vengono reimpiantati sul tubo.
Risulta quindi evidente come la migliore conoscenza anatomica e soprattutto funzionale della radice aortica abbia rivestito un ruolo fondamentale nel comprendere la patologia di questa regione e soprattutto nella creazione di tecniche chirurgiche mirate alla sua riparazione: siamo giunti ad una fase in cui le conoscenze anatomiche e
fisiopatologiche vengono fuse insieme, di modo tale che le varie parti del cuore non sono più viste nella loro singolarità, ma vengono integrate fra loro all’interno di unità anatomo-funzionali, di cui il root aortico rappresenta un esempio.
Analizzeremo dunque l’evoluzione della sua definizione anatomo-funzionale, fino alla moderna concezione, le patologie che lo coinvolgono e le tecniche chirurgiche a disposizione per la sua riparazione.
7
CAPITOLO 1
INTRODUZIONE
Con il termine di aortic root, o radice aortica, ci si riferisce a quella regione che si estende per circa 3 cm dalla porzione di efflusso del ventricolo sinistro alla giunzione con la porzione ascendente dell’aorta.
Da un punto di vista anatomico si definisce “valvola aortica”, anche se è molto più complessa delle semplici tre cuspidi semilunari; è una struttura formata da molteplici componenti che si articolano e interagiscono fra loro: le tre cuspidi semilunari con i loro margini di inserzione sulle pareti aortica e ventricolare, i triangoli interleaflet, i seni di Valsalva, la giunzione sino-tubulare.
ANATOMIA
Rapporti
Osservando il cuore nella proiezione anteroposteriore si nota come la radice aortica rivesta una posizione centrale; la valvola aortica è adiacente ma posteriore e a destra rispetto alla polmonare, e con essa forma un angolo inclinato inferiormente.
All’interno della radice si osservano tre rigonfiamenti circondati da pericardio: sono i seni aortici o di Valsalva; due di questi danno origine alle arterie coronarie, e sono pertanto detti seno coronarico destro e sinistro, mentre il terzo è chiamato non coronarico. Da un
Fig. 1 Componenti della
8
punto di vista anatomico sono spesso chiamati anteriore, per la coronaria destra, posteriore sinistro per la coronaria sinistra e posteriore destro per il non coronarico; in ogni caso, i seni da cui hanno origine le coronarie sono quelli adiacenti alla valvola polmonare.
Vista la posizione centrale, il root prende rapporti complessi con le camere cardiache e le altre strutture.
La porzione di parete aortica che si frappone fra seno aortico coronarico destro e non coronarico e la parete anteriore dell’atrio destro fa si che questa protruda all’interno della cavità atriale formando il torus aorticus.
Questo rapporto deve essere tenuto ben in considerazione nel momento in cui si pratichino punture transettali o impianti di device per la riparazione di difetti del setto interatriale.
A differenza della valvola polmonare, che risulta essere interamente ancorata alla parete muscolare, quella aortica solo in parte è circondata da parete muscolare del
ventricolo sinistro, mentre la regione a cavallo della commissura fra la cuspide coronarica sinistra e la non coronarica prende rapporto con lo scheletro fibroso del cuore, formando quella che prende il nome di “continuità mitro-aortica”; il lembo antero-mediale della valvola mitralica prende rapporto con la valvola aortica, e a valvola aperta va a formare come un sipario che divide il tratto di inflow da quello di outflow del ventricolo sinistro.
Fig. 2 Questa immagine anatomica replica la
finestra ecocardiografica parasternale asse lungo e mostra come l'aortic root risulti essere il perno centrale dell'organo cardiaco e si estenda dalla base di attacco dei leaflets (frecce gialle), fino alla giunzione sino-tubulare (linea rossa tratteggiata)
Fig. 3 In questo preparato sono
stati asportati gli atri e i tronchi arteriosi; si apprezzano i seni di Valsalva: due coronarici dai quali emergono le coronarie (seni 1 e 2)ed uno non coronarico (3)
9
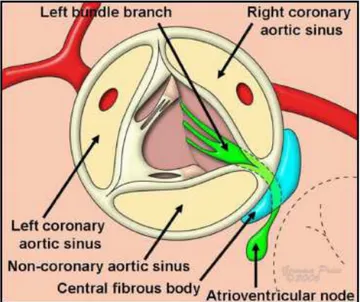
La zona fra seno non coronarico e seno coronarico destro è clinicamente molto importante, dal momento che le fibre del sistema di conduzione, partendo dal nodo atrio-ventricolare posto all’apice del triangolo di Koch, si portano ad attraversare questa regione formando il fascio di His che passa al di sotto del setto membranoso [4]. Un danno in questa zona può ledere temporaneamente o permanentemente il sistema di conduzione, rendendo necessario l’impianto di un pacemaker.
L’aortic root ha anche un intimo rapporto con il setto interventricolare, dal momento che sporge leggermente a destra sopra il setto; negli anziani questa relazione cambia dando una curvatura sigmoidea al setto interventricolare, cosa che rappresenta una normale variante che non deve quindi essere confusa con una cardiomiopatia ipertrofica.
Infine lo stretto rapporto con l’infundibolo sottopolmonare è dimostrato dalla facilità con cui infezioni batteriche si propagano fra le due valvole.
Giunzione ventricolo-arteriosa
Per anni si è cercato di definire in maniera universale cosa si intendesse per giunzione ventricolo-arteriosa, e soprattutto per anulus, ma la complessa anatomia della radice aortica ha reso difficile trovare una definizione da tutti accettata, tanto che ancora oggi la
questione è dibattuta.
Da un punto di vista strettamente linguistico, anulus altro non è che un anello, e lo stesso root può essere asportato interamente dal cuore e inserito al dito come un anello; ciò nonostante non è pensabile definire l’intero aortic root come anulus valvolare.
Fig. 4 L'illustrazione mostra la
localizzazione delle fibre di conduzione atrio-ventricolari, come vengono viste dal chirurgo lungo l'aortic root.
10
Comunemente col termine di anulus – o basal ring – ci si riferisce alla zona di transizione fra il ventricolo sinistro e l’aorta; nonostante questo sono possibili diverse definizioni: per il chirurgo corrisponde a quello che è chiamato “anulus chirurgico”, ed è rappresentato dalla linea di inserzione delle cuspidi della valvola aortica, a livello del quale vengono suturate le protesi valvolari; per l’anatomista invece è quella zona in cui il miocardio termina lasciando spazio alla parete aortica; per l’ecocardiografista infine corrisponde al piano passante per il punto più basso (nadirs) delle cuspidi valvolari. Nonostante sia ormai accettato che nessun anello fibroso possa essere isolato a livello di questa giunzione, il dibattito rimane ancora aperto [5].
Piuttosto che di anulus è quindi più opportuno parlare di giunzione ventricolo-arteriosa; dal punto di vista anatomico è il punto in cui la muscolatura miocardica del ventricolo sinistro cessa per continuarsi nella parete fibro-elastica dei seni di Valsalva; la precisa localizzazione di questa struttura non è identificabile, ma si può estrapolare
completando la linea circolare intorno al tratto di efflusso del ventricolo. Questo anello che si viene a formare è discordante con la morfologia della linea di inserzione semilunare delle cuspidi valvolari: infatti queste due strutture si vengono a intersecare fra di loro, di modo tale che i nadirs della linea di inserzione si vengono a trovare sotto la giunzione ventricolo-arteriosa, e in questa maniera segmenti di miocardio sono inclusi nei seni aortici. Ad essere interessati sono il seno della coronaria destra e la parte anteriore del seno coronarico sinistro, mentre la parte posteriore di questo e il seno non coronarico non contengono miocardio, essendo occupati dal tessuto fibroso che costituisce la continuità mitro aortica, che si ispessisce alle estremità a formare i trigoni fibrosi sinistro e destro (quest’ultimo contribuisce a formare il corpo fibroso centrale del cuore).
Fig. 5 L'illustrazione mostra
un aortic root sezionato. Si noti come l'attacco
semilunare dei leaflets valvolari contenga sia
porzione di parete aortica – a livello dei triangoli
interleafets – sia parete ventricolare – alla base di ogni singola cuspide
11
Risulta quindi che la giunzione ventricolo-arteriosa è approssimativamente formata per poco meno di metà della sua circonferenza da tessuto muscolare, e la restante parte da tessuto fibroso.
Questa giunzione anatomica, tuttavia, non coincide con la giunzione funzionale:
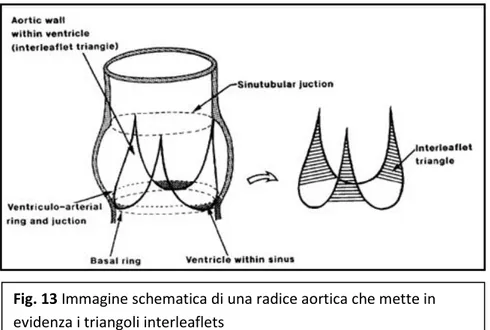
come accennato precedentemente, le cuspidi valvolari si inseriscono a livello della radice aortica con una linea di inserzione non circolare, ma a semiluna, che si estende dalla base della radice fino alla giunzione sino-tubulare; in questa maniera si vengono a delimitare delle regioni triangolari a base inferiore, detti triangoli interleaflet.
Vista questa particolare configurazione è evidente come la porzione di muscolatura ventricolare compresa nella base dei seni di Valsalva sia, a tutti gli effetti, funzionalmente incorporata nell’aorta, e alla stessa maniera i triangoli interleaflet, anatomicamente di pertinenza aortica, quando la valvola è chiusa si trovano ad essere, da un punto di vista emodinamico, parte del ventricolo sinistro. [6]
Fig. 6 Visione intraluminale della radice aortica aperta longitudinalmente:
la linea nera continua delimita la giunzione ventricolo-arteriosa; la line a nera tratteggiata delimita il limite prossimale di dissezione della radice. La freccia a doppia punta mostra la porzione di miocardio inclusa nella base del seno coronarico destro; la linea circolare tratteggiata delimita il setto membranoso
12
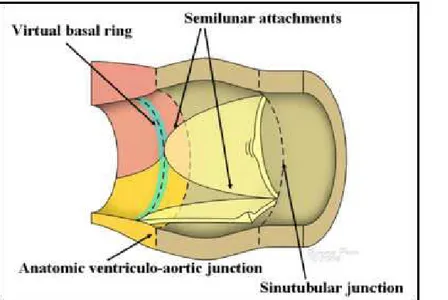
Concludendo, è possibile quindi distinguere tre diverse strutture:
• Virtual basal ring: linea che si viene a delineare unendo le parti più prossimali delle cuspidi della valvola aortica
• Giunzione ventricolo-arteriosa anatomica
• Giunzione ventricolo-arteriosa funzionale, a forma di corona a tre punte
Con lo sviluppo delle tecniche valve sparing si è resa necessaria la comprensione della giunzione ventricolo-arteriosa anche sul versante extraluminare dell’aortic root.
Da questo lato la giunzione corrisponde al punto in cui la radice si inserisce nel tessuto miocardico: dal lato del seno non coronarico e coronarico sinistro il limite per la dissezione prossimale del root corrisponde al tetto dell’atrio sinistro; questo limite è allo stesso livello o uno o due millimetri sotto i nadirs delle corrispondenti linee di inserzione delle cuspidi. Dal lato del seno coronarico destro, invece, il limite corrisponde al miocardio proveniente dal setto interventricolare, e si continua lateralmente nel tratto di efflusso del ventricolo destro; questo limite generalmente però non arriva al nadir della cuspide, la cui linea di inserzione si approfonda nel setto interventricolare. Di conseguenza, parte di miocardio è inclusa nella base del seno aortico di destra, e l’estensione di questa inclusione varia da cuore a cuore. [5]
Fig. 7 L'illustrazione mostra un
aortic root idealizzato: l'attacco delle cuspidi valvolari – in rosso – si estende per l'intera lunghezza del root, dalla giunzione sino - tubulare – in blu – sino all'anello basale virtuale – in verde –, prodotto dall'unione dei nadir di ogni singola cuspide. In giallo notiamo la giunzione ventricolo-arteriosa anatomica, incrociata dalla linea di attacco dei leaflets
13
Cuspidi aortiche e seni di Valsalva
Gli spazi compresi fra la superficie luminale dei tre rigonfiamenti della radice aortica e le loro corrispettive cuspidi valvolari prendono il nome di seni aortici di Valsalva, e sono delimitati prossimalmente dalla linea di inserzione delle cuspidi, mentre distalmente il confine è segnato dalla giunzione sino-tubulare; da un punto di vista funzionale i tre seni sono uguali fra loro, mentre anatomicamente è necessario operare una distinzione: due di questi danno origine alle arterie coronarie, e sono pertanto detti seno coronarico destro e sinistro, mentre il terzo è chiamato non coronarico. Da un punto di vista anatomico sono spesso chiamati anteriore, per la coronaria destra, posteriore sinistro per la coronaria sinistra e posteriore destro per il non coronarico; in ogni caso, i seni da cui hanno origine le coronarie sono quelli adiacenti alla valvola polmonare.
I due seni coronarici sono per la maggior parte costituiti da parete aortica anche se, come si è detto precedentemente, visto l’andamento della giunzione ventricolo-arteriosa anatomica che incrocia le linee di inserzione delle cuspidi valvolari, è presente alla basa una semiluna di tessuto miocardico.
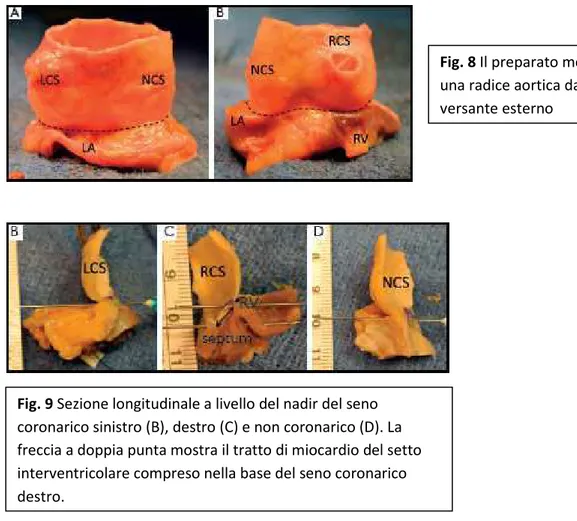
Fig. 8 Il preparato mostra
una radice aortica dal versante esterno
Fig. 9 Sezione longitudinale a livello del nadir del seno
coronarico sinistro (B), destro (C) e non coronarico (D). La freccia a doppia punta mostra il tratto di miocardio del setto interventricolare compreso nella base del seno coronarico destro.
14
Il seno non coronarico non presenta invece questa porzione muscolare, ma ha una parete esclusivamente fibrosa che entra a far parte di quella struttura che va a rappresentare la continuità mitro-aortica.
Ci sono evidenze che i vortici che si creano all’interno dei seni comportano una riduzione dello stress sulle cuspidi valvolari e supportano il flusso coronarico (vedi oltre). [7] Ognuna delle tre cuspidi che formano la valvola aortica normale presenta un margine libero ed uno che si inserisce sull’aortic root; quando la valvola si apre, i lembi si portano nei rispettivi seni, senza tuttavia occludere l’orifizio coronarico.
Il disegno tricuspidalico della valvola rappresenta la soluzione migliore per ottenere un’apertura della valvola a bassa resistenza; nessuna altra configurazione permetterebbe questo, come dimostrato nei soggetti portatori di valvola bicuspide.
Le linee di inserzione semilunari di due cuspidi adiacenti si incontrano a livello della giunzione sino-tubulare formando quelle che prendono il nome di commissure. Il corpo delle cuspidi è flessibile e più sottile nel giovane, anche se lo spessore non è uniforme.
Fig. 10 La radice aortica è stata
aperta e i leaflets sono stati rimossi, mostrando la loro linea di inserzione semilunare; la linea tratteggiata indica la giunzione ventricolo-arteriosa anatomica
Fig. 11 Immagine schematica di un
15
La lunghezza del margine libero eccede la distanza intercommissurale, disposizione che permette la perfetta coaptazione senza pieghe durante la diastole ventricolare. Inoltre permette la mobilità del lembo così come la completa apertura durante la sistole. [8]
Sul versante ventricolare si osserva una zona che si estende per tutta la larghezza della cuspide e per un terzo della lunghezza, detta lunula, che rappresenta il punto di coaptazione delle cuspidi: queste infatti quando la valvola si chiude non si mettono in rapporto attraverso il margine libero, bensì attraverso il margine inferiore di questa regione a livello della quale si osserva un rigonfiamento detto nodulo di Aranzio che occupa il 60% della parte inferiore della lunula. Con la valvola in posizione chiusa si ha la separazione fra il sangue contenuto in cavità ventricolare e quello contenuto in aorta. Non sono rare, soprattutto negli anziani, delle fenestrature a livello delle lunule; tuttavia la continenza valvolare non ne risente in quanto queste sono localizzate superiormente rispetto alla linea di chiusura.
Talvolta, però, larghe fenestrazioni si estendono oltre la linea di chiusura, comportando una significativa insufficienza valvolare.
Con il passare degli anni le cuspidi si fanno più spesse e rigide: questo aumento di spessore si fa più prominente dopo i 50 anni, quando il nodulo di Aranzio diviene spesso circa il doppio rispetto alla lunula, e questa è almeno il 25% più spessa della parte media della cuspide. Inoltre, la cuspide posteriore risulta più spessa di quelle destra e sinistra. [9]
Ogni cuspide presenta una faccia leggermente corrugata sul versante aortico, e una più liscia sul versante ventricolare.
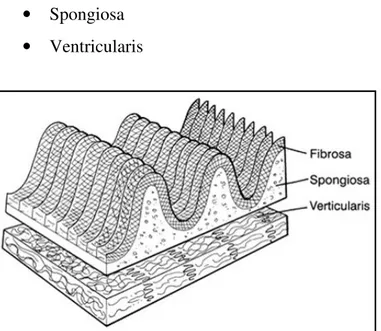
Dal punto di vista istologico, le cuspidi sono composte essenzialmente da collagene, fibre elastiche e glicosaminoglicani, che sono i principali costituenti delle tre lamine:
• Fibrosa o arteriosa • Spongiosa
• Ventricularis
Fig. 12 Immagine schematica dei
differenti strati dei foglietti valvolari; la lamina fibrosa corrugata facilita l’allungamento in direzione radiale
16
A livello della lunula la parete si ispessisce, soprattutto a livello del nodulo di Aranzio, dove si ritrova un ammasso di tessuto elastico.
La superficie endoteliale che riveste le valvole non presenta un punto di demarcazione preciso, ma si continua nelle pareti aortica e ventricolare in un continuum.
Triangoli interleaflet
Sotto ogni commissura troviamo i triangoli interleaflet, con apice a livello della giunzione sino-tubulare e base a livello della giunzione atrio-ventricolare, che consistono
istologicamente in parete aortica, ma emodinamicamente rappresentano un’estensione del tratto di efflusso del ventricolo sinistro.
Questi si proiettano sopra il ventricolo come le punte di una corona, in potenziale comunicazione con spazi extracardiaci.
Rispetto alle zone circostanti, i triangoli hanno una parete più sottile e contengono meno fibre collagene
Il triangolo fra il seno non coronarico e il coronarico sinistro è parte della zona fibrosa che forma la continuità mitro-aortica: se si rimuove si viene a formare una comunicazione col seno trasverso del pericardio, che si estende fra la radice aortica e la parete anteriore degli atri.
Il triangolo fra il seno non coronarico e il coronarico destro è in diretta continuità con la porzione membranosa del setto interventricolare; la parte inferiore incrociando la
Fig. 13 Immagine schematica di una radice aortica che mette in
17
valvola tricuspide viene ad essere divisa in una porzione atrioventricolare e una interventricolare.
La parte superiore del triangolo, invece, se rimossa crea una finestra fra il tratto di efflusso del ventricolo sinistro e la parte destra del seno trasverso del pericardio.
Il terzo triangolo, fra i due seni coronarici, è il meno esteso dei tre. Una volta rimosso si viene a creare una comunicazione fra il tratto di efflusso subaortico e il tessuto che separa il root dall’infundibolo polmonare.
Giunzione sinu-tubulare
Il limite più distale dell’aortic root è rappresentato dalla giunzione sinu-tubulare, punto in cui la porzione tubulare dell’aorta si unisce alla porzione sinusale.
All’interno si osserva generalmente una cresta leggermente rialzata sulla parete. La giunzione non è perfettamente circolare, ma ricalcando i contorni dei seni aortici assume una forma a trifoglio.
L’area della giunzione aumenta con l’età e con l’aumento della massa miocardiaca, intendendo questa come secondaria a quadri di ipertensione. [10]
Questa giunzione è parte integrante del meccanismo valvolare: ogni dilatazione a questo livello può comportare un’incompetenza valvolare.
18
DINAMICA
Dimensioni
Nonostante le semplificazioni che nel corso degli anni sono state fatte, con l’introduzione delle tecniche chirurgiche valve sparing si è resa necessaria una comprensione più
profonda e dettagliata del root aortico; che le strutture all’interno della radice non avessero dimensioni simili era già da tempo noto, ma molti autori consideravano queste differenze insignificanti [11].
In realtà l’aortic root non è una struttura cilindrica, ma i suoi diametri cambiano nei diversi piani di sezione; inoltre, durante il ciclo cardiaco le dimensioni e la conformazione della radice subiscono delle modifiche.
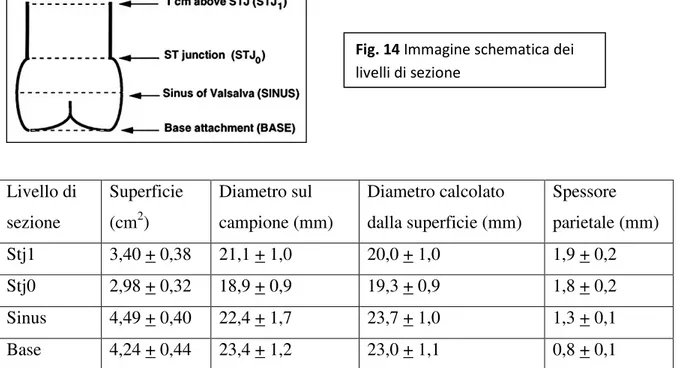
Sezionando il root a quattro differenti livelli, ossia alla base di attacco delle cuspidi, al centro dei seni, alla giunzione sino tubulare e un centimetro al di sopra di questa,
Kunzelman et altri [12] hanno dimostrato come il diametro – e quindi l’area di sezione – vari, di modo tale che sia massimo a livello dei seni di Valsava, e minimo a livello della giunzione sino tubulare (tab. 1); lo spessore di parete pure cambia, essendo massimo un centimetro sopra la giunzione sino tubulare.
Livello di sezione Superficie (cm2) Diametro sul campione (mm) Diametro calcolato dalla superficie (mm) Spessore parietale (mm) Stj1 3,40 + 0,38 21,1 + 1,0 20,0 + 1,0 1,9 + 0,2 Stj0 2,98 + 0,32 18,9 + 0,9 19,3 + 0,9 1,8 + 0,2 Sinus 4,49 + 0,40 22,4 + 1,7 23,7 + 1,0 1,3 + 0,1 Base 4,24 + 0,44 23,4 + 1,2 23,0 + 1,1 0,8 + 0,1
Berdajs e collaboratori [13] hanno dimostrato come anche i seni di Valsalva non siano uguali fra di loro: analizzando 25 cuori hanno dimostrato come esista un pattern costante nella loro dimensione, per cui il seno coronarico destro risulta essere più grande
Fig. 14 Immagine schematica dei
19
del non coronarico, a sua volta maggiore rispetto al coronarico sinistro; e questo rapporto non è casuale, ma si è visto essere una costante della radice aortica.
Le misure prese in considerazione comprendono la distanza intercommissurale, il volume del seno e l’altezza; analizzando in particolare quest’ultima è stato possibile elaborare un modello geometrico che mostra come il piano della giunzione sino tubulare sia inclinato rispetto alla base della radice aortica di un angolo di 5,47°: è stato così possibile
identificare il vettore dell’aortic root, che risulta passare con questa inclinazione attraverso il triangolo interleaflet sinistro.
Le differenze nei diametri del root, nelle dimensioni dei seni aortici e le caratteristiche del vettore hanno un ruolo fondamentale nell’emodinamica. Dinamica del root aortico
Il root aortico, e in particolare i seni di Valsalva, subiscono diverse modificazioni durante il ciclo cardiaco [14]: il perimetro dei seni è massimo durante la fase precoce della sistole, diminuisce durante il resto della sistole e aumenta nuovamente durante la diastole.
I seni appaiono infatti sotto il controllo di due opposti stimoli che si combinano fra di loro: la risposta passiva dell’aorta alla pressione e la risposta attiva della base della valvola alla contrazione ventricolare. In sistole l’aumento di pressione aumenta il diametro a livello delle commissure, mentre la base delle cuspidi tende a ridursi per la contrazione del ventricolo; il risultato netto deriva dal fattore dominante, che può essere qualunque di questi.
Al contrario, durante la diastole si osserva una riduzione del diametro alle commessure e un aumento a livello della base.
Fig. 15 Questa immagine mostra le
differenti altezze dei seni
coronarico destro (hj) e coronarico
sinistro/non coronarico (ho) che
determinano l’angolo fra la giunzione sino tubulare e la base
20
Questo cambiamento è associato alla riduzione del raggio di curvatura dei seni del 16% [14] [15] passando da sistole a diastole, e si accompagna anche a riduzione del 10% del diametro. [5]
L’espansione del root comincia prima dell’eiezione, durante la contrazione isovolumetrica: in questa fase si assiste a una rapida espansione circonferenziale a partire dalla giunzione ventricolo-arteriosa, e a seguire della sino tubulare e dell’aorta ascendente [16]; nella prima l’espansione non è uniforme, ma è maggiore nel settore comprendente la porzione muscolare rispetto a quello comprendente la porzione fibrosa; l’espansione diviene massima durante il primo terzo dell’eiezione. [5] [17]
In contrasto con ciò, l’espansione circonferenziale della giunzione sino tubulare e la longitudinale sono uniformi nelle regioni destra, sinistra e non coronarica.
La fase di eiezione si divide in due momenti: nel precoce, che occupa il terzo iniziale, si assiste alla massima espansione del root a tutti i livelli; si passa da un assetto a cono rovesciato che caratterizza la fase terminale della diastole ad una forma più
tendenzialmente cilindrica. [16]
Contemporaneamente la giunzione ventricolo-arteriosa è sottoposta a una contrazione circonferenziale, non omogenea, dal momento che le sezioni sinistra e destra si contraggono maggiormente rispetto alla non coronarica.
In aggiunta, durante questa fase si assiste ad una torsione in senso orario dei seni sinistro e non coronarico, e una in senso antiorario del destro. [17]
Durante i due terzi finali dell’eiezione si assiste ad una riduzione del volume del root, dapprima lenta e successivamente rapida ad ogni livello. [16]
La diastole è divisibile in due fasi: nella prima metà si ha una riduzione delle dimensioni del root a tutti i livelli, mentre nella seconda metà si ha una riespansione: questa cambia a seconda del livello, in quanto a livello basale e delle commessure si ha una riespansione, mentre l’area della giunzione sino tubulare e dell’aorta ascendente continua a diminuire. [16]
Inoltre si verifica una torsione opposta a quella che caratterizza la sistole. [17] Dinamica valvolare
Vista la dinamicità del root, appare evidente come considerare la valvola aortica una struttura isolata che si muove passivamente seguendo solo il variare di un gradiente pressorio sia alquanto riduttivo; la valvola va considerata nel suo insieme come facente
21
parte di un’unità anatomo-funzionale, e vedremo come questa concezione abbia un risvolto pratico capace di influenzare le scelte chirurgiche sulla regione dal momento che questo insieme influenza anche la durabilità della valvola.
Le proprietà della valvola aortica devono essere tali da consentirne l’apertura con minime differenze di pressione trans valvolare, e allo stesso tempo occorre che si verifichi in diastole una completa chiusura con minima inversione di flusso.
Le tensioni che si sviluppano sulla valvola consentono alle cuspidi di allungarsi in
direzione radiale permettendo una corretta coaptazione, mentre i movimenti verso il basso sono piuttosto limitati.
Allo stesso modo, occorre che si mettano in atto dei meccanismi di riduzione delle tensioni per far si che la funzionalità della valvola sia più duratura; se questi meccanismi non sono correttamente funzionanti la tensione che viene esercitata sulle cuspidi non può essere ridotta, e questo comporta un danno all’endotelio delle cuspidi, danno direttamente proporzionale alla tensione stessa.
I meccanismi che vengono messi in atto per ridurre la tensione sono due: in primo luogo il mutuo supporto delle cuspidi durante la coaptazione consente di distribuire lo stress lungo i margini e gli angoli delle commissure; l’altro meccanismo consiste nel cambiamento del raggio di curvatura dei seni di Valsalva che diminuisce del 16% passando da sistole a diastole. [14]
Brewer descrisse l’espansione del root aortico a livello commissurale come parte indispensabile per una corretta apertura della valvola e per ridurre lo stress sulle cuspidi [18].
Gnyaneshwar et al [19] hanno dimostrato che l’apertura della valvola precede
l’applicazione di qualsiasi pressione positiva come conseguenza della dilatazione del root; infatti l’aumento sostanziale del diametro avviene prima dell’apertura della valvola, come dimostrato anche precedentemente da Pang et al. [20]
De Paulis ha evidenziato come i seni di Valsalva siano necessari per una corretta e
completa apertura della valvola in presenza di un flusso turbolento, che in assenza dei seni provocherebbe un’apertura sub ottimale e una riduzione dell’area dell’orificio, soprattutto in presenza di un’elevata gittata cardiaca. [21]
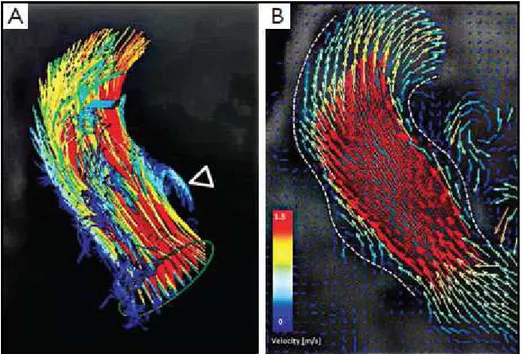
Per quanto riguarda il meccanismo di chiusura, già Leonardo Da Vinci intuì l’importanza dei seni di Valsalva [22], e identificò i vortici che qui si formano come facenti parte del meccanismo.
22
Secondo la vortex theory, infatti, i seni di Valsalva funzionano come reservoir e
favoriscono la formazione di piccoli vortici che determinano la completa espansione delle cuspidi e ne facilitano la chiusura [23]: durante l’ultima parte della fase eiettiva i vortici spingono le cuspidi in modo che l’angolo alla base diventi più ottuso e arrotondato. Oltre a questo, i seni di Valsalva rivestono un ruolo anche nel facilitare l’ingresso del sangue all’interno degli osti coronarici.
Fig. 16 Immagine acquisita con RMN flow-sensitive time-resolved 4D che
23
CAPITOLO 2
INTRODUZIONE
Vista la complessità della radice aortica risulta riduttivo attribuire la patologia
esclusivamente alla valvola, e quindi considerare come uniche opzioni terapeutiche la sostituzione valvolare; abbiamo visto che il root è un’unità anatomo-funzionale in cui interagiscono e cooperano fra di loro diverse strutture per garantire un corretto
funzionamento della regione, e proprio per questo qualunque di queste componenti può danneggiarsi e rendersi responsabile di un quadro di insufficienza aortica.
Al fianco delle cuspidi valvolari, classicamente ritenute le responsabili del quadro patologico, troviamo i bordi della radice, ossia le giunzioni ventricolo-arteriosa e la sino tubulare, che nel loro insieme formano l’anulus aortico funzionale (FAA).
A dimostrazione dell’importanza di queste strutture nella patologia aortica, Padial et al ha dimostrato come la dilatazione della radice aortica correli con la gravità del rigurgito aortico, e ha studiato la sua progressione nel tempo. [24]
Analogamente, in uno studio che prendeva in considerazione sono le valvole bicuspidi, Keane ha mostrato la correlazione fra le dimensioni della radice aortica e l’insufficienza valvolare. [25]
Il meccanismo che lega la dilatazione del FAA con l’insufficienza valvolare è la dislocazione verso l’esterno delle cuspidi con diminuzione della coaptazione centrale. [5] Alla luce di questo, e sulla scia di quanto fatto da Carpentier per la valvola mitrale [26], El Khoury e collaboratori [27] [28] hanno proposto una classificazione funzionale
dell’insufficienza aortica, tendendo in considerazione le diverse componenti che possono risultare deficitarie - FAA e cuspidi – e le possibili opzioni terapeutiche.
Distinguiamo così tre tipi di insufficienza aortica:
• Tipo I: normale movimento valvolare associato a dilatazione del FAA o a perforazione dei lembi valvolari
o Ia: dilatazione della giunzione sino tubulare o dell’aorta ascendente o Ib: dilatazione dei seni di Valsalva e della giunzione sino tubulare o Ic: dilatazione della giunzione ventricolo-arteriosa
24
• Tipo II: prolasso dei lembi valvolari come risultato di eccessivo tessuto nei lembi o distruzione delle commissure
• Tipo III: retrazione dei lembi valvolari, che può essere trovata nella valvola bicuspide, nelle patologie degenerativa o reumatica, come conseguenza di
calcificazioni, ispessimento o fibrosi delle cuspidi; questo comporta che una o più cuspidi non raggiunge la vicina per consentire una coaptazione corretta
Ovviamente i diversi quadri possono presentarsi isolati in un singolo paziente o essere diversamente combinati per contribuire al fenotipo finale.
La chirurgia valve sparing ha come target primario quelle patologie che caratterizzano la classe I, ossia le situazioni che si giovano della sostituzione della radice aortica, associato o meno a riparazione della valvola ma non alla sua sostituzione. Fra queste spiccano gli aneurismi e le dissezioni.
25
DISSEZIONE AORTICA
Generalità
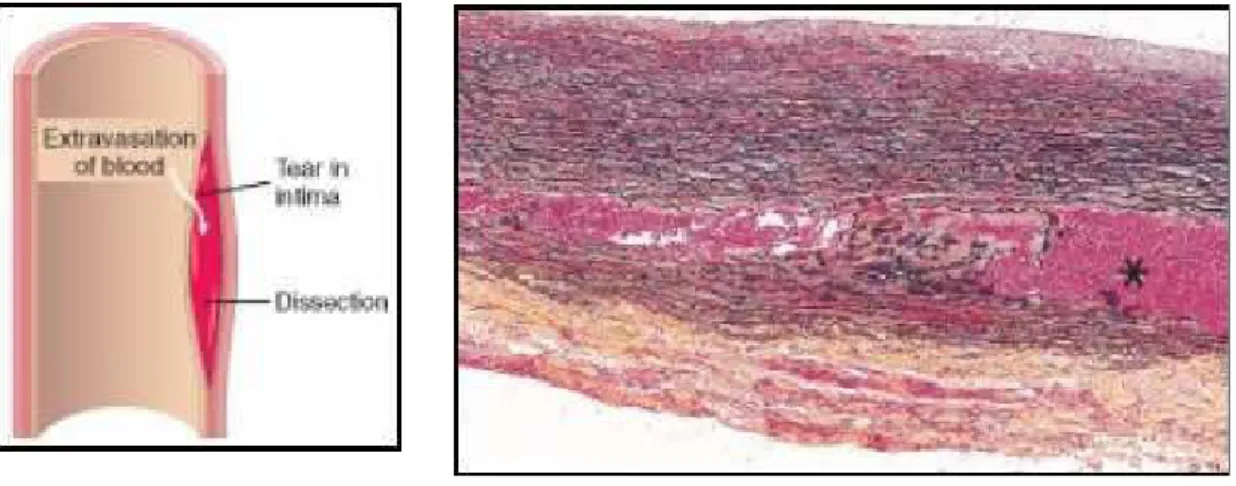
Con ematoma dissecante – o dissezione aortica – si intende un processo patologico
consistente in una raccolta ematica nello spessore della tonaca media di un’arteria elastica, che ne dissocia le strutture lamellari, si estende lungo il vaso potendo così stenosare
l’imbocco di collaterali, e tende infine ad aprirsi, o verso l’interno con una breccia intimale o verso l’esterno con una breccia nell’avventizia, con conseguenze estremamente diverse. Dal momento che non necessariamente si verifica la dilatazione dell’arteria, il vecchio termine di aneurisma dissecante è stato abbandonato.
La dissezione aortica acuta è l’evento che colpisce l’aorta gravato dalla maggiore letalità; rispetto alla rottura di un aneurisma dell’aorta, una corretta diagnosi è fatta meno
regolarmente. Questa difficoltà riflette la rarità della patologia e la variabilità di presentazione, che mima diversi quadri acuti medici e chirurgici.
La precisa incidenza della dissezione aortica è quindi difficile da stimare, anche in virtù del fatto che molti casi rimangono non diagnosticati a causa della morte improvvisa che
determinano (è responsabile del 2-3% delle morti improvvise), e pertanto l’incidenza è sottostimata di circa il 50%.
Si stima che nella popolazione globale si attesta intorno a 3 casi per 100000 persone all’anno [29].
Fig. 17 A destra immagine schematica di dissezione; a sinistra preparato istologico che
26
In tutti gli studi è colpito in misura maggiore il sesso maschile, con un rapporto M:F variabile da 2:1 a 4:1 [30]; questo divario tende ad appiattirsi, così che intorno ai 75 anni l’incidenza nei due sessi risulta pressoché uguale [31].
La dissezione aortica presenta un picco di incidenza bimodale: più del 90% dei casi si verificano in uomini fra i 40 e i 60 con storia di ipertensione; il secondo gruppo di pazienti è invece più giovane, e rappresentato da soggetti portatori di anomalie, sistemiche o localizzate, del tessuto connettivo.
27
Eziologia
La causa di gran lunga più frequente di dissezione è rappresentata dall’aortopatia
degenerativa, come dimostrato dalla correlazione epidemiologica fra queste due situazioni e dall’analisi istologica della media aortica dei tratti non dissecati.
Come detto in precedenza, un altro nesso di fondamentale importanza è quello con l’ipertensione, per due motivi: in primo luogo perché la stessa ipertensione è causa di aortopatia degenerativa, e in secondo luogo perché spesso è un episodio ipertensivo a causare la lacerazione dell’intima e l’inizio del processo di dissecazione.
Altre possibili cause sono rappresentate dalla gravidanza, durante o dopo la quale per motivi sconosciuti si può assistere a dissezione dell’aorta o dei suoi rami; lacerazioni iatrogene dell’intima durante procedure interventistiche o nel punto di anastomosi. Arteriti e aterosclerosi possono provocare un indebolimento della media e dilatazione della parete, ma la presenza di dissezione è rara in quanto la presenza di fibrosi rende difficilmente scollabili gli strati della tonaca media; un caso a parte è rappresentato per l’aterosclerosi dall’ulcera penetrante, che invece può indurre la penetrazione di sangue oltre l’intima, fino alla media.
Una causa importante è rappresentata dai traumi chiusi del torace, in cui a seguito della brusca decelerazione l’aorta tende a lacerarsi, soprattutto nel punto in cui si inserisce il legamento arterioso.
A seguito della formazione della lesione nell’intima e negli strati interni della media, il sangue dal lume vero entra a pressione attraverso la breccia, provocando lo scollamento degli strati della media; nonostante la notevole forza d’urto, il sangue avrebbe difficoltà a generare un simile danno se non ci fosse una condizione predisponente come quelle dette prima.
Lo slaminamento avviene al confine fra i due terzi interni e il terzo esterno della tonaca muscolare, in quanto a questo livello si assiste al passaggio dalla zona interna irrorata attraverso l’intima e quella esterna irrorata attraverso i vasa vasorum, anche se può interessare pure strati più esterni.
Se non sono presenti esiti cicatriziali in grado di fermarla, la dissezione prosegue, sia in direzione anterograda che in direzione retrograda, fino in genere alla formazione di una breccia di uscita.
Talvolta, il sangue che provoca lo scollamento ha una forza tale da provocare la
28
grande da indurre una compressione del vero lume, e può determinare una dilatazione del diametro del vaso (situazione che prende il nome di aneurisma dissecante).
La raccolta ematica tende a farsi strada rompendo una seconda volta la parete arteriosa, o a livello nuovamente dell’intima, formando in questo caso una breccia di rientro con cronicizzazione della dissezione, o a livello del versante avventiziale, con conseguente exitus del paziente quasi inevitabile.
Anatomia patologica
Da un punto di vista macroscopico, in una dissezione si osservano tre lesioni elementari: • Breccia di entrata: è la lacerazione a livello dell’intima e degli strati interni della
media, attraverso cui il sangue si fa strada nella parete del vaso. Morfologicamente può avere un aspetto lineare – lacerazione netta, trasversale rispetto all’asse del vaso – o a stella, e quindi con bordi frastagliati.
• Dissecazione della media:
• Breccia di uscita: in caso di breccia di rientro si viene a formare una condizione di dissezione cronica, nella quale il falso lume va in contro a un processori
endotelizzazione divenendo indistinguibile dal vero lume, configurando il quadro che in passato veniva definito aorta a canna di fucile. In realtà è ancora possibile distinguere i due lumi in quanto eventuali collaterali che originano dal vero lume attraversano il falso lume.
Talvolta la breccia di rientro non è spontanea, ma realizzata artificialmente attraverso un processo di fenestrazione, nel tentativo di cronicizzare la lesione. Non sempre è identificabile una alterazione della parete aortica; quando presente, la più frequente è rappresentata dalla degenerazione mediale, o necrosi cistica della media. Questa degenerazione è caratterizzata dalla frammentazione del tessuto elastico e dalla separazione degli elementi fibromuscolari e di quelli elastici nel contesto della media, con formazione di piccoli spazi lacunari che vengono ad essere riempiti da matrice
extracellulare amorfa (da cui il nome, anche se non si tratta di vere cisti). Queste alterazioni si riscontrano spesso nel paziente con sindrome di Marfan.
29
Nel paziente iperteso che va incontro a dissezione si osservano spesso alterazioni variabili della tonaca media, ma non specifici, che vanno dalla frammentazione del tessuto elastico alla degenerazione franca della tonaca media.
Nella dissecazione classica si osserva quindi la presenza di un flap intimale, ossia il risultato dello scollamento dell’intima e di parte della media con formazione di una porzione di parete che si interpone a separare il vero lume dal falso; questa struttura vedremo riveste un ruolo importante nella diagnostica per immagini, in quanto è uno degli elementi patognomonici che vengono messi in evidenza dalle tecniche di imaging.
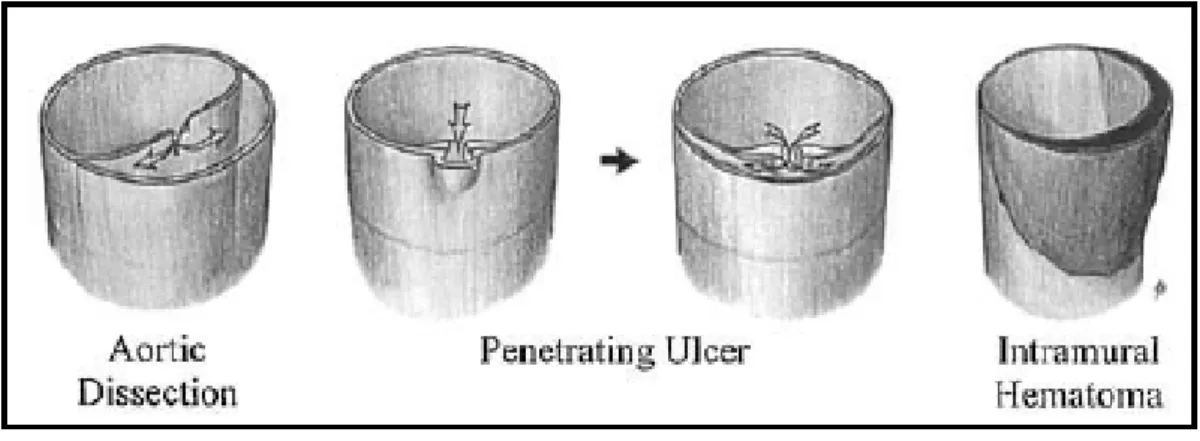
Esistono due entità patologiche che possiedono una propria identità, e che necessitano di un management clinico ritagliato su misura, ma che spesso, rientrando nel capitolo delle sindromi aortiche acute, vengono considerate come “varianti” della classica dissezione aortica: l’ulcera penetrante aterosclerotica e l’ematoma intramurale.
Queste lesioni nonostante siano diverse dalla dissezione sono a questa molto legate, sia perché spesso diagnosticate erroneamente come tale, sia perché nella loro evoluzione possono dar luogo ad una dissezione classica.
Fig. 18 Degenerazione cistica della media; in A sezione della tonaca media dell’aorta di un
paziente con sindrome di Marfan mostrante frammentazione dell’elastina e formazione di aree prive di elastina che somigliano a spazi cistici. In B confronto con la tonaca muscolare di un individuo sano
30 L’ulcera penetrante aterosclerotica è un’ulcera della placca ateromatosa che si
estende a distrugge la lamina elastica interna, creando una profonda soluzione di continuo attraverso l’intima dentro la media. La placca può precipitare formando una dissezione localizzata associata a un variabile ematoma entro la parete aortica, o addirittura causare una rottura nell’avventizia con conseguente formazione di uno pseudoaneurisma. [32] La sintomatologia che comporta è simile alla dissezione classica, ma l’imaging mostra un aspetto completamente diverso, con presenza di una cratere ulcerato nella parete
evidenziabile come immagine di plus. [33]
L’ematoma intramurale è dovuto alla rottura dei vasa vasorum aortici con
formazione di uno spazio circonferenziale contenente sangue, in assenza di ulcere o lesioni dell’intima.
Si può venire a formare spontaneamente in pazienti ipertesi o come complicanza a seguito di un trauma chiuso del torace; inoltre si può formare da un’ulcera penetrante
aterosclerotica. [34] Classificazione
La classificazione delle dissezioni aortiche si basa essenzialmente su due parametri: temporale e topografico.
La classificazione temporale divide la patologia in acuta e cronica: si parla di acuta quando ci troviamo entro due settimane dall’evento scatenante, mentre di cronica quando il
processo supera i 14 giorni dall’evento scatenante o se è scoperto occasionalmente. [35]
Fig. 19 Schema rappresentante le differenze fra dissezione, ulcera penetrante e
31
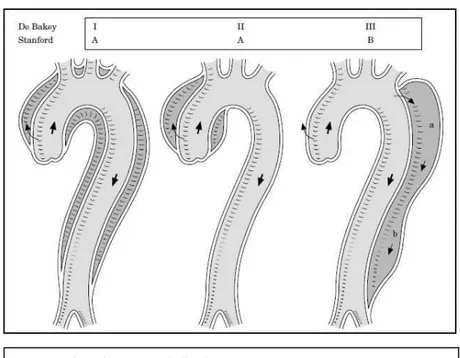
La classificazione topografica che per prima venne introdotta è quella di DeBakey [36], che prevede la suddivisione delle dissezioni in tre gruppi:
• I: quando interessa l’aorta ascendente, l’arco e l’aorta discendente • II: quando è limitata alla sola aorta ascendente
• III: quando la lesione è limitata all’aorta discendente
Una prima modifica a questa classificazione venne introdotta da Reul e Cooley [37], che divisero il tipo III in due sottotipi, a e b:
• IIIa: interessamento dell’aorta discendente toracica
• IIIb: interessamento dell’aorta discendente toraco-addominale
Tuttavia la classificazione che ad oggi viene maggiormente usata è quella dell’università di Stanford [38], che rappresenta una semplificazione di quella di De Bakey in quanto
prevede solo due classi:
• A: corrisponde ai gruppi I e II di De Bakey, vale a dire quelli con interessamento dell’aorta ascendente
• B: corrisponde al gruppo III, in cui l’aorta ascendente è intatta
Questa classificazione risulta essere più pratica da usare anche tenendo conto di quelle che sono l’evoluzione clinica e le indicazioni terapeutiche (vedi dopo).
32
Storia naturale
Vista l’alta mortalità, il tasso di sopravvivenza in entrambi i tipi di dissezione, A e B, è alquanto basso.
Per quanto concerne la dissezione di tipo A, nelle prime 24-48 ore la mortalità si aggira attorno a 1-2%/h, motivo per cui questo tipo di dissezione necessita di intervento chirurgico immediato. [30]
I pazienti che subiscono un intervento ritardato o un trattamento non operativo hanno una storia naturale che non è ancora stata del tutto chiarita.
Da uno studio condotto da Scholl et al [39] su pazienti con dissezione di tipo A e non sottoposti, per diversi motivi, immediatamente alla chirurgia, sono emersi due punti: i pazienti che sono stati diagnosticati con diversi giorni di ritardo e che hanno superato l’iniziale periodo di maggior pericolo possono essere sottoposti in modo abbastanza sicuro ad un intervento in semi-elezione piuttosto che in emergenza; in secondo luogo, un gruppo selezionato di pazienti che non è considerato idoneo all’intervento e che sopravvive alla prima fase della dissezione può essere trattato con terapia medica aggressiva, e raggiunge un sopravvivenza precoce e a breve termine accettabile, meglio di quanto previsto in passato.
Le complicanze cui può incorrere una dissezione di tipo A sono molteplici, e sono le principali responsabili della mortalità; dipendono dalla porzione di aorta che in questa
Fig. 21 Curva di Kaplan-Meier che mostra i diversi tassi di
33
situazione viene ad essere interessata, motivo per cui la classificazione di Stanford prevede la distinzione delle forme in cui è presente o meno l’interessamento di aorta ascendente. L’estensione retrograda provoca le complicanze più gravi, rappresentate da:
• Rottura nella porzione intrapericardica dell’aorta, con conseguente emopericardio e tamponamento cardiaco, causa più frequente di morte nelle prime due settimane; • Rottura nel setto interatriale, con conseguente ematoma del setto e possibile fistola
tra aorta e atrio destro o blocco della conduzione seno atriale;
• Estensione della dissezione lungo le coronarie con loro occlusione e ischemia miocardica acuta; l’interessamento della coronaria destra è il più frequente; • Distorsione delle commessure aortiche e conseguente insufficienza aortica acuta
per prolasso dei lembi valvolari, che risultano tuttavia essere normali. Per questo motivo nelle forme acute si può ricorrere ad una chirurgia valve sparing nel 84% dei casi, mentre nelle forme croniche approssimativamente nel 50%.
In una review di Stanford si osserva che la mortalità operatoria nelle dissezioni acute è del 7% + 5%, mentre nelle forme croniche è 11% + 7%
Circa un terzo delle dissezioni è di tipo B; la sostituzione di un ampio tratto di aorta discendente può portare ad un elevato tasso di mortalità e di paraplegia, tant’è che il trattamento iniziale delle forme non complicate è di tipo medico e mira a ridurre la pressione sanguigna e la forza di contrazione cardiaca; la soluzione chirurgica viene riservata alle forme complicate, e si avvale della sostituzione del tratto interessato in caso di rottura (avvenuta o imminente), e della fenestrazione in caso di occlusione vascolare. [40]
Le complicanze che possono insorgere nelle dissezioni di tipo B dipendono dal tratto di aorta interessato: quando ad essere interessato è l’arco aortico la complicanza principale è l’estensione della dissecazione ai tronchi sopraortici, o la loro occlusione; particolarmente grave è l’interessamento delle carotidi, che può condurre verso l’ischemia cerebrale.
Nel caso dell’interessamento dell’aorta addominale la situazione è meno grave, e dopo la rottura del vaso l’evento potenzialmente più pericoloso è rappresentato dall’occlusione delle arterie renali con quadri che variano dall’insufficienza renale acuta all’infarto renale.
34
Uno studio del 2007 [41] ha evidenziato una mortalità nelle dissezioni di tipo A sottoposte a trattamento medico del 20% a 24h e del 40% a 48h, contro una mortalità nei casi trattati chirurgicamente che si attesta intorno al 15%.
Per quanto concerne i pazienti con dissezioni di tipo B, la sopravvivenza nei soggetti sottoposti a trattamento medico si attesta intorno al 60% a 5 anni e al 40% a 10 anni; la sopravvivenza appare migliore nei pazienti con dissezione distale non comunicante. Contrariamente a quanto osservato per il tipo A, la mortalità nei pazienti sottoposti a intervento chirurgico risulta maggiore, probabilmente perché questo è riservato ai casi che si presentano complicati.
Segni e sintomi
Fig. 22 Mortalità a 14 giorni stratificata per
35
La sintomatologia della dissezione è variabilmente dipendente da due fattori, rappresentati dalla localizzazione ed estensione della lesione e da fattori riguardanti il paziente, quali sesso ed età.
Il sintomo più tipico è rappresentato da dolore improvviso e violento al petto o
interscapolare, a seconda che la dissezione interessi l’aorta ascendente o la discendente; tuttavia, i pazienti possono presentare sintomi aspecifici o comunque non dolore.
Il dolore toracico della dissezione inizia in maniera improvvisa e con massima intensità sin dal principio; è generalmente intenso, resistente alla terapia analgesica di primo livello; viene descritto come oppressivo, e può essere migratorio.
L’iniziale localizzazione e irradiazione può fornire indizi circa il sito di origine della lesione e la sua estensione lungo l’aorta.
La sincope, se presente, è un segno infausto in quanto indica un tamponamento o un ictus. Sintomi neurologici acuti possono ritrovarsi ed essere temporanei.
La scarsa specificità dei sintomi può indurre ad un ritardo nella diagnosi, soprattutto nei casi in cui i sintomi presenti sono aspecifici.
Anche i segni rilevabili all’esame fisico non sono generalmente specifici;
ipertensione può essere presente – come detto prima spesso è un rialzo pressorio la causa della lacerazione dell’intima in un’aorta già compromessa -; un deficit del polso si ritrova nel 30% dei pazienti con dissezione di tipo A ed è associato ad un aumento della mortalità. Deficit neurologici focali sono descritti nel 17% dei casi.
I sintomi possono evolvere rapidamente associati alla progressione della dissezione, e includono le complicanze viste precedentemente: rigurgito aortico, ischemia miocardica, shock cariogeno, tamponamento cardiaco, deficit neurologici, ischemia periferica,
mesenterica o renale.
In aggiunta, segni riscontrabili in altre patologie, come l’effusione pleurica (reattiva o emorragica), si trovano nel 16% dei pazienti, e possono indurre un ulteriore ritardo nella diagnosi.
Una diagnosi tempestiva richiede un forte sospetto, soprattutto nel paziente anziano in cui la sintomatologia tipo è generalmente meno comune e le comorbidità, come la coronaropatia, complicano ulteriormente l’inquadramento.
Diagnosi
All’arrivo in ospedale il paziente deve essere sottoposto agli esami diagnostici di routine, che tuttavia in questa situazione tendono a non essere particolarmente dirimenti.
36
Tutti i pazienti nei quali si sospetti una sindrome aortica acuta devono essere
invariabilmente sottoposti ad uno studio imaging con una delle tecniche a disposizione. Dopo aver raccolto un’anamnesi quanto possibile accurata e aver indagato le caratteristiche del dolore, occorre ricercare eventuali segni che talvolta si ritrovano associati alla
dissezione, come deficit di polso, valutazione della pressione differenziale, segni
neurologici focali, e un nuovo rumore di rigurgito aortico; tuttavia sintomi atipici, stabilità emodinamica, assenza di differenze nei polsi, possono portare ad un ritardo nella diagnosi. Di fatto un’analisi ha mostrato un tempo medio di diagnosi di 4,3 ore, con un 25% dei pazienti che viene diagnosticato dopo 24 ore o più dall’insorgenza dei sintomi. [42]
L’ECG presenta nel 69% dei casi delle anomalie, che tuttavia non sono specifiche per la dissezione, mentre in un 31% dei casi è del tutto normale. Stessa cosa vale per RX torace, che pur presentando anormalità nell’80% dei casi non permette di fare diagnosi. [43].
È comunque fondamentale sottolineare che la negatività di queste indagini non permette di escludere la diagnosi di dissezione aortica.
Biomarker come il D-dimero, miosina, BNP, troponina, sono non specifici, e servono più che altro nella diagnosi differenziale.
La diagnosi di certezza la si può ottenere solamente con le metodiche di imaging, e fra queste quelle che sicuramente spiccano maggiormente e trovano largo consenso sono l’ecocardiografia, preferibilmente trans esofagea, e la TC con mezzo di contrasto.
L’ecocardiografia rappresenta la prima scelta alla quale si può ricorrere in
situazione di emergenza; consente di visualizzare sia l’aorta che i suoi rami principali, non richiede mezzo di contrasto né esposizione a radiazioni ionizzanti, consente di studiare le strutture cardiache – la presenza di insufficienza aortica, emopericardio etc. – ma ha una limitazione: è un’indagine operatore-dipendente.
37
Per poter confermare la diagnosi di dissezione occorre che vengano messi in evidenza due distinti lumi separati da un flap intimale; questo può presentare una soluzione di continuo che costituisce l’intimal tear, evidenziabile attraverso la metodica color Doppler.
Una volta riconosciuto il falso lume è possibile valutarne alcune caratteristiche, come la presenza di trombosi o di flusso – segno di comunicazione fra le due parti.
In prima istanza si ricorre all’ecocardiografia trans toracica, che presenta una sensibilità compresa fra 77% e 80%, e una specificità fra 93% e 96% in caso di interessamento dell’aorta ascendente, mentre una dissezione distale viene riconosciuta solo nel 70% dei pazienti.
Per contro, l’ecocardiografia trans esofagea permette uno studio più accurato raggiungendo una sensibilità e specificità del 98% e 95% rispettivamente [44], e consente di superare le limitazioni imposte dalla conformazione del torace all’esame trans toracico.
Un’ulteriore esame che oggi può essere facilmente eseguito e che consente di effettuare una diagnosi accurata è rappresentato dalla TC; grazie alla ormai grande diffusione delle apparecchiature è possibile eseguire in breve tempo una TC in ogni ospedale. Tuttavia i tempi per la diagnosi sono superiori rispetto all’ecocardiografia, per cui viene riservata esclusivamente ai pazienti che si presentano in stabilità emodinamica. Anche in questo caso la diagnosi viene effettuata sulla base del riconoscimento dell’intimal flap che separa i due lumi.
Fig. 23 In a Ecocardiogramma trans esofageo dell’aorta che mostra una
aorta ascendente dilatata con una dissezione nel mezzo che separa il lume vero da quello falso; in b proiezione asse-corto dell’aorta discendente di un paziente con dissezione che mostra il flap mobile
38
Trombi murali in un aneurisma fusiforme o masse intorno all’aorta possono rendere difficile la diagnosi e mimare una dissezione.
Grazie anche alle ricostruzioni 3D la sensibilità della TC oscilla fra il 96% e il 100%, mentre la specificità fra 87% e 99%. [44]
Fig. 24 Dissezione aortica di tipo A coinvolgente l’aorta ascendente. La freccia (a) indica il
flap intimale che separa il lume vero da quello falso. La ricostruzione sul piano assiale (b) conferma la presenza del flap intimale (freccia) e la posizione del lume falso (anteriore e meno opacizzato) rispetto a quello vero (posteriore e più opacizzato). La ricostruzione 3D sul piano sagittale obliquo mostra un caso di dissezione di tipo B; la freccia indica il flap intimale con origine a livello dell’istmo aortico e coinvolgimento esclusivo dell’aorta discendente
39
Un’accuratezza diagnostica addirittura superiore la si ritrova nella RMN, che presenta una sensibilità del 95-99% e una specificità del 95-100% [44]; nonostante questo, la risonanza è un’indagine utilizzabile nello studio delle forme croniche ma, visti i tempi necessari per l’acquisizione, non può essere utilizzata in emergenza, men che meno nel paziente emodinamicamente instabile.
L’aortografia è stato in passato il gold standard per la diagnosi di dissezione aortica, basata sul riscontro di segni diretti – come la visualizzazione del flap intimale – o indiretti – come l’irregolarità del contorno del lume aortico. Ad oggi non viene più utilizzata. Indicazioni
Raccomandazioni per il management definitivo
Classe I:
1. Una consulenza chirurgica urgente deve essere richiesta per tutti i pazienti con dissezione, indipendentemente dalla sua localizzazione, appena la diagnosi e confermata od altamente sospettata.
2. La dissezione aortica acuta coinvolgente l’aorta ascendente deve essere
immediatamente valutata per l’intervento chirurgico, visto il suo alto rischio di rottura e di complicanze per la vita.
3. La dissezione aortica acuta coinvolgente la porzione discendente deve essere trattata con terapia medica a meno che non si sviluppino complicanze pericolose per la vita (mal perfusione periferica, progressione della dissezione, aneurisma in espansione, impossibilità al controllo della pressione arteriosa o dei sintomi).
Fig. 25 In a immagine T1 pesata in sezione sagittale che mostra il flap intimale (frecce);
in b sezione trasversale che evidenzia la differenza di intensità di segnale fra il vero lume ed il falso.
40 Raccomandazioni per l’intervento chirurgico nelle dissezioni aortiche acute
Classe I:
1. Per i pazienti con dissezione dell’aorta toracica ascendente, tutta la parte
aneurismatica dell’aorta e l’estensione prossimale della dissezione dovrebbe essere resecata. Un aortic root solo parzialmente coinvolto nella dissezione può essere sottoposto ad un tentativo di riparazione con risospensione della valvola aortica. Un’estesa dissezione dell’aortic root invece deve essere trattata con una completa sostituzione con un graft valvolato o con un intervento di valve-sparing. Se presente una dissezione di tipo II secondo DeBakey, l’intera porzione di aorta dissecata deve essere sostituita.
Raccomandazioni per l’ematoma intramurale senza intimal tear
Classe IIa:
1. E’ ragionevole trattare l’ematoma intramurale allo stesso modo di una dissezione nel segmento di aorta interessato.
42
ANEURISMI AORTICI
Introduzione
Per aneurisma si intende la dilatazione permanente dell’intero spessore di un segmento di arteria di almeno una volta e mezzo il normale diametro; in caso contrario si parla di ectasia.
Per poter parlare di aneurisma occorre quindi che il diametro del vaso sia aumentato, ma oltre a questo occorre che la parete che lo costituisce sia formata da tutte le tonache della normale parete vasale: questo è un elemento fondamentale per distinguere i veri aneurismi dagli pseudo aneurismi, che rappresentano situazioni in cui è presente un’alterazione del profilo esterno del vaso, ma questa è dovuta alla rottura dell’intima e della media con conseguente raccolta ematica racchiusa solo dall’avventizia.
L’aneurisma dissecante è un caso particolare di cui è stato parlato precedentemente. Un’altra distinzione importante da fare riguarda la conformazione dell’aneurisma, che può essere sacciforme, nel caso in cui venga interessata solo parte della circonferenza del vaso, o fusiforme, quando invece è interessata tutta la circonferenza.
Con un’incidenza che si attesta intorno 5,9 casi per 100000 abitanti l’anno,
rappresenta la 13° causa di morte negli Stati Uniti [45]; negli ultimi anni si è assistito ad un aumento dell’incidenza di questa patologia in quanto, con il miglioramento delle tecniche di imaging, si è migliorata la capacità diagnostica, riuscendo a diagnosticare anche forme ancora asintomatiche: la prevalenza delle forme asintomatiche è stimata essere compresa fra 0,16% e 0,34%. [46]
Fig. 26 Schema che mette a confronto un aneurisma vero sacciforme
43
In ogni caso, prima dell’evento acuto il 95% degli aneurismi è asintomatico; talvolta nelle fasi più avanzate è apprezzabile un soffio da rigurgito aortico, ma solo se è interessata l’aorta ascendente. [47]
L’età media di insorgenza è compresa fra 59 e 69 anni, e il sesso maschile anche in questo caso risulta essere maggiormente interessato, con un rapporto M:F variabile da 2:1 a 4:1.
Molto spesso si tratta di pazienti che presentano altre comorbidità, quali ipertensione, coronaropatia, BPCO, e insufficienza cardiaca congestizia.
I pazienti con aneurisma dell’aorta presentano anche un rischio aumentato di eventi cardiovascolari, la maggior parte dei quali non direttamente collegata all’aneurisma stesso, ma probabilmente dovuta ai comuni fattori di rischio – come fumo e ipertensione – e vie patologiche – come l’infiammazione – che fanno si che ci sia un alto rischio di comorbidità cardiovascolari al momento della diagnosi di aneurisma [48]; infatti questi soggetti hanno un rischio di mortalità a 10 anni per eventi cardiovascolari 15 volte maggiore rispetto al rischio di morte per aneurisma [49]. Nonostante una correzione ottimale del difetto, il rischio cardiovascolare aumentato rimane [48].
Eziopatogenesi
Generalmente gli aneurismi sono dovuti all’azione combinata dell’indebolimento della parete arteriosa e dell’aumento della pressione laterale del sangue; tuttavia esistono casi in cui uno solo dei due fattori risulta essere determinante, come nel caso della distruzione pressoché completa della media aortica nella aortopatia degenerativa o nell’aterosclerosi, o con meccanismo inverso, come accade negli aneurismi metastenotici, dove si ha una forte pressione da parte del sangue a valle di un brusco restringimento come può essere una coartazione aortica.
Le cause più frequenti sono rappresentate da aortopatia degenerativa e aterosclerosi, ma non vanno trascurate le forme arteritiche, sia immuno mediate che infettive, e le forme traumatiche.