FA
LAU
ANA
NE
Relatori
Prof. Eg
Prof.ssa
COLTÀ D
UREA SP
ALISI
EL CIR
idio D’A
Rossana
U
DI SCIEN
PECIALI
MODE
RCUIT
ngelo
Scuri
A
Univer
NZE MA
STICA IN
Tesi di la
ELLIS
TO CER
Anno Acc
rsità d
TEMATI
N NEUR
aurea spe
STICA
REBEL
cademico 2
di Pisa
ICHE FIS
OBIOLO
ecialistica
DELL
LLARE
2009/2010
a
SICHE E
OGIA MO
a
LA RIS
E DEL
Cand
Giulia
0
NATURA
OLECOLA
SONAN
L RATT
didata
Capitani
ALI
ARE
NZA
TO
ni
Ieri è storia, domani è mistero, ma oggi è un dono. Per
questo si chiama presente.
RIASSUNTO 4 INTRODUZIONE 6 10 10 11 13 18 20 21 26 26
Lo studio delle oscillazioni e la scoperta della risonanza 28 29 32 32 33 35 38 NEURON 39 41 METODI 42 42 43 47 49 51 RISULTATI 57
MODELLO DEL CIRCUITO FONDAMENTALE DELLO STRATO GRANULARE 57
60 61 62 66 69 71 75 BIBLIOGRAFIA 78 RINGRAZIAMENTI 83 3 IDR MEDIO
IMPORTANZA DELLE SINAPSI
MODULAZIONE DELLA RISONANZA DISCUSSIONE E CONCLUSIONI
Le equazioni di Hodgkin-Huxley Propagazione del potenziale d'azione
Trasmissione dei potenziali d'azione attraverso le sinapsi
STIMOLI E ATTIVITA' TONICA ANALISI DATI
CALCOLO DELL'INDICE DI RISONANZA
I segnali neuronali ed il potenziale d'azione Le sinapsi
Proprietà elettriche passive della membrana
SCOPO DELLA TESI
METODI DI MODELLIZZAZIONE COMPUTAZIONALE
Modello per la generazione del potenziale d'azione Il circuito cerebellare
OSCILLAZIONE E RISONANZA
Attività oscillatoria dei neuroni cerebrali e cecebellari Evidenze sperimentali di di risonanza
INTRODUZIONE ALLE NEUROSCIENZE COMPUTAZIONALI
Descrizione biofisica dei fenomeni elettrofisiologici dei neuroni
IL CERVELLETTO
Anatomia e fisiologia Suddivisione funzionale
Afferenze alla corteccia cerebellare Efferenze della corteccia cerebellare La corteccia cerebellare
4
RIASSUNTO
Sofisticate procedure sperimentali mirate a visualizzare l’attività globale di aree cerebrali hanno confermato la connessione funzionale tra le oscillazioni dell’ attività di insiemi neuronali e specifici stati funzionali cerebrali (Basar et al., 2001; Gross et al., 2002). Lo studio dell’avviamento, propagazione e mantenimento di attività oscillatorie a specifiche frequenze potrebbe favorire una migliore comprensione di molti processi cognitivi, motori e sensoriali, e come ognuno di questi processi si manifesti con oscillazioni a frequenze differenti.
Recenti studi hanno mostrato che durante l’esecuzione di funzioni motorie l’attività dei neuroni della corteccia cerebellare oscilla a frequenze comprese nella banda θ (3-10 Hz; Leung & Yu, 1998). Contrazioni dei pollici della mano, lenti movimenti della dita delle mani (Vallbo & Wessberg, 1993; Gross et al., 2002), semplici movimenti di entrambe le mani (Pollok et al., 2005a), sono tutte attività motorie in cui le cortecce cerebrale e cerebellare manifestano oscillazioni in banda θ. La presenza simultanea della frequenza θ in queste due strutture nervose ci porta ad ipotizzare una possibile e stretta “collaborazione” funzionale tra di esse, oltrechè l’instaurazione di un circuito che vede coinvolte sia aree corticali cerebrali sia strutture sottocorticali come il talamo e il cervelletto (Gross et al., 2002). Parallelamente ricerche sperimentali e modellistiche svolte su cellule granulari e su cellule del Golgi, entrambe costituenti la maggior parte dello strato granulare cerebellare, hanno rivelato la caratteristica peculiare di modulare l’intensità della loro risposta in base alla frequenza di ripetizione degli stimoli ricevuti. In particolare è stato mostrato come questi tipi neuronali, studiati singolarmente sia a livello sperimentale che modellistico, sono in grado di rispondere con intensità maggiore a determinate frequenze di stimolazione piuttosto che altre: questo fenomeno viene definito
risonanza. Le frequenze tali per cui le cellule granulari e le cellule del Golgi sono in
grado di “risuonare” sono quelle comprese nella banda θ (D'Angelo et al., 2001; Solinas et al., 2007b); saranno allora definiti “risuonatori” quegli elementi in grado di risuonare come le cellule granulari, e gli elementi come le cellule del Golgi, capaci di risuonare ma che sono anche caratterizzati da una loro attività spontanea autoritmica, saranno definiti
5 Queste osservazioni ci hanno permesso di individuare la principale ipotesi sulla quale si è basato questo lavoro di tesi: lo strato granulare si comporta come un circuito risonante, in grado di amplificare le oscillazioni θ provenienti da circuiti esterni come ad esempio il sistema cortico-talamico. Il lavoro di ricerca presente è stato focalizzato sullo studio, tramite tecniche modellistiche, della risonanza in banda θ e dei suoi meccanismi a livello circuitale e cellulare nello strato granulare del cervelletto.
La riproduzione delle dinamiche di risonanza agli stimoli ripetuti è stata condotta utilizzando un modello computazionale del circuito base dello strato granulare del cervelletto costruito mediante la piattaforma di simulazione NEURON. Tale modello riproduce fedelmente tutte le proprietà note del sistema ed è composto da neuroni capaci di generare fenomeni di risonanza in risposta a brevi treni di potenziali d’azione ripetuti a specifiche frequenze (con frequenze che vanno da 0.5-10 Hz; D'Angelo et al., 2001; Solinas et al., 2007b). Le cellule granulari all’interno del modello del circuito base dello strato granulare del cervelletto mostrano risposte risonanti a treni di impulsi ripetuti tra 3 Hz e 8 Hz. Questo risultato conferma le osservazioni sperimentali preliminari. Inoltre, il modello non predice una riduzione dell’intensità del fenomeno di risonanza in seguito ad alterazioni della corrente KM (D'Angelo et al., 2001). Tale corrente è sensibile all’attivazione di recettori muscarinici ed è caratterizzata da costanti di tempo compatibili con le frequenze di risonanza del sistema.
Le simulazioni di un modello biologicamente dettagliato permettono un’analisi simultanea di tutte le componenti cellulari della rete.
In conclusione, l’analisi modellistica indica che lo strato granulare del cervelletto ha proprietà di risonanza nella banda θ. Questa risonanza è basata su proprietà cellulari e circuitali riconducibili alle caratteristiche di risposta molecolare dei canali ionici, dei recettori di membrana e della stocasticità della neurotrasmissione. La risonanza in banda θ potrebbe riflettere la necessità del cervelletto di comunicare con la corteccia cerebrale in questa particolare gamma di frequenze durante lo svolgimento di determinate attività come quelle motorie.
6
INTRODUZIONE
Lo studio delle proprietà elettrofisiologiche dei neuroni e delle reti da essi formate richiede strumenti capaci di tenere conto della complessità delle dinamiche coinvolte. Anche il modello teorico più attinente alla realtà sperimentale può nascondere incongruenze e lacune. Le neuroscienze computazionali forniscono uno strumento di verifica per i modelli teorici costruendo una replica virtuale del sistema studiato. Nell’ambito delle neuroscienze computazionali rientrano lo studio sia di singoli neuroni che di reti neurali atto ad aiutare il ricercatore nella comprensione della complessità funzionale dei circuiti coinvolti in operazioni quali la comprensione linguistica, la cognizione numerica, la cognizione spaziale o il controllo motorio. Il cervelletto, pur partecipando a molte di queste funzioni (Bracke-Tolkmitt et al., 1989), è tradizionalmente considerato per il suo contributo a funzioni di controllo motorio. Il cervelletto svolge infatti un’essenziale funzione di guida e correzione dell’attività dei centri direttamente responsabili di tutte le funzioni motorie come la corteccia motoria e la coteccia premotoria (Gross et al., 2002). Dal cervelletto dipende soprattutto la capacità di compiere i movimenti in modo corretto, con la necessaria prontezza, scioltezza e precisione (Holmes, 1917, 1939; Keele & Ivry, 1990).
Contro il senso comune l’attività neuronale responsabile dell’ esecuzione e soprattutto della scioltezza di questi movimenti presenta discontinuità temporali e ripetizione stereotipicizzata dei patterns di attivazione delle reti coinvolte (Gross et al., 2002). È emblematica in tal senso la testimonianza di uno dei pazienti visitati da Gordon Holmes, neurologo irlandese, che testimonia: “sento i movimenti del braccio intermittenti come se
dovessi ad ogni momento ricominciare il movimento da capo”. I circuiti neuronali
coinvolti in particolari stati funzionali presentano un’ attività di insieme caratterizzata da oscillazioni in particolari bande di frequenza, ad esempio alcune attività motorie come i movimenti delle dita e delle mani (rif. Riassunto) ed anche il tremore fisiologico (Gruart et al., 2000; Koekkoek et al., 2002) sono caratterizzati da oscillazioni in banda θ. Le attuali teorie funzionali mancano degli strumenti necessari per spiegare il ruolo delle oscillazioni nella codifica dei segnali neuronali lasciando ampio spazio per nuove interpretazioni (Montemurro & Panzeri, 2006) che mirano a dimostrare come questo
7 fenomeno sia alla base di molti processi cognitivi, motori e sensoriali, e come ognuno di questi processi si manifesti con oscillazioni a frequenze differenti (Basar et al., 2001).
Fig. 1 Mappa delle connessioni tra aree corticali durante attività neuronale oscillatoria a frequenze comprese tra 6 Hz e 9 Hz. La corteccia motoria primaria sinistra è stata utilizzata come riferimento per stimare la coerenza del segnale. Le aree attivate mostrano una significativa correlazione della loro attività con l’area di riferimento ( p < 0.05). Le frecce indicano la direzione dominanate della diffusione di attività tra le aree indicate. Immagine tratta da Gross et al. (2002).
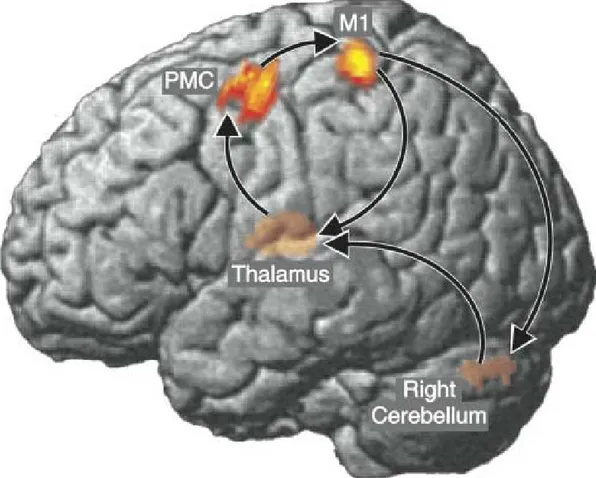
Il modo in cui le oscillazioni in banda θ contribuiscono alla formulazione ed esecuzione dei comandi motori è tuttora oggetto di studio. Recenti ricerche condotte utilizzando tecniche quali la Magneto-Encefalo-Grafia e l’ Elettro-Mio-Grafia (MEG, EMG; Gross et al., 2002) hanno rilevato attività oscillatorie sincronizzate (in banda θ) di diverse aree cerebrali, subcorticali e cerebellari durante il movimento sinusoidale lento (0.5 Hz) del dito indice della mano destra o sinistra. Lo studio della latenza nell’avviamento delle oscillazioni ha permesso di individuare l’origine del comando motorio nella sua forma oscillatoria nella corteccia prefrontale (dove si ha la decisione del movimento, Gross et al., 2002), con successiva diffusione alla corteccia premotoria, corteccia motoria e sensoriale primaria, corteccia parietale posteriore (Fig. 1). Tramite il ponte il segnale raggiunge la corteccia cerebellare che lo ritrasmette al talamo
8 raggiungendo di nuovo la corteccia motoria (CCL: cerebro-cerebellar-loop, definito anche circuito cortico-talamo-cerebellare). Questi risultati sono stati confermati da un successivo studio condotto da Schnitzler et al. (2006).
Studi svolti negli ultimi anni hanno mostrato come il cervelletto sia coinvolto in molte attività di tipo fisiologico come il linguaggio (Halsband & Lange, 2006), la musica (Krause et al., 2010), la scrittura (Butz et al., 2006), l’apprendimento (Dalal, 2007; Dalal et al., 2008), la programmazione ed esecuzione motoria (Guggisberg et al., 2007); ciò implica il coinvolgimento di questa struttura anche a livello patologico, non solo sensori-motorio ma anche cognitivo ed emozionale; la sua implicazione neuropatologica si è così estesa andando oltre le classiche patologie motorie come l’atassia, arrivando a malattie quali l’autismo, la dislessia e probabilmente anche la schizofrenia (Ito, 2008). L’interesse per la struttura cerebellare si è quindi amplificata negli anni in relazione alle molteplici funzioni fisiopatologiche che lo coinvolgono.
Attività oscillatorie patologiche a livello corticale e subcorticale sono state rilevate in pazienti affetti da malattia di Parkinson e atassia cerebellare (Marsden et al., 2000). In particolare nei pazienti affetti da Parkinson è stato mostrato un coinvolgimento del cervelletto e del CCL i quali manifestano un’attività oscillatoria a riposo a frequenze comprese tra 4-6 Hz (Volkmann et al., 1996; Timmermann et al., 2003; Timmermann et al., 2004). Nei pazienti affetti da encefalopatie epatiche sono state ritrovate sincronizzazioni di attività neurale a 6-12 Hz che portano ad un tremore posturale (Schnitzler et al., 2006). Queste conoscenze ci suggeriscono quanto sia fondamentale il contributo cerebellare affinché vi sia una corretta informazione cortico-muscolare, sottolineando l’importanza della connessione funzionale cerebro-cerebellare.
Il fenomeno per cui l’anello sensori-motorio cerebro-cerebellare (CCL) esibisce un intervallo preferenziale di frequenze di lavoro viene definito risonanza e questa condizione sembra essere fondamentale per la corretta comunicazione tra queste due strutture nervose durante determinate attività; le osservazioni sopra riportate rafforzano l’ipotesi principale di questo lavoro di tesi, ovvero che il cervelletto, in particolare lo strato granulare che riceve il maggior contingente di afferenze provenienti dal SNC e dalla periferia, sia fondamentale nel mantenimento e nell’amplificazione delle oscillazioni provenienti dal sistema cortico-talamico (Fig. 2). Inoltre lesioni cerebellari possono portare a particolari patologie riportando alterazioni nel ritmo del loop e riflettendosi, a livello funzionale, in disfunzioni motorie: cosa potrebbe succedere se la risonanza in
9 Per rispondere a questa domanda abbiamo utilizzato tecniche computazionali e come primo obiettivo abbiamo verificato la persistenza della risonanza a livello circuitale, la quale abbiamo mostrato essere presente nei singoli modelli di cellula granulare e del Golgi (rif. Riassunto), successivamente abbiamo cercato di modulare questo fenomeno agendo sui processi responsabili di essa al fine di dirigere i futuri esperimenti verso un approccio corretto limitando quindi i costi e il tempo impiegati.
Ipotesi di risonanza in banda theta
Lo strato granulare si comporta come un circuito risonante in grado di amplificare le oscillazioni theta trasmesse dai circuiti esterni come il sistema cortico‐talamico. I meccanismi circuitali e cellulari (incluse le sinapsi chimiche) sono tuttora oggetto di studio.
Trasmettitore oscillante:
Sistema cortico‐talamico
Ricevitore risonante
sintonizzato:
strato granulare
Fig. 2 La figura mostra in modo schematizzato l’ipotesi principale su cui si basa la risonanza in banda theta. E’ evidente come l’ipotesi pone in rilievo la funzione di ricevitore risonante (in banda θ) e amplificatore del cervelletto affinchè vi sia una corretta comunicazione con le strutture corticali: infatti l’informazione che giunge al cervelletto viene successivamente ritrasmessa, modulata, alla corteccia attraverso il talamo.
10 IL CERVELLETTO
Anatomia e fisiologia
Il cervelletto è una formazione nervosa impari mediana derivante da un’evaginazione dorsale del metencefalo, presente in tutti i vertebrati. Esso è localizzato nella fossa cranica posteriore ed è collegato al tronco encefalico tramite dei solidi cordoni di fibre nervose, afferenti ed efferenti, tre per ogni lato (inferiore, medio e superiore), denominati peduncoli cerebellari attraverso i quali comunica con il resto del sistema nervoso. La caratteristica del cervelletto è la presenza di numerose convoluzioni trasversali e longitudinali parallele tra loro che decorrono da un lato all’altro.
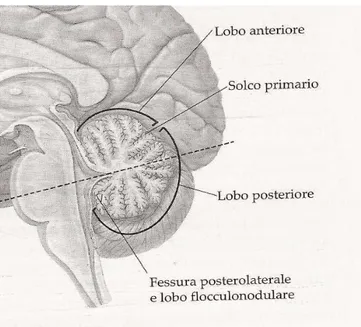
Due profonde fissure trasversali dividono il cervelletto in tre lobi principali (Fig. 3). La fissura primaria, localizzata nella superficie superiore del cervelletto, divide lo stesso in un lobo anteriore e in uno posteriore. La fissura posterolaterale nella parte inferiore del cevelletto separa il grande lobo posteriore dal piccolo lobo flocculonodulare. Altre fissure meno profonde suddividono ciascun lobo in numerosi lobuli (lingula, lobulus centralis, culmen, declive, folium vermis, tuber vermis, pyramis, uvula, nodulus).
Fig. 3 Sezione sagittale mediana La figura mostra la
suddivisione del cervelletto nei tre lobi principali: il lobo anteriore separato dal lobo posteriore attraverso il solco primario e il lobo flocculonodulare separato dal lobo posteriore dalla fessura posterolaterale. Modificata da John H. Martin, 2005.
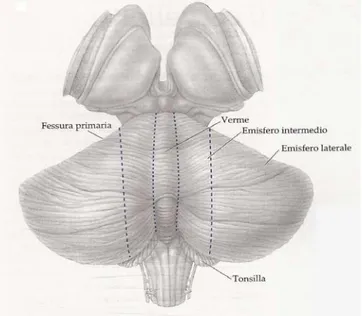
11 La superficie del cervelletto ha anche due solchi longitudinali più marcati in corrispondenza della superficie del lobo posteriore. Questi dividono il cervelletto in tre zone sagittali: una striscia sottile, disposta in corrispondenza della linea mediana, detta verme e gli emisferi cerebellari destro e sinistro (Fig. 4).
Fig. 4 Visione dorsale del cervelletto. Nella figura sono indicati i confini tra il verme, le parti intermedie e le parti laterali degli emisferi cerebellari. Queste tre parti della corteccia cerebellare corrispondono anche a suddivisioni di tipo funzionale. Trattada John H. Martin, 2005.
Nel cervelletto, come negli emisferi cerebrali, la maggior parte della sostanza grigia costituisce la corteccia di tutto l’organo (corteccia cerebellare); il resto è costituito da sostanza bianca, detta anche arbor vitae per la caratteristica struttura ramificata, nella quale si trovano i nuclei profondi, quattro per ogni lato (dentato, del fastigio, globoso ed emboliforme), importanti centri per gli output cerebellari.
Suddivisione funzionale
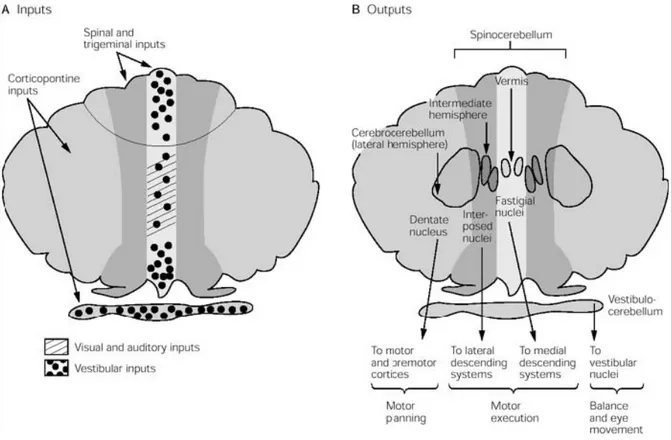
Dal punto di vista funzionale nel cervelletto si distinguono tre regioni, ciascuna delle quali ha connessioni anatomiche distinte con il tronco dell’encefalo e il midollo spinale: il vestibolo-cerebello, lo spino-cerebello e il cerebro-cerebello (Fig. 5). Ognuna di queste
12 regioni riceve afferenze da fonti diverse ed invia proiezioni a parti diverse del sistema nervoso centrale.
Il vestibolo-cerebello è la regione cerebellare filogeneticamente più antica ed è costituita dal lobo flocculonodulare e l’uvula; riceve afferenze e invia proiezioni selettivamente ai nuclei vestibolari del bulbo. Per queste sue afferenze ed efferenze vestibolari, il vestibolo-cerebello è coinvolto nel controllo dell’equilibrio, della postura, della deambulazione e dei movimenti oculari.
Lo spino-cerebello si sviluppa rostrocaudalmente al vestibolo-cerebello ed occupa la parte centrale dei lobi anteriore e posteriore. Esso comprende due regioni disposte in senso sagittale: il verme e la zona intermedia degli emisferi (dette anche “zone paravermiane”). Entrambe ricevono afferenze sensitive dal midollo spinale. Il verme proietta al nucleo del fastigio, mentre le zone intermedie proiettano al nucleo interposito (costituito dal nucleo globoso ed emboliforme). Esso controlla quindi le vie motorie discendenti nel midollo spinale connettendosi sia ai motoneuroni del gruppo ventro-laterale sia a quelli del gruppo dorso-mediale, esercitando un’importante funzione di controllo dei movimenti volontari degli arti e quelli di sostegno posturale.
Il cerebro-cerebello è la porzione filogeneticamente più recente e comprende la parte laterale degli emisferi. Le sue afferenze provengono esclusivamente dai nuclei pontini. Esso tramite il nucleo dentato proietta al talamo, che a sua volta proietta alla corteccia cerebrale motoria e somatomotoria, instaurando di fatto un circuito talamo-cortico-ponto-cerebellare. Il cerebro-cerebello esplica la sua attività di controllo sull’attuazione e progettazione dei movimenti volontari, in particolare di quelli più fini e precisi delle estremità. Recenti studi mostrano come questa porzione cerebellare sia coinvolta anche in funzioni più elevate come la cognizione e il linguaggio.
13
Fig. 5 Suddivisione funzionale cerebellare. Questa figura mostra la suddivisione funzionale del cervelletto in vestibolo-cerebello, spino-cerebello e cerebro-cerebello in base all’origine delle principali fibre afferenti. Tratta da Kandel, 2000.
Afferenze alla corteccia cerebellare
Ad ogni regione funzionale del cervelletto arrivano afferenze che portano informazioni da differenti zone del sistema sensoriale del sistema nervoso centrale (SNC).
Afferenze al vestibolo-cerebello:
• Le vie vestibolo-cerebellari: originano dai nuclei del nervo vestibolare e giungono alla corteccia attraverso i peduncoli cerebellari inferiori. Vi sono fasci diretti dal ganglio vestibolare (fibre primarie) che si portano al lobo flocculonodulare ipsilaterale e altre fibre (fibre secondarie) provenienti dai nuclei vestibolari mediali e inferiori che possono invece decussare. I segnali che arrivano a questa porzione cerebellare provengono dagli organi labirintei.
14 Afferenze allo spino-cerebello:
• Fascio spino-cerebellare ventrale crociato: origina dal midollo spinale, in particolare dai neuroni funicolari del nucleo intermedio mediale giungendo nel lobo anteriore cerebellare tramite i peduncoli cerebellari superiori. Le informazioni trasportate sono relative alla sensibilità propriocettiva e tattile di tutto il corpo.
• Fascio spino-cerebellare dorsale diretto: origina dalla colonna di Clarke nel midollo spinale e giunge alla corteccia ipsilaterale del lobo anteriore tramite i peduncoli cerebellari inferiori. Le informazioni trasportate sono relative alla sensibilità propriocettiva e tattile di tutto il corpo.
• Fascio cuneo-cerebellare: origina dal nucleo cuneato accessorio del bulbo e giunge al lobo anteriore ipsilaterale e alla porzione posteriore del verme attraverso i peduncoli cerebellari inferiori. Questa via è equivalente a quella spino-cerebellare dorsale per gli arti superiori.
• Fibre dal nucleo del cordone laterale: originano dal nucleo del cordone laterale e giungono alla corteccia attraverso i peduncoli cerebellari inferiori. Le informazioni trasportate sono inerenti allo stato dei muscoli, in particolare quelli flessori.
• Via olivo-cerebellare: origina dai nuclei olivari accessori e giunge alla corteccia attraveso i peduncoli cerebellari inferiori. Questa via ha significato analogo a quella spino-cerebellare dorsale ed ha estesa proiezione anche al cerebro-cerebello. Esso porta al cervelletto le fibre rampicanti (CFs) che sinaptano con le cellule del Purkinje (PCs) eccitandole. Tale fascio è costituito da due principali vie: la via spino-olivo-cerebellare, che fa stazione nell’oliva bulbare e porta informazioni soprattutto propriocettive; la via talamo-cortico-olivo-cerebellare, che parte da diverse aree della corteccia motoria e sensoriale, passa attraverso i gangli della base (in particolare per il globus pallidus e putamen) giungendo al nucleo olivare inferiore e infine allo spino-cerebello. • Via trigemino-cerebellare diretta: origina dai protoneuroni del nucleo
mesencefalico e del ganglio semilunare del V nervo cranico, giungendo al lobo anteriore ipsilaterale attraverso i peduncoli cerebellari superiori. Le
15 informazioni che vengono trasportate sono relative alla sensibilità propriocettiva per i muscoli masticolatori ed estrinseci dell’occhio.
Afferenze al cerebro-cerebello:
• Via rubro-cerebellare: origina dal nucleo rosso e giunge ai nuclei dentati attraverso i peduncoli cerebellari superiori. Le informazioni portate da esso sono relative all’esecuzione dei movimenti
• Via cortico-ponto-cerebellare: origina diffusamente dalla corteccia dei lobi frontale, temporale ed occipitale, attraversano i nuclei basilari del ponte e attraverso i peduncoli cerebellari medi giungono al cerebro-cerebello. Le informazioni portate sono di tipo sensoriale (tattile, acustico, visivo) e motorio, con organizzazione somatotopica.
• Via olivo-cerebellare: origina dal nucleo olivare inferiore principale e giunge alla corteccia attraverso i peduncoli cerebellari inferiori. Ha significato analogo alla via spino-cerebellare dorsale.
• Fibre arciformi esterne anteriori: originano dal nucleo arciforme bulbare e giungono al cerebro-cerebello attraverso i peduncoli cerebellari inferiori. Fanno parte del sistema extra-piramidale di controllo del movimento e costituiscono una via omologa alla via cortico-olivo-cerebellare.
Afferenze diffuse:
• Via tetto-cerebellare: origina dai tubercoli quadrigemini superiori e inferiori giungendo alla corteccia controlaterale attraverso i peduncoli cerebellari superiori. Conduce stimoli acustici e visivi.
• Via tetto-ponto-cerebellare: origina dai tubercoli superiori e inferiori, passa attraverso il ponte e giunge alla corteccia cerebellare attraverso i peduncoli cerebellari medi. Conduce stimoli acustici e visivi.
• Via spino-ponto-cerebellare: origina dai nuclei basilari del ponte e giunge alla corteccia controlaterale attraverso i peduncoli cerebellari medi. Le
16 informazioni portate da questa via riguardano la sensibilità esterocettiva tattile superficiale.
• Via trigemino-cerebellare crociata: origina dai neuroni del nucleo sensitivo principale e dal nucleo della radice discendente del trigemino giungendo controlateralmente al lobo anteriore attraverso i peduncoli cerebellari inferiori. Conduce impulsi della sensibilità epicritica e protopatica.
• Via reticolo-cerebellare: origina dalla formazione reticolare e giunge alla corteccia vermiana ipsilaterale del lobo anteriore. Trasmette impulsi della sensibilità propriocettiva.
17
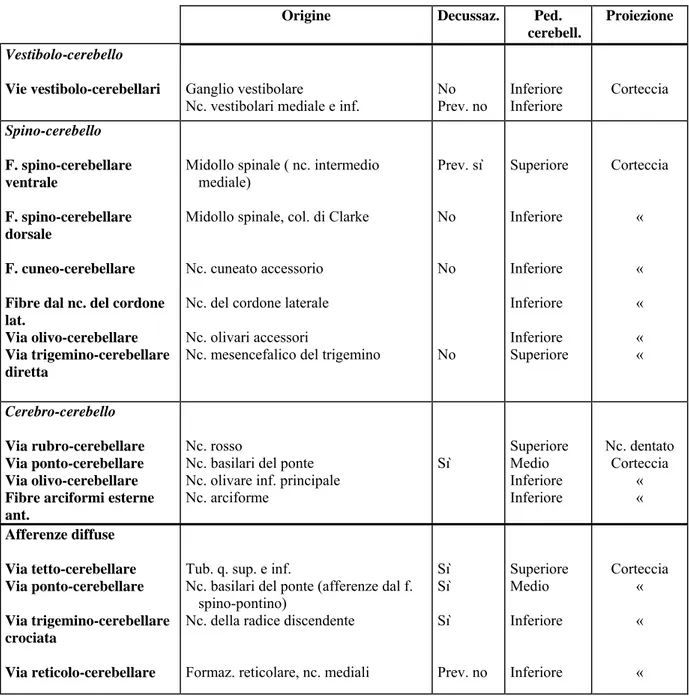
Tab. 1 Schema afferenze che giungono alla corteccia cerebellare
Origine Decussaz. Ped. cerebell.
Proiezione Vestibolo-cerebello
Vie vestibolo-cerebellari Ganglio vestibolare
Nc. vestibolari mediale e inf.
No Prev. no Inferiore Inferiore Corteccia Spino-cerebello F. spino-cerebellare ventrale F. spino-cerebellare dorsale F. cuneo-cerebellare Fibre dal nc. del cordone lat.
Via olivo-cerebellare Via trigemino-cerebellare diretta
Midollo spinale ( nc. intermedio mediale)
Midollo spinale, col. di Clarke Nc. cuneato accessorio Nc. del cordone laterale Nc. olivari accessori
Nc. mesencefalico del trigemino
Prev. sì No No No Superiore Inferiore Inferiore Inferiore Inferiore Superiore Corteccia « « « « « Cerebro-cerebello Via rubro-cerebellare Via ponto-cerebellare Via olivo-cerebellare Fibre arciformi esterne ant.
Nc. rosso
Nc. basilari del ponte Nc. olivare inf. principale Nc. arciforme Sì Superiore Medio Inferiore Inferiore Nc. dentato Corteccia « « Afferenze diffuse Via tetto-cerebellare Via ponto-cerebellare Via trigemino-cerebellare crociata Via reticolo-cerebellare
Tub. q. sup. e inf.
Nc. basilari del ponte (afferenze dal f. spino-pontino)
Nc. della radice discendente Formaz. reticolare, nc. mediali
Sì Sì Sì Prev. no Superiore Medio Inferiore Inferiore Corteccia « « «
18
Efferenze della corteccia cerebellare
Le vie efferenti cerebellari (Tab. 2) partono quasi totalmente dai nuclei profondi che a sua volta ricevono fibre da vari territori della corteccia cerebellare. In particolare, dalle aree corticali dello spino-cerebello partono fibre dirette ai nuclei globoso ed emboliforme, mentre dalla corteccia cerebro-cerebellare partono fibre che si dirigono verso il nucleo dentato. L’insieme delle proiezioni è essenzialmente ipsilaterale. Le fibre che invece si dipartono dal vestibolo-cerebello non passano attraverso i nuclei intrinseci cerebellari, ma si dirigono direttamente verso i nuclei vestibolari.
Efferenze dal vestibolo-cerebello: • Vie cerebello-vestibolari:
I. Fibre provenienti dal lobo flocculonodulare si portano ai nuclei vestibolari laterale e inferiore ipsilaterale attraverso i peduncoli cerebellari inferiori; il verme proietta al nucleo laterale di Deiters ipsilaterale.
II. Dai nuclei del tetto origina il fascicolo uncinato che attraverso i peduncoli cerebellari superiori raggiunge i nuclei vestibolari controlaterali; dal nucleo vestibolare laterale si diparte il fascio vestibolo-spinale che giunge al midollo spinale; un contingente raggiunge il fascicolo longitudinale mediale che si porta ai nuclei motori dei nervi cranici, specialmente oculomotori.
III. Un altro contingente dai nuclei del tetto è la via tetto-bulbare che attraverso i peduncoli cerebellari inferiori raggiunge il complesso vestibolare omolaterale.
• Via cerebello-reticolare: origina dai nuclei del tetto con il fascicolo uncinato le cui fibre si arrestano a livello della formazione reticolare mediale del bulbo e del ponte.
19 Efferenze dallo spino-cerebello:
• Via cerebello-rubra: dai nuclei globoso ed emboliforme origina un insieme di fibre che salgono attraverso il peduncolo cerebellare superiore, decussano, successivamente si dividono in una branca discendente che termina nella formazione reticolare bulbo-pontina e in una branca ascendente che forma la via cerebello-rubra, la quale giunge alla porzione magnicellulare del nucleo rosso nel mesencefalo.
• Via cerebello-reticolare: origina dai nuclei globoso ed emboliforme, passa attraverso tutti i peduncoli cerebellari (decussando in parte) e raggiunge i nuclei mediali della sostanza reticolare. Qui si dipartono efferenze verso il midollo spinale formando così la via cerebello-reticolo-spinale.
Efferenze dal cerebro-cerebello:
• Via cerebello-rubra: un fascio di fibre si diparte dal nucleo dentato e attraverso i peduncoli cerebellari superiori si porta alla porzione parvicellulare del nucleo rosso controlaterale. Qui si originano fibre che si portano al talamo formando la via dento-rubro-talamica.
• Via cerebello-talamica: si origina dal nucleo dentato e attraverso i peduncoli cerebellari superiori arriva al nucleo ventro-laterale del talamo contro-laterale; da qui si diparte un fascio di fibre che raggiunge il lobo frontale della corteccia cerebrale.
• Via cerebello-oculomotrice: origina dal nucleo dentato e raggiunge i nuclei somatomotori controlaterali dei nervi III, IV, VI.
20
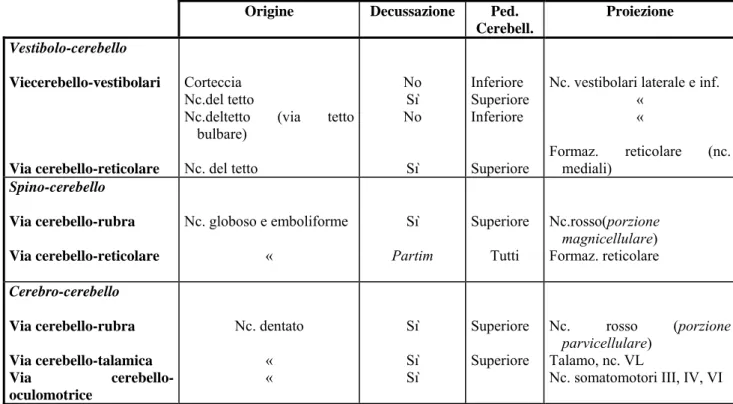
Tab. 2 Schema efferenze cerebellari
La corteccia cerebellare
Il cervelletto è costituito da una porzione esterna di sostanza grigia (corteccia cerebellare), da una porzione più interna di sostanza bianca, e da tre paia di nuclei profondi: il nucleo del fastigio, il nucleo interposito (a sua volta composto da due nuclei: il nucleo globoso e il nucleo emboliforme) e il nucleo dentato.
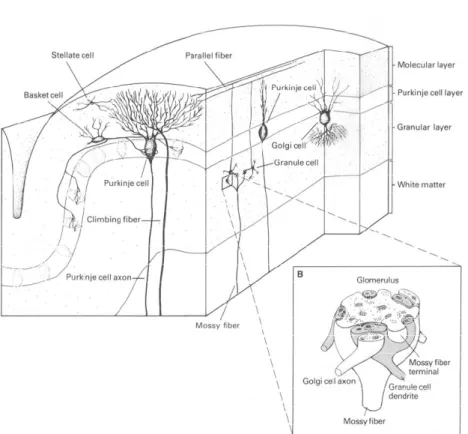
La corteccia cerebellare ha una struttura semplice ed uniforme con una citoarchitettura costante, tale da permettere di riconoscere tre strati: strato molecolare, strato delle cellule del Purkinje e strato granulare (Palay & Chan-Palay, 1974). Essa è costituita da sette tipi cellulari neuronali differenti: cellule dei granuli (unico tipo di neurone eccitatorio corticale cerebellare; GrC), cellule unipolari a spazzola (UBC), cellule del Purkinje, e quattro tipi di interneuroni inibitori, cellule di Lugaro, cellule del Golgi (GoC), cellule stellate e cellule a canestro. Inoltre si riconoscono due tipi principali di fibre afferenti: le fibre muscoidi e le fibre rampicanti.
Origine Decussazione Ped. Cerebell. Proiezione Vestibolo-cerebello Viecerebello-vestibolari Via cerebello-reticolare Corteccia Nc.del tetto
Nc.deltetto (via tetto bulbare) Nc. del tetto No Sì No Sì Inferiore Superiore Inferiore Superiore
Nc. vestibolari laterale e inf. « « Formaz. reticolare (nc. mediali) Spino-cerebello Via cerebello-rubra Via cerebello-reticolare Nc. globoso e emboliforme « Sì Partim Superiore Tutti Nc.rosso(porzione magnicellulare) Formaz. reticolare Cerebro-cerebello Via cerebello-rubra Via cerebello-talamica Via cerebello-oculomotrice Nc. dentato « « Sì Sì Sì Superiore Superiore Nc. rosso (porzione parvicellulare) Talamo, nc. VL
21 Lo strato molecolare è il più esterno ed è costituito principalmente dagli assoni delle cellule dei granuli (fibre parallele) che decorrono parallelamente all’asse longitudinale del folium, contattando così gli alberi dendritici delle cellule del Purkinje. In questo strato ritroviamo gli interneuroni inibitori: cellule a canestro e cellule stellate. Le prime contattano le cellule del Purkinje circondandone “a canestro” il soma. Le seconde contattano l’albero dendritico delle cellule del Purkinje formando sinapsi inibitorie.
Lo strato delle cellule del Purkinje è costituito dai grandi corpi cellulari dei neuroni del Purkinje, disposti uno accanto all’altro formando un monostrato di corpi cellulari. I dendriti di questi neuroni si portano verso lo strato molecolare perpendicolarmente rispetto al piano longitudinale del folium (e quindi alle fibre parallele); qui si ramificano considerevolmente e ricevono ricchissimi contatti sinaptici da fibre afferenti, le fibre rampicanti, ed interneuroni. I neuroni del Purkinje inviano i loro assoni ai nuclei profondi cerebellari e al nucleo vestibolare. Essi costituiscono l’unica via di uscita dalla corteccia cerebellare.
Lo strato granulare contiene un elevato numero di piccoli neuroni, la maggior parte dei quali sono granuli. Il loro numero è all’incirca 1011. I granuli presentano in media quattro o cinque dendriti che si espandono ad artiglio e prendono contatto con le fibre afferenti muscoidi con le quali, insieme alla terminazione assonica della cellula del Golgi, formano i glomeruli cerebellari. Gli assoni di queste cellule invece ascendono verso lo strato molecolare dove si dividono a “T” formando le cosiddette fibre parallele che decorrono parallelamente rispetto all’asse longitudinale del folium e stabilendo connessioni sinaptiche con i dendriti delle cellule del Golgi, con i dendriti delle cellule del Purkinje e con gli interneuroni tipici di questo strato (cellule a canestro e cellule stellate). In questo strato troviamo un altro tipo neuronale, un interneurone inibitorio: la cellula del Golgi. Questo neurone presenta un soma più grande rispetto a quello dei granuli, i suoi assoni si sviluppano all’interno dello strato granulare così come i suoi dendriti baso-laterali, i quali prendono contatto con le fibre afferenti muscoidi; alcuni dei suoi dendriti si espandono verso lo strato delle cellule del Purkinje e verso lo strato molecolare contattando le fibre parallele.
Il circuito cerebellare
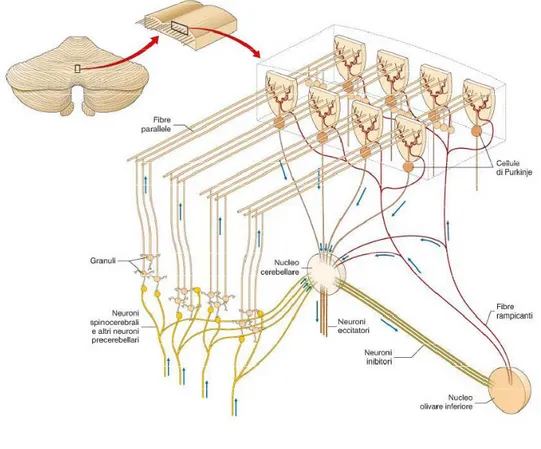
La corteccia cerebellare riceve due tipi di input eccitatori, le fibre muscoidi e le fibre rampicanti, le quali determinano l’attività delle cellule del Purkinje, ovvero l’unica uscita
22 del circuito cerebellare (Fig. 6). Questi due tipi di fibre prendono origine da strutture diverse e a livello del cervelletto hanno ruoli funzionali differenti. Entrambe inviano collaterali eccitatorie ai nuclei profondi cerebellari attivandoli: formano così il circuito cerebellare primario, che viene a sua volta modulato dall’azione inibitoria della corteccia cerebellare, influenzata dagli stessi input.
Le fibre muscoidi costituiscono il sistema afferente principale, originano da molte regioni del SNC: il nervo e i nuclei vestibolari, il midollo spinale, i nuclei trigeminali e la formazione reticolare della corteccia cerebrale tramite la via ponto-cerebellare. Queste fibre giungono al cervelletto attraverso i peduncoli cerebellari medi e superiori inviando collaterali ai nuclei cerebellari profondi; successivamente si ramificano nella sostanza bianca. Le fibre muscoidi influenzano indirettamente le cellule del Purkinje formando sinapsi con le cellule dei granuli che a loro volta sinaptano con le Purkinje stesse attraverso le fibre parallele; una fibra muscoide può avere con le cellule granulari da 50 contatti nel ratto a 200 contatti nell’uomo. I dendriti delle cellule granulari sinaptano con le fibre muscoidi (ogni granulo riceve input da 3 a 5 fibre muscoidi, in media 4, ogni sinapsi è di tipo eccitatorio) a livello di una particolare stuttura chiamata glomerulo cerebellare (Fig. 6); fanno parte di questa struttura anche gli assoni e i dendriti basolaterali delle cellule del Golgi (sinapsi inibitoria cellula del Golgi-granulo; sinapsi eccitatoria fibra muscoide-cellula del Golgi). Gli assoni dei granuli salgono nello strato molecolare biforcandosi in fibre parellele (o a “T”), sinaptando con molte cellule del Purkinje: ognuna di queste cellule riceve input convergenti da circa 150.000 o più fibre parallele (Harvey & Napper, 1991). Allo stesso strato accedono anche i dendriti apicali delle cellule del Golgi che ricevono un numero tutt’ora ignoto di sinapsi eccitatorie dalle fibre parallele (Palay & Chan-Palay, 1974; Barmack & Yakhnitsa, 2008).
Le fibre rampicanti prendono origine dal nucleo olivare inferiore posto nel bulbo (De Zeeuw et al., 1998). Gli input che giungono a questa struttura provengono principalmente dal midollo spinale, dal tronco encefalico, dai nuclei cerebellari e dalla corteccia motoria. Gli assoni olivari sono lunghi, sottili e mielinizzati, quando giungono al cervelletto inviano collaterali ai nuclei cerebellari proseguendo verso la corteccia cerebellare e ramificandosi in molte fibre sottili. Quando le fibre entrano nello strato granulare perdono il loro rivestimento mielinico, infine giungono nello strato molecolare dove sinaptano con i dendriti delle cellule del Purkinje. Ogni fibra rampicante può contattare al massimo dieci cellule del Purkinje e ognuna di esse riceve connessioni sinaptiche da una sola fibra rampicante. Le sinapsi delle fibre rampicanti sono tutte eccitatorie e sono tra le più
23 potenti del sistema nervoso. Un singolo potenziale d’azione di una fibra rampicante evoca potenziali postsinaptici molto ampi che determinano una scarica ad alta frequenza di potenziali d’azione nelle cellule del Purkinje, questo tipo di scarica è stato denominato
complex spike (spike complesso). Al contrario l’input della fibra muscoide trasmessa
dalle fibre parallele evoca un EPSP più piccolo; affinchè la cellula del Purkinje produca un singolo potenziale d’azione chiamato simple spike (spike semplice) sono richieste sommazione spaziale e temporale.
Post-syn Pre-syn Cellule del granulo Cellule del Golgi Cellule del Purkinje Fibre muscoidi + + nc Fibre rampicanti + ? + Cellule granulari nc + +
24
Fig. 6 Circuito e cellule della corteccia cerebellare. Sezione verticale di un
folium cerebellare nel piano trasversale e sagittale in cui è illustrata l’organizzazione generale della corteccia cerebellare. Sono anche illustrate le caratteristiche strutturali di un glomerulo cerebellare nello strato dei granuli. Al microscopio un glomerulo appare come una zona chiara a livello della quale la terminazione di una fibra muscoide, a forma di bulbo, stabilisce contatti sinaptici con le terminazioni assonali di una cellula del Golgi e con i dendriti di una cellula granulare. Lo strato più interno, o strato dei granuli, contiene un elevato numero (all’incirca 1011) di cellule granulari (che hanno
ricevuto questo nome perché nei preparati biologici appaiono come cellule di piccole dimensioni il cui nucleo occupa quasi tutto il volume intracellulare) ed alcune cellule del Golgi, di maggiori dimensioni (diametro del soma ~10 μm). Le fibre muscoidi, che costituiscono la principale afferenza del cervelletto, terminano a livello di questo strato. Le terminazioni delle fibre muscoidi, che formano delle espansioni a forma di bulbo, stabiliscono contatti sinaptici con i granuli e le cellule del Golgi a livello di complessi agglomerati sinaptici detti glomeruli cerebellari. Modificata da Kandel, 2000.
25
Fig. 7 Organizzazione tridimensionale della corteccia cerebellare. Le fibre muscoidi
eccitano i granuli, i cui assoni formano le fibre parallele, che decorrono in direzione trasversale ed eccitano migliaia di cellule del Purkinje, che possono distare anche parecchi millimetri, sia medialmente che lateralmente, dal punto in cui gli assoni si biforcano. Al contrario, le fibre rampicanti si ramificano in direzione sagittale ed eccitano sei-sette cellule del Purkinje disposte anteriormente e posteriormente rispetto al punto di biforcazione dei loro assoni. Le connessioni trasversali delle fibre parallele e quelle sagittali delle fibre rampicanti compongono perciò una matrice ortogonale.
26
Oscillazione e risonanza
Attività oscillatoria dei neuroni cerebrali e cerebellari
Oggigiorno sappiamo che durante momenti funzionali, quali il movimento e la cognizione, si richiede una cooperazione e sincronizzazione da parte delle cellule neuronali coinvolte. È possibile che tale sincronizzazione tra questi neuroni si esprima attraverso un’attività particolare definita oscillatoria.
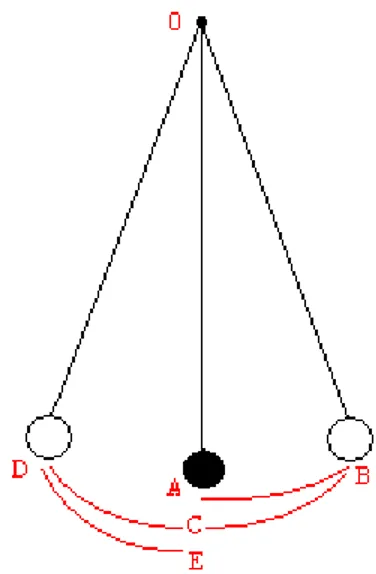
Il fenomeno di oscillazione è presente in molti sistemi: fisici, sociali, biologici; un’oscillazione è definita come una variazione periodica nel tempo. Ad esempio: quando un pendolo viene urtato esso inizia a muoversi avanti e indietro rispetto alla sua posizione statica iniziale; questo movimento viene chiamato oscillazione ed il tempo impiegato dal pendolo per andare da un estremo all'altro e ritornare nella posizione iniziale è definito periodo (Fig. 8).
Fig. 8 In nero è disegnato il pendolo in posizione iniziale
(A). Quando il pendolo viene urtato questo inizia a muoversi portandosi all’estremo B; giunto a questo estremo il pendolo tornerà indietro oltrepassando il punto iniziale (chiamato adesso C), giungendo così all’estremo opposto (D). Da qui il pendolo si riporta all’altro capo e così via. Quando il il pendolo dal punto D arriva in E (punto iniziale) avremo un’oscillazione completa. Tratto da http://xoomer.virgilio.it/alessandro_corti/acustica_musicale. htm
27
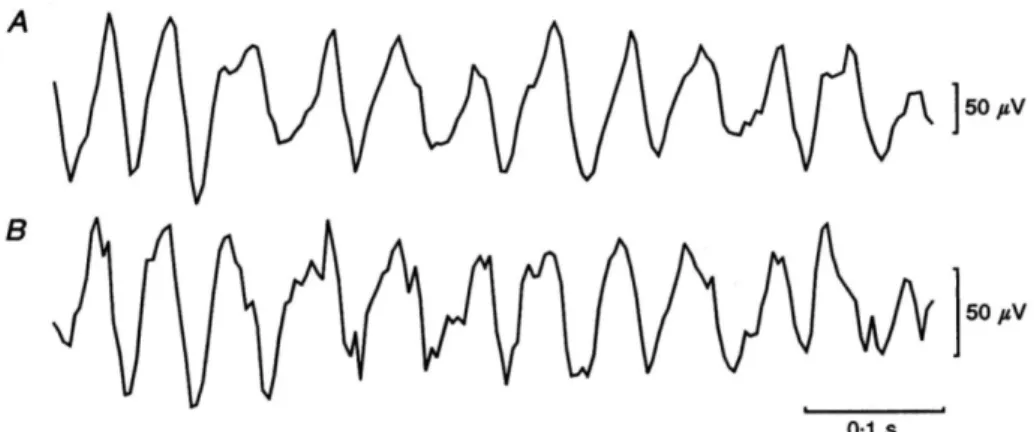
Fig. 9 Le due figure mostrano registrazioni simultanee di onde lente corticali, mettendo in
rilievo la loro caratteristica attività oscillatoria. Modificata da Baker et al. (1997)
Nel sistema nervoso, costituito da cellule neuronali quando parliamo di oscillazione ci riferiamo alla variazione periodica nel tempo del potenziale elettrico di membrana (Fig. 9).
I primi fenomeni di attività oscillatoria sono stati registrati in strutture corticali cerebrali: a livello dei nuclei talamici (Deschenes et al., 1984), dell’ippocampo (Kramis et al., 1975; Buzsaki et al., 1992; Soltesz & Deschenes, 1993; Bragin et al., 1995; Tesche & Karhu, 2000; Buzsaki, 2002; Jacobs et al., 2007; Wikgren et al., 2010), della corteccia motoria (Sanes & Donoghue, 1993; Baker et al., 1997) e della corteccia parietale (MacKay &Mendonça, 1995).
Attraverso questi studi possiamo apprendere che le oscillazioni presenti a livello cerebrale non sono di un solo tipo ma coinvolgono un ampio range di frequenze, a partire da quelle appartenenti alla banda θ (3-10 Hz) fino ad arrivare a quelle appartenenti alla banda gamma (28-64 Hz) (Leung & Yu, 1998; Sederberg et al., 2003). Tra tutte la banda θ risulta essere la più interessante poichè la ritroviamo espressa in tutte le aree cerebrali e sembra essere alla base di momenti funzionali quali la cognizione e il movimento, con un ruolo preponderante in quest’ultima attività.
Nel cervelletto l’attività oscillatoria è stata registrata solo alcuni anni dopo rispetto alle prime registrazioni cerebrali (Pellerin & Lamarre, 1997; Hartmann & Bower, 1998; Courtemanche et al., 2002; Gross et al., 2002; Courtemanche & Lamarre, 2005; Pollok et al., 2005a; Schnitzler et al., 2006).
Uno studio svolto da Pellerin e Lamarre (1997) sui primati tramite tecniche di registrazione extracellulare (LFP: Local-Field-Potential, registrazioni di campo) ha mostrato un’evidente fenomeno oscillatorio anche se in un range diverso da quello della
28 banda θ (esattamente compreso tra 13-18 Hz). La ricerca ha messo in evidenza come queste oscillazioni non fossero sempre presenti: durante i periodi di immobilità e di allerta dell’animale le oscillazioni erano
Tipi di onde
Frequenza (Hz)
Delta
0.5 – 3
Theta 3
–10
Alfa 10–
13
Gamma 28-64
Tab. 3 Tabella descrittiva della nomenclatura delle bande
di frequenza note delle attività neuronali. I dati inseriti nella tabella sono stati tratti da E. Basar et al., 2001; Leung & Yu, 1998; Serdeberg et al., 2003.
evidenti mentre negli stati di veglia o di sonno queste non venivano espresse. La considerazione funzionale più importante tratta da questo studio è il possibile coinvolgimento cerebellare durante comportamenti sensorimotori complessi e quindi la presenza di una stretta comunicazione tra cervello e cervelletto.
In seguito alcuni studi hanno focalizzato l’attenzione sulla possibile associazione tra cervello e cervelletto durante la funzione di controllo sensorimotorio, i quali hanno mostrato che nell’uomo questo controllo avviene nel range di frequenze appartenenti alla banda θ (Gross et al., 2002).
Lo studio delle oscillazioni e la scoperta della risonanza
Nel 1665 il fisico e matematico olandese Christian Huygens, tra i primi a postulare la teoria ondulatoria della luce, osservò che, disponendo a fianco e sulla stessa parete due pendoli, questi tendevano a sintonizzare il proprio movimento oscillatorio quasi che "volessero assumere lo stesso ritmo". Dai suoi studi deriva quel fenomeno che oggi chiamiamo 'risonanza'. Nel caso dei due pendoli, si dice che uno fa risuonare l'altro alla
29 propria frequenza. Allo stesso modo e per lo stesso principio, se si percuote un diapason, che produce onde alla frequenza fissa di 440 Hz, e lo si pone vicino a un secondo diapason 'silenzioso', dopo un breve intervallo quest'ultimo comincia a vibrare.
La risonanza è un fenomeno che può essere soggetto ad amplificazione attiva (Hutcheon & Yarom, 2000). La risonanza è una proprietà che caratterizza la frequenza a cui le cellule neuronali rispondono al meglio ad un determinato input ripetuto nel tempo, sia esso di diversa natura. Quando una cellula neuronale viene sollecitata con stimoli ripetuti, in base alla frequenza di stimolazione la sua risposta cambia, ed è possibile notare questo comportamento analizzando alcuni parametri della risposta stessa quali: l’ampiezza delle oscillazioni sottosoglia, il numero di spikes soprasoglia, la latenza con cui si presenta la risposta dopo lo stimolo, la precisione con cui si genera la risposta ad ogni ripetizione dello stimolo. Questi parametri rilevati dalla risposta neuronale ci hanno permesso di trarre una conclusione molto importante ovvero che tra tutte le frequenze di stimolazione che si possono utilizzare esistono alcune di esse per cui la risposta della cellula neuronale è migliore. Una letteratura in continua crescita sta attribuendo all’attività ritmica di insiemi neuronali e stazioni cerebrali concatenate un ruolo fondamentale nell’espletare funzione motorie, cognitive e percettive (Gross et al., 2002; Pollok et al., 2004; Pollok et al., 2005b).
Evidenze sperimentali di risonanza
Le prime osservazioni di dinamiche di risonanza a livello neuronale sono state documentate nelle cellule neuronali olivari inferiori del tronco encefalico di porcellini d’India, “in vitro” (Llinas & Yarom, 1986): iniezioni di correnti intracellulari sinusoidali da 1 a 20 Hz hanno mostrato dei picchi nelle risposte in due range di frequenze. Da 3 a 6 Hz quando le cellule erano depolarizzate (-50 mV) e da 9 a 12 Hz quando invece erano iperpolarizzate (-75 mV).
Allo stesso modo, iniezioni di correnti oscillanti con frequenza variabile sono in grado di modulare l’attività elettrica “in vitro” delle cellule talamiche (Puil et al., 1994) mostrando oscillazioni di ampiezze maggiori all’interno di due intervalli di frequenze preferenziali: 2-4 Hz e 12-26 Hz.
30 Questo fenomeno di risonanza è stato rilevato anche nelle oscillazioni sottosoglia registrate in fettine di corteccia frontale di porcellino d’India, originate iniettando correnti sinusoidali a diverse frequenze (Gutfreund et al., 1995). Iniezioni di correnti sinusoidali in cellule ippocampali a diverse frequenze “in vitro” hanno evidenziato risposte ottimali all’interno di frequenze che vanno da 3-10 Hz, ovvero in banda θ (Leung & Yu, 1998).
Nel cervelletto questo fenomeno è stato rilevato “in vitro” nelle cellule granulari e nelle cellule del Golgi (D’Angelo et al., 2001; Solinas et al., 2007b) le quali costituiscono la maggior parte dello strato granulare. Nelle cellule granulari, attraverso la tecnica del
patch clamp in modalità “whole cell”, sono state registrate le risposte della cellula ad
iniezioni di correnti periodiche a frequenze variabili: queste hanno riportato risposte maggiori all’interno della banda di frequenza θ, 3-12 Hz (D'Angelo et al., 2001). Questa ricerca ha indagato sia a livello sperimentale che computazionale il comportamento delle cellule granulari cerebellari quando esse vengono stimolate da correnti sinusoidali caratterizzate da frequenze comprese nel intervallo da 1 Hz 10 Hz. Sperimentalmente le cellule sono state stimolate con correnti sinusoidali ad intensità variabile, quindi ne è stato valutato il comportamento di risposta in base alla frequenza di stimolazione e all’intensità dello stimolo stesso. I risultati hanno messo in evidenza l’importanza non tanto dell’intensità quanto della frequenza con cui le cellule vengono stimolate, poichè le curve che vengono costruite utilizzando i risultati delle registrazioni (ovvero le risposte delle cellule allo stimolo ripetuto) mostrano uno stesso andamento per le varie frequenze di stimolo utilizzate nonostante l’intensità dello stimolo sia variabile (Fig. 10).
Analizzando i due grafici in Fig. 10 possiamo evidenziare la presenza del fenomeno di risonanza in banda theta (5-8 Hz), sia quando lo stimolo è soprasoglia (presenza di spikes) sia quando esso è sottosoglia (gli spikes non sono presenti ma notiamo una depolarizzazione della membrana accentuata per alcune frequenze piuttosto che altre).
31
Fig. 10 I grafici mostrano il fenomeno della risonanza nelle cellule granulari del ratto.
Il grafico a sinistra evidenzia come varia la frequenza degli spikes (ISI: inter-spikes-interval) di risposta in base alla frequenza di stimolazione (stimolo soprasoglia); notiamo come nel range compreso tra 5 e 8 Hz la risposta sia maggiore rispetto alle altre frequenze di stimolo, la quale si riflette in un numero di spikes, all’interno di un burst, più grande alle frequenze comprese nel range definito rispetto alle altre. La curva a destra rappresenta i valori di depolarizzazione registrati nelle cellule granulari in risposta a stimoli ripetuti sottosoglia; anche in questo tipo di stimolazione si può registrare il fenomeno di risonanza per cui all’interno di un determinato range la risposta (cioè la depolarizzazione) delle cellule neuronali è maggiore ed è compresa nel range tra 5 e 8 Hz (le curve col pallino nero sono state ricavate utilizzando un’intensità di corrente di 6 pA, mentre quelle con il triangolino sono state ricavate utilizzando un’intensità di corrente pari a 8 pA). Tratta da D’Angelo et al., (2001).
Il modello è stato costruito utilizzando dati ricavati sperimentalmente in precedenza ed ha confermato ciò che è stato rilevato a livello sperimentale.
Fig. 11 I grafici mostrano il fenomeno della risonanza nelle cellule granulari del ratto
nel modello.
Entrambi sono i corrispettivi dei grafici in Fig. 10 generati attraversoil modello della cellula granulare.
Rispetto ai grafici della Fig. 10 in questi sono state analizzate le risposte a tre intensità di corrente sinusoidale differente: linea puntinata - 4 pA; linea nera – 6 pA; linea tratteggiata – 8 pA. Tratta da D’Angelo et al., (2001).
32
Introduzione alle Neuroscienze Computazionali
Descrizione biofisica dei fenomeni elettrofisiologici dei neuroni
I neuroni sono cellule del sistema nervoso altamente specializzate e dedicate al trasferimento, immagazzinamento ed elaborazione delle informazioni. Tale elaborazione avviene attraverso segnali elettrici dovuti a differenze di potenziale associate a correnti elettriche di natura ionica (essenzialmente sono rilevanti solo gli ioni sodio, potassio, calcio e cloro) che attraversano la membrana cellulare del neurone. I neuroni sono in numero molto elevato e sono connessi fra di loro in modo molto intricato: ad esempio nella corteccia cerebrale si ha una densità superiore a 104 neuroni/mm3.
Tipicamente, pur nella varietà di tipi di cellule neuronali (neuroni della corteccia cerebrale, motoneuroni del midollo spinale, ecc.), possiamo riconoscere tre parti morfologicamente e funzionalmente distinte: il corpo cellulare o soma; i dendriti e gli assoni. Il soma ha una struttura compatta che risulta approssimativamente sferica (da pochi µm a decine di µm di diametro). I dendriti sono estensioni del soma con una struttura molto ramificata che possono raggiungere il millimetro di lunghezza ed hanno la funzione di raccogliere i segnali provenienti dagli altri neuroni e trasmetterli al soma. Gli assoni sono lunghe protuberanze (anche oltre un metro nei neuroni motori degli organismi animali superiori) che si proiettano dal soma e la loro funzione consiste nella trasmissione del segnale generato dal soma in genere verso i dendriti di un'altro neurone. Usando la terminologia dei circuiti elettrici si può quindi dire che i dendriti rappresentano genericamente il dispositivo di ingresso (“input”), gli assoni il dispositivo di uscita (“output”) e il soma l'unità di elaborazione delle informazioni. La morfologia di un particolare tipo di neurone nonché la sua posizione nella rete neuronale forniscono indizi sulla funzione espletata: ad esempio il livello di arborizzazione fornisce un'idea del numero di connessioni che può ricevere e verso quante altre cellule neuronali invii i propri segnali (Fig. 12).
33
Fig. 12 Forme e dimensioni dei neuroni
I segnali neuronali ed il potenziale di azione
Si definisce potenziale di membrana la differenza di potenziale presente a cavallo della membrana cellulare e misurabile ai capi di due elettrodi, uno posto all'interno della cellula neuronale ed uno posto nel liquido extracellulare circostante. Quando si parla di segnale neuronale ci si riferisce alla variazione temporale e spaziale del potenziale di membrana. Quando il neurone è a riposo, ossia non è in qualche modo eccitato dall'esterno, il potenziale di membrana assume un valore caratteristico denominato potenziale di riposo, tipicamente dell'ordine di -65 mV, ossia l'interno della cellula si trova ad un potenziale inferiore rispetto all'esterno.
I potenziali di azione (PdA) sono impulsi di tensione tipici generati durante la dinamica neuronale; essi hanno una forma pressoché stereotipata e non sono soggetti ad attenuazione o distorsione durante la propagazione lungo l'assone. In Fig 13 è riportata la forma tipica di un potenziale di azione. Si notino le seguenti caratteristiche:
34
Fig. 13 Neurone e potenziale d‘azione
• Il potenziale d’azione ha una durata di circa 1-2 ms ed una ampiezza misurata fra il minimo ed il massimo di circa 100-120 mV.
• Nella prima fase del PdA il potenziale di membrana mostra una crescita veloce fino ad arrivare ad una fase denominata di depolarizzazione in cui risulta positivo; al termine di questa fase l'interno della cellula si trova quindi ad un potenziale superiore rispetto all'esterno.
• Nella fase di discesa, prima di ritornare al valore di riposo, il potenziale di membrana passa attraverso una fase denominata di iperpolarizzazione, tipicamente della durata di circa 10 ms (e quindi molto più lenta della depolarizzazione), in cui si trova ad un valore inferiore rispetto a quello di riposo. Il potenziale di azione, che una volta generato nel soma della cellula neuronale, viaggia lungo l'assone ed è trasmesso agli altri neuroni, costituisce l'unità elementare associata alla trasmissione dei segnali neuronali. Tipicamente, quindi, quando ci si riferisce al segnale emesso da un neurone si intende la sequenza temporale di questi potenziali di azione, detta anche treno di impulsi (si usa tipicamente il termine inglese
35
Le sinapsi
In modo generico, si può definire la sinapsi come una zona di congiunzione tra elementi coinvolti dall’innervazione nervosa. Attraverso la sinapsi viene consentito in modo elettrico o chimico, ed eventualmente modulato, il passaggio del potenziale d’azione che porta l’informazione. Una sinapsi può sussistere ad esempio tra il dendrite di un neurone e l’assone di un altro neurone, oppure tra un assone e una cellula muscolare, o ancora tra un assone e una cellula di tessuto ghiandolare. Tra le caratteristiche comuni a tutte le sinapsi vi sono l’organizzazione in un sito presinaptico e uno postsinptico, e la caratteristica di essere o eccitatorie o inibitorie, nel senso che possono promuovere l’eccitamento della cellula a valle portandola a produrre PdA (o a contrarsi se si tratta di un muscolo), oppure promuovere l’inibizione e “spegnere” la cellula a valle che sta producendo PdA. Nel caso delle sinapsi elettriche la comunicazione è estremamente rapida in quanto il citoplasma delle cellule presinaptica e postsinaptica è in comunicazione mediante particolari dispositivi chiamati gap junctions, la cui apertura è sensibile a diversi fattori (voltaggio, [Ca2+], pH, ecc). La trasmissione avviene mediante passaggio diretto di correnti elettriche e, nel caso la giunzione coinvolga più cellule, consente di sincronizzare la stimolazione.
Nella sinapsi chimica invece l’elemento presinaptico e postsinaptico non sono a diretto contatto tra loro, ma separati da uno spazio intersinaptico di circa 200 Å. In questo caso l’arrivo di un PdA provoca una depolarizzazione che permette l’ingresso dello ione Ca2+ all’interno del sito presinaptico; qui il Ca2+ va a modulare un processo di esocitosi per cui un soggetto chimico contenuto in vescicole, detto neurotrasmettitore, viene rilasciato nello spazio intersinaptico, dove diffonde. Il neurotrasmettitore agisce su specifici recettori di membrana a livello del terminale postsinaptico. Questi sono canali a controllo di ligando che vengono aperti dal legame col neurotrasmettitore e innescano così una serie di flussi ionici depolarizzanti che porterà alla generazione di un nuovo PdA. Per essere più precisi va ricordato che il canale è una proteina con una sua conformazione dinamica, che risente dei cambiamenti di temperatura o ddp (differenza di potenziale) di membrana o di pH. Già la sola agitazione molecolare dovuta alla temperatura è sufficiente a far passare il canale da uno sta chiuso ad uno aperto, o viceversa; l’arrivo di un neurotrasmettitore influisce, a seconda della sua concentrazione, sulla velocità della reazione.
36
Fig. 14 Sequenza di eventi che caratterizzano la trasmissione sinaptica chimica:
L’arrivo di un potenziale d’azione nella terminazione presinaptica determina l’apertura di canali Ca2+
-voltaggio dipendenti localizzati nelle zone attive. Di conseguenza la concentrazione di ioni Ca2+ aumenta
notevolmente determinando la fusione delle vescicole sinaptiche con la membrana plasmatica. Tale fusione fa sì che le vescicole liberino il loro contenuto nella fessura sinaptica mediante un processo detto di esocitosi. Il neurotrasmettitore così liberato diffonde nello spazio sinaptico e si lega a recettori specifici sulla membrana plasmatica. I recettori, a loro volta, determinano l’apertura o la chiusura di canali ionici che vanno variare il potenziale di membrana della cellula postsinaptica. La complessa sequenza di passaggi che la trasmissione sinaptica chimica comporta è causa del ritardo con cui compaiono i potenziali d’azione nella cellula postsinaptica.
Spesso l’innesco di un PdA richiede la sommazione spaziale e temporale del contributo di più sinapsi, in quanto deve essere raggiunta un soglia di depolarizzazione abbastanza alta da permettere l’apertura dei canali voltaggio dipendenti (principalmente quelli di Na+) .
Il tipo di risposta evocata al terminale postsinaptico in seguito al legame col neurotrasmettitore dipende principalmente dal tipo di recettore coinvolto. Le risposte rapide sono mediate direttamente da canali ionici, o più precisamente da recettori
37 ionotropici (AMPA, NMDA); le risposte lente (intervallo temporale ca. 0.5 - 1 ms) sono invece dovute all’attivazione di recettori metabotropici.
Se la membrana della cellula bersaglio iperpolarizza si ha un’ azione inibitoria e si parla di inhibitory post-synaptic potential (IPSP); se viceversa avviene una depolarizzazione si ha una risposta eccitatoria e si parla di excitatory post-synaptic
potential (EPSP).
Durante una stimolazione ripetitiva la sinapsi può modificare alcuni suoi parametri, come la probabilità di rilascio o la quantità di neurotrasmettitore rilasciato o, ancora, la conduttanza dei canali recettori; questi fenomeni vengono inquadrati nel contesto della plasticità sinaptica. La suddivisione dei diversi tipi di plasticità viene fatta in base alla loro durata: si ha plasticità a breve termine per tempi dell’ordine di secondi-ore, mentre plasticità a lungo termine per tempi dell’ordine di giorni-mesi. Nella prima categoria sono annoverate la facilitazione e la depressione, durante le quali la probabilità di rilascio del neurotrasmettitore è rispettivamente maggiore o minore della quantità “standard” per un determinato stimolo. Nella seconda categoria sono annoverati i fenomeni di potenziamento a lungo termine (LTP) e depressione a lungo termine (LTD), che coinvolgono cambiamenti permanenti (viene coinvolta l’espressione genica) della conduttanza dei canali e della probabilità di rilascio. Viene da se che a cambiamenti della quantità di neurotrasmettitore rilasciata seguono anche cambiamenti della corrente sinaptica. I fenomeni di plasticità sono considerati la base cellulare dei processi di apprendimento e memoria.
38
Proprietà elettriche passive della membrana
Da un punto di vista elettrico la più semplice schematizzazione di una porzione di membrana cellulare a riposo fa ricorso a tre elementi circuitali: una resistenza (R), una capacità (C), un generatore di tensione V uguale al potenziale di riposo (Fig. 15). La presenza della resistenza si spiega con l'esistenza dei canali ionici che realizzano un contatto tra l'interno e l'esterno della cellula. La resistenza di membrana è di solito riportata come una resistenza di membrana specifica, Rm, definita come una resistenza per
unità di superficie (in unita Ω/cm2). R è quindi ottenuta moltiplicando Rm per l'area della
membrana considerata. Rm è determinata principalmente dalle permeabilità a riposo del
potassio e del cloro. Valori tipici di Rm variano da circa 103 Ω/cm2 per membrane con
molti canali ionici a circa 5·104 Ω/cm2 per membrane con pochi canali ionici. Ma oltre a permettere il passaggio di correnti ioniche, la membrana accumula cariche sulla superficie interna ed esterna, ed è proprio questa separazione che determina il potenziale di membrana.
Fig. 15 Schematizzazione elettrica di una porzione di membrana cellulare
del neurone. Vrest indica il potenziale di riposo.
La realizzazione di questa separazione di cariche conferisce alla membrana le proprietà di un condensatore. La capacità di membrana è di solito specificata in termini di una capacità di membrana specifica, Cm, definita come una capacità per unità di superficie (in
unità F/cm2 ). C è quindi ottenuta moltiplicando Cm per l'area della membrana
considerata. Cm è tipicamente dell'ordine di 1 μF/cm2. Occorre sottolineare che tale
schematizzazione descrive solo il comportamento passivo della membrana e non prende in considerazione eventuali componenti non lineari o attive come ad esempio conduttanze voltaggio-dipendenti.
39
NEURON
Le simulazioni sono dei modelli teorici di determinati aspetti della realtà che, diversamente dai modelli e dalle teorie tradizionali, non sono formulati a parole o con i simboli matematici che vengono validati dalla logica della mente che li legge, ma sono espressi dai programmi interpretati e validati dalla loro corretta esecuzione su processori.
Questi risultati possono essere confrontati con i dati empirici reali e, nel caso di concordanza, portano alla conferma della teoria sottesa alla simulazione; oppure si possono utilizzare i dati empirici acquisiti inserendoli nel modello da simulare.
Banks e Carson (1984) hanno definito la simulazione come l’imitazione di un processo o di un sistema reale nel tempo. La simulazione determina la creazione di “una storia artificiale” del sistema, e permette la valutazione di questa storia per operare inferenze concernenti le caratteristiche operative del sistema reale. Secondo Span (1982), la simulazione, nella sua forma più semplice, consiste nel codificare un modello matematico in un programma, da utilizzare in un computer per produrre dati simulati.
I dati prodotti dal modello possono essere paragonati con dati sperimentali rilevati nel sistema reale per verificare la bontà delle previsioni del modello. Effettuata questa verifica, il modello può essere utilizzato per l’analisi dei sistemi. Sembra importante chiarire la differenza tra modello e processo di simulazione. Quest’ultimo rappresenta, infatti, l’uso del modello e la successiva elaborazione dei risultati per determinare la bontà della stima. Solamente se il modello rappresenta effettivamente il sistema reale, si può effettuare una previsione del sistema reale stesso nell’ambiento in cui esso è inserito. Chi utilizza un modello può, infine, ipotizzare una serie di pertubazioni o modifiche al sistema, verificando la possibile risposta del sistema reale. Risulta oggi possibile applicare le simulazioni per l’analisi dei sistemi biologici tramite programmi dedicati.
40 In questa tesi di laurea è stato utilizzato un software di simulazione dedicato ai modelli computazionali neurali: NEURON. Il codice di simulazione NEURON, sviluppato da Michael Hines e John W. Moore (Hines & Carnevale, 1997) presso il Dipartimento di Neurobiologia delle Università di Duke (North Carolina) e di Yale (Connecticut), nasce per essere un valido ed efficiente ambiente per la simulazione di modelli di neuroni biologici e artificiali, siano essi isolati o connessi per costituire reti complesse. NEURON, tra i numerosi software presenti nel campo delle neuroscienze, è quello che garantisce la migliore efficienza e velocità di simulazione (Hines & Carnevale, 1997) per quei problemi riguardanti singole cellule e piccole reti di neuroni. Questa piattaforma di lavoro permette di costruire modelli a partire dal singolo canale ionico presente in un neurone composto da assone, soma e dendriti, arrivando alla rete neuronale la quale è costituita dai singoli modelli di cellula che prendono contatto tra loro attraverso sinapsi che a loro volta possono essere di tipo eccitatorio o inibitorio. Il software permette all’utente di focalizzare la propria attenzione sulle proprietà morfologiche (dimensione delle varie strutture che definiscono la cellula) e biofisiche (capacità di membrana, resistenza assoplasmatica, tipo di membrana, conduttanze voltaggio dipendenti, etc.) del modello risparmiando all’utente il tedioso compito di considerare tutto ciò che riguarda la risoluzione delle equazioni differenziali che sono necessarie per l’effettiva riproduzione delle dinamiche elettrofisiologiche. Infatti, la rappresentazione interna della cellula avviene mediante sezioni cilindriche (definite dall’utente) tra loro interconnesse. Ogni compartimento rappresenta un patch di membrana che contiene i canali e i meccanismi di trasporto che governano la corrente di transmembrana. La somma delle aree di ogni compartimento fornisce l’ area totale della membrana della struttura considerata. Un’ estensione sostanziale ha riguardato l’introduzione di un’ interfaccia grafica utilizzabile per creare ed utilizzare modelli molto semplici, compiere brevi simulazioni al fine di esplorare lo spazio dei parametri e visualizzare in real-time gli andamenti delle variabili simulate in funzione dello spazio e del tempo. Una seconda estensione ha riguardato l’introduzione dell’interprete per la programmazione orientata agli oggetti il quale fornisce la possibilità di usare un linguaggio di programmazione completo per realizzare sistemi biologicamente più realistici e complessi rispetto a quanto possibile con la sola interfaccia grafica. Il software può essere liberamente scaricato dal web (http://www.neuron.yale.edu/neuron/).