INDICE
PREMESSA
pag. 5
1.INTRODUZIONE
pag. 6
2.SCOPO DEL LAVORO
pag. 8
3.LA VOLPE ROSSA: BIOLOGIA E INURBAMENTO
pag. 9
- Categoria sistematica 9
- Distribuzione 9
- Morfologia 10
- Organizzazione territoriale e densità 11
- Organizzazione sociale e attività riproduttiva 12
- Habitat e abitudini alimentari 13
- Il fenomeno dell'inurbamento 14
4.ELMINTI DELLA VOLPE ROSSA IN ITALIA E IN EUROPA
pag. 17
- Phylum Nemathelminthes 17
- Phylum Platyhelminthes 24
- Phylum Acanthocephala 31
5.ELMINTI OGGETTO DI STUDIO
pag. 33
- Phylum Nemathelminthes 33
- Phylum Platyhelminthes 44
6.AREA DI STUDIO
pag. 55
7.MATERIALI E METODI
pag. 56
- Raccolta dei campioni 56
- Esame dell'intestino 56
- Esame dell'apparato cardio-polmonare 57
- Identificazione dei parassiti 57
- Esami coprologici 58
- Indagini molecolari 59
- Indagini svolte dall'I.Z.S. di Imperia 61
8.RISULTATI
pag. 64
-Esame dell'intestino 64
-Esame dell'apparato cardio-polmonare 64
-Esami coprologici 65
-Indagini svolte dall'I.Z.S di Liguria, Piemonte e Valle d'Aosta 65
-Indagini biomolecolari 66
9.DISCUSSIONE
pag. 71
10.CONCLUSIONI
pag. 79
BIBLIOGRAFIA
pag. 80
Zoonosi e malattie parassitarie della volpe rossa (Vulpes vulpes): indagine epidemiologica in provincia di Imperia (Liguria) e di Cuneo (Piemonte)
Parole chiave:Vulpes vulpes, elminti, zoonosi, epidemiologia, Nord Italia
La volpe rossa (Vulpes vulpes), il carnivoro selvatico più diffuso in Italia, è un potenziale serbatoio di virus, batteri, protozoi, elminti e artropodi che possono essere trasmessi ad animali domestici, ad altri selvatici e all’uomo (zoonosi).
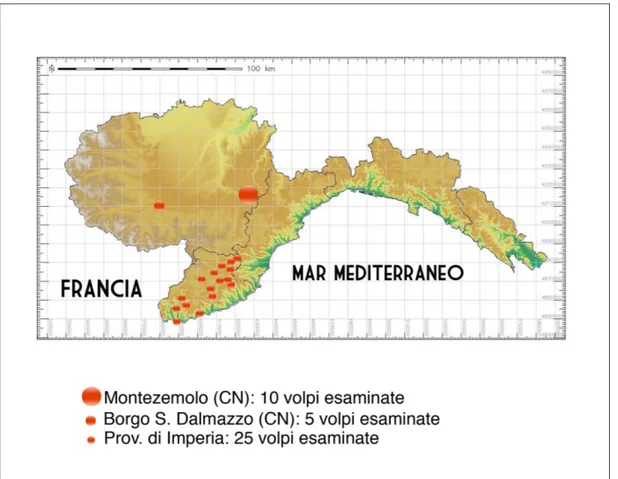
E’ stata condotta un’indagine epidemiologica parassitaria in tre aree dell’Italia Settentrionale: la provincia di Imperia e le municipalità di Montezemolo e di Borgo S. Dalmazzo, (Cuneo).
Sono state analizzate 40 volpi. Per l’esame dell’intestino è stata usata la SCT (Sedimentation and Counting Technique). Il sedimento, osservato allo stereomicroscopio, è stato poi utilizzato per indagini molecolari per la ricerca di cestodi, in particolare Echinococcus spp. Campioni fecali rettali sono stati prelevati per esami coprologici qualitativi, FLOTAC e PCR. L’apparato cardiopolmonare è stato sottoposto a lavaggio e sedimentazione. Porzioni di muscolo tibiale sono state esaminate con la digestione artificiale per la ricerca di larve di Trichinella spp.
I parassiti intestinali rinvenuti con SCT sono: Mesocestoides spp. 92.5%, Uncinaria stenocephala 72.5%, Toxascaris leonina 40%, Toxocara canis 22.5%, Trichuris vulpis 22.5%, Dipylidium caninum 17.5%, Taenia spp. 12.5% Pterigodermatites affinis 10%, Capillaria putorii 10%, Molineus legerae 2.5%. I parassiti cardiopolmonari trovati sono: Angiostrongylus vasorum 70%,
Eucoleus (sin. Capillaria) aerophilus 47.5% e Crenosoma vulpis 2.5%. Indagini molecolari hanno rilevato la presenza di
DNA di Echinococcus granulosus equinus in una volpe, ma il parassita non è stato rinvenuto alla necroscopia. Agli esami coprologici si sono trovate uova di parassiti della famiglia Ancylostomatidae, di Capillaria spp, T. leonina, T. canis, T.
vulpis, Strongyloides spp, Mesocestoides spp, Taenia spp e oocisti di Isospora spp. Nessuna volpe è risultata positiva per Trichinella spp. e per filaria.
Questa indagine ha esteso le conoscenze epidemiologiche sull’elmintofauna della volpe ad un’area poco studiata. Si sono rilevate sia specie intestinali tipiche che altre più rare, alcune zoonotiche. Si riscontra un’elevata prevalenza di nematodi cardiopolmonari, potenziali responsabili di gravi patologie respiratorie e circolatorie nel cane e nel gatto. La ricerca di Echinococcus multilocularis ha dato risultati negativi, nonostante la continuità territoriale della zona di studio con la Francia, dove il parassita è presente.
Keywords: Vulpes vulpes, helminths, zoonosis, epidemiology, North Italy
The red fox (Vulpes vulpes), the most widespread wild carnivore in Italy, is a possible reservoir of virus, bacteria, protozoa, helminths and arthropods that can be transmitted both to domestic and wild animals and to humans (zoonosis).
A parasitological survey was carried out in the following three areas of North Italy: the county of Imperia and the towns of Montezemolo and of Borgo S.Dalmazzo (Cuneo).
A total of 40 foxes were examined. The intestine was analysed with SCT (Sedimentation and Counting Technique). The sediment was observed by stereomicroscopy and then used for molecular analyses to search for cestodes, particularly Echinococcus spp. Faecal samples from the rectum were used for qualitative copro-microscopical analysis, FLOTAC technique and PCR. Cardiopulmonary apparatus was investigated by washing and sedimentation. Fragments of tibial muscle were submitted to artificial digestion to search for larvae ofTrichinella spp.
The following intestinal parasites were found with SCT: Mesocestoides spp. 92.5%, Uncinaria stenocephala 72.5%,
Toxascaris leonina 40%, Toxocara canis 22.5%, Trichuris vulpis 22.5%, Dipylidium caninum 17.5%, Taenia spp. 12.5%, Pterigodermatites affinis 10%, Capillaria putorii 10%, Molineus legerae 2.5%. The cardiopulmonary parasites found were: Angiostrongylus vasorum 70%, Eucoleus (sin. Capillaria) aerophilus 47.5%, Crenosoma vulpis 2.5%. PCR detected DNA of Echinococcus granulosus equinus in 1 fox, but the parasite was not found with necropsy. Coprological examination
revealed eggs of parasites of the family Ancylostomatidae, of Capillaria spp, T. leonina, T. canis, T. vulpis, Mesocestoides spp, Taenia spp and oocysts of Isospora spp. Trichinella spp and filariae were absent.
This survey extends epidemiological knowledge about the fox helminth community to an area poorly studied. Both typical intestinal species and more rare ones were found, some of them zoonotic. Particularly relevant appears the high prevalence of cardiopulmonary nematodes, potential causes of severe respiratory and vascular distress in dogs and cats. Echinococcus multilocularis was not found, despite proximity of the study area with France, where it is present.
1. INTRODUZIONE
La volpe rossa (Vulpes vulpes, L. 1785) è il carnivoro selvatico più diffuso sul territorio italiano (Genovesi 2001) e in tutto l'emisfero settentrionale. Il suo areale di distribuzione interessa quasi interamente il continente eurasiatico e il Nord America (Macdonalds et al. 2004), grazie all'adattabilità agli ambienti più eterogenei, dalla montagna fino ai centri urbani (Spagnesi e De Marinis 2002).
La diffusa presenza sul territorio, insieme all'alta socialità intraspecifica, rendono questa specie un ottimale serbatoio di agenti eziologici di varie malattie: virali (rabbia, malattia di Aujeszky, encefalomielite virale, parvovirosi, cimurro, epatite infettiva), batteriche (tularemia, brucellosi, borreliosi, salmonellosi, listeriosi, yersiniosi, leptospirosi) e parassitarie (da protozoi: toxoplasmosi, leishmaniosi; da elminti: echinococcosi, teniasi, trichinellosi, ascaridiosi, ancilostomosi, angiostrongilosi, filariosi; da ectoparassiti: rogna, dermatofitosi). Tali malattie possono interessare anche altre specie animali, selvatiche e domestiche, ed essere responsabili di zoonosi. Lo studio della specie Vulpes vulpes riveste quindi notevole importanza sia da un punto di vista medico che veterinario. Tra le zoonosi elmintiche di particolare interesse si ricordano l'echinococcosi alveolare, la toxocariosi e la trichinellosi.
L'echinococcosi alveolare è sostenuta dalla forma larvale del cestode Echinococcus multilocularis (Leukart 1863). L'uomo si infesta attraverso l'ingestione di uova del parassita, andando a costituire un ospite accidentale nel ciclo biologico, il quale normalmente si svolge in ambito silvestre tra volpe e roditori selvatici. L'infestione umana può provocare una grave patologia con un tasso di mortalità elevato (Eckert et al. 2000). E. multilocularis è presente nelle zone a clima temperato e rigido dell'emisfero settentrionale (Jenkins et al. 2005). Fino alla fine degli anni '80 si riteneva che in Europa la sua distribuzione fosse limitata ad una zona endemica compresa tra Svizzera, Austria, Germania meridionale e Francia centrale. Negli ultimi anni vari studi europei hanno dimostrato un areale distributivo inaspettatamente più ampio. In Italia, precedentemente considerata indenne, il parassita è stato segnalato per la prima volta nel 2002 in alcune volpi della provincia di Bolzano (Manfredi et al. 2002).
La sindrome da larva migrans viscerale, dovuta alla migrazione somatica delle forme larvali degli ascaridi, in particolare di Toxocara canis, è una malattia che colpisce soprattutto i bambini a seguito dell'accidentale ingestione delle uova larvate. Le larve sono responsabili di lesioni a livello epatico, polmonare e oculare. I fattori di rischio più importanti per la popolazione umana sono la contaminazione ambientale da uova del parassita, alla quale le volpi infestate possono contribuire,
e il mancato rispetto delle norme igieniche.
La trichinellosi è una patologia sostenuta da parassiti del genere Trichinella. L'unica specie autoctona in Italia è T. britovi, di cui la volpe rossa è il principale serbatoio. La patologia si manifesta a seguito dell'ingestione di carni crude o poco cotte contaminate dalle larve del parassita. La volpe può infestare l'uomo indirettamente con la trasmissione al cinghiale; molto più di rado, direttamente, nel caso di consumo delle sue carni.
La maggior parte delle specie parassitarie che colpiscono la volpe sono comuni agli animali domestici, pertanto questo canide, oltre a rivestire un ruolo importante come reservoir, rappresenta un buon indicatore per lo studio della prevalenza di questi parassiti.
Il ruolo della volpe come potenziale portatrice di agenti patogeni per altre specie viventi va tenuto in particolare considerazione alla luce del recente fenomeno dell'urbanizzazione (vedi Cap. 3). Le popolazioni di volpi urbane sono ormai molto numerose e interessano svariate città europee. Il comportamento sinantropo favorisce il contatto con la popolazione umana e con gli animali domestici e conseguentemente il rischio di trasmissione di agenti patogeni.
2. SCOPO DEL LAVORO
Scopo di questa tesi è lo studio della biocenosi parassitaria di un gruppo di volpi provenienti dal comprensorio delle Alpi Marittime.
Non ci risultano in letteratura indagini epidemiologiche sui parassiti intestinali e cardiopolmonari di volpi provenienti dall'area presa in esame. Si è pertanto voluto eseguire uno screening epidemiologico dell'elmintofauna di questa specie, per aggiornare il quadro degli studi condotti in altre regioni. In particolare l'attenzione è stata rivolta agli elminti responsabili di zoonosi e ai parassiti cardiopolmonari (tra cui Angiostrongylus vasorum, Eucoleus aerophilus, Crenosoma vulpis). Per questi ultimi infatti gli studi disponibili in letteratura sono decisamente meno numerosi di quelli sui parassiti gastro-intestinali.
Inoltre, alla luce del recente ampliamento dell'areale di distribuzione di Echinococcus multilocularis, se ne è voluta verificare l'eventuale presenza, data la continuità territoriale dell'area di studio con la Francia, stato in cui la presenza del parassita è documentata.
3. LA VOLPE ROSSA: BIOLOGIA E INURBAMENTO
Lo studio delle malattie infettive e parassitarie in ambito silvestre non può prescindere dalla conoscenza di alcuni aspetti fondamentali della biologia delle specie che partecipano al ciclo degli agenti patogeni. Particolare rilevanza rivestono la consistenza e la densità delle popolazioni animali, l'organizzazione territoriale, l'erratismo, il comportamento sociale e l'alimentazione (Agrimi e Di Guardo 1997).
Verranno pertanto illustrate di seguito le caratteristiche biologiche delle volpe rossa e il recente fenomeno dell'urbanizzazione.
3.1 Categoria tassonomica
Regno : Animalia Phylum: Chordata Sezione: Vertebrata Classe: Mammifera Ordine: Carnivora Superfamiglia: Cinofeloidea Famiglia: Canidae Genere: VulpesSpecie: Vulpes vulpes (Linnaeus, 1758)
In Italia si riconoscono due sottospecie:
- Vulpes vulpes crucigera (Bechstein 1789): penisola e isole maggiori eccetto la Sardegna - Vulpes vulpes ichnusae (Miller 1907): Sardegna
3.2 Distribuzione
La volpe rossa o volpe comune (Vulpes vulpes L. 1758) è originaria dell’emisfero settentrionale. È presente in tutto il continente euroasiatico, dall’Irlanda allo Stretto di Bering; il suo areale si estende verso sud in Giappone, Cina e regioni settentrionali dell'India e dell'Indocina. È diffusa nelle regioni costiere del Nord Africa e lungo la valle del Nilo, nonché in tutto il Medio Oriente a
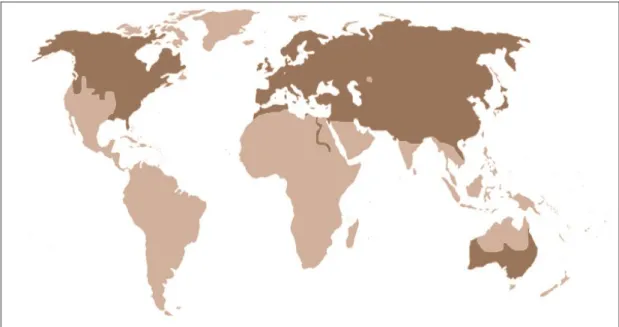
eccezione delle zone del deserto centrale della penisola arabica. In Nord America è distribuita dalle Isole Aleutine (Alaska) alla costa caraibica del Texas. È presente anche in Australia, dove è stata introdotta alla fine del XIX secolo. [Fig. 1]
Fig. 1 - Distribuzione mondiale della volpe rossa
In Italia è il carnivoro più diffuso ed omogeneamente distribuito, trovandosi su tutta la penisola e sulle isole maggiori. L’enorme areale della volpe rossa ne testimonia l’alto grado di adattabilità e di plasticità ecologica, comune a tutta la famiglia dei canidi. (Spagnesi e De Marinis 2002)
3.3 Morfologia
La volpe rossa presenta corporatura snella, con testa piccola e muso allungato ed appuntito; occhi obliqui e vivaci, con pupille ellittiche, orecchie grandi erte sul capo, aguzze, di colore fulvo alla base e scure all'apice. [Fig. 2]
La lunghezza del corpo va da 57 a 77 cm, l'altezza al garrese è di 40 cm circa. La coda può misurare fino a 40 cm. Peso medio: 4-6 kg per le femmine, 6-8 kg per i maschi.
Il colore del mantello è bruno fulvo, tendente al rossastro sul dorso, più intenso sul muso e sulla linea mediana dorsale, bianco sul collo e sul petto, bianco-grigio sul ventre. La coda, molto folta, è bruno rossastra con l'estremità bianca (Boitani e Vinditti 1988). L'estremità delle zampe è quasi sempre nera. Gli arti sono corti e forti, gli anteriori hanno cinque dita e sono leggermente più larghi dei posteriori, che presentano invece quattro dita. L'orma mostra l'impronta di unghie, cuscinetti digitali e cuscinetto plantare con la forma di triangolo isoscele. Gli artigli della volpe
sono parzialmente retrattili, a differenza del cane, e restano così maggiormente affilati.
Gli artigli retrattili e le pupille ellittiche sono caratteristiche comuni alla famiglia dei felidi; proprio per caratteri comuni come questi canidi e felidi sono riuniti nella superfamiglia dei Cinofeloidei.
Fig. 2 - Esemplare adulto di Vulpes vulpes
Esistono variazioni razziali notevoli: si distinguono attualmente nel mondo 46 sottospecie o razze geografiche, anche se si tratta di una classificazione non definitiva e dal limitato significato sistematico ed ecologico. La sottospecie sarda Vulpes vulpes ichnusae, ad esempio, è caratterizzata da taglia ridotta e orecchie particolarmente piccole (Spagnesi e De Marinis 2002).
Osservazioni condotte in Italia hanno inoltre rilevato individui più grandi nelle zone alpine e individui più piccoli e leggeri nelle zone di pianura e costiere (Boitani e Vinditti)
3.4 Organizzazione territoriale e densità
Ogni mammifero dispone nel corso della vita di un home range o area familiare: si definisce come tale quell'area utilizzata da un animale per le sue attività vitali: ricerca del cibo, ricerca del partner, allevamento della prole. Quella parte di home range che viene attivamente e aggressivamente difesa dai conspecifici è invece definita territorio (Boitani e Vinditti 1988). La volpe rossa è una specie stanziale. L'home range viene solitamente condiviso da una coppia maschio-femmina e stagionalmente dalla loro prole. Le dimensioni di quest'area (da 200 a 2000 ha, Boitani e Vinditti 1988) dipendono essenzialmente dalla disponibilità di fonti trofiche, dalla loro distribuzione
locale, dalla disposizione dei luoghi idonei a costituire rifugi. In ambienti con elevata disponibilità di cibo le aree familiari sono meno estese e frequentemente ospitano più soggetti, tipicamente un maschio con più femmine. La forma delle aree familiari è molto varia, i confini sono spesso delineati da limiti fisici naturali o artificiali (fossi, fiumi, laghi, strade, ferrovie, recinti). La marcatura dei confini territoriali avviene con l'urinazione e con la defecazione: le feci, scure, di odore pungente, sono lasciate in evidenza su pietre, ciuffi, d'erba, tronchi... E' stata evidenziata una certa variabilità stagionale dei confini, che possono ampliarsi nei periodi in cui le risorse alimentari scarseggiano; inoltre si può assistere a variazioni nella frequentazione e nell'utilizzo delle varie zone interne (Ables 1975, citato da Frosoni 2004).
Le dimensioni delle aree vitali sono inversamente proporzionali alla densità della popolazione volpina. Le densità più basse si ritrovano negli habitat alpini, dove le risorse trofiche sono disperse in modo uniforme; in questi casi le aree vitali dei singoli individui sono assai estese (molte centinaia di ettari). Negli agro-ecosistemi tradizionali, dove esiste una grande eterogeneità ambientale ed una distribuzione disomogenea delle risorse, si ritrovano le densità più alte e le aree vitali individuali meno estese (alcune decine di ettari) (Spagnesi e De Marinis 2002).
3.5 Organizzazione sociale e attività riproduttiva
Il gruppo sociale di base è costituito da una coppia maschio-femmina, che, come suddetto, condivide l'home range. Il legame di coppia può essere stagionale o, più frequentemente, permanente. I membri della coppia tuttavia si spostano in modo autonomo, cacciando individualmente e limitando i contatti al corteggiamento, all'accoppiamento e all'allevamento dei cuccioli. Talvolta si possono costituire gruppi con una struttura sociale più complessa, costituiti da due femmine e un maschio o da un numero più elevato di individui, fino a sei. Questi gruppi sono composti da un maschio, da una femmina dominante, che è l'unica a riprodursi, e da altre femmine, generalmente imparentate (sorelle e figlie), denominate helper in quanto aiutano nella cura della prole. La scala gerarchica sembra essere principalmente legata all'età dei soggetti. La costituzione di gruppi sociali più numerosi sembra avvenire in caso di elevata densità della popolazione, andando in questo modo a costituire un meccanismo di autoregolazione (Cavallini 2001).
La maturità sessuale viene raggiunta entro il primo anno di vita, intorno ai dieci mesi. Le femmine presentano un solo estro all'anno, che dura da uno a sei giorni, durante i quali manifestano i tipici segni del calore, tra cui il portamento alzato della coda. Anche nei maschi l'attività sessuale segue una certa ciclicità: l'attività spermatica è massima nel periodo degli
accoppiamenti, poi diminuisce (Boitani e Vinditti 1988). Il principale fattore di regolazione dell'attività riproduttiva è il fotoperiodo. Il periodo riproduttivo in Europa inizia a gennaio: gli accoppiamenti seguono ad un lungo periodo di corteggiamento da parte del maschio e frequentemente a lotte tra vari maschi (Scaramella 1984). La gestazione dura circa due mesi (49-56 giorni). I cuccioli nascono nel periodo compreso tra metà marzo e metà maggio. Il numero medio dei cuccioli varia da 3 a 8; la prolificità è strettamente correlata alla disponibilità trofica e alla densità di popolazione. Ciò costituisce uno dei fattori alla base dell'adattabilità e diffusione della volpe e dimostra la scarsa efficacia dei tentativi di riduzione della popolazione effettuati tramite abbattimento: infatti a una temporanea diminuzione della consistenza numerica della popolazione segue molto velocemente il ripopolamento.
I piccoli sono inetti e ciechi alla nascita, di colore marrone, piuttosto diversi dagli individui adulti. Essi vengono allevati in tane preparate alla fine dell'inverno: queste possiedono generalmente un ingresso stretto che porta in una prima area allargata, dalla quale si accede al nido vero e proprio. Da questa camera centrale si arriva in una camera laterale utilizzata come dispensa per il cibo accumulato durante i mesi più caldi. Tutto il complesso è sempre provvisto di almeno un'uscita secondaria, talvolta anche due. Molto frequentemente le volpi occupano le tane di altri mammiferi, soprattutto tassi e conigli, adattandole alle proprie esigenze (Scaramella 1984). I volpacchiotti sono allattati per un mese dalla madre, che alla terza settimana di vita inizia ad integrare la loro dieta con cibi solidi predigeriti. Dopo 8-10 settimane abbandonano la tana iniziando gradualmente a esplorare il territorio.
Completato lo svezzamento e l'accrescimento, tra la fine dell'estate e l'inizio dell'autunno i giovani si disperdono alla ricerca di un proprio territorio, allontanandosi anche decine di km dal luogo di nascita, alla ricerca di una zona in cui stabilire in proprio territorio. Tali spostamenti sono detti “movimenti di dispersione”, rilevanti da un punto di vista epidemiologico in quanto possono favorire la diffusione dei parassiti. In alcuni studi sono stati osservati valori di prevalenza e carico parassitario di elminti zoonotici (Toxocara canis, Echinococcus multilocularis) più elevati proprio nelle fasce d'età giovanili (Deplazes et al. 2004; Richards et al. 1995; Willingham et al. 1996).
3.6 Habitat e abitudini alimentari
La specie Vulpes vulpes si è adattata a colonizzare gli habitat più vari: praterie alpine, foreste di conifere, boschi misti e caducifogli, macchia mediterranea, pianure e colline coltivate, valli fluviali e, sempre più frequentemente, ambiente urbano (Spagnesi e De Marinis 2002). Essa predilige ambienti eterogenei, che offrono maggiore variabilità di rifugi e di risorse alimentari, che è in
grado di sfruttare adattando le sue abitudini alimentari e comportamentali (Lloyd 1975, citato da Testoni 1997).
Pur appartenendo all'ordine dei carnivori, la volpe è fondamentalmente onnivora. La dieta può essere costituita da mammiferi di piccole e medie dimensioni (generalmente arvicole, topi selvatici, ratti, conigli selvatici e lepri, occasionalmente agnelli), vegetali (frutta), invertebrati (coleotteri, chiocciole, vermi), uccelli (fagiani, galline, anatre, passeriformi...), pesci, anfibi, rettili, rifiuti e carogne (Boitani e Vinditti 1988). Ogni genere di cibo è ingerito in proporzione alla sua disponibilità nell'ambiente: questo criterio alimentare è definito opportunista e induce variazioni geografiche e stagionali della composizione dietetica. Da un'analisi generale dei risultati di diversi studi europei sull'ecologia trofica della volpe in ambiente rurale emerge ad esempio che a latitudini superiori prevalgono i vertebrati (soprattutto micromammiferi), mentre col diminuire della latitudine diventano predominanti frutta e invertebrati (Lucherini et al. 1991). Invece, per gli individui che vivono in prossimità delle discariche e nelle aree urbane, i rifiuti possono costituire la principale componente alimentare. Dal confronto tra alcuni studi sulla biologia trofica in diversi ambienti emerge che la composizione della dieta di una volpe che vive in habitat rurale e quella di una volpe urbana sono molto differenti. In città la dieta è costituita prevalentemente da cibo di origine antropogenica (rifiuti, cibo di animali domestici, non di rado volontariamente somministrato dall'uomo) e in minor misura da invertebrati, piccoli mammiferi e uccelli; in ambiente rurale si osserva una prevalenza dell'attività predatoria con la caccia a piccoli mammiferi (roditori, soprattutto Arvicolidae in centro Europa) ed uccelli, seguiti da invertebrati e frutta (Reperant et al. 2007).
3.7 Il fenomeno dell'inurbamento
L'espansione delle città durante il XX secolo è coincisa con una loro graduale e progressiva colonizzazione da parte di un vasto numero di specie selvatiche, le cui segnalazioni nei centri urbani e nelle aree periferiche sono diventate sempre più frequenti. Da una parte lo sviluppo urbano ha decisamente concorso al miglioramento delle condizioni igieniche di vita delle persone, favorendo la diminuzione dell'incidenza di molte parassitosi, dall'altra l'inurbamento esasperato ha comportato una serie di patologie inattese, tra cui alcune zoonosi da parassiti che hanno trovato un habitat adatto alla loro diffusione. Le dimensioni raggiunte da alcuni centri urbani rendono difficile un rapporto armonico tra uomo e ambiente. La presenza di edifici abbandonati e zone dismesse, soprattutto in periferia, incoraggia il sinantropismo degli animali selvatici, attratti dalla grande disponibilità di cibo rappresentata principalmente dai rifiuti (Genchi 1983). La volpe rossa
costituisce uno degli esempi meglio documentati di una specie che si è adattata con successo a vivere negli agglomerati urbani nel corso del secolo scorso (Wandeler et al. 2003).
Le prime segnalazioni della presenza stabile di volpi in zone urbane e suburbane densamente abitate risalgono agli anni 1930 e per lungo tempo furono limitate alla Gran Bretagna, per cui l'inurbamento fu inizialmente ritenuto un fenomeno esclusivamente britannico. A partire dagli anni '80, in seguito al successo della campagna vaccinale per l'eradicazione della rabbia, si è assistito nell'Europa continentale ad un aumento della consistenza numerica della popolazione volpina. Questa malattia virale aveva rappresentato un fondamentale fattore di regolazione demografica, e aveva decimato la specie in particolare negli anni 1970-1980, quando una grave epizoozia si era diffusa sul continente, risparmiando tuttavia la Gran Bretagna, rimasta sempre indenne (Deplazes et al. 2004). In corrispondenza dell'aumento demografico si è assistito alla diffusione del fenomeno dell'inurbamento in Europa continentale. Le segnalazioni di volpi urbane, che vivono stabilmente nelle aree cittadine, sia in periferia che nelle zone centrali, sono ormai numerose e riguardano moltissime città europee: Zurigo e altre 28 città svizzere, Oslo in Norvegia, Arthus e Copenhagen in Danimarca, Stoccarda e Berlino in Germania (Deplazes et al. 2004; Hofer et al. 2000), Brussels in Belgio (Brochier et al. 2007). Il fenomeno è riportato anche in città nordamericane (Los Angeles, New York, Washington, Toronto), australiane (Adelaide, Brisbane, Canberra, Melbourne, Sydney) e giapponesi (Sapporo) (Wandeler et al. 2003; Tsukada et al. 2000; thefoxwebsite.org). In Italia sono state pubblicate segnalazioni sulla presenza di volpi in contesti urbanizzati a Napoli (Guglielmi et al. 2003), Roma (Cignini e Riga 1997) e in provincia di Venezia (Bon 1998).
Il successo dell'adattamento all'habitat antropizzato è legato alla plasticità ecologica della specie, che riesce a colonizzare ambienti molto diversi. L'habitat urbano presenta alcuni vantaggi che ne hanno favorito la colonizzazione: l'elevata disponibilità di cibo da fonti antropogeniche e la relativa abbondanza di rifugi, in particolare nelle città con ampie zone residenziali ricche di giardini e aree verdi, che sembrano essere le più frequentate dalle volpi (theredfoxwebsite.org). Diversi studi sulle volpi urbane hanno dimostrato modificazioni delle abitudini eco-etologiche in città: si assiste infatti a cambiamenti della dieta (Reperant et al. 2007) e dell'organizzazione territoriale e sociale (Wandeler et al. 2003). La variazione della dieta può determinare effetti sull'epidemiologia della fauna parassitaria, per quanto riguarda i parassiti a ciclo indiretto che sfruttano la relazione preda-predatore: sono state infatti trovate prevalenze minori di tali parassiti in volpi urbane rispetto a volpi rurali della campagna circostante sia a Ginevra (Reperant et al. 2007) che a Zurigo (Hofer et al. 2000).
maggiore rispetto a quella rilevata in ambienti rurali. I valori di densità più elevati segnalati sono di 4 o 5 gruppi familiari per km² (rispettivamente De Blander et al. 2006 e Deplazes et al. 2004
citati da Brochier et al. 2007). L'alta densità comporta generalmente una diversa organizzazione territoriale e sociale: gli home-range sono ridotti, non di rado sovrapposti tra loro e i gruppi familiari sono più spesso costituiti da un maschio con alcune femmine, anziché da una coppia (Wandeler et al. 2003). In condizioni di elevata densità si ha pertanto una riduzione delle femmine che si riproducono, poiché, come già detto, nei gruppi familiari costituiti da più di due individui solo la femmina dominante si accoppia.
I già citati studi sulle cosiddette volpi urbane dimostrano come l'inurbamento sia ormai un fenomeno radicato, che determina inevitabilmente una maggiore frequenza di contatto tra questa specie, la popolazione umana e gli animali domestici, sollevando problemi sanitari, data la potenzialità della specie di costituire un reservoir di zoonosi, parassitarie e di altra natura.
Un elevato numero di studi è stato indirizzato recentemente a verificare la prevalenza di Echinococcus multilocularis e Toxocara canis in volpi che vivono in contesti fortemente abitati (Brochier et al. 2007; Deplazes et al. 2004; Reperant et al. 2007; Richards et al. 1995; Stieger et al. 2002 ). In alcuni casi sono stati rilevati valori piuttosto elevati, con prevalenze del 30% per E. multilocularis a Ginevra (Reperant et al. 2007), 47% a Zurigo (Deplazes et al. 2004) e del 50% a
Ginevra per
T. canis. In un altro studio sono state rilevate contaminazioni del suolo da uova di T. canis maggiori in ambiente urbano rispetto all'ambiente rurale. Probabilmente tale differenza è dovuta ad una maggiore concentrazione territoriale delle feci di cani, soprattutto in parchi pubblici o aree verdi (Mizgajska 2001). Tuttavia, date le elevate prevalenze di T. canis registrate, il ruolo della volpe nella contaminazione non dovrebbe essere sottovalutato (Reperant et al. 2007).
E' evidente il forte rischio delle zone suburbane e dei villaggi rurali. Qui le volpi si trovano spesso in elevata densità, presentano alte prevalenze di parassiti (Deplazes et al. 2004, Reperant et al. 2007) e si ha solitamente notevole concentrazione di animali domestici. In queste aree, inoltre, l'uso del territorio per attività lavorative (agricoltura, allevamento) o di svago (escursionismo, caccia, pesca...) può esporre maggiormente la popolazione umana al contatto con agenti patogeni (Deplazes et al. 2004).
4. ELMINTI DELLA VOLPE ROSSA
IN ITALIA E IN EUROPA
Sono di seguito elencati gli elminti parassiti della volpe rossa segnalati nelle pubblicazioni italiane ed europee, suddivisi in base al Phylum, alla Classe e alla localizzazione.
Phylum Nemathelminthes
Classe Nematoda
ESOFAGO
Famiglia Spirocercidae
Spirocerca lupi (Rudolphi, 1809)
- Segnalato in Italia da: Leoni et al. 1986, Sardegna; Polidori et al. 1985, Sardegna.
- Segnalato in Europa da: Eira et al. 2006, Portogallo; Segovia et al. 2004, Penisola Iberica; Shimalov et al. 2003, Bielorussia; Gortazar et al. 1998, Spagna; Navarrete et al. 1990, Spagna (citato da Testoni 1997).
STOMACO
Famiglia Molineidae
Olullanus tricuspis (Leuckart, 1865)
- Segnalato in Italia da: Iori et al. 1990, Lazio (prima segnalazione).
- Segnalato in Europa da: Lassnig et al. 1998, Austria; Schoffel et al. 1991, Germania.
Famiglia Physalopteridae
Physaloptera sibirica (Petrow e Gorbunow, 1931)
- Segnalato in Italia da: Ferroglio e Ragagli 2008, Piemonte e Valle d'Aosta.
- Segnalato in Europa da: Segovia et al. 2004,Spagna; Rodriguez et al. 1998, Spagna.
Famiglia Spirocercidae
Cyathospirura spp.. (Baylis, 1934)
- Segnalato in Italia da: Manfredi et al. 2003, prov. di Trento (prima segnalazione). - Segnalato in Europa da: Carvalho-Varela et al. 1985.
Mastophorus muris (Gemlin, 1790)
- Segnalato in Europa da: Segovia et al. 2004, Spagna. Vigisospirura pothekina (Petrov e Potekhina, 1953) - Segnalato in Europa da: Segovia et al. 2004, Spagna.
Famiglia Spiruridae
Spirura rytipleurites (Deslongchamps, 1824)
- Segnalato in Italia da: Iori 1990, Lazio (prima segnalazione).
Famiglia Subuluridae
Oxynema crassispiculum (Sonsino, 1889)
- Segnalato in Italia da: Di Cerbo et al. 2008 Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2004, provincia di Trento (prima segnalazione in Italia).
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna.
INTESTINO
Famiglia Ancylostomatidae
Ancylostoma caninum (Ercolani, 1859)
- Segnalato in Italia da: Balestrieri et al. 2006, Val d'Aosta; Capelli et al. 2003, provincia di Ferrara; Guberti e Poglayen 1991, Appenino Romagnolo; Iori et al. 1990, Lazio; Poglayen et al. 1988, provincia di Forlì ; Rossi et al. 1983, Piemonte; Tozzini et al. 1979, Toscana.
- Segnalato in Europa da: Saeed et al. 2006, Danimarca; Ramisz et al. 2004, Polonia; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Papadopoulos et al. 1997, Grecia; Wessbecher et al. 1994a, Germania; Ballek et al. 1992a, Wiegand e Krug 1988 (citato da Testoni 1997), Germania; Borgsteede 1984, Olanda; Pétavy et al. 1980, Francia; Williams 1976, Gran Bretagna. Uncinaria stenocephala (Railliet, 1884)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Di Cerbo et al. 2008 Trentino, Lombardia, Veneto, Valle d’Aosta; Balestrieri et al. 2006, Val d'Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Manfredi et al. 2003, provincia di Trento; Capelli et al. 2003, provincia di Vicenza, Pisa e Ferrara; Stancampiano et al. 1998, provincia di Vicenza; Poli et al. 1994, provincia di Pisa; Guberti e Poglayen 1991, Appenino Romagnolo; Iori et al. 1990, Lombardia, Trentino, Veneto, Lazio; Leoni et al.1986, Sardegna; Poglayen et al. 1985, provincia di Forlì; Rossi et al. 1983, Piemonte; Tozzini et al. 1979, Toscana; Soldati et al. 1976, Appennino
Modenese; Lai e Arru 1969, Sardegna; Giuliani et al. 1955, Provincia dell’Aquila.
- Segnalato in Europa da: Borecka et al. 2009, Polonia; Martinez-Carrasco et al. 2007, Spagna; Eira et al. 2006, Portogallo; Saeed et al. 2006 , Danimarca; Okulewicz et al. 2005, Polonia; Vervaeke et al. 2005, Belgio; Ramisz et al. 2004, Polonia; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Smith et al. 2003, Gran Bretagna; Wolfe et al. 2001, Irlanda; Criado-Fornelio et al. 2000, Spagna; Hofer et al. 2000, Svizzera; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Papadopoulos et al. 1997, Grecia; Willingham et al.1996, Danimarca; Richards et al. 1995, Gran Bretagna; Wessbecher et al. 1994a, Germania; Steinbach et al.1993, Germania;Ballek et al. 1992a, Schoffel et al. 1991, Lucius et al. 1988, Wiegand e Krug 1988 (citato da Testoni 1997) Germania; Navarrete et al. 1990, Spagna (citato da Testoni 1997); Pétavy et al. 1990, Francia; Borgsteede et al. 1984, Olanda; Grandchamp 1982, Svizzera (citato da Testoni 1997); Pétavy e Deblock 1980, Francia.
Famiglia Ascarididae
Toxocara canis (Werner, 1782)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Di Cerbo et al. 2008 Trentino, Lombardia, Veneto, Valle d’Aosta; Balestrieri et al. 2006, Val d'Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Manfredi et al. 2003, provincia di Trento; Capelli et al. 2003, provincia di Vicenza, Pisa e Ferrara; Stancampiano et al.1998, provincia di Vicenza; Poli et al. 1994, provincia di Pisa; Guberti e Poglayen 1991, Appennino Romagnolo; Iori et al. 1990, Piemonte, Lombardia, Trentino, Veneto, Lazio; Leoni et al. 1986, Sardegna; Poglayen et al. 1988, 1985, provincia di Forlì; Rossi et al. 1983, Piemonte; Tozzini et al. 1979, Toscana; Soldati et al. 1976, Appennino Modenese; Giuliani 1955 provincia dell'Aquila.
- Segnalato in Europa da: Borecka et al. 2009, Polonia; Martinez-Carrasco et al. 2007, Spagna; Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Okulewicz et al. 2005, Polonia; Vervaeke et al. 2005, Belgio; Ramisz et al. 2004, Polonia; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Smith et al. 2003,Gran Bretagna; Luty et al. 2001, Polonia; Wolfe et al. 2001, Irlanda; Criado-Fornelio 2000, Spagna; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Papadopoulos et al. 1997, Grecia; Willingham et al.1996, Danimarca; Richards et al. 1995, Gran Bretagna; Wessbecher et al. 1994a, Germania; Steinbach et al. 1994, Germania ; Uhl et al. 1993 (citato da Testoni), Germania; Ballek et al. 1992a, Germania; Schoffel et al. 1991, Germania; Pétavy et al. 1990, Francia; Wiegand e Krug 1988 (citato da Testoni), Germania; Borgsteede et al. 1984, Olanda; Pétavy e Deblock 1980, Francia; Hackett e Walters 1980; Williams 1976, Gran Bretagna.
Toxocara cati (Schrank, 1788)
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia.
Toxascaris leonina (Linstow, 1902)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Balestrieri et al. 2006, Val d'Aosta; Capelli et al. 2003, provincia di Pisa; Iori et al. 1990, Lazio; Soldati et al. 1976, Appennino Modenese.
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Saeed et al. 2006, Danimarca; Okulewicz et al. 2005, Polonia; Vervaeke et al. 2005, Belgio; Ramisz et al. 2004, Polonia; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Smith et al. 2003, Gran Bretagna; Criado-Fornelio et al. 2000, Spagna; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Papadopoulos et al. 1997, Grecia; Richards et al 1995, Gran Bretagna; Wessbecher et al. 1994, Germania; Steinbach et al. 1993, Ballek et al. 1992, Schoffel et al. 1991, Germania; Pétavy et al. 1990, Francia; Hackett e Walters 1980, Gran Bretagna; Pétavy e Deblock 1980, Francia; Williams 1976, Gran Bretagna.
Famiglia Molineidae
Molineus legerae (Durette-Desset e Pesson, 1987)
- Segnalato in Italia da: Di Cerbo et al. 2008 Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2003 Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2003, provincia di Trento (prima segnalazione).
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Durette-Desset e Pesson 1987, Belgio e Francia.
Molineus patens (Dujardin, 1845)
- Segnalato in Europa da: Eira et al. 2006, Portogallo; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Borgsteede et al. 1984, Olanda; Pétavy e Deblock 1980, Francia.
Famiglia Rictulariidae
Pterygodermatites affinis (Jagerskiold, 1904)
- Segnalato in Italia da: Di Cerbo et al. 2008 Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Manfredi et al. 2003, provincia di Trento; Capelli et al. 2003, provincia di Vicenza; Stancampiano et al. 1998, provincia di Vicenza; Iori e Leto 1990, Lombardia, Veneto, Trentino (prima segnalazione).
Segovia et al.2004, Spagna; Gortazar et al. 1998, Spagna; Pétavy et al. 1990,Francia. Rictularia proni (Seurat, 1915)
- Segnalato in Italia da : Leoni et al. 1986, Sardegna (Rictularia spp.).
- Segnalato in Europa da: Eira et al. 2006, Portogallo; Papadopoulos et al. 1997, Grecia.
Famiglia Strongyloididae
Strongyloides vulpis (Petrow, 1941)
- Segnalato in Europa da: Shimalov et al. 2003, Bielorussia; Borgsteede et al. 1984, Olanda.
Famiglia Trichinellidae
Trichinella spp..(Railliet, 1895)
- Segnalato in Italia da: Balestrieri et al. 2006, Val d'Aosta; Balbo e Rossi 1992, Piemonte e Valle d’Aosta; Rossi et al. 1992; Iori et al. 1990, Lazio; Soldati et al. 1976, Appennino Modenese.
- Segnalato in Europa da: Davidson et al. 2006, Norvegia; Okulewicz et al. 2005, Polonia; Shimalov et al. 2003, Bielorussia; Sréter et al. 2003, Ungheria; Criado-Fornelio et al. 2000, Spagna; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria.
Famiglia Trichuridae
Trichuris vulpis (Frohlich, 1789)
- Segnalato in Italia da: Di Cerbo et al. 2008b, Trentino; Balestrieri et al. 2006, Val d'Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Manfredi et al. 2003, provincia di Trento; Capelli et al. 2003, provincia di Vicenza, Pisa, Ferrara; Stancampiano et al. 1998, provincia di Vicenza; Guberti e Poglayen 1991, Appenino Romagnolo; Iori et al. 1990, Piemonte, Veneto, Trentino; Poglayen 1988, provincia di Forlì; Leoni et al. 1986, Sardegna; Poglayen et al. 1985,provincia di Forlì; Soldati et al. 1976, Appennino Modenese.
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Ramisz et al. 2004, Polonia; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Smith et al. 2003, Gran Bretagna; Criado-Fornelio et al. 2000, Spagna; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Papadopoulos et al. 1997, Grecia; Richards et al. 1995, Gran Bretagna; Schoffel et al. 1991, Germania; Carvalho-Varela e Marcos 1990, Portogallo (citato da Richards 1995); Pétavy et al. 1990, Francia.
Aonchotheca putorii (Rudolphi, 1819) (sin. Capillaria putorii)
- Segnalato in Italia da: Di Cerbo et al. 2008b, Trentino, Lombardia, Veneto, Valle d’Aosta; Di Cerbo et al. 2004, provincia di Trento; Manfredi et al. 2003, provincia di Trento; Iori et al. 1990, Trentino, Lazio (prima segnalazione).
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Ballek et al. 1992a, Germania
Famiglia Trichostrongylidae
- Segnalato in Europa da: Papadopoulos et al. 1997, Grecia; Pétavy et al. 1990, Francia (senza identificazione di specie-genere).
APPARATO CARDIO-CIRCOLATORIO
Famiglia Angiostrongylidae
Angiostrongylus vasorum (Bailliet, 1866)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Iori et al. 1990, Lazio; Poli et al. 1983, 1984, 1985, 1991, 1994Toscana; Leoni et al. 1986, Sardegna; Arispici e Poli 1982, Toscana;
- Segnalato in Europa da: Morgan et al. 2008, Gran Bretagna; Martinez-Carrasco et al. 2007, Spagna; Saeed et al. 2006, Danimarca; Eira et al. 2006, Portogallo; Mañas et al. 2005, Spagna; Segovia et al. 2004, Spagna; Sréter et al. 2003, Ungheria; Gortazar et al. 1998 Spagna; Willingham et al. 1996, Danimarca; Simpson et al. 1996 Gran Bretagna.
Fam. Onchocercidae
Dirofilaria immitis (Leidy, 1856)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Marconcini et al. 1996, Toscana; Leoni et al. 1986; Sardegna; Poli et al. 1983, provincia di Pisa; Gradoni et al. 1980.
- Segnalato in Europa da: Eira et al. 2006, Portogallo; Mañas et al. 2005, Spagna; Segovia et al. 2004, Spagna; Gortazar et al. 1998, Spagna; Gortazar et al. 1994, Spagna.
APPARATO RESPIRATORIO
Famiglia Crenosomatidae
Crenosoma vulpis (Dujardin, 1845)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Manfredi et al. 2003, provincia di Trento; Poli et al. 1994, 1985, 1983, provincia di Pisa; Iori et al. 1990, Trentino, Lazio; Rossi et al. 1983,
Piemonte; Giuliani 1955, provincia dell'Aquila.
- Segnalato in Europa da: Morgan et al. 2008, Gran Bretagna; Saeed et al. 2006, Danimarca; Davidson et al. 2006, Norvegia; Eira et al. 2006, Portogallo; Mañas et al. 2005, Spagna; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Sréter et al. 2003, Ungheria; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Willingham et al. 1996, Danimarca; Steinbach et al. 1994, Schoffel et al. 1991, Germania; Borgsteede et al. 1984, Olanda.
Famiglia Trichuridae
Eucoleus aerophilus (Creplin, 1839) (sin. Capillaria aerophila)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Balestrieri et al. 2006, Val d'Aosta; Manfredi et al. 2003, provincia di Trento; Poli et al. 1994, 1985, 1983 provincia di Pisa; Iori et al. 1990, Piemonte, Veneto, Lazio; Leoni et al. 1986, Sardegna; Polimenidis 1963 (citato da Testoni 1997). - Segnalato in Europa da: Borecka et al. 2009, Polonia; Morgan et al. 2008, Gran Bretagna; Martinez-Carrasco et al. 2007, Spagna; Davidson et al. 2006, Norvegia; Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Mañas et al. 2005, Spagna; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Sréter et al. 2003 Ungheria; Wolfe et al. 2001, Irlanda; Criado-Fornelio et al. 2000, Spagna; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Richards et al. 1995 (reperto occasionale, studio sui parassiti intestinali), Gran Bretagna; Steinbach et al. 1993, Germania; Schoffel et al. 1991, Germania; Navarrete et al. 1990, Spagna (citato da Testoni 1997); Lucius et al. 1988, Germania; Borgsteede et al. 1984, Olanda.
Capillaria böhmi (Supperer, 1953)
Segnalato in Europa da: Davidson et al. 2006, Norvegia; Sréter et al. 2003, Ungheria; Lassnig et al. 1998, Austria.
APPARATO URO-GENITALE
Famiglia Trichuridae
Pearsonema plica (Rudophi, 1819) (sin. Capillaria plica)
- Segnalato in Italia da: Iori et al. 1990, Piemonte, Veneto, Trentino, Lazio.
- Segnalato in Europa da: Davidson et al. 2006, Norvegia; Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Sreter et al. 2003, Ungheria; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Steinbach et al. 1993, Germania; Schoffel et al. 1991, Lucius et al. 1988, Germania; Borgsteede et al. 1984, Olanda.
SOTTOCUTE
Famiglia Onchocercidae
Dirofilaria repens (Railliet e Henry, 1911)
- Segnalato in Italia da: Magi et al. 2008, Toscana; Marconcini et al. 1996, Toscana; Gradoni et al. 1980, provincia di Grosseto; Mantovani e Tsaglis 1965, Italia Centrale.
Acanthocheilonema dracunculoides (Cobbold, 1870) (sin. Dipetalonema dracunculoides)
- Segnalato in Italia da: Magi et al. 2008, Toscana; Iori et al. 1990, Lazio; Marconcini et al. 1989, Toscana; Cancrini 1986, provincia di Roma; Gradoni et al 1980, provincia di Grosseto.
Acanthocheilonema reconditum (Grassi, 1889)(sin. Dipetalonema reconditum) - Segnalato in Italia da: Magi et al. 2008, Toscana.
OCCHIO
Thelazia callipaeda (Railliet e Henry, 1911)
- Segnalato in Italia da: Rossi e Bertaglia 1989, Piemonte.
Phylum Platyhelminthes
Classe Cestoda
INTESTINO
Ordine Cyclophyllidea Famiglia Taeniidae Taenia spp. (L.1785)- Segnalato in Italia da : Di Cerbo et al. 2008a, provincia di Trento e Belluno; Di Cerbo et al. 2003 Trentino, Lombardia, Veneto, Valle d’Aosta; Stancampiano et al.1998, provincia di Vicenza; Guberti e Poglayen 1991, Appennino Romagnolo; Poglayen et al. 1985, provincia di Forlì; Tozzini et al. 1979, Toscana.
- Segnalato in Europa da: Borecka et al. 2009, Polonia; Saeed et al. 2006, Danimarca;Okulewicz et al. 2005, Polonia; Vervaeke et al. 2005, Belgio; Ramisz et al. 2004, Polonia; Smith et al. 2003, Gran Bretagna; Wolfe et al. 2001,Irlanda; Lassnig et al.1998, Austria; Papadopoulos et al. 1997, Grecia; Pfeiffer et al. 1997, Germania; Willingham et al. 1996, Danimarca; Borgsteede et al. 1984, Olanda.
Taenia pisiformis (Bloch, 1780)
- Segnalato in Italia da: Iori et al. 1990, Piemonte, Lombardia, Veneto; Poglayen et al. 1988; Rossi et al. 1983; Soldati et al. 1976, Appennino Modenese; Giuliani 1955, provincia dell'Aquila
- Segnalato in Europa da :Martinez-Carrasco et al. 2007, Spagna; Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Smith et al. 2003, Gran Bretagna; Criado-Fornelio et al. 2000, Spagna; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Pfeiffer et al. 1997a, Germania; Richards et al. 1995, Gran Bretagna; Ballek et al. 1992b, Germania; Jones e Walters 1992, Gran Bretagna; Lucius et al. 1988, Germania; Pétavy e Deblock 1980, Francia (forme immature); Williams 1976, Gran Bretagna.
Taenia hydatidgena (Pallas, 1766)
- Segnalato in Italia da: Di Cerbo et al. 2008b, Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Guberti e Poglayen 1991, Appennino Romagnolo; Poglayen et al. 1985, 1988, provincia di Forlì.
- Segnalato in Europa da: Saeed et al. 2006, Danimarca; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Papadopoulos et al. 1997, Grecia; Richards et al. 1995 Gran Bretagna; Ballek et al.1992b, Germania; Hackett e Walters 1980, Williams 1976, Gran Bretagna.
Taenia taeniformis (Batsch, 1786)
- Segnalato in Italia da: Di Cerbo et al. 2008b, Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2004, provincia di Trento; Soldati et al. 1976, Appennino Modenese.
- Segnalato in Europa da: Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Pfeiffer et al.1997, Germania; Wessbecher et al. 1994b, Germania; Ballek et al. 1992b, Germania; Schoffel et al. 1991, Germania.
Taenia crassiceps (Zeder 1800)
- Segnalato in Italia da: Di Cerbo et al. 2008b, Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2004, provincia di Trento; Capelli et al. 2003, provincia di Vicenza e Ferrara; Stancampiano et al. 1998, provincia di Vicenza; Guberti e Poglayen 1991, Appennino Romagnolo; Iori et al. 1990, Piemonte Lombardia, Trentino; Poglayen et al. 1985, provincia di Forlì; Rossi et al. 1983, Piemonte.
- Segnalato in Europa da: Saeed et al. 2006, Danimarca; Segovia et al. 2004, Spagna; Shimalov et al. 2003; Bielorussia; Lassnig et al. 1998, Austria; Papadopoulos et al. 1997, Grecia; Pfeiffer et al.
1997, Germania; Wessbecher et al. 1994b, Germania; Ballek et al 1992b, Germania; Schoffel et al. 1991, Germania; Pétavy et al. 1990, Francia;Grandchamp 1982, Svizzera; Pétavy e Deblock 1980, Francia.
Taenia polyacantha (Leukart, 1856)
- Segnalato in Italia da: Manfredi et al. 2003, provincia di Trento; Capelli et al. 2003, provincia di Vicenza; Stancampiano et al. 1998, provincia di Vicenza; Iori et al. 1990, Piemonte Lombardia, Veneto, Trentino, Lazio; Rossi et al. 1983, Piemonte.
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Gortazar et al. 1998, Spagna; Lassnig et al. 1998, Austria; Pfeiffer et al. 1997, Germania; Wessbecher et al. 1994b, Germania; Ballek et al. 1992b, Germania; Jones e Walters 1992, Gran Bretagna; Pétavy et al.1990, Francia; Pétavy e Deblock 1980, Francia.
Taenia multiceps
(
Leske, 1780)
(sin. Multiceps multiceps)- Segnalato in Italia da : Soldati et al. 1976, Appennino Modenese.
- Segnalato in Europa da: Gortazar et al. 1998, Spagna; Ballek et al. 1992b, Germania; Hackett e Walters 1980 Gran Bretagna.
Taenia ovis (Cobbold, 1869)
- Segnalato in Europa da: Pétavy e Deblock 1980, Francia (forme immature); Williams 1976, Gran Bretagna.
Taenia cervi (Christiansen, 1931)
- Segnalato in Europa da: Lucius et al.1988, Germania. Taenia serialis, subsp serialis
- Segnalato in Europa da: Pfeiffer et al.1997, Germania; Ballek et al. 1992b, Germania; Jones e Walters 1992, Gran Bretagna; Schoffel et al. 1991 Germania.
Taenia martis
- Segnalato in Europa da: Ballek et al. 1992b, Germania. Echinococcus multilocularis (Leukart, 1863)
- Segnalato in Italia da: Di Cerbo et al. 2008 Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2005, Trentino; Manfredi et al 2002, Trentino (prima segnalazione).
- Segnalato in Europa da: Borecka et al. 2009, Polonia; Hanosset et al. 2008, Belgio; Brochier et al. 2007, Belgio; Saeed et al. 2006, Danimarca; Okulewicz et al. 2005, Polonia; Vervaeke et al.
2005, Belgio; Ramisz et al. 2004, Polonia; Shimalov et al. 2003, Bielorussia; Raoul et al. 2001, Francia; Deplazes et al.1999, Svizzera; Lassnig et al. 1998, Austria; Wessbecher et al. 1994b, Germania; Ballek et al. 1992b, Germania; Trambenkova 1992, Russia (citato da Testoni); Pétavy et al. 1990, Francia; Cook et al. 1989, Gran Bretagna; Pétavy e Deblock 1980, Francia.
Echinococcus granulosus (Batsch, 1786)
- Segnalato in Italia da: Leoni et al. 1986, Sardegna (un unico esemplare immaturo); Arru et al. 1969 Sardegna (stadi immaturi); Giuliani 1955, provincia dell'Aquila (stadi immaturi).
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Richards et al. 1995, Gran Bretagna; Jones e Walters 1992, Gran Bretagna; Trambenkova 1992, Russia (citato da Testoni); Hackett e Walters 1980, Gran Bretagna; Sanchez et al. 1977 (citato da Gortazar et al.1998), Spagna.
Famiglia Mesocestoididae
Mesocestoides spp.. (Valliant, 1863)
- Segnalato in Italia da: Leoni et al. 1986, Sardegna; Capelli et al. 2003, provincia di Pisa e Ferrara; Tozzini et al. 1979, Toscana.
- Segnalato in Europa da: Borecka et al. 2009, Polonia; Saeed et al. 2006, Danimarca; Segovia et al. 2004, penisola iberica; Eira et al. 2006, Portogallo; Gortazar et al. 1998, Spagna; Ramisz et al. 2004, Polonia; Lassnig et al. 1998, Austria; Papadopoulos et al. 1997, Grecia Pfeiffer et al. 1997, Germania; Wessbecher et al. 1994b, Germania; Ballek et al. 1992b, Germania; Jones e Walters 1992, Gran Bretagna.
Mesocestoides lineatus (Goeze, 1872)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Di Cerbo et al. 2008, Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2003, provincia di Trento; Guberti e Poglayen 1991, Appenino Romagnolo; Poglayen et al. 1988, 1985, provincia di Forlì; Tozzini et al. 1979, Toscana; Soldati et al. 1976, Appennino Modenese.
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Okulewicz et al. 2005, Polonia; Shimalov et al. 2003, Bielorussia; Criado-Fornelio et al. 2000, Spagna; Willingham et al. 1996, Danimarca; Navarrete et al. 1990, Spagna (citato da Testoni); Wiegan e Krug 1988, Germania (citato da Testoni).
Mesocestoides litteratus (Batsch, 1786)
- Segnalato in Italia da: Iori et al. 1990, Lombardia; Veneto, Trentino e Lazio; Giuliani 1955, provincia dell'Aquila.
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Pétavy et al. 1990, Francia; Pétavy e Deblock 1980, Francia.
Famiglia Dilepididae
Dipylidium caninum (L. 1758)
- Segnalato in Italia da: Magi et al. 2009, Toscana; Capelli et al. 2003, provincia di Pisa e Ferrara; Guberti e Poglayen 1991, Appennino Romagnolo; Poglayen et al. 1985, 1988, provincia di Forlì. - Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Vervaeke et al. 2005, Belgio; Smith et al. 2003, Gran Bretagna; Shimalov et al. 2003, Bielorussia; Papadopoulos et al. 1997, Grecia; Pfeiffer et al. 1997, Germania; Richards et al. 1995, Gran Bretagna; Wessbecher et al. 1994, Germania; Jones e Walters 1992, Gran Bretagna; Hackett e Walters 1980, Gran Bretagna. Diplopylidium noelleri (Skrjabin, 1924)
- Segnalato in Italia da: Leoni et al. 1986, Sardegna.
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Gortazar et al. 1998, Spagna. Joyeuxiella spp..
- Segnalato in Italia da: Leoni et al. 1986, Sardegna. Joyeuxiella echinorhynchoides (Sonsino, 1889)
- Segnalato in Italia da: Iori et al.1990, Lazio (prima segnalazione).
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Papadopoulos et al. 1997, Grecia. Joyeuxiella pasqualei (Diamare, 1893)
- Segnalato in Italia da: Giuliani 1955, provincia dell'Aquila.
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Segovia et al. 2004, Spagna; Gortazar et al. 1998, Spagna.
Amoebotaenia paradoxa (Rudolphi, 1802)
Famiglia Hymenolepididae Hymenolepsis spp..(Weinland, 1858)
- Segnalato in Europa da: Pfeiffer 1997, Germania; Borgsteede 1984, Olanda.
Ordine Pseudophyllidea Famiglia Diphyllobothriidae Diphyllobothrium latum (L. 1758)
- Segnalato in Europa da: Wessbecher et al. 1994b, Germania; Carvalho-Varela e Marcos 1993, Portogallo.
Spirometra erinacei (Rudolphi, 1819)
- Segnalato in Italia da: Capelli et al. 2003, provincia di Ferrara.
- Segnalato in Europa da: Shimalov et al. 2003, Bielorussia; Papadopoulos et al. 1997, Grecia.
Classe Trematoda
INTESTINO
Famiglia Brachylaimidae
Brachylaima recurva (Dujardin, 1845)
- Segnalato in Europa da: Richards et al. 1995, Gran Bretagna; Segovia et al. 2004, Spagna; Edwards et al. 1979, Gran Bretagna (cit. da Richards 1995).
Famiglia Diplostomidae
Alaria alata (Goeze, 1782)
- Segnalato in Europa da: Borecka et al. 2009, Polonia; Saeed et al.2006, Danimarca; Segovia et al. 2004, Spagna; Eira et al. 2006, Portogallo; Ramisz et al. 2004, Polonia; Shimalov et al. 2003, Bielorussia; Wolfe et al. 2001, Irlanda; Criado-Fornelio et al. 2000, Spagna; Papadopoulos et al. 1997, Grecia; Schoffel et al. 1991, Germania; Lucius et al 1988, Germania; Borgsteede et al. 1984, Olanda.
Pharyngostomum cordatum (Diesing, 1850)
- Segnalato in Italia da: Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2003; Trentino, Lombardia, Veneto, Valle d’Aosta; Manfredi et al. 2003, provincia di Trento.
Famiglia Echinostomatidae
Echinochasmus perfoliatus (Ratz, 1908)
- Segnalato in Europa da: Saeed et al. 2006, Danimarca; Shimalov et al. 2003, Bielorussia. Echinostoma revolutum (Fröhlich 1802)
- Segnalato in Europa da: Borecka et al. 2009, Polonia. Isthmiophora melis (Schrank 1788) (sin. Euparyphium melis)
- Segnalato in Europa da: Shimalov et al. 2003, Bielorussia; Borgsteede et al. 1984, Olanda.
Famiglia Heterophyidae
Cryptocotyle lingua (Creplin 1825)
- Segnalato in Europa da: Saeed et al. 2006, Danimarca; Richards et al. 1995, Gran Bretagna; Borgsteede et al. 1984, Olanda.
Cryptocotyle concava (Creplin 1825)
- Segnalato in Europa da: Malczewsky 1962, Polonia (citato da Testoni 1997). Apophallus donicum (Skrjiabin e Lindtrop, 1919)
- Segnalato in Europa da: Shimalov et al. 2003, Bielorussia; Schoffel et al. 1991, Germania Borgsteede et al. 1984, Olanda.
Apophallus muhlingi (Jagerskiold, 1899)
- Segnalato in Europa da: Malczewsky 1962, Polonia (citato da Testoni 1997). Ascocotyle longa(Ransom, 1920)
- Segnalato in Europa da: Eira et al. 2006, Portogallo.
Famiglia Plagiorchiidae
Plagiorchis elegans (Rudolphi, 1802).
- Segnalato in Italia da: Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2004, provincia di Trento (prima segnalazione in Italia).
FEGATO
Famiglia Opistorchiidae
Metorchis vulpis (Looss, 1899)
- Segnalato in Italia da: Di Cerbo et al. 2008a, provincia di Trento e Belluno; Manfredi et al. 2005, Trentino, Lombardia, Veneto, Valle d’Aosta, Liguria; Di Cerbo et al. 2004, provincia di Trento (prima segnalazione in Italia).
Metorchis albidus (Braun, 1893)
- Segnalato in Europa da: Gortazar et al. 1998, Spagna; Schoffel et al. 1991, Germania. Metorchis bilis (Braun, 1790)
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Schuster et al. 1999, Germania.
Opistorchis felineus (Rivolta 1884) (sin. O. Tenuicollis) - Segnalato in Italia da: Iori et al. 1990, Lazio.
- Segnalato in Europa da: Segovia et al. 2004, Spagna; Shimalov et al. 2003, Bielorussia; Schuster et al. 1999, Germania; Lucius et al. 1988, Germania; Shoffel et al. 1991, Germania.
Pseudamphistomum truncatum (Rudolphi 1819)
- Segnalato in Europa da: Eira et al. 2006, Portogallo; Saeed et al. 2006, Danimarca; Shimalov et al. 2003, Bielorussia; Shoffel et al. 1991, Germania.
Famiglia Dicroceliidae
Dicrocelium dendriticum (Rudolphi, 1819)
- Segnalato in Europa da: Shimalov et al. 2003, Bielorussia.
Phylum ACANTHOCEPHALA
INTESTINO
Famiglia Oligacanthorynchidae
Macracanthorhynchus catulinus (Kostylew, 1927)
- Segnalato in Europa da: Martinez-Carrasco et al. 2007, Spagna; Eira et al. 2006, Portogallo; Segovia et al.2004, Spagna; Shimalov et al.2003, Bielorussia; Richards et al. 1995, Gran Bretagna; Troitskaya 1955, Russia (citato da Richards et al. 1995).
Oncicola canis (Kaupp, 1909)
- Segnalato in Europa da: Papadopoulos et al. 1997, Grecia.
Famiglia Plagiorhynchidae
Prosthorhynchus transversus(Rudolphi 1819)
5. ELMINTI DELLA VOLPE ROSSA
OGGETTO DI STUDIO
Di seguito verranno descritti le specie elmintiche rinvenute nel corso di questo studio epidemiologico; inoltre verranno trattati quei parassiti per i quali sono state condotte indagini specifiche.
Phylum Nemathelminthes
Gli organismi appartenenti al Phylum presentano corpo cilindrico non metamerico con un'ampia cavità celomatica (pseudoceloma) contenente fluido, a pressione più elevata rispetto ai tessuti circostanti. La differenza di pressione è funzionale al movimento, tipicamente sinusoidale. Il corpo è ricoperto da una cuticola. Possiedono un apparato digerente completo. I sessi sono separati, tipica è la minore dimensione dei maschi rispetto alle femmine all’interno della specie.
Classe Nematoda
Delle sei classi appartenenti al Phylum Nemathelminthes solo la classe Nematoda ha interesse parassitologico. Una possibile classificazione delle specie parassitarie di interesse veterinario distingue due grandi gruppi all'interno della classe: bursati e non bursati, in riferimento alla presenza o meno di una borsa copulatrice a livello dell'estremità caudale del maschio, costituita da espansioni dorsali, ventrali e laterali della cuticola.
Ordine Strongylida (Nematodi bursati)
Famiglia Ancylostomatidae
Caratterizzata da estremità cefalica ripiegata dorsalmente, per cui gli elminti di questa famiglia sono spesso definiti “vermi a uncino”; capsula buccale ben sviluppata, armata di denticoli o di placche taglienti; borsa copulatrice con lobi laterali e dorsali ugualmente sviluppati e spicoli lunghi, sottili e flessibili. Appartengono alla famiglia 18 generi ma le specie zoonotiche appartengono tutte al genere Ancylostoma.
Uncinaria stenocephala (Railliet, 1884) -Ospiti: canidi, felidi
-Localizzazione: intestino tenue -Distribuzione in Europa: ubiquitaria
-Morfologia: parassita biancastro, lungo circa 1 cm x 120-180 μm (maschio 5-9 mm, femmina 7-13 mm), con capsula buccale dotata sul margine esterno di due placche taglienti laterali e di un paio di denticoli alla base. Altri denticoli sono al fondo della capsula. Il maschio possiede una borsa copulatrice trilobata [Foto 1-2] e spicoli lunghi 640-760 μm. Uova elissoidi, a 4-8 nuclei di segmentazione quando eliminate dall'ospite, misurano 71-93 x 37-55 μm.
-Ciclo biologico: le uova deposte dalle femmine sono eliminate con le feci e maturano nell'ambiente esterno a temperature comprese tra 15-25 °C e umidità idonea. La forma infestante è costituita dalle larve L3 che infestano l'ospite per os oppure per cutem; la prima via di trasmissione sembra essere più frequente per la specie in questione, infatti le larve penetrate per cutem difficilmente raggiungono la sede intestinale. Giunte nell'intestino dell'ospite, le larve maturano ad adulti. Periodo prepatente: 3-4 settimane. Il periodo patente dipende dallo stato immunitario dell'ospite. -Patogenesi e segni clinici: gli adulti si attaccano alla mucosa provocando piccole soluzioni di continuo dei villi che determinano sanguinamento, provocando talvolta lieve anemia, ipoalbuminemia, diarrea, anoressia e letargia, soprattutto negli animali giovani. Frequentemente non si hanno sintomi manifesti. Le larve che entrano per cutem provocano dermatiti a carico del cuscinetto plantare e degli spazi interdigitali.
-Aspetti zoonotici: è stata dimostrata sperimentalmente la possibilità che il parassita causi lesioni cutanee nell’uomo, ma non sono riportate infezioni naturali (Taylor et al. 2007).
Famiglia Molineidae
Caratterizzata da capsula buccale piccola, dotata di un denticolo o di una lancetta nelle specie ematofaghe. Borsa con lobi laterali più sviluppati e spicoli corti e tozzi.
Molineus legerae (Durette-Desset & Pesson, 1987) -Ospiti: canidi
-Distribuzione in Europa: Europa occidentale
-Morfologia: nematodi piccoli, lunghi meno di 1 cm. Estremità cefalica molto più sviluppata in lunghezza che in larghezza [Foto3]. Il poro escretore si apre nella parte ventrale del corpo a livello della seconda metà dell'esofago. Vista dall'apice la testa presenta una bocca triangolare, 6 papille labiali esterne e 4 papille cefaliche. Il corpo è circondato da creste cuticolari visibili alla sezione trasversale. Il maschio, lungo 6-7 mm, è bursato, con spicoli lunghi 118 μm che si dividono in 3 punte. La femmina misura 7-11 mm, ha l'apertura vulvare più vicina all'estremità caudale rispetto a Molineus patens e presenta una caratteristica punta all'apice caudale lunga 18 μm [Foto 4]. Le uova misurano 60 x 40 μm e sono eliminate allo stadio di morula.
-Ciclo biologico: diretto, non completamente noto.
Famiglia Angiostrongylidae
Caratterizzata da assenza di capsula buccale; borsa copulatrice di dimensioni ridotte, apertura vulvare nella parte posteriore del corpo.
Angiostrongylus vasorum (Bailliet, 1866) -Ospiti definitivi (O.D.): canidi, mustelidi
-Ospiti intermedi (O.I.): molluschi gasteropodi, rane
-Localizzazione: ventricolo destro e arteria polmonare dell'O.D.
-Distribuzione in Europa: il parassita si riteneva limitato a determinate aree endemiche (area sud-occidentale di Francia e Gran Bretagna, Irlanda, Danimarca), ma recenti segnalazioni in zone diverse (Germania, Italia, Scandinavia) lasciano ipotizzare un allargamento dell'areale di distribuzione (Morgan et al. 2005)
-Morfologia: nematodi sottili lunghi fino a 2,5 cm. Le femmine, lunghe 18-25 mm hanno le ovaie bianche arrotolate intorno all'intestino rosso, il che conferisce loro un tipico aspetto striato [Foto 5]. I maschi misurano 14-18 mm, sono biancastri e hanno una piccola borsa caudale con due spicoli striati longitudinalmente lunghi 360-400 μm [Foto 6]. Le larve L1 misurano 320-360 μm, presentano un bottone cefalico all'estremità anteriore e una tacca sub-terminale all'apice della coda ondulata.
-Ciclo biologico: indiretto. Le femmine ovovivipare depongono le uova larvate nel torrente ematico dell'arteria polmonare che le trasporta ai capillari polmonari dove schiudono. Le larve L1 attraversano la parete alveolare e migrano risalendo la trachea fino alla faringe, dove sono
deglutite ed eliminate con le feci. Subiscono alcune mute prima di penetrare nell'ospite intermedio. Il ciclo biologico non è stato ancora completamente chiarito, ad esempio non è noto se le larve penetrino nell'O.I. dall'esterno o debbano essere ingerite; non si sa se la trasmissione all'O.D. avvenga esclusivamente se l'O.I. viene ingerito o se le larve vengono anche escrete attraverso le sue escrezioni/secrezioni (Morgan et al. 2005). Lo stadio infestante per l'O.D. sono le larve L3; una volta ingerite, queste migrano ai linfonodi enterici, dove mutano a L4 e da qui raggiungono la sede definitiva. Il periodo prepatente è di 7 settimane. Il parassita sopravvive nell'ospite fino a 5 anni. Si suppone che le larve siano eliminate in modo non continuativo e ciò pone dei limiti per la diagnosi coprologica.
-Patogenesi e segni clinici: i parassiti adulti nei grossi vasi provocano endoarterite e periarterite; in caso di localizzazione cardiaca si osserva endocardite con interessamento della valvola tricupspide. Le larve e le uova causano infiammazione a livello alveolare. Si possono verificare fenomeni tromboembolici. Si osservano disturbi della coagulazione che provocano anemia, ematomi, emorragie. I disturbi di circolo possono esitare in ipertrofia del ventricolo destro, insufficienza cardiaca ed eventualmente insufficienza respiratoria. I segni clinici variano a seconda dell'intensità e della durata dell'infestazione; comprendono tosse (talvolta emottisi), dispnea, tachipnea, depressione, intolleranza all'esercizio fisico, edemi, sincopi. Talvolta si riscontrano segni neurologici (paresi, atassia, dolore spinale, perdita della visione) dovuti a localizzazione erratica o a emorragie subdurali (Yamakawa et al. 2009).
Famiglia Crenosomatidae
Caratterizzata da assenza di capsula buccale; borsa ben sviluppata con spicoli, apertura vulvare nella parte mediana del corpo.
Crenosoma vulpis (Dujardin, 1845)
-Ospiti definitivi (O.D.): canidi, mustelidi, procionidi -Ospiti intermedi (O.I.): gasteropodi terricoli
-Localizzazione: trachea e bronchi -Distribuzione in Europa: ubiquitaria
-Morfologia: vermi bianchi tozzi, il maschio misura 3,5-8 mm e possiede due spicoli di 370 μm; la femmina misura 12-15 mm, la vulva è situata circa a metà del corpo. In entrambi i sessi la cuticola forma nella parte cefalica 18-26 caratteristiche pliche ad anello, ornate sui margini da spine retroverse [Foto 7]. Le larve L1 misurano 265-330 μm e hanno coda diritta e appuntita (Della