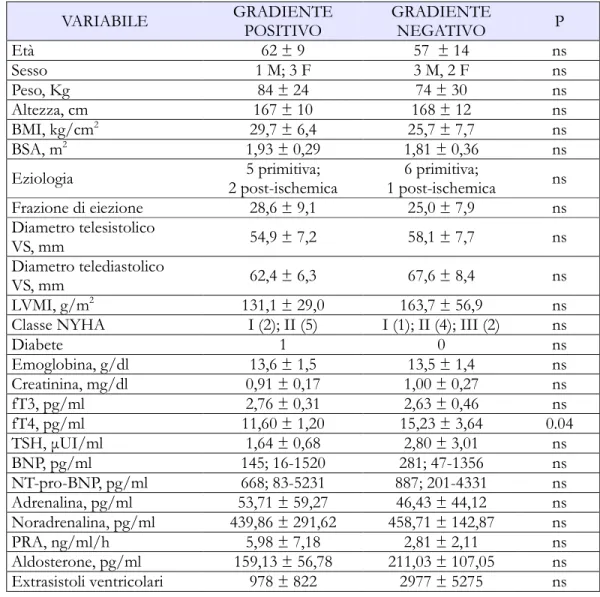
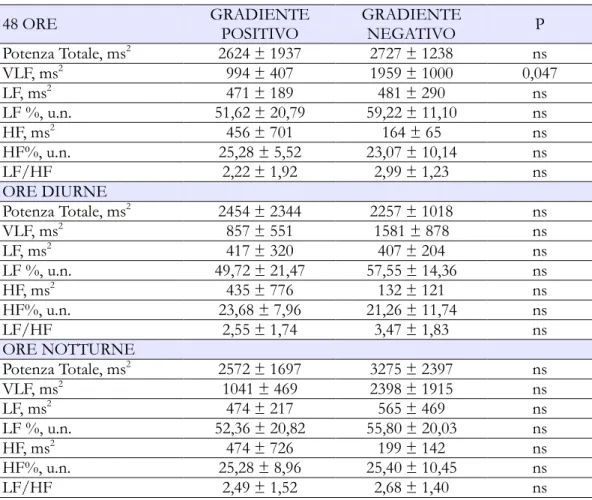
I
NTRODUZIONEIl sistema nervoso autonomo (SNA), regolato da un complesso sistema a feedback che segnala alterazioni dell’omeostasi pressoria, dell’equilibrio acido-base e della tensione di O2 e CO2, è responsabile dell’adattamento della funzione cardiaca e circolatoria in
risposta a stimoli fisiologici fasici (emozioni, attività fisica, variazioni posturali) e alle modificazioni dello stato di coscienza (Moruzzi G, 1986).
In malattia, la riduzione della funzione contrattile cardiaca e la conseguente inabilità a mantenere una gittata cardiaca adeguata durante lo sforzo fisico e, in relazione alla severità della disfunzione, anche a riposo, sono stimoli potenti per l’eccitazione tonica della branca simpatica e per la deattivazione della branca parasimpatica del SNA. Si ottiene così uno stimolo vasocostrittivo, cronotropo ed inotropo che, in funzione compensatoria, tende a sopperire al deficit contrattile, al prezzo, con il protrarsi di questa condizione, di un maggiore rischio di aritmie ventricolari e morte improvvisa, di un aumento del consumo miocardico di ossigeno, di ischemia su base macro- e microcircolatoria e, infine, di adattamenti periferici sfavorevoli (vasi, rene, polmone, muscoli) nel lungo periodo (Wehrmacher WH e Randall WC, 1984).
Nel tempo si accompagna all’alterazione autonomica un’attivazione di alcuni sistemi endocrini ad azione vasocostrittiva e sodioritentiva (sistema renina-angiotensina-aldosterone (RAAS), sistema endotelinico, vasopressinico), che contribuisce al quadro clinico complessivo (dispnea, edemi, fatigue) e alla progressione della malattia, sino all’exitus (Francis GS, 2001). La terapia moderna dello scompenso cardiaco ha quindi un caposaldo nei farmaci che controbilanciano l’attivazione simpatica direttamente
(β-(Passino C, 2006).
La prognosi della malattia, comunque sfavorevole, è uno stimolo alla ricerca di nuovi target terapeutici.
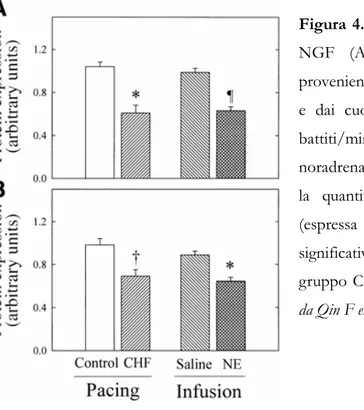
La modulazione autonomica del cuore risente dell’integrazione centrale (centri simpatici e parasimpatici del tronco encefalico) e dei feedback periferici (principalmente baro-, chemo-, ergocettivi, ma anche polmonari) ma è influenzata anche da stimoli locali provenienti dall'organo target. Il NGF (Nerve Growth Factor), un fattore di crescita noto per la sua azione trofica sulle cellule del sistema nervoso centrale e del sistema nervoso autonomo, viene prodotto anche dai cardiomiociti (Kaye DM et al, 2000) e rappresenta uno di questi stimoli. NGF è coinvolto nella regolazione della funzionalità sinaptica attraverso una serie di effetti a livello pre-recettoriale (aumento della densità di innervazione ed aumento del reuptake della noradrenalina) (Kreusser MM et al, 2006), recettoriale (incremento dell'espressione dei recettori β-adrenergici) (Heath BM et al, 1998) e post-recettoriale (azione sulle conduttanze ioniche sulla membrana del cardiomiocita)(Liu QY et al, 1998).
Obiettivo del nostro lavoro è la valutazione, in pazienti affetti da scompenso cardiaco, della presenza di eventuali correlati clinici con il livello di produzione cardiaca di NGF e della sua influenza sulla risposta cardiovascolare alla modulazione del SNA.
1.
C
ONTROLLO ADRENERGICO DELLA FUNZIONE
....
CARDIACA
1.1
I
L SISTEMA NERVOSO AUTONOMO
Il complesso di strutture preposte alla modulazione delle funzioni non soggette al controllo volontario costituisce il sistema nervoso vegetativo o autonomo (SNA). Il SNA, pur agendo a livello sottocorticale, interagisce con centri bulbari e soprabulbari (ipotalamo, amigdala a corteccia cerebrale) in grado di integrare l'unità morfo-funzionale del controllo autonomico – il riflesso – con le funzioni mentali superiori (Dini FL e Buralli S, 2007).
Il SNA regola momento per momento la funzione cardiaca, vascolare, viscerale e ghiandolare attivando o disattivando ciascuna delle sue due componenti, il sistema nervoso simpatico o ortosimpatico (SNS) ed il sistema parasimpatico (SPS), le quali inducono effetti di segno opposto, eccitatorio o inibitorio, sugli organi bersaglio (Richerson GB, 2003). Dal punto di vista neuroanatomico, ciascuna della due branche consiste di due neuroni Qualcosa gli aveva rivelato il significato delle
due parole oscure. Con ferma e curata calligrafia aggiunse al manoscritto queste righe: “Aristù (Aristotele) chiama tragedia i panegirici e commedia le satire e gli anatemi. J.L. Borges La ricerca di Averroè in L’Aleph
spinale sacrale per il SPS e nel midollo toracico e lombare per il SNS. I prolungamenti assonici dei neuroni preganglionari sinaptano con il soma dei postganglionari in corrispondenza di strutture chiamate gangli, alloggiate a ridosso o all'interno dei visceri nel caso del SPS o nella catena paravertebrale per il SNS.
In realtà, qualsiasi risposta del SNA non prevede mai l'abolizione dell'attività di una delle due branche, ma, piuttosto il raggiungimento di un punto di equilibrio adeguato alla natura ed all'intensità dello stimolo.
I neuroni del SNA trasmettono i loro messaggi agli altri neuroni ed agli organi effettori attraverso la liberazione di alcuni mediatori chimici o neurotrasmettitori. Tutti i neuroni preganglionari liberano acetilcolina (ACh), la quale si lega ai recettori nicotinici esposti sulla membrana dei neuroni postganglionari. Questi ultimi, invece, utilizzano un neurotrasmettitore differente a seconda che appartengano all'una o all'altra branca del SNA. Infatti, i neuroni postganglionari parasimpatici rilasciano ACh, il cui messaggio è condotto dai recettori muscarinici, una serie di recettori metabotropici (legati a proteine G) presenti nelle diverse isoforme (M1-M5) sugli organi bersaglio. Nel caso dei neuroni
simpatici post-gangliari, il neurotrasmettitore è invece l'adrenalina (adrenalina, A), il cui recettore post-sinaptico, anche esso metabotropico, appartiene ad una delle due classi principali: α e β. I recettori α, a loro volta suddivisi in α1 ed α2, hanno affinità maggiore
per la noradrenalina (noradrenalina, NA) che per l'adrenalina e possono mediare fenomeni di vasocostrizione, midriasi, natriuresi e soppressione della secrezione insulinica. D'altra parte, i recettori β, presenti nelle isoforme β1, β2 e β3, hanno affinità
maggiore per l'A e sono responsabili di vasodilatazione, cronotropismo ed inotropismo positivo, rilassamento bronchiale, modulazione della secrezione di renina, endotelina e vasopressina, regolazione della termogenesi e della lipolisi e, in virtù della loro presenza a livello presinaptico, anche della liberazione di NA (Garland EM e Biaggioni I, 2001).
1.2
R
EGOLAZIONE AUTONOMICA DEL CUORE
Come è già stato accennato, il sistema cardiovascolare è regolato, nella sua attività, dagli impulsi emessi dai neuroni del SNA. Le fibre parasimpatiche destinate al cuore decorrono nel contesto del nervo vago e trovano la loro origine nel nucleo motore dorsale del vago, situato nel tronco dell'encefalo. I neuroni postganglionari, ricevuto l'impulso dai neuroni preganglionari a livello dei gangli cardiaci, innervano gli atri, il
nodo del seno ed il nodo atrio-ventricolare. Il vago, insieme al glossofaringeo, accoglie anche fibre afferenti, come quelle provenienti dai barocettori aortici e carotidei e destinate al nucleo del tratto solitario. Gli effetti dello stimolo vagale sul cuore dipendono dall'attivazione dei recettori muscarinici M2 e sono, in generale, inibitori. Il
legame recettoriale dell'ACh rallenta la frequenza cardiaca (effetto cronotropo negativo), rallenta la velocità di conduzione atrio-ventricolare (effetto dromotropo negativo), fino, nel caso di stimoli particolarmente intensi, ad un blocco completo della trasmissione del potenziale d'azione a livello atrio-ventricolare, riduce l'eccitabilità del miocardio (effetto batmotropo negativo), soprattutto nel tessuto non ventricolare e, infine, deprime la capacità contrattile cardiaca (effetto inotropo negativo). Nonostante l'iniezione di ACh produca vasodilatazione, il sistema parasimpatico non innerva direttamente la muscolatura liscia vasale e tale effetto risulta dalla liberazione di ossido nitrico (Dini FL e Buralli S, 2007).
I neuroni simpatici preganglionari originano dalle corna laterali della porzione toracica del midollo spinale e sinaptano con quelli postganglionari nei gangli cervicali. In particolare, la porzione più cospicua di fibre dirette al cuore proviene dai gangli stellati (Janes RD et al, 1986). La stimolazione simpatica, attraverso il legame delle catecolamine ai recettori β1 e β2 espressi dai miocardiociti, rappresenta il più importante sistema
responsabile degli effetti stimolanti sul cuore. Le conseguenze elettrofisiologiche dell'attivazione adrenergica sono opposte a quelle indotte dal parasimpatico, ovvero sono cronotropa, dromotropa e batmotropa positiva. L'A e soprattutto, la NA stimolano direttamente il miocardio atriale e ventricolare, potenziandone la contrattilità. Tale effetto è riconducibile per la maggior parte all'attivazione dei recettori β. Tuttavia, la stimolazione cronica dei recettori β1 esita, alla lunga, in una compromissione della
funzione cardiaca, probabilmente a seguito dello sviluppo di ipertrofia e fibrosi miocardica mediato da questa classe di recettori favorendo il fenomeno di rimodellamento ventricolare (Gregorevic P et al, 2005). Lo stimolo adrenergico induce infine anche un'accelerazione del rilasciamento diastolico (effetto lusitropo positivo), fondamentale per garantire un adeguato riempimento ventricolare in caso di aumento della frequenza cardiaca e di riduzione della diastole. In periferia la NA, interagendo con
Recettore Meccanismo di
azione Effetto Agonisti Antagonisti
α-1 Gq: attivazione
della fosfolipasi C Inotropo +
Adrenalina ≥ Noradrenalina » Isoprenalina Doxazosina Prazosina Fenossibenzamina Cervedilolo α-2 Gi: inattivazione dell'adenilato ciclasi Inibizione del rilascio della noradrenalina Adrenalina ≥ Noradrenalina » Isoprenalina Clonidina Lofexidina Carvedilolo β-1 Gs: attivazione dell'adenilato ciclasi Cronotropo + Dromotropo + Inotropo + Lusitropo + Isoprenalina > Adrenalina = Noradrenalina Metoprololo Atenololo Bisoprololo Carvedilolo ... β-2 Gs: attivazione dell'adenilato ciclasi Cronotropo + Dromotropo + Inotropo + Lusitropo + Vasodilatatore Isoprenalina > Adrenalina » Noradrenalina Propanololo Carvedilolo ... M2 Gi: inattivazione dell'adenilato ciclasi Inotropo - Cronotropo - Acetilcolina Metacolina Atropina, Ossibutina Tiotropio
Per quanto la fisiologia classica consideri le due branche del SNA come opposte e mutualmente esclusive, dai primi anni '80 questo dogma è stato messo in discussione. In quegli anni, infatti, Kollai e Koizumi, registrando contemporaneamente le scariche vagali e simpatiche nei cuori di cani anestetizzati, ne osservarono un'attivazione contemporanea. Da allora l'interazione sincrona e sinergica tra i sistemi simpatico e parasimpatico è stata riscontrata in una serie di condizioni fisiologiche e patologiche (Paton et al, 2005). Il risultato di questo dialogo è una oscillazione ritmica delle funzioni cardiovascolari. Il significato di queste oscillazioni, che possono presentarsi con frequenze estremamente diverse, deve essere ancora compreso appieno, ma appare Tabella 1.1 Meccanismi molecolari di azione, effetto sull’organo bersaglio, agonisti ed antagonisti delle principali classi di recettori per i neurotrasmettitori del SNA nel cuore e nei vasi.
verosimile che la coattivazione vago-simpatica in casi specifici possa consentire una più fine modulazione dell'uscita dell'organo target. Un esempio di tale fenomeno è la regolazione cronotropa del cuore che, nonostante nel soggetto sano sia per la maggior parte legata al relativo ipertono vagale (per cui la frequenza cardiaca a riposo è significativamente inferiore a quella intrinseca, 100-120 battiti/min), è il frutto dell'equilibrio dinamico tra attività simpatica e parasimpatica.
Alcuni importanti riflessi vasomotori, cardiocronotropi e respiratori costituiscono le afferenze del sistema di controllo autonomico del sistema cardiovascolare. Tra questi, un ruolo di primo piano è occupato dal baroriflesso. I barocettori, presenti nella parete del seno carotideo e dell'arco aortico, sono sensibili allo stiramento e rispondono a variazioni pressorie inducendo una riduzione dell'attività simpatica ed un aumento di quella vagale dirette al cuore ed una flessione del tono vasocostrittore sulla muscolatura liscia dei vasi. La caduta della pressione centrale induce, invece, una risposta simpatico-mediata con aumento della frequenza e contrattilità cardiaca, delle resistenze arteriose e della pressione diastolica. Il baroriflesso, quindi, tende a stabilizzare rapidamente la pressione attorno ad un valore medio; tuttavia, qualora lo stimolo sia mantenuto abbastanza a lungo, la soglia di scarica dei barocettori può modificarsi, per un fenomeno noto come resetting (Emdin M, Iervasi G; 2000). Le vie riflesse di controllo della funzione cardiovascolare hanno origine, oltre che dai barocettori, anche da altri sistemi recettoriali sensibili alla diminuzione della pressione venosa centrale (meccanocettori presenti nelle pareti atriali e dei grossi vasi venosi), all'ipossia, ipercapnia e acidemia (chemocettori), alla tensione ciclica prodotta dai movimenti respiratori (meccanocettori delle diramazioni bronchiali) e, infine, ai prodotti del metabolismo muscolare (ergocettori).
1.3
C
OMPROMISSIONE DEL CONTROLLO AUTONOMICO
...
CARDIACO
Sin dal diciannovesimo secolo la fisiologia classica ha riconosciuto il ruolo essenziale della regolazione autonomica nel modulare gli adattamenti fasici della funzione cardiocircolatoria. Stupisce quindi che le alterazioni della funzione autonomica abbiano
Eggleston C, 1925). In generale, una compromissione del SNA, o disautonomia, rappresenta una situazione in cui un' alterata funzione autonomica influisce negativamente sullo stato di salute. Il quadro delle disautonomie è estremamente eterogeneo ed include sia condizioni di rilevanza clinica episodica e transitoria in soggetti altrimenti sani (come nel caso della sincope), così come vere e proprie malattie croniche neurodegenerative progressive, patologie in cui l'alterata funzione autonomica gioca un ruolo fisiopatologico fondamentale ed altre in cui invece si limita ad aggravare lo stato clinico.
La maggior parte dei casi di insufficienza autonomica cronica è secondaria ad altri processi patologici sistemici e d'organo – per esempio il diabete, l'amiloidosi o il mieloma multiplo – all'effetto di agenti tossici come l'alcool oppure di farmaci antidepressivi, antipsicotici, antipertensivi o antineoplastici. Un certo grado di neuropatia autonomica cardiaca è una frequente, anche se sottodiagnosticata, complicanza del diabete. Essa deriva dal danno alle fibre dirette al cuore ed ai vasi sanguigni e può causare anomalie nelle oscillazioni della frequenza cardiaca e nella dinamica vascolare, aumento del rischio aritmogeno e facilitazione della microangiopatia (Manzella D e Paolisso G, 2005).
A volte, tuttavia, l'insufficienza autonomica rappresenta la manifestazione clinica principale e non è secondaria, almeno apparentemente, ad altre patologie: si parla in questi casi di insufficienza autonomica cronica primaria. A tale gruppo appartengono tre malattie: l'ipotensione ortostatica senza neurodegenerazione centrale, l'atrofia sistemica multipla e la malattia di Parkinson (Gilman S et al, 1998). Nel morbo di Parkinson in particolare la disfunzione autonomica – dovuta alla deposizione dei corpi di Lewy in strutture coinvolte nella autonomiche – sembra essere, alla luce di recenti osservazioni, più frequente e precoce di quanto non tradizionalmente ritenuto (Bonuccelli U et al, 2003). Alcune condizioni patologiche di competenza cardiovascolare possono annoverare un certo grado di disautonomia tra i moventi patogenetici o tra le manifestazioni cliniche. L'ipertensione essenziale neurogena, per esempio, è mantenuta da un'iperattivazione simpatica, responsabile, inizialmente, dell'aumento della portata cardiaca e poi, anche, della vasocostrizione periferica, della sodioritenzione e dell'incrementata secrezione reninica (Grassi G et al, 1998; Greenwood JP et al, 1999). Infine è ormai riconosciuto che il livello di stimolo simpatico accelera la progressione della malattia e costituisce un indice prognostico nello scompenso cardiaco (Kaye DM et al, 1995). Il riconoscimento di queste entità clinico-patologiche (insieme ad altre, quali le sincope neurocardiogenica e
l'intolleranza ortostatica), ha motivato la definizione di una nuova disciplina che si occupasse delle ricadute cliniche delle alterazioni a vari livelli nei rapporti tra sistema nervoso e sistema cardiovascolare: la neurocardiologia (Goldstein DS et al, 2002).
La frequenza con cui le alterazioni del sistema nervoso autonomo accompagnano alcune importanti condizioni morbose ed il ruolo, a volte decisivo, che esse giocano nel determinarne la presentazione e l'evoluzione, ha promosso la ricerca di strumenti in grado di fornire una stima accurata ed oggettivabile della competenza autonomica di un soggetto, così da porre le basi per un inquadramento completo della patologia, per una valutazione prognostica ed eventualmente per un intervento terapeutico mirato.
2.
T
ECNICHE DI STUDIO DEL SISTEMA NERVOSO
...
AUTONOMO
2.1
P
ERCHE' STUDIARE IL SISTEMA NERVOSO AUTONOMO
Nel paragrafo precedente si è fatto cenno a come l'insufficienza autonomica possa rivestire un ruolo di primo piano in alcune importanti patologie. Lo studio Hoorn, uscito nel 2001, ha dimostrato che gli indici di disfunzione autonomica sono associati con un aumento del rischio di morte cardiovascolare e di morte per tutte le cause, in particolare nei soggetti diabetici, ipertesi e con una storia di malattie cardiovascolari (Gerritsen J et al, 2001), tuttora la principale causa di morbilità e mortalità nei Paesi industrializzati. Nonostante enormi progressi siano stati compiuti nella diagnosi e terapia, rimane quindi l'esigenza di una comprensione più approfondita dei loro meccanismi fisiopatologici. In questo contesto si inscrive l'impulso che recentemente ha avuto lo studio della neuroregolazione delle malattie cardiovascolari, alla luce soprattutto dell'evidenza che il SNA costituisce un asse del sistema neuro-ormonale, fondamento di un nuovo modello interpretativo della fisiopatologico, in primis, dello scompenso cardiaco.
dosaggio delle catecolamine, la heart rate variability, e lo stimolo dei feedback barocettivi e chemocettivi sono il frutto di questo impulso e, pur avendo affiancato le classiche tecniche di indagine autonomica (come la batteria di Ewing) non sono ancora entrate nell'uso clinico routinario. Nelle prossime pagine ognuna di queste metodiche verrà presa in analisi e si discuterà di come abbia contribuito a chiarire i complessi rapporti tra SNA e sistema cardiovascolare.
2.2
T
EST NEUROVEGETATIVI
2.2.1
L
A BATTERIA DI EWINGL'esigenza di quantificare l'entità della compromissione autonomica nasceva nella metà degli anni '70, quando Ewing, occupandosi di neuropatia diabetica, osservò che i pazienti affetti da questa complicanza si caratterizzavano per una gravissima prognosi, con una mortalità di circa il 50% a 5 anni dall'insorgenza dei sintomi (Ewing DJ et al, 1976). I primi test elaborati da Ewing per obiettivare il grado di compromissione del SNA furono il test della respirazione profonda (deep breathing) e la manovra di Valsalva standardizzata. Negli anni successivi le prime due prove furono affiancate dal calcolo delle variazioni di frequenza al cambiamento posturale (lying-to-standing test), dalla valutazioni delle modifiche pressorie nell'immediato ortostatismo (postural hypotension) e infine, dal test della contrazione isometrica prolungata (sustained handgrip). Nasceva così la batteria di Ewing, che - completata con l'elaborazione di un sistema a punteggi che esprimesse con un valore numerico la risposta a tutte le prove – si è dimostrata negli anni affidabile, di semplice esecuzione, riproducibile e non invasiva.
Questo gruppo di test, nato inizialmente con lo scopo di caratterizzare la neuropatia diabetica, è andato affermandosi nel tempo anche nella diagnostica di altre malattie, come lo scompenso cardiaco in cardiologia e le degenerazioni extrapiramidali e ponto-cerebellari in neurologia.
2.2.2
D
EEP BREATHING TESTNella frequenza cardiaca esistono delle oscillazioni cicliche dovute agli atti respiratori. Questo fenomeno, noto come aritmia sinusale respiratoria, si manifesta sul tracciato
individuati almeno due possibili meccanismi alla base dell'aritmia sinusale: il primo prevede una modulazione diretta dei neuroni vagali preganglionari da parte del drive respiratorio centrale, il secondo una inibizione delle efferenze vagali mediata dall'insufflazione polmonare (Yasuma F e Hayano J, 2004).
Le oscillazioni della frequenza cardiaca sono più spiccate nei soggetti giovani, per valori bassi di frequenza cardiaca basale e durante la respirazione profonda. Ewing propose che, per dotare la tecnica della massima riproducibilità possibile, il paziente, seduto e calmo, doveva essere invitato a compiere sei atti respiratori in un minuto (impiegando cinque secondi per inspirare e cinque per espirare) (Ewing DJ e Clarke BF, 1982). L'elettrocardiogramma, registrato nel corso della manovra, consente di misurare le variazioni di lunghezza del tratto RR. Nella sua formulazione originaria l'interpretazione del deep breathing test prevedeva il calcolo della differenza tra la media delle tre frequenze più alte e la media delle tre più basse, e lo stesso Ewing aveva elaborato una griglia di valutazione con intervalli di frequenza tanto più bassi quanto maggiore era la compromissione autonomica. Attualmente molto utilizzato è il rapporto E/I (Expiration-Inspiration ratio), ovvero il rapporto fra la media dei tre più lunghi intervalli RR nella espirazione e la media dei tre intervalli RR più brevi dell'inspirazione. I valori normali sono 1,10 e 10,8 battiti/min rispettivamente per il rapporto E/I e per la differenza della frequenza cardiaca (Ziegler D et al, 1992; Balzani I et al, 1991).
2.2.3
L
YING-TO-STANDING TESTNei soggetti normali, al passaggio dal clinostatismo all'ortostatismo, si verifica un aumento della frequenza cardiaca, che contribuisce a mantenere una appropriata gittata cardiaca nonostante il sequestro ematico periferico. Si è osservato che la frequenza cardiaca più alta cade fra il decimo ed il ventesimo battito dopo l'assunzione della stazione eretta, mentre intorno al trentesimo battito la frequenza torna a livelli anche inferiori a quelli basali (overshoot bradycardia, per usare l'espressione di Ewing). Questa risposta in frequenza cardiaca all'acquisizione della posizione ortostatica viene annullata dall'atropina ma non dal propanololo, e dipende perciò dal grado di competenza parasimpatica (Pfeifer M, 1999).
Il test viene eseguito invitando il paziente a stendersi su un letto basculante che viene improvvisamente portato in posizione verticale, con un monitoraggio elettrocardiografico continuo nel corso di tutta la prova. Il risultato del test è espresso
come rapporto 30/15, ovvero il rapporto che si ottiene dividendo il valore del più lungo intervallo RR misurato tra il 25° ed il 30° battito dopo la verticalizzazione del lettino per l'intervallo RR più breve tra il 10° ed il 20° battito (valore normale > 1) (Ziegler D et al, 1992).
2.2.4
M
ANOVRA DI VALSALVALa manovra di Valsalva, utilizzata come test neurovegetativo, consiste in una espirazione forzata a glottide aperta contro resistenza costante. L'aumento della pressione intratoracica conseguente all'espirazione provoca una diminuzione del ritorno venoso, con diminuzione della pressione arteriosa, tachicardia e vasocostrizione periferica. Appena terminata l'espirazione, la pressione arteriosa aumenta oltre i valori basali, per la persistente stimolazione barorecettoriale. Le modificazioni della frequenza cardiaca e della pressione arteriosa si articolano in quattro fasi successive. Nella fase I la pressione aortica subisce un transitorio incremento a causa dell'aumento della pressione intratoracica; nella fase II precoce il precarico si riduce e si osserva diminuzione della pressione arteriosa e tachicardia, seguita, nella fase II tardiva, da un parziale recupero della pressione arteriosa; nella fase III, con la fine dell'espirazione, la pressione diminuisce nuovamente e la frequenza cardiaca aumenta; infine, nella fase IV, la pressione arteriosa si incrementa oltre il valore iniziale a causa della vasocostrizione residua e del ripristinato ritorno venoso. La tachicardia osservata nel corso dell'espirazione forzata è dovuta inizialmente a deattivazione vagale, in seguito ad attivazione simpatica (Vinik A et al, 2003).
Il test si esegue facendo espirare il paziente, il cui ECG viene registrato in continuo, attraverso un boccaglio collegato ad un manometro in maniera tale da raggiungere una pressione di circa 40 mmHg per 15 secondi. Il risultato si calcola come rapporto tra l'intervallo RR più lungo dopo la fine dell'espirazione e quello più breve durante l'espirazione (Valsalva ratio, normale se maggiore di 1,15) (Ziegler D et al, 1992).
2.2.5
T
EST DELL'IPOTENSIONE ORTOSTATICAIl test prevede la misurazione ripetuta della pressione arteriosa del paziente supino ad intervalli di almeno un minuto fino al riscontro di valori stabili. Quindi, con l'aiuto di un letto basculante, il paziente viene messo in posizione verticale e la pressione arteriosa viene misurata al tilt, al primo, al terzo e ed al quinto minuto. Il cut-off individuato per la definizione di ipotensione ortostatica è una riduzione di 20 mmHg per la pressione sistolica e di 10 mmHg per la diastolica (Consensus Committee of the American Autonomic Society and the American Academy of Neurology, 1996). Questo test, di esecuzione estremamente semplice, ha però lo svantaggio di positivizzarsi solo in caso di grave compromissione simpatica (Ewing DJ e Clarke BF, 1982).
2.2.6
H
ANDGRIP TESTQuesto test misura il grado di attivazione simpatica conseguente ad uno sforzo isometrico. Lo sforzo viene standardizzato utilizzando un dinamometro a maniglia ed invitando il paziente a mantenere per tre minuti una forza pari a circa il 30% di quella massima, precedentemente misurata. La più alta pressione arteriosa diastolica, misurata al termine dello sforzo, viene confrontata con la media di tre misurazioni effettuate a riposo: un incremento superiore a 15 mmHg è considerato normale, border-line tra 15 e 10 mmHg, anormale se inferiore a 10 mmHg (Ewing DJ e Clarke BF, 1982).
2.2.7
C
ONSIDERAZIONI SULL'USO DEI TEST NEUROVEGETATIVILe prove neurovegetative evocano delle risposte in frequenza ed in pressione attraverso un arco riflesso le cui componeneti sono influenzate da una moltitudine di variabili fisio-patologiche, farmacologiche e comportamentali. Al fine di ottenere la massima standardizzazione dei test di funzione autonomica è necessario perciò ove possibile correggere per queste variabili.
La variabilità della frequenza cardiaca, spontanea ed evocata, ha, per esempio, una relazione inversa con l'età del paziente (van Ravenswaaij-Arts CM et al, 1993) e il valore della frequenza cardiaca a riposo (van Dijk JG et al, 1991). Altri fattori confondenti di carattere fisiopatologico sono rappresentati dall'obesità grave, per la limitazione delle escursioni toraciche, dalle alterazioni metaboliche (iperglicemia, ipoglicemia, insulinemia) e dalle malattie broncopolmonari (Rossi M et al, 1989; Lee SP et al, 2005; Marfella R et al, 2000; Muscelli E et al, 1998; Stewart AG et al, 1991). Esistono infine diverse classi
farmacologiche - soprattutto nell'ambito dei farmaci antiipertensivi e degli psicofarmaci - che possiedono la capacità potenziale di modificare la risposta ai test neurovegetativi. I β-bloccanti, per esempio, riducono la frequenza cardiaca basale e modificano l'equilibrio simpato-vagale a favore del vago (Kleiger RE et al, 2005); i diuretici invece, per l'effetto di riduzione del volume circolante, possono accentuare la risposta al test dell'ipotensione ortostatica. Una minore ricchezza di dati è disponibile per i calcio-antagonisti, gli ACE-inibitori ed i sartani. Gli antidepressivi triciclici, e la clorpromazina possiedono documentati effetti anticolinergici ed antiadrenergici; azione esclusivamente anti-adrenergica è descritta invece per la venlafaxina, il tradozone e la mirtazapina.
2.3
S
ENSIBILITA' BAROCETTIVA
Il baroriflesso è un meccanismo di regolazione della funzione cardiovascolare. Il riflesso origina dai recettori sensibili allo stiramento presenti nella parete arteriosa del seno carotideo, dell'arco carotideo, delle camere atriali e dei grossi vasi. L'impulso afferente proveniente dal seno carotideo viaggia nel contesto del nervo vago e del glossofaringeo e giunge al nucleo del tratto solitario, dove si integra con segnali provenienti dalla corteccia e viene condotto al centro cardiomotore. Di qui parte l'efferenza – composta da fibre simpatiche e parasimpatiche – diretta al cuore ed alle cellule muscolari lisce dei vasi (Timmers HJL et al, 2003). Il circuito anatomico appena descritto consente che ogni variazione pressoria possa essere percepita e possa indurre una risposta in termini di frequenza cardiaca. La sensibilità barocettiva è calcolata misurando l'entità della diminuzione della frequenza in rapporto all'incremento pressorio (Sinski M et al, 2006).
La sensibilità barocettiva riveste un importante significato prognostico nelle malattie cardiovascolari. Una compromissione della sensibilità predice il rischio di morte cardiaca nel post-infarto e di aritmie potenzialmente mortali (La Rovere MT et al, 1998; La Rovere MT et al, 2001). Ad oggi, la possibilità di evocare il baroriflesso farmacologicamente o attraverso la tecnica di neck suction, unitamente alla disponibilità di metodiche non invasive di registrazione battito-battito della frequenza cardiaca e della pressione arteriosa ha contribuito all'introduzione nella pratica clinica della misurazione della sensibilità del
2.4
D
OSAGGIO DELLA NORADRENALINA
2.4.1
N
ORADRENALINA PLASMATICA E URINARIALa determinazione dell'adrenalina e della noradrenalina nelle urine dei pazienti ha rappresentato per molti anni il metodo tradizionale di misurazione dell'attività del sistema nervoso simpatico. Tuttavia, questo approccio statico non risentiva delle variazioni a breve termine delle scariche adrenergiche e venne affiancato al dosaggio delle concentrazioni plasmatiche. Anche questo tipo di analisi, però, non è scevra di limitazioni. In primo luogo la noradrenalina circolante non è che una parte della quantità totale rilasciata dalle terminazioni nervose; inoltre i livelli plasmatici di noradrenalina rispecchiano l'attività simpatica “globale” e sono influenzati dal tasso di clearance, dal metabolismo e dal reuptake periferico (Grassi G and Esler M, 1999).
2.4.2
S
PILLOVER DELLA NORADRENALINAUn metodo clinico per la determinazione dell'attività regionale del sistema nervoso simpatico utilizza la noradrenalina radiomarcata con trizio. La noradrenalina triziata viene iniettata in vena in piccole quantità – di solito con una dose di carico ed una infusione continua, fino al raggiungimento dello steady-state (Jacob G et al, 2000) – e la sua diluizione nel circolo venoso refluo dall'organo di interesse rispecchia le secrezione della noradrenalina da parte delle terminazioni nervose simpatiche (Esler M e Kaye D, 2000). Oltre a fornire una indicazione accurata dell'output adrenergico diretto ad un singolo organo, questa tecnica ha il vantaggio di non risentire delle variazioni nella clearance della noradrenalina.
La quantificazione dello spillover si è dimostrata molto utile nel chiarimento di alcuni meccanismi fisiopatologici dell'ipertensione. Il riscontro di un aumentato rilascio di noradrenalina da parte del cuore e del rene nei soggetti ipertesi, soprattutto in quelli più giovani, ha suggerito infatti che l'ipertensione – soprattutto nelle sue fasi iniziali – possa essere caratterizzata da un incremento del tono simpatico (Esler M et al, 1989).
2.5
M
ICRONEUROGRAFIA
Anche la microneurografia, come lo spillover della noradrenalina è una tecnica che indaga lo stato regionale dell'attivazione simpatica. Essa consiste nella registrazione, per mezzo microelettrodi di tungsteno, dell'attività simpatica di un fascio nervoso cutaneo o
muscolare, specchio del output simpatico centrale diretto alla regione studiata. A seconda della posizione degli elettrodi è possibile valutare il drive adrenergico vasocostrittore ai vasi muscolari o alla cute, rispettivamente muscle e skin sympathetic nerve activity (MSNA e SSNA). Il segnale viene amplificato, filtrato e corretto, quindi i burst simpatici sono individuati con un software dedicato e le loro caratteristiche in ampiezza e frequenza studiate.
La microneurografia, pur essendo una tecnica quantitativa, sicura, accurata, e riproducibile, non è ancora entrata nell'uso clinico routinario (van de Borne P et al, 1997).
2.6
H
EART RATE VARIABILITY
Lo studio della heart rate variability (HRV), o variabilità della frequenza cardiaca fornisce una misura delle oscillazioni nella lunghezza degli intervalli tra due battiti consecutivi. L'analisi spettrale della HRV ha il vantaggio di essere un metodo semplice e non invasivo per studiare le modificazioni dinamiche del controllo autonomico della frequenza cardiaca (Notarius CF e Floras JS, 2001).
Quando l'analisi delle variazioni della frequenza cardiaca è condotta nel dominio del tempo è possibile, attraverso operazioni statistiche sugli intervalli RR, ricavare una serie di indici di variabilità (Figura 2.1). Il più semplice è la deviazione standard della durata degli intervalli RR tra battiti normli (SDNN), che ben rappresenta la variabilità battito-battito. Lo SDANN si ottiene invece suddividendo la sequenza degli RR in intervalli di 5 minuti, quindi calcolando la deviazione standard della media di ogni intervallo. Altri indici misurano la variabilità battito-battito mediata dal parasimpatico. Essi sono lo rMSSD, ovvero la radice quadrata della media dei quadrati delle differenze di intervalli RR successivi, ed il pNN50, la percentuale di intervalli RR maggiori di 50 ms rispetto al precedente sul totale degli intervalli RR studiati (Kleiger RE et al, 1992; Task Force of the European Society of Cardiology the North American Society of Pacing Electrophysiology, 1996). L'analisi spettrale dell'intervallo RR nel dominio della frequenza fornisce informazioni sulla distribuzione della variabilità in funzione della frequenza. A seconda della durata della registrazione è possibile determinarne range differenti di oscillazione. Quando la sequenza di intervalli RR copre un periodo breve – da 2 a 5 minuti – si possono
oscillazioni dell'outflow simpatico – basse (0,04-0,15 Hz; low frequency, LF) e alte (0,15-0,4 Hz; high frequency, HF); registrazioni più lunghe, di 24-48 ore, consentono di studiare anche range di frequenza ancora più bassi (< 0,003 Hz; ULF) (Lahiri MK et al, 2008). La componente HF della HRV è un indice dell'attività vagale sincrona con il ritmo respiratorio, ed è ridotta infatti di oltre il 90% dalla somministrazione di atropina, non risentendo invece del blocco simpatico operato con il propanololo (Ahmed M et al, 1994); le componenti LF e VLF riflettono la variabilità secondaria ad una più fine modulazione simpato-vagale (Pumprla J et al, 2002); rimane infine ancora poco chiara la base fisiologica della componente ULF. La risposta cardiaca alla stimolazione nervosa ha una latenza inferiore nel caso dell'efferenza parasimpatica rispetto a quella simpatica, perciò il vago modula la frequenza cardiaca a tutte le frequenze fino a 0,5 Hz, mentre il simpatico ha un guadagno significativo solo sotto 0,15 Hz.
Pur se con meccanismi fisiopatologici ancora non del tutto chiariti, la diminuzione della HRV ha un significato negativo nella prognosi sia nei pazienti affetti da malattie cardiovascolari sia nella popolazione generale, verosimilmente esprimendo una ridotta Figura 2.1 Trend nelle 24 ore dell’andamento dell’intervallo RR (e del suo reciproco, frequenza cardiaca) in un soggetto sano (in alto) ed in un paziente con scompenso cardiaco (in basso).
plasticità di risposta del nodo del seno. Queste osservazioni hanno aperto la strada all'utilizzo di presidi farmacologici e non che incrementino la HRV. Alla prima categoria appartengono i β-bloccanti, l'esercizio fisico aerobico alla seconda (Notarius CF e Floras JS, 2001).
Le tecniche di studio tradizionali appena descritte sono state recentemente affiancate dall'analisi non-lineare della frequenza cardiaca, così da individuare anche quelle fluttuazioni distribuite in range molto ampi di frequenza. Lo studio del controllo autonomico sulla frequenza cardiaca non si esaurisce alla HRV. Infatti oltre a metodiche come la heart rate turbulence e la heart rate recovery, non va dimenticato che la semplice frequenza cardiaca basale costituisce un indice semplice, seppur grossolano, dell'equilibrio simpato-vagale (Fox K et al, 2007; Lahiri MK et al, 2008).
2.7
M
ETODICHE DI IMAGING
In aggiunta alle tecniche appena descritte, sono disponibili diversi traccianti radiomarcati per il sistema nervoso autonomo, ottenuti marcando le catecolamine o i loro analoghi. Uno dei più utilizzati è la I-123/I-131 metaiodiobenzilguanidina (MIBG), un analogo della noradrenalina che fornisce informazioni sull'entità e sulla distribuzione delle fibre adrenergiche in acquisizioni SPECT planari e tomografiche. Come il suo analogo, il MIBG arriva nel vallo sinaptico e, probabilmente, è internalizzato dal cuore, ma, a differenza della noradrenalina è resistente all'azione della monoaminoossidasi e della catecol-O-metiltransferasi.
La C-11 meta-idrossiefedrina è un analogo della noradrenalina usato come tracciante nella PET, che offre il vantaggio di una migliore risoluzione spaziale rispetto alla SPECT. Sebbene ancora molto poco utilizzato, è disponibile anche un tracciante PET per il parasimpatico, il F-18 fluoroetossibenzovesamicolo, una molecola capace di legarsi ai trasportatori dell'acetilcolina esposti sui neuroni parasimpatici (Higuchi T e Schwaiger M, 2006)
3.
I
NTRODUZIONE ALLA NEUROBIOLOGIA DELLO
....
SCOMPENSO CARDIACO
3.1
L
O SCOMPENSO CARDIACO
3.1.1
D
EFINIZIONE E CLASSIFICAZIONELo scompenso cardiaco rappresenta la condizione nella quale esitano tutte le malattie cardiovascolari e consiste nell’incapacità, da parte del cuore, di garantire un flusso ematico tale da soddisfare le esigenze metaboliche dei vari organi. Nel suo Textbook of cardiovascular medicine, Braunwald lo definisce come “una sindrome clinica complessa derivante da anomalie (ereditarie o acquisite) della struttura e/o della funzione cardiaca che compromettono la capacità del ventricolo sinistro di accogliere o di espellere il sangue” (Braunwald E et al, 2008). Il cuore è normalmente in grado di mettere in atto, a seconda della natura e dell'intensità dello stimolo che perturba la sua funzione, una risposta diversa sia sul piano temporale (acuto o cronico) sia sul fronte di azione (metabolico, neuroumorale, emodinamico o strutturale). E’ proprio nel caso in cui tale stimolo superi le naturali possibilità adattative, che si sfocia progressivamente nello scompenso. Lo scompenso cardiaco può essere classificato sulla base della sintomatologia lamentata dai pazienti nella vita quotidiana, con particolare attenzione alla dispnea. Questa classificazione, elaborata dalla New York Heart Association (NYHA), è in
uso da diversi anni e, pur essendo di semplice utilizzo nella pratica clinica, ha lo svantaggio della soggettività, legata alla diversa percezione dei sintomi da paziente a paziente, e della scarsa riproducibilità (Gerritsen J et al, 2001). Altre classificazioni, come quella di Feinstein (dyspnea-fatigue index) (Feinstein AR et al, 1989) non sono riuscite ad entrare nell'utilizzo routinario a causa della loro complessità. L'American College of Cardiology ha prodotto nel 2001 una classificazione che pone l'accento sulla storia naturale e la natura progressiva dello scompenso cardiaco (Hunt SA et al, 2001) riconoscendo quattro stadi: i pazienti in stadio A sono quelli affetti da condizioni morbose – come il diabete e l'ipertensione arteriosa – che predispongono allo sviluppo dello scompenso cardiaco, ma i loro cuori conservano la normale morfologia; lo stadio B individua le situazioni in cui una noxa patogena ha, in maniera acuta o cronica, provocato un danno al miocardio e promosso il fenomeno di “rimodellamento ventricolare”, caratterizzato da alterazioni morfologiche (dilatazione) e strutturali (apoptosi, fibrosi e ipertrofia); nello stadio C la comparsa dei sintomi tipici dello scompenso definisce la sindrome clinica conclamata e, infine, lo stadio D raccoglie i pazienti con scompenso cardiaco terminale refrattario alla terapia standard, che devono fare uso continuativo di terapia inotropa infusionale (Jessup M e Brozena S, 2003) (Figura 3.1).
3.1.2
E
PIDEMIOLOGIAA guardare le sue caratteristiche epidemiologiche, lo scompenso cardiaco costituisce a buon diritto una endemia. Nonostante sia più frequente nell'età avanzata ed in alcune particolari regioni del mondo, il suo peso non è trascurabile in nessun Paese. Dati raccolti dall'American Heart Association riportano come nel 2005 5.300.000 persone negli USA erano affette da scompenso (American Heart Association Statistics Committee and Stroke Statistics Subcommittee, 2008). In uno studio pubblicato nel 2007 su una popolazione statunitense di 2029 individui di età superiore si 45 anni, il 56% era classificato in stadio A o B di scompenso cardiaco, mentre la sindrome clinica conclamata (stadio C e D) si manifestava nel 12% dei soggetti (Ammar KA et al, 2007). Inoltre, nonostante la prognosi sia molto migliorata negli ultimi 50 anni – con una riduzione della mortalità di circa il 12% a decade – essa rimane ancora poco incoraggiante, considerato che la mortalità corretta per l'età a 30 giorni, 1 e 5 anni negli uomini colpiti da scompenso è stata rispettivamente del 10, 24 e 45%, addirittura maggiore di quella di alcune comuni neoplasie maligne (Levy D et al, 2002; Jessup M e Brozena S, 2003).
Oltre all'innegabile costo in vite umane, lo scompenso cardiaco rappresenta un peso anche dal punto di vista economico, tanto che la American Heart Association ha stimato una spesa – diretta e indiretta – di 21 miliardi di dollari per la gestione di questa patologia negli Stati Uniti nel solo 2001 (American Heart Association, 2001). Nei prossimi anni sarà dunque necessario, oltre ad una riduzione dei costi - per esempio potenziando, ove possibile, la gestione ambulatoriale – anche un intervento più efficace sui pazienti, sia riducendo la frequenza dei casi trattati in maniera subottimale, sia individuando target terapeutici alternativi.
3.1.3
M
ODELLO NEUROENDOCRINO DELLO SCOMPENSO CARDIACOPer quasi tutto il ventesimo secolo lo scompenso cardiaco è stato considerato un problema di natura emodinamica, per cui la compromissione della funzione di pompa provocava l’aumento delle pressioni polmonari e venose e la diminuzione della gittata, fino alla morte del paziente. Tali considerazioni costituivano il razionale per l’utilizzo in terapia dei diuretici, per ridurre la congestione polmonare e periferica, dei vasodilatatori, per diminuire il post-carico, e di agenti inotropi, per sostenere la contrattilità cardiaca. L’importanza dei meccanismi non emodinamici nella patogenesi dello scompenso ha
cominciato a profilarsi solo nei primi anni Ottanta, quando si scoprì che l’assetto neurormonale del paziente scompensato rivestiva un ruolo fondamentale nella patogenesi, nella diagnosi e nella prognosi, promuovendo così una riconsiderazione globale dello scompenso da malattia emodinamica a disturbo neuroendocrino (Brum PC et al, 2006). Secondo questo modello, infatti, lo scompenso si instaurerebbe e svilupperebbe come conseguenza dell'attivazione di sistemi neuro-ormonali ed immunologici endogeni in risposta ad un insulto acuto o cronico sul cuore o ad una mutazione nel programma genetico. L'attivazione del sistema renina-angiotensina-aldosterone (RAAS) e del sistema nervoso simpatico, così come la liberazione di ormone antidiuretico e di endoteline, avrebbero, attraverso la loro azione vasocostrittrice e sodio-ritentiva, un significato compensatorio di fronte alla riduzione della funzione cardiaca. Tuttavia la ritenzione di fluidi, la vasocostrizione e l'aumento della frequenza cardiaca e dell'inotropismo, se mantenuti cronicamente, contribuiscono essi stessi ad iniziare e promuovere il remodeling morfologico del ventricolo sinistro che esita, in ultima analisi, nello scompenso cardiaco conclamato (Packer M, 1992). A dire il vero l'assetto appena descritto non costituisce che un braccio nell'equilibrio neuro-ormonale dello scompenso. Il cuore, infatti, sotto l'influenza di una enorme varietà di stimoli, secerne delle molecole, i peptidi natriuretici (atrial natriuretic peptide, ANP; brain natriuretic peptide, BNP) che, attraverso la loro azione vasodilatatrice, natriuretica e diuretica – coadiuvata dalle prostaglandine e dall'ossido nitrico – riducono il carico emodinamico e rallentano la progressione della disfunzione (Emdin M et al, 2004) (Figura 3.2).
Questa nuova idea dello scompenso cardiaco è supportata dall'evidenza che farmaci disegnati per bloccare, direttamente o indirettamente, il RAAS o il sistema nervoso simpatico hanno un impatto decisivo sulla funzione ventricolare sinistra e sulla prognosi dei pazienti scompensati (Garg R et al, 1995; Packer M et al, 1996; Pitt B et al, 1999). Così, ad oggi, i β-bloccanti, gli ACE-inibitori, i sartani o gli antialdosteronici costituiscono – seppur con indicazioni diverse a seconda dello stadio della malattia - elementi fondamentali nella terapia razionale dello scompenso cardiaco.
3.2
S
NS NELLO SCOMPENSO CARDIACO
3.2.1
A
TTIVAZIONE SIMPATICA NELLO SCOMPENSOLa modulazione dell’attività cardiaca da parte del SNA – simpatico in primo luogo – è il risultato di una lunga serie di elementi, tra i quali lo sviluppo ontogenetico del tessuto nervoso (Carmeliet P, 2003), la densità delle fibre nervose all’interno del miocardio, la distribuzione dei recettori adrenergici, il metabolismo dei neurotrasmettitori, il grado di accoppiamento funzionale tra i cardiomiociti ed i neuroni simpatici, ovvero la “synaptic strenght” (Kaye DM et al, 2005) e, infine, di tutte quelle variazioni nelle proprietà attive della membrana cellulare che, in condizioni patologiche, possono condurre al prolungamento del potenziale d’azione, all’alterazione dell’eccitabilità e refrattarietà e, Figura 3.2 Rappresentazione diagrammatica del bilancio neurormonale nello scompenso cardiaco e delle sue ripercussioni fisiopatologiche e cliniche.
quindi, a blocchi di conduzione e foci di rientro (Chen PS et al, 2001; Tomaselli GF et al, 1999).
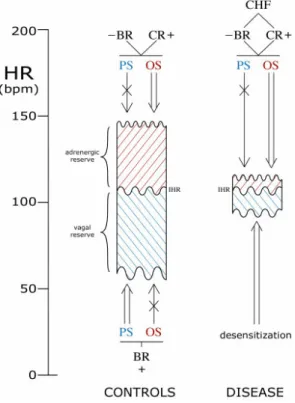
E' noto da tempo che l'iperattivazione adrenergica è uno degli elementi caratterizzanti dello scompenso cardiaco, soprattutto alla luce della sua nuova interpretazione fisiopatologica su base neuro-ormonale (Leimbach WN et al, 1986). Tradizionalmente, il ruolo principale nella genesi dell'ipertono simpatico è attribuito ad una deregolazione degli archi riflessi che regolano la funzione cardiovascolare, in particolare alla riduzione del guadagno del baroriflesso, che si presenta fin dagli stadi più precoci dello scompenso (Grassi C et al, 1995). In questo modo, nel paziente scompensato, sono necessarie variazioni pressorie di entità significativamente maggiore rispetto al soggetto sano per ottenere lo stesso grado di soppressione del tono adrenergico. Dal momento che una simile desensibilizzazione è stata descritta anche per i recettori sensibili allo stiramento presenti nel cuore e nei grossi vasi, nello scompenso sono indeboliti due dei freni principali allo stimolo adrenergico. Questo meccanismo è potenziato dall'attivazione del chemoriflesso e dell'ergoriflesso - sensibili rispettivamente alle variazioni delle pressioni parziali dei gas respiratori nel sangue ed ai cataboliti muscolari periferici – le cui efferenze aumentano entrambe il drive catecolaminergico sul cuore (Piepoli M et al, 1996) (Figura 3.3).
Figura 3.3 La deregolazione degli archi riflessi a partenza dai baro- e chemocettori è responsabile, nello scompenso cardiaco, della riduzione della riserva adrenergica e vagale.
Infine, anche le alterazioni del pattern respiratorio potrebbero, almeno in parte, spiegare l'ipertono simpatico: nel caso delle apnee che caratterizzano il respiro di Cheyne-Stokes degli scompensati, per esempio, esso potrebbe derivare dalla periodica ricorrenza di ipossiemia ed ipercapnia (Somers VK et al, 1995).
3.2.2
A
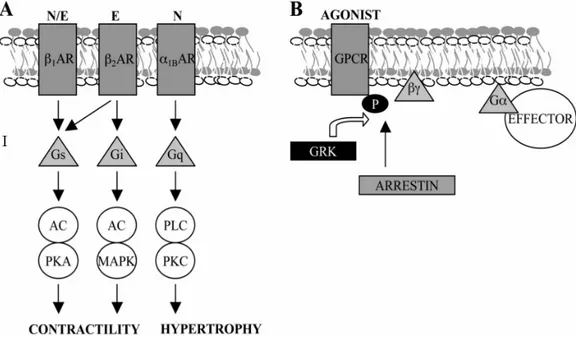
SPETTI BIOMOLECOLARI DELLA DISFUNZIONE SIMPATICAIn condizioni fisiologiche il SNS agisce sul cuore attraverso le catecolamine, rilasciate nel vallo sinaptico dalla terminazione nervosa. A livello cellulare le catecolamine interagiscono con i recettori adrenergici, membri della superfamiglia dei recettori accoppiati a proteine G. In particolare la noradrenalina (NE) si lega principalmente ai recettori α1 e β1, mentre l’adrenalina (E) è un ligando per i β1 ed i β2 . Un gruppo di chinasi, le G protein-coupled receptor kinases (GRKs), fosforilando il recettore attivato, facilitano il legame della β-arrestina – una molecola che interferisce stericamente con l’attività recettoriale – ed agiscono perciò da elemento modulatore della stimolazione simpatica (Figura 3.4) (Keys JR et al, 2004).
I
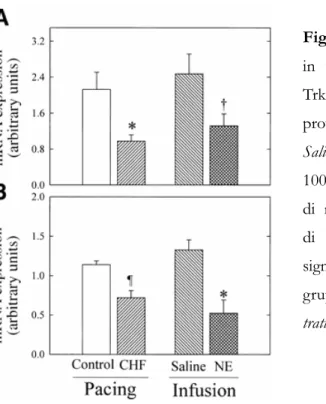
Figura 3.4 (A) Schema delle vie di trasduzione del segnale attivate dai recettori per E e NE nel cuore. (B) La fosforilazione del recettore attivato da parte di GRK facilita il legame dell’arrestina, responsabile della desensitizzazione del segnale. N, noradrenalina; E, adrenalina; PKA, protein kinase A; MAPK, mitogen-activated protein kinase; PKC, protein kinase C. Immagine tratta da Keys JR et al, 2004.
I primi studi volti alla caratterizzazione biochimica del tono simpatico nello scompenso cardiaco si affidavano alla semplice misurazione della concentrazione totale delle catecolamine nel sangue venoso periferico, una tecnica che – come già anticipato – non poteva che fornire un indice sommario di quanto accade nel cuore. Solo più di recente, i gruppi di Esler e Floras hanno utilizzato metodiche in grado di garantire una migliore risoluzione spaziale e temporale dei fenomeni neuroumorali nel cuore scompensato, ovvero, rispettivamente, i radiotraccianti nello studio del turnover sistemico e regionale della NA e le registrazioni microneurografiche del MSNA negli esperimenti di neurofisiologia sull’uomo (Esler M et al, 1990; Floras JS; 1993). Se da una parte questi lavori hanno documentato, in accordo con le osservazioni classiche, un aumentato spillover della NA nello scompenso cardiaco, dall’altra hanno palesato una situazione paradossale: il contenuto intramiocardico di NA è diminuito, come se il cuore fosse “funzionalmente” denervato (Kaye DM e Esler M, 2005).
L’analisi dei meccanismi che influenzano la trasmissione adrenergica ha consentito, negli anni, una accurata definizione delle alterazioni biomolecolari nel controllo simpatico del cuore scompensato. In primo luogo è stato osservato un aumento dell'efflusso di NA nel liquido interstiziale, risultato poi essere inversamente correlato alla performance ventricolare; in secondo luogo ci sono prove che la NA è captata in quantità minore durante il passaggio attraverso il cuore scompensato, più probabilmente a causa di modificazioni post-trasduzionali del trasportatore NET piuttosto che di una ridotta espressione del suo mRNA; infine la densità di innervazione – stimata attraverso immunoistochimica su tessuto miocardico diretta contro la tirosin idrossilasi, un enzima chiave nella via sintetica della NA – appare sensibilmente ridotta (Kaye DM e Esler M, 2005).
Questo riassetto biochimico generale non risparmia neanche gli elementi posti all’interfaccia tra il SNS ed il sistema cardiovascolare, i recettori adrenergici, che rivestono un ruolo centrale nella conversione dell'output nervoso in modificazione nella contrattilità e della frequenza cardiaca. Il cuore sano esprime i recettori β1 e β2 in
rapporto di 70:30; l’effetto cronotropo positivo dei β1 è mediato da una proteina G
AMP ciclico (cAMP), il prodotto della reazione catalizzata dall’adenilato ciclasi, dipende dal bilancio funzionale Gs - Gi . Il cAMP si rende poi responsabile della attivazione di una chinasi, la cAMP-dependent protein kinase (PKA), la quale, fosforilando proteine quali i canali del calcio di tipo L, il fosfolambano o la troponina I, riveste un ruolo fondamentale nel signaling adrenergico.
Gli studi pionieristici di Bristow nei primi anni Ottanta hanno dimostrato che lo scompenso cardiaco è caratterizzato da un generale riassetto del quadro recettoriale sopra descritto che prevede, parallelamente all'iperattivazione simpatica, la riduzione della densità dei recettori β-adrenergici e la loro desensibilizzazione, risultando in una risposta smorzata alla stimolazione simpatica (Bristow MR et al, 1982). Questa situazione è stata definita meglio col tempo e si è scoperto che sono i recettori β1 ad essere
selettivamente ipoespressi – così da essere presenti nel cuore in proporzione con i β2 di
50:50 – e che le chinasi GRK2, PKC e la stessa PKA sono responsabili del disaccoppiamento tra stimolazione del recettore ed effetto a valle. Le alterazioni appena descritte, contestualmente alla diminuzione del rapporto Gs/Gi, culminano in una ridotta produzione di cAMP. L’ipotesi che le cascate di segnalazione intracellulare scatenate dai sottotipi β1 e β2 di recettori adrenergici possiedano significati differenti nella
fisiologia e nella patologia cardiaca è stata confermata da una serie di esperimenti effettuati su topi transgenici nel corso dello scorso decennio, sistematizzati nel 2004 da Keys e Koch (Keys JR et al, 2004). Questi lavori hanno dimostrato che i topi knockout per i β1 AR avevano una normale frequenza cardiaca, ma non presentavano nessuna risposta
adrenergica all’esercizio; al contrario l'eliminazione del gene codificante per β2 AR non
alterava in maniera significativa la fisiologia cardiaca. Gli studi di gain of function hanno fornito risposte coerenti, dal momento che un aumento di appena 5 volte rispetto al livello basale dell’espressione di β1 AR era sufficiente ad ottenere lo stesso grado di
ipertrofia e disfunzione ventricolare in topi di 35 settimane, che era raggiunto incrementando invece di ben 100 volte l’espressione dei β2 AR. Questo tipo di studi, che
ovviamente hanno coinvolto non solo il sistema recettoriale, ma l’intera via di trasduzione del segnale, hanno aperto la strada all’analisi sistematica dei polimorfismi nei geni coinvolti nella via di stimolazione adrenergica. Tali polimorfismi, interagendo con fattori ambientali, potrebbero influenzare in maniera decisiva la progressione dello scompenso cardiaco.
3.2.3
R
EMODELING ELETTROFISIOLOGICOLe risposte locali e periferiche allo scompenso cardiaco evocano tutta una serie di alterazioni nella elettrofisiologia cardiaca che espongono i pazienti ad un rischio di morte per fenomeni aritmici che si accresce con il progredire della malattia e che dipende dall’aumento in frequenza e complessità delle ectopie ventricolari. Al contrario, i dati ottenuti già nella prima metà degli anni Ottanta nel Veteran’s Administration Heart Failure Trial, mostrano come per la morte cardiaca improvvisa non valga alcuna correlazione con lo stadio della malattia e come, viceversa, essa sembri prediligere i pazienti con disfunzione miocardica moderata (Cohn JN et al, 1986).
La durata del potenziale d’azione è di importanza fondamentale nel definire i tempi di ripolarizzazione del tessuto miocardico. Il suo prolungamento è caratteristico delle cellule dei tessuti prelevati da ventricoli di animali affetti da scompenso cardiaco e si manifesta con un parallelo rallentamento della fase di ripolarizzazione; d’altra parte lo stesso sembrerebbe accadere negli isolati da cuori umani scompensati (Tomaselli GF et al, 1999). Per diverso tempo la presenza di disomogeneità regionale nel prolungamento del potenziale d’azione è rimasta un’incognita e solo di recente, con la tecnica del mappaggio ottico transmurale del potenziale d’azione, applicata a preparazioni di cuori di cane, è stato possibile analizzare le modificazioni nella ripolarizzazione in diversi strati della parete cardiaca. I risultati ottenuti mostravano che il prolungamento era decisamente più accentuato nei fasci muscolari centrali e subendocardici; quelli subepicardici sembravano, di converso, relativamente risparmiati (Figura 3.5) (Akar JD et al, 2006).
Le caratteristiche generali del potenziale d’azione dei cardiomiociti, come la forma e la durata stessa, altro non sono se non l’epifenomeno del complesso bilancio tra correnti depolarizzanti e ripolarizzanti a cavallo della membrana cellulare. Per la ripolarizzazione, in particolare, è fondamentale la conduttanza al potassio: mentre la corrente inward rectifier (IK1) interviene nelle fasi terminali del potenziale d’azione, la calcium-independent transient outward current (Ito) riveste un ruolo cruciale nelle primissime fasi e, infine, la delayed rectifier current (IK) nelle sue componenti rapida e lenta, si attiva in fase 3. Nonostante si siano osservati cambiamenti in tutte le correnti al potassio note, il più significativo è di certo la down-regulation di Ito. Tali alterazioni sono disomogenee
e, in ogni modo, influenzano profondamente la fase 1 del potenziale d’azione ed il livello del plateau, con evidenti ripercussioni sulle fasi successive.
L’accoppiamento eccitazione-contrazione è un fenomeno governato dalle variazioni delle concentrazioni di calcio nei compartimenti intracellulari ed extracellulari ed era verosimile che nello scompenso – situazione in cui [Ca] intracellulare è aumentata – questo sistema fosse destabilizzato. Sorprendentemente, nonostante ci si aspettasse che l’accumulo di calcio citosolico nel miocardiocita promuovesse l’inattivazione della corrente di tipo L del calcio – la principale responsabile dell’ingresso del calcio e stimolo per il suo rilascio dal reticolo sarcoplasmatico – il decadimento di tale corrente è, attraverso meccanismi ancora largamente sconosciuti, rallentato. Le altre conduttanze, coinvolte o meno nella gestione del calcio, come i canali di tipo T, lo scambiatore Na+ -Figura 3.5 Potenziali d’azione registrati in diversi strati di miocardio dal versante epicardico (A) a quello endocardico (G) in controlli (a sinistra) ed in cuori scompensati (a destra). Uno stimolo prematuro (freccia) viene condotto lungo tutto lo spessore nei controlli, mentre nello scompenso, a causa del prolungamento del tempo di ripolarizzazione, viene bloccato in C. Immagine tratta da Akar JG et al, 2006.
Ca++
, la corrente pacemaker If o la pompa Na +
-K+
sembrano essere intaccate ad un livello minimo, incapace di raggiungere la significatività. Alterazioni, anche piccole, dei parametri elettrofisiologici cellulari possono intaccare il delicato equilibrio dal quale nasce il potenziale d’azione del cardiomiocita e manifestarsi, sul piano clinico, come aritmie. E’ esattamente quanto accade nel cuore scompensato, in cui la variazione di ogni conduttanza può associarsi alla comparsa di un fenomeno aritmogenico: ad esempio, l’incremento della corrente di tipo T del calcio e la depressione di quelle al potassio alterano la normale automaticità delle fibre miocardiche, i cambiamenti nella fisiologia dei canali del calcio possono generare early afterpotential (EAP) così come delayed afterpotential (DAP). Tuttavia il meccanismo più comune che sottende la comparsa di aritmie ventricolari è il rientro da anormale conduzione dell’impulso, una condizione questa particolarmente frequente nei pazienti in cui lo scompenso si è sviluppato a seguito di fatti ischemici. Si osserva, in questi casi, un fenomeno che è responsabile delle manifestazioni aritmiche anche di altre malattie dei canali ionici – la sindrome di Brugada e la sindrome del QT lungo – ovvero la dispersione del potenziale d’azione nell’ambito del ventricolo (Verrier RL et al, 2004). E’ verosimile che perturbazioni nelle correnti del potassio possano accentuare tale dispersione e che a tale eterogeneità spaziale possano sovrapporsi alterazioni nella conduzione intercellulare, a causa, per esempio, di variazioni nella [Ca] citoplasmatica o della ridistribuzione delle gap-junction.
3.2.4
S
IGNIFICATO PROGNOSTICO DELL'ATTIVAZIONE SIMPATICAE’ noto da tempo che la iperattivazione cronica del SNS ha significato negativo nel decorso dello scompenso e, anzi, può direttamente accelerare la progressione della patologia. In un lavoro di Cohn et al, pubblicato nel 1984, la concentrazione plasmatica di noradrenalina risultava essere, all'analisi multivariata, l'unico predittore indipendente di mortalità in un gruppo di 106 pazienti con scompenso cardiaco moderato-severo, dimostrandosi superiore anche alle variabili emodinamiche nella stratificazione prognostica di questa classe di pazienti (Cohn JN et al, 1984).
Esistono diversi meccanismi attraverso i quali la stimolazione simpatica cronica può rendersi responsabile delle osservazioni cliniche appena riportate. In primo luogo la
conclamato (Francis GS et al, 1993). Oltre a questo esistono evidenze che la noradrenalina possieda un effetto tossico diretto – tempo- e concentrazione-dipendente – sui cardiomiociti, mediato dall'aumento delle concentrazioni intracellulari di calcio. La diminuita vitalità e, infine, la morte dei cardiomiociti esposti a concentrazioni soprafisiologiche di catecolamine concorre al declino della funzione contrattile del ventricolo nello scompenso (Mann DL et al, 1992). Infine l'iperattivazione simpatica potrebbe predisporre all'insorgenza di aritmie ventricolari potenzialmente fatali (la causa più frequente di morte improvvisa nel paziente scompensato) ed indurre modificazioni sfavorevoli nel sistema immunitario (Olsson G and Rehnqvist N, 1984; Maisel A, 1994). Oltre alle concentrazioni plasmatiche delle catecolamine, anche la sensibilità barocettiva e la variabilità della frequenza cardiaca si sono affermate, negli ultimi anni, tra gli indici di funzione autonomica, quali importanti fattori prognostici nello scompenso cardiaco. Mortara e colleghi hanno dimostrato, nel 1997 come i pazienti affetti da scompenso con una sensibilità barocettiva inferiore a 1,3 ms/mmHg avevano un rischio relativo di morte cardiaca di 2,7 rispetto ai pazienti scompensati con sensibilità superiore a 3 ms/mmHg e come tale rischio rimanesse significativo (1,5) anche dopo la correzione per classe NYHA, frazione di eiezione, intervallo RR basale e consumo di O2 durante esercizio
(Mortara A et al, 1997).
Anche la variabilità della frequenza cardiaca fornisce importanti informazioni prognostiche, probabilmente perchè, esprimendo il livello di soppressione dell'attività vagale e di iperattivazione adrenergica, costituisce un indice di suscettibilità del paziente allo sviluppo di aritmie ventricolari e di morte cardiaca improvvisa (Task Force of the European Society of Cardiology the North American Society of Pacing Electrophysiology, 1996). Nonostante siano entrambe espressione del controllo riflesso della frequenza cardiaca, la sensibilità barocettiva risente meno, rispetto alla variabilità della frequenza cardiaca, di parametri non strettamente autonomici, come i cambiamenti nel livello di attività fisica (Bernardi L et al, 1996). D'altra parte il valore additivo di questi due indici è confermato dal fatto che la loro combinazione è associata con mortalità maggiore rispetto a quella dei pazienti con alterazioni dell'uno o dell'altro (La Rovere MT et al, 1998).
Sulla scia di queste nuove acquisizioni nella fisiopatologia dello scompenso, anche il trattamento si è indirizzato verso l'antagonismo – diretto o indiretto - del sistema simpatico. Ad oggi le opzioni sono molteplici ed includono interventi farmacologici e non farmacologici. L'utilizzo dei β-bloccanti, seppure inizialmente accolto con
scetticismo, costituisce attualmente un cardine della terapia dello scompenso. Gli effetti clinici dei β-bloccanti sono mediati dal blocco dei recettori β espressi sulla superficie del cardiomiocita e dalla diminuzione della secrezione reninica (Ritz E, 2005). Inoltre è stato descritto per alcuni β-bloccanti un effetto di up-regulation e di riduzione del disaccoppiamento recettoriale (Bristow MR, 1993) Infine essi riducono la frequenza cardiaca e la domanda di ossigeno del cuore, aumentando così il tempo di rilasciamento diastolico e, in ultima analisi, la frazione di eiezione ventricolare sinistra. Il sistema simpatico ed il sistema RAAS interagiscono a vari livelli. Infatti, non solo il simpatico stimola la liberazione di renina dalle cellule iuxta-glomerulari, ma sia l'angiotensina II sia l'aldosterone potenziano il rilascio della noradrenalina a livello sinaptico e ne impediscono il reuptake (Hilgers KF et al, 1993). Per questa ragione, anche gli ACE-inibitori, i sartani e gli antialdosteronici possono essere considerati, a buon diritto, come inibitori indiretti del sistema simpatico. Negli ultimi tempi, infine, si stanno accumulando evidenze sulla proprietà anti-adrenergiche di due approcci non farmacologici allo scompenso cardiaco, ovvero il training aerobico (Passino C, 2006; Mousa TM et al, 2008) e la terapia di resincronizzazione (Najem B et al, 2006).
Nonostante i presidi appena elencati si siano dimostrati, in diversi trial clinici, (CIBIS-II Investigators and Committees, 1999; The CONSENSUS trial study group, 1987; Pitt B et al, 1999), in grado di migliorare la sopravvivenza dei pazienti con scompenso cardiaco, la loro prognosi rimane ancora oggi infausta. I dati ricavati dal Rotterdam Study sono particolarmente significativi al proposito. In un campione di 181 pazienti la sopravvivenza a 5 anni era del 59% e gli hazard ratio per eventi cardiaci non fatali e morte cardiaca improvvisa erano - rispettivamente - 2,6 e 4,8 (Mosterd A et al, 2001). Lo scompenso cardiaco, in definitiva, incide in maniera drammatica sulla speranza di vita dei pazienti e c'è quindi ancora un forte bisogno di individuare nuovi possibili target terapeutici.
4.
N
ERVE GROWTH FACTOR NELLO SCOMPENSO
..
CARDIACO
4.1
L
A SCOPERTA
Negli ultimi anni i diversi filoni di ricerca nell'ambito delle malattie psichiatriche, neurologiche, autoimmuni ed allergiche, hanno cominciato a convergere a livello di un gruppo di molecole individuate negli anni ’50 dal gruppo di Rita Levi-Montalcini come fattori di crescita per le cellule nervose: le neurotrofine. A questa famiglia appartengono il Nerve Growth Factor (NGF) – il primo scoperto ed il meglio caratterizzato – il Brain Derived Neurotrophic Factor (BDNF), e le neurotrofine 3, 4/5 e 6. Il fatto che queste molecole, prodotte da numerosi tipi di cellule diverse da quelle peculiari del tessuto nervoso, siano fisiologicamente presenti nel circolo sanguigno dell’uomo e che i loro livelli subiscano delle sensibili variazioni nel corso di alcune condizioni morbose – quali la malattia di Alzheimer, l’artrite reumatoide, la sclerosi multipla, l’aterosclerosi – ha riservato loro un ruolo nella patogenesi di queste malattie e ne ha suggerito eventuali proprietà terapeutiche (Aloe L et al, 2001).
Le neurotrofine sono inizialmente sintetizzate come pre-neurotrofine, e poi clivate intracellularmente a dare il prodotto maturo, ovvero piccole proteine di circa 12kDa di massa le quali formano, a loro volta, dimeri stabili, non covalenti. Gli effetti biologici delle neurotrofine sono mediati dall’interazione con diversi recettori: TrkA, TrkB e TrkC – tirosin-chinasi ad alta affinità di legame – e p75, un recettore a bassa affinità. Il legame