1
RIASSUNTO
Premessa. La pubertà precoce centrale (PPC) è un disordine endocrino
dell’età pediatrica caratterizzato dalla comparsa di caratteri sessuali secondari prima degli 8 anni nelle femmine e dei 9 anni nei maschi.
La PPC si accompagna alla precoce comparsa di caratteristiche sessuali secondarie e ad un insieme di modificazioni auxologiche che possono avere ripercussioni importanti sul raggiungimento della statura adulta.
La finalità principale della terapia della PPC è quella di bloccare la progressione dello sviluppo puberale che determinerebbe un incremento degli ormoni gonadici responsabili di un’anticipazione della maturazione ossea e di una compromissione della statura in età adulta. Ulteriori scopi del trattamento sono la prevenzione di un menarca anticipato, l’acquisizione di normali proporzioni corporee e la garanzia di un adeguato sviluppo psicologico per l’età.
Gli analoghi del GnRH (GnRHa) rappresentano i farmaci di scelta per il trattamento della PPC. Questi agiscono a livello dell’ asse ipotalamo-ipofisi-gonade inibendo la secrezione delle gonadotropine con conseguente diminuzione della produzione degli ormoni sessuali da parte delle gonadi.
2
Scopi dello studio. In questo studio è stato effettuata la valutazione
dell’outcome staturale nei bambini affetti da PPC trattati con GnRHa. Secondariamente è stato valutato nei pazienti trattati: l’esistenza di variabili che correlino con il guadagno staturale, la presenza di differenze nell’accrescimento staturo-ponderale dei pazienti raggruppati per sesso (maschi vs femmine), l’influenza del trattamento sul BMI SDS, la reversibilità della soppressione del GnRHa sull’attività dell’asse ipotalamo-ipofisi-gonade.
Pazienti e metodi. Sono stati reclutati 164 pazienti (21 maschi e 143
femmine) trattati con analoghi del GnRH per pregressa diagnosi clinica ed endocrinologica di pubertà precoce centrale. Di questi, 115 soggetti (18 maschi e 97 femmine) hanno completato il periodo di follow up, rendendo possibile un’analisi statistica dei dati raccolti.
L’età media dei pazienti al momento di intraprendere la terapia era di 8.6 anni e di 11.7 anni alla sua sospensione con una durata media del trattamento di 3.0 anni.
Sono stati valutati altezza, BMI, sviluppo puberale e funzione gonadica, rispettivamente al momento della diagnosi, della sospensione della terapia e al raggiungimento della statura adulta.
3
In particolare, mediante un’analisi della varianza (ANOVA) sono stati messi a confronto i risultati ottenuti nel gruppo dei maschi e nel gruppo delle femmine del nostro campione di pazienti.
Successivamente è stata valutata l’esistenza di correlazioni lineari significative tra il guadagno staturale (calcolato come differenza tra la statura adulta e la previsione staturale iniziale) e caratteristiche proprie dei pazienti al momento di inizio del trattamento.
Tra queste è stata esaminata più specificatamente l’età cronologica all’inizio del trattamento: le femmine del nostro studio sono state suddivise retrospettivamente in due gruppi sulla base dell’età all’inizio della terapia (gruppo A: età ≤ 8 anni vs gruppo B: età > 8 anni) e i risultati sono stati messi a confronto.
È stata inoltre valutata l’influenza del trattamento con analoghi del GnRH sul BMI (calcolato in termini di SDS) e la reversibilità della soppressione del GnRHa sull’attività dell’asse ipotalamo-ipofisi-gonade.
Risultati. La statura adulta delle femmine è risultata pari a 160.2 ± 6.5 cm
(-0.4 ± 1.1 SDS), significativamente maggiore rispetto alla PAH calcolata all’inizio della terapia e all’interno del target genetico (TH SDS -0.3 ± 0.8 vs FH -0.4 ±1.1; p = NS). Nei maschi la statura adulta è risultata di 171.8 ± 6.9 cm (-0.5 ± 1 SDS), valore che è risultato all’interno del target genetico,
4
sebbene inferiore, non significativamente, alla PAH calcolata all’inizio della terapia.
Mediante l’analisi delle correlazioni bivariate di Pearson è stato riscontrata una correlazione significativamente positiva tra guadagno staturale espresso in SDS e l’avanzamento dell’età ossea all’inizio della terapia, ed una correlazione significativamente negativa con l’età cronologica, i livelli di LH e di estradiolo all’inizio della terapia.
L’analisi statistica ha inoltre mostrato un guadagno staturale significativamente maggiore nel gruppo delle pazienti trattate prima degli 8 anni.
Complessivamente il valore medio di BMI non si è modificato significativamente nel corso della terapia (p = NS) e sia nei maschi che nelle femmine si è assistito ad una diminuzione del BMI SDS dalla sospensione della terapia al raggiungimento della statura adulta, anche se solo nelle femmine tale decremento è risultato statisticamente significativo (p = 0.026).
Tutte le pazienti femmine sottoposte a trattamento per PPC hanno presentato il menarca entro 3 mesi-2 anni dalla sospensione della terapia, ad una età media di 12.5 anni.
I pazienti maschi hanno raggiunto un completo sviluppo gonadico, con un volume testicolare medio di 19.2 ± 3.1 ml sia destra che a sinistra in età adulta.
5
Conclusioni. I dati ottenuti permettono di concludere che la terapia con
GnRH analoghi nei bambini con PPC è sicura ed efficace.
Essa determina in entrambi i sessi il raggiungimento di una statura adulta adeguata al potenziale genetico e nell’ambito della norma per la popolazione generale; garantisce risultati migliori sul guadagno staturale nei bambini che presentano minor età cronologica e maggior avanzamento dell’età ossea all’inizio della terapia.
Il trattamento non presenta inoltre un impatto negativo sull’evoluzione del BMI nei pazienti affetti da PPC, non aumenta il rischio di obesità nell’età né adolescenziale né adulta e non altera la normale attività dell’asse ipotalamo-ipofisi-gonadi alla sua sospensione.
6
1-INTRODUZIONE
1.1 La pubertà
Il termine pubertà deriva dal sostantivo latino pubertas,-atis che significa “adulto”.
La pubertà è infatti quel periodo dell’età evolutiva caratterizzato da complesse mutazioni somatiche, endocrinologiche, metaboliche e psicologiche finalizzate al completamento della crescita staturo-ponderale e al raggiungimento della completa maturazione sessuale con l’acquisizione delle capacità riproduttive [1].
La pubertà rappresenta perciò un periodo di transizione tra l’infanzia e l’età adulta, caratterizzato sotto il profilo fisico dall’acquisizione dei caratteri sessuali secondari e da un’accelerazione della velocità di crescita (growth
spurt), mentre sotto il profilo psicologico si accompagna ad importanti
modificazioni, con il passaggio del pensiero cognitivo ed emozionale dal tipo prepubere a quello dell’adulto [2].
7
1.2 Il normale sviluppo puberale
Il normale sviluppo puberale presuppone l’integrità del sistema endocrino riproduttivo, costituito da ipotalamo, ipofisi, gonadi ed organi bersaglio [3]. L’asse ipotalamo-ipofisi-gonadi è attivo durante lo sviluppo fetale e continua a svolgere la sua funzione durante la prima infanzia per entrare infine in uno stato di relativa quiescenza, definito pausa giovanile [3], grazie a meccanismi inibitori steroido-indipendenti e steroido-dipendenti. Il primum movens dello sviluppo puberale è rappresentato dalla riattivazione dell’asse ipotalamo-ipofisi-gonadi ed esattamente dalla ripresa della secrezione pulsatile del GnRH (fattore ipotalamico di rilascio delle gonadotropine), cui fa seguito un’aumentata secrezione di gonadotropine (FSH ed LH) da parte della ghiandola ipofisaria [3] con un aumento di ampiezza e frequenza dei picchi secretori di LH i cui valori superano quelli di FSH.
Tali cambiamenti ormonali, a loro volta, inducono una stimolazione delle gonadi (testicoli ed ovaie) con conseguente immissione in circolo di steroidi sessuali che, legandosi ai loro recettori sugli organi bersaglio, determinano le modificazioni somatiche tipiche della pubertà.
La maturazione gonadica ed il rilascio di ormoni sessuali rappresentano il fenomeno generalmente definito gonadarca.
8
Testosterone ed estradiolo, assieme ad inibina, attivina e follistatina, sono a loro volta responsabili, mediante meccanismi di feedback, della regolazione dell’ipotalamo e dell’adenoipofisi [3].
Nelle femmine, l’LH a livello ovarico stimola la produzione di androgeni da parte delle cellule della teca e di progesterone da parte delle cellule della granulosa.
Nel maschio, l’LH determina la produzione di testosterone da parte delle cellule del Leydig, mentre la stimolazione delle cellule del Sertoli da parte del FSH è indispensabile per lo sviluppo delle cellule germinali [4].
Le modificazioni somatiche tipiche dell’età puberale sono il risultato non solo del già citato gonadarca, ma anche di un fenomeno indipendente che prende il nome di adrenarca.
L’adrenarca è il processo di maturazione della zona reticolare della ghiandola surenale, cui consegue la produzione di androgeni (DHEA, DHEA-S, androstenedione) associata a caratteristiche sessuali secondarie quali lo sviluppo della peluria pubica (pubarca) ed ascellare (ircarca), sudorazione acre ed acne [3].
Da un punto di vista clinico, la pubertà porta con sé una serie di modificazioni somatiche associate alla maturazione sessuale.
In entrambi i sessi, lo sviluppo delle caratteristiche sessuali secondarie è convenzionalmente suddiviso in cinque stadi, noti come stadi di Tanner,
9
dal nome del pediatra britannico che per primo ideò questo sistema classificativo.
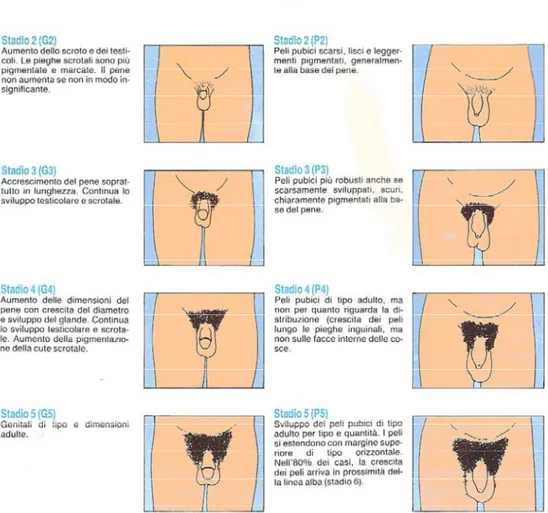
Nel maschio i primi segni di sviluppo puberale sono rappresentati dall’incremento del volume testicolare con il raggiungimento di un volume di 4 ml (valutato mediante orchidometro di Praeder) corrispondente allo stadio G2 di Tanner (Fig. 1). Tale fenomeno coincide con l’aumento dei tubuli seminiferi e l’inizio della spermatogenesi.
L’aumento di dimensione dei testicoli avviene circa un anno prima della comparsa degli altri caratteri sessuali secondari, e si verifica nel 95% dei maschi tra i 9.5-13.8 anni [5].
Segue nel maschio la comparsa della peluria pubica ed ascellare androgeno-dipendente, il cambiamento della voce, l’aumento di dimensioni dei genitali, l’erezione del pene e l’eiaculazione spontanea (spermarca), che si verifica generalmente in corrispondenza dello stadio G3 di Tanner. L’aumento dei livelli di testosterone circolante determina inoltre un progressivo incremento del contenuto minerale osseo e della massa magra, assieme ad una diminuzione della massa grassa.
Non è infrequente lo sviluppo di acne e di una transitoria ginecomastia, che persiste in genere per un massimo di 6-24 mesi.
Lo scatto puberale di crescita inizia verso i 12.0 -13.0 anni con il raggiungimento della massima velocità di crescita intorno ai 14.0 -15.0
10
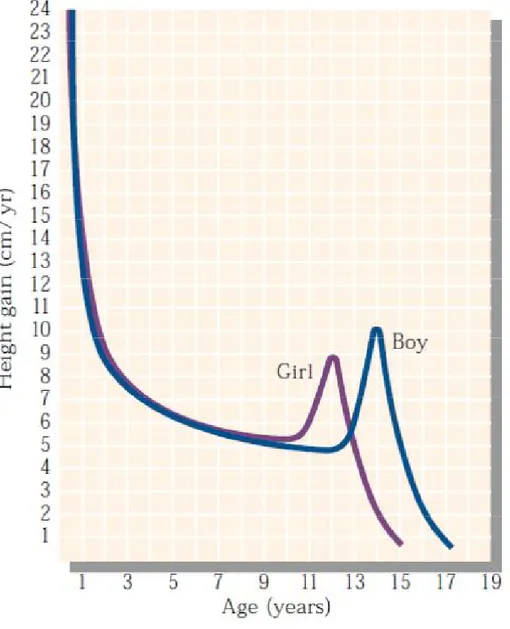
durante lo stadio G3-G4 di Tanner, diversamente da quanto accade nelle femmine in cui la maggiore accelerazione di crescita avviene con l’inizio della pubertà [6]. Nel maschio lo scatto di crescita (o spurt puberale) determina un incremento della statura di circa 27-28 cm (Fig. 3).
Nelle femmine il primo segno clinico della pubertà è rappresentato dallo sviluppo mammario (telarca), corrispondente allo stadio B2 di Tanner, che avviene nel 95% delle bambine tra 8.9-13.2 anni [5] (Fig. 2); esso è determinato dalla produzione di estrogeni da parte dell’ovaio, sotto l’influenza dell’aumentata secrezione dell’ormone ipofisario LH.
Questo stadio è generalmente seguito entro 6 mesi dal pubarca e dallo sviluppo della peluria ascellare accompagnato dalla comparsa di una sudorazione acre (per lo sviluppo di ghiandole apocrine) e da acne, come conseguenza di un’aumentata secrezione di androgeni sia di origine ovarica che surrenalica.
Il menarca (prima mestruazione) in media avviene entro 2 anni dalla comparsa del telarca ed è espressione della raggiunta maturazione dell’asse ipotalamo-ipofisi-gonadi. In Italia l’età media al menarca nella popolazione generale è di 12.4 anni [7].
Nella femmina lo scatto puberale inizia quasi contemporaneamente con il telarca (tra 10.5– 11.0 anni) e talvolta rappresenta addirittura il primo segno di sviluppo puberale. La massima velocità di crescita viene raggiunta
11
intorno ai 12.0 anni con una crescita residua dopo il menarca di 4–6 cm [8] (Fig. 3). Complessivamente nelle femmine durante la crescita puberale si riscontra un incremento staturale di circa 22-25 cm.
La progressione di questi caratteri, che si svolge in un lasso di tempo che generalmente copre 3-3.5 anni (ma che può variare da meno di 2 anni a più di 5-6 anni), porta al raggiungimento quasi totale delle caratteristiche somatiche adulte.
12
13
Figura 3. Accelerazione della velocità di crescita in età puberale (immagine riadattata da Marshall et al., J. Reprod. Fert. 1978)
14
1.3 Pubertà precoce centrale
La pubertà precoce centrale (PPC) è uno dei più comuni disordini di natura endocrina nell’età pediatrica [6] e rappresenta una condizione con importanti implicazioni fisiche e psicosociali tanto per i bambini affetti quanto per le loro famiglie.
1.3.1 Definizione
La PPC viene generalmente definita come la comparsa di caratteri sessuali secondari prima del compimento dell’età di 8 anni nei soggetti di sesso femminile e di 9 anni nei soggetti di sesso maschile [1]. Nelle bambine l’insorgenza del menarca prima dell’età di 9 anni rappresenta un criterio addizionale [9].
Tali limiti di età si basano su un margine di 2 deviazioni standard (SDS) al di sotto dell’età media di sviluppo puberale normalmente riscontrata nella popolazione generale.
15
1.3.2. Variazioni nell’inizio dello sviluppo puberale
Un aspetto peculiare nella specie umana è la fisiologica variabilità dell’età di esordio dello sviluppo puberale tra individui normali nonostante condizioni di vita relativamente simili [10].
Tale variabilità è implicata a fattori genetici, etnici, nutrizionali e a quel fenomeno noto come andamento secolare della crescita (o, secondo la dizione anglosassone, secular trend).
Con tale termine ci si riferisce alla tendenza all’anticipo dei tempi dello sviluppo puberale riscontrato nel secolo scorso in Europa e negli Stati Uniti, probabilmente legata al miglioramento delle condizioni socioeconomiche, nutrizionali ed igieniche.
Numerosi dati in letteratura [11, 12] dimostrano come all’inizio del XIX secolo l’età di insorgenza del menarca nei paesi industrializzati fosse di 17 anni con successiva anticipazione di circa 2-3 mesi per decade fino agli anni ‘80 da quando si è registrata una stabilizzazione, come conseguenza di un raggiunto consolidamento delle condizioni generali di vita [11].
Attualmente nei paesi europei l’inizio della pubertà avviene intorno ai 10.5-11 anni nelle femmine e l’età media del menarca varia tra 12.5 e 13 anni, mentre nei maschi lo sviluppo puberale manifesta i suoi primi segni clinici intorno agli 11-11.5 anni [10].
16
Figura 4. Secular trend nell’età del menarca (Sorensen et al., Hormone Research in Paediatrics 2012).
A differenza della stabilità osservata per l’età di comparsa del menarca nelle ultime due decadi, diversi studi americani hanno dimostrato come l’età di esordio dello sviluppo mammario stia andando incontro ad un progressiva anticipazione [11] (Fig. 5).
Dati provenienti dall’ American population-based Third National Health and Nutrition Examination Survey (NHANES III), condotto tra il 1988 e il 1994, hanno infatti riportato un’età media all’esordio puberale nel sesso femminile di 9.7 per le bambine bianche e di 9.5 anni per le afro-americane [13]: significativamente minore rispetto alla media di 11 anni rilevata dalla maggior parte degli studi europei ed americani fino agli anni 80 [11, 14].
17
L’attendibilità di questi dati è stata tuttavia criticata sulla base della valutazione esclusivamente visiva dello sviluppo mammario.
Un contemporaneo studio americano condotto su larga scala, il Pediatric Reasearch in Office Settings (PROS), dopo aver incluso la palpazione del seno nella valutazione clinica del 39% delle pazienti, ha confermato i risultati del NHANES III riguardo al declino dell’età di esordio puberale [11, 15, 16].
Nello studio PROS, utilizzando il classico limite diagnostico di 8 anni, il 6.7% delle bambine bianche e il 27.2% delle afroamericane rispondeva ai criteri per la diagnosi di PPC [16, 17].
Tali risultati hanno portato, nel 1999, la società statunitense di endocrinologia pediatrica (Lawson Wilkins Pediatric Endocrine Society) a revisionare i limiti di età per la diagnosi di PPC negli Stati Uniti, suggerendo di effettuare una valutazione in tutte le bambine in cui segni clinici puberali compaiono prima dei 7 anni se di razza caucasica o dei 6 anni se di razza afroamericana [17].
Molti pediatri endocrinologi hanno tuttavia messo in discussione l’applicabilità all’intera popolazione americana di questi risultati [18, 19], che potrebbero essere falsati da rilevanti problemi metodologici nella valutazione dello stadio puberale [18, 19].
Sulla base dei recenti dati riportati da Biro e collaboratori, la proporzione di bambine, sia bianche sia di colore, che presentano sviluppo mammario
18
prima degli 8 anni, continua ad aumentare (rispettivamente 10.4% e 23.4%), suggerendo un ulteriore declino nell’età di esordio puberale nella popolazione femminile americana rispetto al 1990 quando vennero raccolti i dati degli studi NHANES III e PROS [20].
Per quanto riguarda l’Europa, studi condotti nell’ultimo decennio del secolo scorso non hanno rivelato risultati simili a quelli americani in merito all’anticipo della comparsa del seno.
Tuttavia, più recentemente, uno studio danese sulla pubertà ha riportato un declino di 12 mesi nell’età media di esordio dello sviluppo mammario in ragazze sane danesi in un periodo di 15 anni [21]; risultati molto simili sono stati riportati in altri paesi Europei [22, 23].
Ciò starebbe ad indicare che il secular trend osservato negli Stati Uniti negli anni 90 potrebbe oggi manifestarsi in Europa, seppur con una minor rilevanza, con 15 anni di ritardo [11].
Per quanto riguarda la comparsa degli stadi puberali successivi, un’analisi condotta tra il NHANES III e il precedente studio basato sulla popolazione, il NHES III (Third National Health Examination Survey), non ha rilevato evidenze di un avanzamento nell’età di comparsa dello stadio B3-5 di Tanner né nella popolazione bianca né in quella afroamericana [24].
Si deve in ogni caso considerare che la valutazione di questi stati più tardivi di sviluppo mammario può essere oggetto di una certa variabilità
19
osservatore-dipendente, per cui la compatibilità tra studi diversi e periodi di tempo diversi deve essere valutata con estrema cautela.
In definitiva i dati riportati negli ultimi due decenni suggeriscono un trend secolare verso un anticipo dell’età di comparsa del telarca, mentre l’età di comparsa dei successivi stadi puberali e del menarca ha subito solamente una variazione marginale nelle femmine sia europee sia americane [11].
Figura 5. Età di comparsa del telarca nelle femmine (Sorensen et al., Hormone Research in Paediatrics 2012)
In merito all’età di esordio dello sviluppo puberale nei maschi, disponiamo in letteratura di un minor numero di studi (Fig. 6).
Facendo riferimento a dati degli anni 40 del secolo scorso, l’età di esordio dello sviluppo genitale è stata stimata, da studi sia americani sia europei,
20
intorno agli 11.5 anni [14, 25]. Nello studio NHANES III è stato rilevato, come per le femmine, un anticipo significativo nell’età di esordio puberale, rispetto ai dati raccolti negli anni precedenti. Tuttavia, la carenza di dati tratti dagli studi antecedenti (NHES III) ha portato a numerose controversie sull’interpretazione dei risultati del NHANES III.
Un contemporaneo studio americano, considerato più attendibile per l’utilizzo dell’orchidometro di Praeder nella valutazione dello stadio puberale, ha riscontrato un’età media allo sviluppo compatibile a quella rilevata dai precedenti studi americani ed europei, i quali non erano ricorsi a tale ausilio diagnostico per la stima del volume testicolare [26].
In Europa sono disponibili pochi studi ad ampio spettro sulla popolazione maschile nei quali, in contrasto con quanto riscontrato nei corrispettivi americani, la valutazione clinica è stata integrata con l’utilizzo dell’orchidometro di Prader.
Valutando i dati a disposizione non si è osservato un declino nell’età di esordio puberale tra gli anni 60 e gli anni 90 del secolo scorso.
Più recentemente lo studio di Copenhagen ha documentato, mediante valutazione dello stadio dei genitali e del volume testicolare con orchidometro di Prader, un declino di 3 mesi nell’età di esordio puberale nel sesso maschile verificatosi negli ultimi 15 anni, analogamente a quanto osservato dallo stesso studio nel sesso femminile.
21
Pertanto l’inizio dello sviluppo può aver subito un’anticipazione anche nei maschi, sebbene in modo meno esteso rispetto al sesso femminile.
Il limite di età classicamente utilizzato per definire la pubertà precoce nei maschi sembra essere tuttora valido sulla base di questi studi su popolazioni.
Figura 6. Età di sviluppo testicolare nei maschi (Sorensen et al., Hormone Research in Paediatrics 2012)
Il riscontro, più evidente nel sesso femminile, di un anticipo nei tempi di comparsa dei primi segni puberali associato ad una stabilità nella manifestazione dei segni successivi (e del menarca) ha portato la comunità scientifica a chiedersi se tale anticipazione delle manifestazioni cliniche si associ o meno ad un incremento di tipo puberale dei livelli ormonali [11].
22
Grazie al contributo del Copenhagen Puberty Study del 2009 è stato possibile raccogliere campioni di sangue dalla maggior parte dei pazienti di entrambi i sessi inclusi nello studio al fine di valutare i livelli circolanti di gonadotropine e steroidi sessuali [21].
Sorprendentemente il netto declino dell’età di comparsa del tessuto mammario non era accompagnato da una precocità nell’incremento dei livelli di gonadotropine ed estradiolo [21].
La mancanza di un incremento di questi ormoni suggerisce che il recente anticipo nell’età del telarca non sia causato da una precoce attivazione puberale di tipo centrale (gonadotropino-dipendente); ciò ha portato ad ipotizzare che siano coinvolti altri fattori gonadotropino-indipendenti, come ad esempio un aumento della biodisponibilità di estrogeni o della sensibilità ad essi, con conseguente sviluppo di un telarca isolato.
23
1.3.3 Fattori coinvolti nella variabilità di inizio della pubertà
La variabilità riscontrata nell’età di inizio dello sviluppo puberale è il risultato dell’interazione di più fattori, di natura genetica, etnica, nutrizionale ed ambientale.
1.3.3.1 Fattori genetici
Il momento di avvio della pubertà presenta una forte correlazione all’interno di gruppi etnici, familiari, in particolare tra gemelli omozigoti, a dimostrare come il 50-80% della variabilità del timing puberale sia determinato da fattori genetici [10].
È importante considerare che tale componente genetica non preclude un ruolo significativo delle influenze ambientali che sono mutate nel corso del tempo.
Recentemente è stata rivolto particolare interesse nell’individuazione dei fattori genetici principalmente coinvolti nell’avvio dello sviluppo puberale. Alcuni studi condotti analizzando l’aggregazione familiare e la ricorrenza di pubertà precoce all’interno delle famiglie di bambini affetti da PPC suggeriscono una trasmissione autosomica dominante con penetranza incompleta sesso-dipendente [27].
24
Tra i meccanismi genetici coinvolti nel processo di sviluppo puberale dei mammiferi è stato recentemente identificato il sistema ligando-recettore GPR54.
Mutazioni inattivanti di GPR54 sono state individuate in alcuni soggetti con ipogonadismo ipogonadotropo, condizione clinica caratterizzata dall’assenza di maturazione sessuale e bassi livelli di gonadotropine.
Il ligando di GPR54 è codificato dal gene KISS1, che produce un peptide di 54 aminoacidi chiamato kisspeptina, sintetizzato a livello ipotalamico [28].
Studi di biologia molecolare hanno dimostrato come l’espressione ipotalamica di KISS1 aumenti nel momento del picco di rilascio di GnRH in entrambi i sessi all’inizio della pubertà. Esperimenti eseguiti su topi di sesso femminile immaturi e scimmie di sesso maschile prive di gonadi hanno mostrato come una somministrazione sistemica o centrale di kisspeptina induca una precoce attivazione dell’asse ipotalamo-ipofisario per stimolazione della secrezione di GnRH dai neuroni ipotalamici che esprimono GPR54 [29, 30].
In particolare, somministrazioni ripetute di kisspeptina alterano la comparsa della maturazione sessuale nei topi femmina con un precoce sviluppo dei caratteri sessuali secondari ed incremento delle gonadotropine [31].
25
La prima alterazione del sistema della kisspeptina in pazienti con pubertà precoce centrale idiopatica è stata riscontrata nel 2009 in una bambina nella quale è stata individuata una mutazione attivante il gene che codifica per GPR54 [32].
Parallelamente è stata identificata, in un bambino con PPC, una mutazione del gene KISS1 con conseguente maggior resistenza della kisspeptina alla degradazione in vitro ed incremento della sua biodisponibilità [32].
Tali evidenze vanno a sostenere l’ipotesi che il sistema della kisspeptina svolga un importante ruolo nella determinazione dello sviluppo puberale . A tale proposito De Vries et collaboratori hanno dimostrato come i livelli di kisspeptina risultino significativamente più alti in ragazze con PPC rispetto ai controlli, suggerendo la possibilità che tale parametro venga utilizzato come criterio aggiuntivo per confermare la diagnosi di pubertà precoce centrale [28].
Oltre al sistema della kisspeptina, polimorfismi del gene LIN28B o nelle sue vicinanze hanno mostrato un’associazione con l’età del menarca in quattro indipendenti studi GWA (genome-wide association) [33-36].
Uno di questi ha dimostrato una stretta correlazione tra tali polimorfismi e una precoce età del menarca e di altri indicatori di sviluppo puberale (sviluppo mammario, cambiamenti nella voce e avanzamento della peluria pubica ed ascellare) [35].
26
LIN28B e il suo omologo LIN28A codificano infatti per due proteine che agiscono come regolatori di microRNA nel sistema endocrino con un ruolo importante nel determinare l’inizio della pubertà [37].
Sono attualmente in corso studi per individuare altri possibili geni implicati nella patogenesi della pubertà precoce centrale, con possibili candidati come il sistema GABAergico, il Neuropeptide Y, la Leptina e il suo recettore (LEPR) ed il sistema della Neurochinina B [27]. Questi potranno portare nei prossimi anni un contributo importante nella comprensione della patogenesi e dei meccanismi genetici dello sviluppo puberale.
1.3.3.2 Fattori nutrizionali
Negli ultimi anni è stata posta particolare attenzione all’influenza esercitata dalle abitudini alimentari e dallo stato nutrizionale sullo sviluppo sessuale. Diversi studi hanno suggerito una correlazione tra l’anticipazione della pubertà e l’evidente aumento del tasso di obesità in età pediatrica osservato nell’ultimo secolo [38].
I primi autori a suggerire una relazione diretta tra peso corporeo ed età dello sviluppo puberale furono Frisch e Revelle, i quali, negli anni 70 del secolo scorso, comparando gruppi di maturatori precoci e tardivi, conclusero che è necessaria una quantità critica di tessuto adiposo affinchè la pubertà abbia inizio [39].
27
L’ipotesi di Frisch e Revelle ha ispirato un numero considerevole di studi che hanno talora confermato l’esistenza di una relazione significativa tra età di inizio della pubertà e massa grassa, valutata mediante il calcolo dell’indice di massa corporea (BMI, Body Mass Index).
Nel 1987 il National Heart, Lung and Blood Institute’s National Growth and Health Study, condotto su un gruppo di ragazze tra i 9 e i 18 anni, ha dimostrato come le ragazze a sviluppare per prime fossero quelle con un BMI consistentemente più alto [38].
Più recentemente i risultati del Pediatric Research in Office Settings (PROS) hanno messo in luce come in ragazze bianche tra i 6 e i 9 anni, il punteggio BMI z (calcolato utilizzando tabelle tratte dallo studio NHANES III) del sottogruppo allo stadio B2 di Tanner fosse significativamente maggiore rispetto al sottogruppo della stessa età in fase prepubere con una relazione diretta ad ogni età tra stadio di Tanner e BMI z score (Fig. 7). Lo stesso andamento è stato osservato nella popolazione afroamericana, seppur con differenze minori [38].
28
Figura 7. Relazione tra sviluppo mammario secondo lo stadio puberale di Tanner e BMIz score in bambine di età compresa tra i 7 e i 12 anni (Kaplowitz et al., Pediatrics 2001)
Un ulteriore studio ad aver esaminato la relazione tra il menarca e l’attuale trend in aumento dell’obesità pediatrica è il Bogalusa Heart Study, da cui è emerso come una precoce età al menarca sia correlata negativamente con il BMI: i dati dello studio dimostrano come l’incidenza di menarca precoce (prima di 11 anni) sia 1.79 volte maggiore nelle ragazze al 75° percentile per il BMI rispetto a quelle al 25° percentile [38].
Un recente confronto tra i dati del National Health Examination Survey (NHES), raccolti tra il 1963 e il 1970, e i dati del NHANES III, raccolti tra il 1988 e il 1994, mostra come l’età media al menarca nell’arco di 25 anni sia passata da 12.8 a 12.5 anni, e contemporaneamente la percentuale di ragazze tra i 10 e i 15 anni con un BMI maggiore all’85° percentile sia
29
aumentata dal 16% al 27% [38]. Similarmente a quanto osservato negli studi PROS e Bogalusa, ragazze prepuberi di età tra i 10 e i 15 anni presentavano un BMI z score minore rispetto a ragazze della stessa età post-menarca sia nel NHES che nel NHANES III.
Come si evince da questi studi, sono pochi i dati disponibili sulla popolazione di sesso maschile, pertanto la relazione tra obesità e precocità dello sviluppo puberale nei maschi deve essere ancora indagata.
Osservazioni cliniche e studi condotti su modelli animali hanno evidenziato come la leptina, neurormone prodotto dagli adipociti, agendo come segnale correlato ai depositi di grasso nell’organismo, svolga un importante ruolo permissivo nell’avviamento della pubertà, sebbene il suo incremento non sembra essere il fattore determinante per il suo inizio. La leptina rappresenterebbe quindi il legame tra i depositi di grasso nell’organismo e l’età di inizio della pubertà [38].
1.3.3.3 Fattori ambientali
Fattori socioeconomici, stile di vita, luogo di residenza, livello di educazione ed esposizione ad inquinanti ambientali sono elementi che hanno mostrato possedere un ruolo importante nella determinazione dell’età di inizio della pubertà.
30
È stato dimostrato come bambini che provengono da famiglie con un elevato status socioeconomico vadano incontro al menarca più precocemente rispetto a bambini di famiglie disagiate; allo stesso modo vivere in ambienti urbanizzati comporta uno sviluppo puberale ad un’età minore rispetto a quello che si osserva negli ambienti rurali [11].
A riprova dell’importanza svolta dallo stile e dalle condizioni di vita sulla determinazione dell’età del menarca è stato osservato un secular trend anche nei paesi in via di sviluppo come conseguenza del miglioramento delle condizioni di vita. A sostegno di tale ipotesi, si è riscontrato, all’interno del medesimo paese, un’anticipazione dell’età di inizio della pubertà nelle bambine che vivono in migliori condizioni socioeconomiche e nutrizionali [10].
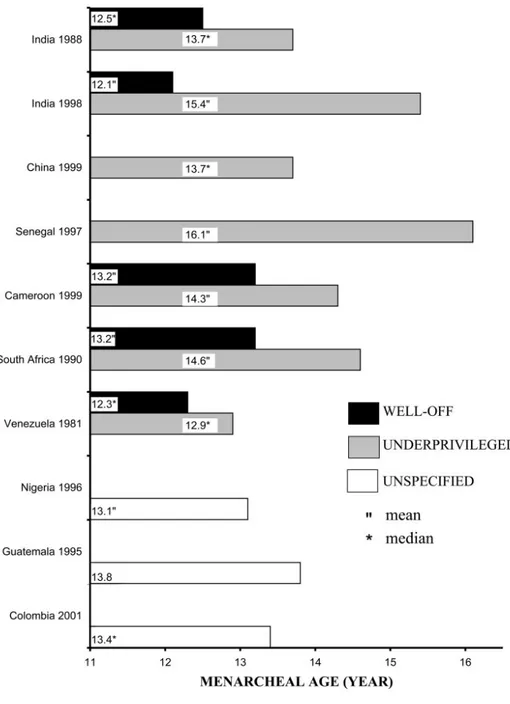
È stato notato che l’età del menarca in paesi come la Nigeria, il Guatemala o la Colombia risulta più tardiva rispetto al vicino Cile o al Venezuela, in cui la qualità della vita è migliore. In paesi come la Cina e il Senegal, in cui le ragazze vivono in condizioni ancor più sfavorevoli, l’età del menarca si aggira addirittura intorno ai 16.1 anni (Fig. 8) [11].
31
Figura 8. Età media (o mediana) al menarca in diversi paesi in via di sviluppo; i dati sono mostrati separatamente a seconda delle condizioni di vita (Parent et al., Endocrine Reviews 2003).
32
Questi dati dimostrano il ruolo cruciale svolto dalle condizioni socioeconomiche e nutrizionali nella determinazione dell’età di inizio della pubertà [10].
A sostegno di questa ipotesi è stata osservata in Europa e negli Stati Uniti una maggior incidenza di pubertà precoce centrale in bambini adottati da paesi in via di sviluppo, i quali passano da condizioni di vita altamente sfavorevoli ad una situazione di benessere psicosociale [40]. La frequenza di PPC in questi bambini è stata stimata nei vari studi tra il 13 ed il 30%, con una leggera preponderanza nel sesso femminile [10].
Anche situazioni di stress quali patologie acute/croniche [41] o vivere condizioni di guerra [42] sembrano influenzare l’attività dell’asse iptalamo-ipofisario, comportando un ritardo nell’inizio dello sviluppo puberale. Un ulteriore ruolo nell’avvio della pubertà, a cui negli ultimi anni è stata posta particolare attenzione, è quello svolto da sostanze indicate con la dizione anglosassone endocrine disrupters traducibile in italiano con disregolatori endocrini.
Con questo termine si intendono sostanze inquinanti che possiedono attività ormonale. Sono composti esogeni, sintetici o naturali, capaci di interferire con la sintesi, la secrezione e il catabolismo degli ormoni endogeni, alterando l’omeostasi endocrina dell’organismo [43].
Questi composti comunemente dispersi nell’ambiente, possono derivare da attività industriali o agricole (pesticidi, solventi, metalli pesanti), la
33
maggior parte dell’esposizione comunque si suppone avvenga attraverso la contaminazione degli alimenti (90%). Tali sostanze sono state implicate nella genesi di alterazioni importanti a carico della sfera riproduttiva, dell’apparato genito-urinario, del metabolismo e in alcuni casi connessi anche all’insorgenza di alcuni tumori [43].
È stato prospettato un loro coinvolgimento anche nell’insorgenza della pubertà precoce centrale, in quanto dati raccolti da studi epidemiologici e sperimentali sull’animale hanno mostrato un’interazione tra disregolatori endocrini e l’asse ipotalamo-ipofisi-gonadi con una prematura attivazione di quest’ultimo [44].
Sono state recentemente segnalate sostanze ad azione estrogenica di uso comune e considerate innocue, presenti ad esempio in tisane a base di finocchio selvatico e in olii essenziali per uso topico, coinvolte rispettivamente nell’insorgenza di telarca prematuro e di ginecomastia in bambini prepuberi [45, 46].
L’inquinamento da parte dei disregolatori endocrini potrebbe quindi essere una concausa dell’anticipato timing dello sviluppo sessuale, come suggerito dal rilievo di una maggiore incidenza di pubertà precoce centrale in zone con un’alta concentrazione di queste sostanze [43].
34
1.3.4 Epidemiologia
La PPC rappresenta un disordine relativamente raro con un’incidenza stimata tra 1:5000 a 1:10000 [1, 9].
Il rapporto femmine / maschi varia da 3:1 a 23:1 [9]. È stato ipotizzato che la ragione di tale preponderanza del sesso femminile sia da ascrivere ad una minor sensibilità del centro di regolazione ipotalamico della secrezione delle gonadotropine (pulse generator) agli effetti inibitori esercitati da bassi livelli di steroidi gonadici che caratterizzano il periodo prepuberale [47]. È stata riscontrata una predisposizione allo sviluppo di PPC in bambini affetti da patologie quali la neurofibromatosi di tipo I , meningomielocele , idrocefalo , encefalopatia neonatale e in bambini che siano stati sottoposti ad irradiazione del cranio [48].
1.3.5 Fisiopatologia
Da un punto di vista fisiopatologico la PPC è l’espressione di una precoce attivazione dell’asse ipotalamo-ipofisario con un aumento della secrezione pulsatile di GnRH nella circolazione portale ipofisaria e conseguente rilascio di LH ed FSH nel circolo periferico.
Ad oggi non siamo a conoscenza di quale sia il trigger responsabile dell’attivazione dell’asse ipotalamo-ipofisario.
35
Molteplici fattori, tra cui molti ancora da individuare, appaiono implicati nella genesi della PPC, tra cui: la presenza di familiarità per pubertà precoce, un basso peso alla nascita o un eccessivo guadagno di peso nella prima infanzia, la condizione di adozione, l’esposizione a sostanze chimiche e ormonali.
1.3.6 Eziologia
Da un punto di vista eziologico la PPC può essere distinta in: Idiopatica (familiare o sporadica)
Organica
Alterazioni a carico del SNC vengono riscontrate solo in una piccola percentuale dei pazienti presi in esame, con una notevole differenza tra i due sessi: la prevalenza di forme idiopatiche risulta del 69-98% nelle pazienti di sesso femminile e dello 0-60% nei pazienti di sesso maschile. Pertanto il rischio di una sottostante origine organica è maggiore nei bambini maschi [49] ed è inversamente proporzionale all’età di insorgenza [50].
La lesione più frequentemente riscontrata è l’amartoma ipotalamico (2-28% dei pazienti), lesione generalmente asintomatica, ma che talvolta può manifestarsi con crisi convulsive spesso resistenti al trattamento anticonvulsivante [1].
36
Le principali cause di pubertà precoce centrale sono riportate in Tabella 1.
Tabella 1. Principali cause di pubertà precoce centrale
IDIOPATICA
Familiare (≈ 30% dei casi) Sporadica
NEUROGENICA O ORGANICA
Malformazioni congenite (cisti aracnoidee, idrocefalo, spina bifida, neurofibromatosi tipo I, meningomielocele)
Adenoma LH secernente, pinealoma
Malattie acquisite: tumori ipotalamici (amartomi, astrocitomi, gliomi, craniofaringioma, ependimoma), infezioni del SNC, encefalopatie neonatali, ascessi del SNC, radioterapia, chemioterapia, traumi cranici.
SECONDARIA AD ESPOSIZIONE ECCESSIVA AGLI ORMONI STEREOIDEI
Iperplasia surrenale congenita Testotossicosi
Sindrome di Mc Cune Albright
Tumori ovarici, testicolari e surrenalici Cisti ovariche
37
1.3.7 Clinica della PPC e sue varianti cliniche
1.3.7.1 Clinica della PPC
Sul piano clinico la PPC non si differenzia dalla pubertà normale, e lo sviluppo dei caratteri sessuali secondari segue, in generale, il medesimo ritmo cronologico.
La comparsa di tessuto mammario nella femmina (corrispondente allo stadio B2 di Tanner) e l’incremento del volume testicolare nel maschio (oltre i 4 ml) sono i primi segni fisici dell’attivazione dell’asse ipotalamico-ipofisario, fenomeno spesso preceduto o accompagnato da un’accelerazione della velocità di crescita.
1.3.7.2 Varianti cliniche
La PPC rappresenta un continuum di manifestazioni cliniche e velocità di progressione, spaziando da varianti normali od incomplete lentamente progressive a forme complete rapidamente progressive, in cui lo sviluppo puberale procede ad una velocità maggiore rispetto a quella fisiologica e l’assetto ormonale è patologico.
Un quadro particolare è quello della cosiddetta Early and Fast Puberty (EFP), definita dalla comparsa di segni puberali tra gli 8 e i 9 anni con
38
progressione accelerata [51]. Nonostante alcuni autori abbiano sostenuto che questa condizione possa portare ad una compromissione della statura adulta [52], l’utilità dell’intervento terapeutico con analoghi del GnRH è ancora oggi oggetto di controversie.
La PPC deve essere pertanto distinta da tali varianti normali o transitorie mediante un’accurata ispezione clinica, la determinazione dell’età ossea (EO), un’ecografia pelvica nelle bambine e la valutazione dell’assetto ormonale con test di stimolo al GnRH.
1.3.8 Conseguenze
La pubertà precoce si accompagna non solo alla comparsa di caratteristiche sessuali secondarie, ma anche ad un insieme di modificazioni auxologiche che possono avere ripercussioni importanti sul raggiungimento della statura adulta.
Nei bambini con pubertà precoce centrale la velocità di crescita è aumentata e l’età ossea (EO) è avanzata rispetto all’età cronologica (EC), come conseguenza dell’azione degli ormoni sessuali sulla cartilagine di coniugazione che determinano una più precoce ossificazione dei nuclei di accrescimento epifisari e una riduzione del potenziale di crescita [8]. Ciò rappresenta un aspetto auxologico sfavorevole perché determina una statura
39
finale (FH, Final Height) ridotta rispetto a quella ottenibile in base al patrimonio genetico (TH, Target Height) se la pubertà avvenisse a un’età normale.
Questi bambini risultano, infatti, più alti rispetto ai loro coetanei prepuberi al momento dello sviluppo puberale anticipato [1], ma in assenza di un “adeguato trattamento“ presentano da adulti una bassa statura.
È stato descritto inoltre nei bambini con pubertà precoce centrale un aumento della frequenza di fenomeni quali disturbi psicologici della sfera dell’attività sessuale, rischio di abuso, consumo di sostante stupefacenti, disturbi della condotta alimentare, depressione [53, 54]. Questi effetti negativi sono spesso limitati nel tempo, ma possono talora protrarsi fino all’età adulta [54].
Infine studi retrospettivi dimostrano come donne che abbiano raggiunto precocemente l’età del menarca presentino nella vita adulta valori più alti di BMI, circonferenza addominale, pressione arteriosa, emoglobina glicosilata, e uno sfavorevole profilo lipidico [53]. Tutte queste caratteristiche portano ad un maggior rischio di ipertensione, diabete mellito, malattie cardiovascolari, quindi ad un aumento della morbidità e mortalità [55].
40
1.3.9 Diagnosi di PPC
La diagnosi di PPC può essere formulata sulla base di rilievi sia clinici sia biochimici sia strumentali.
Dal punto di vista clinico l’esame del bambino deve comprendere un’accurata anamnesi personale e familiare, la valutazione dei parametri auxologici e la quantificazione dello stadio puberale mediante l’utilizzo dei parametri di Tanner.
Attraverso l’anamnesi bisogna risalire all’età di comparsa dei primi segni di sviluppo puberale, la progressione di questi ultimi nel tempo e il pattern di crescita negli ultimi 6-12 mesi. E’ necessario interrogare i genitori sull’età di comparsa dei caratteri sessuali secondari e di ulteriori segni di pubertà come acne, sudorazione acre, erezione ed emissioni notturne nei bambini, perdite ematiche vaginali nella bambine [56].
Una familiarità può suggerire una forma di pubertà precoce centrale familiare o nel maschio una condizione di testotossicosi [1].
L’esame fisico deve includere l’altezza, il peso, la misura delle proporzioni fisiche e dello stadio puberale secondo Tanner.
Deve essere valutata l’età ossea, mediante una radiografia del polso e della mano non dominante. Nella pubertà precoce il metodo di Greulich e Pyle rimane quello generalmente più usato e probabilmente più adeguato seppur con le limitazioni metodologiche di utilizzare una metodica per la
41
valutazione di soggetti normali ed applicata a condizioni patologiche [1]. Un valore di età ossea maggiore di 2 DS rispetto a quella cronologica è indicativa, insieme con gli altri dati clinici, di uno sviluppo puberale precoce; in particolare un rapporto EO/ES > di 1.0 è suggestivo per una forma di pubertà precoce a rapida evoluzione [48].
Un’ecografia pelvica e addominale è indicata in tutte le bambine per escludere la presenza di un tumore ovarico o surrenalico o la presenza di cisti ovariche. Secondariamente il rilievo ecografico delle dimensioni delle ovaie e dell’utero, la forma e lo spessore uterino, la struttura dell’ovaio (omogeneo o microcistico in epoca pre-puberale, multicistico o macrocistico/follicolare in bambine con pubertà precoce centrale), la presenza di endometrio, il rapporto fondo/cervice uterina, e la valutazione con Ecocolor-Doppler delle arterie uterine rappresentano parametri utili nella diagnosi differenziale tra pubertà precoce centrale, pubertà normale o telarca prematuro .
La valutazione ecografica può fornire alcune misurazioni utili al fine di discriminare forme di pubertà precoce da varianti di sviluppo normali. In particolare: a livello uterino la presenza di un eco endometriale, una lunghezza > 4 cm, con diametro trasverso > 1.5 cm o un volume > 2.0 cm, e un volume ovarico compreso tra 1-3 mL (calcolato secondo la formula: lunghezza x larghezza x altezza x 0.5233) in una bambina con telarca suggerisce una diagnosi di PPC.
42
Nonostante l’accuratezza delle misurazioni, nessuno di questi parametri può essere valutato come diagnostico da solo, ma deve essere integrato con la valutazione clinica-auxologica e con la valutazione dell’assetto ormonale [57].
La valutazione ormonale deve includere la valutazione dell’asse ipotalamo-ipofisi-gonadi; il gold standard è rappresentato dal test di stimolo con GnRH (100 μg/m² i.v.) con la successiva determinazione di LH e FSH a vari intervalli di tempo [56]. Questo esame oltre a permettere la diagnosi definitiva di pubertà precoce centrale consente anche l’esclusione delle forme gonadotropino-indipendenti (periferiche). La risposta puberale al test prevede un aumento significativo di entrambi gli ormoni, in particolare un picco di LH nel range puberale (usualmente > 5ul/L con i metodi IRMA o ICMA), con una risposta predominante dell’LH sull’FSH [1, 58].
Negli ultimi anni, in parte grazie ai miglioramenti nelle tecniche di quantificazione dei livelli basali di gonadotropine, è insorto il dibattito sull’utilità della misurazione del livello basale di LH come unica metodica per porre diagnosi di PPC [53]. Si tratta di un metodo che dispone di una maggior sensibilità per la rilevazione di valori molto bassi, capace di discriminare differenze di addirittura 0,1 U/L. Tuttavia è stato riscontrata con questa metodica una maggior difficoltà nel distinguere pattern ormonali prepuberali da quelli puberali, soprattutto negli stadi iniziali, a causa di una sovrapposizione dei dati ormonali ottenuti [53].
43
Per questo ad oggi la maggior parte degli autori continua a ritenere il test da stimolo con GnRH il gold standard per la diagnosi di PPC.
Alcuni valori ormonali, sebbene non diagnostici da soli, devono essere valutati nel sospetto di PPC e possono rappresentare un importante ausilio diagnostico. Nelle femmine i valori di estradiolo, ottenuti al mattino utilizzando kit con limiti di determinazione approssimativamente di 5 pg/ml (18 pmol/litro), possono fornire importanti indicazioni: ad esempio valori > 20 pg/ml possono indicare una produzione od un’esposizione estrogenica, mentre valori più elevati (> 100 pg/ml) sono suggestivi per la presenza di cisti ovariche o tumori. Livelli di estradiolo >20 pg/ml supportano la diagnosi di PPC, sebbene sia importante evidenziare come siano stati riscontrati valori inferiori in bambine affette da PPC.
La valutazione ormonale dovrebbe includere inoltre il dosaggio del testosterone: valori elevati rappresentano un marker attendibile di attivazione testicolare nei maschi, mentre nelle femmine la sua determinazione è utile in presenza di segni di iperandrogenismo.
Tuttavia è importante ricordare che la determinazione del testosterone e dell’estradiolo presenta un importante limite diagnostico. I metodi di dosaggio attualmente disponibili in commercio non sempre prevedono limiti di sensibilità inferiori ai valori prepuberi, e attualmente solo la
tandem mass spectometry, il più sensibile metodo di misurazione, è in
44
In conclusione si può affermare che la misurazione degli ormoni gonadici può fornire informazioni a supporto della diagnosi di PPC ma da sola non è sufficiente [6, 56].
Per escludere forme secondarie di pubertà precoce centrale è importante inoltre valutare anche la funzionalità tiroidea e surrenalica e i valori di α-fetoproteina in particolare nei maschi.
Infine una risonanza magnetica dovrà essere eseguita in tutti i bambini soprattutto se sussistono segni o sintomi clinici che richiedono l’esclusione di una lesione del sistema nervoso centrale come causa di pubertà precoce centrale [48], se si tratta di pazienti di sesso maschile o se l’età del soggetto è comunque inferiore a 5-6 anni (anche in assenza di qualunque sintomatologia clinica) [48, 59]. Nonostante ciò ad oggi esistono ancora molte controversie relative alla scelta dei pazienti da indirizzare a questo tipo di indagine [60]: anche recenti dati in letteratura hanno confermato come possano esservi lesioni del SNC anche in età successive in assenza di segni clinici suggestivi di alterazioni neurologiche [61].
Riassumendo è possibile far diagnosi di PPC in presenza di:
Segni di attivazione dell’asse ipotalamo ipofisario in bambine di età inferiore agli 8 anni o in bambini di età inferiore ai 9 anni che si manifesti nelle prime con stadio B2 di Tanner, nei secondi con incremento del volume testicolare (>4 ml).
45 Aumento della velocità di crescita
Avanzamento dell’età ossea di almeno un anno rispetto all’età cronologica Segni aggiuntivi (sanguinamenti mestruali e/o perdite vaginali nelle
bambine; acne, capelli grassi, erezioni e polluzioni notturne nei bambini) Aumento dei livelli di LH, basali o dopo test di stimolo con GnRH (sono da
considerarsi puberali valori basali> 0.6 UI/L e valori di picco dopo stimolo >5 UI/L)
1.3.10 Diagnosi differenziale
Qualora ci si trovi di fronte ad un bambino con sospetto di pubertà precoce centrale è fondamentale escludere quelle che vengono definite “forme incomplete”. Tra le più comuni:
telarca prematuro isolato, comparsa di tessuto mammario (stadio 2 di Tanner) in bambine nei primi anni di vita senza evidenze di una sua rapida progressione nel tempo e in assenza di patologie del sistema nervoso centrale che ne giustifichino l’insorgenza [62]. Questo disturbo insorge generalmente prima dei 2 anni di vita e raramente dopo i 4 anni, regredisce nella maggior parte dei casi nei 6 mesi o 6 anni successivi alla diagnosi. Solo in una minoranza di bambine il telarca si mantiene sino alla pubertà. Nella maggior parte dei casi non si osserva un aumento della velocità di crescita e l’età ossea può talora essere avanzata di 6-12 mesi, mentre è raro
46
un avanzamento di 2 o più anni [6]. È una condizione benigna che non pregiudica lo sviluppo e la fertilità delle bambine affette e non richiede alcun trattamento se non un attento follow up per il rischio, seppur raro, di evoluzione in un quadro di pubertà precoce vera [63].
Pubarca o ircarca prematuro isolato: precoce comparsa di peluria pubica (pubarca) e/o ascellare (ircarca), spesso accompagnata da sudorazione acre, prima degli 8 anni nelle femmine e dei 9 anni nei maschi in assenza degli altri segni di maturità sessuale o di virilizzazione. È una condizione benigna che non necessita di alcun trattamento [64]. Generalmente i bambini con pubarca prematuro presentano una velocità di crescita normale per l’età [6] ed un’età ossea che può essere lievemente avanzata per l’età cronologica senza una compromissione della statura finale [64]. La base ormonale del PA è un precoce incremento della secrezione surrenalica di deboli androgeni, principalmente DHEA, il quale viene convertito in una forma di deposito, il DHEAS . La causa dell’aumento dei livelli dei questo ormone non è nota, ma non sembra essere generalmente conseguenza di un’incrementata secrezione dell’ormone ipofisario ACTH, poiché i livelli di cortisolo non risultano aumentati [6]. Diversi studi hanno identificato nell’obesità e nel basso peso alla nascita due potenziali fattori di rischio per l’insorgenza di adrenarca isolato [65, 66].
peluria genitale nell’infanzia: comparsa di sottili peli nell’area genitale nel primo anno di vita, tipicamente lungo le labbra nei bambini e sullo scroto
47
nelle bambine. Gli organi genitali sono invariati e la velocità di crescita non risulta aumentata. Non sono necessarie ulteriori indagini [6].
menarca prematuro isolato: rara condizione caratterizzata dalla comparsa di perdite ematiche vaginali periodiche senza altri segni di sviluppo sessuale secondario; può presentarsi sotto forma di leggeri sanguinamenti intermittenti o spotting quotidiano che perdura per molte settimane o episodi di sanguinamento severo che durano diversi giorni e sono separati da periodi di 3-4 mesi. L’esame ultrasonografico della pelvi mostra un quadro normale. Ad oggi non è noto il meccanismo responsabile di questo fenomeno [6]. Si tratta di una condizione benigna che non richiede alcuna forma di trattamento e non pregiudica la fertilità futura.
Infine la pubertà precoce centrale deve essere distinta dalla pubertà precoce periferica (altrimenti detta pseudo pubertà precoce o pubertà precoce gonadotropino-indipendente) caratterizzata dalla comparsa di alcuni caratteri sessuali secondari con perdita della sequenza fisiologica in assenza dell’attivazione dell’asse ipotalamo-ipofisi-gonadi.
La diagnosi differenziale si basa sull’esecuzione del test al GnRH che mostrerà bassi livelli di LH ed FSH.
48
1.4 Il trattamento della PPC
1.4.1 Indicazioni al trattamento della PPC
Il trattamento può essere indicato per ragioni sia psicosociali/comportamentali sia auxologiche sia una combinazione delle due.
Le più importanti complicanze a lungo termine della PPC sono rappresentate da una ridotta prognosi staturale e da importanti ripercussioni sullo sviluppo psicologico e sociale del bambino, un’anticipata maturazione sessuale inadeguata per l’età cronologica del soggetto, turbe comportamentali e difficoltà nella vita di relazione [67].
La decisione di trattare deve basarsi sia sull’età di esordio dello sviluppo puberale sia sull’evidenza della sua progressione.
Nelle bambine, allorchè la pubertà si manifesti con caratteristiche di progressività prima dell’età di 7 anni, il trattamento è fortemente raccomandato al fine di preservare il potenziale di crescita, mentre risulta ancora dibattuta l’appropriatezza di un trattamento somministrato in bambine la cui diagnosi di PPC cade nell’ambito di una fascia di età borderline (7-8 anni). I dati della letteratura confermano che in casi “dubbi” ( età cronologica di 7-8 anni, età ossea non particolarmente avanzata, previsione staturale vicina al target genetico) è importante lo
49
svolgimento di un adeguato follow up per valutare la progressione dello sviluppo puberale, i cambiamenti nella previsione della statura adulta (PAH, Predicted Adult Height) e la variazione dell’assetto ormonale per stabilire infine quali di questi pazienti necessitino del trattamento.
Nei maschi l’indicazione al trattamento si basa essenzialmente sull’età di esordio, sulla presenza di un andamento rapidamente progressivo dello sviluppo puberale e/o sullo sviluppo di problematiche di tipo psicosociale o comportamentale [1].
1.4.2 Obiettivi del trattamento
Gli obiettivi principali della terapia sono la soppressione della secrezione ipofisaria di gonadotropine con la diminuzione della produzione degli ormoni sessuali da parte delle gonadi [9].
La finalità principale è quella di bloccare l’evoluzione dei segni puberali prematuramente comparsi e rallentare la velocità di crescita e la maturazione ossea accelerata, al fine di migliorare la prognosi staturale del soggetto.
Ulteriori scopi del trattamento sono la prevenzione di un menarca anticipato e di una precoce attività sessuale, l’acquisizione di normali proporzioni corporee e la possibilità di un adeguato sviluppo psicologico per l’età.
50
La terapia deve perciò assicurare il benessere psicosociale del bambino e consentirgli un coretto inserimento tra i coetanei riducendo allo stesso tempo l’apprensione dei genitori [9, 67].
1.4.3 Modalità di trattamento
Il trattamento della PPC è essenzialmente di tipo farmacologico.
Anche nei casi di PPC secondaria a lesione centrale il trattamento causale non ha alcun effetto sul decorso dello sviluppo puberale, pertanto, nei casi in cui la patologia di base non lo richieda, non si realizza alcun intervento chirurgico, ma si ricorre esclusivamente alla terapia medica [53].
Dal 1981 l’utilizzo di agonisti del GnRH (GnRHa) rappresenta il trattamento d’elezione con radicale modificazione della prognosi dei pazienti affetti [48, 68].
Le terapie con ciproterone acetato e medrossiprogesterone acetato usate in passato sono oggi ritenute obsolete per la loro incompleta soppressione ormonale, gli scarsi effetti sulla statura finale e potenziali importanti effetti collaterali (ipertensione, aumento di peso, epatotossicità, astenia, alterazione della funzione surrenalica) [1, 69].
Gli agonisti del GnRH sono decapeptidi sintetici analoghi al peptide naturale dal quale differiscono per la sostituzione di un solo aminoacido,
51
cambiamento che conferisce al prodotto un notevole potere agonista associato ad una più marcata resistenza alla degradazione enzimatica.
La somministrazione cronica di GnRHa, dopo un’iniziale fase di stimolazione (flare-up), determina la desensibilizzazione e la down-regulation dei recettori ipofisari del GnRH e il conseguente arresto della secrezione di LH ed FSH [1].
La costante esposizione al farmaco rappresenta un requisito fondamentale per la sua efficacia, determinando la completa soppressione dell’asse ipotalamo-ipofisario [1].
La caduta dei livelli di gonadotropine induce a sua volta una marcata inibizione dell’attività gonadica in entrambi i sessi ed una regressione dei segni e sintomi clinici.
I preparati più comunemente utilizzati per il trattamento della PPC sono la Leuprolina (Enantone) e la Triptorelina (Decapeptyl, Gonapeptyl) sotto forma di preparati depot di cui è sufficiente una sola somministrazione i.m. ogni 28 giorni.
Rispetto ad altri tipi di preparati usati in passato (spray intranasali, iniezioni s.c.), le formulazioni depot rilasciano una quantità costante di principio attivo tra le iniezioni e migliorano significativamente l’efficacia clinica e la compliance, sia a breve che a lungo termine dei bambini trattati [1, 48].
52
In Tabella 2 sono riportate le dosi e gli schemi terapeutici più comunemente utilizzati.
Tabella 2. Principali agonisti del GnRH utilizzati nel trattamento della CPP.
Prodotto Potenza Somministrazione Dose
Buserelin 20 Iniezione s.c. 10-40 μg/kg/die Buserelin Spray nasale 1.2-1.8 μg/kg/die Deslorelin 150 Iniezione s.c. 4-8 μg/kg/die Leuprorelin 20 Iniezione s.c. 20-50 μg/kg/die
Leuprorelin *depot 3.75 140-300μg/kg/28 giorni (USA) Leuprorelin *depot 3.75 3.75 mg/28 giorni
(Europa) Leuprorelin *depot 3.75 10-30-90 μg/kg/28
giorni (Giappone) Leuprorelin *depot 11.25 11.25 mg/90 giorni
Triptorelin 35 *depot 3.75 60-100 µg/kg/25-28 giorni
°rispetto al GnRH naturale; *approvato in Italia per il trattamento della PPC (nota AIFA n. 51)
53
Attualmente sono in commercio formulazioni di triptorelina e leuprolide depot trimestrali (11.25mg/90 giorni), che possono rappresentare un’efficace opzione nel trattamento della pubertà precoce centrale soprattutto in quei bambini con reazioni emotive negative alle iniezioni. Una riduzione del numero annuale delle iniezioni da 12 a 4 potrebbe infatti determinare una migliore compliance al trattamento [1].
Dati provenienti da recenti studi clinici confermano la sicurezza e l’efficacia di questo nuovo tipo di formulazione che rappresenta una valida alternativa soprattutto nei pazienti con scarsa compliance alla terapia e candidati ad una terapia di lunga durata [70, 71].
Ancor più recentemente è emerso un ulteriore approccio al trattamento della PPC rappresentato dall’impianto sottocutaneo di Histerelin acetato (circa 65mcg/die per 12 mesi) che permette una rapida e sostenuta soppressione dell’asse ipotalamo-ipofisi-gonadi per un intero anno [6, 72]. Si tratta di un’alternativa alle tradizionali iniezioni con formulazioni depot da somministrare mensilmente. Dagli studi condotti fino ad oggi questa innovativa formulazione si è dimostrata efficace e generalmente ben tollerata, sebbene siano stati segnalati sporadici casi di formazione di ascessi nel sito di introduzione dell’impianto e rottura dell’impianto [73, 74]. Tali segnalazioni, ad oggi, rappresentano solo casi sporadici e sono necessari follow up a lungo termine per stabilire la ricorrenza di tali complicanze [75].
54
1.4.4 Effetti avversi
Gli analoghi del GnRH sono farmaci generalmente ben tollerati in bambini ed adolescenti. Disturbi di tipo sistemico come cefalea o vampate di calore sono state riscontrati occasionalmente nei pazienti in trattamento, ma sono generalmente sintomi di breve durata che non interferiscono con la terapia. Effetti avversi di tipo locale (eritemi, lesioni orticarioidi, infezioni) si manifestano nel 10-15% dei pazienti e richiedono, se persistenti, un cambiamento nell’agente da utilizzare, poiché possono esitare in ascessi sterili in una certa percentuale di pazienti [73]. Anche se estremamente rari sono stati descritti episodi di anafilassi [59].
Preoccupazioni diffuse nella comunità scientifica riguardano il possibile incremento ponderale associato all’uso di GnRHa, la diminuzione della densità minerale ossea come conseguenza della terapia ed il mancato ripristino della capacità riproduttiva alla sospensione del trattamento [53]. Studi recenti condotti mediante analisi retrospettiva tendono ad escludere queste ipotesi, assicurando la completa sicurezza di questa categoria di farmaci [59].
55
1.4.5 Monitoraggio della terapia
Il monitoraggio del trattamento con analoghi del GnRH richiede un’attento controllo della maturazione scheletrica, della velocità di crescita, delle caratteristiche sessuali secondarie, dei livelli di gonadotropine, di steroidi sessuali e la ripetizione del test al GnRH [1].
Stadio puberale, valori ormonali e parametri auxologici devono essere valutati ogni 3-6 mesi e l’età ossea deve essere stabilita periodicamente, al fine di verificare l’aderenza alla terapia e il suo buon funzionamento.
Si deve tenere in considerazione che la progressione dello sviluppo del seno nelle femmine o dei testicoli nel maschio è suggestiva di una mancata efficacia del trattamento, mentre l’incremento dei peli pubici può indicare un semplice adrenarca [59].
La velocità di crescita e l’avanzamento dell’età ossea rispetto all’età cronologica devono mostrare un declino durante il trattamento: un eccessivo declino della velocità di crescita (minore o uguale a 2 SDS) o un rapido avanzamento dell’età ossea dovrebbero spingere ad una rivalutazione della terapia.
Sanguinamenti vaginali possono comparire dopo la prima somministrazione, ma la loro persistenza può suggerire una perdita di efficacia del trattamento, una compliance inefficace o un’incorrettezza della diagnosi.
56
Per quanto riguarda il follow up dei valori ormonali, livelli elevati di LH, ottenuti utilizzando assay ultrasensibili, sia basali sia dopo stimolo con GnRH o GnRHa, indicano una mancata soppressione ipofisaria [59]. Al contrario, livelli di FSH non sono generalmente utilizzati per monitorare l’efficacia del trattamento. Qualora vengano misurati, testosterone ed estradiolo devono mantenersi a livelli prepuberali.
1.4.6 Durata e sospensione del trattamento
L’influenza dei diversi fattori coinvolti nel guadagno staturale dei pazienti trattati non sempre è ben determinabile.
Diversi studi hanno riportato una relazione diretta tra la durata del trattamento e la statura finale ed una relazione inversa tra l’età all’inizio della terapia e la statura finale. È dimostrato infatti come un eccessivo ritardo (1-2 anni) nella somministrazione della terapia possa compromettere il raggiungimento di una adeguata statura adulta [59].
La decisione di sospendere il trattamento dipende dal raggiungimento di quelli che rappresentano i principali obiettivi dello stesso: il miglioramento della prognosi staturale, la sincronizzazione dello sviluppo puberale con i coetanei ed il superamento di eventuali problematiche psicosociali e/o comportamentali.