1
FACOLTÀ DI SCIENZE MATEMATICHE, FISICHE E
NATURALI
Laurea Magistrale in Conservazione ed Evoluzione
ANALISI DELL’IMPATTO DELLA QUALITÀ
DELL’HABITAT SUI PARAMETRI INDIVIDUALI DI
QUATTRO SPECIE DI MICROMAMMIFERI
(Apodemus sylvaticus, Apodemus flavicollis,
Myodes glareolus, Muscardinus avellanarius):
UN CASO DI STUDIO NEI PAESAGGI FRAMMENTATI
DELL’ITALIA CENTRALE
Anno Accademico 2012-2013
Relatori
Prof. Giovanni Santangelo
Dip di Biologia, Università di Pisa
Dott. Alessio Morteliti
Dip. di Biologia e Biotecnologie “Charles Darwin”,
Università “La Sapienza” di Roma
Candidata
Matilde Boschetti
Mat
.
471596
2
FACOLTÀ DI SCIENZE MATEMATICHE, FISICHE E
NATURALI
Laurea Magistrale in Conservazione ed Evoluzione
ANALISI DELL’IMPATTO DELLA QUALITÀ DELL’HABITAT
SUI PARAMETRI INDIVIDUALI DI QUATTRO SPECIE DI
MICROMAMMIFERI (Apodemus sylvaticus, Apodemus
flavicollis, Myodes glareolus, Muscardinus avellanarius):
UN CASO DI STUDIO NEI PAESAGGI FRAMMENTATI
DELL’ITALIA CENTRALE
Anno Accademico 2012-2013
Relatori
Prof. Giovanni Santangelo
Dip di Biologia, Università di Pisa
Dott. Alessio Morteliti
Dip. di Biologia e Biotecnologie “Charles Darwin”,
Università “La Sapienza” di Roma
Candidata
Matilde Boschetti
Mat. 471596
4
Alla mia famiglia,
che è molto più
di coloro con i quali ho
5
INDICE
1. Introduzione 8
1.1. Perdita, frammentazione e degrado dell’habitat 8
1.2. Qualità dell’habitat e conseguenze a livello individuale: stato dell’arte 15
1.3. Criticità nella ricerca 19
1.4. Scopo dello studio e obiettivi della tesi 21
2. Biologia delle specie 22
2.1. Introduzione all’Ordine Rodentia 22
2.2. Le specie terricole 23
2.2.1. Apodemus sylvaticus 23
2.2.2. Apodemus flavicollis 28
2.2.3. Myodes glareolus 33
2.3. La specie arboricola: Muscardinus avellanarius 38
3. Materiali e Metodi 45
3.1. Area di studio 45
3.1.1. La Regione Lazio 45
3.1.2. La Riserva Naturale “Selva del Lamone” 53
3.1.3. La Tuscia Viterbese 57
3.1.4. L’area Sabina 59
3.2. I micromammiferi come specie modello 63
3.3. Disegno sperimentale: specie terricole 64
3.3.1. Selezione dei frammenti 64
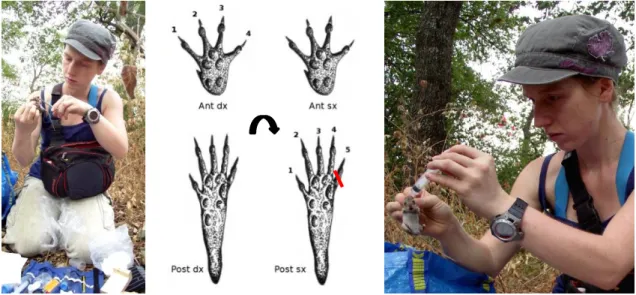
3.3.2. Raccolta dati: dati individuali 67
3.3.3. Esemplari deceduti 72
3.3.4. Analisi genetiche 75
3.3.5. Raccolta dati: dati ambientali e microambientali 76
3.4. Disegno sperimentale: Muscardinus avellanarius 79
3.4.1. Selezione dei frammenti 79
3.4.2. Raccolta dati: dati individuali 82
3.4.3. Esemplari deceduti e analisi genetiche 85
3.4.4. Raccolta dati: dati ambientali e microambientali 86 3.5. Variabili individuali, analisi statistiche e variabili ambientali 87
3.5.1. Calcolo delle variabili individuali 87
6
4. Risultati 91
4.1. Ripartizione delle catture 91
4.2. Peso medio 92
4.3. Fertilità media 97
4.4. Probabilità di sopravvivenza 100
5. Discussione 113
5.1. Interpretazione dei risultati 113
5.1.1. Peso medio: considerazioni interpretative e metodologiche 113 5.1.2. Fertilità media: considerazioni interpretative e metodologiche 118 5.1.3. Probabilità di sopravvivenza e di ricattura:
considerazioni interpretative e metodologiche 121
5.2. Scelta delle variabili ambientali e tecniche di campionamento 124
5.3. Conclusioni e sviluppi futuri 126
6. Bibliografia 132
7. Appendici 146
8
1.Introduzione
1.1. Perdita, frammentazione e degrado dell’habitat
La ricerca scientifica degli ultimi due decenni ha messo in evidenza come l’insieme dei fenomeni generalmente inclusi nel termine “frammentazione dell’habitat” sia una delle principali minacce a livello globale per la conservazione della biodiversità (Lindenmayer & Fischer, 2006). Proprio l’intensa attività ricerca svolta in questo ambito, tuttavia, ha portato a includere nel termine “frammentazione dell’habitat” una serie di processi diversi, con impatti differenti e che richiedono diverse strategie di contrasto; ciò ha creato una confusione teorica e applicativa che ha sostanzialmente rallentato e inficiato i progressi delle strategie di conservazione (Lindenmayer & Fischer, 2007). Recentemente tuttavia si è preso coscienza del problema, andando a riconoscere e a suddividere tre principali fenomeni:
- Perdita di habitat;
- Frammentazione di habitat per se; - Degrado della qualità dell’habitat.
Complessivamente, questi tre fenomeni determinano “la trasformazione, nel corso del tempo, di un’ampia superficie di habitat continuo in un certo numero di frammenti di habitat di dimensioni minori e di minor area totale, reciprocamente isolati da una matrice differente dall’habitat originale” (Wilcove et al., 1986, Fig. 1.1).
Fig 1.1: Il processo di “frammentazione dell’habitat” sensu lato in cui si assiste a “la trasformazione, nel corso
del tempo, di un’ampia superficie di habitat continuo in un certo numero di frammenti di habitat di dimensioni minori e di minor area totale, reciprocamente isolati da una matrice differente dall’habitat originale” (Wilcove
9 Perdita, frammentazione e degrado dell’ habitat sono attualmente riconosciute come tre delle principali cause di declino della biodiversità a livello mondiale; in particolare, esse costituiscono la principale minaccia per i Mammiferi sia in Europa che nel resto del mondo (Mortelliti et al., 2010b).
La principale causa di perdita di habitat a livello globale è l’agricoltura, sia di sussistenza che, soprattutto, intensiva. Solitamente questo processo porta alla creazione di paesaggi agricoli costituiti da un mosaico di particelle destinate ad usi diversi. Tipicamente in tali mosaici si alternano porzioni di territorio destinate ad usi agro-pastorali (coltivazioni, orti e pascoli) con insediamenti umani (fattorie e masserie), infrastrutture (strade e ferrovie) e frammenti di ambiente naturale o semi-naturale nella forma di piccoli boschi, alberi isolati nei pascoli, vegetazione nativa usata per il pascolo e siepi o filari di vegetazione lungo le strade e i corsi d’acqua (Bennett, 2006). In particolare nell’Europa occidentale una frazione sostanziale del biota dipende per il proprio sostentamento da habitat derivanti dalle pratiche agricole sviluppate nel corso dei secoli (Sutherland, 2004). Il fatto che la distruzione di habitat avvenga principalmente per convertire terreni all’uso agricolo ha un’altra importante conseguenza: le aree che spontaneamente vengono lasciate intatte sono di norma quelle inadatte all’agricoltura, ovvero quelle con eccessiva pendenza, o situate a quote elevate, oppure con esposizione sfavorevole o poco fertili. Questo fa sì che in un paesaggio agricolo i frammenti di bosco residui spesso non siano omogeneamente distribuiti ma siano concentrati nelle aree meno favorevoli e di minor qualità (Robinson & Traill, 1996; Lindenmayer & Fischer, 2006). I paesaggi agricoli a mosaico sono ambienti dinamici, che possono essere in grado di sostenere numerose specie di flora e fauna native, ma che rischiano anche di andare incontro a un deterioramento progressivo tale da renderli alla fine inadatti alla persistenza delle medesime specie e incapaci di mantenere i normali processi ecologici. Questo deterioramento riguarda in
primis l’incremento della distruzione della vegetazione nativa, la semplificazione e il degrado
degli habitat, l’uso crescente di pesticidi e fertilizzanti e l’espansione degli insediamenti umani e delle infrastrutture per il trasporto (Chamberlain et al.,2000; Ford et al., 2001; Burel et al., 2004; Schroth et al., 2004).
Questi paesaggi sono intrinsecamente eterogenei e dalla loro struttura a mosaico derivano tre principali proprietà emergenti del paesaggio, ovvero l’estensione complessiva dell’habitat, la composizione del mosaico e la configurazione spaziale degli elementi (Bennett, 2006). Tali proprietà influenzano in diversi modi e a livelli diversi sia le singole specie che la biodiversità complessiva del paesaggio; ad esempio l’estensione complessiva di habitat influenza fortemente la presenza delle singole specie o la ricchezza degli assembramenti faunistici
10 dipendenti da un certo tipo di habitat, mentre l’eterogeneità del mosaico favorisce la ricchezza specifica. Viceversa, la configurazione spaziale degli elementi (riconducibile alla frammentazione per se) sembra esercitare un minor impatto sulle specie (Bennett, 2006). A seconda del livello di perdita e frammentazione dell’habitat, il paesaggio modificato può essere classificato come variegato, frammentato o residuale (Fig. 1.2). In un paesaggio variegato permane il 60-90% dell’habitat originario (partendo da una condizione di paesaggio “intatto” in cui si suppone che l’intero paesaggio costituisca habitat per la specie considerata); in un paesaggio frammentato tale percentuale scende al 10-60%, mentre in un paesaggio residuale si conserva meno del 10% dell’habitat originario (Fischer & Lindenmayer, 2007).
Per quanto riguarda il primo dei fenomeni annoverati sotto il termine “frammentazione dell’habitat”, la perdita di habitat è definita come la rimozione dell’habitat disponibile per una determinata specie (Fischer & Lindenmayer, 2007), a prescindere dalla configurazione assunta dall’habitat residuo; questo fenomeno ha sempre un impatto negativo sulla specie in questione, comportando alterazioni:
nell’abbondanza e nella distribuzione delle popolazioni; nel loro tasso di crescita;
Fig 1.2: Modello concettuale del processo di modificazione di un paesaggio, visto come progressione da un
paesaggio “intatto” (con oltre il 90% di habitat conservato) a un paesaggio residuale, altamente modificato (con meno del 10% di habitat conservato). Adattato da Fischer & Lindenmayer, 2007.
11 nella diversità genetica, con rischi di inbreeding e depauperamento genetico;
nel successo riproduttivo, di dispersione e di foraggiamento; nella sopravvivenza delle specie specialiste o di grandi dimensioni; nella complessità delle reti trofiche (Fahrig, 2003).
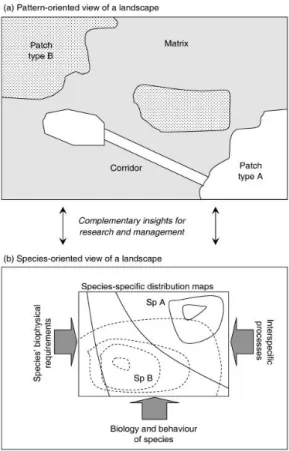
È opportuno ricordare, a tale proposito, che l’habitat è definito come lo spettro di ambienti e risorse sfruttabili da una determinata specie (Fischer & Lindenmayer, 2007); costituisce dunque un’entità altamente specie-specifica, situata in un continuum di condizioni che vanno dall’ottimale all’inidonea e con molte sfumature intermedie, piuttosto che un dualismo habitat-matrice come proposto dall’interpretazione tradizionale della teoria della biogeografia delle isole di Macarthur e Wilson (Lindenmayer & Fischer, 2006, Fig. 1.3). Tale interpretazione dualistica, ovvero il modello frammento-matrice, riveste tuttavia un’utilità pratica considerevole nel determinare una schematizzazione funzionale del paesaggio; tale schematizzazione deve però tenere in considerazione il fatto che la matrice può risultare più o meno permeabile a seconda delle specie, o anche essere fonte occasionale di risorse trofiche.
Fig 1.3: a. visione schematica tradizionale di un paesaggio con classificazione funzionale dei suoi vari elementi
(frammento di habitat di tipo A, frammento di habitat di tipo B; matrice; corridoio), in base alla percezione umana del paesaggio;
b. visione di un paesaggio nell’ottica di due specie (Specie A e Specie B): la biologia e il comportamento, i
requisiti biofisici delle specie e i processi di interazione interspecifica definiscono zone di habitat ottimale o variamente subottimale, che determinano la distribuzione delle specie. Adattato da Fischer & Lindenmayer,
12 A tale proposito, è importante ricordare che dato che l’habitat è un’entità specie-specifica, anche la perdita di habitat è altrettanto specie-specifica; in particolare, la perdita di vegetazione nativa non è necessariamente sinonimo di perdita di habitat, in quanto molte specie possono sopravvivere agevolmente in ambienti modificati dall’uomo (Lindenmayer & Fischer, 2007).
La frammentazione di habitat per se (o suddivisione dell’habitat) è definita come la suddivisione di un habitat continuo in un numero maggiore di frammenti di habitat, separati da aree subottimali o di matrice (Fahrig, 2003). È un processo concettualmente distinto dalla perdita di habitat: la frammentazione per se determina infatti la conformazione spaziale dell’habitat disponibile in un paesaggio, supposto che l’ammontare totale di habitat resti costante; ovvero, definisce come una certa quantità di habitat disponibile sia dislocato in un paesaggio, in un certo numero di frammenti di diverse dimensioni e forma o viceversa costituendo un’area continua (Fig. 1.4).
Questo processo sembra avere un impatto decisamente più limitato sulle specie e tale impatto, qualora presente, può anche essere positivo (soprattutto nel caso in cui si considerino specie generaliste). In particolare, è stato ipotizzato che gli effetti della frammentazione per se possano divenire evidenti solo in paesaggi con un basso livello di habitat residuo (inferiore al 20-30%) (Fahrig, 2003).
Gli effetti negativi della suddivisione dell’habitat sono legati sostanzialmente:
alla creazione, in un dato paesaggio, di un maggior numero di frammenti di dimensioni minori. Al limite, ciascun frammento diviene troppo piccolo per sostenere una popolazione locale, e le specie incapaci di attraversare le zone di non-habitat si ritrovano confinate in un numero elevato di frammenti inadatti alla loro sopravvivenza. Ciò riduce la dimensione complessiva della popolazione nel paesaggio e la sua probabilità di persistenza (Fahrig, 2003);
all’effetto-margine. In un paesaggio maggiormente frammentato si ha una maggior proporzione di aree marginali rispetto all’ammontare complessivo dell’habitat. Ciò amplifica l’impatto negativo dell’effetto-margine e aumenta la probabilità che gli esemplari abbandonino l’habitat per entrare nella matrice; questo implica un possibile aumento del tasso complessivo di mortalità (specialmente legata alla predazione) e una diminuzione complessiva del tasso di riproduzione della popolazione (Fahrig, 2003).
13 Qualora presenti, i possibili effetti positivi della suddivisione dell’habitat sono legati:
alla diminuzione dell’isolamento dei patch, in quanto se l’ammontare complessivo di habitat resta costante la presenza di un maggior numero di frammenti per paesaggio implica una diminuzione della distanza media tra i frammenti. Ciò può favorire la dispersione tra i frammenti;
alla disponibilità di tipi diversi di habitat (eterogeneità ambientale) necessari durante le varie fasi del ciclo vitale;
ad alcuni benefici legati alla presenza di aree di margine per le specie generaliste e opportuniste (Fahrig, 2003).
È opportuno sottolineare che nei paesaggi reali i processi di perdita e frammentazione dell’habitat sono di norma fortemente collegati e spesso avvengono in contemporanea e con effetti cumulativi; è tuttavia fondamentale distinguerli a livello teorico perché richiedono misure di conservazione differenti (Mortelliti et al., 2010b). Infatti, se per una determinata specie la minaccia maggiore deriva dalla perdita di habitat, la strategia gestionale più efficace è l’aumento delle dimensioni individuali dei frammenti (ripristino dell’habitat) (Mortelliti et al., 2010b); se invece la minaccia maggiore deriva dalla suddivisione dell’habitat, che per le specie incapaci di attraversare la matrice implica l’isolamento delle popolazioni nei singoli frammenti, la strategia migliore è aumentare la connettività tramite collegamenti inter-patch o stepping
stones (Lindenmayer & Fisher, 2007).
Fig 1.4: Esempio di processi di perdita di habitat vs suddivisione di habitat. In entrambi i casi, il processo di
modificazione del paesaggio porta alla formazione di un maggior numero di frammenti di minori dimensioni; tuttavia, nel caso della suddivisione di habitat (supponendo che l’ammontare complessivo di habitat resti
14 Il degrado dell’habitat è un fenomeno complesso e altamente specie-specifico. Esso implica la riduzione della qualità di un’area, per una data specie (Lindenmayer & Fischer, 2007), laddove per “qualità” si intende la capacità dell’ambiente di fornire condizioni appropriate per la sopravvivenza degli individui e la persistenza della popolazione (Hall et al., 1997). In particolare, esso può riguardare la scomparsa di risorse strutturali fondamentali (le cosiddette “keystone structures”), ovvero elementi del paesaggio che alterano in maniera significativa l’ambiente, aumentandone la complessità strutturale (Tews et al., 2004; Manning et al., 2006). Un esempio di tali risorse sono gli alberi isolati in savana, che alterano l’ambiente abiotico e costituiscono un habitat idoneo per molte altre specie vegetali e animali (Vetaas, 1992; Dean et al., 1999; Manning et al., 2006). La perdita di tali elementi strutturali può avere conseguenze particolarmente negative sulle specie native e facilitare l’insorgere di processi di estinzione a cascata (Fisher & Lindenmayer, 2007).
Il deterioramento dell’habitat può avvenire a livello di frammento o a livello di paesaggio; in particolare, una variazione della qualità locale dell’habitat è un fattore importante nella dinamica della popolazione e un aumento della qualità dell’habitat a entrambi i livelli (di frammento e di paesaggio) aumenta la probabilità di occupazione e di colonizzazione dei frammenti e riduce il rischio di estinzione (Frey et al., 2012).
I tre processi – perdita, frammentazione e degrado dell’habitat – tendono a verificarsi contemporaneamente nei paesaggi modificati; il degrado dell’habitat può essere facilitato, accelerato o iniziato dai processi di perdita e/o frammentazione (Tabarelli & Gascon, 2005), ma può anche avvenire facilmente in modo indipendente in paesaggi continui. In un habitat degradato una specie può subire un declino, diminuire la propria consistenza numerica o essere incapace di riprodursi, con una conseguente perdita di fitness. In un paesaggio frammentato, il deterioramento dell’habitat può portare alla formazione di un mosaico di frammenti con un diverso livello di idoneità per la specie; tuttavia, un pattern analogo può realizzarsi anche per l’impatto della perdita e/o frammentazione di habitat su un paesaggio naturalmente eterogeneo (Mortelliti et al., 2010a).
Inoltre, gli effetti di perdita, frammentazione e degrado dell’habitat forestale sembrano dipendere cospicuamente dal livello di specializzazione delle specie considerate; ad esempio tra i micromammiferi le arvicole del genere Myodes mostrano risposte quasi opposte a quelle delle specie generaliste del genere Apodemus, o topi selvatici (Dìaz et al., 1999).
È opportuno sottolineare infine che il declino di una specie spesso risulta dall’interazione di molteplici fattori; in particolar modo, ai fattori di minaccia deterministici (tra cui i principali
15 sono perdita, frammentazione e degrado dell’habitat) si possono andare a sommare numerosi fattori stocastici (ad esempio catastrofi naturali o epidemie). Inoltre, l’effetto delle minacce esogene può essere amplificato da criticità endogene della popolazione (come la stocasticità demografica e genetica), portando la popolazione all’interno di una spirale di estinzione (Fischer & Lindenmayer, 2007, Fig. 1.5).
1.2. Qualità dell’habitat e conseguenze a livello individuale: stato dell’arte
Comprendere in modo dettagliato il ruolo effettivo giocato dalla qualità dell’habitat nel determinare la persistenza di una specie è di notevole importanza. Dal punto di vista della biologia della conservazione, trascurare l’importanza della qualità dell’habitat può rendere inefficaci le strategie di conservazione applicate in un paesaggio frammentato: se una specie è minacciata dal deterioramento dell’habitat, la strategia più efficace è una gestione corretta dell’habitat, che includa processi di identificazione e di ripristino delle risorse essenziali (Mortelliti et al., 2010a). Ad esempio si è rilevato che aumentare la superficie coperta da un
Fig 1.5: Schema delle minacce sperimentate da una specie in declino come conseguenza della modificazione di
un paesaggio; si evidenziano le interazioni tra processi deterministici – esogeni (non legati alle caratteristiche biologiche della specie considerata), processi deterministici – endogeni (dipendenti dalle caratteristiche biologiche intrinseche della specie considerata), stocastici – esogeni e stocastici – endogeni nel determinare il
declino e l’estinzione di una popolazione.
Le minacce di tipo deterministico portano in modo prevedibile al declino, mentre le minacce di tipo stocastico sono legate a eventi casuali.
16 certo tipo di vegetazione (o prevenirne la distruzione) è la strategia con la miglior probabilità di successo per migliorare la condizione di una specie, o di un gruppo di specie, per le quali tale vegetazione sia l’habitat preferito. In alternativa, qualora l’obiettivo sia aumentare la ricchezza specifica di un paesaggio a mosaico, la strategia migliore sembra essere aumentare l’eterogeneità ambientale del mosaico (Bennett, 2006). Tuttavia sino a tempi recenti la maggior parte delle attuali strategie di conservazione nei paesaggi frammentati in Europa è stata indirizzata all’implementazione della connettività strutturale e focalizzata sulla struttura spaziale dei paesaggi, piuttosto che sulla qualità degli habitat (Mortelliti et al., 2010a).
La qualità dell’habitat per una data specie è determinata prevalentemente dall’abbondanza e dalla varietà delle risorse trofiche disponibili, dalla presenza di rifugi e di eventuali keystone
resources. Questi elementi possono avere un impatto a livello dell’individuo, della popolazione
o a entrambi i livelli.
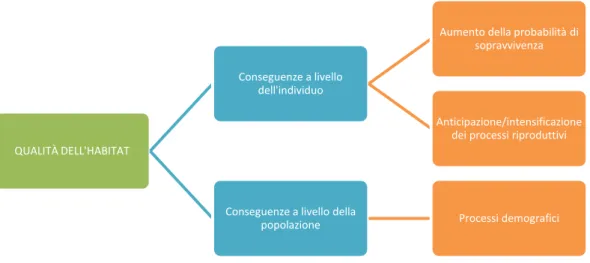
A livello dell’individuo, è stato ipotizzato che un habitat di miglior qualità possa avere un impatto prevalentemente sulle probabilità di sopravvivenza o sullo sforzo riproduttivo (Zanette et al., 2000a; Zanette, 2000b; Dìaz et al., 2003, Fig. 1.6). In particolare una maggiore disponibilità trofica può aumentare le probabilità di sopravvivenza in quanto:
può permettere l’accumulo di maggiori riserve energetiche, implementando la condizione corporea individuale;
può permettere all’individuo di ridurre i propri movimenti, riducendo così le interazioni agonistiche intraspecifiche e interspecifiche (Desy et al., 1990), il rischio di predazione e le possibilità di infezioni e infestazioni (Krasnov et al., 2002).
Fig 1.6: Schema riassuntivo dei principali livelli in cui si può esplicare l’impatto della qualità dell’habitat sulle
specie.
QUALITÀ DELL'HABITAT
Conseguenze a livello dell'individuo
Aumento della probabilità di sopravvivenza
Anticipazione/intensificazione dei processi riproduttivi
Conseguenze a livello della
17 Per quanto riguarda il primo punto, è stato dimostrato che una miglior condizione corporea individuale (o stato di salute) riduce il rischio di morte per inedia (Blem, 1990), aumenta le capacità competitive nei confronti dei conspecifici (Lin & Batzli, 2001) e delle altre specie (Banks & Dickman, 2000) e migliora la resistenza del sistema immunitario rispetto a patogeni e parassiti (Appleby et al., 1999). A tal proposito, è stato rilevato in una popolazione di Rattus
fuscipes nel sud-est dell’Australia che le femmine adulte tendevano ad avere un peso maggiore
(identificato con una miglior condizione corporea) nei frammenti con miglior qualità dell’habitat (Holland & Bennett, 2010).
Risultati analoghi sono stati ottenuti in altri Ordini di Mammiferi e non. Ad esempio nel caso del capriolo (Capreolus capreolus) la massa corporea dei maschi adulti è risultata influenzata dalla ricchezza trofica dell’habitat (Pettorelli et al., 2002); negli Uccelli migratori (in particolare nella pittima reale, Limosa limosa islandica) è stato dimostrato che gli esemplari capaci di occupare i siti di riproduzione con habitat di miglior qualità riuscivano a occupare anche i migliori siti di svernamento, con importanti conseguenze sulla fitness individuale (Gunnarsson et al., 2005); mentre nei Pesci Pleuronectiformi la disponibilità trofica è risultata essere il primo fattore influenzante la crescita e il tasso di sopravvivenza degli stadi giovanili (Gibson, 1994).
Per quanto riguarda l’influenza sulla riproduzione, una maggior disponibilità trofica può permettere a un numero maggiore di individui di estendere la durata del periodo riproduttivo, (Banks & Dickman, 2000; Eccard & Ylönen, 2001) o permettere alle femmine di effettuare un maggior investimento per singolo evento riproduttivo, aumentando il numero di piccoli per cucciolata (Kreiter & Wise, 2001). Viceversa, una disponibilità trofica limitata può limitare il successo riproduttivo fino a originare una “soglia demografica” al di sotto della quale sia la riproduzione delle femmine che la probabilità di sopravvivenza degli individui divengono insufficienti a permettere la persistenza della popolazione nei frammenti (Zanette et al., 2000a; Zanette, 2000b). Recentemente negli Sciuridi (Tamiasciurus hudsonicus e Sciurus
vulgaris) è stata inoltre dimostrata la capacità di prevedere in base a segnali climatici l’arrivo di
annate di eccezionale produttività di semi nelle piante arboree (le cosiddette annate di “pasciona”) e di regolare di conseguenza lo sforzo riproduttivo; ovvero, tali specie aumentavano il numero di piccoli per cucciolata, la proporzione di giovani già riproduttivi ed eventualmente il numero di cucciolate nella stagione immediatamente precedente la pasciona. Questo permetteva alle popolazioni di raggiungere la massima densità nel momento di massima disponibilità trofica e non successivamente ad esso (Boutin et al., 2006).
18 Dato il breve ciclo vitale dei piccoli roditori, è lecito supporre che in caso di maggior disponibilità trofica le risorse “in eccesso” siano destinate prevalentemente a intensificare la riproduzione; poiché i costi diretti della riproduzione sono maggiori per le femmine che per i maschi, le femmine adulte dovrebbero risultare più influenzate dalla qualità dell’habitat (Dìaz et al., 2003).
A livello di popolazione, la qualità dell’habitat diventa più significativa nei frammenti di piccole dimensioni: è stato dimostrato che un’alta qualità dell’habitat per i roditori influenza maggiormente le performances della popolazione nei frammenti piccoli piuttosto che in quelli di grandi dimensioni, nei quali sembra avere un impatto marginale (Holland & Bennett, 2010). La qualità dell’habitat inoltre è risultata significativa nel determinare i pattern di occupazione di molti Mammiferi, tra cui Carnivori (Mortelliti & Boitani, 2008), Primati (Arroyo-Rodriguez et al., 2007) e micromammiferi (Holland & Bennett, 2007), ma anche di Uccelli (Lloyd, 2008), Insetti (Fleishman et al., 2002; Heisswolf et al., 2009) e specie vegetali (Adriaens et al., 2009). In particolare sono già stati rilevati effetti della qualità dell’habitat nel determinare i parametri di estinzione e di colonizzazione (Fleishman et al., 2002; Franken & Hik, 2004), nella persistenza a lungo termine della popolazione (Root, 1998), e sulla ricchezza specifica del paesaggio (Pöyry et al., 2009). Nello specifico, nei Roditori la disponibilità trofica, in particolare di risorse accumulabili come le ghiande di Quercus spp., è risultata influenzare la densità estiva e invernale, il tasso di crescita invernale della popolazione (Pucek et al., 1993; Stenseth et al., 2002) e le variazioni nell’abbondanza di alcune specie (Batzli & Lesieutre, 1991). Nel moscardino la disponibilità trofica influenza indirettamente la mortalità invernale durante l’ibernazione, in quanto tale mortalità risulta dipendere anche dall’accumulo di sufficienti scorte di tessuto adiposo (Bright & Morris, 1996), a sua volta legato alla disponibilità trofica nel periodo autunnale (Juskaitis, 2008). Nei roditori terricoli l’abbondanza di cibo può influenzare positivamente l’entità e la durata dello sforzo riproduttivo in ambo i sessi e le capacità immunitarie di difesa contro gli endoparassiti, nonché la condizione corporea nei maschi (Dìaz & Alonso, 2003); inoltre la qualità dell’habitat è risultata significativa nella determinazione dell’abbondanza e della probabilità di estinzione dell’arvicola rossastra in un paesaggio agricolo frammentato (Van Apeldoorn et al., 1992).
Oltre alla disponibilità trofica, anche la struttura della vegetazione può avere un impatto diretto sui micromammiferi: nel moscardino è documentato che essa influenza la scelta dei siti di nidificazione (Panchetti et al., 2007) e l’abbondanza degli esemplari (Juskaitis, 2008); nelle specie terricole la copertura arbustiva risulta influente sulla densità invernale (Dìaz et al., 1993); nei roditori deserticoli la ricchezza specifica è legata alla copertura vegetazionale
19 (Eccard et al., 2000); nelle specie native di roditori australiani la disponibilità trofica e la struttura vegetazionale, fortemente dipendenti dalle precipitazioni annuali, risultano essere tra i principali fattori determinanti le dinamiche di popolazione nei singoli siti (Breed & Ford, 2007).
1.3. Criticità nella ricerca
Come anticipato nei precedenti paragrafi, il lavoro di ricerca svolto sui temi di perdita, frammentazione e degrado della qualità dell’habitat è estremamente ampio e variegato e coinvolge un numero cospicuo di specie di classi diverse, di Vertebrati e non.
É opportuno tuttavia sottolineare che la maggior parte degli studi sui paesaggi a mosaico non considera la demografia delle specie oggetto di studio, bensì misura parametri relativi, frequentemente, alla ricchezza specifica, all’abbondanza o alla presenza/assenza delle specie (Bennett, 2006). Tali parametri sono soggetti ad una serie di criticità: in primis, la cattura di uno o pochi esemplari può non implicare la presenza effettiva di una popolazione, stabile o effimera, nel frammento, in quanto può essere dovuta alla presenza occasionale di individui di passaggio o in dispersione (Mortelliti et al., 2009a). Inoltre la mera presenza di una specie non implica necessariamente che la popolazione sia vitale, in grado di permanere sul lungo periodo e che siano mantenute la variabilità genetica e le normali dinamiche spaziali. Tali temi – la vitalità della popolazione, il rischio di estinzione e le dinamiche spaziali – possono essere affrontati in modo più corretto solo tramite uno studio demografico della popolazione, che permetta di stimare tramite la raccolta di dati sul lungo periodo i principali parametri demografici della popolazione; in particolare, è necessario poter stimare le dimensioni della popolazione (abbondanza complessiva e densità minima/massima), il trend (incremento/stabilità/diminuzione una volta controllate le fluttuazioni stocastiche) e la struttura (classi di età, sex ratio) (Mortelliti et al., 2012). Gli studi demografici sono tuttavia più complessi e più dispendiosi di altre forme di studio misurativo, perché richiedono in genere uno sforzo di campionamento più duraturo e prolungato, e sono dunque solitamente meno praticati; tuttavia nei paesaggi reali un esperimento misurativo progettato con attenzione e di sufficiente durata può permettere di rilevare gli effettivi impatti a lungo termine dei processi di perdita, frammentazione e degrado dell’habitat sulla sopravvivenza delle popolazioni (Mortelliti et al., 2010b).
È opportuno sottolineare infine che la maggioranza degli studi, demografici e non, verte direttamente sui parametri relativi solo allo stato della popolazione; nella maggior parte dei
20 casi non sono considerate le condizioni individuali degli esemplari. Ciò rappresenta tuttavia una carenza nell’ambito della ricerca, in quanto la condizione corporea individuale costituisce il primo livello su cui si esplicano gli effetti di perdita, frammentazione e degrado dell’habitat; tali effetti a livello individuale possono mediare in vari modi l’impatto della trasformazione dell’habitat a livello di popolazione, ed è necessario rilevarli per comprendere nel dettaglio come l’impatto di perdita, frammentazione e degrado di habitat si trasmetta e si amplifichi, o viceversa possa essere mitigato, passando dall’individuo alla popolazione (Dooley & Bowers, 1998; Dìaz et al., 1999). In particolare, in un paesaggio a mosaico gli effetti legati alla trasformazione dell’habitat possono risultare visibili sulla piccola (individuale) e grande (a livello di paesaggio) scala, ma essere oscurati al livello intermedio del singolo frammento (Bowers & Dooley, 1999); questa considerazione impone notevole cautela sia nella progettazione degli studi di campo che nell’interpretazione dei risultati ottenuti. Un ulteriore fattore di criticità è rappresentato dal fatto che in molti casi l’interazione tra le conseguenze a livello individuale e le conseguenze a livello di popolazione dei fenomeni legati alla trasformazione dell’habitat è ancora in buona parte da chiarire. Ciò dipende dal fatto che la maggior parte degli studi sinora svolti si è focalizzata sull’identificazione dei parametri descrittivi dello stato di perdita, frammentazione o degrado dell’habitat che potessero essere utilizzati come predittori dello stato della popolazione; tuttavia spesso non sono stati adeguatamente considerati i meccanismi “di base” con cui tali parametri agiscono a livello del singolo esemplare, e il modo in cui tali conseguenze individuali si ripercuotono sulla popolazione. Ad esempio è noto che la qualità dell’habitat può influire sulla performance individuale e indirettamente sulla dimensione della popolazione, ma non è chiaro in quale misura rispetto ad altri fattori genetici e demografici (Vergeer et al., 2003); similmente, è stato rilevato che la qualità dell’habitat può influire sull’abbondanza degli esemplari e sulla densità delle popolazioni, ma i meccanismi sottostanti tali effetti sono solo ipotizzati (Orvossy et al., 2012). Per quanto riguarda invece la perdita e la frammentazione di habitat, l’impatto di molti parametri è stato identificato –ad esempio la dimensione del frammento è risultata significativa nell’influenzare l’abbondanza degli esemplari (Tellerìa et al., 1991; Dìaz et al., 1999), ma anche il tasso di reclutamento degli adulti (Dooley & Bowers, 1999) e le probabilità di presenza (Mortelliti et al., 2011)– ma il modo in cui tale effetto si esplichi a partire dall’impatto sui singoli individui necessita di essere approfondito.
É quindi necessario approfondire l’impatto dei fenomeni di perdita, frammentazione e degrado dell’habitat al livello individuale, ma anche identificare i meccanismi con cui tale impatto possa essere amplificato o mitigato passando al livello di popolazione e di frammento o paesaggio.
21
1.4. Scopo dello studio e obiettivi della tesi
Questa tesi si inserisce nell’ambito di un progetto di ricerca pluriennale dell’Università degli Studi di Roma “La Sapienza”, volto a indagare gli effetti della perdita, della frammentazione e del degrado di habitat su quattro specie di micromammiferi forestali. Tale progetto di ricerca si è svolto in collaborazione tra l’ Università degli Studi di Roma “La Sapienza”, l’ Università degli Studi di Milano “Bicocca”, l’Università degli Studi della Tuscia e la Riserva Naturale “Selva del Lamone”. L’area di studio era localizzata in Italia Centrale, nella Regione Lazio, nelle province di Viterbo e di Rieti. La raccolta dati è stata focalizzata sui parametri demografici della popolazione e sulle variabili ambientali e microambientali dell’area di studio.
La presente tesi verte sull’analisi della risposta individuale al “deterioramento” (sensu lato) dell’habitat, focalizzandosi sull’influenza della qualità dell’habitat sullo stato di salute dei singoli esemplari e ipotizzando le possibili ripercussioni a livello di popolazione. L’obiettivo della tesi è infatti di evidenziare, qualora presenti, le relazioni tra parametri di qualità dell’habitat e conseguenze a livello individuale, esaminando i parametri relativi a condizione corporea, fertilità e probabilità di sopravvivenza individuale di specie diverse, a diverso livello di specializzazione, in un paesaggio frammentato.
In particolare, si ipotizza che:
una maggior disponibilità trofica permetta il mantenimento di una condizione corporea migliore ai singoli esemplari, e ciò si traduca in un aumentato tasso di sopravvivenza (per ambo i sessi) e di fertilità (per le femmine) (Bowers & Dooley, 1999; Dìaz et al., 1999; Dìaz & Alonso, 2003);
nel caso in cui la maggior disponibilità trofica riguardi risorse accumulabili per l’inverno (es. ghiande di Quercus spp.), la miglior condizione corporea conseguibile influenzi prevalentemente il tasso di sopravvivenza dei singoli esemplari, mentre nel caso in cui riguardi risorse disponibili durante il periodo riproduttivo (es. frutti di arbusti) l’effetto maggiore si abbia sulla fertilità (Dìaz et al. 1999; Stenseth et al., 2002);
la presenza di un habitat più strutturato e complesso, con una diversità specifica elevata, influenzi positivamente sia il tasso di sopravvivenza che la fertilità (per la maggior disponibilità di rifugi e poiché garantisce un approvvigionamento alimentare più stabile nelle diverse stagioni, attenuando eventuali crolli di condizione corporea) (Bright et al., 2006; Juskaitis, 2008; Mortelliti et al., 2012).
22
2.Biologia delle specie
2.1. Introduzione all’Ordine Rodentia
Le specie oggetto di studio sono state selezionate tra i micromammiferi nell’ambito dell’Ordine
Rodentia, cui afferisce ben il 42% delle circa 5400 specie di Mammiferi attualmente viventi.
L’Ordine Rodentia si caratterizza per un’elevata plasticità ecologica; ciò ha portato le specie ad esso afferenti a colonizzare la gran parte delle terre emerse, spesso grazie anche all’involontaria azione di trasporto operata dall’uomo, e ad occupare una grande varietà di nicchie ecologiche (Capizzi & Santini, 2007).
Molte specie presentano adattamenti morfologici spinti, ma il carattere distintivo dell’Ordine è la peculiare dentatura, con la presenza di due paia di incisivi a crescita continua e di un diastema maxillo-mandibolare tra incisivi e molari. Le dimensioni corporee sono estremamente variabili, da pochi grammi (Micromys minutus) a decine di chilogrammi (Hydrochaeris hydrochaeris), così come le strategie riproduttive (monogamia, poligamia e promiscuità; specie-r, specie-k e intermedie), il ciclo vitale (da pochi mesi nei Muridi a 10-15 anni negli Istricomorfi), le abitudini comportamentali e la struttura sociale. Le capacità sensoriali sono in genere abbastanza sviluppate, con prevalenza di odorato e tatto a discapito di una vista generalmente mediocre. L’alimentazione è fondamentalmente vegetariana, con preferenza per la foglivoria o la granivoria nelle diverse specie e diverso livello di consumo degli alimenti di origine animale (Invertebrati, uova e nidiacei, piccoli mammiferi) (Capizzi & Santini, 2007).
Trattandosi di un Ordine vasto e articolato, presenta una sistematica complessa e in via di ridefinizione. La teoria attualmente più supportata (Carleton & Mussler, 2005) conferma la monofilia dei Roditori e ne prevede la suddivisione in cinque sottordini:
Sciuromorpha Castorimorpha Myomorpha Anomaluromorpha Hystricomorpha
La maggior parte delle specie è compresa nel sottordine dei Miomorfi (1569 specie, tra cui topi, ratti e arvicole), mentre al sottordine degli Anomaluromorfi afferiscono solo 9 specie africane.
23 Le quattro specie attivamente campionate (Apodemus sylvaticus, Apodemus flavicollis, Myodes
glareolus e Muscardinus avellanarius) appartengono ai due sottordini di Miomorfi e
Sciuromorfi.
Tali specie sono state selezionate in base a:
ciclo vitale sostanzialmente breve, con un rapido ricambio generazionale; densità di popolazione complessivamente elevata e buona contattabilità; diversa attitudine alla vita terricola o arboricola;
diversi livelli di selettività in termini di habitat.
Queste caratteristiche, comuni fra i mammiferi di piccola taglia, rendono tali specie idonee come modelli negli studi sugli effetti della frammentazione dell’habitat (Lambin et al., 2004). Inoltre, per quanto riguarda il moscardino, è nota la sua sensibilità alla perdita e alla frammentazione dell’habitat forestale (Wauters et al. 1994; Rodriguez & Andren 1999; Verbeylen et al., 2003; Koprowski 2005), mentre il topo selvatico a collo giallo è risultato vulnerabile ai processi di frammentazione (Marsh & Harris, 2000; Marsh et al., 2001).
2.2. Le specie terricole
2.2.1. Apodemus sylvaticusIl topo selvatico Apodemus sylvaticus (Linnaeus, 1758) (Fig. 2.1) è un roditore del sottordine Myomorpha, famiglia Muridae, sottofamiglia Murinae, genere
Apodemus, sottogenere Sylvaemus. Il genere
comprende 21 specie, che costituiscono nel complesso la fauna murina dominante della Regione Paleartica (Corbet & Harris, 1991); il topo selvatico conta oltre 30 sottospecie in Europa, di cui sei solo
per l’Italia: A. sylvaticus sylvaticus (Linnaeus, 1758), A. sylvaticus dichrurus (Rafinesque, 1814),
A. sylvaticus milleri (De Beaux, 1925), A. sylvaticus hermani (Felten & Storch, 1970), e A. sylvaticus ilvanus (Kahmann & Niethammer, 1971) (Amori et al., 2009).
Distribuzione:
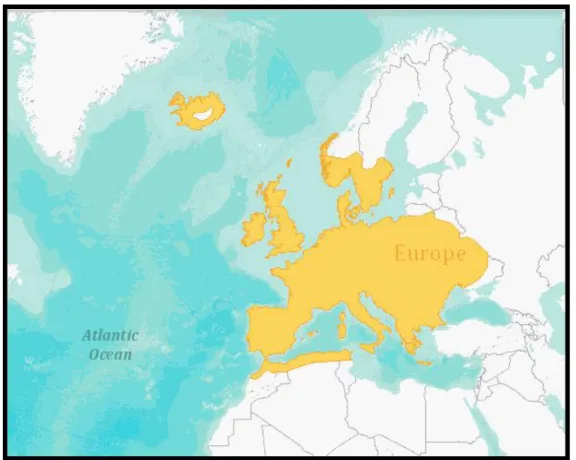
Si tratta di una specie paleartico-occidentale a distribuzione europea con estensione anatolico-magrebina (Amori et al., 2009); il topo selvatico ha infatti un vasto areale, che si estende da nord a sud attraverso l’Europa (con l’eccezione della Finlandia e delle zone settentrionali di
Fig. 2.1: Esemplare di Apodemus sylvaticus,
24 Scandinavia, del Baltico e della Russia) e in alcune aree del Nord Africa (Montgomery, 1999, Wilson & Reeder 2005); da est a ovest, dall’Ucraina e dai confini occidentali della Federazione Russa alla Penisola Iberica. In Africa si ritrova nella Catena Montuosa dell’Atlante e, a nord di essa, lungo tutta la pianura costiera. Popola inoltre la maggior parte delle isole, incluse le Isole Britanniche, l’Islanda e molteplici isole del Mediterraneo (tra cui ad esempio le Isole Egee, la Sardegna e la Corsica, la Sicilia e gli arcipelaghi ad essa afferenti, e l’Arcipelago Toscano in cui si ritrova in particolare la sottospecie A. sylvaticus ilvanus (Amori, 1993; Capizzi & Santini, 2007)). Vive dal livello del mare ai 3300 m di quota nella Catena Montuosa dell’Atlante e fino a quasi 2000 m sulle Alpi Occidentali (Amori et al., 2009). In Italia è diffuso in tutta la penisola, incluse le isole minori (Fig. 2.2).
Proprio in virtù di quest’ampio areale, della sua occorrenza comune e di un trend di popolazione stabile, la specie è classificata come a rischio minimo (classe LC- “Least Concern”) dalla IUCN (2004).
Fig. 2.2: Areale del topo selvatico A. sylvaticus. Tratto da IUCN 2012. The IUCN Red List of Threatened Species.
25 Riconoscimento:
Si tratta di un muride di piccole dimensioni, con la coda in media di poco più corta del corpo: la lunghezza media dall’apice del rostro alla base della coda è compresa, nelle popolazioni peninsulari italiane, tra i 77,2 ± 9,2mm (popolazioni pugliesi) e i 99,1 ± 10,5 mm (popolazioni lucane) ed è, per le popolazioni laziali, di 83,9 ± 7,82mm; la coda raggiunge in media il 96,25% della lunghezza testa-corpo (Amori et al., 2009). Il peso medio degli adulti è generalmente inferiore ai 25 g e si attesta, per le popolazioni laziali, sui 17,2 ± 3,94 g (Amori et al., 2009). Presenta una pelliccia piuttosto mutevole a seconda delle popolazioni, con colorazione variabile dal bruno a un fulvo-grigiastro; le parti inferiori sono biancastre, con una tonalità poco netta, e la linea laterale tra la colorazione del dorso e quella del ventre non è ben demarcata (Fig. 2.3). I giovani presentano una colorazione grigiastra uniforme fino alla muta post-giovanile che avviene tra le cinque e le sette settimane di età. La coda è nuda, presentando solo peli scarsi che non nascondono la pelle, e appare generalmente più scura nella porzione dorsale. Ha occhi grandi e sporgenti, adattati per la visione notturna (Corbet & Harris, 1991), e un acuto senso dell’olfatto. Le zampe e i padiglioni auricolari sono, in proporzione al corpo, più piccoli che nel topo selvatico a collo giallo A. flavicollis; cionondimeno il riconoscimento morfologico delle due specie in natura spesso non è semplice, in quanto soprattutto in Italia i caratteri fenotipici delle due specie tendono a convergere sia per quanto riguarda le dimensioni che la colorazione, rendendo la discriminazione specifica difficile o, in presenza di giovani pre-muta, perfino impossibile. Questo ostacolo non si riscontra in altre parti d’Europa, dove le due specie si distinguono con relativa facilità (Flowerdew, 1991), e ha portato in passato a supporre l’esistenza di fenomeni di ibridazione tra le due specie (Niethammer, 1969). Tale ipotesi è stata in seguito confutata (Jewell & Fullagar, 1964; Engel et al., 1973), ma il dibattito resta acceso.
A
B C
Fig. 2.3: A - Esemplare adulto di topo selvatico con fenotipo caratteristico, durante la manipolazione; B e C - Giovani non determinabili di Apodemus spp. Si notino gli occhi sporgenti tipici del genere.
26 Aspetti ecologici:
È una specie molto adattabile, che denota uno spiccato opportunismo sia nella scelta dell’habitat che nelle abitudini alimentari; l’habitat ottimale è quello forestale, con copertura arborea e arbustiva diffusa e disponibilità trofiche e di rifugio per buona parte dell’anno (Capizzi & Luiselli, 1996), ma il topo selvatico è in grado di vivere agevolmente in un gran numero di altri ambienti quali siepi, aree incolte, parchi, giardini e campi coltivati, soprattutto di cereali. La specie è in grado di tollerare meglio di altre le operazioni di taglio dei boschi, e raggiunge le densità maggiori nelle zone di margine e nei boschetti di piccole dimensioni (Garcia et al., 1998; Diaz et al., 1999). Pur essendo un roditore terricolo, presenta una notevole attitudine ad arrampicarsi ed è sovente attivo nello strato arbustivo fino a 3-4 m d’altezza (Montgomery, 1985).
La dieta è fondamentalmente granivora, con uno spiccato consumo di cibo di origine animale in alcune fasi dell’anno, ma include anche bacche, radici, frutti, parti verdi di piante, corteccia e funghi; l’opportunismo alimentare della specie è tale che essa è in grado di nutrirsi di semi per tutto l’anno, sfruttando quelli che di volta in volta si rendono disponibili, incluse in autunno le ghiande del genere Quercus che costituiscono un ottimo alimento per i roditori (Hansson, 1998). Esistono inoltre differenze alimentari tra adulti e giovani, in quanto i giovani tendono a consumare una minor percentuale di semi rispetto agli adulti (Watts, 1968). In Italia è stato rilevato un prevalente consumo di semi durante tutto l’anno, con massimi nel periodo autunnale in cui costituiscono il 75% della dieta (Canova & Fasola, 1993); questo fatto ha portato a supporre, vista l’entità della depredazione di semi delle piante forestali, che la specie possa influenzare la composizione specifica del bosco (Santos & Tellerìa, 1997). Tuttavia, vista l’abitudine della specie di costituire ingenti scorte dei semi per il periodo invernale, all’interno delle gallerie della tana o in cavità naturali, si suppone che l’effetto della predazione di semi possa essere mitigato dalla germinazione delle scorte non consumate, portando così a una migliore dispersione dei semi e alla rinnovazione di molte essenze forestali (Flowerdew, 1991). È una specie ad attività notturna, monomodale o bimodale nelle notti lunghe, con comportamenti territoriali prevalentemente a carico delle femmine e forme di socialità stagionale legate alle esigenze di sopravvivenza e termoregolazione; infatti durante l’inverno non è infrequente trovare più individui che condividono uno stesso nido, probabilmente per mantenere meglio la temperatura corporea (Wolton & Flowerdew, 1985). Le dimensioni dell’area vitale degli individui variano moltissimo a seconda degli ambienti e degli studi considerati, andando da meno di 300 a oltre 13.000 m2, ma tendono a essere maggiori nei
27 maschi e con un maggior grado di sovrapposizione (Wolton & Flowerdew, 1985; Tattersall et al., 2001). L’attività riproduttiva è massima in estate in gran parte dell’Europa centro-settentrionale, mentre si interrompe in inverno (Flowerdew, 1991); al contrario, nei paesi mediterranei tale attività inizia a fine estate e si protrae fino a primavera, senza soluzione di continuità nei mesi invernali (Saint Girons, 1972; Moreno & Kufner, 1988; Harich & Benazzou, 1990). La gestazione dura 19-20 giorni e l’allattamento 18-22 giorni; le femmine presentano tre paia di mammelle e il numero medio di piccoli per parto oscilla, in laboratorio, tra i 4,3 e i 5,4 (Clarke, 1985). I piccoli nascono totalmente inetti e sono noti fenomeni di paternità multipla (Bartmann & Gerlach, 2001) e di estro post-partum, comune a molte specie di roditori. La riproduzione appare influenzata da molteplici fattori, tra cui la temperatura esterna e il fotoperiodo (Clarke, 1985), l’abbondanza di semi di specie arboree (Le Louarn & Schmitt, 1972) e la presenza di specie competitrici come il topo selvatico a collo giallo (Flowerdew & Ellwood, 2001). La durata del ciclo vitale in natura è generalmente inferiore a un anno (Corbet & Harris, 1991).
Le densità sono comprese tra 1 e 40 individui per ettaro nei boschi decidui, ma possono raggiungere i 130-200 individui/ha nelle annate favorevoli (Flowerdew, 1991); sebbene le densità possano variare notevolmente di anno in anno, non vi sono evidenze di un andamento ciclico delle popolazioni (Flowerdew, 1985). La competizione con altre specie di roditori forestali è stata oggetto di intensa ricerca: è stata rilevata nei confronti del topo selvatico a collo giallo, con cui può esistere competizione per le risorse trofiche in casi di scarsa disponibilità alimentare, e che risulta dominante sul topo selvatico dal punto di vista comportamentale (Montgomery, 1978; Gurnell, 1985). Risulta invece poco significativa nei confronti dell’arvicola rossastra; questo può dipendere dal fatto che le due specie presentano requisiti ecologici nettamente differenti per quanto riguarda microhabitat e dieta, nonché ritmi di attività poco sovrapposti (Gurnell, 1985; Stenseth et al., 2002).
Questa specie, come in genere accade per i micromammiferi terricoli, è una componente importante dell’alimentazione di molti predatori; principalmente è predata da Strigiformi (soprattutto Strix aluco e Tyto alba, Contoli, 1988), Ofidi (Capizzi & Luiselli, 1996), Mustelidi (Mustela nivalis, Flowerdew, 1991) e Felidi (Felis catus in aree prossime a insediamenti umani, Baker et al., 2003), mentre la predazione a carico di rapaci diurni è rara, viste le abitudini prevalentemente notturne della specie (Flowerdew, 2000). È inoltre ospite di numerosi parassiti di diversi gruppi zoologici, tra cui per gli ectoparassiti si segnalano Acari (zecche e
28 non), Sifonatteri (pulci), Anopluri (pidocchi), e per gli endoparassiti Cestodi, Trematodi e Nematodi.
Note di legislazione:
Trattandosi di una specie comune e diffusa in tutta la penisola italiana, ad ampio areale e con trend di popolazione stabile, il topo selvatico non gode di nessuna protezione specifica da parte delle leggi dello stato italiano né da parte di alcuna direttiva comunitaria o convenzione recepita dall’Italia; al contrario, esso è talvolta considerato un animale nocivo per alcune coltivazioni protette, come fragole e agrumi (D’Errico & Di Maio, 1974) e per le semine forestali (Capizzi, 1993), malgrado l’interazione tra il topo selvatico e le attività umane sia occasionale.
2.2.2. Apodemus flavicollis
Il topo selvatico a collo giallo A. flavicollis (Melchior, 1834) è strettamente imparentato con il topo selvatico, di cui sostanzialmente condivide la sistematica. Conta cinque sottospecie, delle quali due presenti in Italia: A. flavicollis flavicollis (Melchior, 1834) e A. flavicollis geminae (von Lehmann, 1961).
Distribuzione:
Si tratta di una specie paleartica occidentale a distribuzione europea, con estensione anatolico-caucasica; occupa un vasto areale in gran parte dell’Europa continentale, fino alla catena degli Urali (Federazione Russa) e alla Turchia; il limite orientale dell’areale è segnato dal confine occidentale dell’Armenia e dai Monti Zagros in Iran, mentre quello meridionale da Siria, Libano e Israele (IUCN Red List of Threatened Species. Version 2012.2)
In Europa è generalmente diffuso, benché sia assente dalla Spagna meridionale, dalla Francia occidentale, dalla Fennoscandia centrale e dalla Russia, nonché dalla maggior parte delle isole (inclusa l’Irlanda, ma è presente in Gran Bretagna). Lo si ritrova in alcune isole orientali del Mediterraneo; vive da zone al livello del mare ad alte quote, fino a 1850 m (Spitzenberger 2002) (Fig. 2.4).
In Italia è presente in tutta la penisola, con l’eccezione delle aree maggiormente urbanizzate e/o intensamente coltivate (zone costiere, Pianura Padana, Salento); è invece assente da tutte le isole (Amori et al., 2009). Proprio in virtù di quest’ampio areale, della sua occorrenza comune e di un trend di popolazione stabile, la specie è classificata come a rischio minimo (classe LC- “Least Concern”) dalla IUCN (2008).
29 Riconoscimento:
Il topo selvatico a collo giallo è, tra le specie italiane del sottogenere Sylvaemus, quella che raggiunge le maggiori dimensioni: la lunghezza testa-corpo media è compresa nelle popolazioni peninsulari tra 88,8 ± 10,1 mm (popolazioni pugliesi) e 102,30 mm (popolazioni calabre), ed è, per le popolazioni laziali, di 96,0 ± 10,6 mm. La coda è di solito poco più lunga del corpo e raggiunge in media il 109,1% della lunghezza testa-corpo (Amori et al., 2009). Il peso medio degli adulti è generalmente superiore a quello del topo selvatico e arriva a superare i 30 g; per le popolazioni laziali, si attesta su 24,6 ± 6,6 g (Amori et al., 2009).
Presenta una pelliccia bruno-rossastra, con tonalità fulve più marcate che nel topo selvatico e le parti inferiori di un bianco candido nel fenotipo regolare; la linea laterale di demarcazione tra la colorazione dorsale e quella ventrale è molto netta. È quasi sempre presente una macchia golare di colore fulvo-giallastro, di dimensioni variabili ma con orientamento trasversale, di solito non allungato, che raramente forma un collare completo nelle popolazioni meridionali. La coda, che appare lunga e massiccia in proporzione al corpo, è nuda salvo peli sparsi che comunque non nascondono la pelle, e appare nettamente bicolore con la parte inferiore chiara e quella superiore nerastra. Anche le altre appendici – zampe e padiglioni auricolari – si presentano grandi e robuste rispetto al corpo; inoltre la parte dorsale del piede
Fig. 2.4: Areale del topo selvatico a collo giallo A. flavicollis. Tratto da IUCN 2012. The IUCN Red List of
30 posteriore tende ad essere bianca (Fig. 2.5). Gli occhi sono scuri e sporgenti e le capacità sensoriali affini a quelle del topo selvatico. I giovani pre-muta sono estremamente simili a quelli di topo selvatico. Questa descrizione si riferisce al fenotipo più caratteristico della specie, ma come precedentemente sottolineato nelle popolazioni italiane i caratteri discriminanti tendono ad essere oltremodo sfumati tra queste due specie congeneriche (Fig. 2.6).
Fig. 2.5: Esemplari tipici di topo selvatico a collo giallo. Si notino: le maggiori dimensioni, il pelo più fulvo, il
ventre bianco, la linea di demarcazione laterale netta e la coda lunga e massiccia rispetto ad un adulto tipico di topo selvatico (Fig. 2.3 A).
Fig. 2.6: Esemplari atipici di probabile topo selvatico a collo giallo. Si noti la commistione di caratteri: dimensioni
cospicue, coda e zampe massicce, coda bipartita (caratteri tipici del topo selvatico a collo giallo), ma presentano una colorazione poco vivida, ventre bianco sporco e linea laterale poco definita (caratteri più affini al fenotipo
31 Aspetti ecologici:
Il topo selvatico a collo giallo presenta requisiti piuttosto specifici in termini di habitat: è una specie legata alle aree forestali, sia a conifere che a latifoglie ma con una preferenza per le seconde (Debernardi et al., 2003); predilige i boschi maturi rispetto a quelli giovani e agli stadi precoci di ricrescita dei cedui e risulta fortemente penalizzato nei casi in cui le operazioni di taglio interessino periodicamente tutta la superficie del bosco (Capizzi & Luiselli, 1996; Marsh et al., 2001). È vulnerabile ai processi di frammentazione dell’habitat, in particolar modo risente del grado di isolamento del frammento in caso di distanze considerevoli (>2 km) dai boschi maturi (Marsh & Harris, 2000; Marsh et al., 2001). Presenta un’attitudine ad arrampicarsi ancora maggiore di quella del topo selvatico e non è insolito che utilizzi come rifugio o come mensa i nidi di uccelli e, ove disponibili, le cassette nido (Montgomery & Gurnell, 1985).
La dieta è essenzialmente granivora, con il cibo di origine animale che assume rilevanza soprattutto durante il periodo estivo (Hansson, 1985); come il topo selvatico, anche il topo selvatico a collo giallo è solito accumulare scorte di semi di piante arboree e anche invertebrati all’interno di gallerie, utilizzando anche quelle scavate da altri micromammiferi (Montgomery & Gurnell, 1985; Amori et el., 1986). Presenta una sovrapposizione consistente, fino all’80%, con la nicchia trofica del topo selvatico (Holisova & Obrtel, 1980); questo fatto, unito alla dominanza comportamentale, all’inibizione dell’attività e all’influenza sui processi riproduttivi del topo selvatico a collo giallo sul topo selvatico (Hoffmeyer, 1973; Flowerdew & Ellwood, 2001) corrobora l’ipotesi dell’esistenza di processi competitivi tra le due specie, in condizioni di simpatria.
È una specie ad attività strettamente notturna e monomodale; l’organizzazione sociale non è nota, se si eccettuano le conoscenze relative a fenomeni di termoregolazione sociale analoghi a quelli del topo selvatico (Fedyk, 1971). Le dimensioni dell’area vitale degli individui sono simili tra maschi e femmine (0,22 ha per i maschi contro 0,19 ha per le femmine) e con un analogo grado di sovrapposizione (Montgomery, 1979).
L’attività riproduttiva si svolge tra febbraio-marzo e ottobre nell’Europa centro-settentrionale, con rari casi di riproduzione invernale in annate di pasciona (Flowerdew, 1991), mentre nelle aree mediterranee la riproduzione invernale è più comune e in centro Italia sono stati osservati individui sessualmente attivi a novembre (Amori et al., 2006). Le femmine presentano tre paia di mammelle e il numero di piccoli per parto oscilla tra 1 e 11, con una media compresa tra 5,0
32 e 6,8 (Flowerdew, 1985); i parti possono essere fino a tre all’anno (Stenseth et al., 2002), tratto comune a molti muridi, e i piccoli nascono totalmente inetti.
Le densità di popolazione sono influenzate dalle disponibilità alimentari, soprattutto dall’entità della produzione autunnale di semi delle specie arboree forestali (Stenseth et al., 2002) che influenza positivamente sia la sopravvivenza invernale che la riproduzione invernale; le densità sono estremamente variabili in funzione dell’ambiente considerato e dell’annata, in quanto a seconda degli studi sono stati rilevati valori massimi in zone montane compresi tra 2,1 e 18,7 ind/ha (Amori et al., 2006), con picchi di 41 ind/ha in annate favorevoli, ma che raggiungevano i 120 ind/ha in altri contesti ambientali (Jêdrzejewska & Jêdrzejewski, 1998). Vi sono indicazioni dell’esistenza di competizione con il topo selvatico a causa della marcata sovrapposizione della nicchia ecologica, mentre la competizione con l’arvicola rossastra sarebbe poco significativa date le differenti esigenze ecologiche e i diversi ritmi di attività dell’arvicola rossastra (Gurnell, 1985). È stato rilevato che in condizioni di sintopia con il topo selvatico, il topo selvatico a collo giallo tende a costruire il nido in posizione sopraelevata, suggerendo una possibile segregazione verticale tra le due specie (Hoffmeyer, 1973). La durata del ciclo vitale è simile a quella del topo selvatico (Corbet & Harris, 1991).
I predatori sono sostanzialmente i medesimi del topo selvatico, ma è documentata una maggior incidenza dei Mustelidi (Mustela nivalis, M. erminea, Martes foina, M. martes) (Capizzi, 2000) e dei serpenti tipici di ambienti forestali come Colubridi e Viperidi (Capizzi & Luiselli, 1996). Studi condotti in Polonia hanno dimostrato inoltre che l’entità della predazione è funzione della consistenza delle popolazioni, ed è perciò in grado di incidere su di esse soprattutto in presenza di densità elevate (Jêdrzejewski & Jêdrzejewska, 1993). I parassiti sono in gran parte gli stessi che infestano il topo selvatico.
Note di legislazione:
Il topo selvatico a collo giallo non gode di nessuna protezione specifica da parte delle leggi nazionali dello stato italiano né da parte di alcuna direttiva comunitaria o convenzione recepita dall’Italia. Essendo legata alle grandi aree boscate, la specie risulta localmente abbondante solo dove esistono le idonee condizioni di habitat (Capizzi & Luiselli, 1996), ma non appare minacciata; in alcune circostanze (semine forestali) può occasionalmente risultare dannosa, specie nelle piantagioni forestali del Nord Europa (Golley et al., 1975), ma nel complesso le interazioni con l’uomo sono minime.
33 2.2.3. Myodes glareolus
L’arvicola rossastra Myodes glareolus (Schreber, 1780) è un roditore del sottordine
Myomorpha, famiglia Cricetidae, sottofamiglia Arvicolinae, genere Myodes. Il genere
comprende 12 specie (Musser & Carleton, 2005) delle quali tre presenti in Europa e solo una, l’arvicola rossastra per l’appunto, in Italia. Le restanti specie sono diffuse in America Settentrionale e in Asia. L’arvicola rossastra conta 29 sottospecie, delle quali quattro diffuse in Italia, ma il quadro sistematico è in via di ridefinizione; le sottospecie attualmente segnalate in Italia sono: M. glareolus nageri (Schinz, 1845), M. glareolus hallucalis (Thomas, 1906), M.
glareolus garganicus (Hagen, 1958) e M. glareolus curcio (von Lehmann, 1961).
Distribuzione:
Si tratta di una specie sibirico-europea che popola le zone boscate della regione Paleartica, dalle isole britanniche al lago Bajkal e ai Monti Altaj nella Siberia Meridionale fino alla parte settentrionale del Vicino Oriente (Turchia e Kazakistan) (Musser & Carleton, 2005); a nord raggiunge i limiti della tundra. È diffusa in quasi tutta l’Europa continentale, con l’eccezione della parte centro-meridionale della Penisola Iberica (Spitzenberg, 1999), e presente in Gran Bretagna e Irlanda. In Italia è presente anche in zone pianeggianti, purché sufficientemente boscate, mentre è rara nella Pianura Padana e assente nel Salento e in tutte le isole (Amori & Aloise, 2005) (Fig. 2.7).
È considerata dalla IUCN come una specie comune, con densità elevate in molte zone dell’areale, ampiamente diffusa, non sottoposta a gravi minacce, con trend di popolazione stabile e frequente in molte aree protette, e di conseguenza classificata come a rischio minimo (LC- “Least Concern”) (International Union for Conservation of Nature, 2008).
34 Riconoscimento:
L’arvicola rossastra è un muride di medie dimensioni, con lunghezza testa-corpo media compresa tra 90 e 100 mm (dati relativi a popolazioni inglesi, Corbet & Harris, 1991) e coda corta, che raggiunge nelle diverse popolazioni italiane dal 44,9% al 57% della lunghezza testa-corpo (Amori et al., 2009). Il peso medio degli adulti è di norma compreso tra i 20 e i 25 g (Corbet & Harris, 1991).
Presenta la tipica sagoma arvicolina, che si distingue da quella degli altri muridi per la testa arrotondata, con muso relativamente corto e smussato e occhi e orecchie più piccoli e meno sporgenti che in Apodemus spp. Anche le zampe, oltre alla coda, sono corte in proporzione al corpo e raramente superano i 2,1 cm di lunghezza.
Presenta una pelliccia nettamente bruno-rossastra, con tonalità digradanti al grigio lungo i fianchi e biancastre sul ventre. La coda e le zampe appaiono di colore scuro, inoltre la coda presenta un ciuffo apicale di peli neri piuttosto vistoso. Sono segnalate forme melaniche, soprattutto in centro Italia (Amori et al., 2009). L’arvicola rossastra si distingue facilmente da altri arvicolini presenti sul territorio nazionale (ad es. Microtus savii) per le dimensioni maggiori, la colorazione del dorso più fulva che grigia, la coda leggermente più lunga e gli occhi e le orecchie più visibili che in altre specie. I giovani pre-muta hanno una colorazione bruno-grigiastra piuttosto omogenea (Fig. 2.8).
Fig. 2.7: Areale dell’arvicola rossastra M. glareolus. Tratto da IUCN 2012. The IUCN Red List of Threatened
35 Aspetti ecologici:
L’arvicola rossastra è una specie notevolmente legata all’ambiente forestale, in particolar modo a boschi misti decidui con un denso strato arbustivo nel sottobosco, e in misura minore ai boschi di conifere (Southern & Lowe., 1968); in Italia si può rinvenire dai boschi planiziali a oltre i 2000 m di quota e appare come un elemento tipico del bioclima temperato o intermedio (Amori et al., 1986).
Ha un’alimentazione quasi interamente vegetariana, con prevalente consumo di germogli e foglie di piante arboree, semi (ghiande, faggiole, pinoli ecc), frutti selvatici, funghi,; la foglivoria si esplica anche a carico di piante erbacee, ma più raramente, e in Gran Bretagna è documentato il consumo di foglie morte (Corbet & Harris, 1991). In uno studio condotto sulle rive del Ticino (PV) la dieta dell’arvicola rossastra si è rivelata più improntata al consumo di foglie e steli, piuttosto che di semi, rispetto a quella del topo selvatico (Canova, 1993); l’arvicola rossastra presenta comunque tratti alimentari particolari rispetto agli altri arvicolini, in quanto ha una dieta decisamente più diversificata (Butet & Delettre, 2011, Fig. 2.9) e accumula scorte di cibo per l’inverno (anche se in misura minore rispetto ad altri muridi), abitudine rara tra nella sottofamiglia (Gebczynska, 1983). Il consumo di invertebrati avviene come integrazione della dieta (Canova & Fasola, 1993).
Fig. 2.8: Esemplari di arvicola rossastra. A sinistra, un adulto; a destra, un giovane. Si notino la pelliccia rossastra