1
INDICE ANALITICO
• Riassunto tesi 3
• Introduzione 6
• Epidemiologia della Retinopatia Diabetica 9
• Storia naturale e classificazione della Retinopatia Diabetica 11
• Meccanismi patogenetici della Retinopatia Diabetica 15
Anatomia patologica della Retinopatia
Iperglicemia e disfunzione endoteliale retinica Metabolismo e disfunzione endoteliale retinica Le alterazioni della neuroretina
• Il rischio cardiovascolare nel Diabete Mellito 25
• Diabete e aterosclerosi vasale 33
Glicemia e disfunzione endoteliale Glicemia e macrofagi
Glicemia e cellule muscolari lisce
• Dislipidemia diabetica e aterosclerosi 38
Ruolo delle particelle ricche di trigliceridi LDL
HDL
• Aterosclerosi e infiammazione cronica 45
Meccanismi infiammatori nell’aterosclerosi Infiammazione del tessuto adiposo
• Insulinoresistenza e rischio cardiovascolare 48
• Il ruolo dell’ipertensione 50
• Fattori di rischio emergenti per malattia cardiovascolare 50
Lipoproteina(a) Fibrinogeno PCR
2
Omocisteina Acido Urico Riduzione di GFR
Fattori di rischio specifici nella popolazione diabetica
Microalbuminuria ABPI (Indice di Winsor)
• Retinopatia Diabetica e rischio cardiovascolare 59
• Fattore Sesso e mortalità cardiaca 63
• Scopo della tesi 66
• Materiali e metodi 66
• Risultati 68
• Discussione e conclusioni 76
3
RIASSUNTO
Lo scopo della tesi è quello di valutare la prevalenza di retinopatia diabetica in un campione di circa 2400 soggetti affetti da Diabete Mellito di tipo 2 ed il rapporto fra retinopatia e controllo glico-metabolico. Infine ci siamo proposti di stabilire se vi sia una correlazione statisticamente significativa fra presenza di retinopatia diabetica e fattori di rischio per malattia cardiovascolare nel campione preso in esame.
Il Diabete Mellito rappresenta il disordine endocrino-metabolico in assoluto più frequente. L’OMS stima che al momento vi siano nel mondo circa 171 milioni di ammalati, e che questo numero sia destinato a raddoppiare entro il 2030. La metà dei casi di malattia risulta latente e quindi misconosciuta.
Il Diabete Mellito è gravato da complicanze croniche di tipo microvascolare e macrovascolare. Fra le complicanze microvascolari la retinopatia occupa il primo posto come frequenza e rappresenta la più importante causa di cecità in età adulta nel mondo Occidentale, con un impatto elevato in termini di disabilità fisica e sociale ed in termini di spesa sanitaria.
Studi epidemiologici prospettici hanno chiaramente dimostrato come il controllo glico-metabolico costituisca il principale determinante nello sviluppo della microangiopatia diabetica e come un controllo glicemico ottimale riduca il rischio di sviluppare retinopatia.
L’aterosclerosi dei grossi vasi rappresenta invece la principale causa di mortalità nella popolazione diabetica. In particolare la cardiopatia ischemica è responsabile del 70-75% delle morti in soggetti affetti da Diabete Mellito di tipo2, ed il rischio di eventi cardiovascolari risulta il doppio rispetto alla popolazione generale. Inoltre il rischio di eventi coronarici acuti in chi è affetto da Diabete Mellito è pari al rischio di soggetti non diabetici con precedenti anamnestici di eventi cardiaci ischemici. Una grande quantità di dati, epidemiologici e fisiopatologici, documenta ormai in modo inconfutabile
4
che il Diabete rappresenta un fattore di rischio indipendente per malattia cardiovascolare negli uomini e nelle donne. I soggetti con diabete di tipo 2 presentano una mortalità annuale pari a circa il 5.4% (doppia rispetto a quella della popolazione non diabetica), e la loro aspettativa di vita è ridotta in media di 5-10 anni. Il Diabete espone ad un aumentato rischio di tutte le forme di patologia cardiovascolare: la frequenza di infarto del miocardio è aumentata di 3-5 volte, quella di stroke di 2-3 volte, il rischio di amputazioni è aumentato di 40 volte. Nonostante questi inconfutabili dati, appare meno chiaro il rapporto fra controllo glico-metabolico e rischio di macroangiopatia aterosclerotica. A questo proposito infatti, recenti studi prospettici avrebbero dimostrato che un controllo glicemico stretto mediante terapia antidiabetica intensiva non riduce la mortalità globale e cardiovascolare nei soggetti diabetici di tipo 2.
L’iperglicemia cronica favorisce ed accelera l’insorgenza di placche aterosclerotiche nei vasi mediante meccanismi non ancora del tutto chiari che coinvolgono disfunzione endoteliale, attivazione di citochine con un conseguente stato di attivazione infiammatoria cronica, aumentata coagulabilità del sangue ed infine modificazioni delle particelle lipoproteiche in senso aterogeno. Le placche aterosclerotiche nei pazienti diabetici non differiscono dal punto di vista qualitativo da quelle dei pazienti non diabetici, ma differiscono per quanto riguarda estensione, precocità e maggiore tendenza alla instabilità.
Negli ultimi tempi in letteratura vi è stato un crescente interesse riguardo alla possibilità che nei diabetici la presenza di complicanze microvascolari comporti un aumentato rischio di complicanze di tipo macrovascolare e che quindi la microangiopatia possa avere, nei diabetici, un possibile ruolo accanto all’ aterosclerosi nella patogenesi degli eventi cardiovascolari.
Mentre è ormai chiara l’associazione fra albuminuria e malattia cardiovascolare, gli studi avrebbero suggerito che anche la retinopatia possa
5
essere associata. In questi studi, sia nel Diabete di tipo 1 che nel Diabete di tipo 2, la retinopatia diabetica è associata con l’incidenza di eventi cardiovascolari e con la mortalità cardiovascolare. Inoltre molti, ma non tutti questi studi hanno indicato che la retinopatia è indipendentemente associata all’incidenza di malattia cardiovascolare o alla mortalità cardiovascolare anche dopo aggiustamenti statistici per quanto riguarda i tradizionali fattori di rischio, il controllo glicemico e la durata del diabete.
Nei pazienti affetti da diabete mellito di tipo 2 valutati nel nostro studio la prevalenza di retinopatia diabetica risultava essere il 24%, di cui il 18% non proliferante di vario grado ed il 6% proliferante e/o laser-trattata. Tale complicanza era direttamente correlata all’età e alla durata della malattia, ed inversamente correlata al controllo metabolico.
La presenza di retinopatia è risultata essere correlata con aumentata prevalenza di cardiopatia ischemica (comprensiva di episodi di infarto miocardio acuto, di coronaropatia trattata con procedure di rivascolarizzazione endoluminare o chirururgica) e di vasculopatia periferica (Ictus ischemico, arteriopatia obliterante cronica arti inferiori e/o aterosclerosi carotidea trattate con terapia medica o chirurgica). L’associazione tra retinopatia diabetica (di qualunque grado) e malattia cardiovascolare risultava indipendente da sesso, età, durata della malattia e controllo metabolico. Nei pazienti con retinopatia diabetica erano presenti elevati valori di altri parametri considerati possibili marker di rischio cardiovascolare, quali fibrinogeno, albuminuria; non c’era invece alcuna correlazione significativa con alterati valori del profilo lipidico. Inoltre nei nostri pazienti la presenza di retinopatia diabetica correlava in modo significativo con bassi valori di ABPI. I risultati di questo lavoro sembrano in sintonia con altri,i quali suggeriscono l’esistenza di possibili fattori di rischio o di possibili meccanismi patogenetici in comune fra retinopatia diabetica, malattie coronariche e malattie vascolari in soggetti affetti da Diabete Mellito. In questa ottica quindi la retinopatia
6
potrebbe essere considerata come fattore di rischio indipendente per malattia cardiovascolare nella popolazione diabetica.
Ancora non è chiaro in che modo la retinopatia, e quindi la microangiopatia, possano contribuire allo sviluppo dell’ aterosclerosi. Maggiori conoscenze in questo ambito potranno in futuro fare emergere da un lato nuovi fattori di rischio in comune fra complicanze microvascolari e macrovascolari del Diabete, dall’altro incentivare lo screening di malattie microvascolari nei pazienti diabetici per predire il rischio di complicanze di tipo macrovascolare.
INTRODUZIONE
Il diabete mellito (DM) comprende una serie di alterazioni del metabolismo che condividono il fenotipo dell’iperglicemia, causati a seconda del tipo di diabete da difetti della secrezione insulinica, dell’azione insulinica sui tessuti periferici o da entrambi i meccanismi (1). Esistono differenti tipi di diabete mellito, causati tutti da una variabile interazione fra fattori genetici, ambientali e di stile di vita. La maggior parte delle tipologie di diabete può essere ricondotta a due grandi categorie: diabete mellito di tipo 1 (DM1) e di tipo 2 (DM2). Il tipo 1 rappresenta il 5-10 % di tutti i casi di diabete mellito, ed è causato dalla distruzione immuno-mediata delle beta cellule del pancreas, con una riduzione in termini assoluti della secrezione insulinica (2); il tipo 2 invece comprende all’incirca il 90 % di tutti i tipi di diabete mellito ed ha una eziopatogenesi decisamente più complessa, caratterizzata da una ridotta azione insulinica sui tessuti (insulinoresistenza) e da un difetto relativo di secrezione insulinica (3). Le manifestazioni di un DM2 conclamato vedono quindi un continuum patogenetico che parte da una iniziale insulinoresistenza compensata da una ipersecrezione pancreatica di insulina, arrivando ad una fase terminale in cui questa aumentata secrezione non riesce più a compensare
7
l’insulinoresistenza, giungendo quindi ad uno stadio di deficit insulinico assoluto (3).
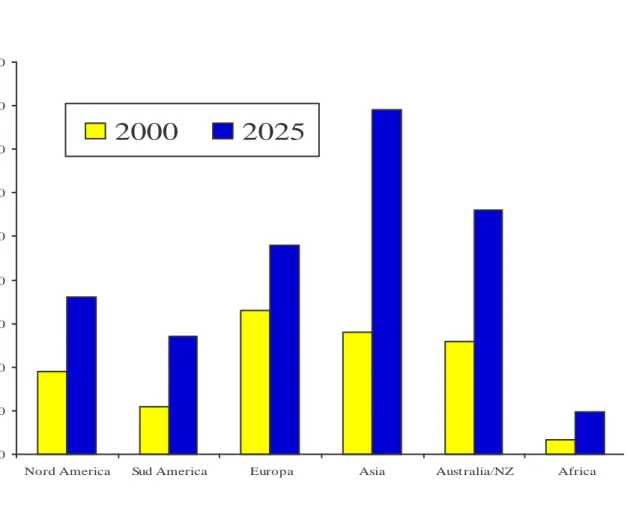
FIG. 1 Prevalenza del diabete mellito nel mondo nel 2000 e proiezioni nel 2025
A causa del costante incremento nella popolazione occidentale di obesità ed errati stili di vita, le proiezioni dell’OMS prevedono il raddoppio dei casi di diabete mellito in Europa entro il 2025 (4). La prevalenza mondiale di malattia nel 2000 era stimata essere del 2.8%, mentre le proiezioni per il 2030 prevedono di raggiungere una prevalenza mondiale intorno al 4.4% (4).
Sempre l’OMS stima che vi siano circa 171 milioni di persone affette dalla malattia nel mondo in tutte le fasce di età e che nel 2030 si arriverà a 366 milioni di malati (4); inoltre è stato stimato che la metà dei malati diabetici non è a conoscenza della propria malattia (4) (FIG.1). Il diabete mellito ha e continuerà ad avere in futuro un impatto enorme in termini di costi sociali
0 10 20 30 40 50 60 70 80 90
Nord America Sud America Europa Asia Aust ralia/NZ Africa
8
diretti ed indiretti, in quanto gravato da complicanze acute (ipoglicemia, chetoacidosi) e croniche (a carico di occhi, reni, sistema nervoso, apparato cardiocircolatorio, arti inferiori) che sono frequenti, invalidanti e spesso causa di morte (FIG.2).
Ne conseguono costi diretti (ospedalizzazione, farmaci, indagini di laboratorio e strumentali) ed indiretti (assenteismo dal lavoro, morti premature, mancato guadagno) estremamente alti e probabilmente sottostimati; a questo riguardo basti pensare al fatto che spesso i costi legati alle complicanze croniche di malattia sono imputati alle specifiche patologie d’organo piuttosto che alla malattia che ne è stata la causa.
9
EPIDEMIOLOGIA DELLA RETINOPATIA DIABETICA
La retinopatia si colloca fra le complicanze croniche di tipo microangiopatico del Diabete Mellito. Non è però l’unica conseguenza oftalmologica della malattia, poiché il Diabete è associato anche all’insorgenza di glaucoma e cataratta. Nell’ambito delle complicanze microangiopatiche, la retinopatia si colloca al primo posto come frequenza.
La retinopatia diabetica rimane ancora oggi nei paesi industrializzati la più importante causa di cecità nell’adulto in età lavorativa, con tutte le nefaste conseguenze in termini di disabilità fisica e sociale per il malato, e in termini di costi sociali per la comunità (5). Uno studio del 1994 ha messo in risalto le correlazioni fra insorgenza di retinopatia diabetica proliferante e condizioni economiche del malato, dimostrando chiaramente le conseguenze della malattia in termini di licenziamento e di difficoltà d’inserimento nel mondo del lavoro; per le donne è stato inoltre dimostrato un aumentato rischio di divorzio nei quattro anni successivi alla perdita della vista (6).
I costi sociali della retinopatia diabetica sono molto alti; negli Stati Uniti è stato stimato agli inizi degli anni Novanta che un adulto diabetico (età inferiore ai 65 anni) affetto da cecità costi allo stato all’incirca 12.000 dollari l’anno, senza includere i costi aggiuntivi legati alla perdita di produttività del malato e alla sua riabilitazione (5). Le stesse considerazioni possono essere fatte per gli altri paesi industrializzati, tra cui l’Italia, e non ci sono indicazioni per pensare che il problema sia destinato a risolversi nel corso degli anni, viste le proiezioni dell’OMS.
Pochi sono gli studi fatti per quanto riguarda gli aspetti epidemiologici della malattia e il suo impatto fra le cause di cecità; fra questi il Wisconsin Epidemiology Study of Diabetic Retinopathy (WESDR) (7) è probabilmente lo studio più esteso e completo che sia stato mai fatto al riguardo. Si tratta di uno studio trasversale di tipo osservazionale (fatto quindi sull’esame fisico del
10
paziente piuttosto che sulle statistiche correnti) svoltosi a partire dal 1980 fino al 1998; in un primo lavoro sono stati presi in esame 2366 pazienti diabetici di tipo 1 e di tipo 2 fra il 1980 e il 1982, con una prevalenza di retinopatia diabetica del 71 % per i pazienti di tipo 1 e del 39% per quelli di tipo 2. Nel gruppo dei pazienti con diabete di tipo 1 sono stati inoltre stimati i casi di retinopatia proliferante e di edema maculare clinicamente significativo, le cui prevalenze sono state rispettivamente del 23% e del 14%. Lo stesso gruppo di studio ha valutato nel 1998 tutti quei pazienti con diagnosi di Diabete di tipo 1 e tipo 2 da almeno 15 anni: nel primo gruppo sono stati osservati segni di retinopatia diabetica back-ground nel 97% dei pazienti, mentre circa il 37% dei pazienti presentava segni di retinopatia proliferante; nel secondo gruppo (diabete tipo 2) invece l’80% presentava segni di retinopatia back-ground e solo il 10% di retinopatia proliferante (7).
L’EURODIAB (8) è invece un grosso studio multicentrico europeo che ha preso in considerazione trasversalmente 3250 pazienti diabetici di tipo 1 nel 1990, riportando valori di prevalenza più bassa: rispettivamente 35.9% per la retinopatia non proliferante e 10.3% per quella di tipo proliferante; inoltre la prevalenza di retinopatia non proliferante era pari all’82% per pazienti con almeno 20 anni di durata della malattia, mentre per la forma proliferante questa era stimata al 37% per una durata di malattia di almeno 30 anni.
Si stima che negli Stati Uniti la retinopatia diabetica sia responsabile di severo difetto della vista nell’86% dei pazienti con Diabete di tipo 1 e nel 33% di quelli con Diabete di tipo 2, che il diabete sia responsabile ogni anno della registrazione come ciechi di almeno 5000 nuovi malati (9),(10) e che ogni anno circa 250.000 pazienti diabetici siano destinati ad una significativa riduzione dell’acuità visiva (5).
Per quanto riguarda la situazione in Italia i dati a disposizione sono ancora più scarsi, anche a causa dell’assenza di un registro nazionale per cecità da diabete. Studi condotti in singole aree geografiche concordano nell’affermare
11
che le complicanze oculari del diabete rappresentino la più comune causa di cecità in età lavorativa anche in Italia, e che la retinopatia diabetica sia in assoluto la seconda causa di cecità nella popolazione generale, preceduta dalla cataratta e seguita dalla miopia. La maggior parte di questi studi si basa su dati provenienti dagli Archivi degli uffici per il rilascio delle pensioni d’invalidità civile, che possono tuttavia essere imperfetti per il rischio di sottostima dei risultati, in quanto spesso vengono esclusi da questi registri portatori di cecità parziale (residuo visivo inferiore a 1/20 nell’occhio migliore), egualmente invalidante (11).
Porta e collaboratori hanno stimato l’impatto della retinopatia nella sola provincia di Torino, concludendo che il deficit visivo nel diabetico è per l’80-90% imputabile alla retinopatia, e che l’incidenza di cecità secondaria a diabete si aggira intorno ai 2 casi/100.000 abitanti/anno (12).
STORIA NATURALE E CLASSIFICAZIONE DELLA RETINOPATIA DIABETICA
Da sempre l’esame del fundus oculi è considerato un validissimo elemento clinico e diagnostico nell’approccio al paziente con malattie internistiche. Naturalmente ciò che è possibile visualizzare del microcircolo retinico è dato dai vasi arteriosi e venosi che originano dal disco ottico e dai loro rami periferici, mentre non abbiamo visione dei capillari, i quali sono troppo piccoli per una visione diretta; questi tuttavia nel loro insieme conferiscono alla retina il tradizionale colore rosso, ed è possibile visualizzare i danni che il diabete comporta a loro carico.
La retinopatia diabetica può essere classificata in vari modi. La prima classificazione introdotta fu la ’Airlie House Classification, risalente agli anni ’60, piuttosto complessa e caratterizzata da numerosi stadi di malattia. Successivamente sono state introdotte altre classificazioni, tra cui la
12
EURODIAB CLASSIFICATION nell’ambito dell’ EURODIAB IDDM Complications Study,che consente una classificazione in gradi della malattia in modo più semplice e standardizzato.
Tradizionalmente la retinopatia diabetica (RD) viene suddivisa in retinopatia non proliferante (lieve, moderata e severa) e retinopatia proliferante. Gli autori anglosassoni riconoscono inoltre una retinopatia avanzata (Advanced Diabetic Eye Disease).
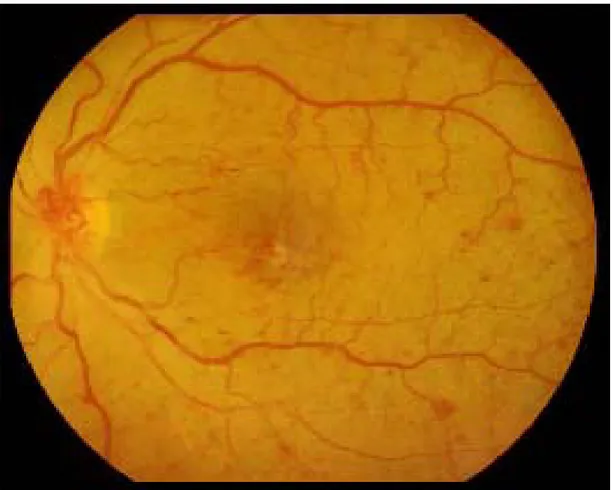
La RD non proliferante o back-ground è caratterizzata dalla presenza all’Oftalmoscopia di microaneurismi, emorragie a chiazza, essudati duri e noduli cotonosi (Fig. 3).
13
I microaneurismi appaiono all’osservatore come piccoli puntini rossi in risalto rispetto allo sfondo rosso retinico e corrispondono a dilatazioni sacciformi dei capillari, espressione di un indebolimento della parete di questi ultimi. Si tratta in assoluto dei segni più precoci di malattia.
Le emorragie “a chiazza” danno segno di sé con lesioni rosse più grandi e a margini abbastanza regolari e rotondeggianti; originano dalla rottura di capillari situati nello strato più profondo della retina, che corrisponde allo strato dei neuroni di connessione disposti in modo verticale, motivo per il quale la raccolta ematica assume un contorno rotondeggiante. Questo tipo d’emorragie sono un segno tipico del diabete a livello retinico, così come le emorragie retiniche “a fiamma” lo sono per l’ipertensione arteriosa, interessando in questo caso lo strato retinico più superficiale in cui le fibre nervose sono disposte a formare una rete orizzontale. Gli essudati duri consistono in lesioni giallastre a margini ben definiti nella retina, e sono il risultato di una aumentata permeabilità capillare, con passaggio di plasma e proteine nell’interstizio. I Noduli cotonosi appaiono infine come piccole aree retiniche di colore pallido e a margini sfumati, da cui deriva l’aggettivo “cotonosi”. Corrispondono al rigonfiamento edematoso delle fibre nervose dato da una condizione di ischemia (occlusione dei capillari).
Ciò che caratterizza la maggiore o minore gravità della RD non proliferante è dato dalla quantità e dall’estensione delle suddette lesioni. Nella forma PREPROLIFERANTE troviamo numerosi Microaneurismi ed estese emorragie profonde sui quattro quadranti della retina; a questo si associano Anomalie venose (anse, evidenti irregolarità di calibro) e dilatazione dei piccoli vasi che vengono indicate con la sigla inglese IRMA (anomalie microvascolari intraretiniche). Quando compaiono questi segni il paziente è a rischio di sviluppare una forma di retinopatia proliferante.
La Retinopatia proliferante si caratterizza per la presenza di neovasi a partenza dalle vene del disco ottico o dalla parte periferica della retina. Questi
14
neovasi sono molto fragili e tendono a sanguinare facilmente, dando luogo ad emorragie preretiniche (Fig. 4).
Fig 4. Retinopatia diabetica Proliferante.
La neoangiogenesi è considerata una risposta incongrua ad una condizione di ischemia, riconducibile alla obliterazione dei capillari retinici. I neovasi e le emorragie sono seguiti dallo sviluppo di tralci fibrosi che per effetto della trazione esercitata sulla retina ne possono provocare il distacco, con perdita permanente del visus.
Il distacco retinico che così si configura porta allo stadio terminale della retinopatia, chiamato dagli autori anglosassoni Advanced Diabetic Eye Disease. In questo stadio finale di malattia l’ abnorme neoangiogenesi
15
raggiunge il segmento anteriore dell’occhio ed in particolare l’iride (rubeosi iridea), causando un grave glaucoma neovascolare.
La maculopatia è definita dalla presenza di lesioni retiniche nella regione maculare, di tipo edematoso e/o ischemico, con conseguente grave compromissione della acuità visiva e della percezione dei colori. Si tratta della più frequente causa di cecità nel diabetico. E’ stato identificato un quadro a maggior rischio di perdita della vista, definito come Edema Maculare clinicamente significativo, caratterizzato da:
• ispessimento edematoso della retina entro 500 micrometri dal centro della macula.
• essudati duri localizzati entro 500 micrometri dal centro della macula, asociati a segni di ispessimento retinico.
• Aree di ispessimento di retina ampie almeno un diametro papillare a distanza pari o inferiore ad un diametro papillare dal centro della macula.
Per diagnosticare l’edema maculare è necessario l’esame stereoscopico del fundus oculi mediante lampada a fessura.
MECCANISMI PATOGENETICI DELLA RETINOPATIA
Sebbene molti sforzi siano stati compiuti nel tentativo di appurare la patogenesi della retinopatia diabetica, ad oggi l’unico elemento certo è rappresentato dal fatto che l’iperglicemia cronica risulta l’unico primum movens nello sviluppo della complicanza. Molti sono ancora i punti da chiarire riguardo a come la suddetta iperglicemia porti a disfunzione endoteliale e quindi a danno vasale.
Il Diabetes Control and Complications Trial (DCCT) ha chiaramente dimostrato il ruolo preponderante del compenso metabolico nello sviluppo e nella progressione della retinopatia in pazienti affetti da diabete mellito tipo 1,
16
indicando l’iperglicemia come chiara causa di microangiopatia (13). Sempre a tale proposito l’Oslo Study del 1992 ha dimostrato, grazie ad uno studio longitudinale a 7 anni, che i pazienti con emoglobina glicosilata più elevata erano a maggior rischio di deterioramento marcato della retina, identificando anche un valore soglia di emoglobina glicosilata (pari a 8%) al di sopra del quale fosse molto probabile lo sviluppo di retinopatia (14). Infine il UKPDS nel 1998 ha dimostrato come anche nel Diabete di tipo 2 valga lo stesso tipo di considerazione, dimostrando chiaramente che incidenza e gravità della retinopatia sono minori in pazienti con più stretto controllo glico-metabolico rispetto a quelli con controllo non ottimale (15). Tuttavia la pratica clinica dimostra che in molti pazienti con controlli glicemici altalenanti vi sia comunque una progressione nella retinopatia, portando alcuni autori ad ipotizzare un fenomeno di “memoria metabolica” a livello del microcircolo
(16). Inoltre in certi pazienti è documentabile lo sviluppo della retinopatia nonostante uno stretto controllo glico-metabolico fin dall’inizio di malattia, suggerendo così che l’ iperglicemia cronica possa non essere l’unico determinante nello sviluppo delle complicanze, ma che piuttosto questa si intersechi con altri fattori, anche di ordine genetico.
Analizzando retine di soggetti diabetici deceduti, è emerso che le alterazioni istologiche cui va incontro il microcircolo retinico sono rappresentate da aumentata permeabilità vascolare con rottura della membrana emato-retinica, ispessimento della membrana basale capillare, occlusione capillare mediata da piastrine e leucociti, perdita di periciti e cellule muscolari lisce, incrementato turn over delle cellule endoteliali con perdita finale di queste ultime. E’ stato appurato che i periciti rappresentano elementi cellulari particolarmente vulnerabili nel diabete e che la perdita dei periciti avviene nelle fasi precoci
17
della retinopatia, ipotizzando quindi un ruolo primario di questi assieme alle cellule endoteliali. Infatti la perdita di periciti e cellule endoteliali comporta la presenza di capillari acellulari. Aree retiniche in cui prevalgano tali capillari risultano scarsamente perfuse, dando luogo ad aree ischemiche e conseguente rilascio di fattori di crescita che favoriscono la neoangiogenesi e l’aumentata permeabilità nel microcircolo(17).
IPERGLICEMIA E DISFUNZIONE ENDOTELIALE RETINICA
E’ ormai appurato che il denominatore comune delle complicanze microvascolari del diabete sta nella cosiddetta disfnzione endoteliale, seppure con effetti diversi sulla base della sede vascolare interessata.
Fino ad inizio anni ’80 l’endotelio era visto esclusivamente come un monostrato di cellule inerti con la sola funzione di supporto meccanico. Successivamente è stato dimostrato che in realtà alle cellule endoteliali compete anche un ruolo attivo biosintetico, la cui funzione risulta essenziale nella fisiopatologia cardiovascolare. Sono stati quindi individuati una serie di mediatori chimici di origine endoteliale essenziali ai fini dell’omeostasi cardiovascolare. Accanto alla funzione biosintetica è stato inoltre visto come le cellule endoteliali possiedano sul versante luminale strutture recettoriali, ed è stato così identificato il cosiddetto endothelial surface layer, con compiti di regolazione dei rapporti fra sangue e vasi, fra cui trasporto di nutrienti, coagulazione e fibrinolisi, interazione con leucociti e piastrine, angioneogenesi (18).
Mediatori chimici di disfunzione endoteliale. In letteratura (17) fra i vari mediatori chimici di disfunzione dell’endotelio molta attenzione è stata riservata a VEGF (Fig.3). Si tratta di una proteina con dimostrato effetto mitogeno sulle cellule endoteliali vascolari. VEGF inoltre è in grado di
18
aumentare la permeabilità vascolare (da cui l’originale nome di “vascular permeability factor”). Questo fattore di crescita è essenziale nello sviluppo del circolo vascolare durante la vita fetale e alla nascita l’espressione di VEGF subisce una drastica riduzione; tuttavia è stato dimostrato che alcuni elementi cellulari continuano ad esprimere costitutivamente una piccola quota di VEGF anche dopo la nascita, fra cui cellule della neuroretina, dello strato corioideo e dell’epitelio pigmentato retinico. Valori incrementati circa 20 volte superiori al normale di VEGF sono stati rilevati nell’umor vitreo di pazienti sottoposti a vitrectomia a causa di retinopatia diabetica proliferante. A conferma di ciò in animali da esperimento sono state iniettate endo vitreo dosi di VEGF esogeno, osservando successivamente segni riconducibili a neovascolarizzazione a livello retinico ed irideo. Sempre in modelli animali iniezioni di specifici anticorpi anti-VEGF nel corpo vitreo hanno dato chiari segni di prevenzione della neoangiogenesi a livello retinico. E’ ormai appurato che l’espressione di VEGF è decisamente incrementata in corso di ipossia tissutale, a livello di retina come di altri tessuti, confermando quindi il ruolo di VEGF nella genesi della retinopatia diabetica proliferante, ma non solo: aumentati valori di VEGF sono stati rinvenuti anche in fasi iniziali di retinopatia senza segni di neoangiogenesi. Infine studi recenti (19) hanno riferito una incrementata espressione di VEGF a livello di neuroni retinici (mediante tecniche immunoistochimiche) in pazienti senza alcun segno di retinopatia, supportando l’ipotesi che la retinopatia diabetica non sia riconducibile esclusivamente ad alterazioni microangiopatiche, ma anche a primitive disfunzioni della neuroretina. In virtù di quanto osservato, risulta promettente l’impiego di anticorpi anti-VEGF nella cura della retinopatia diabetica umana, sebbene non manchino inconvenienti per un impiego di questi (17): il loro uso sistemico potrebbe ostacolare lo sviluppo di circoli collaterali a livello di gamba e a livello coronario, penalizzando così potenziali buoni risultati a livello retinico, ed inoltre una somministrazione
19
locale (endovitreale) di tali farmaci non è esente da rischi. Promettente appare anche l’impiego di farmaci in grado di esercitare un blocco a livello dei recettori VEGF, fra i quali VEGFR-1 e VEGFR-2 che sono anch’essi risultati maggiormente espressi in retine di soggetti diabetici. Nonostante queste evidenze preliminari ancora non sono stati avviati trias clinici in questa direzione, a differenza del campo oncologico, dove inibitori di VEGFR-2 sono stati impiegati dimostrando una certa efficacia terapeutica (17).
Fra i mediatori chimici di perdita della funzione endoteliale un ruolo importante è stato attribuito anche a TGF-beta. Da studi in vitro (20) si evince come questo sia in grado di stimolare la proliferazione endoteliale e come alte concentrazioni di glucosio siano in grado di indurre sull’endotelio retinico un aumentata espressione di TGF-beta e del relativo recettore (21). Inoltre è stato osservato un ruolo sempre di TGF-beta sulla sintesi di altri fattori di crescita responsabili della sintesi di matrice extracellulare a livello retinico (22), potendo così mediare l’aumento di spessore della membrana basale dei capillari osservato nella retinopatia diabetica e favorire quindi l’occlusione vascolare.
20
Fig.5 Nella parte A della figura è visualizzata una retina normale, mentre nella parte B è raffigurata una retina di un paziente con retinopatia proliferante. VEGF ed i suoi recettori di membrana a livello retinico, VEGFR-1 e VEGFR-2, potrebbero avere rilevanza nella patogenesi della retinopatia diabetica.
METABOLISMO E DISFUNZIONE ENDOTELIALE RETINICA
Il meccanismo esatto per cui da una condizione di elevata glicemia nel tempo si giunga alla suddetta disfunzione endoteliale nel microcircolo retinico ancora non è ben conosciuto. Vari studi ipotizzano che l’ambiente metabolico caratteristico del diabete crei anomalie biochimiche a carico del metabolismo cellulare retinico, e che queste alterazioni solo in un secondo momento portino a disfunzione endoteliale e quindi a microangiopatia.
Resta ancora molto da capire riguardo a queste vie metaboliche anomale attivate maggiormente in corso di diabete e responsabili di possibili danni cellulari.
La via dei polioli. Recenti pubblicazioni (23) sono tornate a mettere in risalto la via dei polioli come possibile meccanismo di alterazione della omeostasi cellulare. La via dei polioli è una via biochimica che entra in gioco quando i livelli di glucosio intracellulari sono elevati, e l’Aldoso reduttasi è l’enzima chiave di tale via, in quanto riduce il glucosio a sorbitolo sfruttando NADPH come cofattore. Il sorbitolo è successivamente ridotto a fruttosio dall’enzima sorbitolo deidrogenasi, che sfrutta NAD + come cofattore. Le conseguenze di una eccessiva attivazione di questa via sono molteplici. Per prima cosa il sorbitolo, essendo fortemente idrofilo, si accumula nella cellula creando una condizione di stress osmotico per la cellula stessa. Oltre a ciò il fruttosio prodotto dalla via dei polioli è successivamente convertito in fruttosio-3-fosfato e 3-deossiglucosone: entrambi i composti risultano essere forti agenti glicosilanti, entrando in gioco nella formazione di AGEs (vedi dopo). Infine il
21
consumo di NADPH e NAD+ comporta da un lato un difetto nella produzione cellulare di agenti che proteggano la cellula da stresso ossidativo, come il GSH, dall’altro un alterazione del rapporto NAD+/NADH con formazione di specie reattive ossidanti dannose per la cellula, portando ad una condizione chiamata “pseudo ipossia”. Questa situazione innesca a sua volta una cascata di eventi che porta a danni cellulari irreversibili (23). Partendo da queste osservazioni sono partiti una serie di studi per valutare l’effetto in modelli animali di specifici farmaci inibitori della Aldoso reduttasi sulla retinopatia diabetica, con risultati contrastanti (24),(25). L’aumentata espressione dell’enzima su cellule nervose in retine umane di diabetici spinge comunque ad approfondire le ricerche in questo campo (26). E’ stato inoltre individuato il gene che codifica per la Aldoso reduttasi sul cromosoma n°7, suggerendo che mutazioni a livello del sito promotore di tale gene possano essere coinvolte nella patogenesi della retinopatia diabetica (27). E’ stata infatti dimostrata in pazienti diabetici cileni di tipo 2 una progressione nove volte più veloce di retinopatia in presenza di uno specifico allele (allele Z-2), suggerendo un ruolo importante del gene come fattore di rischio nello sviluppo di retinopatia diabetica (28). Sempre per quanto riguarda l’allele Z-2, da studi in vitro su cellule retiniche umane è stata dimostrata una up-regulation dell’enzima in ambiente iperglicemico (29).
L’infiammazione cronica. Un altro meccanismo preso in considerazione di
recente vede un ruolo dell’ infiammazione cronica all’origine delle complicanze del diabete e quindi anche della retinopatia. Infatti molti dei mediatori chimici dell’infiammazione sono stati rilevati in concentrazioni più elevate della norma in retine animali, umane ed in colture di cellule retiniche incubate con alte concentrazioni di glucosio (30). In modelli animali è stata anche dimostrata una maggiore capacità di adesione endoteliale dei leucociti, con una maggiore espressione di ICAM-1 e altre molecole di adesione pro
22
infiammatorie. Sempre in modelli animali sono state rinvenute alterazioni piastriniche responsabili della formazione di microtrombi, che possono contribuire a generare occlusione dei capillari retinici. Tramite tecniche di DNA-binding è stata documentata una sovra espressione di NF-kb anche a livello dei nuclei di cellule endoteliali e periciti (NF-Kb è noto per essere fortemente implicato nello sviluppo dei processi infiammatori) (30).
Sebbene nell’uomo il nesso fra infiammazione e retinopatia diabetica sia meno chiaro che nel modello animale, anche in studi condotti su retine umane sono stati rinvenuti livelli più elevati del normale di citochine come IL-1, TNFalfa e Caspasi-1(30), tanto da spingere i ricercatori a testare l’aspirina in vari trials clinici come possibile farmaco in grado di prevenire la progressione di retinopatia nel diabetico, con risultati non del tutto chiari (30): mentre il DAMAD trial ha fornito risultati incoraggianti grazie a rallentamento dell’incremento di microaneurismi nel fundus oculi (31), l’ETDS trial non ha rilevato alcun impatto positivo della terapia sullo sviluppo della retinopatia
(32). Il mancato effetto dell’aspirina sulla retinopatia potrebbe essere attribuito al fatto che nell’ ETDS trial siano stati arruolati pazienti con stadi avanzati di retinopatia diabetica e che siano state usate dosi troppo basse di farmaco (30).
Lo stress ossidativo. Grande attenzione viene riservata all’incrementato
stresso ossidativo come possibile meccanismo di danno cellulare nel diabete. Sappiamo come l’ossigeno sia essenziale per il corretto mantenimento del metabolismo aerobio della cellula, e come l’omeostasi cellulare sia garantita da un fine equilibrio fra formazione ed eliminazione di specie reattive dell’ossigeno. Lo stress ossidativo non è altro che l’alterazione di questo equilibrio, vale a dire l’incrementata produzione di specie reattive dell’ossigeno e/o la ridotta disponibilità di sistemi enzimatici di difesa da queste. Alla base di molte malattie umane, fra cui diabete mellito e malattia di Alzheimer, si pensa che vi sia una condizione di partenza caratterizzata da
23
stress ossidativo a carico delle cellule, e che tale tipo di stress comporti a lungo andare danni irreversibili per la cellula stessa, riconducibili ad alterazioni di macromolecole come DNA, proteine, lipidi e glucidi (33).
La retina ha il più alto up-take di ossigeno fra tutti i tessuti umani, e ciò la rende particolarmente suscettibile allo stress di tipo ossidativo, per cui è stato ipotizzato un nesso casuale di questo con l’iperglicemia cronica. Inoltre studi su modelli animali hanno ipotizzato che alla base del fenomeno della “memoria metabolica” in precedenza citato vi sia l’accumulo nelle cellule di specie reattive dell’ossigeno non più rimovibili che rendono così vano il ripristino di un ottimale controllo glicemico dopo un periodo in cui tale controllo non è stato ottimale. A conferma di quanto detto fino ad ora, nelle retine di ratti resi diabetici sono stati osservati da un lato elevati livelli di Superossidi e di Perossido di idrogeno, dall’altro bassi livelli di sistemi enzimatici difensivi, fra cui il GSH. L’ipotesi è quindi che il meccanismo dello stress ossidativo innescato dall’iperglicemia, oltre che causare direttamente un effetto citopatico sulla cellula, possa perpetuare un circolo vizioso andando ad attivare altre vie metaboliche di per sé dannose per la cellula, come la già citata via dei polioli, l’attivazione della via della PKC oppure incrementare l’espressione di fattori di crescita vascolari come il VEGF che sono cruciali nello sviluppo della microangiopatia. Accanto a questo è stato inoltre ipotizzato che un incremento delle specie reattive dell’ossigeno possa innescare uno stimolo infiammatorio cronico andando ad aumentare l’espressione di NF-kb, NO, Prostaglandine ed altri mediatori pro infiammatori, oltre che favorire l’attivazione dell’apoptosi a livello di periciti e cellule endoteliali. Un altro meccanismo per spiegare il danno perpetuato dallo stress ossidativo sulle cellule è la eccessiva produzione dei cosiddetti AGEs. Gli AGEs non sono altro che prodotti finali di glicosilazione non enzimatica irreversibile innescati dall’abbondanza di zuccheri nel sangue, i quali si legano covalentemente per via non enzimatica con gli amino gruppi di
24
proteine e lipidi, dando luogo alla formazione di basi di Schiff e prodotti di Amadori, responsabili a loro volta del danno strutturale e funzionale di molte macromolecole cellulari. L’iperglicemia non farebbe altro che facilitare queste reazioni a livello di periciti e cellule endoteliali, e si ipotizza che nel corso di queste reazioni biochimiche di per sé dannose possano anche essere prodotte ulteriori specie reattive dell’ossigeno, amplificando così il danno a livello endoteliale nella retina così come in altri distretti vascolari (33).
Ruolo di PCK. Infine un'altra via biochimica che nella retinopatia diabetica
potrebbe essere fondamentale come chiave patogenetica è la cascata di reazioni attivate dalla PKC, che fa da trasduttore di segnale chimico per molti ormoni e citochine. Alti livelli di glucosio nelle cellule retiniche incrementano da un lato il livello di specie reattive, mentre dall’altro portano ad una aumentata disponibilità di Diacilglicerolo nell’ambiente cellulare, così da incrementare l’attività della PKC (34). Una anomala attivazione della PKC potrebbe essere alla base di tutta una serie di conseguenze a livello di microcircolo retinico, fra cui: aumentata permeabilità vascolare, ridotto flusso vasale, up-regulation di VEGF e altri fattori di crescita neoangiogenetici, apoptosi a livello endoteliale (35).
Negli ultimi anni sono emersi nuovi elementi che fanno ipotizzare come la retinopatia diabetica non sia caratterizzata solo da alterazioni a livello vascolare, ma come entrino in gioco anche disfunzioni primitive a carico della neuroretina, in particolare a livello di neuroni e cellule gliali, e come queste alterazioni possano essere considerate il primo step nello sviluppo della retinopatia ancora prima dello sviluppo di lesioni vascolari (19). In modelli animali di ratti resi diabetici sono stati osservati segni istologici di neuro
25
degenerazione retinica, in particolare apoptosi neuronale e ridotto spessore retinico, associati a riduzione nel numero di cellule gangliari (36). Nell’uomo da studi effettuati con elettroretinogramma sono emerse alterazioni significative a carico dei potenziali di oscillazione ben prima della manifestazione di danno vascolare locale, suggerendo quindi anche nella retina umana alterazioni che possano essere riconducibili a danno neuronale
(37). L’osservazione sarebbe rafforzata dalla evidenza clinica di disturbi dell’adattamento alla visione notturna e della discriminazione cromatica in pazienti diabetici in fasi precoci di retinopatia diabetica (38). In questa chiave di lettura la retinopatia diabetica sarebbe considerata quindi non tanto una malattia del microcircolo, quanto piuttosto una malattia ad eziologia multifattoriale ancora più complessa (19). Infine l’osservazione che neuroni e cellule gliali della retina esprimano recettori specifici per fattori di crescita vascolari (fra cui VEGF) depone a favore di un ruolo della disfunzione retinica nello sviluppo del danno vasale (39). Quello che resta ancora da capire è se queste alterazioni neuro retiniche siano indipendenti dalla microangiopatia o se piuttosto siano una manifestazione precoce di questa (19).
IL RISCHIO CARDIOVASCOLARE NEL DIABETE MELLITO
L’aterosclerosi è la principale causa di morbidità e di mortalità nella popolazione diabetica (40), motivo per cui in entrambi i tipi di diabete il rischio cardiovascolare risulta aumentato di più di due volte rispetto alla popolazione generale e le malattie cardiovascolari rappresentano il 70-75 % delle cause globali di morte nella popolazione diabetica (41),(42) (Fig.4). Tale rischio è solo parzialmente spiegato dalla coesistenza nella popolazione diabetica di vari fattori di rischio tradizionali (obesità, dislipidemia, ipertensione etc.), motivo per cui il diabete mellito spesso è considerato un fattore di rischio indipendente per lo sviluppo di patologie cardiovascolari.
26
L’infarto del miocardio rappresenta la principale causa di mortalità nella popolazione diabetica (43). Recenti dati stimano che il rischio d’infarto miocardico in pazienti diabetici con precedente anamnesi negativa per complicanze cardiovascolari sia pari al rischio di pazienti non diabetici con un precedente evento infartuale (44).
Studi condotti negli ultimi anni hanno messo in evidenza come vi sia una aumentata incidenza di malattie cardiovascolari non solo nei soggetti con diabete mellito conclamato, ma anche in quelli con alterata glicemia a digiuno o ridotta tolleranza glucidica (45).
Esiste una certa mole di dati in letteratura che mette chiaramente in relazione la condizione di iperglicemia cronica e lo sviluppo di complicanze microangiopatiche in soggetti diabetici, date da retinopatia, nefropatia e neuropatia periferica (46). Studi clinici randomizzati hanno dimostrato che un controllo glicemico ottimale riduce l’incidenza di complicanze microvascolari nella popolazione diabetica (46).
Abbiamo invece un numero ancora limitato di studi prospettici che mettano in luce il rapporto fra controllo della glicemia e sviluppo di complicanze di tipo macrovascolare, date da cardiopatia ischemica, ictus cerebrale e vasculopatia periferica. Inoltre questi dati presenti in letteratura non sono univoci, tanto che la American Diabetes Association recentemente ha definito ancora non chiaro il ruolo dell’iperglicemia nello sviluppo delle complicanze cardiovascolari diabetiche.
Il United Kingdom Prospective Diabetes Study, uno studio randomizzato, prospettico e mulicentrico, aveva mostrato come una terapia ipoglicemizzante intensiva (mediante sulfaniluree o insulina) in pazienti con recente diagnosi di DM2 fosse associata con un ridotto rischio di complicanze microangiopatiche clinicamente significative e con una non significativa riduzione del 16% nel rischio relativo di infarto del miocardio(47). Nello stesso studio, nei pazienti il cui peso corporeo eccedeva in più del 120% del peso ideale e che quindi
27
ricevettero metformina come ipoglicemizzante, fu osservata una riduzione nel rischio di infarto del miocardio e nel rischio di morte globale, nonostante in questi pazienti fossero registrati livelli superiori di emoglobina glicosilata rispetto ai pazienti trattati con sulfanilureee o insulina (47). Una metanalisi di precedenti studi osservazionali condotti per mettere in relazione livelli medi di Hb1ac e sviluppo di complicanze, ha dato risultati differenti, mostrando che dopo aggiustamento statistico per altri fattori di rischio l’incremento dell’1% nei livelli di Hb1ac fosse associato ad un aumentato rischio del 18% di eventi cardiovascolari (48) e ad un aumento del 12-14% di rischio di morte
(59),(50). Dagli stessi risultati si evidenziava anche un incremento del 37% del rischio di sviluppare retinopatia o danno renale (51). Quindi questi risultati deponevano per una relazione fra livelli di Hb1ac ed eventi cardiovascolari, suggerendo quindi che una terapia finalizzata ad abbassare i livelli di emoglobina glicosilata potrebbe ridurre il rischio (51). A questo proposito un altro studio osservazionale longitudinale, conosciuto come Epidemiology of Diabetes Interventions and Complications (EDIC), ha dimostrato che un trattamento intensivo in pazienti diabetici di tipo 1 può associarsi ad un minor grado di calcificazione a livello coronarico, se confrontato ad un gruppo di pazienti sottoposti a terapia convenzionale(53). Tuttavia queste ipotesi non sono state mai testate in studi clinici con adeguata potenza statistica ed inoltre sono supportate da studi con outcomes primari non specifici esclusivamente per eventi cardiovascolari. Una rivisitazione più recente sull’argomento ha ridimensionato questi risultati, fornendo risultati differenti. L’ADVANCE (The Action in Diabetes and Vascular Disease:Preterax and Diamicron Modified Release Controlled Evaluation) è uno studio (51) che è stato concepito per testare gli effetti sulle complicanze cardiovascolari di una terapia ipoglicemizzante intensiva finalizzata a una riduzione dei valori medi di Hb1ac sotto il 6.5% in una popolazione di 11.140 pazienti con DM2. I pazienti selezionati erano di età compresa fra 30 e 55 anni e con una
28
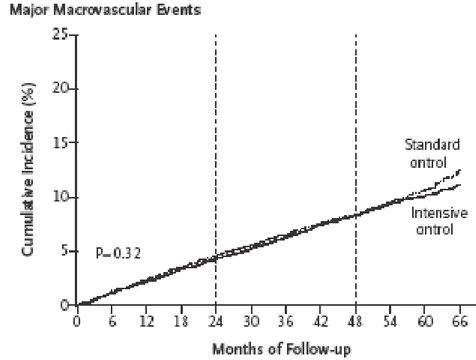
anamnesi positiva per precedenti eventi macrovascolari o microvascolari, o in alternativa con almeno un fattore di rischio cardiovascolare documentabile. I risultati ottenuti sono stati confrontati con quelli visti su di un gruppo di pazienti sottoposti a trattamento ipoglicemizzante tradizionale e con un target di Hb1ac sotto il 7%. E’ stata dimostrata una riduzione del 10 % in termini di rischio relativo di eventi macro e micro vascolari in pazienti sottoposti a controllo metabolico intensivo, tuttavia il peso maggiore in questa percentuale è stato attribuito alla riduzione del rischio di nefropatia diabetica (stimato al 21%). Andando invece ad analizzare i dati separatamente per quanto riguardava gli eventi cardiovascolari, non è stata trovata in realtà alcuna correlazione significativa. Non è inoltre stato rilevato che gli effetti del trattamento glicemico intensivo fossero dipendenti dai valori di partenza di Hb1ac, né da altri fattori come sesso, età o precedenti eventi cardiaci. Infine non sono state rinvenute significative differenze fra i due gruppi relativamente al tasso di mortalità generale e a quello relativo ad eventi cardiovascolari (51). The Action to Control Cardiovascular Risk in Diabetes (ACCORD) è un altro studio(53) specificamente designato per stimare se una terapia ipoglicemizzante che tende a valori normali di Hb1ac (inferiori al 6%) possa ridurre la percentuale di complicanze cardiovascolari in una popolazione diabetica di tipo 2 a confronto con una strategia terapeutica volta a ottenere livelli di Hb1ac tra il 7 ed il 7.9%. In questo studio sono stati arruolati pazienti diabetici di tipo 2 di età compresa fra 40 e 79 anni e con anamnesi positiva per eventi cardiaci, o in alternativa per vasculopatia periferica, albuminuria o ipertrofia ventricolare sinistra. Nel gruppo di pazienti con trattamento intensivo è stato documentato un incremento del tasso di mortalità del 22% a confronto con pazienti sottoposti a trattamento convenzionale, corrispondente ad un incremento assoluto della mortalità dell’1%. Questo valore corrisponde ad una morte in più ogni 95 pazienti durante un follow-up di 3.5 anni. Queste differenze in termini di mortalità emergono in un lasso di tempo compreso fra
29
1 e 2 anni a partire dal follow-up, mentre a partire da tre anni dall’inizio di questo si osserva un decremento della mortalità, suggerendo che un ipotetico beneficio di un controllo glicemico intensivo potrebbe emergere a distanza di diversi anni di terapia, mentre nei primi anni vi sarebbe un aumentato rischio di morte per eventi cardiovascolari (53), confermando precedenti dati del University Group Diabetes Program che avevano posto l’attenzione sull’aumento dei tassi di mortalità in un gruppo di pazienti che ricevevano sulfaniluree come terapia ipoglicemizzante (54). A causa di questi risultati, nel braccio dei pazienti sottoposti a stretto controllo lo studio è stato interrotto nel Febbraio 2008 con 17 mesi di anticipo ed ancora non sono chiari i motivi di questa aumentata mortalità, per spiegare la quale saranno necessari ulteriori studi prospettici (53).
In sostanza sia l’ADVANCE che l’ACCORD hanno suggerito che valori di glicemia prossimi alla norma non riducono gli eventi cardiovascolari nel breve periodo.
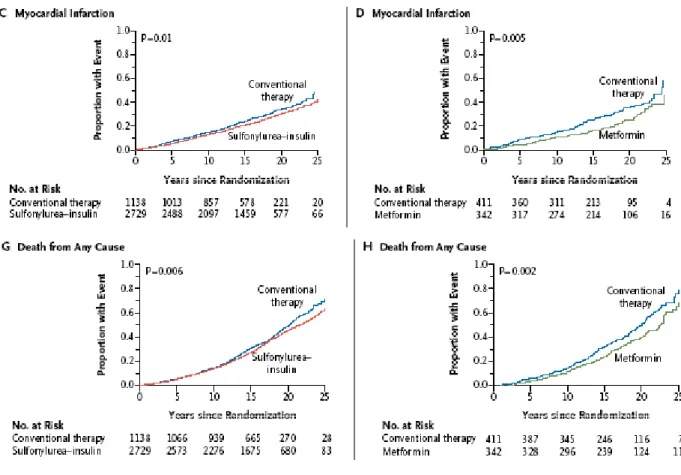
Recentemente sono stati forniti i risultati di un ampio studio sui pazienti residui del UKPDS trial (47) terminato nel Settembre 1997. Questi pazienti sono stati nuovamente arruolatati in un programma di monitoraggio post-trial della durata di dieci anni. Nel gruppo di pazienti sottoposti a terapia ipoglicemizzante intensiva (sulfaniluree o insulina) durante il precedente trial, è stato sostanzialmente confermato il beneficio di un controllo glicemico stretto sullo sviluppo di complicanze microangiopatiche rispetto ai pazienti sottoposti a trattamento routinario, nonostante la rapida perdita di differenze in termini di emoglobina glicosilata nel corso del follow-up a 10 anni. Nei 10 anni del post-trial è però emersa anche una significativa riduzione del rischio di infarto acuto del miocardio (del 15%) e del rischio di morte generale (del 13%)., nonostante nel trial originario non fossero emerse differenze significative in termini di rischio di eventi macrovascolari fra i due gruppi di pazienti (54).
30
Fig. 6 Nella figura sono rappresentate graficamente le proporzioni di pazienti nel UKPDS che hanno sviluppato infarto del miocardio (C e D) e morti per qualsiasi causa (G e H), mettendo a confronto il gruppo sottoposto a terapia intensiva (sulfaniluree o insulina) con quello sottoposto a terapia convenzionale ed il gruppo trattato con metformina con quello trattato con terapia convenzionale.(Da N Engl J Med 2008;359).
31
Fig. 7 La figura rappresenta graficamente i valori di incidenza cumulativa relativa ad eventi macrovascolari e microvascolari rilevati nello studio dell’ADVANCE Collaborative Group (N Engl J Med 358;24,2008).
32
Allo stato attuale delle conoscenze non siamo quindi in grado di sapere con esattezza se un controllo glicemico ottimale porti dei benefici in termini di riduzione del rischio di eventi cardiovascolari, né se esista un target ideale di Hb1ac cui tendere in pazienti a rischio; risulta invece più chiaro il beneficio di un controllo glicemico ottimale nel prevenire complicanze di tipo microvascolare.
Il DM2 è responsabile di diverse complicanze a carico dell’apparato cardiovascolare, tutte riconducibili ad un incremento e ad un’accelerazione dell’aterosclerosi a livello dei grossi vasi (aorta, carotidi, femorali) e del circolo coronarico, aumentando così il rischio nel diabetico di infarto acuto del miocardio, ictus cerebri ed arteriopatia obliterante degli arti inferiori (58). In particolare l’aterosclerosi coronarica, responsabile della progressiva occlusione di uno o più vasi coronarici, è responsabile della maggior parte delle complicanze mortali legate al diabete. Gli studi istologici hanno dimostrato che le placche aterosclerotiche dei pazienti diabetici non sono qualitativamente differenti da quelle che invece si sviluppano nei vasi della popolazione generale. Ciò che è emerso è che in realtà nel diabetico tali placche insorgono più precocemente in termini di età, e con caratteri di maggior estensione e dimensioni, interessando anche i rami più distali. Infine è stato visto che le placche nel diabetico hanno maggiore tendenza all’ulcerazione ed alla instabilità (57).
Accanto all’aterosclerosi, nel DM2 esiste anche un danno a carico del microcircolo, responsabile in particolare della nefropatia e della retinopatia diabetica. Negli ultimi anni sono emersi sempre più indizi per affermare che esista anche una microangiopatia diabetica a carico del distretto coronarico, che indipendentemente dalla presenza di malattia aterosclerotica può entrare in gioco nella genesi della cardiopatia ischemica (58). Oltre a questo di recente è stato osservato come i pazienti con DM2 abbiano un rischio aumentato di sviluppare scompenso cardiaco rispetto alla popolazione generale, ipotizzando
33
così l’esistenza di una cardiomiopatia diabetica come entità nosologica indipendente dalla cardiopatia di tipo ischemico (59). Questa ultima osservazione si basa sulla constatazione che il diabete mellito possa essere responsabile di alterazioni a livello delle cellule miocardiche, causando alterazioni meccaniche che potrebbero esitare in disfunzioni diastoliche o sistoliche con successivo sviluppo di ipertrofia ventricolare (57).
DIABETE E ATEROSCLEROSI VASALE
Diversi studi effettuati in vitro, su modelli animali e sull’uomo, hanno suggerito vari meccanismi attraverso i quali l’iperglicemia cronica, che caratterizza il diabete mellito, possa favorire l’aterogenesi nelle arterie. E’ stato dimostrato come alte concentrazioni di glucosio possano incrementare l’espressione di NF-kb a livello nucleare (60)(61), e come questa attivazione a sua volta incrementi l’attivazione di altri geni nelle cellule endoteliali, monocitiche e muscolari liscie. A seguito di esposizione ad alte concentrazioni di glucosio si formano i prodotti terminali di glicosilazione avanzata (AGEs), vale a dire proteine e lipidi glicati (60). La presenza e l’accumulo di AGEs nella cellula ne altera struttura e funzioni. Infatti AGEs provocano cross-legami irreversibili a livello delle proteine presenti nella parete dei vasi, portando a lungo andare ad un loro ispessimento e ad un aumento di permeabilità, con formazione di anomali depositi di proteine provenienti dal circolo ematico a livello degli strati sub-intimali della parete
(61). In aggiunta questi prodotti sono responsabili dell’attivazione di specifici recettori cellulari (RAGE), che a sua volta provoca una up-regulation di fattori di crescita, come il già citato (NF-kb), coinvolti nella risposta infiammatoria (64). E’ stato inoltre dimostrato che AGEs solubili sono in grado di attivare i monociti e di inibire l’azione dell’ Ossido Nitrico (NO) a livello endoteliale (64).
34
Altro meccanismo sospettato di essere coinvolto nella genesi dell’aterosclerosi nel DM2 è rappresentato dall’incrementato stress ossidativo mediato dalla glicemia, con possibili effetti dannosi a carico della parete dei vasi arteriosi. In particolare è stato osservato un ruolo dell’autoossidazione del glucosio nella produzione di particolari specie reattive dell’ossigeno (ROS), come l’anione superossido, responsabili in esperimenti in vitro dell’ossidazione di LDL (62). Evidenze indirette suggeriscono infatti la presenza di un aumento delle lipoproteine ossidate in pazienti con DM2 e di un loro legame con il controllo glicemico. Tuttavia molte di queste osservazioni si basano su analisi fatte con sistemi di rilevazione biochimica non specifici per prodotti reattivi dell’ossigeno, ed inoltre l’assenza di marcatori specifici di stress ossidativo nel collagene, nel plasma o nelle urine di pazienti con DM2 non depone per un incremento sistemico dei meccanismi ossidativi. Nonostante ciò resta valida l’ ipotesi riguardo ad un possibile ruolo dell’ossidazione e della glicosilazione non enzimatica nello sviluppo delle complicanze macrovascolari del DM2. Le vie biochimiche sospettate di essere coinvolte in questo meccanismo sono: generazione di Superossidi mitocondriali, aumentata produzione di NADPH nei macrofagi di derivazione monocitaria, alterato equilibrio red-ox con formazione di radicali idrossilici
(63). Infine a conferma del ruolo dell’iperglicemia nell’incrementare lo stress ossidativo nel metabolismo cellulare, studi sull’uomo hanno messo in relazione l’escrezione giornaliera di specifici indicatori di aumentata produzione di radicali liberi con le oscillazioni della glicemia in pazienti diabetici: ebbene l’escrezione urinaria nelle 24 ore di 8-isoprostaglandina F2 (un derivato dell’acido arachidonico prodotto dalla membrana cellulare in condizioni di stress ossidativo) era incrementato in pazienti diabetici di tipo 2 rispetto alla popolazione generale, e l’aumento era correlato alle escursioni glicemiche nel corso della giornata (62).
35
Fig. 8 La figura rappresenta in modo schematico i più importanti meccanismi patogenetici chiamati in causa per collegare la condizione di iperglicemia cronica e di insulinoresistenza che caratterizza il DM2 con lo sviluppo di aterosclerosi a livello vascolare.
La disfunzione endoteliale è ritenuta allo stesso tempo un precursore oltre che un effetto finale della aterosclerosi. Infatti accanto ad una ovvia funzione meccanica, l’endotelio svolge anche funzioni biologiche cruciali mediate da varie molecole biologicamente attive prodotte e rilasciate dalle cellule endoteliali. Fra queste funzioni troviamo la regolazione dell’adesione leucocitaria all’endotelio vasale, la regolazione di adesione e aggregazione piastrinica ed infine la regolazione del flusso ematico (65). La formazione di ROS e di AGEs, che abbiamo prima visto essere fortemente pro aterosclerotica, stimola anche l’espressione da parte endoteliale di citochine pro-infiammatorie, come IL-6 e fattore chemio tattico-1 monocitario, con
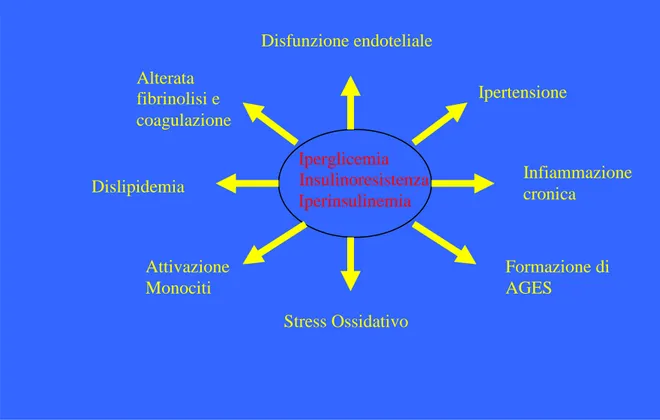
GLICEMIA E DISFUNZIONE ENDOTELIALE
Disfunzione endoteliale Iperglicemia Insulinoresistenza Iperinsulinemia Infiammazione cronica Stress Ossidativo Dislipidemia Formazione di AGES Attivazione Monociti Alterata fibrinolisi e coagulazione Ipertensione
36
conseguente azione favorevole verso l’adesione dei leucociti a livello endoteliale (66). In aggiunta l’incrementato stress ossidativo comporta anche una ridotta produzione di NO, riconducibile a degradazione di un cofattore (BH4) essenziale per il funzionamento di Nitrossido Sintasi Endogena (eNOS). Il deficit di NO ha un duplice effetto: favorisce da una parte l’adesione leucocitaria endoteliale, in quanto la produzione di NO comporta l’inibizione delle molecole di adesione, dall’altra altera quei meccanismi endotelio dipendenti di vasodilatazione locale che sono essenziali nella regolazione del flusso di sangue nei tessuti (60). Sulla alterata produzione di NO endogeno sembra che agisca anche la condizione di insulinoresistenza, sempre presente nel DM2 (65).
Di recente è stato ipotizzato un ruolo attivo del C-peptide nella regolazione della funzione endoteliale (67). C-peptide è una proteina cosecreta assieme all’insulina dalle beta-cellule pancreatiche a partire da un precursore comune, la Proinsulina, e i suoi valori risultano estremamente bassi nel sangue dei pazienti diabetici di tipo 1. Da sempre considerata come una molecola inerte, è stato di recente riportato come questa possa avere funzioni biologiche incrementando il flusso di sangue a livello del circolo muscolare, cutaneo e retinico; inoltre in pazienti con DM1 un ridotto flusso a livello coronarico può essere migliorato dal ristabilirsi di normali valori di C-peptide. E’ stato ipotizzato che il C-peptide possa avere una azione indiretta di tipo vasodilatante incrementando l’espressione endoteliale di NO (66).
Tanto alte concentrazioni di glucosio che di AGEs sono associate ad un incrementato stato di attivazione dei monociti del sangue, sia in vitro che in vivo (66). Sempre da questi studi è stato notato che monociti incubati in vitro con alte concentrazioni di glucosio risultano attivati in uno stato di
37
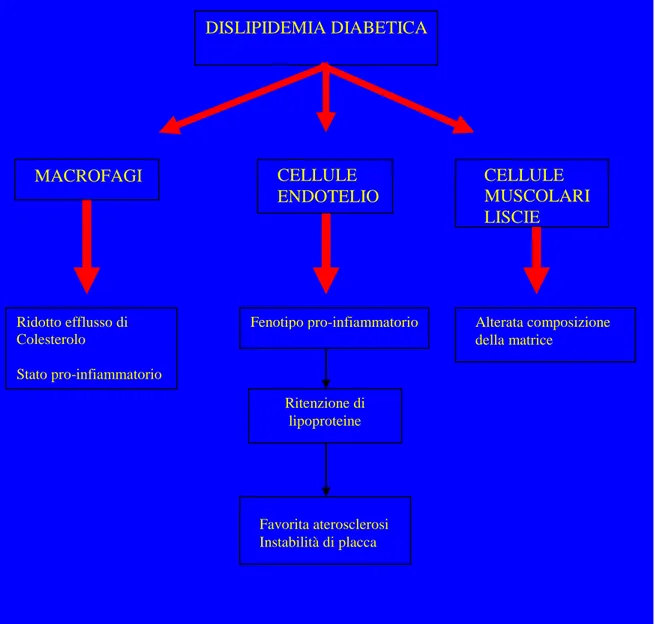
infiammazione cronica, dimostrato dall’aumentata espressione di citochine (IL-1 e IL-6) e CD 36, e gli stessi risultati si sono osservati anche in monociti isolati dal sangue di pazienti con un diabete scarsamente controllato (69). Questi cambiamenti pro infiammatori a carico dei monociti sembrano siano correlati in vivo con attivazione della via cellulare della Protein Chinasi C (PKC), con l’attivazione del fattore di trascrizione NF-kb ed infine con l’aumentata produzione di anioni superossidi (62). Queste tre vie sono tutte a loro volta riconducibili a una condizione di stress ossidativo da iperglicemia cronica. I monociti attivati entrano in gioco nella patogenesi delle placche aterosclerotiche penetrando gli spazi endoteliali sotto lo stimolo di fattori chemio tattici, proliferando e differenziandosi in macrofagi dentro la parete vasale. L’accumulo di macrofagi a livello intimale nella parete vascolare è stato ripetutamente osservato nei diabetici. La presenza di valori alterati di glicemia ripetuti nel tempo non basterebbero però a spiegare questo anomalo accumulo di macrofagi nelle lesioni aterosclerotiche: a questo processo sembra infatti partecipare la dislipidemia secondaria a diabete, che stimola la proliferazione intimale dei macrofagi probabilmente mediante meccanismi mediati dalla ossidazione glucosio dipendente delle particelle LDL (62).
Alte concentrazioni di glucosio sono in grado di stimolare la proliferazione di cellule muscolari lisce vasali in vitro (62). Alla progressione dell’ aterosclerosi, le cellule muscolari lisce della tonaca media migrano verso la tonaca intima ove proliferano e generano fattori di crescita, partecipando così allo sviluppo del cappuccio fibroso aterosclerotico. Inoltre simili risultati si sono visti dopo l’esposizione di cellule muscolari lisce ad alte concentrazioni di AGEs e di Insulina (62). E’ noto che le cellule muscolari lisce dei vasi arteriosi producono diverse molecole della matrice extracellulare che possono essere implicate
38
nell’aterogenesi (70). Ad esami istologici post-mortem è infatti stata rinvenuta nelle placche aterosclerotiche di pazienti con DM2 una aumentata presenza di condroitin solfato e dermatan solfato, a discapito di eparan solfato che è invece risultato essere ridotto a confronto con lesioni di non diabetici (71). Queste modificazioni potrebbero facilitare la ritenzione di particelle LDL a livello sub endoteliale, favorendo quindi lo sviluppo di aterosclerosi e di infiammazione cronica a livello vasale (62).
DISLIPIDEMIA DIABETICA E ATEROSCLEROSI
La dislipidemia secondaria a diabete mellito è fortemente correlata allo sviluppo di aterosclerosi nei vasi arteriosi.
Sebbene in molti casi non vi sia un sostanziale incremento della concentrazione di colesterolo LDL nel siero dei pazienti diabetici di tipo 2, l’uso delle statine (farmaci ipolipemizzanti per eccellenza con spiccato effetto sulle particelle LDL) resta un punto fermo terapeutico nella gestione del rischio cardiovascolare in questa tipologia di pazienti. L’uso di tali farmaci si è infatti dimostrato efficace nel ridurre il rischio di complicanze cardiovascolari del 20-50 % nei diabetici di tipo 2 (70), anche se in questi pazienti permane un eccesso di rischio aggiuntivo se confrontati con la popolazione non diabetica a parità di condizioni (62). Una parte di questo eccesso di rischio è stato spiegato ipotizzando la presenza di anomalie nelle particelle lipoproteiche dei diabetici di tipo 2 che evidentemente non possono essere migliorate dalla terapia con statine (62).
La dislipidemia diabetica è caratterizzata dalla presenza di incrementati livelli ematici di lipoproteine ricche di trigliceridi, da ridotti livelli di particelle HDL e dalla anomala dimensione e composizione di LDL e HDL.
39
RUOLO DELLE PARTICELLE RICCHE DI TRIGLICERIDI
Le particelle lipoproteiche ricche di trigliceridi, che possono risultare incrementate nel post-prandiale oppure a digiuno, sono le VLDL, i metaboliti delle VLDL ed infine i cosiddetti chilomicroni remnants. Il ruolo di queste particelle nella aterosclerosi diabetica resta controverso. Si è visto infatti che il tasso di trigliceridi nel sangue varia in maniera inversa con la concentrazione di HDL, e questo avendo le HDL un ruolo anti-aterogeno crea un fattore di confondimento nell’attribuire un ruolo ai trigliceridi nella aterogenesi (73). A tale proposito è stato comunque ipotizzato un ruolo della trigliceridemia post-prandiale nel sangue come fattore predittivo di eventi cardiovascolari, indipendentemente dai livelli di HDL (74). Un ruolo proaterogenico a livello della parete dei vasi è stato del resto dimostrato per lipoproteine ricche in trigliceridi da esperimenti in vitro: queste particelle lipoproteiche porterebbero ad un incrementato stato pro infiammatorio di macrofagi e cellule endoteliali, oltre che ad apoptosi di queste ultime (63). Tutto ciò sarebbe riconducibile ad una incrementata espressione di TNF-alfa e di recettori di adesione a livello dei macrofagi, con il risultato di favorire l’adesione endoteliale di monociti e macrofagi derivati dai monociti. Inoltre i chilomicroni remnants e le particelle lipoproteiche ricche in trigliceridi favoriscono l’infarcimento lipidico dei macrofagi a livello della placca aterosclerotica, e l’inattivazione dei recettori VLDL nei macrofagi di modelli animali comporta un arresto nello sviluppo dell’ aterosclerosi (62).
Sebbene nei diabetici di tipo 2 non vi sia un sostanziale aumento della concentrazione ematica di colesterolo LDL, a parità di concentrazione di LDL nel siero di questi pazienti generalmente è osservabile un aumento numerico
40
di particelle LDL, riconducibile alla presenza di lipoproteine più piccole, più dense e più povere in contenuto lipidico se paragonate alle lipoproteine dei pazienti non diabetici. Poiché ogni particella LDL contiene una singola molecola di apolipoproteina B, ne consegue che nei diabetici di tipo 2 vi sarà un parallelo aumento sierico della concentrazione di apolipoproteina B, che rappresenta quindi una misura indiretta delle anomalie delle LDL nel diabetico. Una questione ancora aperta è se queste particelle LDL piccole e dense tipiche del DM2 siano o meno maggiormente aterogene rispetto alle LDL normali dei non diabetici. Relativamente a questo quesito una incrementata aterogenicità di LDL piccole e dense è supportata dalle evidenze di studi in vitro, che hanno dimostrato come queste possano penetrare più facilmente la parete vasale e come possano avere effetti maggiormente tossici rispetto a quelle normali, causando il rilascio di maggiori quantità di mediatori pro coagulanti; inoltre è stato dimostrato che sono più facilmente ossidabili e più facilmente intrappolabili nella placca aterosclerotica ad opera dei proteoglicani (75). Sembra poi che particelle LDL piccole e dense leghino meno facilmente ai recettori LDL espressi a livello epatico e questo potrebbe portare ad una loro difettosa clereance (76). Resta ancora molto da capire su come trasporre questi interessanti risultati in vitro su modelli in vivo, in quanto ancora non è a disposizione dei ricercatori un modello vivente su cui testare gli effetti proaterogeni di LDL piccole e dense. Negli studi effettuati sull’uomo, pur essendo stata osservata chiaramente la presenza di LDL alterate, ancora non è stato dimostrato un maggiore effetto proaterogeno di queste rispetto alle LDL normali (62).
Individui affetti da DM2 hanno una ridotta concentrazione ematica di colesterolo HDL e di Apolipoproteina AI circolante, la quale è la principale
41
particella apoproteica espressa dalle HDL. Inoltre nei diabetici sono state rinvenute anomalie di dimensioni e composizione anche per le HDL. La funzione di HDL e Apolipoproteina AI è quella di rimuovere l’eccesso di colesterolo dalle placche aterosclerotiche. Le cellule di maggior interesse in questo ambito sono i macrofagi di derivazione monocitaria, i quali nelle placche aterosclerotiche risultano ripieni di esteri di colesterolo assumendo un aspetto “schiumoso” al microscopio elettronico (foam cells). La rimozione di colesterolo in eccesso dai macrofagi delle placche è un importante meccanismo di protezione dallo sviluppo di aterosclerosi e quindi da eventi cardiovascolari clinicamente significativi, e le particelle di colesterolo HDL assieme all’apolipoproteina AI hanno un ruolo fondamentale in questo meccanismo. Sembra che le HDL agiscano su trasportatori G1 ATP dipendenti espressi sulla membrana dei macrofagi, la cui attivazione favorirebbe l’efflusso di esteri di colesterolo all’esterno della cellula. Nel diabetico l’espressione di questo recettore G1 potrebbe essere inibita a causa della presenza di elevate concentrazioni di proteine glicosilata. Inoltre la glicosilazione non enzimatica della apoproteina AI potrebbe ostacolare l’azione di HDL a livello delle placche (76). L’osservazione che in pazienti diabetici con bassi livelli ematici di HDL siano isolabili macrofagi di derivazione monocitaria con un fenotipo pro infiammatorio porta ad ipotizzare un plausibile effetto antiossidante ed antinfiammatorio delle HDL
(62).
In aggiunta a tutto questo, in pazienti diabetici di tipo 2 sono state isolate HDL con una alterata composizione. L’insieme di tutte queste osservazioni depongono per un ruolo cruciale delle HDL nel proteggere dall’insorgenza di placche di tipo aterosclerotico nella parete dei vasi arteriosi e quindi nel proteggere il paziente da malattia cardiovascolare, facendo ipotizzare che le modificazioni delle HDL possano essere il meccanismo più importante nella genesi delle temute complicanze vascolari e cardiache nella popolazione
42
diabetica (62). In esperimenti in vitro è stata infatti dimostrata una ridotta azione antiaterogena delle particelle HDL del paziente diabetico, dimostrando una difettosa rimozione di colesterolo dalle cellule per particelle HDL piccole. Sempre in vitro una alterata composizione delle HDL con ridotta espressione di paroxonasi (azione antiossidante) potrebbe modificare questa azione anti-aterosclerotica.
Da studi su modelli animali è stato visto che topi privi di apoproteina AI e con bassi livelli di HDL presentano maggiore insorgenza di placche aterosclerotiche nei vasi arteriosi, a causa di una difettosa rimozione di esteri di colesterolo e di un incremento dello stato infiammatorio. Viceversa in modelli murini Apolipoproteina E-/- (modello di accelerata aterosclerosi in vivo), l’incrementata espressione di apoproteina AI associata ad alti livelli di colesterolo HDL riduce l’insorgenza di placche (62).