Dipartimento di Medicina Clinica e Sperimentale Dipartimento di Patologia Chirurgica, Cedica,
Molecolare e dell’Area Critica
Dipartimento di Ricerca Traslazionale e delle Nuove Tecnologie in Medicina
Corso di Laurea Specialistica in Medicina e Chirurgia
Valutazione TC della biometria dell’annulus aortico
nel paziente candidato all’intervento di sostituzione
percutanea della valvola aortica:
misurazione delle variazioni dimensionali durante
l’intero ciclo cardiaco con ECG-gating retrospettivo
Candidato Relatore
Stefano ATZORI Chiar.mo Prof. Carlo BARTOLOZZI
“ No mj legga chi non e matematicho nelli mja principj” (“Non lasciar leggere i miei principi a nessuno che non sia un matematico”)
1. Riassunto analitico
La stenosi aortica è la più comune patologia delle valvole cardiache. Con l’incremento dell’età media della popolazione, è aumentata notevolmente l’incidenza della stenosi aortica sclerocalcifica senile. Nell’ottica di ridurre l’invasività dei trattamenti di sostituzione della valvola nei pazienti ad elevato rischio chirurgico, è stata introdotta una nuova tecnica di sostituzione percutanea della stessa, denominata TAVI (Transcatheter Aortic Valve Implantation). Tale procedura non può prescindere da un accurato studio di imaging del cuore e dei siti d’accesso del catetere. In particolare, la struttura anatomica di riferimento per la scelta della protesi più appropriata è l’annulus aortico, ovvero la linea che congiunge i punti più bassi di inserzione delle semilune valvolari. Sebbene l’indagine standard per la sua misurazione sia ancora l’ecocardiografia transesofagea, attualmente molti ritengono che la TC sia superiore ad essa. Gli studi in letteratura riportano una riduzione delle dimensioni dell’annulus aortico in diastole ed un loro aumento in sistole, fase in cui l’annulus tende anche a divenire più circolare. Il parametro dimensionale dell’annulus che sembra variare meno durante il ciclo cardiaco è il perimetro. Tali variazioni sarebbero inoltre maggiori nei pazienti sani rispetto a quelli affetti da stenosi aortica.
Lo scopo di questa tesi è lo studio, mediante TC, dell’annulus aortico durante tutto il ciclo cardiaco, dimostrando che esso non è una struttura stabile, ma modifica ciclicamente la propria morfologia.
Quattordici pazienti affetti da stenosi aortica severa (gruppo TAVI) e dieci pazienti con sospetta CAD (controllo) sono stati sottoposti ad angiografia coronarica TC (TC spirale ECG-gated). Per ciascun esame le immagini sono state ricostruite ad intervalli incrementali del 10% durante il ciclo cardiaco (fasi da 0 a 9, partendo dalla telediastole), generando un dataset TC 4-D. Per individuare il piano su cui giace l’annulus aortico sono state eseguite ricostruzioni MPR passanti per i punti inferiori di inserzione delle semilune valvolari. Per ciascuna fase ECG-gated sono stati misurati: diametro massimo, diametro minimo, diametro medio, indice di sfericità, area trasversa e perimetro dell’annulus aortico, annotando le percentuali di variazione tra i valori estremi di ciascun parametro.
Abbiamo osservato che nei pazienti candidati a TAVI l’annulus risulta più grande in telediastole e più piccolo in sistole e protodiastole. Esso, studiando le variazioni dell’indice di sfericità, appare altresì più circolare in sistole che in diastole. Il perimetro è la variabile che sembra rimanere più stabile durante il ciclo cardiaco nel gruppo di pazienti candidati a TAVI.
Sommario
1.
1. Riassunto analitico ... 3
Sommario ... 4
2. Introduzione ... 6
3. Anatomia della valvola aortica e della radice aortica ... 8
4. Stenosi aortica ... 14 4.1 Epidemiologia ... 14 4.2 Eziologia e patogenesi ... 15 4.3 Fisiopatologia ... 18 4.4 Manifestazioni cliniche ... 21 4.5 Diagnosi strumentale ... 23 4.6 Trattamento ... 27
5. Sostituzione percutanea della valvola aortica (TAVI/TAVR) ... 35
5.1 Selezione dei pazienti ... 35
5.2 Studio anatomico dell’annulus aortico, dell’aorta e degli accessi vascolari ... 37
5.3 Scelta dell’accesso vascolare e descrizione della procedura ... 38
5.4 Tipologie e dimensioni delle protesi. ... 40
5.5 Scelta della protesi più appropriata ... 41
5.6 Complicanze vascolari ... 42
5.7 Prospettive future ... 47
6. Ruolo della TC nella procedura TAVI ... 48
6.1 Tecnica di acquisizione delle immagini TC. ... 48
6.2 Valutazione del sito di accesso. ... 52
6.3 Caratteristiche TC predittive di danno vascolare. ... 52
6.4 Processing e valutazione dell’immagine. ... 53
6.5 Studio del ventricolo sinistro e della parete toracica ... 54
6.6 Studio dell’aorta ... 55
6.7 Studio dell’annulus aortico. ... 55
6.8 Scelta della protesi. ... 58
6.9 Altri parametri della radice aortica. ... 59
6.10 Identificazione del piano dell’annulus aortico in preparazione della fluoroscopia. ... 60
6.11 Calcificazione della valvola aortica. ... 62
6.12 Ruolo della TC nel periodo post-TAVI ... 63
7. Variazioni dimensionali dell’annulus aortico durante il ciclo cardiaco ... 65
9. Scopo della tesi ... 67
11. Risultati ... 71
12. Discussione ... 75
13. Ringraziamenti ... 78
2. Introduzione
La stenosi aortica è la più comune valvulopatia cardiaca, e si stima che colpisca oltre il 5% degli ultrasettantacinquenni. Sebbene essa abbia un’incidenza nettamente inferiore alle patologie coronariche, tuttavia, con la costante crescita dell’età media ed il conseguente aumento dei pazienti anziani con gravi comorbilità, il suo trattamento costituisce ad oggi un problema tutt’altro che irrilevante dal punto di vista medico e chirurgico[1].
Nel 2002, Alain Cribrier fu il primo ad eseguire un intervento di sostituzione percutanea della valvola aortica (TAVI, Trancatheter Aortic Valve Implantation). Questa tecnica ha permesso di evitare la chirurgia invasiva tradizionale di sostituzione della valvola aortica in pazienti anziani o gravemente debilitati, nei quali il rischio chirurgico sarebbe eccessivo [2]. Diversi fattori hanno fatto sì che la TAVI sia diventata sicura e affidabile, primo fra tutti la maggiore attenzione alla complessa anatomia della valvola aortica e delle strutture viciniori, necessaria per una corretta selezione delle valvole protesiche onde evitare le complicanze del prosthesis-patient mismatch [3]. In secondo luogo, una corretta pianificazione dell’intervento, mediante l’accurata scelta del sito d’accesso del catetere, ha permesso di evitare una lunga serie di complicanze vascolari, purtroppo molto frequenti in pazienti come questi, in cui lo stato dell’albero arterioso è spesso reso pessimo dalla presenza di aterosclerosi e calcificazioni importanti [4].
Tutto ciò non sarebbe stato possibile se non vi fosse stato un parallelo sviluppo delle tecniche di imaging, in particolare della TC. Sebbene tuttora le linee guida in materia si basino ancora su dati ecocardiografici, gli studi più recenti indicano come l’utilizzo delle tecniche di immagine tridimensionali, e principalmente la tomografia assiale computerizzata (TC), consenta di migliorare sensibilmente l’outcome clinico a breve e a lungo termine di questi pazienti e di evitare le complicanze di una scelta errata della protesi endovascolare [4, 5, 6]. Il progresso della TC, che le ha consentito di acquisire un ruolo importante anche nello studio del cuore, è da accreditare all’introduzione delle nuove tecnologie ad elevato numero di file di detettori nelle strumentazioni TC spirale ed ai nuovi algoritmi di cardiosincronizzazione e ricostruzione delle immagini. Per la TCMS, come per la RMN, il principale ostacolo da superare nell’acquisizione delle immagini del cuore è costituito dalla pulsazione cardiaca. Ciò è evitabile usando le tecniche ECG-gated, ovvero concentrando l’acquisizione delle immagini in determinati intervalli del ciclo cardiaco [7].
La struttura-target principale per la scelta della protesi più appropriata è l’annulus aortico, anello virtuale ottenuto dalla congiunzione dei punti più bassi di inserzione delle semilune della valvola aortica (“hinge points”) [3,4]. Questa struttura non è fissa, ma durante il ciclo cardiaco subisce variazioni dimensionali significative; gli studi in letteratura indicano un
aumento dei suoi diametri durante la sistole, per poi diminuire in diastole [8]. Lo scopo di questa tesi è lo studio di queste variazioni dimensionali durante l’intero ciclo cardiaco, utilizzando la TC con ECG-gating retrospettivo.
Per completezza espositiva, dopo aver trattato l’anatomia della valvola aortica, sarà fatta una panoramica sulla stenosi aortica, con particolare riguardo al suo trattamento mediante TAVI e alle indagini strumentali che consentono una buona riuscita della procedura.
3. Anatomia della valvola aortica e della radice aortica
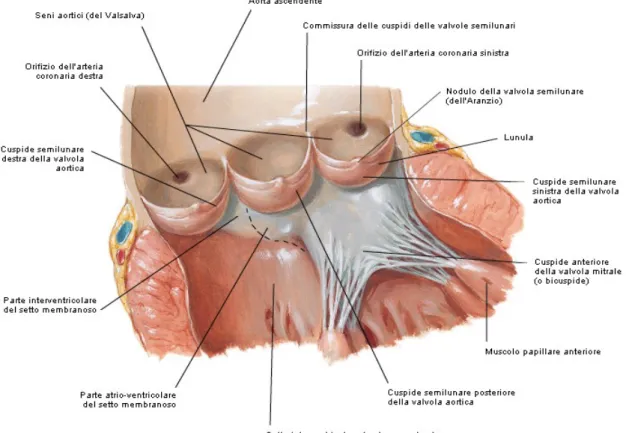
La valvola aortica è la valvola arteriosa semilunare (o a nido di rondine) posta fra il ventricolo sinistro ed il grosso vaso che da esso origina, l’arteria aorta; per la precisione essa separa la porzione d’efflusso del ventricolo sinistro (LVOT, Left Ventricle Outflow Tract) dal bulbo aortico con i seni aortici di Valsalva, da cui originano le arterie coronariche. Come tutte le valvole cardiache, essa è situata a livello del piano valvolare, una struttura disposta non trasversalmente ma obliqua in avanti, in basso e a destra, corrispondente alla giunzione atrioventricolare, che è rappresentata sulla superficie esterna del cuore dal solco atrioventricolare o coronarico. Su tale piano, comprendente lo scheletro fibroso del cuore, sono collocate in senso anteroposteriore le valvole polmonare, aortica, mitrale e tricuspide [9]. A parte questa grossolana descrizione, la valvola aortica è in realtà inserita in un contesto anatomico molto più ampio e complesso, ed è preferibile piuttosto parlare di complesso valvolare aortico e di radice aortica. Questa rappresenta la diretta continuazione del LVOT, e si trova posteriormente ed a destra rispetto all’infundibolo polmonare, con il suo margine posteriore situato tra l’orificio mitralico e la parte muscolare del setto interventricolare. Essa si estende dalla base di attacco delle semilune aortiche all’interno del ventricolo sinistro fino alla giunzione sinotubulare. Le componenti della radice aortica sono (1) le semilune valvolari, (2) i triangoli interleaflet e (3) i seni del Valsalva [3].
1. Le valvole semilunari, aortica e polmonare, hanno un’organizzazione tutto sommato semplice se paragonata a quella delle valvole atrioventricolari. Esse sono costituite da tre pieghe membranose a tasca (semilune) situate in corrispondenza della giunzione tra la porzione di afflusso di ciascun ventricolo e l’origine della rispettiva arteria, laddove esiste un anello fibroso che circonda l’orifizio arterioso. Ciascuna semiluna presenta (Fig 3.1):
- un margine aderente, che s’impianta sull’anello fibroso; - un margine libero, che sporge nel lume del vaso;
- una faccia superiore concava rivolta verso l’arteria:
- una faccia inferiore convessa che guarda verso la cavità ventricolare.
Fig. 3.1. Anatomia e istologia del complesso
valvolare aortico a livello della giunzione ventricolo arteriosa anatomica. Notare che l’inserzione basale delle semilune aortiche al miocardio ventricolare è inferiore rispetto alla giunzione anatomica
I margini delle tasche sono aderenti l’uno all’altro, formando delle commissure.
La valvola aortica presenta tre tasche semilunari: due anteriori (semilune destra e sinistra) e una posteriore. Le due semilune anteriori, destra e sinistra, che si affrontano con le due corrispondenti semilune posteriori della valvola polmonare, sono denominate anche semilune coronariche, in quanto subito al di sopra di esse hanno origine, dai rispettivi seni aortici di Valsalva, le arterie coronariche destra e sinistra. Per questo motivo, la semiluna posteriore è anche denominata semiluna non coronarica [9]. L’origine delle semilune dalle strutture di supporto del ventricolo sinistro, dove le componenti ventricolari danno origine alle pareti fibroelastiche dei seni aortici, demarca la giunzione ventricoloarteriosa anatomica. I punti in cui si attaccano i margini aderenti delle semilune (“hinge points”) sono comunque ben al di sotto della giunzione ventricoloarteriosa [3].
Strutturalmente ciascuna semiluna è costituita da una lamina fibrosa rivestita sulle due facce da endocardio: quello che riveste la faccia convessa prosegue nell’endocardio che tappezza la cavità ventricolare, mentre quello che riveste la faccia concava continua nella tonaca intima dell’aorta nel caso della valvola aortica. La lamina fibrosa presenta un ispessimento nodulare in corrispondenza del punto di mezzo del margine libero, detto nodulo di Aranzio nella valvola aortica. Quando la valvola si chiude i noduli delle tre semilune si incontrano, rendendo più completa la chiusura. Come per le valvole ventricolari, anche nelle valvole arteriose la linea di chiusura non corrisponde esattamente al margine libero, ma a una linea situata sulla faccia convessa a pochi millimetri dal margine libero: fra questo’ultimo e la linea di chiusura ciascuna tasca appare molto sottile (lunula) e, occasionalmente, può presentare delle fenestrature senza che sia compromessa la funzionalità valvolare [9].
Al pari delle valvole atrioventricolari, le valvole semilunari non sono vascolarizzate, ma l’endocardio che le riveste e i fibroblasti contenuti nella lamina fibrosa sono riforniti di ossigeno e nutrienti direttamente dal sangue che bagna la valvola [9].
La particolare organizzazione anatomica delle valvole semilunari consente il passaggio del sangue dal ventricolo al grosso vaso corrispondente durante la sistole ventricolare, in quanto i margini delle tasche si allontanano tra loro; quando il gradiente pressorio si inverte, cioè durante la diastole ventricolare, le tasche si dispiegano sotto la pressione ed il peso del sangue contenuto nel grosso vaso, chiudendosi ermeticamente ed impedendo il reflusso di sangue all’interno del ventricolo; d’altra parte la particolare robustezza strutturale delle semilune impedisce di norma il loro ribaltamento verso la cavità ventricolare, rendendo superfluo un sistema di ancoraggio [9].
Per quanto riguarda la valvola aortica, a causa dello stretto rapporto di vicinanza esistente tra essa e la valvola mitralica (Fig. 3.2), nel ventricolo sinistro non esistono strutture anatomiche di delimitazione fra porzione di afflusso e porzione di efflusso paragonabili alla
cresta sopraventricolare e alla trabecola settomarginale del ventricolo destro, essendo la superficie del setto interventricolare in questa porzione quasi del tutto liscia; solamente la cuspide anteromediale della valvola mitralica costituisce una sorta di tendina interposta fra le due porzioni. Tale concetto è fondamentale nello studio della biometria dell’annulus aortico, in quanto lo stretto rapporto tra le valvole bicuspide e aortica fa sì che quest’ultima subisca delle modificazioni conformazionali importanti durante le diverse fasi del ciclo cardiaco che non hanno eguali in nessun’altra valvola cardiaca [3,8].
La valvola aortica, circondata dal proprio anello fibroso, è incastonata nello scheletro fibroso del cuore ed è posta proprio al centro del piano valvolare, in contiguità con tutte le altre valvole (Fig. 3.3). Circa 2/3 della circonferenza della parte inferiore della radice aortica danno origine a fasci muscolari ventricolari, mentre il rimanente 1/3 (corrispondente alla
maggior parte del margine aderente della semiluna non coronarica e parte di quello della semiluna sinistra è connesso, mediante il trigono fibroso sinistro) è strettamente connesso, mediante il trigono fibroso sinistro, alla cuspide anteromediale (aortica) della valvola mitralica. Ciò determina un importante rapporto anatomico e funzionale tra le due valvole, tanto che si parla anche di “unità aorto – mitralica” [9]. La valvola aortica è unita posteriormente alla valvola tricuspide mediante il trigono fibroso destro, saldamente ancorato all’anello fibroso aortico. La valvola aortica è invece connessa con la valvola polmonare solo mediante una sottile striscia fibrosa che connette la commissura fra le due semilune polmonari posteriori e la semiluna aortica destra (tendine del cono). Dagli anelli fibrosi si dipartono delle lamine connettivali che penetrano nelle semilune valvolari, costituendo quindi un valido sistema di sostegno per queste. La semiluna destra non è connessa allo scheletro fibroso, ma il suo anello dà diretta inserzione ai fasci muscolari del LVOT; tali fasci si attaccano anche a parte del tratto di anello fibroso che circonda la semiluna sinistra [9].
È importante accennare ai rapporti esistenti fra la valvola aortica e il fascio atrioventricolare del sistema di conduzione del cuore (Fig. 3.4). Esso attraversa il trigono fibroso destro per portarsi poi sul lato destro del setto membranoso e quindi dividersi nelle sue due branche, destra e sinistra; questa struttura è dunque particolarmente vicina alla regione subaortica e al setto membranoso del LVOT [9]. Ciò spiega il possibile sviluppo di anomalie della condizione atrioventricolare, fino al BAV completo, per un danneggiamento di questa struttura in seguito all’intervento di TAVI [10].
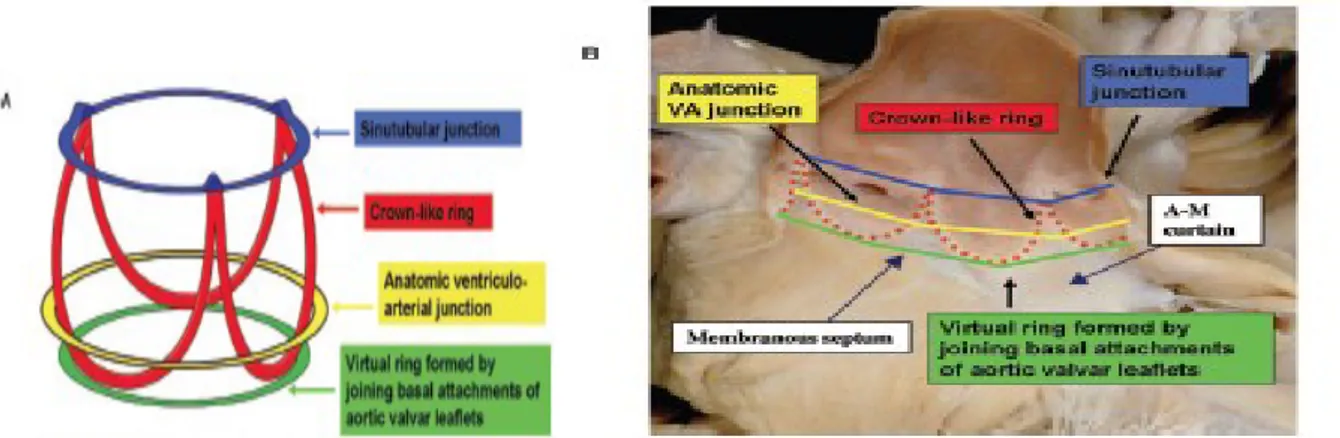
Anelli all’interno della radice aortica. Letteralmente, un “annulus” non è niente di più di un
piccolo anello. Esistono diversi “anelli” anatomici all’interno di questa regione, ma non tutti corrispondono a strutture anatomiche discrete. La radice aortica contiene 1 anello a forma di corona e almeno 3 anelli circolari (Fig. 3.5):
• L’anello a forma di corona (in rosso in figura) è una struttura tridimensionale, costituita dalle linee di attacco delle semilune valvolari.
• La base della corona forma un anello virtuale (in verde in figura), ottenibile unendo i punti più bassi di attacco delle semilune (“hinge points”). Questo anello, l’annulus aortico, è dunque una struttura virtuale (anello virtuale basale, “virtual basal ring”). Esso di fatto costituisce il punto di passaggio tra il LVOT e la radice aortica, e rappresenta la struttura su cui è incentrata la presente trattazione.
• La linea di attacco delle semilune incrocia un terzo anello “reale”, la giunzione ventricoloarteriosa anatomica (in giallo in figura).
• L’ultimo anello, la giunzione sinotubulare (in blu in figura) è invece ottenibile congiungendo tra loro gli apici dell'anello a forma di corona; tale linea rappresenta il passaggio tra i seni di Valsalva e l’aorta ascendente [3].
Fig. 3.4 Rapporti tra il sistema di
conduzione del cuore e il complesso valvolare aortico
Fig. 3.5. A. Rappresentazione schematica tridimensionale dell’annulus aortico, mostrante i 3 anelli circolari e
l’anello a forma di corona. B. Dopo aver rimosso i lembi valvolari ed aperto la radice aortica, vengono mostrati i 4 anelli.
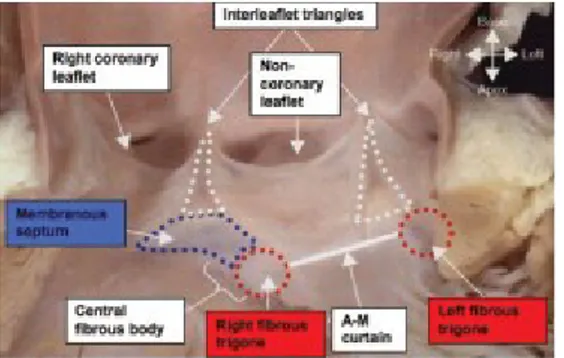
2. Come risultato della conformazione dell’attacco delle semilune, vengono a formarsi tre estensioni triangolari del LVOT che si portano fino alla giunzione sinotubulare, denominati triangoli interleaflet (Fig. 3.6). Questi triangoli non sono formati da miocardio ventricolare ma dalla parete fibrosa assottigliata fra i seni di Valsalva. Le loro porzioni apicali rappresentano potenziali spazi di comunicazione con lo spazio pericardico o, per il triangolo interleaflet tra le semilune destra e sinistra, con il tessuto interposto tra l’aorta e l’infundibolo polmonare. I due triangoli interleaflet che circondano la semiluna non valvolare sono anche in continuità con i trigoni fibrosi, la valvola mitrale e il setto membranoso [3].
3. I seni di Valsalva sono delle dilatazioni della radice aortica poste subito al di sopra della valvola aortica. La loro conformazione permette la creazione di vortici di sangue durante la sistole ventricolare che impediscono alle semilune di venire a diretto contatto con la parete dell’aorta. Dai seni destro e sinistro originano rispettivamente l’arteria coronaria destra e il tronco comune, solitamente subito al di sotto della giunzione sinotubulare [9].
Fig. 3.6. Continuità fibrosa tra i triangoli interleaflet,
4. Stenosi aortica
La stenosi aortica (SA) è definita come l’ostruzione all’efflusso di sangue dal ventricolo sinistro all’aorta. Tale ostruzione è più comunemente localizzata a livello della valvola aortica (stenosi aortica valvolare), e sarà l’oggetto della presente trattazione. Più raramente, l’ostacolo può trovarsi al di sopra della valvola (stenosi sopravalvolare) o al di sotto di questa (stenosi sottovalvolare), oppure può essere causato da alcune forme di cardiomiopatia ipertrofica [1, 11].
4.1 Epidemiologia
La stenosi della valvola aortica è la più comune patologia valvolare cardiaca, interessando globalmente circa il 25% di tutti i pazienti con lesioni valvolari. Nei Paesi sviluppati colpisce prevalentemente soggetti anziani, a causa della degenerazione sclerocalcifica. Altra causa non rara di SA è la bicuspidia congenita, che si ritrova in circa l’1,4 % della popolazione; essa condivide comunque con la forma precedente la patogenesi degenerativa [1, 12]. In uno studio americano condotto su 933 pazienti sottoposti a sostituzione di valvola aortica (AVR, aortic valve replacement), una valvola bicuspide era presente in oltre il 50% dei pazienti, di cui i due terzi sotto i 70 anni e il 40% al di sopra dei 70 anni [13]. Ciò evidenzia come, al crescere dell’età, la forma degenerativa su valvola tricuspide diventa la forma più comune. In terzo luogo la forma reumatica, un tempo causa principale di SA, sta riducendo gradualmente la propria incidenza in virtù della prevenzione primaria della febbre reumatica in età pediatrica; attualmente ha un’incidenza molto bassa negli Stati Uniti e in Europa, mentre nei Paesi in via di sviluppo costituisce ancora la forma di gran lunga preponderante [1, 12].
Grazie al crescere della speranza di vita e dell’età media, l’incidenza della SA è in continua crescita per l’aumento parallelo della forma degenerativa senile. Attualmente quest’ultima, sia essa su valvola nativa bicuspide che tricuspide, è la principale causa di SA nell’adulto. In uno studio ecocardiografico, il 2% degli individui > 65 anni e oltre il 5% degli individui > 75 anni risultavano affetti da SA. Oltre a questo, circa il 30% degli ultrasessantacinquenni presenta una sclerosi valvolare e molti presentano un soffio sistolico eiettivo da stenosi aortica in assenza di ostruzione significativa all’efflusso [1, 11].
Circa l’80% dei pazienti affetti da SA senile è di sesso maschile.
La malattia si rende solitamente manifesta dal punto di vista sintomatologico intorno alla ottava-nona decade di vita in caso di SA degenerativa su valvola nativa tricuspide, mentre
nella stenosi degenerativa su valvola nativa bicuspide l’esordio dei sintomi è anticipato di circa 20 anni [1, 11, 12].
Per sottolineare l’importanza della patologia, specie dal punto di vista cardochirurgico, si consideri che due terzi degli interventi di chirurgia valvolare sono sostituzioni di valvole aortiche, e di questi la grande maggioranza sono impiegati nel trattamento della stenosi [1].
4.2 Eziologia e patogenesi
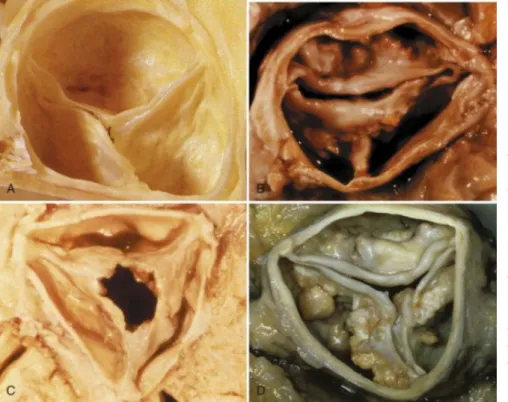
Come appena accennato, le cause principali di stenosi aortica valvolare sono principalmente 2: degenerativa senile (su valvola nativa tricuspide o bicuspide) e reumatica (Fig 4.1). Per completezza si menzionano anche le forme di stenosi valvolare congenita.
Stenosi aortica congenita: le valvole aortiche congenitamente malformate possono assumere morfologia unicuspide, bicuspide o tricuspide, o possono essere costituite da diaframmi cupoliformi. Si tratta di un’anomalia relativamente frequente, più comune nei maschi (rapporto M : F = 4:1). Le forme unicuspidi producono ostruzioni severe nell’infanzia e sono la causa principale di morte per malformazione valvolare nel lattante. La bicuspidia può essere associata a fusione congenita delle commissure valvolari alla nascita, ma raramente causa restringimenti valvolari severi durante l’infanzia; in alcuni casi può svilupparsi un rigurgito valvolare di entità tale da costringere alla chirurgia nella prima età adulta. Al contrario, la maggior parte di questi pazienti ha una normale funzionalità valvolare fino alla
Fig 4.1. Tipi principali di
stenosi aortica.A. Valvola aortica normale
B. Valvola aortica congenitamente bicuspide; notare il falso rafe a ore 6. C. Valvola aortica affetta da malattia reumatica cronica; sono presenti fusione delle commissure e un orifizio ristretto in posizione centrale D. Valvola aortica affetta da
stenosi aortica
tarda età adulta quando, a causa del notevole stress a cui è sottoposta la valvola malformata, questa va incontro a stenosi sclerocalcifica. In questa forma le semilune solitamente sono di dimensioni differenti e, in quella di dimensioni maggiori, è spesso presente un rafe mediano dovuto all’incompleta separazione delle semilune durante lo sviluppo; meno frequentemente i due lembi hanno uguali dimensioni e manca il rafe. Il rafe, che di fatto rappresenta la commissura incompleta, è la sede più frequente delle calcificazioni valvolari [1].
Stenosi aortica sclerocalcifica degenerativa (o senile): le valvole cardiache sono sottoposte a stress meccanici altamente ripetitivi, in particolare a carico delle cerniere delle semilune e dei lembi valvolari a causa (1) dei 40 milioni o più cicli cardiaci/anno; (2) della sostanziale modificazione tissutale ad ogni ciclo; (3) del gradiente pressorio transvalvolare, che si aggira sugli 80 mmHg per la valvola aortica e sui 120 mmHg per la valvola mitrale [12]. Non deve quindi sorprendere che queste strutture, piccole e delicate, soffrano di un danno cumulativo, complicato dalla formazione di depositi di calcio, che può portare ad una patologia clinicamente evidente, e che questo danno sia più evidente nelle valvole situate nella sezione sinistra del cuore, sottoposte a regimi pressori molto più elevati rispetto a quelle destre [12].
La sclerosi aortica rappresenta il primo stadio della malattia calcifica valvolare ed è associata, anche in assenza di ostruzione valvolare, ad un aumento del 50% del rischio di infarto acuto del miocardio (IMA) e di morte per cause cardiovascolari. La sclerosi aortica è definita come un ispessimento irregolare delle semilune valvolari, dimostrato mediante esame ecocardiografico, in assenza di stenosi significativa [11].
Sebbene un tempo fosse considerata il risultato di un normale stress meccanico a carico di valvole altrimenti normali, il concetto che si sta sviluppando attualmente è che il processo si associ a modificazioni proliferative e infiammatorie con accumulo di lipidi, iperattività dell’enzima convertente l’angiotensina (ACE), aumentato stress ossidativo e infiltrazione di macrofagi e linfociti T. Tutto questo porta a un accumulo di calcio con meccanismo simile, ma non identico, a quello delle calcificazioni vascolari [1]. La calcificazione progressiva, disposta inizialmente lungo le linee di attacco delle semilune, porta progressivamente ad una loro immobilizzazione. I margini liberi non sono invece generalmente coinvolti nel processo calcifico. Al contrario della forma reumatica, inoltre, non si verifica fusione delle commissure. Poiché la calcificazione inizia dalla base della semiluna, la tipica architettura microscopica stratificata non viene alterata [12].
La SA condivide fattori di rischio comuni con la calcificazione mitralica, e le due condizioni spesso coesistono. Sono stati individuati diversi polimorfismi genetici associati alla SA calcifica, tra cui i recettori della vitamina D, l’IL-10 e l’apolipoproteina E4. E’ stata
inoltre riscontrata una maggiore incidenza in alcune famiglie, suggerendo una possibile predisposizione familiare alla calcificazione valvolare [1].
Molti fattori di rischio associati allo sviluppo di SA calcifica sono simili a quelli descritti per l’aterosclerosi: età, sesso maschile, ipertensione, fumo, diabete mellito, aumento del colesterolo LDL e riduzione del colesterolo HDL. La SA calcifica è stata anche correlata ai marker dell’infiammazione presenti nella sindrome metabolica [1, 11].
Esiste quindi un grande interesse per queste similitudini tra aterosclerosi e SA senile, specialmente in relazione a un possibile trattamento medico della stessa. Attualmente, comunque, studi di trattamento con statine in pazienti con stenosi aortica hanno dato risultati contrastanti riguardo la progressione del danno valvolare, mortalità, time-to-treatment vs. placebo [14, 15].
La fisiopatologia della stenosi aortica degenerativa è schematizzata in figura 4.2.
Stenosi aortica reumatica: la SA reumatica incide sul 25% dei pazienti affetti da cardiopatia reumatica cronica. Essa è il risultato dell’adesione e della fusione delle commissure e delle semilune e spesso della vascolarizzazione delle semilune stesse, normalmente avascolari, che porta a retrazione e irrigidimento dei margini liberi delle semilune e a fusione delle corde
Fig. 4.2. Patogenesi della stenosi aortica degenerativa. A. Rappresentazione schematica dell’istologia della SA
degenerativa, dalle fasi più precoci della sclerosi aortica allo stadio terminale caratterizzato da estese calcificazioni e fibrosi massiva. B. Corrispondenti alterazioni macroscopiche osservate in sistole dalla faccia aortica della valvola.
tendinee nelle valvole atrioventricolari. La vascolarizzazione valvolare porta a un’alterazione della tipica architettura microscopica stratificata delle semilune. Si sviluppano noduli calcifici su entrambe le facce delle semilune, tali da trasformare l’orificio aortico in una sottile apertura rotonda o triangolare. Essi rappresentano la degenerazione fibrosa dei corpi di Ashoff, lesioni tipiche della cardite reumatica acuta. Come conseguenza, dunque, la valvola può risultare non solo stenotica ma anche insufficiente. Tutti i pazienti affetti da questa forma di SA hanno invariabilmente un coinvolgimento della valvola mitrale, anche se talvolta la sintomatologia predominante è dovuta alla SA. Il processo è invece più raro a carico della valvola tricuspide e ancor più della polmonare; in tali sedi le lesioni tendono anche ad essere meno gravi [12].
4.3 Fisiopatologia
Negli adulti con stenosi aortica, l’ostruzione all’efflusso si sviluppa ed aumenta gradualmente in un lungo periodo di tempo. Al contrario, nei lattanti e nei bambini con stenosi aortica congenita, l’orifizio valvolare mostra soltanto un modico accrescimento all’aumentare dell’età del paziente, cosicché l’ostruzione diventa via via più grave. Come dimostrato anche in modelli animali di stenosi aortica, l’eiezione ventricolare sinistra può essere conservata attraverso una ipertrofia del ventricolo sinistro [1]. Questo meccanismo adattativo ha il fine di ridurre lo stress sistolico sviluppato dal miocardio secondo la legge di Laplace (S = Pr/h, dove S = stress parietale sistolico, P = pressione, r = raggio e h = spessore di parete). Tale ipertrofia può sopportare un altissimo gradiente pressorio transvalvolare per anni senza riduzione della portata cardiaca, dilatazione ventricolare o sviluppo di sintomi [11].
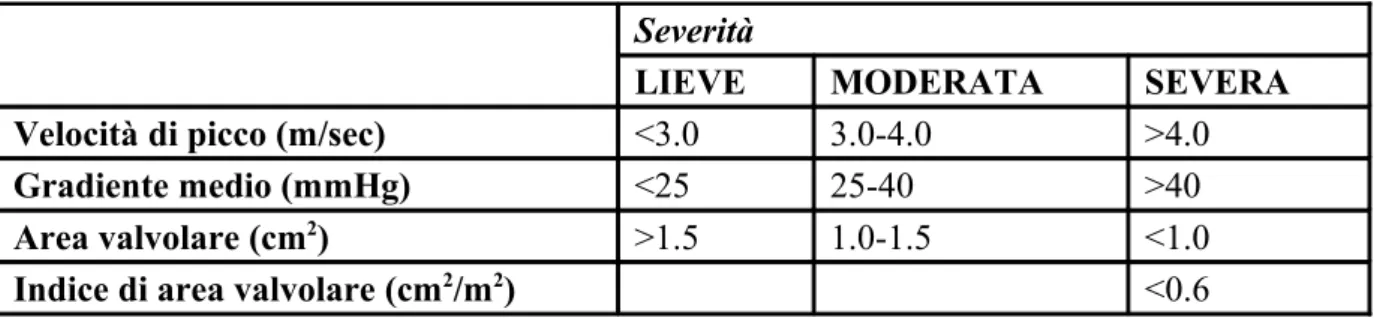
Come tutte le patologie valvolari cardiache, anche la gravità della SA è stata classificata in tre livelli di severità (Tab. 4.1). Un’ostruzione severa all’efflusso del ventricolo sinistro è solitamente caratterizzata da [16]:
• velocità di picco transvalvolare >4 m/s • gradiente pressorio medio >40 mmHg
• area dell’orifizio valvolare <1 cm2 (o <0,6 cm2/m2 di superficie corporea), ovvero
circa un quarto della superficie normale dell’orifizio aortico, che ha valori di 3-4 cm2
Severità
LIEVE MODERATA SEVERA
Velocità di picco (m/sec) <3.0 3.0-4.0 >4.0
Gradiente medio (mmHg) <25 25-40 >40
Area valvolare (cm2) >1.5 1.0-1.5 <1.0
Indice di area valvolare (cm2/m2) <0.6
Nonostante sia facilmente intuibile che i sintomi si aggravano all’aumentare della severità della stenosi, il grado di stenosi associato all’inizio della sintomatologia varia da paziente a paziente, e non c’è un singolo valore che definisce severa o critica una SA nel singolo paziente. Le decisioni cliniche sono prese considerando la sintomatologia e la risposta del ventricolo sinistro al sovraccarico pressorio cronico, correlato alla severità emodinamica. In alcuni casi, per stabilire esattamente il grado di severità della patologia, sono necessarie valutazioni aggiuntive, quali la perdita di lavoro cardiaco o l’impedenza valvolare, oppure la valutazione con variazioni del carico di lavoro miocardico (ad esempio test da sforzo con dobutamina) [16].
Il sovraccarico cronico di pressione esita tipicamente in ipertrofia concentrica del ventricolo sinistro, con aumento dello spessore di parete e dimensione normale della cavità. Tale aumento di spessore consente una normalizzazione dello stress di parete, per cui la funzione contrattile del ventricolo sinistro risulta mantenuta. D’altra parte, l’aumentata dimensione delle cellule miocardiche e la fibrosi interstiziale conducono a una progressiva disfunzione diastolica, che può persistere anche dopo il trattamento della SA [1].
La resistenza vascolare sistemica, oltre alla resistenza valvolare, contribuisce al postcarico ventricolare totale. Per questo motivo, una concomitante ipertensione arteriosa aggrava ulteriormente il lavoro del ventricolo sinistro e può influenzare la valutazione della severità della SA [1].
La funzione cardiaca durante l’esercizio fisico è anomala nei pazienti con SA moderata o severa, e anche i pazienti asintomatici mostrano una ridotta tolleranza all’esercizio. Sebbene la portata cardiaca a riposo sia entro i limiti del normale, il normale incremento della portata cardiaca presente durante l’esercizio fisico è compromesso ed è mediato quasi esclusivamente dall’aumento della frequenza cardiaca a fronte di una piccola variazione dello stroke volume. Inoltre, anche se lo stroke volume è inalterato, il flusso transvalvolare aumenta a causa del ridotto tempo di eiezione, per cui la velocità di picco e il gradiente transvalvolare aumentano proporzionalmente. Prima dello sviluppo dei sintomi, l’area valvolare aumenta leggermente durante l’esercizio (0,2 cm2 in media), ma quanto la SA
diventa più grave e i sintomi sono imminenti, l’area valvolare rimane immutata, risultando in
una velocità di picco e un gradiente pressorio sotto sforzo ancora maggiori. A questo punto, c’è un ridotto aumento di pressione arteriosa sotto sforzo (<10 mmHg), equivalente a una stenosi severa [1].
Funzionalità miocardica nella SA. L’ipertrofia è il principale meccanismo attraverso cui il ventricolo sinistro si adatta al sovraccarico cronico di pressione. L’aumentato stress parietale sistolico porta a una replicazione in parallelo dei sarcomeri nei cardiomiociti, il cui corrispettivo macroscopico è l’ipertrofia concentrica. L’aumentato spessore parietale è spesso sufficiente a controbilanciare l’aumentata pressione, per cui la tensione al momento del picco sistolico resta o ritorna normale [1].
Nei pazienti con SA è stata descritta una correlazione inversa tra stress parietale e frazione di eiezione (EF). Ciò suggerisce che la ridotta EF e la riduzione della velocità di accorciamento delle fibrocellule miocardiche che si sviluppa in alcuni pazienti sono la conseguenza di un inadeguato ispessimento parietale. In altri, la ridotta EF è secondaria a una vera riduzione della contrattilità; in questo gruppo, il trattamento chirurgico ha una minore efficacia. In definitiva, sia un aumento del postcarico che un’alterata contrattilità contribuiscono a generare la disfunzione ventricolare sinistra [1].
Alterazioni diastoliche. Sebbene l’ipertrofia sia un utile meccanismo di compenso per il cuore, esiste una conseguenza fisiopatologica inevitabile, ovvero un aumento della rigidità (stiffness) diastolica. Questo porta a sua volta ad un aumento della pressione di riempimento ventricolare. Alcuni pazienti con SA mostrano un’aumentata stiffness ventricolare (aumentata rigidità cavitaria) semplicemente a causa dell’aumento della massa ventricolare, in mancanza di alterazioni delle proprietà diastoliche dei singoli miocardiociti; altri, al contrario, mostrano un aumento sia della stiffness cavitaria che della stiffness muscolare. Qualunque sia il meccanismo che conduce all’aumento della stiffness, si verifica un aumento della pressione di riempimento per ogni livello di volume ventricolare diastolico. La disfunzione diastolica può migliorare in seguito al trattamento chirurgico della SA, ma un certo grado di disfunzione diastolica persiste anche a lungo termine [1].
Ischemia. Nei pazienti con SA, il flusso coronarico a riposo è elevato in termini assoluti, ma è normale se si considera che la massa muscolare miocardica è aumentata. La riduzione della riserva coronarica può esitare in un’inadeguata perfusione ventricolare nei pazienti con SA severa, anche in assenza di malattia delle arterie coronariche (coronary artery disease, CAD). La massa ventricolare ipertrofica, l’aumentata pressione sistolica e il prolungamento della fase sistolica aumentano notevolmente il consumo di ossigeno e nutrienti. In aggiunta, la pressione intraparietale che normalmente comprime le arterie coronarie risulta elevata, talvolta in maniera tale da risultare maggiore della pressione di perfusione; questo, unitamente ad un ridotto tempo diastolico, conduce a un mismatch tra offerta e domanda miocardica di
ossigeno. Altro fattore che contribuisce ad alterare la perfusione miocardica è la riduzione della densità capillare che si sviluppa all’aumentare della massa ventricolare.
In conclusione, questa riduzione della perfusione può rendersi responsabile di ischemia sottoendocardica, specialmente al momento di una maggiore richiesta di ossigeno e/o il periodo di riempimento diastolico risulta ridotto (ad esempio tachicardia, anemia, infezioni, gravidanza) [1].
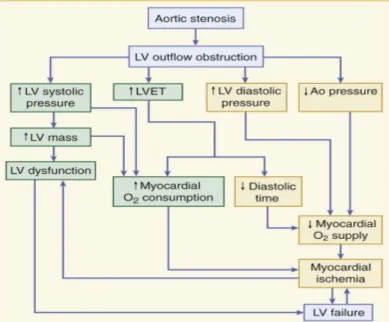
Una rappresentazione schematica della complessa fisiopatologia della stenosi aortica è fornita dalla fig. 4.3.
4.4 Manifestazioni cliniche
Sintomatologia. Le manifestazioni cliniche della SA acquisita sono dispnea da sforzo, angina, sincope da sforzo e sintomi da insufficienza cardiaca negli stadi finali. Molti pazienti sono oggi diagnosticati per la presenza di un soffio sistolico all’esame obiettivo, con conferma diagnostica tramite esame ecocardiografico. I sintomi si presentano di solito tra 50 e 70 anni nei pazienti con SA da bicuspidia congenita, mentre nei pazienti con valvola nativa tricuspide i sintomi si sviluppano dopo i 70 anni, sebbene in questo gruppo ben il 40% presenti una bicuspidia [1, 11].
La più frequente manifestazione clinica della SA nei pazienti con malattia nota è la riduzione progressiva della tolleranza allo sforzo, affaticamento o dispnea da sforzo. Tali sintomi possono essere il risultato della congestione polmonare conseguente all’aumento della pressione telediastolica, oppure derivare dall’impossibilità da parte del cuore di aumentare a sufficienza la portata cardiaca durante l’esercizio. Sintomi più gravi quali dispnea a riposo con ortopnea, dispnea parossistica notturna o edema polmonare riflettono gradi più severi di
Fig. 4.3. Fisiopatologia della stenosi
aortica. LV: ventricolo sinistro; LVET: durata del periodo di eiezione sistolica; Ao: aortica
ipertensione venosa polmonare e indicano lo sviluppo di scompenso cardiaco. Questi sintomi sono relativamente tardivi, e l’intervento terapeutico è di solito intrapreso prima di questo stadio [1, 11].
L’angina è presente in circa i due terzi dei pazienti con SA severa, il 50% circa dei quali presenta anche CAD. La sintomatologia dolorosa insorge tipicamente sotto sforzo e si riduce o recede completamente a riposo. Essa si sviluppa, in assenza di patologia coronarica, in conseguenza di un aumento delle richieste miocardiche di ossigeno e della compressione dei vasi coronarici. In caso di associazione con CAD, oltre a questo, si somma l’ostruzione dei vasi coronarici epicardici [1, 11].
La sincope si sviluppa tipicamente a causa della riduzione della perfusione cerebrale che si verifica durante lo sforzo: la vasodilatazione sistemica associata all’esercizio fisico non è supportata da un parallelo aumento della portata cardiaca, con conseguente riduzione della pressione arteriosa. Nella SA severa, è stata descritta anche una disfunzione dei barocettori. Nella sincope da SA è comune la presenza di sintomi premonitori. Una sincope a riposo può essere il risultato di una perdita del contributo atriale al riempimento ventricolare, quale può realizzarsi in caso di fibrillazione atriale transitoria o di blocco atrioventricolare transitorio dovuto all’estensione delle calcificazioni a livello del sistema di conduzione del cuore [1].
Altre manifestazioni tardive riscontrabili nel paziente con SA sono FA, ipertensione polmonare e ipertensione venosa sistemica. Sebbene la SA possa essere responsabile di morte improvvisa, quest’ultima è più comune in pazienti precedentemente sintomatici.
Nei pazienti affetti da SA severa possono svilupparsi anche sanguinamenti gastrointestinali, spesso associati ad angiodisplasia, più comune a livello del colon destro, o ad altre malformazioni vascolari. La loro causa è da ricercarsi nell’aggregazione piastrinica indotta dallo shear stress. Tali problematiche sono correlate con la severità della SA e si risolvono con l’intervento di AVR [1].
Le endocarditi infettive sono una prerogativa dei pazienti giovani con lievi deformità valvolari piuttosto che dei pazienti anziani con gravi deformità valvolari calcifiche. Emboli cerebrali esitanti in stroke o TIA possono essere causati da microtrombi sulle cuspidi valvolari ispessite. Tali emboli possono inoltre dirigersi verso altri organi, inclusi i reni e il cuore [1]. Esame fisico. Le valutazioni da effettuare nel paziente con AS sono le seguenti:
• palpazione del polso carotideo: nella SA severa il polso carotideo ha una ridotta fase ascendente, un picco più tardivo e una ridotta ampiezza (pulsus parvus et tardus). Quando presenti, queste caratteristiche sono specifiche della SA. Comunque, molti adulti con AS presentano in comorbilità altre condizioni, quali l’insufficienza aortica o l’ipertensione arteriosa, che possono modificare diversamente l’onda sfigmica carotidea; per questi motivi, un polso normale non esclude in alcun caso la possibile
presenza di SA. Similmente, anche i valori pressori non sono utili per l’orientamento diagnostico verso una possibile SA. Quando la stenosi si fa severa, la pressione arteriosa e la forza del polso possono essere ridotte, a meno di pazienti con rigurgito aortico o con arteriosclerosi importante, in cui la pressione può essere normale o anche aumentata. Nella SA severa, l’irradiazione del soffio alle carotidi può determinare un fremito palpabile [1].
• auscultazione cardiaca: il soffio sistolico della SA tipicamente è udibile alla base del cuore ed è irradiato alle carotidi; ha forma in crescendo-decrescendo. La cessazione del soffio prima del tono A2 aiuta a differenziarlo dal rumore mitralico pansistolico. In generale, più il picco del soffio è tardivo maggiore è la gravità della stenosi. Lo sdoppiamento del secondo tono cardiaco può essere d’aiuto per escludere la diagnosi di SA severa perché lo sdoppiamento del secondo tono implica che i foglietti valvolari siano flessibili, consentendo lo sdoppiamento stesso. Nella SA severa, S2 può essere singolo perché la calcificazione e l’immobilità delle valvole rendono S2 non udibile, perché P2 è nascosto nel soffio aortico prolungato, oppure perché il prolungarsi della fase sistolica determina la fusione di A2 e P2 [1].
4.5 Diagnosi strumentale
Ecocardiografia. Analogamente alle altre valvulopatie cardiache, anche nella SA l’ecocardiogramma costituisce l’indagine standard per l’approccio diagnostico, il follow–up e la selezione dei pazienti candidati ad AVR (Fig. 4.4).
L’ecocardiografia consente una buona definizione dell’anatomia valvolare, identifica l’eziologia della SA e l’entità delle calcificazioni valvolari, e talvolta permette di osservare direttamente l’orifizio aortico. Usando la proiezione parasternale asse-corto è possibile anche identificare il numero di semilune presenti nella valvola. L’esame è anche utile per lo studio del’ipertrofia ventricolare, per la valutazione della funzione ventricolare (mediante calcolo della EF), per la misurazione delle dimensioni della radice aortica e l’identificazione di eventuali patologie mitraliche associate [16, 17].
Una migliore definizione dell’anatomia valvolare può essere ottenuta mediante l’ecocardiografia transesofagea.
Con l’ausilio della tecnica doppler, è possibile calcolare la velocità di picco transvalvolare, che costituisce la principale misura per la valutazione della severità della stenosi e predire l’outcome clinico di questi pazienti. I criteri per la definizione di SA severa sono stati elencati in precedenza. Usando particolari algoritmi è possibile calcolare anche l’area dell’orifizio e il gradiente pressorio transaortico medio. Queste ultime due misurazioni sono ormai sufficientemente validate e possono sostituire esami emodinamici più invasivi; tale valutazione non può però prescindere dall’uso di una strumentazione adeguata da parte di personale esperto [16].
Le modificazioni a carico del ventricolo sinistro causate dal sovraccarico pressorio cronico si riflettono sulle forme d’onda atriali e ventricolari all’indagine Doppler, che rappresenta quindi un’importante metodica di valutazione della risposta delle camere cardiache e della funzione cardiaca.
Fig. 4. 4. A sinistra, immagine TEE di valvola aortica tricuspide. A destra, immagine TTE di una tipica
valvola aortica bicuspide con fusione delle semilune destra e sinistra
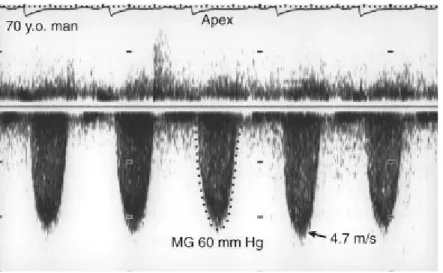
Fig 4.5. Spettro Doppler CW di un
uomo di 70 anni affetto da SA severa. La velocità di picco era 4,7 m/s e il gradiente medio di 60 mmHg
La combinazione di ecocardiografia pulsed, continuous wave e color Doppler è inoltre utile nella stima della severità del rigurgito aortico, che coesiste in circa il 75 % dei pazienti con AS predominante, e nel determinare la pressione arteriosa polmonare. In alcuni pazienti possono essere necessarie alcune misurazioni aggiuntive, come la correzione per la pressione poststenotica e l’indagine ecografica transesofagea (richiesta, ad esempio, nei pazienti candidati a TAVI) [16].
La stima della severità della SA può essere influenzata da un’eventuale presenza di ipertensione arteriosa associata, che richiede dunque una rivalutazione successiva al controllo pressorio. In pazienti con disfunzione ventricolare sinistra e bassa portata cardiaca, la valutazione della severità della SA può essere evidenziata mediante test emodinamici da sforzo dopo infusione di inotropi come la dobutamina, che permette di discriminare tra stenosi severa e stenosi pseudosevera [16].
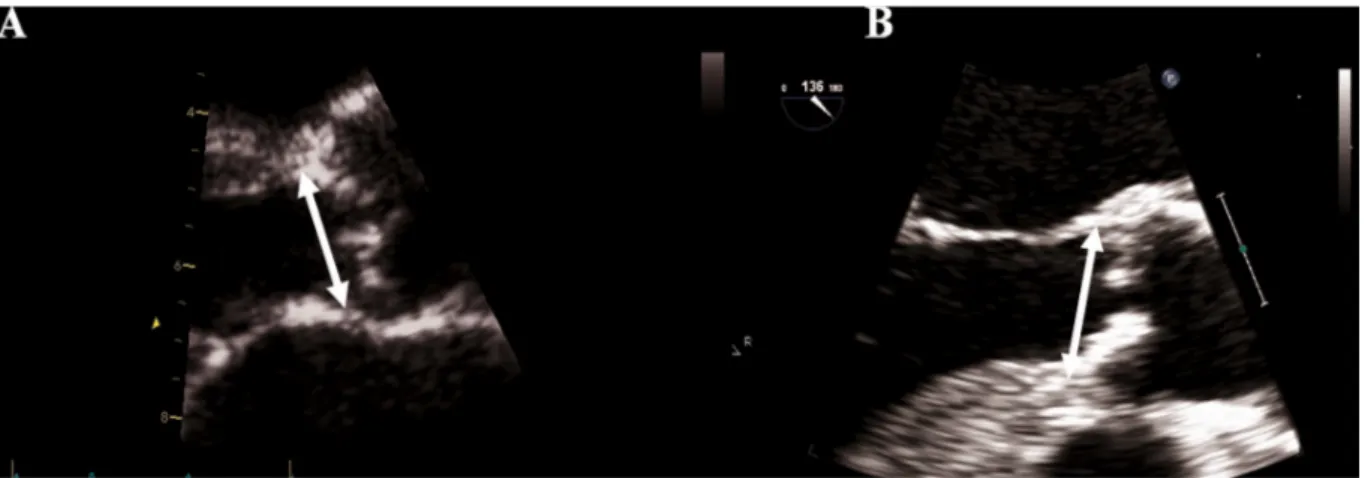
L’ecocardiografia transtoracica (TTE) può essere impiegata anche per lo studio dell’annulus aortico, sebbene l’ecocardiografia transesofagea sia da preferire (Fig. 4.6). L’esame è condotto in decubito laterale sinistro usando apparecchi ecocardiografici standard. Tutte le misurazioni sono acquisite in fase sistolica e vengono ottenute dalla media dei valori registrati in 3 battiti cardiaci. L’annulus aortico è assunto come la distanza fra i margini inferiori dalla giunzione della semiluna coronarica destra con l’endocardio settale alla giunzione della semiluna posteriore con la valvola mitrale posteriormente. Deve essere anche indicata la presenza di calcificazioni. Le immagini dell’annulus in TTE sono ottenute in proiezione parasternale [17].
L’ecocardiografia transesofagea (TEE) è impiegata in particolare per la misurazione dell’annulus aortico nei pazienti candidati a TAVI. Questa tecnica ha lo svantaggio di essere bidimensionale (2D), per cui la misura riguardante l’annulus aortico ottenuta grazie ad essa sottostima quelle che sono le sue reali dimensioni. L’annulus è acquisito con sonda ecografica
Fig. 4.6. Misurazione dell’annulus aortico mediante TTE (A) e TEE (B). Le dimensioni dell’annulus aortico sono
in posizione medio-esofagea usando un piano di immagine di 120°-150°. Le misurazioni sono ottenute come indicato a proposito della TTE. Sembra, invece, piuttosto promettente la 3D-TEE. Questo apparecchio ha dimostrato, in recenti studi di comparazione fra le diverse tecniche di imaging dell’annulus aortico, una buona accuratezza se paragonato ad altre indagini tridimensionali quali la TC o la RMN [6, 18, 19]. Le immagini sono acquisite come volumi piramidali della radice aortica durante 3 cicli cardiaci e processate off-line utilizzando la modalità multi planar reformation (MPR), attraverso cui è possibile identificare il diametro maggiore dell’annulus (Fig. 4.7) [18].
Cateterismo cardiaco e angiografia cardiaca. Nella maggioranza dei pazienti, l’indagine ecocardiografica fornisce le informazioni richieste per la gestione dei pazienti affetti da SA, dunque il cateterismo cardiaco è indicato nei rari casi in cui l’ecocardiografia non ha fornito indicazioni esaustive. L’angiografia coronarica è invece richiesta in previsione dell’intervento di AVR, sia esso chirurgico o percutaneo [1].
Le indicazioni all’esecuzione dell’ecocardiografia, dei test da sforzo e del cateterismo e dell’angiografia coronarica sono riportati nella tabella 4.2.
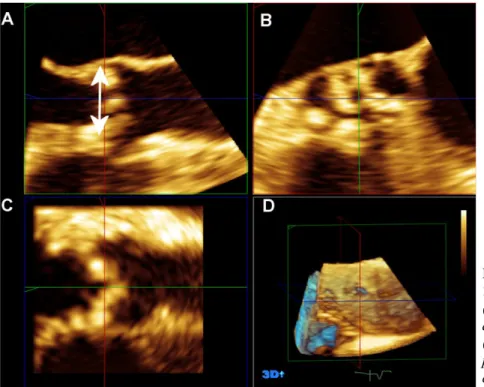
Fig. 4.7 Ricostruzione di 3-D
TEE in proiezione a 3 camere (A,D) e misurazione del diametro dell’annulus aortico (A). Sono mostrate anche le proiezioni coronali e asse-corto della valvola aortica (B, C).
Tomografia assiale computerizzata. Oltre a valutare l’entità delle calcificazioni, la TC è utile anche per lo studio della dilatazione aortica in pazienti con evidenza di malattie della radice aortica all’esame ecocardiografico o radiografico del torace. Lo studio accurato delle strutture del complesso valvolare aortico è fondamentale nelle decisioni cliniche e nella pianificazione dell’intervento chirurgico tradizionale [1]. L’importanza della TC nella previsione dell’intervento di TAVI sarà analizzata estesamente in un capitolo dedicato.
Risonanza magnetica. Questa indagine può risultare utile nello studio del volume, della funzione e della massa del ventricolo sinistro, specialmente in quei pazienti in cui l’ecocardiografia non è stata completamente dirimente. Anche la severità della SA può essere valutata sia qualitativamente che quantitativamente mediante RM grazie ad apposite sequenze sensibili al flusso ematico (Phase Contrast), sebbene questo approccio non sia molto utilizzato [1]. E’ possibile impiegare anche la RM nello studio dell’annulus aortico preparatorio all’intervento di TAVI; di questo aspetto e del confronto con la TC sarà fatto cenno nel paragrafo dedicato a quest’ultima.
4.6 Trattamento
Principi generali e terapia medica. Il principio più importante nel management degli adulti affetti da SA è l’educazione dei pazienti riguardo il decorso della malattia e i sintomi tipici. I pazienti devono essere avvertiti di avvisare immediatamente il medico ogniqualvolta compaiano o peggiorino i sintomi che possono essere dovuti alla SA. È inoltre necessario consigliare i pazienti con SA severa di non svolgere sport agonistici o attività fisica intensa; queste restrizioni non valgono per i pazienti con stenosi lieve. Sebbene non sia stato
dimostrato che la terapia medica possa modificare la progressione della malattia, in ogni paziente adulto o anziano con SA (così come in tutti i pazienti in queste fasce d’età) si devono attentamente valutare e trattare i comuni fattori di rischio per la malattia coronarica [11].
I pazienti sintomatici con SA severa sono solitamente candidati alla sostituzione chirurgica della valvola aortica, per il fatto che la terapia medica ha poco da offrire a pazienti di questo tipo. La terapia medica può comunque essere d’aiuto in quei pazienti considerati inoperabili per importanti comorbilità [1]. Alcuni di questi pazienti possono essere sottoposti all’impianto di valvole transcatetere (TAVI), ma in certi casi tale procedura non è proponibile.
Sebbene i diuretici siano utili nel caso di accumulo di fluidi, questi devono essere impiegati con cautela perché possono ridurre l’elevata pressione telediastolica nel ventricolo sinistro e la portata cardiaca, con rischio di ipotensione ortostatica. Anche gli ACE-inibitori devono essere impiegati con attenzione, ma possono avere importanti effetti benefici nei pazienti con disfunzione ventricolare sintomatica non candidati alla terapia chirurgica. Questi farmaci debbono essere utilizzati a basse dosi nelle fasi iniziali, dosi da aumentare progressivamente onde evitare lo sviluppo di ipotensione. I beta-bloccanti possono deprimere la funzione miocardica e precipitare lo scompenso cardiaco, pertanto andrebbero evitati nei pazienti con SA. Il trattamento delle condizioni associate, quali l’ipertensione o la coronaropatia, può essere complicato in questi pazienti per il fatto che la vasodilatazione farmaco-indotta non può essere compensata da un aumento parallelo della portata cardiaca. La cura di queste comorbilità è comunque importante; per questo motivo si consiglia di iniziare la terapia con basse dosi dei farmaci per aumentarle lentamente e sotto stretto monitoraggio della pressione arteriosa e dei sintomi [11].
In meno del 10% dei pazienti con SA si osserva la presenza di FA o flutter atriale, probabilmente a causa della tardiva insorgenza di dilatazione dell’atrio sinistro. Quando si osservano aritmie di questo tipo in pazienti con SA, è necessario considerare la possibile presenza di una valvulopatia mitralica associata. In caso di FA con elevata risposta ventricolare, è possibile anche lo sviluppo di manifestazioni anginose. La perdita del contributo atriale al riempimento ventricolare sinistro, in pazienti in cui la portata cardiaca è di per sé ridotta, può inoltre causare ipotensione ortostatica o sincope. Per questi motivi, è d’obbligo trattare prontamente questa aritmia, di solito con cardioversione. L’insorgenza di FA in pazienti peraltro asintomatici è spesso una spia dello sviluppo dei sintomi tipici entro un breve periodo [1].
Chirurgia tradizionale. La terapia di sostituzione della valvola aortica (AVR, Aortic Valve Replacement) è raccomandata nei pazienti adulti con SA severa e sintomatica, anche se i sintomi appaiono lievi. Nonostante queste indicazioni, che seguono le linee guida, molti
pazienti con SA sintomatica non vengono riferiti appropriatamente alla cardiochirurgia, anche in presenza di un basso rischio operatorio. L’AVR è inoltre raccomandata in caso di SA severa sintomatica con frazione di eiezione < 50% e per pazienti con SA severa asintomatica che devono sottoporsi all’innesto di bypass coronarici o ad altri interventi di cardiochirurgia. L’AVR trova indicazioni aggiuntive anche nei pazienti asintomatici ma che sviluppano importanti sintomi o caduta della pressione arteriosa durante il test da sforzo; l’approccio chirurgico va considerato inoltre nei pazienti asintomatici con basso rischio operatorio, quando si dimostra una rapida progressione della malattia (ad esempio calcificazioni valvolari molto estese) oppure quando la stenosi è molto severa. In previsione di AVR è indicata l’esecuzione di una coronarografia [1].
Le indicazioni al trattamento chirurgico della SA severa sono riportate in figura 4.8.
La AVR chirurgica è la procedura di scelta per il trattamento dei pazienti affetti da stenosi aortica valvolare severa. La riparazione dei lembi valvolari non si è rivelata efficace a causa della presenza delle calcificazioni.
Attualmente esistono protesi valvolari per la sostituzione della valvola aortica e delle valvole atrioventricolari. Esse appartengono a due gruppi principali (meccaniche e biologiche) che si distinguono principalmente per il diverso rischio tromboembolico (maggiore per le protesi meccaniche) e di degenerazione strutturale della protesi (maggiore per le protesi biologiche) [1].
Protesi meccaniche: le protesi meccaniche sono classificate in tre gruppi principali:
- valvole a doppio disco o bileaflet tilting disc, le più impiegate tra le valvole meccaniche per le piccole dimensioni, il profilo piatto e le eccellenti proprietà emodinamiche
- valvole a disco (tilting disc)
- valvole a palla (ball cage), non più impiegate a partire dal 2007 ma da considerare per la possibilità di trovare pazienti in cui siano state impiantate valvole di questo tipo.
Sia le valvole bileaflet che le tilting disc possiedono normalmente una piccola quota di reflusso (5-10 ml/battito). Tutte le valvole meccaniche sono contraddistinte da un’ottima durevolezza nel tempo, anche superiore a 40 anni. Il rischio tromboembolico, elevato soprattutto nel primo anno dopo l’impianto della protesi, è minore nelle protesi aortiche che in quelle mitraliche, ma è comunque necessario intraprendere una terapia anticoagulante a lungo termine mediante dicumarolici. La terapia con warfarin va iniziata già in seconda giornata postoperatoria. I valori di INR devono essere mantenuti in un range tra 2.0 e 3.0 con valvole bileaflet e Medtronic-Hall e tra 2.5 e 3.5 in tutti gli altri tipi di valvole in posizione aortica e in tutte le protesi di valvole mitraliche. L’aggiunta di Aspirina a dosaggi antiaggreganti (75-100 mg/die) riduce ulteriormente questo rischio, ed è indicata dopo ogni intervento di sostituzione valvolare, in qualunque posizione [1].
Le complicanze principali successive all’impianto di valvole artificiali sono (statistiche riferite all’impianto di protesi valvolare aortica, mentre per la mitralica le complicanze sono più frequenti):
- sanguinamenti legati alla terapia con warfarin, con 0,2 eventi mortali/100 pazienti/anno e 2,2 eventi emorragici gravi/100 pazienti/anno
- tromboembolia nonostante trattamento anticoagulante, con 0,2 eventi fatali/100 pazienti/anno e 1-2 eventi non fatali/100 pazienti/anno
- trombosi valvolare (0,1%)
- emolisi, solitamente lieve e presente nella maggior parte dei casi; essa non causa normalmente effetti significativi a meno che non si sviluppi rigurgito paravalvolare [1]
Protesi biologiche: le protesi biologiche sono state sviluppate con lo scopo principale di
ridurre il rischio tromboembolico ed evitare l’impiego dei farmaci anticoagulanti. Attualmente vengono impiegati diversi tipi di valvole:
-valvole a telaio: consistono in tre cuspidi valvolari, usualmente di origine porcina, montate su un’intelaiatura anulare semirigida (stent) che consente l’impianto della valvola e mantiene correttamente la struttura tridimensionale delle semilune. Il trattamento con glutaraldeide, stabilizzando i legami delle molecole di collagene, consente di aumentare la biocompatibilità e la durata del dispositivo, oltre a permettere la sua sterilizzazione. Valvole eterologhe possono essere create anche mediante l’impiego di pericardio bovino, che viene tagliato e
cucito per riprodurre la morfologia valvolare. Questo tipo di bioprotesi ha il vantaggio di essere ritagliata sullo specifico paziente, consentendo migliori risultati emodinamici. Nei primi 3 mesi di periodo postoperatorio, nei quali il processo di endotelizzazione dello stent non è ancora completo, esiste un rischio di tromboembolia che rende consigliabile l’impiego di farmaci anticoagulanti orali con INR target tra 2 e 3; successivamente, questi farmaci non sono più indicati per le valvole porcine in posizione aortica (rischio tromboembolico medio di 2 episodi/100 pazienti / anno), ed è sufficiente la sola antiaggregazione con aspirina a basse dosi (75-100 mg/die) [1].
Il problema principale delle valvole porcine è la loro durata limitata. Degenerazione, depositi di fibrina, fibrosi, calcificazioni e perforazioni che richiedono un nuovo intervento compaino dopo 4-5 anni in alcuni pazienti, e a 10 anni fino al 30 % di queste valvole non ha più un’adeguata funzionalità, per cui la loro vita si aggira in media sui 15 anni. Le valvole in pericardio bovino, al contrario, hanno una maggior durata e resistenza, con l’86 % di queste valvole prive di deterioramento a 12 anni. Il deterioramento è più frequente per le valvole poste nel cuore sinistro (probabilmente per le elevate pressioni di chiusura) ed è età dipendente, essendo inferiore per i pazienti > 65 anni, con < 10% di deterioramento strutturale a 10 anni. Prevedibilmente, l’impiego di valvole biologiche è da evitare nei bambini e negli adulti di età inferiore a 35-40 anni, nei quali la degenerazione è inevitabile; al contrario, la degenerazione è rara nei pazienti ultrasettantenni. Una particolare categoria in cui le protesi biologiche hanno una durata particolarmente limitata sono i pazienti con insufficienza renale cronica, anche se studi recenti hanno messo in dubbio questo dato [1].
La sostituzione della valvola bioprotesica va presa in considerazione quando il danneggiamento è molto evidente e/o progressivo e in presenza delle stesse indicazioni che hanno portato alla sostituzione della valvola nativa. La seconda operazione, quando eseguita in elezione, ha un rischio di mortalità chirurgica 2-3 volte maggiore di quello del primo intervento.
-valvole senza telaio: poiché il telaio si somma all’ostruzione e aumenta lo stress sulle semilune valvolari, sono state sviluppate valvole aortiche porcine senza stent, impiegate in particolare in pazienti con radice aortica di piccole dimensioni. È riportato in letteratura che queste valvole hanno un flusso più fisiologico e gradienti transvalvolari minori rispetto alle valvole porcine con telaio, consentendo una maggior regressione dell’ipertrofia ventricolare sinistra e una miglior funzionalità ventricolare. Nonostante questo, i risultati a lungo termine sembrano simili a quelli delle valvole porcine con telaio, anche perché le valvole con telaio di ultima generazione hanno una maggiore durata e migliori risultati emodinamici [1].
-valvole aortiche da donatore (omologhe o ibride): sono prelevate da cadavere, sterilizzate e criopreservate in azoto liquido. Esse vengono inserite direttamente, senza essere prima
montate su un telaio. In questa procedura può essere inserita solo la nuova valvola, in posizione subcoronarica, oppure la valvola con una porzione di aorta del donatore, con successivo reimpianto delle arterie coronarie nel graft. I risultati emodinamici sono superiori alle valvole con stent e simili a quelle senza stent. La trombogenicità è bassa, ma le proprietà riguardanti il deterioramento strutturale sono simili a quelle porcine e sono maggiori per le valvole crioconservate e inferiori per le valvole fresche trapiantate immediatamente dopo il prelievo, se il donatore e il ricevente hanno età simili e nella tecnica di trapianto della radice aortica. La tecnica subcoronarica è associata con una maggiore incidenza di rigurgito postoperatorio e di necessità di reintervento. Inoltre, sia la valvola che la radice aortica omologhe sono predisposte allo sviluppo di calcificazioni molto estese, rendendo complicato l’eventuale reintervento. Un possibile vantaggio di questa tecnica è la bassa incidenza di endocarditi infettive precoci, tanto da essere frequentemente impiegata nel trattamento chirurgico delle stesse endocarditi. In studi randomizzati non è stato comunque identificato alcun vantaggio nell’uso di valvole omologhe rispetto alle valvole porcine nell’outcome del trattamento chirurgico delle endocarditi infettive [1].
-valvole polmonari autologhe: in questo intervento, denominato procedura di Ross, la valvola polmonare dello stesso paziente viene rimossa, spesso con parte del tronco polmonare, e impiantata al posto della valvola aortica nativa e spesso anche dell’aorta adiacente, con successivo reimpianto delle arterie coronariche nel graft. Una valvola polmonare o aortica umana omologa è poi inserita al posto della valvola polmonare trasposta in precedenza. È ovvio che una simile procedura non determina un aumento del rischio tromboembolico. Il vantaggio principale di questa tecnica è la lunga durata. Essa non può però essere impiegata in pazienti con valvole aortiche bicuspidi o con radice aortica dilatata per l’eccessivo stress a cui va incontro il tessuto del tronco polmonare trasposto. Questa è la procedura di scelta nei bambini, negli adolescenti e nei giovani adulti con aspettativa di vita >20 anni; è consigliabile anche nelle donne che vogliono intraprendere una futura gravidanza [1].
Per completezza vanno menzionate in questa sezione anche le valvole Medtronic CoreValve ed Edwards SAPIEN, entrambe valvole biologiche eterologhe, che saranno descritte approfonditamente nel paragrafo riguardante la procedura TAVI/TAVR.
L’intervento chirurgico tradizionale, oggi, è diventato una procedura a basso rischio. Il rischio operatorio, in assenza di disfunzione ventricolare sinistra, si attesta complessivamente fra il 2 e il 5% e, in pazienti di età inferiore ai 70 anni, scende a valori inferiori anche all’1%. I fattori di rischio associati ad un’elevata mortalità sono lo scompenso cardiaco in elevata classe NYHA, disfunzione ventricolare sinistra, età avanzata e presenza in comorbilità di una coronaropatia. La mortalità a 30 giorni è associata anche al numero di interventi di AVR effettuati in ciascun centro. La sopravvivenza a 10 anni attuale è all’incirca dell’85% . I fattori