1.1. Anatomia
La prostata è nel cane l’unica ghiandola accessoria annessa all’apparato genitale maschile. È un organo androgeno-dipendente, infatti, l’azione degli ormoni steroidei è determinante sia per la differenziazione, sia per lo sviluppo e sia per la funzionalità della prostata stessa (Marcato, 1997).
Questo complesso ghiandolare si sviluppa, in tutti i mammiferi, intorno alla sesta settimana di gravidanza a partire dalla parete del seno uro-genitale dell’embrione vicino alla terminazione dei condotti mesonefrici (Barone, 1994). Fino a che i residui vestigiali dell’uraco non regrediscono, ciò avviene nei primi mesi di vita, la prostata è situata all’interno della cavità addominale per poi spostarsi nella cavità pelvica.
Nel cane tale ghiandola somiglia molto a quella dell'uomo (Woodburne, 1961); è un organo fibro-muscolo-ghiandolare di forma ovoidale o sferoidale, di diametro di 2-3 cm e pesa 6-8 gr in cani di taglia ed età medie; il colore è grigio-giallastro e la consistenza è solida (Barone R, 1994). Il suo volume è inversamente proporzionale a quello dei testicoli pertanto, risulta più grande nei Carnivori rispetto agli Equidi, Conoglio, Toro e Verro (Bruni e Zimmeri, 1974).
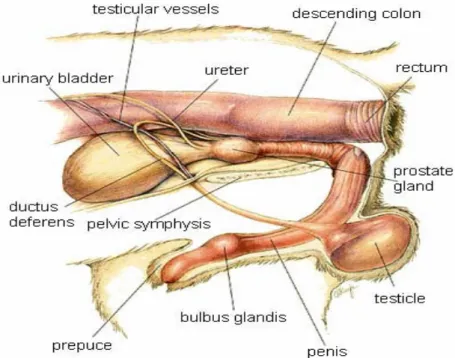
Questa ghiandola è localizzata principalmente nello spazio retroperitoneale, subito caudalmente alla vescica nella regione del collo vescicale e dell’uretra prossimale; solo la superficie cranio-dorsale è ricoperta dal peritoneo mentre quella ventrale da tessuto adiposo (Barsanti,1999).
Le sue dimensioni sono ridotte fino alla pubertà quando, sotto l’influenza degli ormoni androgeni, s’ingrandisce fino a raggiungere le dimensioni definitive dell’adulto.
La posizione nel quadrante addominale caudale dipende principalmente dall’età (come è stato dimostrato da Gordon, 1961), dal grado di distensione vescicale e
dalle eventuali condizioni patologiche presenti. Infatti, è intraddominale nei cuccioli neonati, per la connessione esistente della vescica con il canale dell’ uraco, mentre in seguito alla scomparsa del residuo uracale (prima dei 2 mesi di vita) viene trascinata all’ingresso della pelvi dalla vescica che si porta sempre più caudalmente verso il bacino (Stead e Borthwich, 1976).
Con l’aumentare dell’età, la prostata, subisce un progressivo e costante aumento in volume e peso, dovuto alla stimolazione androgenica, che ne determina un ritorno in sede intraddominale, cosicché nei cani maschi interi di età superiore ai 5 anni gran parte di questa ghiandola è localizzata in addome (Barsanti, 1999). In alcuni soggetti, di età superiore ai 5 anni, accade frequentemente che tale crescita possa essere esagerata, portando alla cosiddetta “Ipertrofia prostatica benigna” (Barsanti e Finco, 1995).
La crescita e la secrezione prostatica sono regolate dal diidrotestosterone (DHT), un metabolita del testosterone (T) che origina dall’azione dell’enzima 5α-reduttasi (Kamolpatana e Johnston, 1996) e ciò concorre a spiegare il motivo della atrofia alla quale va incontro questa ghiandola in seguito a castrazione. Infatti si riscontra una riduzione delle dimensioni pari al 50% nelle prime 3 settimane dalla castrazione e del 70% dopo 9 settimane da tale intervento (Barsanti e Finco, 1995).
La prostata del cane è quasi interamente costituita da un corpo voluminoso e bilobato, Corpus prostatae, e da una parte disseminata, Pars disseminata prostatae, rappresentata soltanto da piccoli lobuli sparsi sul decorso dell’uretra membranosa, posti tra lo strato cavernoso e il muscolo uretrale. Il corpo circonda interamente l’inizio dell’uretra e la parte adiacente del collo vescicale ed è situato sul margine craniale del pube. La sua faccia dorsale è depressa per la presenza di un solco mediano, più profondo nella parte craniale, grazie al quale vengono a delinearsi due lobi, destro e sinistro, particolarmente sviluppati e che risultano in continuità strutturale sulla faccia dell’uretra, dove sono molto meno ispessiti che sulla faccia ventrale. Sotto quest’ultima essi rimangono distinti l’uno dall’altro e sono uniti mediante uno spesso setto mediano, fibroso e privo di tessuto ghiandolare. La sostanza ghiandolare che fa da ponte tra i due lobi sulla faccia
dorsale del condotto uretrale è definita Isthmus prostatae che corrisponde a quello che talora viene denominato Lobus medius nella prostata umana; in quest’ultima, invece, l’istmo rappresenta la parte fibrosa e priva di tessuto ghiandolare che unisce i 2 lobi ventralmente all’uretra (Barone,1994).
Per quanto concerne i rapporti topografici la prostata è dorsalmente unita al retto mediante un setto fibroso, il setto retto-genitale (Barone, 1994), ventralmente poggia con la sua metà caudale sul pettine del pube (Berg,1982) coprendo la parte pre-prostatica e prostatica dell’uretra, cui aderisce intimamente, mentre cranialmente contrae rapporti con il collo vescicale (Figura 1.1.1.).
Figura 1.1.1. Topografia della prostata
Sulla superficie cranio-dorsale decorrono i due dotti deferenti appaiati su entrambi i lati del piano mediano e che penetrano insieme nello spessore della ghiandola per raggiungere l’uretra con un decorso obliquo caudo-ventrale, dove si aprono per mezzo di due fessure su ciascun lato di un piccolo ispessimento della parete uretrale, detto collicolo seminale o veromontanum (Miller e Christensen, 1964). Alla sommità di quest’ultimo si trova l’apertura di un diverticolo a fondo cieco,
l’utricolo prostatico o “utero mascolino”; caudalmente si continua con l’uretra, che attraversa la ghiandola secondo l’asse longitudinale mediano.
Le dimensioni della ghiandola variano in relazione all’età, alla razza e al peso somatico del cane (O’Shea, 1962). Sono stati effettuati numerosi studi al fine di chiarire i rapporti tra volume e peso della prostata, prendendo in considerazione diversi parametri riguardanti l’animale. Alcuni Autori, in passato, hanno sottolineato l’esistenza di una correlazione significativa tra peso del corpo dell’animale e peso della ghiandola. Schlottauer (1936) sosteneva che il peso della prostata sarebbe dovuto essere compreso tra 0,1 e 0,7 g/kg di p.c. e valori superiori avrebbero indicato la presenza di un fenomeno ipertrofico con significato patologico. In seguito, altri Autori (O’Shea, 1962) hanno considerato il rapporto peso ghiandola/peso corporeo abbastanza indicativo di processi patologici in atto, ma segnalano la presenza di numerose variazioni, sia legate al singolo individuo, sia alla razza e sia all’età, che rendono meno sicura tale comparazione.
È possibile suddividere le variazioni di volume della prostata nel corso della vita dell’animale in tre fasi: una prima fase di crescita normale che corrisponde al periodo che va dall’embriogenesi fino alla crescita post-natale e che termina intorno ai 2-3 anni di età; una fase di crescita iperplastica, androgeno dipendente, durante la vita adulta che termina approssimativamente intorno ai 10-12 anni e una terza fase di involuzione senile che ha inizio nel momento in cui la produzione di androgeni comincia lentamente a diminuire (intorno agli 11 anni di età). È difficile effettuare una netta distinzione tra questi periodi in quanto altamente soggettiva ed influenzata dalle differenze esistenti tra i singoli animali. Infatti, superati i 5 anni di età, quasi tutti i cani mostrano un ingrossamento della prostata accompagnato anche da alterazioni a livello istologico, testimonianza della presenza di una ipertrofia ghiandolare che in alcuni soggetti evolve verso l’ Ipertrofia prostatica benigna. Questo quadro clinico viene osservato nel 60% dei cani con più di 5 anni di età e quasi nel 100% dei cani con più di 10-12 anni (Simpson et al., 1998). Nei cani sani, superati i 10 anni, si verificare una
diminuizione nel peso della ghiandola, considerata come una manifestazione involutiva dell’età senile.
Ancora, Isaacs (1984) ha dimostrato che tra 4 e 16 mesi di età la prostata cresce con un tempo di raddoppiamento costante di 0,64 anni. Ciò corrisponde al tempo in cui il testosterone sierico raggiunge i normali livelli dell’età adulta. Una volta raggiunta la normale dimensione del soggetto adulto, la prostata cessa di crescere (circa 12-14 gr.) se il livello di testosterone si mantiene sui normali livelli dell’adulto e se non si sviluppa iperplasia.
1.2. Struttura
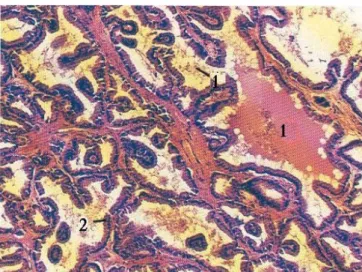
La prostata è una ghiandola tubuloalveolare composta, a secrezione sierosa (Bacha e Wood, 1997) (Figura 1.2.1.). Il corpo è avvolto da una capsula di connettivo denso, traslucido, che si inflette a formare due solchi mediani che dividono la ghiandola in due lobi. Dalla capsula si dipartono delle trabecole, ben evidenti, dirette verso il corpo ghiandolare, contenenti fibre muscolari lisce oltre a fibroblasti e collagene (Fawcett, 1994), nonché diramazioni vascolari e nervose (Figura 1.2.2.).
Figura 1.2.1. Corpo della prostata. Nel cane la prostata è una ghiandola a secrezione sierosa:
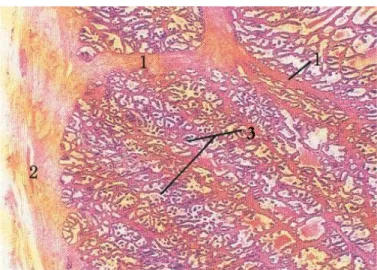
Figura 1.2.2 Corpo della prostata. Il corpo della prostata è circondato da una capsula formata da
tessuto connettivo denso e tessuto muscolare liscio; dalla superficie interna della capsula si dipartono trabecole che dividono la ghiandola in lobuli : 1-Trabecola; 2-Capsula; 3-Ghiandola; (Colorazione ematossilina-eosina). (Bacha e Wood, 1997).
Ciascun lobo è quindi suddiviso in diversi lobuli ben separati tra loro, che appaiono piramidali a base periferica; sono formati da tubuloalveoli composti che sboccano con 10-20 dotti prostatici terminali nell’uretra prostatica (Christie, 1981).
Le ghiandole tubuloalveolari hanno un lume largo, irregolare e ramificato e sono rivestite da epitelio semplice, che varia da cubico a clindrico e mostra un'attività secretoria apocrina (Luther, 1990). Le sue cellule, con nucleo ovoidale e basale, presentano tutte le caratteristiche di un'attività secernente intensa; il loro citoplasma contiene reticolo endoplasmatico ruvido ed apparato del Golgi ben sviluppati dove possono essere individuati granuli di secreto in formazione, di cui molti sembrano essere di natura lipidica (Pelagalli e Botte, 1999; Barone,1994). In seguito alla castrazione, l'epitelio diventa basso e le sue cellule perdono il loro carattere secernente; tuttavia, la somministrazione di testosterone ristabilisce la morfologia primitiva e l'attività funzionale (Barone, 1994).
L'epitelio riposa su una membrana basale esilissima e spesso indistinta. Le cellule epiteliali basali, definite anche cellule di riserva, sono presenti in maniera sporadica lungo tutta la membrana basale; il loro ruolo non è ben conosciuto, ma potrebbero essere precursori delle cellule epiteliali secretorie (Merk et al., 1982).
Esse sono, infatti, il tipo cellulare che prolifera maggiormente nella prostata dei cuccioli neonati. Nella ghiandola adulta esistono due popolazioni biologicamente distinte di cellule basali: quelle acinari, che formano uno strato discontinuo, e quelle duttali in strato contiguo. E’ stato rilevato che l’aumento, relativo all’età, del tasso di proliferazione della popolazione di cellule basali acinari, probabilmente mediato da steroidi sessuali, è un fattore chiave nella patogenesi dell’iperplasia prostatica canina, mentre il carcinoma prostatico probabilmente origina dalle cellule duttali (Leav et al., 2001).
I dotti escretori dapprima irregolari, risultano provvisti di numerose dilatazioni e diverticoli secernenti e sono ricoperti da un epitelio prismatico più alto del precedente. Tale epitelio diviene progressivamente stratificato fino ad assumere, nei dotti prostatici terminali, più stretti e meno irregolari, le caratteristiche del rivestimento uretrale (epitelio di transizione).
La struttura della parte disseminata non differisce molto da quella appena descritta (Barone R,1994).
Oltre alle cellule epiteliali basali e a quelle secretorie o luminali, è possibile distinguere morfologicamente una terza popolazione cellulare rappresentata dalle cellule neuroendocrine. Queste ultime rappresentano la porzione minore della popolazione epiteliale totale, ma sono distribuite in tutta la prostata in modo eterogeneo; sono coinvolte nella regolazione dell’omeostasi dei processi esocrini, come nella crescita e differenziazione della prostata (Hazem et al., 2002).
L'epitelio della ghiandola e dei dotti comprendono il 90% della massa prostatica; cellule muscolari lisce e tessuto connettivo rappresentano la parte rimanente (Strandberg e Berry, 1985).
1.3. Vascolarizzazione
La descrizione delle particolarità anatomiche della prostata e la distribuzione dei vasi sanguigni è essenziale per capire l’origine dei meccanismi fisiologici e dei processi patologici che interessano la ghiandola, nonché risultano essenziali per la scelta del trattamento farmacologico o chirurgico, quando ciò si renda necessario.
La conoscenza del letto microvascolare intraghiandolare normale e la densità vascolare risultano fondamentali per l’evidenziazione di una eventuale neovascolarizzazione della prostata considerata un importante indicatore diagnostico e segnale prognostico di malattia (Brading, 1999) poichè legato ad una aumentata richiesta di ossigeno e nutrienti, conseguenti ad una aumentata attività metabolica.
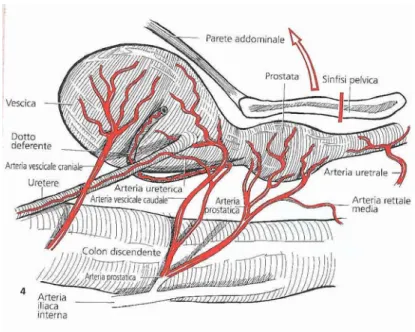
La principale irrorazione arteriosa deriva dall’arteria uro-genitale originante dall’arteria iliaca interna. L’arteria uro-genitale si divide in un ramo prostatico-vescicale e in un ramo prostatico-uretrale che vascolarizza la parte disseminata. Il tratto vescicale dell’arteria prostatica irrora alcuni rami prostatici e si ramifica, poi, nel dotto deferente, nel retto e nell’uretere. Il ramo uretrale, invece, irrora la maggior parte dei rame prostatici prima di irrorare l’uretra e la parte laterale del retto (Barsanti,1999). I rami prostatici si ramificano sulla superficie e penetrano nella ghiandola seguendo i setti connettivali fino ai fondi ciechi ghiandolari, dove danno luogo ad una fitta rete capillare.
Ogni lobo è approvvigionato attraverso l’arteria prostatica sinistra e destra, rispettivamente al lobo sinistro e al lobo destro.
L’arteria prostatica è di piccolo calibro, e la parete è simile alle arterie di tipo muscolare. La vena prostatica è, anch’essa, di piccolo calibro e munita di valvole. Nella prostata canina si distinguono tre zone vascolari: capsulare, parenchimale ed uretrale. I vasi di superficie della capsula sono prevalentemente vene ed il diametro dei vasi arteriosi è più grande di quello delle vene. Il parenchima è vascolarizzato dai rami dei vasi trabecolari che sono di due tipi: diretti e ramificati.
A livello capillare le cellule endoteliali sono unite da giunzioni molto strette. Si viene cosi’ a formare uno strato cellulare continuo, come se la parete interna dei vasi fosse tappezzata da un epitelio. A questo livello il transito può avvenire solo attraverso le cellule endoteliali, mentre nei capillari sistemici, fenestrati, gli scambi sono limitati solo dalle dimensioni del soluto rispetto ai pori, pertanto di può parlare di “barriera prostatica”.
La parte prostatica dell’uretra è raggiunta da un ramo indipendente dell’arteria prostatica (Miroslav, 2004).
La prostata è drenata da: vena prostatica, vena del bulbo uretrale e vene della prostata ventrale.
Figura 1.3.1 Prostata e vescica: vascolarizzazione (Dàvid et al., 2000).
I vasi linfatici sono numerosi e si raggruppano in una rete perighiandolare i cui efferenti si portano ai linfonodi iliaci mediali (Barone, 1994).
1.4. Innervazione
L’innervazione è fornita dal plesso prostatico. Il nervo pudendo innerva la muscolatura scheletrica dello sfintere esterno dell’uretra post-prostatica.
Le radici dei nervi pelvici da S1 a S3 forniscono l’innervazione motoria parasimpatica al muscolo detrusore della vescica. Il nervo pelvico segue l’arteria e la vena urogenitale prima di formare il plesso vescicale craniale, il plesso genitale mediano ed il plesso emorroidario caudale (Bojrab, 2001).
Il nervo ipogastrico, che origina a livello del ganglio mesenterico caudale e dal nervo mesenterico caudale, provvede all’innervazione simpatica della vescica
della prostata e dell’uretra (Berg, 1982), decorre anche nel legamento ombelicale laterale, accompagnando un ramo dell’arteria prostatico-vescicale.
La stimolazione parasimpatica è responsabile di un aumento della secrezione prostatica durante l’erezione, mentre quella simpatica provoca l’escrezione del secreto durante l’eiaculazione (Dorfman e Barsanti, 1998).
1.5. Fisiologia
La prostata, unica ghiandola sessuale accessoria nel cane maschio, ha una attività secretoria continua, indipendentemente dall’attività sessuale. Essa secerne un liquido chiaro e sieroso deputato a garantire un ambiente ottimale per la sopravvivenza e la motilità degli spermatozoi, ma non è essenziale per la fertilità (Luther, 1990). Poiché la motilità spermatica è maggiore soltanto ad un ph lievemente acido, la natura non molto acida del fluido prostatico è importante nel contrastare il carattere acido del fluido dei dotti deferenti e delle secrezioni vaginali della femmina (Kornegay, 1973). La secrezione prostatica si mescola al secreto testicolare conferendo volume al liquido seminale; il secreto prostatico, infatti, rappresenta circa il 97% dell’eiaculato.
Il contributo della prostata al plasma seminale varia da soggetto a soggetto e anche da momenti diversi dello stesso animale. Studi quantitativi, condotti durante l’eiaculazione, hanno evidenziato che durante un periodo che va da 3 a 35 minuti può essere secreto un volume di liquido prostatico variabile da 2 a 30 ml (Smith, 1975). Questo prodotto, in parte di nuova sintesi ed in parte preformato, costituisce la terza frazione dell’eiaculato anche se alcuni Autori (England e Allen, 1990) hanno dimostrato che perfino la prima frazione ha la stessa origine. Studi sperimentali hanno dimostrato, inoltre, che 0.1-2 ml /h di secreto si formano indipendentemente dalla stimolazione nervosa (Watanabe et al., 1988).
In condizioni normali, secrezioni basali di piccole quantità (<1 ml/h) di fluido prostatico fluiscono costantemente nei dotti escretori prostatici e nell’uretra prostatica. Quando non è in corso né la minzione né l’eiaculazione, la pressione
uretrale spinge tale secrezione basale in direzione craniale, all’interno della vescica (reflusso di fluido prostatico) (Watanabe et al., 1988).
Il secreto prostatico è un liquido acquoso, opalescente, ipotonico, con un ph leggermente acido (fra 6.0e 7.4). Come la quantità, così pure la composizione può variare in funzione di molteplici fattori, sia ormonali che nervosi. Sono presenti, in concentrazione minore del plasma, ioni sodio, cloro, potassio e bicarbonato. La secrezione attiva indotta dall’eiaculazione fa sì che si produca un secreto più proteico e isotonico; la concentrazione di sodio diviene uguale a quella del plasma, le concentrazioni di potassio e cloro divengono maggiori rispetto al plasma.
Il secreto contiene elevate concentrazioni di zinco, importante per la vitalità spermatica e detentore di proprietà antibatteriche in quanto, probabilmente, componente di un fattore antibatterico zinco-associato (Branam, 1984). La prostata del cane e dell'uomo normale, infatti, produce una sostanza antibatterica denominata “fattore antibatterico prostatico” (PAF = Prostatic Antibacterial Factor), un polipeptide contenente zinco, termostabile, idrosolubile, a basso peso molecolare e dotato di vasta attività antibatterica, soprattutto verso i batteri enterici Gram-negativi (Fair e Parrish, 1981).
Si ritiene inoltre che lo zinco sia importante per garantire una normale funzionalità dello sperma.
Oltre alla presenza di prostaglandine, immunoglobuline, lipidi e glucidi in quantità non molto elevata, la caratteristica del liquido prostatico è la sua ricchezza in enzimi tra i quali si ritrovano: glicuronidasi, amilasi, fibrinolisina, proteasi come l’antigene prostatico specifico (PSA) ma di particolare interesse sono la fosfatasi acida (PA) e l’arginina esterasi (CPSE), presente in elevate concentrazioni in quanto rappresenta il 90% delle proteine totali del liquido seminale (Chapdelaine, 1984). L’importanza che rivestono questi due enzimi consiste nel significato diagnostico che il loro livello può ricoprire; infatti, il livello di arginina esterasi dipende dall’ormone androgeno e le variazioni rispetto alla quantità normale (10 mg/ml) possono riflettere una situazione ormonale alterata (Isaac e Shaper, 1983). Per quanto riguarda la fosfatasi acida, presente in
quantità minori, il suo livello rappresenta un importante test diagnostico per gli uomini affetti da una malattia prostatica, mentre la sua utilità nel cane è dubbia (Dube et al., 1985).
In passato, si pensava che fosse la stimolazione parasimpatica (nervo pelvico) ad incrementare la produzione di fluido subito prima dell'eiaculazione (Bruchini e Schmidt, 1978) mentre oggi si ritiene che il controllo neurologico della secrezione dell'epitelio prostatico dipenda dalle fibre postgangliari colinergiche del nervo ipogastrico (stimolazione simpatica) (Robinette, 1993). La contrazione dello stroma fibromuscolare per rilasciare il liquido prostatico viene controllata principalmente dalle fibre postgangliari adrenergiche del nervo ipogastrico, con un possibile contributo di fibre colinergiche del nervo pelvico (Robinette, 1993). Come detto già in precedenza, la prostata è un organo androgeno-dipendente pertanto il mantenimento della normale qualità e quantità di secrezione prostatica richiede una adeguata stimolazione da parte degli androgeni.
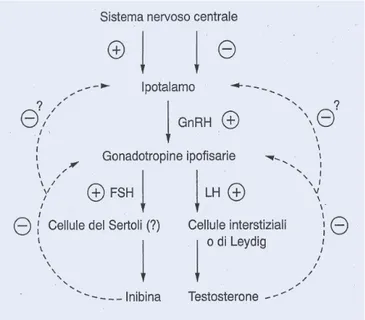
Nel cane adulto sano, l’androgeno presente in maggior quantità nel siero è il testosterone, prodotto per il 95% dalle cellule di Leydig testicolari. I livelli di testosterone fluttuano nell’arco delle 24h, con un massimo di secrezione la sera e un minimo al mattino. Questo andamento della produzione testicolare degli androgeni riflette rigorosamente la produzione dell’ormone gonadotropo ipofisario (ICSH), dalla quale dipende direttamente l’attività secretoria delle cellule di Leydig (Casella e Taglietti, 1996) (Figura 1.5.1.).
Nella prostata circa il 90% del testosterone libero viene convertito in diidrotestosterone (DHT), un metabolita che possiede un’attività almeno 2 volte maggiore rispetto al suo precursore. Sebbene il DHT nel siero è presente in basse concentrazioni, circa 10 volte meno del testosterone, nella ghiandola prostatica la concentrazione del DHT è 5 volte maggiore rispetto al testosterone. Il processo di conversione del testosterone in DHT, ad opera delle 5α-reduttasi, è irreversibile. Questo processo avviene per la maggior parte nello stroma e poi il DHT viene trasportato nelle cellule epiteliali, mentre, soltanto un 10% del DHT viene convertito nelle cellule dell’epitelio basale.
Figura 1.5.1. Meccanismi di retroazione (feed-back) positiva o negativa alla base della
regolazione endocrina della produzione di testosterone (Aguggini et al., 1998).
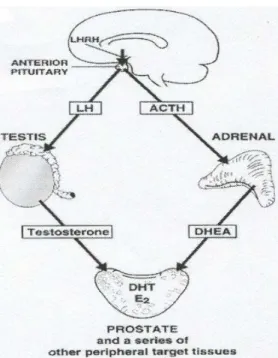
Il testosterone è anche la maggior fonte di estrogeni circolanti, che derivano da un processo enzimatico di aromatizzazione, anch’esso irreversibile, avente sede nel fegato, nel tessuto adiposo e nella prostata. Una modesta quantità di estrogeni, 10-25%, è prodotta anche dalle cellule del Sertoli testicolari, per trasformazione degli androgeni, che ad esse giungono dalle cellule di Leydig. Diversi studi hanno dimostrato che nei maschi i livelli di testosterone calano con l’età, questo non è il caso degli estrogeni circolanti, perciò in cani anziani il rapporto tra estradiolo libero e testosterone libero può aumentare di un 40%, ed è stato supposto che questo fatto potrebbe avere importanza nell’insorgenza dell’iperplasia prostatica benigna (Stone et al., 1986). In particolare gli estrogeni sembrano capaci di incentivare la crescita del compartimento stromale (Walsh e Wilson, 1976).
Altri androgeni capaci di stimolare la crescita prostatica sono gli androgeni surrenalici, in particolare l’androstenedione e il deidroepiandrosterone (DHEA). Il DHEA non possiede di per sé un’elevata attività androgena, però è trasformato nei tessuti in testosterone, e nella corteccia surrenale una piccola frazione è trasformata prima in testosterone e poi in estradiolo, e come tale agisce;
l’androstenedione ha attività analoga ma minore a quella del DHEA, e viene trasformato, sempre a livello della corteccia surrenale, in estrone (Figura 1.5.2.).
Figura 1.5.2. Rappresentazione schematica del ruolo del testicolo e del surrene nella produzione
degli ormoni steroidei (Labrie et al., 2001).
Di norma i corticosteroidi androgeni sono prodotti dal surrene in quantità così limitata, rispetto a quella del testosterone secreta dai testicoli, da non influenzare, particolarmente nel maschio, in modo significativo i caratteri e le funzioni sessuali. E’ stato dimostrato che soltanto in corso di tumori delle surrenali in cui la produzione può essere eccedente, possono essere incentivate la crescita e le variazione morfologiche della prostata (Oesterling et al., 1986).
Un altro ormone che agisce sulla prostata è la prolattina, ormone pituitario, che aumenta e migliora l’assorbimento del testosterone nella prostata. Diversi studi sperimentali hanno confermato, infatti, che l’assorbimento di androgeni nella prostata aumenta circa del 20% in concomitanza alla somministrazione di prolattina (Assimos et al., 1984). Ciò è dovuto, probabilmente, al fatto che questo ormone modifica la fluidità della membrana plasmatica con un incremento della solubilità agli steroidi, aumenta il gradiente di concentrazione all’interno delle membrane plasmatiche aumentando la diffusione passiva degli steroidi, aumenta
la quota di steroidi liberi nel sangue e facilita il trasporto degli androgeni legati alle proteine (Farnsworth, 1999).
La prolattina è anche un fattore di crescita e differenziazione, ed è evidente un diretto effetto sulle cellule epiteliali (McKeehan et al., 1984), giustificato dalla presenza di numerosi recettori prolattinici nelle porzioni apicali dell’epitelio secretorio e dal numero limitato a livello dello stroma (Aragona e Friesen, 1975).
1.5.1 Recettori prostatici
La risposta dei tessuti agli ormoni è determinata dalla presenza di recettori cellulari e dall’apparato post-recettoriale al quale il recettore è accoppiato. Un recettore è capace di riconoscere ogni ormone come entità distinta e di legarlo a lui, modificando il metabolismo cellulare e/o la crescita cellulare.
È stato dimostrato che nel citosol della prostata ci sono tre tipi di recettori steroidei con distinta specificità, classificati in recettori androgeni, estrogeni e progestinici (Frenette et al., 1982). I recettori per gli estrogeni nella prostata sono presenti in numero scarso, ma sono molto importanti per la crescita delle cellule staminali e la secrezione della matrice extracellulare, si trovano nelle cellule dell’epitelio e, in maggior quantità, in quelle dello stroma (Farnsworth, 1999). L’estradiolo, infatti, soltanto dopo essersi combinato con specifici recettori per gli estrogeni, induce un aumento del numero dei complessi recettoriali androgeni a livello nucleare e la presenza di recettori del progesterone nel citoplasma (Walsh, 1984).
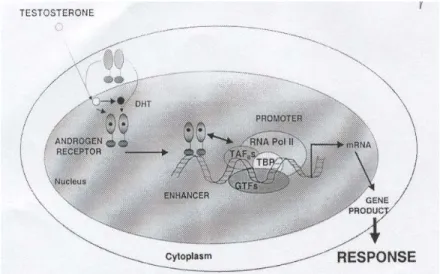
Il DHT lega specifici recettori androgeni (AR) localizzati nella membrana nucleare, principalmente nelle cellule epiteliali e in numero minore nelle cellule stromali (Farsnworth, 1999). Dal legame con il DHT, i recettori vengono attivati e divengono quindi capaci di legare il DNA, causando la trascrizione genica. Una volta attivati, i recettori possono agire senza l’ulteriore influenza dell’androgeno (Ekman, 2000). Il nuovo m-RNA prodotto esce attraverso i pori nucleari nel citoplasma iniziando, nei ribosomi, la sintesi di nuovi peptidi per la crescita di cellule epiteliali prostatiche (Figura 1.6.1.).
Figura 1.6.1 Dopo che il testosterone si lega ai recettori degli androgeni, ilcomplesso
testosterone-recettore è trasportato nel nucleo, dove si unisce alla cromatina e causa la trascrizione genica (Berrevoets et al., 2002).
Il testosterone e il DHT si legano agli stessi recettori per gli androgeni, sebbene i complessi DHT-recettore siano più efficaci nell’azione sul cromosoma e, quindi, più androgenici (Cheville, 2003). Sperimentalmente è stato visto che il trattamento con 3a-androstenediolo fa aumentare i recettori androgeni e fa diminuire i recettori estrogeni e progestinici.
Nella prostata è stato individuato anche un altro tipo di recettore, il recettore prolattinico, il cui numero nel tessuto prostatico iperplastico aumenta, determinando una diminuizione sierica della prolattina per aumento del numero dei legami (Walsh, 1984).