Capitolo 4
Parte Sperimentale
Metodi e materiali
Gli spettri NMR sono stati registrati con uno strumento Bruker Avance 250 (250 MHz) operante in trasformata di Fourier. I dati sono stati determinati su soluzioni dei prodotti in CDCl3, DMSO o sul liquidi ionici come tali (tubo coassiale con DMSO) e sono riportati in ppm (J in Hertz).
Le misure UV-vis sono state effettuate con uno spettrometro Varian Cary 2200. I dye utilizzati per la determinazione dei suddetti parametri sono:
Reichardt’s dye (90%, Aldrich)
N,N-dietil-4-nitroanilina (pura, Frinton) 4-nitroanilina (99+%, Aldrich)
La misurazione della viscosità è stata effettuata con il viscosimetro Brookfield DV-II+ Pro, software associato, Rheocalc V3.2. Il modello matematico utilizzato per l’elaborazione delle misure è il Casson. Il perno rotante utilizzato è SC4-18.
L’apparecchio utilizzato per la conducibilità è conducimetro Cond 510 della XS instruments.
105 In entrambi i casi è stato utilizzato il bagno termostatato Brookfield TC-502.
Per le densità è stato utilizzato un densimetro AP PAAR DMA55 calculating density meter.
Le voltammetrie cicliche sono state effettuate con un Princeton Applied Research (PAR) 273A Potentiostat/Galvanostat, controllato tramite il software PAR M270. Tutte le misurazioni sono state condotte in atmosfera di argon in una cella a tre elettrodi in platino a 303 K. L’area di 0,031 cm2 dell’elettrodo di lavoro è stata valutata elettrochimicamente usando il picco della corrente di ossidazione di una soluzione 2 mM di Ferrocene (Fe(C5H5)2, Fc) in MeCN (0,1 M Bu4NPF6) attraverso la relazione di Randles-Sevcik.
Il gas cromatografo utilizzato per l’analisi dei prodotti è HP 5890 series II. Il flusso dei gas: aria 250 kPa, idrogeno 110 kPa e elio 200 kPa. Lo strumento è dotato di splittaggio in due colonne: HP-Wax (Crosslinked Polyethylene Glycol) 30m x 0,25 mm x 0,25 µm Film Thickness, HP-5 (Crosslinked 5% Ph Me Silicone) 30m x 0,25 mm x 0,25 µm. La rampa prevedeva una T iniziale di 50 °C mantenuta tale per 4 minuti, quindi un incremento di 3 °C al minuto fino al raggiungimento di 240 °C mantenuti per 20 minuti.
Per le analisi GC-MS è stato usato un GC Varian Chromopack CP-3800 associato ad un Varian Chromopack Saturn 2000.
Materiali:
2-cicloesen-1-olo (96%, Aldrich), 2-cicloesen-1-one (GC > 95%, Fluka), 3,5-dimetilpirazolo (99% Acros), 4-clorobutirronitrile (97%, Aldrich), Acido cloridrico (37% Carlo Erba), Acido esafluorofosforico (60%, Aldrich), Argento nitrato (puro, Cabro), Acetone (per HPLC, Carlo Erba), Acetonitrile (per HPLC, Carlo Erba), Butilbromuro (99% Aldrich), Butilcloruro (99%, Aldrich), Butilioduro (98% Aldrich), Cicloesene (puro, Aldrich), Cicloesene ossido (GC 98%, Aldrich), Cobalto(II) acetilacetonato (97%, Aldrich), Dimetilcarbonato (99% Acros), Etilbromuro (98%, Aldrich), Etilioduro (ReagentPlus® 99% Aldrich), Ferro(II) acetilacetonato (99,95%, Aldrich), Fe(III) acetilacetonato (99,9+%, Aldrich), Ferro(II) ammonio solfato (puro, Carlo Erba), Fe(III) cloruro (anidro, ≥ 97%, Fluka), Litio bis(trifluorometilsulfonil)immide (puro, Iolitec),
106 Magnesio solfato (97%, puro, anidro, Acros), Manganese(IV) ossido (attivato < 5 µm ~ 85%), Metilioduro (ReagentPlus® 99% Aldrich), N-metilimidazolo (99+%, Aldrich), Ottilcloruro (99%, Aldrich), Pirazolo (100% Fluka), Perossido di idrogeno (35%, Aldrich), Potassio carbonato (≥ 99%, anidro, Fluka), Potassio idrossido (≥ 85% Aldrich), Rame(II) cloruro (97%, Aldrich), Sodio metossido (98+% Strem), Sodio dicianammide (puro, Fluka), Sodio tetrafluoroborato (98%, Aldrich), Tungstato di sodio (99%, Aldrich), Undecano (≥ 99%, Aldrich).
107
N-metilpirazolo
Ad una soluzione di pirazolo (1,5 g, 21,59 mmol) e metilioduro (5,2 mL, 23,93 mmol) in MeCN (22 mL) è stato aggiunto KOH (2,64 g, 40,01 mmol). La miscela di reazione è stata riscaldata a 60 °C per 24 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico (4 x 25 mL). La fase organica è stata essiccata su MgSO4 ed il solvente evaporato a pressione ridotta. Il prodotto isolato (resa 66%) è stato identificato sulla base degli spettri NMR.
Ad una soluzione di pirazolo (0,5 g, 7,20 mmol) e DMC (9,2 mL) in MeCN (5 mL) è stato aggiunto sodio metossido (0,79 g, 14,39 mmol) e la miscela è stata scaldata alla temperatura di riflusso per 13 ore, sotto agitazione. Dopo neutralizzazione con 1,2 mL di HCl ed aggiunta di 7 mL di acqua il prodotto è stato estratto con etere dietilico (5 x 6 mL). La fase organica è stata estratta essiccata su MgSO4 e dopo evaporazione del solvente il prodotto isolato (resa 83%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, CDCl3): δ = 3,91 (s, 3H), δ = 6,23 (s, 1H), δ = 7,34 (s, 1H), δ = 7,48 (s, 1H).
108 N-etilpirazolo N N H N N Et EtI KOH/MeCN
Ad una soluzione di pirazolo (3 g, 43,17 mmol) ed etilioduro (3,56 mL, 44,51 mmol) in MeCN (40 mL) è stato aggiunto KOH (5,28 g, 79,99 mmol) e la miscela di reazione è stata riscaldata a 60 °C per 48 ore, sotto agitazione. Dopo aggiunta di acqua il prodotto è stato estratto con etere dietilico (5 x 40 mL) e la fase organica è stata essiccata su MgSO4 per dare, dopo evaporazione del solvente a pressione ridotta, il prodotto atteso (resa 54%), identificato sulla base degli spettri NMR.
1H NMR (250 MHz, CDCl3): δ = 1,46 (t, 3H), δ = 4,18 (q, 2H), δ = 6,21 (t, 1H), δ = 7,37 (d, 1H), δ = 7,47 (d, 1H).
13C NMR (250 MHz, CDCl3): δ = 15,89, δ = 47,12, δ = 105,56, δ = 128,42, δ = 139,32.
109 N-butilpirazolo N N H N N Bu BuI KOH/MeCN
Ad una soluzione di pirazolo (3 g, 43,17 mmol) e butilioduro (5,2 mL, 45,49 mmol) in MeCN (40 mL) è stato aggiunto KOH (5,33 g, 95,09 mmol) e la miscela di reazione è stata riscaldata a 60 °C per 48 ore, sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico (5 x 50 mL). La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 89%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, CDCl3): δ = 0,90 (t, 3H), δ = 1,27 (m, 2H), δ = 1,81 (m, 2H), δ = 4,09 (t, 2H), δ = 6,20 (s, 1H), δ = 7,33 (s, 1H), δ = 7,46 (s, 1H).
13C NMR (250 MHz, CDCl3): δ = 13,88, δ = 20,10, δ = 32,77, δ = 52,12, δ = 105,40, δ = 129,09, δ = 139,28.
110
1,3,5-trimetilpirazolo
Ad una soluzione di 3,5-dimetilpirazolo (5 g, 54,01 mmol) e metilioduro (3,50 mL, 56,17 mmol) in 70 mL di acetone è stato aggiunto K2CO3 (15,53 g, 112,3 mmol). La miscela di reazione è stata riscaldata a 50 °C per 96 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico. La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 67%) è stato identificato sulla base degli spettri NMR.
Ad una soluzione di 3,5-dimetilpirazolo (1,5 g, 15,45 mmol) e metilioduro (1,07 mL, 17,19 mmol) in MeCN (20 mL) è stato aggiunto KOH (1,89 g, 28,63 mmol). La miscela di reazione è stata riscaldata a 60 °C per 24 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico. La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 90%) è stato identificato sulla base degli spettri NMR.
Ad una soluzione di 3,5-dimetilpirazolo (5 g, 51,49 mmol) e DMC (37 mL) è stato aggiunto sodio metossido (4,3 g, 77,24 mmol). La miscela di reazione è stata posta a riflusso per 13 ore sotto agitazione. Dopo neutralizzazione con 6,5 mL di HCl ed aggiunta di 50 mL di acqua il prodotto organico è stato estratto con etere dietilico (5 x 30 mL). La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 90%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, CDCl3): δ = 2,19 (s, 6H), δ = 3,68 (s, 3H), δ = 5,77 (s, 1H). 13C NMR (250 MHz, CDCl3): δ = 11,38, δ = 13,67, δ = 35,89, δ = 105,08, δ = 139,38, δ = 147,36.
111
1-etil-3,5-dimetilpirazolo
Ad una soluzione di 3,5-dimetilpirazolo (3 g, 30,89 mmol) ed etilioduro (2,55 mL, 31,88 mmol) in 40 mL di MeCN è stato aggiunto KOH (3,78 g, 57,24 mmol). La miscela di reazione è stata riscaldata a 60 °C per 48 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico (5 x 40 mL). La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 89%) è stato identificato sulla base degli spettri NMR.
Ad una soluzione di 3,5-dimetilpirazolo (3 g, 30,89 mmol) ed etilbromuro (2,59 mL, 34,70 mmol) in 40 mL di MeCN è stato aggiunto KOH (3,78 g, 57,24 mmol). La miscela di reazione è stata riscaldata a 60 °C per 60 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico (5 x 40 mL). La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 99%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, CDCl3): δ = 1,35 (t, 3H), δ = 2,19 (s, 6H), δ = 3,97 (q, 2H), δ = 5,75 (s, 1H).
13C NMR (250 MHz, CDCl3): δ = 11,20, δ = 13,75, δ = 43,73, δ = 105,12, δ = 138,34, δ =147,35.
112
1-butil-3,5-dimetilpirazolo
Ad una soluzione di 3,5-dimetilpirazolo (3 g, 30,89 mmol) e butilioduro (5,4 mL, 46,94 mmol) in 40 mL di acetone è stato aggiunto K2CO3 (9 g, 65,12 mmol). La miscela di reazione è stata riscaldata a 50 °C per 102 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico. La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 75%) è stato identificato sulla base degli spettri NMR.
Ad una soluzione di 3,5-dimetilpirazolo (3 g, 30,89 mmol) e butilioduro (3,70 mL, 34,29 mmol) in 40 mL di MeCN è stato aggiunto KOH (3,78 g, 57,24 mmol). La miscela di reazione è stata riscaldata a 60 °C per 60 ore sotto agitazione. Dopo aggiunta di acqua il prodotto organico è stato estratto con etere dietilico. La fase organica è stata essiccata su MgSO4 e, dopo evaporazione del solvente a pressione ridotta, il prodotto isolato (resa 89%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, CDCl3): δ = 0,91 (t, 3H), δ = 1,30 (m, 2H), δ = 1,74 (m, 2H), δ = 2,19 (s, 6H), δ = 3,91 (t, 2H), δ = 5,74 (s, 1H).
13C NMR (250 MHz, CDCl3): δ = 11,33, δ = 13,77, δ = 14,05, δ = 20,28, δ = 32,85, δ = 48,75, δ = 104,92, δ = 138,68, δ = 147,29.
113
[1-butil-2-metilpirazolio]Ioduro
La soluzione di 1-metilpirazolo (4,12 g, 25,55 mmol) e butilioduro (3,04 mL, 26,60 mmol) in 20 mL di MeCN è stata riscaldata alla temperatura di riflusso per 120 ore sotto agitazione. Il prodotto è stato lavato con una miscela di acqua/etere dietilico e la fase acquosa è stata evaporata a pressione ridotta. Il prodotto isolato (resa 20%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, DMSO): δ = 0,90 (t, 3H), δ = 1,31 (sex, 2H), δ = 1,80 (quintetto, 2H), δ = 4,15 (s, 3H), δ = 4,46 (t, 2 H), δ = 8,43 (d, 1H).
13C NMR (250MHz, DMSO): δ = 13,90, δ = 20,11, δ = 32,79, δ = 52,14, δ = 105,44, δ = 129, 14, δ = 139,29.
114
[1-butil-2,3,5-trimetilpirazolio]Ioduro
La soluzione di 1,3,5-trimetilpirazolo (6,59 g, 35,46 mmol) e butilioduro (4,22 mL, 36,92 mmol) in 25 mL di MeCN è stata riscaldata alla temperatura di riflusso per 120 ore sotto agitazione. Il prodotto è stato lavato con una miscela di acqua/etere dietilico e la fase acquosa è stata evaporata a pressione ridotta. Il prodotto isolato (resa 57%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, D2O): δ = 0,90 (t, 3H), δ = 1,33 (sex, 2H), δ = 1,72 (quintetto, 2H), δ = 2,36 (s, 3H), δ = 2,39 (s, 3H), δ = 3,87 (s, 3H), δ = 4,29 (t, 2H), δ =6,39 (s, 1H).
13C NMR (250 MHz, D2O): δ = 11,46, δ = 13,09, δ = 19,32, δ = 30,54, δ = 33,56, δ = 46,76, δ = 107,70, δ = 146,78.
115
[1-butirronitril-2-metilpirazolio]Ioduro
La soluzione di 1-metilpirazolo (11,86 g, 144,44 mmol) e 4-iodobutirronitrile (28,73 mL, 147,34 mmol) in 50 mL di MeCN è stata riscaldata alla temperatura di riflusso per 96 ore sotto agitazione. Il prodotto è stato lavato con una miscela di acqua/etere dietilico e la fase acquosa evaporata a pressione ridotta. Il prodotto isolato (resa 26%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, D2O): δ = 2,24 (quintetto, 2H), δ = 2,57 (t, 2H), δ = 4,06 (s, 3H), δ = 4,52 (t, 2H), δ = 6,69 (t, 1H), δ = 8,11 (d, 1H), δ = 8,17 (d, 1H).
13C NMR (250 MHz, D2O): δ = 13,61, δ = 24,11, δ = 36,94, δ = 48,07, δ = 107,33, δ = 119,60, δ = 137,25, δ = 138,32.
116
[1-butirronitril-2,3,5-trimetilpirazolio]Ioduro
La soluzione di 1,3,5-trimetilpirazolo (10,74 g, 97,48 mmol) e 4-iodobutirronitrile (19,59 mL, 100,46 mmol) in 45 mL di MeCN è stata riscaldata alla temperatura di riflusso per 96 ore sotto agitazione. Il prodotto è stato lavato con una miscela di acqua/etere dietilico e la fase acquosa è stata evaporata a pressione ridotta. Il prodotto isolato (resa 65%) è stato identificato sulla base degli spettri NMR.
1H NMR (250 MHz, D2O): δ = 2,19 (quintetto, 2H), δ = 2,40 (s, 3H), δ = 2,45 (s, 3H), δ = 6,62 (t, 2H), δ = 3,93 (s, 3H), δ = 4,47 (t, 2H), δ = 6,43 (s,1H).
13C NMR (250 MHz, D2O): δ = 10,72, δ = 10,87, δ = 23,58, δ = 33,08, δ = 44,45, δ = 107,44, δ = 119,54, δ = 146,04, δ = 146,87.
117
[Rmim][X]
[bmim][Cl]
Una soluzione di N-metil-imidazolo (10 mL, 125 mmol) e n-butil-clururo (14,85 mL, 138 mmol) in 40 mL di acqua, è stata riscaldata alla temperatura di riflusso per 5 giorni sotto agitazione. Il solvente è stato evaporato a pressione ridotta. Il prodotto è stato isolato con resa del 95%.
[omim][Cl]
Una soluzione di N-metil-imidazolo (5,0 mL, 62,73 mmol) e n-ottil-clururo (10,7 mL, 62,75 mmol) in 15 mL di acqua, è stata riscaldata alla temperatura di riflusso per 9 giorni sotto agitazione. Il solvente è stato evaporato a pressione ridotta per 8 ore. Il prodotto è stato isolato con resa dell’ 89%.
[emim][Br]
Una soluzione di N-metil-imidazolo (10,0 mL, 0,125 mol) e N-etil-bromuro (9,6 mL, 0,156 mol) in 20 mL di acqua, è stata posta a riflusso per 4 giorni sotto agitazione. La fase acquosa è stata essiccata a pressione ridotta per 8 ore. Il prodotto isolato ha dato una resa del 92%.
butirronitrile-mim Cloruro
Una soluzione di N-metilimidazolo (4,0 mL, 50,6 mmol) e 4-clorobutirronitrile (,54 mL, 58,1 mmol) in 70 mL di acqua è stata riscaldata a 80 °C per 4 giorni. La miscela
118 di reazione è stata quindi lavata tre volte con THF e poi lasciata una notte a decantare. La fase non eterea è stata seccata a pressione ridotta, ottenendo 7,42 g di un solido bianco, resa 79%.
119
N,N’-dialchilpirazolio Bis(trifluorometilsulfonil)immide
Ad una soluzione di 1-butil-2-metilpirazolio ioduro (12,0 g, 44,92 mmol) in 150 ml di acqua è stato aggiunto LiTf2N (13,29 g, 45,82 mmol). La miscela di reazione è stata mantenuta sotto agitazione a temperatura ambiente per 7 ore, fino a formazione di un sistema bifasico. Allontanata la fase acquosa, il liquido ionico solubilizzato in diclorometano è stato lavato con acqua (3 x 50 ml), la fase organica e è stata seccata ed il solvente allontanato per evaporazione a pressione ridotta (resa del 90%).
La stessa procedura è stata utilizzata per preparare i seguenti liquidi ionici, con resa come riportato:
- [bmpz][Tf2N]: 89% - [bm3pz][Tf2N]: 98% - [C3(CN)mpz][Tf2N]: 85% - [C3(CN)m3pz][Tf2N]: 80% - [bmim][Tf2N]: 96%.
120
Argento Dicianammide
A 30 mL di acqua è stata aggiunta una soluzione di argento nitrato (2,0 g, 12 mmol in 10 mL di acqua) ed una soluzione di sodio dicianammide (1,0 g, 12 mmol, in 10 mL di acqua). La miscela è stata riscaldata a 50 °C sotto agitazione per 30 minuti. Il solido ottenuto (AgN(CN)2) è stato filtrato su setto con porosità uguale a 3 e lavato con acqua (40 mL). Resa 100%.
N,N’-dialchilpirazolio Dicianammidi
Ad una soluzione dell’opportuno alchil-pirazolio ioduro in 100 mL di acqua sono stati aggiunti 1,2 equivalenti di argento dicianammide, preparato di fresco, e 150 mL di acqua. La miscela è stata mantenuta sotto agitazione e leggero riscaldamento. Dopo 2 ore, il solido formato è stato allontanato per filtrazione e la soluzione acquosa è stata concentrata, a pressione ridotta. Il prodotto è stato seccata sotto vuoto per 6 ore.
La stessa procedura è stata utilizzata per preparare i seguenti liquidi ionici, con resa come riportato:
- [bmpz][N(CN)2]: 89% - [bm3pz][N(CN)2]: 92%.
121
Ossidazioni
Le reazioni sono state condotte in parallelo. La procedura seguita per tutte le ossidazioni è stata la seguente:
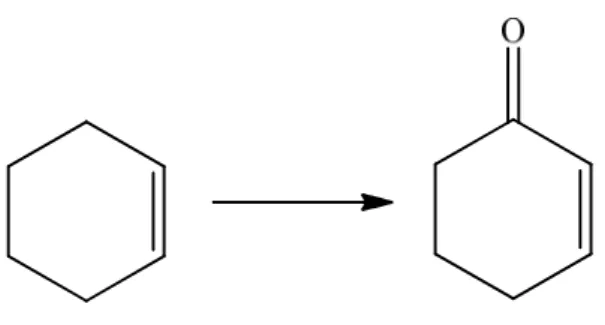
- Ad 1 g di liquido ionico è stata aggiunta l’opportuna quantità di catalizzatore metallico (vedi tabelle 3.2, 3.3, 3.4, 3.5, 3.6 e 3.7). Alla miscela raffreddata a 0 °C con bagno di ghiaccio è stata addizionata lentamente l’H2O2 35% (da 1 a 4 equivalenti rispetto al cicloesene). Dopo 5 minuti a 0 °C, sono stati aggiunti 0.5 mL di cicloesene (5,0 mmol) e la miscela è stata mantenuta sotto agitazione per i tempi riportati nelle tabelle 3.2, 3.3, 3.4, 3.5, 3.6 e 3.7. A tempi prestabiliti le miscele di reazione sono state estratte con Et2O (4 x 12 mL). Gli estratti eteri sono stati essiccati su MgSO4 e analizzati per GC o GC-MS dopo aggiunta dello standard interno (undecano).
La soluzione standard è stata preparata miscelando 13,1 mg di undecano, 47,2 mg di cicloesene, 25,5 mg di cicloesenolo, 41,2 mg di cicloesenone e 52,1 mg di cicloesene ossido in 5 ml di etere etilico anidro (Tabella 4.1).
Tabella 4.1. Fattori di correzione per le reazioni di ossidazione effettuate.
Tempo di
ritenzione (min) Area (mV/s)
Fattore di correzione cicloesene 4,7 257742,4 1,22 cicloesenolo 10,1 241750,1 1,44 cicloesenone 11,5 181770,7 1,51 cicloesene ossido 13,7 242719,9 1,43 undecano 22,4
122 È stato possibile quindi calcolare il fattore di correzione, per relazionare le aree a delle quantità, nell’analisi dei campioni:
݂௦ = ൬ܣݎ݁ܽ݉݃ ൰ ௗ ൬ܣݎ݁ܽ݉݃ ൰ ௦ = 257742 × 13,1 = 1,2287272 × 47,2 ݂௦ = ൬ܣݎ݁ܽ݉݃ ൰ ௗ ൬ܣݎ݁ܽ݉݃ ൰ ௦ = 241750 × 13,1 = 1,4487272 × 25,5 ݂௦ = ൬ܣݎ݁ܽ݉݃ ൰ ௗ ൬ܣݎ݁ܽ݉݃ ൰ ௦ = 181770 × 13,1 = 1,5187272 × 41,2 ݂௦ ௦௦ௗ = ൬ܣݎ݁ܽ݉݃ ൰ ௗ ൬ܣݎ݁ܽ݉݃ ൰ ௦ ௦௦ௗ = 242719 × 13,1 = 1,4387272 × 52,1 Le quantità ottenute sono state calcolate mediante la formula:
݉݃௫ = ܣݎ݁ܽ݉݃ௌ௧ௗௗ