1
Indice
- Introduzione
………....5- Capitolo I :
Il ruolo delle adipochine nell’insufficienza delle cellule β nel
diabete di tipo 2
1.1Leptina……… 8
1.2 Adiponectina ………..9
1.3 Fattori di necrosi tumorale α ………12
1.4 Resistina ………..12
1.5 Visfatina ………...13
1.6 Apelina ……….14
1.7 Interazioni tra adipochine nei loro effetti
sulle cellule β ………..15
- Capitolo II :
Epidemiologia del diabete di tipo 2 e importanza dei predittori
di rischio
2.1 Considerazioni generali ……….17
2.2 Predittori tradizionali di rischio del
diabete di tipo 2 ………19
2.3 Predizione genetica del diabete di tipo 2 ………23
2
- Capitolo III :
Ciclofillina-A: un potenziale marcatore di screening della malattia
vascolare nel diabete di tipo 2
3.1 Patofisiologia della malattia vascolare nel diabete …...26
3.2 Marcatori di screening per la malattia vascolare
nel diabete ……….28
3.3 Biomarcatori dell‟infiammazione per la malattia
vascolare ……….29
3.4 Le proteine dei monociti come potenziali
marcatori nella malattia vascolare e nel diabete ……….31
3.5 Ciclofillina-A come nuovo promettente marcatore ……33
3.6 Infiammazione,ROS e ciclofillina-A ……….34
- Capitolo IV :
Biomarcatori proteomici o di rischio del diabete mellito di tipo 2
nelle donne con sindrome dell’ovaio policistico
4.1 Considerazioni generali ………..37
4.2 Le caratteristiche principali degli studi ………..39
4.3 Studi proteomici per il diabete mellito di
tipo 2 ………...39
4.4 Caratteristiche degli 8 biomarcatori ………...41
- Capitolo V:
La prevenzione del diabete di tipo 2
5.1 Farmaci anti-iperglicemici ……….45
5.2 Dieta ………...48
5.3 Farmaci per l‟obesità ……….49
3
- Capitolo VI :
Terapie immunomodulanti per il diabete di tipo 2
6.1 Considerazioni generali ………..52
6.2 IL-1β e antagonista del recettore IL-1β ………..55
6.3 Bloccanti del TNFα ………...56
6.4 Agonisti dei recettori attivati dal proliferatore dei
perossisomi (gamma agonisti) …………..………..57
6.5 Statine ……….59
6.6 Salicilati ………..59
- Capitolo VII :
Nuove immunoterapie per il trattamento del diabete di tipo 2
7.1 Resolvin ……….61
7.2 Inibitori del recettore toll-like ( TLR ) ………...61
7.3 Inibitori della deacetilasi degli istoni (HDAC) ………..62
7.4 Inibitori della dipeptidil peptidasi ( DPP-4) …………...63
7.5 Attivatori sirtuin ……….67
7.6 Glitazars ……….67
7.7 Terapia anti -CD3……… ...68
4
- Capitolo VIII :
Nuove speranze per i diabetici di tipo 2: prendere di mira
l’insulino-resistenza attraverso l’immunomodulazione di cellule staminali
8.1 Considerazioni generali ……….69
8.2 Terapia con cellule staminali educatrici ……….71
8.3 Efficacia dell‟immunomodulazione delle cellule
staminali nel trattamento del diabete di tipo 2…………...72
- Conclusioni ……….75
- Bibliografia ……….77
5
Introduzione
Il diabete di tipo 2 è il tipo di diabete più comune, con tassi di prevalenza che superano il 12% della popolazione in India, il 9,7% in Cina e l‟8,3% negli Stati Uniti. L‟incidenza del diabete di tipo 2 sta aumentando in tutto il mondo a causa della diffusione di uno stile di vita occidentale, caratterizzato da eccessi nutrizionali e da scarso esercizio fisico. 1
Le complicazioni associate al diabete, ad esempio, malattie cardiovascolari, ictus, cecità, insufficienza renale e stress emotivo, peggiorano notevolmente la qualità della vita dei pazienti con diabete di tipo 2, limitando la produttività degli individui con la malattia e creando pesi economici e sociali significativi. Trovare una cura per il diabete di tipo 2 è una priorità importante.
Negli adulti, tradizionalmente, il diabete di tipo 2 è stato caratterizzato da glicemia a digiuno elevata e da un test di tolleranza al glucosio anormale senza una evidenza della distruzione autoimmune delle cellule β delle isole pancreatiche. Tuttavia evidenze raccolte nel corso del decennio passato indicano che nell‟eziologia del diabete di tipo 2, c‟è una componente autoimmune che dà inizio ad un‟infiammazione che colpisce le cellule β delle isole pancreatiche, questo fornisce una nuova visione in relazione al meccanismo e per il potenziale trattamento della resistenza all‟insulina. 2,3
L‟insulina è un ormone prodotto dalle cellule β delle isole pancreatiche ed ha un ruolo fondamentale nel regolare a livello cellulare il metabolismo, la crescita, la differenziazione, la sopravvivenza e l‟omeostasi, attraverso recettori espressi nelle cellule di tutti i tessuti.
L‟eziologia autoimmunitaria è stata a lungo associata con il diabete di tipo 1, mentre il diabete di tipo 2 è stato storicamente considerato una malattia metabolica.
Le recenti scoperte, però, che hanno evidenziato il coinvolgimento del sistema immunitario nello sviluppo del diabete di tipo 2 e nel progressivo deterioramento della funzione delle cellule β, hanno messo in dubbio la vecchia designazione del diabete di tipo 2, come malattia puramente metabolica. 4
6
L‟insufficienza delle cellule β del pancreas e l‟insulino-resistenza possono essere considerati degli eventi fondamentali che portano allo sviluppo del diabete di tipo 2. Nelle prime fasi della malattia, l‟insulino-resistenza, viene contrastata da un aumento delle cellule β pancreatiche, in massa e funzione che può spesso ritardare la diagnosi per un periodo di anni. Con l‟andar del tempo, la cellula β soccombe all‟insulino resistenza, attraverso, la glucotossicità, la lipotossicità e di conseguenza si avrà l‟iperglicemia. Per prevenire l‟insorgenza del diabete di tipo 2 è importante mantenere sia la massa che la funzione delle cellule β del pancreas.
Lo sviluppo del diabete di tipo 2, adesso è stato collegato allo stabilirsi di infiammazione cronica associata all‟obesità nel tessuto adiposo viscerale. Mano a mano che un individuo diventa obeso, avvengono parecchi cambiamenti all‟interno del tessuto adiposo, causando uno spostamento da un mezzo antiinfiammatorio ad un ambiente infiammatorio.
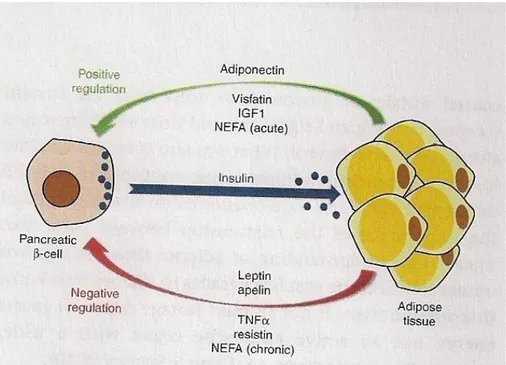
Tali modifiche includono: ipertrofia degli adipociti, un decremento dell‟adiponectina (una proteina antiinfiammatoria prodotta da adipociti), un aumento nei livelli plasmatici della proteina C-reattiva (plasmatica) e i livelli aumentati di citochine pro- infiammatorie, come l‟interleuchina, (IL-6), fattore di necrosi tumorale ( TNF α) e IL-1β, attivazione del fattore di trascrizione nucleare, infiltrazione di macrofagi pro- infiammatori e infiltrazione di CD8+ pro-infiammatorio nel tessuto adiposo. 5,6 Il rapporto tra pancreas e tessuto adiposo per molti anni è stato ritenuto essere come una strada a senso unico . Era accettato che la secrezione di insulina da parte delle isole pancreatiche in risposta alla glicemia aumentata, causava l‟uptake del glucosio negli adipociti, attraverso il legame ai recettori per l‟insulina e questo portasse all‟aumentato immagazzinamento di triacilglicerolo. L‟ insulino-resistenza nel tessuto adiposo contribuiva all‟insufficienza delle cellule β. Adesso sappiamo che il tessuto adiposo non è un inerte magazzino di stoccaggio di energia in eccesso, ma è un organo endocrino attivo, con un secretoma ampio, biologicamente attivo.
Le molecole rilasciate dal tessuto adiposo o dagli adipociti vengono comunemente chiamate adipochine. La maggior parte delle adipochine sono peptidi, proteine con proprietà di tipo ormonale (qualcune sono citochine), ma in questo contesto anche gli acidi grassi non esterificati, NEFAS, acidi grassi liberi, possono essere considerati come adipochine. L‟aumento dei depositi di tessuto adiposo che si ha nell‟obesità può portare ad un‟alterazione nella regolazione della secrezione di adipochine,
7
questo giustifica un potenziale collegamento patofisiologico tra obesità e diabete di tipo 2. Alcune adipochine aumentano la sensibilità insulinica, ad esempio l‟adiponectina e la visfatina; altre al contrario, la riducono causando insulino– resistenza, ad esempio resistina, fattore di necrosi tumorale (TNF α). 7
Figura 1 rappresentazione dell’interrelazione tra il tessuto adiposo e le cellule β
8
CAPITOLO I:
Il ruolo delle adipochine nell’insufficienza delle
cellule β nel diabete di tipo 2
1.1 Leptina
La leptina è un ormone prodotto prevalentemente dagli adipociti, importante per la regolazione del bilancio energetico, avente bersagli sia a livello del sistema nervoso centrale, che a livello dei tessuti periferici, come le cellule β delle isole pancreatiche. La leptina è stata la prima adipochina ad essere associata ad effetti pancreatici diretti e certamente la più studiata in relazione ai suoi effetti. Oggi generalmente si ritiene che abbia un potente effetto inibitorio sulla secrezione di insulina da parte delle cellule β pancreatiche in vitro e in vivo ed ha l‟effetto aggiuntivo di ridurre l‟espressione del gene pre-proinsulina. Modelli sperimentali animali caratterizzati da un difetto genetico di produzione di leptina (topi ob/ob) o da un deficit del suo recettore, sono caratterizzati da insulino-resistenza.
Alcune ricerche fatte utilizzando cellule β umane, hanno dimostrato che concentrazioni basse inibiscono il rilascio di insulina e livelli più alti hanno un effetto stimolatorio. 8
La leptina riduce l‟espressione della proteina 2 di disaccoppiamento (UCP 2) in queste isole e questo può contribuire ad un effetto dell‟adipochina nel miglioramento dell‟apoptosi delle cellule β. Al contrario uno studio recente non ha trovato l‟effetto della leptina sull‟apoptosi, nonostante causasse un aumento della proliferazione cellulare, mediato dalle specie attive dell‟ossigeno (ROS), e non ha riscontrato che la leptina inibiva la GSIS, cioè la secrezione di insulina stimolata da glucosio. I bassi livelli di ROS promuovono la massa delle cellule β e questo può sottolineare l‟importanza del risultato dello studio, sopra citato, nel quale si affermava che la leptina diminuiva UCP2, proteina che riduce i livelli di ROS.
Le cellule β del pancreas esprimono il recettore per la leptina, LepR (Ob-R) e gli effetti di quest‟ultima sulle cellule sono diretti. La leptina attiva vie di segnalazione
9
multiple nelle cellule β pancreatiche ed una via classica è l‟attivazione della via Jak/STAT dove la chinasi JAK 2 associata al recettore fosforila dei residui di tirosina su LepRb che successivamente fosforila e che poi possono traslocare nel nucleo e regolare la trascrizione genica. 9
Un‟altra via, nella quale è coinvolta la leptina, è quella del fosfoinositide 3-chinasi , attivata dall‟insulina. Alcune ricerche hanno dimostrato che questo può determinare l‟inibizione di PTEN, una fosfatasi di lipidi e proteine che agisce a valle della P13K, defosforilando il fosfatidilinositolo trifosfato e diminuendo i suoi livelli.
In tal modo la leptina può aumentare il fosfatidilinositolo trifosfato, che porta ad un aumento dell‟attivazione dei canali del potassio ATP-Dipendenti, all‟iperpolarizzazione della membrana delle cellule β e all‟inibizione del GSIS. Hanno successivamente dimostrato che la delezione di PTEN proteggeva da effetti nella funzione e nella massa delle cellule β in modelli murini di diabete di tipo 2, compreso in topo ob/ob con deficienza di leptina. 10
1.2 Adiponectina
L‟adiponectina fu una delle prime adipochine identificate e a differenza di molte altre ha effetti benefici, migliorando la sensibilità all‟insulina e la funzione vascolare, quindi è sia anti-diabetica che anti-aterogenica. L‟aumento di adiposità si associa con una diminuita secrezione di adiponectina, apparentemente perché gli adipociti ipertrofici la rilasciano meno. L‟adiponectina è in circolo come un‟associazione multimerica dell‟adiponectina a lunghezza intera e viene scissa ad una forma globulare. L‟adiponectina è ridotta nell‟obesità e nel diabete ed i suoi livelli circolanti sono inversamente correlati al rischio di sviluppare diabete . Gli effetti di tale ormone sono mediati dall‟interazione con due tipi di recettori di membrana: Adipo R1, espresso prevalentemente nel muscolo scheletrico e Adipo R2, espresso nel fegato. 11
[Molti degli effetti dell‟interazione adiponectina-adipoR sono mediati da AMPK, dal recettore α attivato dal proliferatore dei perossisomi (PPARα) ]
10
L‟azione insulino-sensibilizzante a livello cellulare è mediata dall‟attivazione delle AMP-chinasi, con conseguente stimolo alla β-ossidazione degli acidi grassi, riduzione dei livelli di FFA circolanti e riduzione del deposito di trigliceridi nei tessuti periferici (muscolo scheletrico, fegato, pancreas). La mancanza dell‟effetto protettivo dell‟adiponectina porta ad insulino-resistenza nell‟obesità e nel diabete, si verifica anche una ridotta espressione dei recettori Adipo R1 e Adipo R2. Ciò è stato osservato nei topi ob/ob, nel muscolo scheletrico e sembra contribuire ad un ridotto effetto di stimolo dell‟attivazione dell‟AMP chinasi.
La somministrazione dell‟ormone nell‟animale da esperimento migliora l‟insulino- resistenza, riduce i livelli di glucosio, FFA e trigliceridi.
Ci sono evidenze sostanziali degli effetti dell‟adiponectina sulla funzione e sopravvivenza delle cellule β e sull‟espressione di entrambi i recettori AdipoRs in cellule β primarie e clonali. Sono stati fatti diversi studi per capire le azioni dell‟adiponectina sulle cellule β.
Alcune ricerche che usavano la linee di cellule β clonali di topo NIT-1, hanno dimostrato che l‟Adipo R2 veniva espresso in queste cellule. Si trovò che l‟incubazione con l‟acido grasso palmitato, che causa l‟apoptosi delle cellule β, per 24 ore, aumentava l‟espressione di adipo R2 che poi diminuiva di nuovo dopo 48 ore; l‟agonista del PPARα clofibrato, ritardava il danneggiamento dell‟espressione di Adipo R2 da parte del palmitato. 12
L‟adiponectina aumentava la fosforilazione di AMPK e aggiungendo anche clofibrato aumentava ancora di più la fosforilazione e in parte il palmitato revocava l‟inibizione di GSIS ovvero la secrezione di insulina stimolata dal glucosio.
Altri studi che utilizzavano la cellula clonale di ratto INS-1, trovarono che il glucosio intermittente (IHG), causava alle cellule β, più danni del glucosio mantenuto elevato nel tempo (SHG) e che questo danneggiamento veniva in parte revocato dall‟adiponectina.
Il glucosio elevato intermittente causava più apoptosi e danneggiava la GSIS in modo maggiore rispetto al SHG, ma l‟adiponectina in parte revocava il danno.
Quindi l‟adiponectina in parte ripristinava il contenuto di insulina e l‟espressione mRNA del gene PDX1 (homeobox 1) pancreatico e duodenale, che erano state diminuite soprattutto da IHG.
11
In altre ricerche, riguardanti l‟adipochina, venne usata la linea BRIN-BD11 di cellule beta clonali e dimostrarono che l‟espressione di adipo R1 era molto più alta di quella di adipo R2. Furono confrontati gli effetti della proteina globulare (ADN) e del frammento ADN15-36. L‟oleato NEFA monoinsaturo protettivo diminuiva l‟mRNA dell‟Adipo R1 e un agonista PPARα diminuiva l‟espressione di Adipo R1. Il palmitato diminuiva l‟mRNA di Adipo R2, ma gli agonisti PPARα diminuivano l‟espressione di AdipoR2. L‟adiponectina globulare, ma non ADN 15-36 aumentava fortemente l‟espressione della lipasi delle lipoproteine ma diminuiva leggermente l‟espressione di PDX1. Nè l‟uno né l‟altro frammento aveva effetto sull‟espressione dell‟insulina.
Successivamente dimostrarono che anche ADN aumentava la fosforilazione di ERK nelle cellule MIN6 ma a differenza dei precedenti studi, trovarono che proteggeva dall‟apoptosi indotta da deprivazione di siero e fu misurato mediante dosaggio della caspasi 3 scissa. 13
Recentemente hanno fornito prove convincenti che molte delle azioni dell‟adiponectina sono mediate attraverso l‟attivazione, mediante Adipo R1/R2, di un‟attività ceramidasica che porta alla generazione di sfingosina 1-fosfato e suggeriscono che l‟AMPK sia coinvolto soltanto tramite l‟attivazione a valle. Hanno dimostrato che l‟adiponectina protegge le cellule β dall‟apoptosi mediata da caspasi 8. Studi fatti nel 2012, hanno dimostrato che l‟adiponectina aumenta la proliferazione delle cellule β clonali (RIN e MIN 6), senza influenzare l‟apoptosi. Questi effetti sembrano coinvolgere la produzione di ROS inibendo l‟espressione di enzimi antiossidanti come la superossido dismutasi. Gli autori riportano che queste molecole ossidanti possono avere un ruolo fisiologico nel regolare la massa delle cellule β. Tuttavia non trovarono alcun effetto dell‟adiponectina sulla secrezione di insulina. L‟effetto complessivo di livelli alti di adiponectina sarebbe quello di conservare la massa delle cellule β o attraverso l‟inibizione dell‟apoptosi o aumentando la proliferazione delle cellule β, mentre i bassi livelli trovati nell‟obesità e nel diabete di tipo 2, contribuirebbero alla sua riduzione.
Gli individui con elevati livelli plasmatici di un‟adipochina antiinfiammatoria, l‟adiponectina, hanno un basso rischio di sviluppare il diabete di tipo 2. 14
12
1.3 Fattore di necrosi tumorale α
Il fattore di necrosi tumorale è una citochina pro-infiammatoria che determina la morte delle cellule β, nel diabete di tipo 1, attraverso il sistema immunitario, è anche un‟adipochina e i livelli elevati che si riscontrano nell‟obesità sembrano essere responsabili dell‟insulino resistenza. Anche se ci sono evidenti effetti del TNFα sulle cellule β, che possono portare al diabete di tipo 2, recenti studi sostengono che un aumento dei livelli di TNFα nelle persone e negli animali obesi, non raggiunge livelli tali da avere effetti negativi sulla funzione o sopravvivenza delle cellule β. TNFα può indurre l‟apoptosi delle cellule β, attraverso il fattore nucleare attivatore della catena leggera kappa della via delle cellule β attivate.
Diverse ricerche attestano effetti diretti del TNFα sull‟inibizione della secrezione di insulina.
Un ultimo studio ha riportato che TNFα induce l‟espressione di amilina da parte della cellula β. Gli autori riportano che non c‟era una contemporanea induzione dell‟espressione della proinsulina da parte del TNFα e questo può determinare un aumento del rapporto tra amilina e insulina nelle cellule β, e ad un eccesso della secrezione di amilina, rispetto a quella di insulina. Considerando che l‟amilina può determinare la distruzione delle cellule β e che il rapporto tra insulina e l‟amilina circolanti, potrebbe causare insulino-resistenza, ciò ci fa ulteriormente pensare che il TNFα sia coinvolto nel legame tra obesità e insulino-resistenza. 15
1.4 Resistina
La resistina, una molecola secreta dagli adipociti, fu identificata nel 2001 ed era in grado di indurre, in modo forte, insulino-resistenza nei roditori. Fu scoperta in seguito all‟analisi di geni degli adipociti che vengono indotti e soppressi a seguito del trattamento con farmaci chiamati tiazolidindioni, capaci di aumentare la sensibilità tissutale all‟insulina e importanti perché agonisti del PPRAγ, un recettore nucleare che regola lo sviluppo delle cellule adipose e l‟omeostasi del glucosio. Fu dimostrato
13
che la resistina viene fortemente down-regolata a seguito dell‟attivazione del PPARγ indotta dal rosiglitazone e fu ipotizzato essere un gene per il diabete.
Successivamente gli studi fatti da Nagaev e Smith nel 2001, che dimostravano nei roditori l‟effetto insulino resistente, determinato da resistina, non vennero riprodotti con successo nell‟uomo e questo provocò un calo di interesse nei confronti di questa molecola.
Nel 2007, Brown e altri, dimostrarono che la resistina down-regolava i livelli di espressione del recettore dell‟insulina nelle cellule β clonali e quindi diminuiva la vitalità delle cellule β. Successivamente Nakata e altri, videro che la resistina induceva insulino-resistenza nelle isole pancreatiche, provocando una riduzione della secrezione di insulina stimolata da glucosio. 16,17
Tutti questi studi però vennero fatti su cellule β murine e i risultati non sono ancora stati ripetuti su cellule umane. Tuttavia è stato dimostrato che nelle cellule β del pancreas, vi è la resistina e la sua espressione è up-regolata nel diabete di tipo 2, per cui, anche se deve essere ancora dimostrato il ruolo della resistina nelle cellule umane, sembra che possa avere un‟azione importante come proteina intracellulare.
1.5 Visfatina
La visfatina è una proteina di recente identificazione, prodotta e secreta soprattutto nel tessuto adiposo viscerale, la cui espressione tissutale e i cui livelli plasmatici sono direttamente proporzionali al grado di obesità addominale.
E‟ un enzima fosforibosiltransferasico, inizialmente descritto come un insulino mimetico in parte ritrattato da alcuni studi ma successivamente alcune ricerche hanno dimostrato che la visfatina può agire in modo simile alle adipochine, aumentando la secrezione di insulina.18
A livello dei tessuti periferici la visfatina condivide molte delle azioni dell‟insulina, come dimostrato da alcuni studi sperimentali nei quali la somministrazione di alte dosi di visfatina ricombinante ha ridotto i livelli di glucosio sia nei topi insulino resistenti che in quelli insulino-deficienti. Quando viene somministrata in topi
14
diabetici, migliora l‟insulino-sensibilità, riducendo sia la glicemia che la insulinemia. Tali effetti sono mediati dal recettore insulinico stesso, del quale l‟adipochina è un ligando, anche se con un sito di legame diverso da quello dell‟insulina. Sembra avere un effetto addizionale a quello dell‟insulina, mediante l‟attivazione di cascate alternative di trasduzione del segnale ormonale.
Alcuni studi hanno dimostrato che la visfatina non solo aumentava la secrezione di insulina da parte delle cellule β, ma che aveva anche un effetto diretto attivando i recettori per l‟insulina delle cellule β, aumentando la loro fosforilazione.
Un recente studio, ha dimostrato che la visfatina stimolava la proliferazione delle cellule β ed inibiva l‟apoptosi delle cellule β indotta da palmitato, risultati che suggeriscono l‟effetto positivo che ha la visfatina sulla massa delle cellule β.
I meccanismi che dimostrano le azioni della visfatina sulle cellule β, non sono ancora completamente compresi, ma sembrano anche coinvolgere la produzione enzimatica della nicotinammide mononucleotide che regola la trascrizione di insulina.
Rimane tuttavia da stabilire se gli effetti complessivi della visfatina siano benefici o deleteri per le cellule β. Alcuni studi dimostrano che gli effetti benefici si hanno a livelli fisiologici più bassi, mentre le concentrazioni patologiche più alte possono avere effetti dannosi. 19
1.6 Apelina
L‟apelina è un peptide identificato di recente che viene ampiamente espressa e che funziona come un‟adipochina con effetti sul comportamento alimentare e sull‟utilizzo di glucosio. Il recettore dell‟apelina APJ, viene espresso nelle isole e la sua attivazione inibisce la secrezione di insulina. Recenti studi suggeriscono che l‟apelina stessa viene espressa nelle isole pancreatiche, specialmente nelle cellule β, c‟è quindi la possibilità di effetti autocrini e paracrini. 20
15
1.7 Interazioni tra adipochine nei loro effetti sulle cellule β
La maggior parte degli studi fatti, hanno analizzato il ruolo delle singole adipochine sulle cellule β del pancreas, tuttavia, in vivo la cellula β ed il recettore dell‟insulina, sono esposti all‟azione di livelli alterati dell‟intera gamma dell‟adipochine . Come possiamo vedere in figura 2, molte adipochine interagiscono tramite vie che si intersecano, per esempio vie di segnalazione che coinvolgono P13k, AMPK, MAPK, ERK1/2 . I cambiamenti delle concentrazioni delle adipochine circolanti osservati nelle malattie metaboliche sono complessi e richiedono ulteriori studi.
Figura 2 Interazioni tra le adipochine nelle cellule β
In conclusione, possiamo affermare che un numero crescente di ormoni vengono secreti dal tessuto adiposo e hanno un‟importante funzione nel mantenimento o nella perdita di massa o funzione delle cellule β. Tuttavia è necessario vedere se questi fattori determinano lo sviluppo del diabete o se contribuiscono alla sua progressione ,
16
influenzando la velocità alla quale la cellula β perde la sua capacità di compensare l‟insulino-resistenza . E‟ però possibile affermare con una certa sicurezza che le adipochine sono un fattore significativo nell‟insufficienza delle cellule β. 2
ADIPOCHINE EFFETTI
Adiponectina Aumenta GSIS
Aumenta la proliferazione
Apelina Inibisce la secrezione di insulina
Leptina
Inibisce GSIS
Diminuisce i livelli di pre-proinsulina Protegge dalla apoptosi
Resistina Diminuisce i recettori dell‟insulina e
aumenta la vitalità delle cellule
TNF α
Inibisce GSIS
Diminuisce la trascrizione di insulina Induce apoptosi
Aumenta l‟amilina ma non l‟espressione del gene della pro-insulina
Visfatina Aumenta la secrezione di insulina
Tabella 1: Riassunto delle adipochine con una dimostrazione degli effetti sulle cellule pancreatiche
17
CAPITOLO II :
Epidemiologia del diabete di tipo 2 e importanza dei
predittori di rischio
2.1 Considerazioni generali
I dati epidemiologici internazionali indicano che il diabete di tipo 2 sta assumendo a livello mondiale un andamento tipicamente epidemico, cioè caratterizzato dal rapido incremento del numero di persone affette.
Proiezioni nel tempo prevedono il raddoppio del numero dei soggetti affetti nell‟arco di trenta anni. L‟incremento più rilevante è atteso nelle aree in via di sviluppo, dove è aumentata la prevalenza di obesità. L‟incremento temporale nella prevalenza del diabete di tipo 2 riconosce cause diverse : aumentata incidenza della malattia, più giovane età di esordio e di diagnosi della malattia, aumentata sopravvivenza dei diabetici e soprattutto invecchiamento della popolazione generale.
Il rischio di diabete di tipo 2 è in larga parte determinato da età, obesità, familiarità ed etnia.
I dati dello studio di Casale Monferrato indicano un aumento non solo del diabete pari al 44% ma anche della prevalenza di obesità nei diabetici. 22
Nei soggetti con età < 65 anni la prevalenza del diabete di tipo 2 è aumentata in modo irrilevante, mentre nella fascia di età > 65 anni l‟incremento è stato notevole. Oltre gli 80 anni si è registrato il raddoppio della prevalenza. L‟incremento è quindi particolarmente evidente nelle persone che hanno un‟età > 65 anni, che attualmente rappresentano i 2/3 della popolazione diabetica. La prevenzione, attraverso lo screening, dovrebbe essere rivolta a questa fascia di popolazione. Inoltre le disuguaglianze sociali incidono fortemente sul rischio di contrarre il diabete: la prevalenza di diabete è più elevata nelle donne e nelle classi sociali più basse e tale effetto è evidente in tutte le classi di età.
18
Grafico 1: Prevalenza di diabete per sesso, età e classe sociale
E‟ inoltre confermato il ruolo dell‟obesità, che aumenta il rischio di sviluppare il diabete rispetto al normopeso. Predittori di diabete sono risultati essere l‟alterata glicemia a digiuno, la ridotta tolleranza ai carboidrati, il peso, la dislipidemia e l‟ipertensione arteriosa.
Il diabete di tipo 2 rappresenta un tipico esempio di “ malattia complessa “ ad eziologia multifattoriale, che riconosce, tra gli altri fattori patogenetici, anche una suscettibilità genetica; la componente genetica non ha un diretto rapporto causa-effetto con la malattia, ma agisce solo come un fattore di rischio per la stessa.
Studi recenti hanno dimostrato che sono coinvolti contemporaneamente molti geni nello stesso individuo. Negli ultimi 15 anni, mediante studi di associazione che hanno esaminato l‟intero genoma GWAS ( genome-wide association studies ), sono stati identificati una ventina di loci associati alla malattia, anche se per alcuni di essi , il livello di significatività statistica non è ancora quello ritenuto ottimale.
Tutti gli studi a cui si fa riferimento hanno evidenziato, in modo omogeneo, come l‟informazione genetica è certamente in grado di predire lo sviluppo del diabete di tipo 2, ma che l‟informazione che si ottiene modifica di poco la capacità di predizione che oggi si ottiene basandosi solo su parametri anamnestici come la
19
familiarità, clinici come la presenza di obesità e bio-umorali, come il livello di glicemia a digiuno.
Chiaramente con il crescere del numero di determinanti genetici che verranno identificati nel prossimo futuro, con il miglioramento delle conoscenze su come questi geni interagiscono tra di loro e con fattori di rischio clinici ed ambientali, l‟utilità del test genetico nella predizione del diabete di tipo 2 è destinato ad aumentare e ad arrivare ad una fruibilità clinica.
2.2 Predittori tradizionali di rischio del diabete di tipo 2
Una variante genetica associata al diabete di tipo 2 è fissata dal concepimento e questa dovrebbe dare qualche vantaggio predittivo, rispetto ad altri predittori di rischio che variano nel corso della vita, come l‟indice di massa corporea, la storia della famiglia. Il rischio del diabete di tipo 2 aumenta con stili di vita scorretti, come la sedentarietà, diete con alto carico glicemico o ricche di grassi.
Predittori di rischio sono anche rappresentati da una storia familiare con persone affette da diabete o da una storia personale di diabete gestazionale. Il rischio di sviluppare il diabete di tipo 2 è aumentato con l‟obesità e con livelli elevati di pressione del sangue.
I livelli di glicemia a digiuno più alti predicono il diabete di tipo 2, e una tolleranza al glucosio difettosa (IGT) funziona in modo analogo al predittore, ma la combinazione di IFG (glucosio a digiuno difettosa) e IGT comporta un rischio maggiore rispetto agli altri da soli. Valori alti di emoglobina glicata e livelli particolarmente elevati di trigliceridi e di lipoproteine ad alta densità predicono il diabete di tipo 2 .
Analizzo più in dettaglio i predittori di rischio.
L‟alterazione della regolazione glicemica si riferisce a due condizioni metaboliche : l‟alterata tolleranza al glucosio, (IGT) e l‟alterata glicemia a digiuno (IFG) . In Italia, solo il 20-25% dei soggetti con IFG e/o IGT, sviluppa il diabete nell‟arco di 10 anni . I soggetti che soddisfano i criteri diagnostici per IGT o per IFG, pur avendo valori
20
glicemici intermedi tra la normale tolleranza glucidica e l‟ iperglicemia diabetica, presentano frequentemente altre alterazioni metaboliche ed un elevato rischio cardiovascolare rispetto ai soggetti normoglicemici.
Le basi fisiopatologiche di queste due condizioni metaboliche sono differenti. Il controllo della glicemia a digiuno dipende dalla capacità di mantenere un‟adeguata secrezione basale di insulina e dalla presenza di un‟appropriata insulino-sensibilità sia a livello epatico sia a livello muscolare, al fine di sopprimere la produzione epatica di glucosio e di garantire un‟appropriata captazione del glucosio stesso a livello del fegato e del muscolo scheletrico; nell‟ IGT è presente un‟insulino- resistenza muscolare. IGT e IFG presentano sia una diversa prevalenza sia delle differenze fenotipiche. L‟ IFG prevale nell‟età compresa tra i 40 e i 50 anni, con l‟eccezioni delle donne europee nelle quali aumenta dopo i 70 anni ed è più frequente nel sesso maschile in tutti i gruppi d‟età, fatta eccezione per gli europei tra i 70-79 anni e gli asiatici tra gli 80 - 89 anni. La prevalenza di IGT aumenta con l‟aumentare dell‟età ed è più frequente nel sesso femminile con l‟eccezione della popolazione asiatica sopra i 60 anni e della popolazione europea sopra agli 80 anni. 23,24
Numerosi studi hanno valutato il potere predittivo di IGT e di IFG nei confronti dello sviluppo di diabete ed è risultato che l‟incidenza di diabete è più elevata nei soggetti che presentano entrambe le condizioni e tende ad essere sovrapponibile nei soggetti con IGT o IFG isolati.
Si osservano anche delle differenze tra gruppi etnici, ad esempio negli indiani l‟IFG presenta un valore predittivo superiore all‟IGT mentre il contrario avviene nella popolazione italiana.
Riguardo all‟associazione tra l‟obesità , misurata come indice di massa corporea , (IMC) e progressione verso il diabete, i dati sono contrastanti. In alcuni studi, risultava essere un fattore predittivo indipendente di progressione da IGT a diabete , mentre in altri l‟associazione tra IMC ed evoluzione verso il diabete non dava risultati significanti durante il periodo di follow-up. L‟IMC non risultava essere un forte predittore di diabete, soprattutto nelle popolazioni con la più alta incidenza di diabete. In un'altra analisi, la distribuzione viscerale del tessuto adiposo, predice la progressione da IGT a diabete.
Nelle diverse popolazioni la maggiore variabilità è rappresentata dalla correlazione tra età e progressione verso il diabete. Il diabete si svilupperà in età precoce nelle
21
persone geneticamente suscettibili e dopo i 40-50 anni, il tasso di progressione declina. Oltre a questi fattori predittivi tradizionali alcuni studi hanno evidenziato che lo sviluppo del diabete è associato anche allo stile di vita delle persone. Soggetti sedentari, che praticavano lavori di concetto, avevano una maggiore possibilità di ammalarsi di diabete, rispetto ad agricoltori e pescatori.
I valori di insulinemia cioè l‟aumento di glicemia a digiuno e la diminuzione dell‟insulinemia dopo il carico di glucosio, nei soggetti con IGT, correlano con la progressione verso il diabete. 25
In sintesi la glicemia a digiuno e dopo carico, l‟ iperinsulinemia a digiuno e la ridotta risposta di insulina al carico, la distribuzione viscerale del tessuto adiposo, l‟indice di massa corporea, l‟età, lo stile di vita sedentario hanno un elevato valore predittivo per l‟evoluzione a diabete, mentre la familiarità per il diabete ed il genere non sono predittivi.
Un altro fattore di rischio è rappresentato dal diabete gestazionale, caratterizzato da un‟intolleranza ai carboidrati di vario grado e severità, con inizio o primo riconoscimento durante la gravidanza.
In genere dopo il parto si assiste ad un completo ritorno alla normalità e solo una piccola percentuale di donne persiste nello stato diabetico dopo il parto. E‟ importante tener presente che le donne, inizialmente ritornate ad uno stato di normoglicemia, sono esposte ad un più alto rischio di sviluppare alterazioni metaboliche negli anni successivi sotto forma di diabete di tipo 1, di tipo 2. 26
Il diabete gestazionale è più frequente in donne con familiarità positiva per il diabete mellito, sovrappeso-obese e con età maggiore di 35 anni. Al contrario hanno un minimo rischio di sviluppare il diabete gestazionale le donne di età inferiore a 25 anni, normopeso e con familiarità negativa per diabete mellito. E‟ importante sottolineare che questo tipo di diabete rappresenta una condizione di elevato rischio per il DM2 e può essere la prima manifestazione; per tali motivi l‟attenzione a tale patologia si presenta imperativa in termini non solo di cura e prevenzione a breve termine, cioè fino all‟espletamento del parto, ma anche di prevenzione a lungo termine.
22 A seguito di alcuni studi, si è arrivati a capire che:
-la progressione da diabete gestazionale a DM2 aumenta soprattutto nei primi 5 anni dopo il parto
-Livelli glicemici a digiuno elevati nel corso della gravidanza, sono forti predittori dello sviluppo futuro del diabete
-L‟etnia può risultare importante nel determinare la suscettibilità ad avere livelli glicemici elevati
-Nonostante lo screening non sia eseguito ovunque, le conoscenze attuali delle possibilità di prevenire il diabete di tipo 2, inducono a promuovere tale screening proprio nell‟intento di usarlo per identificare una popolazione ad alto rischio di DM2 -La familiarità per il diabete di tipo 2, l‟età della gestante, l‟ IMC materno pre e post gravidico, la precocità della diagnosi di DG e la necessità di terapia insulinica sono i maggiori fattori di rischio per lo sviluppo di diabete nelle donne che sono state affette da diabete gestazionale.
Fattori di rischio per il diabete di tipo 2
Età
Sovrappeso
Inattività fisica
Parenti di 1° grado con diabete
Storia di diabete gestazionale
Ipertensione arteriosa
Sindrome dell‟ovaio policistico
Malattie cardiovascolari
Età ≥ 45 anni
23
2.3 Predizione genetica del diabete di tipo 2
Un beneficio del progetto sul genoma umano era la diagnosi precoce delle predisposizioni genetiche alla malattia. Il decennio che seguì al sequenziamento del genoma umano, ha visto la generazione di un numero sufficiente di dati genetici. Anche se l‟incidenza del diabete di tipo 2 può essere ritardata o impedita, mantenendo uno stile di vita sano, l‟ identificazione di sottogruppi della popolazione a rischio particolarmente elevato per il diabete di tipo 2, potrebbe agevolare il paziente.
Nell‟era pre-genomica gli studi sui gemelli e la famiglia avevano un ruolo importante nel separare le componenti genetiche dalle ambientali del diabete di tipo 2.
Gli studi sui gemelli hanno dimostrato che l‟influenza della componente genetica nel diabete di tipo 2 ha una percentuale del 25-40%, il che suggerisce che sia i fattori genetici che non genetici, contribuiscono in modo sostanziale ad un rischio di diabete di tipo 2 individuale.
Avere un genitore con il diabete di tipo 2 raddoppia il rischio di un individuo e avere due genitori interessati può aumentare il rischio di un individuo fino a sei volte. I dati degli studi di Framingham Offspring, dimostrano che il rischio genetico aumenta con la storia della famiglia, tuttavia, le varianti genetiche del diabete di tipo 2 note non rendono conto della forte relazione del rapporto tra storia familiare e rischio del diabete di tipo 2. In base agli studi fatti, la storia familiare, rispetto alle varianti genetiche attualmente identificate, rimane il fattore predittivo più potente del diabete di tipo 2.
Le prove finora fatte non giustificano l‟uso di routine dei test genetici per predire il diabete di tipo 2 nelle cure cliniche. Allo stato attuale alcune limitazioni della base di conoscenze contribuiscono alla modesta performance dell‟informazione genotipica, come predittore di rischio.
Gli studi sull‟ampiezza del genoma, compresi quelli che scoprirono le varianti note del diabete di tipo 2, si basano su piattaforme di array di genotipizzazione, che non riescono a trovare una percentuale maggiore della variazione comune nelle popolazioni ancestrali non europee, a causa dei tassi di linkage disequilibrium ( LD )
24
più bassi in questi gruppi. La maggior parte delle varianti note associate al diabete di tipo 2 sono in regioni introniche non codificanti. 27
Questa osservazione suggerisce che queste varianti possono essere solo dei surrogati nel LD con le vere varianti casuali. Se si facesse la mappatura e il risequenziamento di queste regioni, si dovrebbero identificare le varianti casuali che dovrebbero avere forti associazioni con il diabete di tipo 2 dei loro surrogati e quindi migliorerebbe la previsione genetica.
Sebbene questi test abbiano probabilmente identificato la maggior parte dei loci più comuni associati al diabete di tipo 2, nelle popolazioni di origine europea la genetica del diabete di tipo 2 è tuttora un‟area attiva di ricerca.
Il divario più grande per predire il diabete è l‟omogeneità razziale degli studi fatti fino a ora. La metà delle analisi di questo gruppo di studi del diabete di tipo 2 si è avvantaggiata del grado minore di LD nelle popolazioni europee per identificare le associazioni genetiche con il T2D. Gli studi di previsione genetica per prima applicarono queste scoperte in popolazioni di origine europea simili a quelli in cui sono stati scoperti e invece quelli in altri gruppi razziali, restano indietro.
Le frequenze degli alleli di rischio variano per molti tratti, a seconda della razza e delle etnie. In genere gli studi sulle associazioni genetiche trovano che le varianti associate al diabete di tipo 2 provenienti da studi sul genoma europei hanno effetti simili nelle popolazioni non europee.
Gli SNP europei associati al T2D, sono dei surrogati più semplici delle vere varianti casuali in vecchie popolazioni come gli africani, che hanno un LD genomico più frammentato. Lo studio sul genoma, in popolazioni diverse, porterà ad almeno due vantaggi. In primo luogo estenderà la conoscenza sull‟architettura genetica del diabete di tipo 2 a quei gruppi razziali ed etnici che sono affetti da questa malattia in modo sproporzionato . 28
In secondo luogo una qualunque variante associata al diabete di tipo 2, che viene replicata o viene scoperta in popolazioni più antiche come gli africani, probabilmente sarà in una regione più piccola della regione corrispondente europea, restringendo il genoma necessario per mappare, risequenziare e per identificare la variante o le varianti causali. L‟inclusione di varianti causali ha la capacità di migliorare i modelli di previsione genetica del diabete di tipo 2 per i pazienti individuali.
25
Il test genetico ha molti ruoli potenziali futuri nella gestione clinica e nella prevenzione del diabete di tipo 2. L‟informazione sul genotipo predice in modo significativo il diabete di tipo 2, ma questi test verranno superati in età adulta da test, esami già di routine nella pratica clinica. Circa 40 varianti genetiche possono predire il diabete di tipo 2 in modo significativo, anche se individualmente, la maggior parte di queste varianti aumenta la probabilità del diabete di tipo 2 solo modestamente. I fattori di rischio clinici di routine, come la storia familiare, indice di massa corporea, e l‟elevata glicemia a digiuno funzionano meglio dei modelli di previsione genetica in adulti di mezza età di origine europea. Fino ad oggi, tuttavia l‟utilità di queste analisi è molto modesta e non andrebbe consigliata nella pratica clinica per ricavare informazioni utili per la predizione e/o la prevenzione del diabete di tipo 2 nel singolo individuo.
E‟ purtroppo prevedibile che, senza una regolamentazione gestita dalle autorità sanitarie, la diffusione delle analisi genomiche a scopo di lucro comporterà diversi rischi nel prossimo futuro. Il più importante sembra essere quello di medicalizzare eccessivamente una larga fetta della popolazione con evidenti implicazioni personali, sociali ed economiche. Il soggetto a cui verrà comunicato di essere a rischio genetico per il diabete di tipo 2, vivrà nell‟ansia di questo evento e cercherà frequenti riscontri clinici e di laboratorio del suo status glicemico. Un secondo motivo di preoccupazione è rappresentato dal fatto che questo tipo di informazioni, se verranno richieste e fornite ad una larga fetta della popolazione, non potrà essere gestito se non in minima parte dai genetisti medici e/o diabetologi con competenze genetiche. Ciò costringerebbe il medico di medicina generale ad un carico di impegno supplementare e ad imparare a confrontarsi con dati sofisticati, prodotti da procedure di elevata complessità tecnologica dal significato non facile e dalla fruibilità non immediata.
26
CAPITOLO III :
Ciclofillina-A: un potenziale marcatore di screening
della malattia vascolare nel diabete di tipo 2
3.1 Patofisiologia della malattia vascolare nel diabete
Le persone affette da diabete presentano come principale causa di morte le malattie vascolari. Le manifestazioni macrovascolari comprendono aterosclerosi e calcificazione mediale mentre le conseguenze microvascolari, retinopatia e nefropatia, sono le principali cause di cecità e di insufficienza renale nella fase finale della malattia. L‟aterosclerosi e le sue complicazioni sono causate da un‟alterazione della funzione delle cellule del muscolo liscio endoteliale e vascolare e da una predisposizione alla trombosi. Nel diabete di tipo 2, la costante infiammazione dell‟endotelio e l‟azione dei monociti hanno effetto sulla funzione vascolare e questo può portare all‟insorgenza della malattia. I monociti svolgono un ruolo importante nell‟inizio, nella progressione e nell‟instabilità della lesione aterosclerotica e la loro attivazione determina una disfunzione endoteliale che comporta complicazioni vascolari.
Sia la disfunzione endoteliale che l‟attivazione dei monociti sono causati da stress ossidativo, generato da specie reattive dell‟ossigeno (ROS).
Normalmente, nelle cellule endoteliali, che regolano la funzione e la struttura cellulare, vengono sintetizzate e rilasciate sostanze biologicamente attive che hanno la funzione di mantenere l‟omeostasi vascolare, garantendo un flusso di sangue adeguato, evitando trombosi e diapedesi leucocitaria. L‟ossido nitrico è una di queste molecole sintetizzate dalla cellula endoteliale e la sua biodisponibilità rappresenta un marcatore importante per diagnosticare alterazioni vascolari. 29
L‟ossido nitrico provoca vasodilatazione e protegge il vaso sanguigno da danni endogeni, causati da segnali molecolari che impediscono l‟interazione delle piastrine e dei leucociti con la parete vascolare e inibiscono la proliferazione e la migrazione delle cellule di muscolo liscio vascolare.
27
La mancanza dell‟ossido nitrico, derivato dall‟endotelio, determina un aumento dell‟attività del fattore di trascrizione pro infiammatorio, fattore kappa B nucleare, ciò provoca la migrazione dei monociti e delle cellule del muscolo liscio vascolare nell‟intima e la formazione di macrofagi che portano ai cambiamenti morfologici iniziali dell‟aterosclerosi. L‟iperglicemia riduce il monossido d‟azoto che deriva dall‟endotelio e aumenta la produzione di specie di ossigeno reattivo, come l‟anione superossido, che inattiva l‟ossido nitrico. L‟iperglicemia determina l‟ aumento della produzione dell‟anione superossido, attraverso la catena di trasporto di elettroni mitocondriale. Il glucosio attiva la PKC, che è coinvolta nella regolazione e nell‟attivazione delle ossidasi dipendenti dal NADPH, associati alla membrana e provoca la produzione di anione superossido . Si verifica un effetto a cascata , con liberazione di anione superossido e inattivazione dell‟ossido nitrico.
Nel diabete gli acidi grassi, che vengono rilasciati in modo maggiore dal tessuto adiposo, possono mettere in pericolo la funzione endoteliale, attraverso vari meccanismi, come un aumento della produzione di radicali liberi, l‟attivazione della PKC e un peggioramento della dislipidemia.
Il diabete non solo aumenta l‟attività della PKC, la produzione di NF-kB, la generazione di radicali liberi, nella muscolatura liscia vascolare, ma anche nelle cellule endoteliali. L‟ iperglicemia aumenta la migrazione delle cellule del muscolo liscio vascolare nelle lesioni aterosclerotiche primarie, dove si replicano e producono una matrice extra-cellulare e questi sono i passi importanti nella formazione di una lesione adulta. Le anomalie metaboliche che caratterizzano il diabete, come l‟iperglicemia, aumento degli acidi grassi liberi, resistenza all‟insulina, provocano dei meccanismi molecolari che favoriscono la disfunzione vascolare. Tra questi si hanno: un calo della biodisponibilità di NO, un aumento dello stress ossidativo, disturbi della trasduzione del segnale intracellulare. Nell‟iperglicemia la funzione delle piastrine è alterata e c‟è un aumento della produzione di diversi fattori pro trombotici. Queste anomalie portano all‟aterosclerosi e ad un aumento del rischio di eventi cardiovascolari avversi che si verificano in pazienti con diabete e aterosclerosi. 30
28
3.2 Marcatori di screening per la malattia vascolare nel diabete
Il lungo periodo asintomatico, prima dell‟insorgenza delle malattie croniche, permette di diagnosticarle in tempo attraverso una sistematica prevenzione. Le malattie croniche come il diabete di tipo 2 e le sue complicazioni, possono essere evitate, eliminando i fattori che determinano la malattia o usando terapie che modulano il processo patologico prima della comparsa dei sintomi clinici.
L‟uso di biomarcatori, ossia di molecole, proteine, enzimi, sarà utile per la prevenzione delle malattie e sarà necessario l‟avvio di programmi di screening a quelle persone che hanno più probabilità di sviluppare la malattia. I recenti progressi tecnologici nel campo delle genetica, genomica, proteomica offrono grandi opportunità per la scoperta di biomarcatori. Quando si utilizzò l‟insulina si pensava che fosse una terapia completa per il diabete mellito e invece dopo più di 80 anni dalla sua scoperta, i pazienti con diabete di tipo 2 hanno un‟ aspettativa di vita, considerevolmente ridotta. Questa elevata mortalità è dovuta principalmente alle complicazioni a lungo termine che colpiscono vasi sanguigni, occhi, cuore, reni e nervi.
Una comprensione della patogenesi delle complicanze del diabete, aiuterà ad individuare i potenziali siti di intervento terapeutico o marcatori precoci da utilizzare per lo screening. Le persone con diabete hanno più probabilità di sviluppare malattie renali, di subire maggiori amputazioni, di sviluppare un infarto del miocardio e di subire un ictus, rispetto agli individui senza il diabete. L‟identificazione di marcatori di rischio per la malattia vascolare nel diabete è significativa sia per la prevenzione della disabilità a lungo termine sia per i costi sanitari.
I livelli elevati di glicemia hanno un ruolo importante nello sviluppo e nella progressione delle complicazioni del diabete vascolare. L‟obesità ed i livelli di glucosio nel sangue, ci predirranno se una persona svilupperà il diabete. I valori di emoglobina glicata sono in fase di monitoraggio per lo screening dei pazienti a rischio. Diversi marcatori di rischio, basati su stili di vita e su fattori genetici , sono stati preposti e testati per la predizione del diabete, ma anche se il loro funzionamento è abbastanza buono, nessuno di questi è stato usato clinicamente. 31 Sono stati proposti nuovi biomarcatori, sia per migliorare la previsione clinica, che per ottenere una migliore comprensione nella patogenesi del diabete di tipo 2.
29
Secondo gli studi i livelli bassi di adiponectina, gli alti livelli di apo B, della proteina C-reattiva e dell‟insulina, aumentano la possibilità che una donna svilupperà il diabete. Misurando questi fattori la previsione del diabete aumentava del 14% rispetto a quando i medici usavano, per predire la malattia, fattori di rischio classici, come l‟indice di massa corporea ed i livelli di glucosio nel sangue.
Negli uomini invece i biomarcatori che predicevano meglio la patologia diabetica erano bassi livelli di adiponectina, alti livelli di proteina C-reattiva e di ferritina. Monitorando questi biomarcatori, si è notato un aumento del 25% nell‟individuare il diabete.
L‟infiammazione ha un ruolo importante nello sviluppo del diabete infatti non solo partecipa a tutte le fasi dell‟aterosclerosi ma regola anche “ il potenziale trombotico” nella placca stessa e la capacità protrombotica e antifibrinolitica del sangue nella fase fluida.
La presenza dell‟infiammazione nell‟aterosclerosi ha portato ad analizzare alcuni fattori infiammatori importanti nella previsione del rischio cardiovascolare.32
3.3 Biomarcatori dell’infiammazione per la malattia vascolare
L‟infiammazione svolge una funzione importante nell‟aterogenesi, per cui è necessario comprendere meglio il ruolo dei biomarcatori sul meccanismo patogeno della malattia vascolare nel diabete. I biomarcatori infiammatori sono rappresentati da: citochine, come il fattore di necrosi tumorale, IL-1, IL-18, IL-6 messaggera; adipochine come adiponectina, la proteina C reattiva, PAI-1 e il fibrinogeno.
Un buon biomarcatore dovrebbe non solo fornire informazioni sul rischio cardiovascolare ma dovrebbe anche esser facile da misurare, usando dosaggi poco costosi, standardizzati con bassa variabilità, che non richiedono tecniche di dosaggio o di raccolta del plasma specializzati.
La proteina C-reattiva è un analita eccellente, con un dosaggio standardizzato, ha una variazione diurna trascurabile, non dipendente dal cibo, ha una lunga emivita, è facilmente misurabile e immunodosaggi standardizzati ad alta sensibilità, forniscono
30
risultati simili nel plasma fresco, conservato o congelato, dimostrando la stabilità della proteina.
I livelli plasmatici sono aumentati sia nel diabete di tipo 1 che in quello di tipo 2 e gli individui diabetici hanno una più alta concentrazione rispetto agli individui non diabetici, suggerendo un maggiore ruolo dell‟infiammazione nell‟aterosclerosi, vista in questi pazienti. E‟ stato fatto uno studio basato su popolazioni, che esamina l‟associazione tra valori plasmatici di proteina C-reattiva e il rischio di mortalità in 5 anni in pazienti con diabete di tipo 2. 33
Gli autori hanno condotto questo studio in 2381 soggetti diabetici, facenti parte dello studio “Casale Monferrato”, basato sulla popolazione. In base a questo studio si è visto che i soggetti diabetici con valori di proteina C-reattiva › 3 mg/l, hanno un rischio più alto del 51% di mortalità per tutte le cause e un rischio più elevato del 44% di mortalità cardiovascolare, rispetto ai soggetti diabetici della stessa età e sesso, in modo indipendente dai fattori di rischio classici.
Il PAI-1 e il fibrinogeno sono responsabili dell‟aterotrombosi ma sono meno utili della proteina C-reattiva. Il PAI-1 circola con un‟emivita di 6 minuti, mostra una variazione circadiana e per misurarlo accuratamente, i campioni devono essere trattati rapidamente, una procedura che non è pratica in clinica.
Il fibrinogeno ha una variazione diurna e non è facile misurarlo in maniera riproducibile e standardizzata .
L‟adiponectina ha una variazione diurna minima, rendendola più adatta per le analisi cliniche.
IL-1 potrebbe avere una base biologica grande come biomarcatore ma ha una breve
emivita.
IL-6 non è misurabile con facilità a causa della sua breve emivita nel plasma.
E‟ necessario però tener presente che in molte malattie, come infezioni, traumi, neoplasie, malattie allergiche, i livelli di proteina C-reattiva sono aumentati, quindi non necessariamente un livello alterato indica un danno a livello della parete vascolare. 34
Non sono disponibili dati consistenti per esser certi che la proteina C-reattiva predica in modo indipendente eventi vascolari, sono necessarie perciò evidenze più concrete. La prova della causalità in studi con animali, la randomizzazione
31
mendeliana, modelli di topi transgenici, non hanno fornito alcuna prova attendibile per la proteina C-reattiva come marcatore per l‟aterosclerosi.
Gli unici biomarcatori del sangue raccomandati sono il colesterolo LDL, il colesterolo HDL e i trigliceridi. Le concentrazioni di colesterolo plasmatico, da sole, non sono responsabili delle malattie coronariche, in quanto più della metà degli eventi vascolari si verificano in soggetti con concentrazioni del colesterolo sotto la media. Mano a mano che si è avuta una maggiore comprensione dell‟aterotrombosi, sono stati valutati una serie di biomarcatori che evidenziano infiammazione, stress ossidativo, trombosi e rappresentano dei potenziali strumenti clinici per predire il rischio.
3.4 Le proteine dei monociti come potenziali marcatori nella
malattia vascolare e nel diabete
L‟iperglicemia determina un aumento dello stress ossidativo e uno stato pro infiammatorio generalizzato che provoca l‟attivazione dei geni dell‟infiammazione multipli, responsabili di un aumento dei monociti nel diabete. Studi fatti sui geni hanno rilevato che il trattamento con concentrazioni elevate di glucosio, determina nei monociti l‟espressione di citochine infiammatorie e dei geni delle chemochine, rilevanti nella patogenesi dell‟aterosclerosi. 35
Nel diabete di tipo 2, l‟attivazione dei monociti e l‟adesione all‟endotelio delle arterie provocano lesioni vascolari aterosclerotiche che determinano lo sviluppo della malattia. I monociti possono secernere e rilasciare proteine o loro frammenti nell‟ambiente extracellulare e nei fluidi corporei come il sangue, quindi attraverso un prelievo, che è minimamente invasivo, si possono analizzare le proteine presenti. Secondo uno studio fatto su pazienti per la maggior parte di loro asintomatici, analizzando il rapporto tra i marcatori dell‟infiammazione come hs-CRP, IL-6, fibrinogeno, conteggio dei monociti e conteggio dei globuli bianchi con lo spessore della placca carotidea e intima mediale, si vide che il conteggio dei monociti era un predittore di aterosclerosi delle carotidi.
32
Tuttavia non è noto se il conteggio dei monociti possa prevedere la progressione dell‟aterosclerosi e il futuro rischio cardiovascolare.
Il glucosio elevato provoca la sintesi della proteina dei monociti MCP-1 nelle cellule endoteliali e quindi ha un ruolo importante nell‟attivazione dei monociti e nella formazione delle lesioni.
MCP-1 è una chemochina prodotta da monociti, macrofagi, cellule muscolari lisce e da cellule endoteliali, all‟interno di placche aterosclerotiche. Serve come agente chemiotattico per reclutare monociti nella parete vascolare. MCP-1 è coinvolta nella diapedesi dei monociti del sangue, nella intima delle arterie e ciò porterà all‟aterosclerosi. Studi clinici hanno dimostrato che i livelli plasmatici di MCP-1 sono correlati con la maggior parte dei fattori di rischio cardiovascolari .
Per ridurre il rischio dell‟aterosclerosi si può modulare l‟espressione di MCP-1, indotta da concentrazioni elevate di glucosio nelle cellule endoteliali aortiche in vitro, usando una proteina anti-infiammatoria, la quercitina.
Questi risultati ci suggeriscono nuovi metodi per regolare il gene MCP-1, indotto da alto glucosio nelle cellule endoteliali aortiche e l‟efficacia della quercitina nel ridurre il rischio di aterosclerosi.
La concentrazione plasmatica di MCP-1 è risultata essere maggiore in pazienti con diabete e CAD, rispetto a quelli affetti solo da patologia diabetica. 36
Studi successivi, fatti da Herder e altri, nel 2006, hanno trovato risultati un po‟ contrastanti, in quanto hanno osservato che le concentrazioni nel siero di MCP-1 non erano associate al diabete di tipo 2.
Precedenti studi su pazienti diabetici, hanno segnalato un aumento delle malattie cardiovascolari in soggetti con elevati livelli di marcatori infiammatori, come la proteina C-reattiva .
MCP-1 non aumenta durante la fase acuta della sindrome coronarica acuta (ACS) e i suoi livelli elevati sono associati ad un aumento del rischio di morte a lungo termine e per gravi eventi cardiaci avversi. MCP-1 è lontana dall‟essere pronta per uso clinico perché non fornisce molte informazioni.
Sebbene MCP-1 è aumentata dopo ACS, la misura del MCP-1 non è uno strumento utile per monitorare la terapia con statine o per identificare quei pazienti ai quali sarebbe utile un trattamento con statine più aggressivo. Tuttavia, dato il ruolo patogenetico di MCP-1 nell‟aterosclerosi e data l‟associazione dei livelli plasmatici
33
di MCP-1 con fattori di rischio coronarico, MCP-1 dovrà essere ulteriormente analizzata come biomarcatore bersaglio per nuove terapie contro l‟aterosclerosi.
3.5 Ciclofillina-A come nuovo promettente marcatore nella
malattia vascolare diabetica
Alcuni studi fatti su cellule monocitiche umane osservarono che quando queste cellule venivano stimolate con alte concentrazioni di glucosio, liberavano la ciclofillina-A.
La ciclofillina è un‟immunofillina, identificata in cellule monocitiche umane , secreta in risposta ad alte concentrazioni di glucosio. Negli esseri umani la ciclofillina è in tutti gli organi e la sua concentrazione può rappresentare lo 0,1 % – 0,4% delle proteine totali in una cellula. La ciclofillina-A è stata misurata nei fluidi sinoviali, in pazienti affetti da artrite reumatoide, mediante la sua attività enzimatica e l‟hanno misurata attraverso la presenza di una proteina immunoreattiva della stessa massa molecolare e con la stessa sequenza NH2 terminale. La ciclofillina è stata rilevata nei fluidi biologici di pazienti con malattie infiammatorie e risponde alla terapia con ciclosporina-A, la quale, data la sua efficacia, potrebbe essere usata come un antiinfiammatorio. 37
La ciclofillina promuove la sopravvivenza delle cellule nelle patologie tumorali. Vari meccanismi sono stati proposti per spiegare le funzioni citoprotettive della ciclofillina-A. Questa proteina, può essere essenziale nel mantenere la conformazione delle proteine oncogeniche, mantenere la conformazione delle proteine di segnalazione per la proliferazione cellulare, i fattori di trascrizione, le componenti anti-apoptotiche. Le funzioni citoprotettive della ciclofillina-A e la sua sovra-espressione in molti tipi di tumore suggeriscono che nuovi inibitori della ciclofillina-A dovrebbero essere sviluppati per la terapia del cancro.
La ciclofillina-A ha molte funzioni intracellulari come la segnalazione intracellulare, il traffico e la regolazione delle proteine. Ha un ruolo fisiologico e patologico nelle
34
malattie cardiovascolari e questo la rende un potenziale biomarcatore e un mediatore nelle malattie cardiovascolari come la stenosi vascolare, l‟aterosclerosi e gli aneurismi dell‟aorta addominale.
L‟iperglicemia cronica altera la funzione delle cellule del muscolo liscio ed endoteliali dei vasi sanguigni, che subiscono modificazioni morfologiche e funzionali, a causa di un‟eccessiva glicazione delle proteine extra e intra-cellulari e di un‟incontrollata produzione di radicali liberi. Questi processi contribuiscono all‟ispessimento della membrana basale, all‟occlusione vascolare, all‟aumento della permeabilità e alla generazione della malattia vascolare e dell‟aterosclerosi. 38
3.6 Infiammazione , ROS e ciclofillina-A
L‟infiammazione e lo stress ossidativo sono mediatori patogeni di molte malattie, in particolare quelle cardiovascolari.
Le specie reattive dell‟ossigeno (ROS) agiscono sulle biomolecole della cellula e causano gravi danni come la perossidazione lipidica, l‟ ossidazione delle proteine e danni al DNA. I livelli elevati di ROS sono pericolosi per la cellula ma i livelli controllati, sono importati nella regolazione della funzione cellulare e nel destino delle cellule.
Nella parete vascolare i ROS sono generati da diversi meccanismi come NADPH ossidasi, xantina ossidasi, la catena respiratoria mitocondriale, lipossigenasi e la loro formazione può essere stimolata da stiramento meccanico, fattori ambientali come ipossia. I ROS sono stati implicati nella patogenesi dell‟aterosclerosi, nell‟ipertensione e nella restenosi, in parte promuovendo la crescita della muscolatura liscia vascolare (VSMC) .
Si ha l‟attivazione dei macrofagi che diventano carichi di LDL ossidato e di altri lipidi, che producono specie reattive dell‟ossigeno (ROS) e secernono citochine e fattori di crescita che contribuiscono alla progressione delle placche aterosclerotiche. In seguito allo stress ossidativo, le cellule della muscolatura liscia vascolare, le cellule endoteliali e i macrofagi, liberano la ciclofillina-A che stimola ERK1/2,
35
aumenta la sintesi del DNA e inibisce l‟apoptosi indotta da ossido nitrico nelle cellule della muscolatura liscia. 39
Figura 3 : Il ruolo della ciclofillina nell’iperglicemia
Abbiamo precedentemente visto che gli alti livelli di glucosio attivavano i monociti a secernere la ciclofillina-A e i livelli di questa immunofillina sono superiori in campioni di plasma di pazienti con diabete e CAD rispetto al plasma di pazienti sani.
36
Si pensa che la ciclofillina secreta da monociti in pazienti con diabete di tipo 2, possa essere uno stimolo pro infiammatorio importante per l‟infiammazione vascolare, in pazienti con diabete.
Dato che i livelli plasmatici di ciclofillina-A sono più alti nei pazienti con diabete e malattie vascolari (CAD), sono necessari ulteriori dimostrazioni per osservare se il livello di ciclofillina nel plasma è un marcatore di infiammazione vascolare nel diabete.
Sappiamo molto poco riguardo all‟effetto delle ciclofilline sui recettori specifici, anche se ne sono stati proposti molti.
La secrezione di ciclofillina-A avviene attraverso un processo che richiede la produzione di ROS e la formazione di vescicole ma sono sconosciute le vie di segnalazione responsabili della secrezione di ciclofillina-A nell‟endotelio vascolare, in presenza di diabete.