1
INTRODUZIONE
L'insufficienza renale acuta perioperatoria viene oggi definita acute kidney injury (AKI), secondo l'AKI network.
L’ AKI rappresenta una complicanza di frequente riscontro nei pazienti ricoverati nelle unità di terapia intensiva, risultando come una delle più comuni cause di morbidità e mortalità intraospedaliera e assumendo particolare rilievo per i pazienti sottoposti a chirurgia vascolare e cardiaca. Infatti una percentuale compresa tra il 30 e il 50 % dei pazienti sottoposti a bypass cardiopolmonare sviluppa, nel periodo postoperatorio, un quadro di AKI, con necessità di terapia sostitutiva renale in più del 5% dei casi, e con una mortalità che si aggira intorno all’80%. (1)
Sebbene il rischio di sviluppare un quadro di insufficienza renale possa essere prevenuto e, una volta instauratosi, possa essere trattato con l’impiego di svariate armi terapeutiche, la diagnosi di AKI deve comunque avvenire il più precocemente possibile dallo sviluppo del danno, in modo da proteggere il rene da ulteriori insulti, preservarne la sua funzionalità residua e scongiurare l’utilizzo di terapie sostitutive.
Negli anni, molti algoritmi clinici sono risultati in grado di effettuare una stratificazione del rischio di sviluppare AKI ma non è stato possibile individuarne alcuno per la sua diagnosi precoce. Infatti per molto tempo, ed ancora oggi nella pratica clinica, sono utilizzati indici di danno renale che risultano inefficaci nel predire precocemente l’insorgenza di insufficienza renale e che si innalzano quando ormai il danno è avvenuto e la funzionalità
2
dell’organo compromessa. Per questo motivo si è sviluppata l’esigenza di individuare nuovi biomarkers specifici e sensibili, capaci di evidenziare prima possibile l’insorgenza del danno, che siano in grado di rilevarlo anche in assenza di evidenti segni clinici ma anche facilmente dosabili al letto del paziente.
Negli ultimi anni, le più recenti tecniche genomiche, così come gli studi sperimentali, hanno individuato l’ N-GAL ( neutrophil gelatinase-associated lipocalin) come un possibile precoce marker di AKI, rendendolo uno dei più investigati e promettenti biomarker di danno renale. I dati dei più recenti studi clinici, scaturiti in ambito critico e soprattutto nel paziente sottoposto a chirurgia cardiaca, sia adulto che pediatrico, sembrano dimostrare che, in effetti, l’ N-GAL si comporti come un precoce predittore di AKI, con possibili vantaggi rispetto ai classici metodi di diagnosi.
3
CAPITOLO I
L’
N-GAL
N-GAL (neutrophil gelatinase-associated lipocalin) è una piccola molecola di 25 Kdalton appartenente alla famiglia delle lipocaline, proteine specializzate nel trasporto di piccole molecole idrofobiche attraverso un sito di legame a forma di calice. Attraverso l’interazione con specifici recettori di membrana presenti in svariati siti come le cellule tubulari renali, gli epatociti etc l’NGAL viene internalizzato nella cellula dove funge da vettore per il trasporto di alcuni elementi. Il ligando più significativo di NGAL è rappresentato dalle sideroporine, piccole molecole non peptidiche, implicate nella crescita e nella sopravvivenza cellulare per la loro capacità di trasportare ferro. NGAL può essere trasportato all’interno della cellula in due forme, chiamate Apo-NGAL o Holo-Apo-NGAL, rispettivamente come proteina da sola o in un complesso formato da una sideroporina legante il ferro. Le due forme hanno significato biologico opposto: la prima è in grado di legarsi al ferro e, attraverso il suo trasporto nello spazio extracellulare, rappresentare una causa di deplezione dell’elemento, predisponendo la cellula al processo apoptoico; la seconda, in grado di rilasciare il complesso sideroporina-ferro, è responsabile dell’accumulo eminico e dell’attivazione di una serie di processi ferro-dipendenti. (2) (Fig. 1)
4
Fig.1 Meccanismo di azione di NGAL ( Am J Kid Dis 2008; 52:595-605)
Originariamente N-GAL è stato identificato all’interno dei neutrofili, legato covalentemente alla matrice metalloproteinasica ed ottenuto dalla gelatina purificata del supernatante di queste cellule attivate. La sua attività biologica principale è quella di inibire la crescita batterica, risultando un importante componente dell’immunità innata. I batteri infatti, attraverso la sintesi delle sideroporine e sfruttandone la capacità di legare ferro, si assicurano un supplemento eminico, fondamentale per l’esplicazione delle loro funzioni. N-GAL, con la sua caratteristica proprietà di chelante delle sideroporine, ne contrasta l’azione, esercitando così un effetto batteriostatico. Però, nonostante ciò, il suo aumento non è riscontrato esclusivamente in corso di stati infettivi. Infatti, N-GAL è probabilmente
5
prodotto come proteina di fase acuta da molti tessuti che vanno incontro a danno sostenuto, tra cui oltre al rene, il fegato, l’intestino, la pelle, le vie aeree.
Quando N-GAL risulta legato ad una sideroporina è in grado di ridirezionare il Fe da organi come fegato e milza verso il rene, in particolar modo verso il tubulo prossimale, esercitando un effetto protettivo nei confronti di quest’ultimo. Probabilmente l’aumento dei livelli di N-GAL esercita un effetto limitante il danno nei confronti dell’insulto che persiste e verso insulti futuri (3).
1. Sorgenti e circolazione di N-GAL
In condizioni fisiologiche si riscontra in basse concentrazioni in urine e plasma, viene liberamente filtrato dal glomerulo e riassorbito nel tubulo prossimale.
Durante il danno renale si assiste ad una up-regulation dell’ mRNA a carico della porzione distale del nefrone, nel ramo ascendente dell’ansa di Henle e nei dotti collettori (4), nonostante l’insulto ischemico avvenga prevalentemente a carico del tubulo prossimale (5-8). Questo pool di N-GAL sintetizzato localmente, per effetto del danno sul tubulo prossimale, non viene sostanzialmente inserito nella circolazione sistemica ma escreto nelle urine (4) e sembra assumere un significato antimicrobico nei confronti delle basse vie urinarie. In corso di AKI, oltre alla up-regulation a livello locale, si assiste anche ad una a distanza che permette la liberazione di N-GAL nel torrente sanguigno e che va a costituire un pool sistemico distinto da quello regionale. (9)
6
2. Caratteristiche di un biomarker ideale per aki
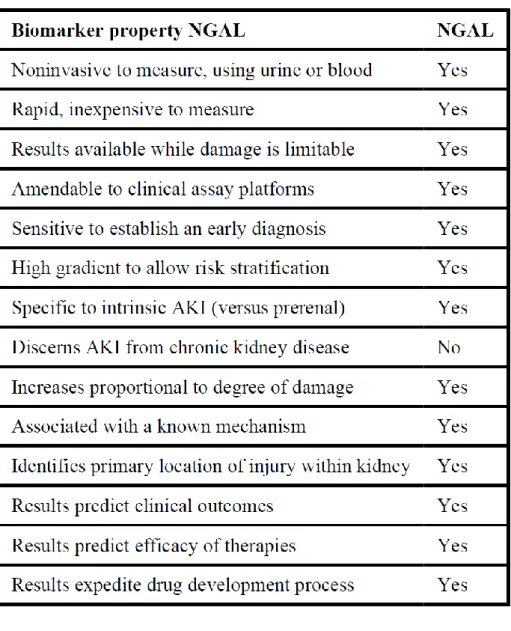
Il biomarker ideale dovrebbe riassumere una serie di caratteristiche specifiche che lo rendano davvero unico indicatore di riferimento per la diagnosi di una determinata patologia. La non invasività e la facilità di esecuzione al letto del malato o in laboratorio sono requisiti fondamentali, come la sorgente di prelievo. Sangue ed urine rappresentano la sorgente di più facile accesso nel paziente anche se, nel caso di AKI, la raccolta può essere inficiata per diverse problematiche. Innanzitutto si può verificare uno stato di oligoanuria che renda difficile o impossibile il prelievo, poi il biomarker non deve essere influenzato dallo stato di diluizione urinaria in quanto, l’impiego di diuretici e lo stato di idratazione del paziente, possono largamente influenzare questo dato.
Dovrebbe essere rapidamente e facilmente misurabile attraverso piattaforme cliniche standardizzate così come sensibile, in modo da individuare precocemente la patologia con l’ausilio di precisi cut-off di riferimento e possedere una elevata potenza statistica. La precocità dell’individuazione del danno è una caratteristica molto importante in quanto, nel continuo divenire del danno renale, un intervento terapeutico che avvenga prima che il danno diventi irreversibile risulta fondamentale per il mantenimento della funzionalità d’organo. (Fig.2)
7
Fig.2 Possibile intervento di NGAL nella diagnosi evolutiva del danno renale (modificato da Annu Rev Pharmacol Toxicol 2008; 48: 463-493)
Dovrebbe essere in grado di identificare qual è il sito di danno primario, individuando così vari sottotipi, l’eziologia, nonchè di distinguere il processo acuto da quello cronico.
Dovrebbe essere in grado di determinare una stratificazione del rischio, avere valore prognostico, soprattutto per quanto riguarda l’identificazione del timing per la terapia sostitutiva, ed essere utile nel monitoraggio dell’efficacia della terapia intrapresa. (10,11) (tab.1)
8
9
CAPITOLO II
L’INSUFFICIENZA RENALE
L'insufficienza renale acuta perioperatoria viene oggi definita acute kidney injury (AKI), secondo l'AKI network. Tale classificazione prende in considerazione la creatinina sierica e l’output urinario ( tab.2) (12).
Tab.2 Classificazione dell’AKI (tratto da Crit Care 2007; 11:R31)
L’insufficienza renale complica frequentemente il decorso dei malati critici, specialmente quello dei pazienti sottoposti a chirurgia cardiaca (13). In
10
questo caso, l’alto tasso di mortalità che ne risulta (14), non è causato solamente dall’instaurarsi del danno renale stesso, ma anche dalla compromissione di organi a distanza.
L’AKI è un processo che può svilupparsi per svariate cause: ridotta perfusione renale, insulti tossici od ostruttivi che interessino il tubulo renale, edema o infiammazione tubulo interstiziale, ridotta primaria capacità filtrante del glomerulo.
1. Fisiopatologia del danno renale
L’insulto renale inizia con un danno cellulare che provoca perdita dell’integrità del citoscheletro e perdita della polarità, con dislocazione delle molecole di adesione e altre proteine di membrana come le β integrine e le Na/K ATPasiche (fig.3). Le cellule vanno incontro a desquamazione, lasciando sprovvisto l’epitelio e formando zone in cui solamente la membrana basale si interpone fra l’interstizio peritubulare e il filtrato.
Fig.3 Continuum fisiopatologico del danno renale (tratto da Annu Rev Pharmacol Toxicol 2008; 48: 463-493)
11
Le cellule desquamate, interagendo con la fibronectina che entra nel lume del tubulo, danno luogo ad un’ostruzione e di conseguenza ad aumento dei regimi pressori con reflusso di filtrato. Tutti questi meccanismi provocano quindi alterazione dell’epitelio con stimolazione di processi infiammatori e vasocostrizione. In realtà il rene ha una buona capacità di recupero, tanto che, le cellule rimanenti, attraverso processi di migrazione, verso le membrane basali rimaste esposte, e di differenziazione, riescono a restituire integrità al nefrone dopo il danno acuto. Ovviamente, quando l’insulto persiste nel tempo, si verifica un’inesorabile progressione del danno renale che prelude all’insufficienza cronica (fig.4) (13).
Fig.4 Fisiopatologia del danno renale (tratto da Annu Rev Pharmacol Toxicol 2008; 48: 463-493)
12
2. Interessamento sistemico durante AKI
E’ stato dimostrato che il danno renale è un processo così complesso da assumere non soltanto un coinvolgimento regionale, locale ma anche sistemico (15). Esisterebbero infatti dei complessi meccanismi di comunicazione tra il rene, che subisce l’insulto, e svariati organi come i polmoni, il cuore, il fegato, il cervello, l’intestino, il sistema ematologico, tali da provocare a loro carico l’attivazione del sistema pro infiammatorio e conseguente attivazione di sistemi trascrizionali genici.
Il processo di ischemia e riperfusione del rene, che subisce l’insulto, provoca un processo infiammatorio che conduce alla compromissione del microcircolo, con perdita dell’integrità dell’endotelio renale, a causa dell’ attivazione delle cellule endoteliali e della adesione e dell’intrappolamento dei leucociti. Inoltre, le molecole di adesione, come integrine e selectine, associate alle citochine ad attività pro infiammatoria, sono in grado di alimentare il processo dannoso a carico del rene ma anche di estenderlo ad organi a distanza attraverso il meccanismo della up-regulation genica (16). La gravità del processo è anche dovuta al fatto che ogni organo bersaglio presenta una diversa risposta fisiopatologica all’insulto renale. Questi eventi sono stati attualmente studiati prevalentemente con modelli animali. (Fig.5)
13
Fig.5 Interessamento di organi a distanza in corso di AKI. (tratto da Da Int J
Nephrol 2011; 2012: 1-8)
2.1 Il cuore
L’ecocardiografia dimostra che il muscolo cardiaco va incontro a dilatazione ventricolare con aumento dei diametri ventricolari sinistri di fine diastole e di fine sistole, aumento del tempo di rilasciamento e riduzione
14
dell’accorciamento frazionale. La causa sembrerebbe rappresentata da iper-espressione sia cardiaca sia sistemica di TNFα, IL-1 e ICAM-1 che provocherebbero infiltrazione neutrofila ed apoptosi dei miociti (17,18).
2.2 Il fegato
Alla base del danno epatico vi è sicuramente il processo ossidativo che si instaura durante AKI. Infatti, si assiste, da una parte, alla riduzione del glutatione, che esplica una efficace azione antiossidante, e dall’altra ad un aumento dei livelli di malonaldeide che invece rappresenta un indice di perossidazione lipidica. Inoltre si assiste all’aumento dell’espressione di TNFα e di apoptosi cellulare (18).
2.3 Il sistema nervoso centrale
Il danno neuronale è causato da un reclutamento dei neutrofili provocato da aumento di chemoattrattante i cheratinociti (KC) e fattore stimolante le colonie di granulociti (G-CSF) che si rilevano nella corteccia cerebrale e nell’ippocampo prodotti localmente o ivi riscontrati per alterazione della barriera emato-encefalica. Purtroppo la terapia sostitutiva non è in grado di contrastare i sintomi correlati e conseguenti al danno renale.
2.4 L’intestino
A carico del retto e del colon, si assiste ad un aumentata secrezione di potassio, legata all’azione di un regolatore dei canali al potassio contestualmente espresso da intestino e rene durante AKI (19). Inoltre l’intestino amplifica la risposta infiammatoria sistemica attraverso l’aumento della permeabilità intestinale e la propagazione di tossine riversate nel sistema linfatico (18).
15
2.5 Il polmone
Il processo di danno polmonare conseguente ad AKI è rappresentato da un continuum di eventi che, provocando un circolo vizioso, si autoalimenta e si mantiene, causando il consolidamento del danno sia a carico del sistema respiratorio sia di quello renale (Fig.6). Infatti, quest’ultimo è in grado di provocare inizialmente un processo infiammatorio importante a carico del polmone, il quale a sua volta, attraverso la conseguente ipossiemia e ipercapnia, a cui spesso si aggiunge un’alterazione dell’equilibrio emodinamico da ventilazione meccanica, provoca un peggioramento della perfusione renale e del danno a suo carico.
Anche se il danno polmonare conseguente ad AKI è tutt’oggi parzialmente incompreso, è noto che esso si instaura in seguito a fenomeni proinfiammatori e proapoptotici. Alla base del primo sottosta l’attivazione dei leucociti con il loro traffico e l’aumento di mediatori dell’infiammazione, rappresentate da svariate citochine e chemochinine. Però, al contrario di ciò che avviene nel danno di molti altri organi, in cui un ruolo cruciale è rivestito dall’accumulo di neutrofili, nel polmone questi potrebbero esercitare un ruolo protettivo. Nel processo apoptotico sono probabilmente coinvolte le cellule T con interessamento di epitelio ed endotelio, perdita della funzione di membrana di quest’ultimo e conseguente permeabilità vascolare. (18)
16
Fig.6 Interazioni fisiopatologiche fra AKI ed ALI. (tratto da Int J Nephrol 2011;2012: 1-8)
17
3. AKI associata a cardiochirurgia
Il danno renale acuto che si verifica nei pazienti sottoposti a cardiochirurgia può essere suddiviso in base al timing dell’avvenuto danno in 3 diversi periodi: il preoperatorio, l’intraoperatorio e il postoperatorio.
3.1 Il periodo preoperatorio
All’interno di questo periodo si possono distinguere diversi fattori di rischio rappresentati da: presenza di tossine, fattori metabolici e processi di ischemia-riperfusione.
a) Le tossine
Molti farmaci nefrotossici possono essere usati in terapie preoperatorie; basti ricordare alcuni antibiotici, come gli ammminoglicosidi, i beta-lattamici e l’amfotericina usati nelle endocarditi o gli antiinfiammatori non steroidei e gli ACE inibitori. Anche le procedure diagnostiche preoperatorie possono presentare un elevato rischio di danno renale a causa dell’uso del mezzo di contrasto durante gli studi angiografici (20).
18 b) I fattori metabolici
Il diabete è senz’altro una comorbidità molto frequente nei pazienti che si sottopongono a cardiochirurgia e rappresenta un sicuro fattore di rischio di sviluppo di danno renale postoperatorio. Così come la malnutrizione preoperatoria, individuata attraverso riscontro di bassi valori di albuminemia. Rimane controverso invece il ruolo dell’obesità (20).
c) Il Processo di ischemia- riperfusione
Può verificarsi in caso di:
shock cardiogeno per procurata ipotensione da ridotto output cardiaco.
Ipotensione dovuta a cause non cardiache. Spesso i pazienti a causa di protratta terapia diuretica o per stati di malnutrizione legati a quadri di insufficienza cardiaca possono risultare disidratati ed ipovolemici. L’ipotensione può anche essere causata dall’uso di vasodilatatori.
Embolismo dell’arteria renale. Placche ateromasiche, solitamente interessanti la parete aortica, o vegetazioni valvolari possono essere mobilizzate durante la fase diagnostica preoperatoria durante la fase del cateterismo cardiaco (20).
19 d) L’ attivazione neuro-ormonale
Si verifica molto frequentemente nei pazienti con scompenso cardiaco cronico e, anche in sua assenza, la bassa gittata cardiaca provoca l’attivazione del sistema nervoso simpatico, del sistema renina-angiotensina-aldosterone e determina aumento della vasopressina circolante. Si provoca così una ridotta filtrazione renale dovuta a vasocostrizione, con ritenzione di sodio ed acqua (20).
e) L’infiammazione e lo stress ossidativo
Il processo infiammatorio è principalmente rappresentato dal processo aterosclerotico diffuso che si riscontra in questa tipologia di pazienti e anche dagli stati infettivi come l’endocardite (20). I fattori tossici preoperatori come gli antibiotici e i mezzi di contrasto sono invece in grado di generare specie reattive dell’ossigeno che provocano l’instaurarsi del danno renale (20).
20
3.2 Il periodo intraoperatorio
a) Le tossine
Durante la CEC si può verificare ipoperfusione splancnica, condizione che può determinare alterazione dell’integrità della mucosa intestinale, con conseguente processo di traslocazione batterica e passaggio di endotossine nel torrente ematico. L’LPS, prodotto dalla disintegrazione dei GRAM -, causa l’attivazione del complemento.
Inoltre alcune sostanze ad azione pro-trombotica, somministrate dopo o prodotte durante la CEC, possono essere nefrotossiche. Fra le prime l’acido tranexamico e l’acido caproico e fra le seconde l’emoglobina libera provocata dall’emolisi che può verificarsi soprattutto nelle CEC di lunga durata (20).
b) Il processo di ischemia-riperfusione
i. Durante la fase di preparazione all’intervento
Avviene principalmente per fenomeni di instabilità emodinamica dovuti a diversi fattori come i movimenti del paziente, il posizionamento di accessi venosi e arteriosi vascolari, la sospensione seguita dall’inizio della somministrazione in infusione continua di alcuni farmaci e talvolta l’induzione dell’anestesia.
21
ii. Dal momento dell’incisione fino al by-pass cardiopolmonare o alla lussazione cardiaca
La cannulazione aortica può mobilizzare placche aterosclerotiche presenti sulla parete del vaso così come la manipolazione del ventricolo sinistro può far circolare masse trombotiche che stazionavano in regioni acinetiche, provocando fenomeni embolici delle arterie renali.
iii. CEC o periodo off-pump
Le principali alterazioni emodinamiche che si possono verificare in questo periodo possono essere l’ipoperfusione e i fenomeni embolici.
L’ipoperfusione si verifica quando la pompa della circolazione extracorporea mantiene un output cardiaco inferiore ai 2.2- 2.4 l/min/m2 così da determinare una pressione arteriosa media molto più bassa della normale. Infatti quando è mantenuta per lunghi periodi una PAM (pressione arteriosa media) inferiore a 60 mm Hg si verifica danno renale nel periodo postoperatorio. Anche il mantenimento di un’adeguata ipotermia, 26-34°C, protegge il rene da un eventuale insulto ischemico e, nei casi in cui ci sia necessità di mantenere un flusso molto basso o si debba eseguire un arresto di circolo, la temperatura deve essere ridotta molto fino a 14 °C.
22
Il fenomeno embolico può verificarsi attraverso diversi meccanismi. Innanzitutto le cannule arteriose utilizzate per la CEC possono determinare il distacco di placche ateromasiche che possono raggiungere il circolo di molti organi, compreso quello renale. Possono distaccarsi frammenti delle masse posizionate sulle valvole, secondarie al processo endocarditico. Ancora, da non sottovalutare, la presenza di aria che può rimanere intrappolata durante le procedure chirurgiche che necessitino di incisione cardiaca sinistra (chirurgia della valvola aortica, mitralica e rimodellamento di parete del ventricolo sinistro) o quando si pratica incisione destra, se si è in presenza di un forame ovale pervio. L’aria può inoltre rimanere intrappolata durante le manovre di posizionamento delle cannule. Per tutti i motivi sopra citati, alla fine della CEC è opportuna l’evacuazione dell’aria con le apposite manovre e se possibile una valutazione ecocardiografica trans esofagea.
iv. Inizio della sospensione della CEC
Il momento di transizione che intercorre fra la CEC e il ripristino dell’ autonomia cardiorespiratoria del paziente è un periodo gravato da una elevata instabilità emodinamica. Spesso può verificarsi uno stato di ipotensione legato ad una marcata alterazione dell’attività contrattile cardiaca che non è così in grado di assicurare un adeguato output cardiaco. In altre occasioni, lo
23
stato di ipotensione può essere legato ad un’alterata volemia del paziente o ad una marcata vasodilatazione che, seppur in assenza di deficit marcati di pompa, non riesce comunque ad assicurare una adeguata PAM.
v. Fine della CEC o della chirurgia off-pump
Le cause più frequenti di ischemia renale in questo periodo sono dovute alla possibilità di instaurarsi di uno shock cardiogeno che può essere dovuto ad alterazione della contrattilità miocardica già preesistente all’intervento o a cause legate direttamente alla procedura chirurgica come il kinking, lo spasmo o la chiusura dei bypass aortocoronarici eseguiti e le disfunzioni delle valvole sostituite. Oppure di fenomeni di ipotensione non cardiogena provocati dagli effetti vasodilatatori della protamina, usata nell’antagonismo dell’eparina utilizzata per la CEC, e dal sanguinamento, che può essere di natura chirurgica o legato a coagulopatie sovraimposte (20).
c) I fattori neuro-ormonali
Si assiste ad un aumento della produzione di vasopressina, norepinefrina, epinefrina e renina durante la CEC così come i fattori natriuretici atriali che si innalzano solamente dopo la sua
24
sospensione. L’alterazione di questi meccanismi neuro ormonali è alla base della riduzione del flusso renale e della conseguente riduzione del filtrato glomerulare renale (20).
d) L’infiammazione
L’attivazione della risposta infiammatoria avviene attraverso l’attivazione del complemento, la produzione di citochine e l’attivazione dell’immunità cellulo-mediata.
i. Attivazione del complemento
Avviene attraverso la via alternativa, per diretto contatto con la superficie del circuito extracorporeo e a causa del clampaggio aortico. Quando questo viene messo in atto si verifica infatti un processo ischemico che coinvolge i principali organi e, quando viene rimosso, un processo di riperfusione che provoca l’attivazione del complemento. Inoltre, il complemento può essere attivato anche attraverso la via alternativa dall’uso della protamina, come antagonizzante dell’eparina, a causa della formazione di complessi eparina-protamina. Processo che, probabilmente attraverso l’attivazione dalla proteina C reattiva, può ripetersi anche a distanza di giorni dall’intervento. (21)
ii. Produzione di citochine
Le citochine prodotte fanno parte sia del gruppo con attività proinfiammatoria come il TNF α,l’ IL-1β,l’ IL-6,l’ IL-8 sia con attività
25
antiinfiammatoria come l’IL-10 e il TGF-β. Le condizioni cliniche preesistenti, le quali possono già predisporre ad una produzione anomala di citochine (ad es. disfunzione ventricolare sinistra e diabete mellito) e il conseguente equilibrio che scaturisce dalla produzione di queste sostanze ad azione opposta, contribuiscono allo sviluppo delle complicanze perioperatorie.
iii. Immunità cellulomediata
In corso di circolazione extracorporea si assiste ad un’ aumentata attivazione dei macrofagi e dei monociti provocata dall’attivazione dei fattori chemoattrattanti e da una up-regulation delle molecole di adesione per i macrofagi. Inoltre si verifica un’attivazione dei neutrofili a causa della produzione di radicali liberi. (20,22)
e) Lo stress ossidativo
Oltre alla produzione di radicali liberi si assiste anche ad una riduzione degli enzimi prodotti dal miocardio con azione antiossidante (glutatione reduttasi, superossido dismutasi, catalasi) i quali probabilmente vengono consumati durante la CEC proprio dai ROS. In conclusione, una quantitativa superiorità dei radicali liberi nei confronti delle molecole ad azione antiossidante si traduce in un danno cellulare di tipo ossidativo che contribuisce all’estensione del processo infiammatorio già provocato da altri meccanismi e si verifica precocemente ma anche a distanza di 48 ore dall’intervento (20).
26
3.3 Il periodo postoperatorio
a) Tossine e fattori metabolici
Le stesse tossine citate per il periodo preoperatorio svolgono uguale ruolo anche in questo periodo. A queste si somma l’eventuale azione dannosa provocata da elevati valori di mioglobina scaturiti da processi di rabdomiolisi. Tra i fattori metabolici particolare importanza assume l’iperglicemia che rappresenta un fattore di rischio importante per il danno renale e la necessità di terapia sostitutiva.
b) Ischemia e riperfusione
i. Durante degenza in UTI
Le cause sono nuovamente rappresentate da shock cardiogeno e ipotensione non cardiogenica. Alla cause già largamente prese precedentemente in considerazione al primo si somma la possibilità che si verifichi, in questo periodo, il fenomeno del tamponamento cardiaco. Questo, ovviamente, causa un gravissimo quadro di ipotensione refrattaria a tutti i tipi di terapia medica e che molto spesso necessita di rianimazione cardiopolmonare e, inevitabilmente, di re-intervento chirurgico. Tra le cause di ipotensione non cardiogena vanno nuovamente menzionate lo stato di idratazione del paziente e la vasodilatazione periferica.
27 ii. Dopo la dimissione dall’UTI
Durante questo periodo spesso possono verificarsi alterazioni del ritmo cardiaco che possono provocare riduzione dell’output cardiaco e, ad esempio, nel caso specifico della fibrillazione atriale, di fenomeni embolici. A questi processi possono ancora sommarsi attivazione del sistema neuroormonale, del sistema infiammatorio e stress ossidativo. (20)
4. La sindrome cardio-renale
È una condizione fisiopatologica in cui sussistono disfunzione renale e cardiaca e in cui le singole alterazioni d’organo si autoalimentano, peggiorando la prognosi. La patogenesi della sindrome cardio-renale rimane ancora parzialmente sconosciuta. Secondo lo storico modello di Guyton il ruolo centrale è svolto dal rene, in quanto regolatore del controllo del volume di fluido extracellulare, del sistema renina-angiotensina, dei peptidi natriuretici e dell’ossido nitrico. Il modello, però, è stato recentemente rivisitato poiché risulta sicuramente sufficiente per spiegare i cambiamenti del volume di fluido extracellulare, della pressione arteriosa e dell’output cardiaco ma insufficiente per giustificare processi come l’ipertrofia cardiaca, l’accelerata aterosclerosi e la progressione del danno renale. Per questi motivi, negli ultimi anni, questo modello è stato ampliato comprendendo una visione più ampia del sistema renina angiotensina, l’equilibrio fra
28
produzione di ossido nitrico e radicali liberi dell’ossigeno, il processo infiammatorio e il SNS (23).
4.1 Il sistema renina angiotensina
L’attivazione del sistema renina-angiotensina, provocata da una ipoperfusione renale e con la sua conseguente ritenzione di volume, causa un sovraccarico cardiaco con quadro di scompenso congestizio. Inoltre si verifica da parte dell’angiotensina II l’attivazione del sistema NADPH-ossidasi che determina formazione dei radicali liberi dell’ossigeno. L’angiotensina II, attraverso il coinvolgimento del fattore nucleare NF-kB, è altresì implicata nel processo di infiammazione vascolare e nell’attivazione del sistema nervoso simpatico (23).
4.2
L’equilibrio fra produzione di ossido nitrico e radicali liberidell’ossigeno
Il bilancio che si verifica fra ossido nitrico e radicali liberi dell’ossigeno è a favore di questi ultimi, con una ridotta disponibilità di NO. L’NO, causando vasodilatazione, è implicato nel controllo della pressione arteriosa attraverso il controllo renale del volume di fluido extracellulare, mentre gli ioni superossidi agiscono in maniera opposta sul versante pressorio. All’incremento dello stato ossidativo si somma anche una ridotta
29
produzione di sostanze antiossidanti che si determina a causa delle membrane di dialisi. Lo stato ossidativo può tradursi in danno nei confronti di proteine, lipidi, carboidrati e DNA con formazione di sostanze che, oltre a avere un effetto antiinfiammatorio diretto, provocano anche uno stimolo alla produzione di citochine pro-infiammatorie (23).
4.3 L’infiammazione
Lo stato infiammatorio è un processo ben noto in corso di stati uremici, insieme allo stress ossidativo e, le citochine ad azione pro-infiammatoria che vengono prodotte, risultano predittrici del processo aterosclerotico. Infatti, queste ultime sembrano implicate nel peggioramento e nella progressione dello scompenso cardiaco. Inoltre, il processo infiammatorio può, a sua volta, attivare il processo ossidativo attraverso la produzione dei radicali liberi dell’ossigeno che, risultano, a loro volta, responsabili della up-regulation dei recettori dell’angiotensina II. Ancora, alcune citochine sono in grado di stimolare il rilascio di noradrenalina dai neuroni del sistema simpatico (23).
4.4 Il sistema nervoso simpatico
Il SNS è in grado di regolare il controllo del volume di fluidi extracellulare e la pressione arteriosa attraverso il rilascio di renina, provocata
30
dall’attivazione del sistema simpatico renale. Come meccanismo di compenso, in corso di scompenso cardiaco, si verifica una attivazione del sistema simpatico il quale risulta responsabile dell’ipertrofia, dell’apoptosi cardiaca. L’iperattivazione del SNS provoca un’insensibilità dei recettori beta adrenergici sia in corso di insufficienza renale che di scompenso cardiaco predisponendo anche a disturbi del ritmo cardiaco. Inoltre, attraverso la mediazione dei radicali liberi dell’ossigeno, risulta responsabile di un effetto di promozione di crescita nei confronti dei vasi intrarenali, facilitando il processo aterosclerotico. (23)
31
CAPITOLO III
STUDIO CLINICO
1. Introduzione
Il paziente sottoposto a chirurgia cardiaca è un paziente che va incontro più frequentemente degli altri, sottoposti a chirurgia non cardiaca, al rischio di sviluppare insufficienza renale nel periodo postoperatorio. Questo accade innanzitutto perchè presenta spesso patologie associate come il diabete e l’ipertensione arteriosa che possono provocare già di per sé alterazione della funzionalità renale ma anche, per lo stress subito durante l’intervento chirurgico, in termini di possibile riduzione della perfusione d’organo. Oltretutto, l’alterazione sistemica che si sviluppa conseguentemente al danno locale renale si somma anche, ad un importante coinvolgimento del sistema immunitario ed infiammatorio, in particolar modo nei pazienti sottoposti a circolazione extracorporea. Per questi motivi risulterebbe fondamentale una precoce diagnosi dell’eventuale danno d’organo subito, considerando che molti dubbi sono stati sollevati riguardo alla possibilità di una diagnosi tempestiva effettuata con i metodi convenzionali. Il dosaggio di N-GAL sembra inserirsi proprio in questo contesto, anche se rimangono ancora da chiarire molti aspetti relativi al diverso significato clinico da attribuire al suo dosaggio urinario e plasmatico. Lo studio condotto è proprio volto a chiarire questi aspetti, in particolare se si possano
32
individuare differenze nella cinetica dei due valori e, quindi, se siano diverse le informazioni cliniche che questi possono fornirci.
2. Materiali e metodi
2.1 Disegno e setting dello studio
Studio clinico osservazionale di coorte eseguito presso la U.O. Anestesia e Rianimazione Cardiotoracica dell’Azienda Ospedaliera Universitaria Pisana.
2.2 Scopo dello studio
Studiare la cinetica di N-GAL urinario e N-GAL plasmatico nel tempo. Come end-point secondari sono stati studiati la cinetica della creatininemia nel tempo, lo sviluppo di leucocitosi postoperatoria e la necessità di terapia sostitutiva renale.
2.3 Protocollo dello studio
2.3.A Selezione dei pazienti
Pazienti adulti sottoposti a chirurgia cardiaca in elezione
2.3.B Dati clinici e di laboratorio
Sono stati raccolti per ogni paziente dati antropometrici, anamnestici in termini di comorbidità, tipologia e durata di intervento chirurgico (necessità/assenza di CEC), necessità di terapia con amine durante intervento chirurgico e/o durante degenza in TI, insorgenza di
33
leucocitosi e necessità di terapia sostitutiva renale durante la degenza in TI.
Sono stati eseguiti prelievi per N-GAL urinario e plasmatico, emocromo, creatininemia all’arrivo in sala operatoria, prima dell’intervento chirurgico (T0); all’arrivo in TI (T1); a 4 h (T2) e a 16 h (T3) dall’arrivo in TI.
2.4 Metodi di analisi dei dati
I dati sono stati analizzati mediante l’utilizzo del software SAS 2002-2008 (versione 9.2 di SAS Institute Inc. Cary, NC, USA). I dati continui sono stati presentati mediante media ± deviazione standard (DS), mentre i dati categoriali sono stati riportati mediante conteggio (valore percentuale). Tutte le analisi inferenziali per gli outcome principali (sviluppo di leucocitosi e necessità di terapia sostitutiva renale) sono state eseguite effettuando da prima delle analisi univariate, mediante modelli di regressione logistica, con tutte le covariate del dataset. Le variabili che, a livello univariato, hanno mostrato una significatività ≤0.25 sono state utilizzate per cercare il miglior modello a livello multivariato. Per quanto riguarda le variabili tempo-dipendenti (N-GAL urinario, N-GAL plasmatico, creatininemia), sono stati utilizzati dei modelli di regressione generalizzati (Generalized Estimating Equations) che consentono di tenere conto della correlazione entro-paziente. Tutte le stime dei parametri e tutti i p-value (per valutare la significatività) sono stati calcolati ad un livello di confidenza del 95%.
34
3. Risultati
Sono stati arruolati 49 pazienti i cui dati antropometrici sono riassunti in tab.3.
Tab.3 Dati antropometrici
Età (anni) 69.5 ± 10.1 Sesso (maschi) 26 (53) Peso (kg) 74.4 ± 16.4 Altezza (cm) 165.1 ± 8.7
Sono state prese in considerazione le comorbidità associate di più frequente riscontro e più significative per il tipo di studio in esame (Tab.4)
Tab.4 Comorbidità Patologia Pazienti Diabete mellito 17 (34.7) Ipertensione arteriosa 38 (77.6) Scompenso recente 2 (4.1)
Alterazione funzionalità cardiaca (FE˂40%) 10 (20.4) Alterazione funzionalità renale 5 (10.2)
35
Sono stati arruolati sia pazienti sottoposti ad intervento di sostituzione o plastica valvolare, sostituzione di porzioni di aorta, bypass aorto-coronarico sia esse come procedure singole o combinate. Quindi sono stati esaminati sia pazienti in cui si è resa necessaria la CEC che pazienti in cui l’intervento è stato eseguito a cuore battente. Sono state considerate le durate medie dell’intervento chirurgico e della CEC. (tab.5)
Tab. 5 Caratteristiche dell’intervento chirurgico Intervento combinato 9 (18.4) Presenza di CEC 35 (71.4) Durata intervento(min) 230.3 ± 62.5 Durata CEC (min) 77.0 ± 52
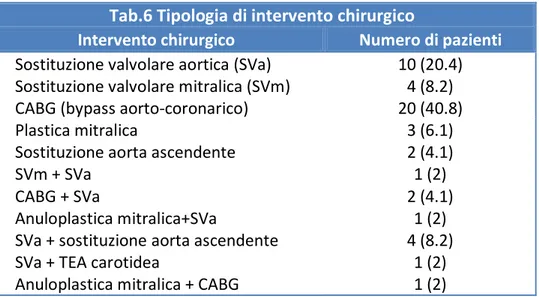
Le tipologie di intervento di chirurgia cardiaca a cui sono stati sottoposti i pazienti sono illustrate in tab.6
Tab.6 Tipologia di intervento chirurgico
Intervento chirurgico Numero di pazienti
Sostituzione valvolare aortica (SVa) Sostituzione valvolare mitralica (SVm)
10 (20.4) 4 (8.2) CABG (bypass aorto-coronarico) 20 (40.8)
Plastica mitralica 3 (6.1)
Sostituzione aorta ascendente 2 (4.1)
SVm + SVa 1 (2)
CABG + SVa 2 (4.1)
Anuloplastica mitralica+SVa
SVa + sostituzione aorta ascendente SVa + TEA carotidea
1 (2) 4 (8.2)
1 (2) Anuloplastica mitralica + CABG 1 (2)
36
Sono stati calcolati i valori medi di N-GAL urinario, plasmatico, creatininemia ai tempi T0, T1, T2, T3 (tab.7)
Tab.7 Valori di laboratorio
U T0 (ng/ml) 26.2 ± 36.6 U T1 (ng/ml) 124.1 ± 226.8 U T2 (ng/ml) 61.9 ± 133.9 U T3 (ng/ml) 42.7 ± 65.6 P T0 (ng/ml) 122.0 ± 128.8 P T1 (ng/ml) 332.8 ± 212.2 P T2 (ng/ml) 400.5 ± 273.2 P T3 (ng/ml) 272.1 ± 256.2 Creat T0 (mg/dl) 1.0 ± 0.5 Creat T1 (mg/dl) 1.0 ± 0.5 Creat T2 (mg/dl) 1.1 ± 0.5 Creat T3 (mg/dl) 1.2 ± 0.6
U= NGAL urinario; P= NGAL plasmatico; Creat= creatininemia
I valori considerati patologici per UN-GAL sono ˃ 130 ng/ml, per PN-GAL ˃ 150 ng/ml e per creatininemia ˃ 1.2 mg/dl.
Per uso di amine si è considerata l’infusione continua di noradrenalina per un tempo minimo di 2 ore, avvenuta nel periodo intraoperatorio o durante la degenza in TI. 23 pazienti sono stati sottoposti a tale terapia.
37
Per lo sviluppo di leucocitosi postoperatoria è stato considerato il riscontro di almeno un valore maggiore di 10000/μL nel corso dei prelievi effettuati (Tab.8).
Per necessità di terapia sostitutiva renale (CRRT) è stato considerato l’instaurarsi di metodiche di CVVHDF (continuos veno-venous hemodiafiltration) durante la degenza in TI ( tab.8).
Tab.8
Leucocitosi 40 (81.6) CRRT 4 (8.2)
3.1 Analisi delle variabili tempo-dipendenti
Dall’analisi dell’N-GAL urinario è stato evidenziato come i suoi valori medi siano significativamente influenzati dal tempo. Nello specifico, il valore medio a T1 è significativamente diverso dal valore medio a T0. Inoltre i valori di N-GAL urinario dipendono in modo significativo dalla presenza di CEC e dalla presenza di valori di creatininemia preoperatori alterati. Infatti il valore medio di N-GAL urinario,nei pazienti sottoposti a CEC, aggiustato per l’effetto che esercita anche la creatininemia basale alterata all’ingresso in sala operatoria, risulta aumentato di 23.7 punti. Nello stesso modo, il valore medio di N-GAL urinario, aggiustato per l’effetto che esercita la CEC,
38
risulta aumentato di 36.6 punti nei pazienti che presentano all’ingresso in sala operatoria valori di creatininemia alterata. (tab.9)
Effetto Stima Errore standard Valore di P Limite inferiore Limite superiore
Intercetta 4.0480 10.1559 0.6913 -16.1673 24.2633
CEC 23.7364 10.6669 0.0284 2.5600 44.9128
Creatininemia basale alterata 36.6328 14.7033 0.0145 7.4432 65.8225
Tempo T1 97.8816 32.8020 0.0044 32.0299 163.73
Tempo T2 35.6939 19.6671 0.0749 -3.7086 75.0964
Tempo T3 16.5143 10.2282 0.1104 -3.8459 36.8745
Tempo T0 (di riferimento) 0 . . . .
Tab.9
Dall’analisi dell’N-GAL plasmatico è emerso che il tempo ha un effetto statisticamente significativo cioè i suoi valori medi ad ogni tempo analizzato (T1,T2,T3) differiscono in modo significativo dal tempo basale (tab.10).
39
Effetto Stima Standard Error Valore di P Limite inferiore Limite superiore
Intercetta 119.96 35.2725 0.0008 50.3767 189.53 FE ˂ 40% -87.4155 39.7276 0.0290 -165.78 -9.0491 uso di amine 67.7045 32.7037 0.0398 3.1934 132.22 scompenso recente -232.42 82.2087 0.0052 -394.59 -70.2578 tempo 208.43 44.4576 <.0001 120.73 296.13 tempo 276.71 44.4576 <.0001 189.02 364.41 tempo 151.41 44.4576 0.0008 63.7113 239.10 tempo 0 . . . . Tab.10
Inoltre, aggiustando i valori per l’effetto della presenza in anamnesi di scompenso cardiaco recente e della FE (frazione di eiezione) ˂ 40%, i valori risultano avere un aumento di 67.7 punti statisticamente significativo nei pazienti che hanno fatto uso di amine.
Dall’analisi della creatininemia si evidenzia che il tempo non ha nessun effetto statisticamente significativo sui valori medi. Essa infatti dipende solamente dal peso corporeo del paziente.(Tab.11)
40
Effetto tempo stima Error Standard Valore di P Limite inferiore Limite superiore
Intercetta -3.2248 1.8625 0.0850 -6.8986 0.4489 Peso corporeo 0.05695 0.01742 0.0013 0.02259 0.09130 tempo 1 -0.01061 1.8916 0.9955 -3.7418 3.7206 tempo 2 0.9198 1.8916 0.6274 -2.8114 4.6510 tempo 3 1.0610 1.8916 0.5755 -2.6701 4.7922 tempo 4 0 . . . . Tab.11
3.2 Analisi degli outcome principali
Usando un modello multivariato per dati correlati si è evidenziato che l’aumento dell’NGAL plasmatico rappresenta un fattore di rischio per lo sviluppo di leucocitosi postoperatoria. (Tab.12)
Parametri stima Errore Standard Valore di P| OR Limite inferiore Limite superiore
Intercetta 24.4016 5.1739 <.0001
Durata CEC -0.0691 0.0126 <.0001 0.93 0.91 0.96
altezza -0.1074 0.0288 0.0002 0.90 0.85 0.95
pNGAL 0.0061 0.0018 0.0010 1.006 1.003 1.01
41
Il modello multivariato logistico utilizzato per l’analisi della sviluppo di necessità di terapia sostitutiva renale è risultato non attendibile per la presenza di un troppo basso numero di eventi (4/49).
42
4. Discussione
L’insufficienza renale rappresenta una frequente complicanza nei pazienti sottoposti a chirurgia cardiaca e, attualmente la sua diagnosi viene effettuata mediante i criteri AKIN che comprendono la valutazione della creatininemia e dell’output urinario. Questo metodo di diagnosi risulta purtroppo affetto da molti limiti legati in particolar modo ai limiti stessi della creatininemia, che si è rivelata essere un indice impreciso e tardivo. Essa infatti può essere influenzata da fattori prerenali, come alterazione del calibro delle arteriole efferenti, e da fattori postrenali, come ostruzione del tratto urinario. Anche da fattori extrarenali, rappresentati da sesso, età, massa muscolare, stato di idratazione del paziente e varia solamente quando più del 50% della funzionalità renale è ormai compromessa. Inoltre, soprastima la funzionalità renale quando i valori di filtrato glomerulare sono particolarmente bassi e, quando questo varia acutamente, non risulta in grado di rilevarlo se non tardivamente nel tempo, ovvero quando ha raggiunto un equilibrio allo steady-state (24). Lo studio condotto conferma questi concetti: infatti la variazione dei valori di creatininemia non risultano statisticamente significativi nel tempo, mentre risultano esserlo contestualmente quelli di NGAL urinario e plasmatico. L’NGAL infatti è in condizioni fisiologiche espresso in bassa concentrazione in molti organi e tessuti compreso il rene. Viene filtrato dal glomerulo e riassorbito nel tubulo prossimale, oltre che secreto dalla porzione sottile ascendente del tubulo. Quando però si verifica un danno renale, oltre alla iperproduzione in loco, si assiste ad un suo ridotto assorbimento così che i valori urinari risultino
43
aumentati. Per questi motivi, il rene, invece, non sembra essere una significativa diretta sorgente di N-GAL plasmatico essendo questo prodotto da altri tessuti ed organi. In letteratura sono presenti ormai da alcuni anni svariati studi su N-GAL. In alcuni è stato valutato solamente N-GAL plasmatico alla ricerca di una sua attendibilità per diagnosi di insufficienza renale, con conclusione che esso rappresenta un buon biomarker. Però questi lavori presentano il limite che sono state incluse popolazioni eterogenee di pazienti critici ammessi in TI, compresi pazienti che hanno sviluppato sepsi nel corso della degenza (25-26), anche se in un caso si è dimostrata la non correlazione con proteina C reattiva a conta neutrofila (26). Altri hanno analizzato pazienti con insufficienza renale sepsi-correlata e non sepsi-correlata, concludendo che i pazienti con AKI sepsi-correlata hanno valori di N-GAL urinario e N-GAL plasmatico più alti rispetto ai pazienti con AKI non sepsi-correlata (27). Ancora N-GAL plasmatico e N-GAL urinario è stato studiato in pazienti settici in presenza e in assenza di AKI concludendo che N-GAL plasmatico non è significativamente diverso nei due gruppi ma che N-GAL urinario è un buon predittore di AKI, soprattutto nei pazienti con shock settico (28). Esistono anche studi condotti su popolazione selezionate di pazienti; ad esempio in gruppi di pazienti cardiochirurgici è stato dimostrato che N-GAL urinario è un precoce biomarker di danno renale (29-30), che in pazienti sottoposti a CEC N-GAL plasmatico e NG-AL urinario sono entrambi più alti nei pazienti che sviluppano AKI (31) e che N-GAL plasmatico è associato ad AKI ma con basso valore predittivo (32). Esiste un lavoro di review che comprende studi con popolazioni eterogenee di pazienti, compresa un’alta percentuale di pazienti pediatrici, che attribuisce un valore diagnostico e prognostico per
44
AKI ad N-GAL sia urinario che plasmatico, anche se con valore predittivo minore per adulti rispetto a pazienti pediatrici (33). Un altro lavoro di review, che comprende una casistica minore ma anch’esso una popolazione eterogenea di pazienti, conclude che N-GAL sia urinario che plasmatico, in assenza di valori alterati di creatininemia, è in grado di porre diagnosi di AKI (34). Vale la pena di sottolineare che tutti gli studi condotti sono gravati da un importante errore di fondo rappresentato dal fatto che la diagnosi di AKI, pur essendo effettuata secondo le linee guida attualmente vigenti all’interno dello scenario scientifico internazionale, viene ancora effettuata usando come parametro principale il dosaggio della creatinina ematica, nonostante siano ormai ben noti i suoi limiti. In generale, comunque, sembra risultare più chiaro il legame di N-GAL urinario con AKI di quanto non lo sia N-GAL plasmatico. L’analisi dello studio in esame, vertendo sul confronto della cinetica fra i valori urinari e plasmatici e lo studio di variabili eventualmente ad essi correlate, ha avuto come scopo quello di condurci ad individuare l’implicazione clinica che i due valori possano avere, eventualmente individuando se comune o diversa.
La popolazione presa in esame è rappresentata esclusivamente da pazienti sottoposti a chirurgia cardiaca in cui è quindi possibile individuare, rispetto a popolazioni eterogenee di pazienti, come possibile momento di insulto renale la fase dell’intervento chirurgico. Il fatto che il valore di N-GAL urinario dell’immediato periodo postoperatorio sia risultato statisticamente significativo evidenzia che esso è in grado di rilevare precocemente un insulto renale. Inoltre, il fatto che non si sia individuata una significatività statistica negli altri valori e che non ci sia correlazione con la necessità di terapia sostitutiva renale potrebbe essere attribuito al fatto che, solamente
45
un numero esiguo di pazienti (quattro), in un campione limitato, ha in effetti sviluppato un quadro di insufficienza renale importante, sottolineando quindi anche la capacità di N-GAL urinario di individuare un danno renale anche solamente di tipo transitorio. Considerando anche che, è da sempre nota la possibilità che l’impiego della CEC rappresenti un importante fattore di rischio per lo sviluppo di insufficienza renale, il dato che i valori medi di N-GAL urinario siano significativamente correlati all’impiego di CEC ci sottolinea maggiormente la sua capacità di individuazione del danno renale. Inoltre esso, per la significatività rilevata nei pazienti che già presentavano in ingresso alterazione della funzionalità renale (individuata attraverso valori di creatininemia preoperatori) e sottoposti a CEC sembrerebbe in grado di individuare anche la progressione di un danno renale già esistente.
Per quanto riguarda l’N-GAL plasmatico va tenuto di conto che esso può risultare aumentato in corso di AKI. Questo avviene, però, non grazie alla iperespressione genica che ne provoca la produzione in loco, ma per interessamento di organi a distanza e quindi per produzione extrarenale. Inoltre va considerato anche che NGAL è stato originariamente isolato dai neutrofili e che, durante la CEC, si assiste ad una massiccia attivazione del sistema infiammatorio. Quest’ultimo, oltre al coinvolgimento di altri meccanismi, provoca anche l’attivazione dell’immunità cellulo-mediata e in particolar modo dei neutrofili stessi. Se, l’attivazione del sistema infiammatorio risulta particolarmente marcata in corso di CEC, non va però dimenticato che qualsiasi tipologia di procedura chirurgica espone ad una attivazione del sistema infiammatorio. La produzione di citochine, chemochinine, ormoni dello stress e altri mediatori chimici, sono implicati
46
nella patogenesi della SIRS (systemic inflammatory response syndrome) prima e della CARS (compensatory anti-inflammatory response syndrome) dopo che si sviluppano in pazienti sottoposti ad interventi chirurgici importanti (35). I neutrofili polimorfonucleati giocano un ruolo centrale nella risposta immunitaria innata e risultano attivati precocemente dopo l’insulto chirurgico. La loro attivazione è provocata, oltre che dall’aumento delle elastasi rilasciate in seguito allo stress chirurgico, anche dal processo di ischemia viscerale a cui possono andare incontro alcuni organi durante la procedura (36). Considerando che N-GAL plasmatico risulta aumentato nei pazienti che hanno fatto uso di amine e presenta una differenza statisticamente significativa a tutti i tempi di prelievo, rispetto al basale, e che questo non accade per N-GAL urinario, si potrebbe ipotizzare che N-GAL plasmatico sia influenzato da qualche altro meccanismo. Cioè all’innalzamento dei valori di N-GAL plasmatico nel tempo potrebbe contribuire non solamente lo screzio renale (provocato oltre che dalla procedura chirurgica in sé anche dall’uso di amine) ma anche l’attivazione del sistema infiammatorio scaturito dalla procedura chirurgica, sia essa eseguita con l’ausilio della CEC sia senza. Questa ipotesi potrebbe anche essere suffragata dal dato che i pazienti che mostrano maggior aumento di N-GAL plasmatico hanno maggiore probabilità di sviluppare leucocitosi durante la degenza (27). Inoltre, l’attivazione del sistema infiammatorio è un processo che persiste nell’immediato periodo postoperatorio, cioè nel periodo preso in esame dal presente studio che è quello della giornata operatoria e della prima postoperatoria. In conclusione, l’N-GAL urinario potrebbe trovare maggior impiego nella diagnosi del danno renale acuto, sia che esso diventi clinicamente palese oppure no, risultando esso più
47
specifico per questo tipo di alterazione. Invece N-GAL plasmatico potrebbe essere gravato da maggior margine di errore, essendo esso più facilmente influenzabile da alterazioni non renali.
È comunque doveroso sottolineare che il presente lavoro è uno studio di tipo osservazionale eseguito su un campione di pazienti limitato nel numero e con un tempo di osservazione anch’esso limitato. Serviranno sicuramente ulteriori studi che possano confermare i dati rilevati e che coinvolgano anche una più attenta e specifica valutazione del sistema infiammatorio.
48
BIBLIOGRAFIA
1) Bennett M, Dent CL, Ma Q et al. Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study. Clin J Am Soc Nephrol 2008; 3: 665-673
2) Bolignano D, Donato V, Coppolino G et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a marker of kidney damage. Am J Kid Dis 2008; 52:595-605
3) Devarajan P. Review: Neutrophil gelatinase-associated lipocalin: a troponin-like biomarker for human acute kidney injury. Neph 2010; 15:419-428
4) Schmidt-Ott K M, Mori K, Yi Li J et al. Dual action of Neutrophil gelatinase-associated lipocalin. J Am Soc Nephrol 2007; 18: 407-413
5) Bonventre JV, Sukhatme VP, Bamberger M et al. Localization of the protein product of the immediate early growth response gene, Egr-1, in the kidney after ischemia and reperfusion. Cell Regul 1991; 2: 251–260
6) Megyesi J, Di Mari J, Udvarhelyi N et al. DNA synthesis is dissociated from the immediate-early gene response in the post-ischemic kidney. Kidney Int 1995; 48: 1451–1458
7) Safirstein R, Megyesi J, Saggi SJ et al. Expression of cytokine-like genes JE and KC is increased during renal ischemia. Am J Physiol 1991; 261: F1095– F1101
49
8) Witzgall R, Brown D, Schwarz C et al. Localization of proliferating cell nuclear antigen, vimentin, c-Fos, and clusterin in the postischemic kidney. Evidence for a heterogenous genetic response among nephron segments, and a large pool of mitotically active and dedifferentiated cells. J Clin Invest 1994; 93: 2175–2188
9) Grigoryev DN, Liu M, Hassoun HT et al. The local and systemic inflammatory transcriptome after acute kidney injury. J Am Soc Nephrol. 2008; 19: 547–58.
10) Devarajan P. Neutrophil gelatinase-associated lipocalin: a promising biomarker for human acute kidney injury. Biomark Med 2010; 4:265-280 11) Devarajan P. Neutrophil gelatinase-associated lipocalin: a troponin-like biomarker for human acute kidney injury. Nephrol 2010; 15:419-428
12) Mehta RL, Kellum JA, Shah SV et al. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007; 11:R31
13) Vaidya VA, Ferguson MA, Bonventre J. Biomarkers of acute kidney injury. Annu Rev Pharmacol Toxicol 2008; 48: 463-493
14) Metnitz PGH, Krenn CG, Steltzer H et al. Effect of acute renal failure requiring renal replacement therapy on outcome in critically ill patients. Crit Care Med 2002;30: 2051–2058.
15) Back MR, Bandyk M, Bradner M et al. Critical analysis of outcome determinants affecting repair of intact aneurysms involving the visceral aorta. Ann Vasc Surg 2005; 19: 648–656
16) Hassoun HT, Grigoryev DN, Lie ML et al. Ischemic acute kidney injury induces a distant organ functional and genomic response distinguishable from bilateral nephrectomy. Am J Physiol 2007; 293: F30–F40.
50
17) K. J. Kelly. Distant effects of experimental renal ischemia/reperfusion injury. J Am Soc Nephr 2003; 14: 1549–1558
18) White LE, Hassoun HT. Inflammatory mechanism of organ crosstalk during ischemic acute kidney injury. Int J Nephrol 2011;2012: 1-8
19) Rabb H, Wang Z, Postler G et al. Possible molecular basis for changes in potassium handling in acute renal failure. Am J Kid Dis 2000;35: 871–877 20) Bellomo R, Auriemma S, Fabbri A et al. The pathophysiology of cardiac surgery-associated acute kidney injury (CSA-AKI). Int J Art Org 2008; 31: 166-178
21) Laffey JG, Boylan JF, Cheng DCH. The systemic inflammatory response to cardiac surgery. Implications for the anesthesiologist. Anesthesiol 2002; 97: 215–52
22) Lombardi L, Guarracino F; Il problema nutrizionale. Pagg. 332-333. Terapia intensiva in chirurgia cardiovascolare. Guarracino F, Santini F. Ed. Elsevier 2011.
23) Bongartz LG, Cramer MJ, Doevedans PA et al. The severe cardiorenalsyndrome: ‛Guyton revisited’. Eur Heart J 2005; 26: 11-17
24) Shemin D, Dworkin LD. Neutrophil gelatinase-associated lipocalin (NGAL) asa biomarker for acute kidney injury. Crit Care Clin 2011; 27: 379-389
25) Cruz D, De Cal M, Garzotto F et al. Plasma neutrophil gelatinase-associated lipocalin is an early biomarker for acute kidney injury in an adult ICU population. Int Care Med 2010; 36: 444-451
51
26) Constantin JM, Futier E, Perbet S et al. Plasma neutrophil gelatinase-associated lipocalin is an early biomarker of acute kidney injury in an adult critically ill patients: a prospective study. J Crit Care 2010; 25: 176e1-176e6 27) Bagshaw SM, Bennett M, Haase M et al. Plasma and urine neutrophil gelatinase-associated lipocalin in septic versus non-septic acute kidney injury in critical illness. Int Care Med 2010; 36: 452-461
28) Martensson J, Bell M, Oldener A et al. Neutrophil gelatinase-associated lipocalin in adult septic patients with and without acute kidney injury. Int Care Med 2010; 36: 1333-1340
29) Bennett M, Dent CL, Ma Q et al. Urine NGAL predicts severity of acute kidney injury after cardiac surgery: a prospective study. Clin J Am Nephrol 2008; 3: 665-673
30) Association betweeen increases in urinary neutrophil gelatinase-associated lipocalin and acute renal dysfunction after adult cardiac surgery. Anestesiol 2006; 105: 485-491
31) Tuladhar SM, Puntmann VA, Soni M et a. Rapid detection of acute kidney injury by plasma and urinary neutrophil gelatinase-associated lipocalin after cardiopulmonary bypass. J Cardiovasc Pharmacol 2009; 53:261-266
32) Perry TE, Muehlschlegel JD, Liu K-Y et al. Plasma neutrophil gelatinase-associated lipocalin and acute postoperative kidney injury in adult cardiac surgical patients. Anest Analg 2010; 110: 1541-1547
52
33) Haase M, Bellomo R, Devarajan P et al. Accuracy of neutrophil gelatinase-associated lipocalin (NGAL) in diagnosis and prognosis in acute kidney injury: a systematic review and meta-analysis. Am J Kid Dis 2009; 54: 1012-1024
34) Haase M, Devarajan P, Haase Fielitz A et al. The out come of neutrophil gelatinase-associated lipocalin-positive subclinical acute kidney injury. J Am Coll Card 2011; 57:1753-1761
35) Kimura F, Shimizu H, Yoshidome H et al. Immunosuppression following surgical and traumatical injury. Surg today 2010; 40: 793-808.
36) Foulds S, Cheshire NJ, Schachter M et al. Endotoxin related early neutrophil activation is associated with outcome after thoracoabdominal aortic aneurysm repair. Br J Surg 1997; 84: 172-7