UNIVERSITÀ DEGLI STUDI DI BOLOGNA
D
OTTORATO DIR
ICERCA INC
HIMICAI
NDUSTRIALE(XX Ciclo)
F
ACOLTÀ DIC
HIMICAI
NDUSTRIALED
IPARTIMENTO DIC
HIMICAI
NDUSTRIALE E DEIM
ATERIALISVILUPPI DI CATALIZZATORI
PER L’ABBATTIMENTO DI NO
xIN PRESENZA DI OSSIGENO
TESI DI DOTTORATO
Presentata da:
Coordinatore:
D
OTT. M
ASSIMILIANOL
IVIC
HIAR.
MOP
ROF. L
UIGIA
NGIOLINIRelatore
:P
ROF. G
IUSEPPEF
ORNASARICorrelatore
:C
HIAR.
MOP
ROF. A
NGELOV
ACCARIT
UTTO ÈV
ELENO,
N
IENTE ÈV
ELENO,
S
OLO LAD
OSEF
AI
LV
ELENO.
P
ARACELSUSN
ULLA SIC
REA,
N
ULLA SID
ISTRUGGE,
T
UTTO SIT
RASFORMA.
A
NTOINEL
AVOISIERO
GNI SCIENZA CHIUDE IN FONDO A SÉ IL DUBBIO.
E
MILEV
ERHAERENL
AS
CIENZA SENZA LAR
ELIGIONE È ZOPPA,
L
AR
ELIGIONE SENZA LAS
CIENZA È CIECA.
A
LBERTE
INSTEINL’I
MMAGINAZIONE È PIÙI
MPORTANTE DELLA ONOSCENZA.
C
D
AMARISF. T
ALDOL
A SCIENZA DI OGGI È LA TECNOLOGIA DI DOMANI.
Parole Chiave
NOx Storage Reduction (NSR)
Pt
Metalli alcalino terrosi
Meccanismo di riduzione con H2
1. OBIETTIVI DELLA RICERCA
12. INTRODUZIONE
52.1 L’ATMOSFERA
32.2 INQUINAMENTO ATMOSFERICO
102.2.1 LO SMOG 13
2.2.2 INQUINANTI PRIMARI DELLA COMBUSTIONE 21
2.3 INQUINAMENTO DEGLI OSSIDI DI AZOTO
272.3.1 CARATTERISTICHE DEGLI OSSIDI DI AZOTO 27 2.3.2 EFFETTI DEGLI NOXSULLA SALUTE 29
2.3.3 LO SMOG FOTOCHIMICO 31
2.3.4 IL BUCO DELL’OZONO 37
2.3.5 NEBBIE E PIOGGE ACIDE 44
2.3.6 EFFETTO SERRA 49
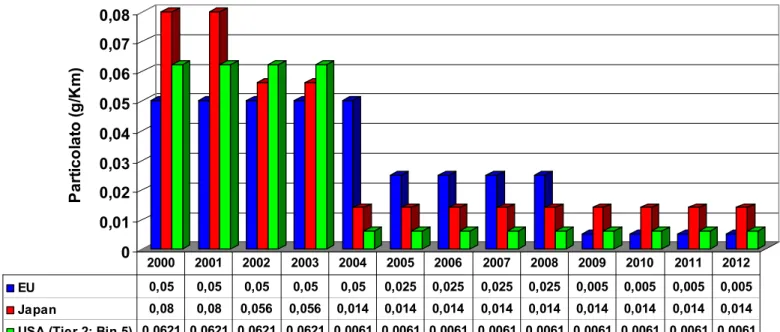
2.4 NORMATIVA SULL’INQUINAMENTO
ATMOSFERICO
562.4.1 NORMATIVE SUI COMBUSTIBILI 56 2.4.2NORMATIVE SULLE EMISSIONI DEGLI
AUTOVEICOLI 60
2.4.3 RIDUZIONE DELLE EMISSIONI DI CO2 66
2.4.4 COMBUSTIBILI ALTERNATIVI 67
2.4.5 VEICOLI ALTERNATIVI 68
2.5 TECNOLOGIE DI CONTROLLO DELLE
EMISSIONI
762.6.1 RIDUZIONE DELLE EMISSIONI DURANTE LO
“START-UP” DEL MOTORE 91
2.6.2 CATALIZZATORI PER COMBUSTIBILI
ALTERNATIVI 94
2.6.3 DIAGNOSI A BORDO DELLE MARMITTE
CATALITICHE (OBD) 95
2.7 LEAN-DeNO
x 982.7.1 RIDUZIONE CATALITICA SELETTIVA DEGLI NOX
(SCR) 99
2.7.2 NOXSTORAGE REDUCTION 103
2.7.3 CATALIZZATORI PER PARTICOLATO 104
3 RASSEGNA BIBLIOGRAFICA
1113.1 CATALIZZATORI TIPO “TOYOTA”
1123.2 MECCANISMO NSR
1143.2.1 OSSIDAZIONE DELL’NO 115
3.2.2 MECCANISMO DI ACCUMULO 117 3.2.3 METALLI ALCALINI E ALCALINO-TERROSI 124 3.2.4 EFFETTO DELLA COMPOSIZIONE DEL GAS 129
3.2.5 AGENTE RIDUCENTE 132
3.2.6 PRODOTTI DELLA RIDUZIONE 134
3.2.7 DISATTIVAZIONE DA SO2 140
3.3 CATALIZZATORI NANOPARTICELLARI
1453.3.1 PREPARAZIONE DI NANOPARTICELLE
IDROTALCITICI
3.4.1 STRUTTURA E PROPRIETÀ DELLE IDROTALCITI O
DEGLI OSSIDI MISTI DA ESSE DERIVATI 148 3.4.2 APPLICAZIONI NELLA DECONTAMINAZIONE
DELL’ARIA 153
3.5 RIASSUNTO DELL’ATTIVITÀ PRECEDENTE
1573.5.1 CATALIZZATORI OTTENUTI DA PRECURSORI
IDROTALCITICI 157
3.5.2RUOLO DELLA COMPOSIZIONE 158
3.5.3ANALISI FT-IR 161
3.5.4 TRATTAMENTO IDROTERMALE 175
4. PARTE SPERIMENTALE
1794.1 SUPPORTI UTILIZZATI
1794.2 PREPARAZIONE DEI CATALIZZATORI
1794.3 CARATTERIZZAZIONE DEI CATALIZZATORI
1814.3.1 XRD 182
4.3.2 DETERMINAZIONE DELL’AREA SUPERFICIALE 185 4.3.3 DETERMINAZIONE DELLA POROSIMETRIA
186 4.3.4 DETERMINAZIONE DELLA DISPERSIONE
METALLICA 187
4.3.5 ANALISI TPR/O 188
4.4 DESCRIZIONE DELL’IMPIANTO
190
4.5 STRUMENTAZIONE
191
4.5.1 SPETTROMETRO DI MASSA A QUADRUPOLO
191
4.6.2 MISURA DELL’ATTIVITÀ CATALITICA 198
5. RISULTATI E DISCUSSIONE
2015.1 CARATTERIZZAZIONE DEI CATALIZZATORI
2015.1.1 CATALIZZATORI A BASE DI PT
NANOPARTICELLARE 202
5.1.2 ANALISI DIFFRATTOMETRICA DEI
CATALIZZATORI A BASE DI PT NANOPARTICELLARE (XRD)
203 5.1.3 ANALISI TPR-O DEI CATALIZZATORI A BASE DI
PT NANOPARTICELLARE 208
5.1.4CATALIZZATORI A BASE DI PT COMPLESSO
AMMONIACALE 209
5.1.5ANALISI DIFFRATTOMETRICA DEI
CATALIZZATORI A BASE DI PT AMMONIACALE (XRD) 210 5.1.6ANALISI TPR-O DEI CATALIZZATORI A BASE DI
PT AMMONIACALE 211
5.1.7CATALIZZATORI A BASE DI OSSIDO MISTO
Mg(Al)O 216
5.1.8ANALISI DIFFRATTOMETRICA DEI
CATALIZZATORI A BASE DI OSSIDO MISTO Mg(Al)O 217 5.1.9ANALISI TPR-O DEI CATALIZZATORI A BASE DI
OSSIDO MISTO Mg(Al)O 218
5.2 REATTIVITA’ DEI DIFFERENTI
CATALIZZATORI
2215.2.3 CAPACITÀ DI ACCUMULO E RIGENERABILITÀ DEI CATALIZZATORI IN ASSENZA DI CO2
238 5.2.5CAPACITÀ DI ACCUMULO E RIGENERABILITÀ DEI
CATALIZZATORI IN PRESENZA DI CO2
247 5.2.6 EFFETTO DEL TEMPO DI RIDUZIONE IN CICLI
OSSIDANTI E RIDUCENTI IN ASSENZA CO2
251 5.2.7 EFFETTO DEL TEMPO DI RIDUZIONE IN CICLI
OSSIDANTI E RIDUCENTI IN PRESENZA CO2
263 5.2.8ATTIVITA’CATALITICA IN PRESENZA DI CO2 E
H2O
267
5.3 IPOTESI DI MECCANISMO
2706. CONCLUSIONI
2731 OBIETTIVI
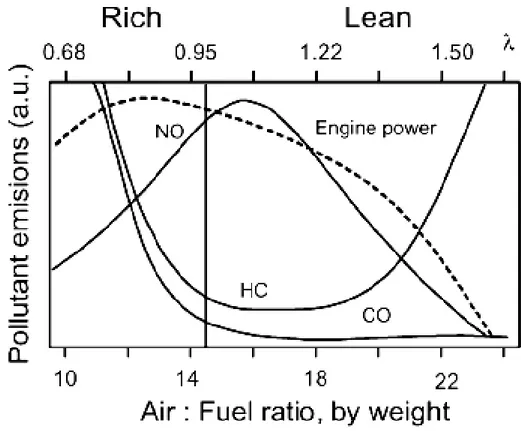
Il traffico veicolare è la principale fonte antropogenica di NOx, idrocarburi (HC) e CO e, dato che la sostituzione dei motori a combustione interna con sistemi alternativi appare ancora lontana nel tempo, lo sviluppo di sistemi in grado di limitare al massimo le emissioni di questi mezzi di trasporto riveste un’importanza fondamentale. Sfortunatamente non esiste un rapporto ottimale aria/combustibile che permetta di avere basse emissioni, mentre la massima potenza ottenibile dal motore corrisponde alle condizioni di elevata formazione di
CO e HC.
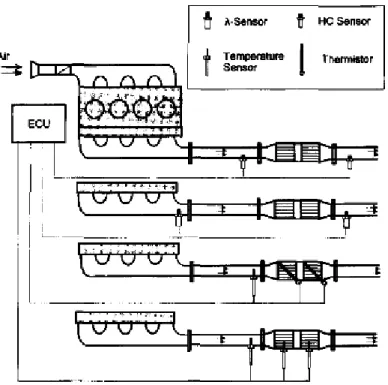
Gli attuali sistemi di abbattimento permettono il controllo delle emissioni da sorgenti mobili tramite una centralina che collega il sistema di iniezione del motore e la concentrazione di ossigeno del sistema catalitico (posto nella marmitta) in modo da controllare il rapporto aria/combustibile (Fig. 1.1).
Fig. 1.1 Schema motore-marmitta catalitica-centralina elettronica.
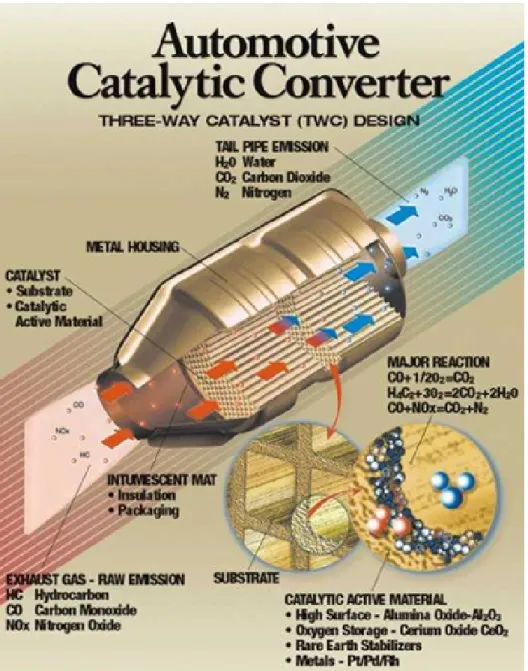
Le marmitte catalitiche per motori a benzina utilizzano catalizzatori “three way” a base di Pt/Rh supportati su ossidi (allumina, zirconia e ceria), che, dovendo operare con un rapporto quasi stechiometrico combustibile/comburente, comportano una minore efficienza del motore e consumi maggiori del 20-30% rispetto alla combustione in eccesso di ossigeno. Inoltre, questa tecnologia non
può essere utilizzata nei motori diesel, che lavorano in eccesso di ossigeno ed utilizzano carburanti con un tenore di zolfo relativamente elevato.
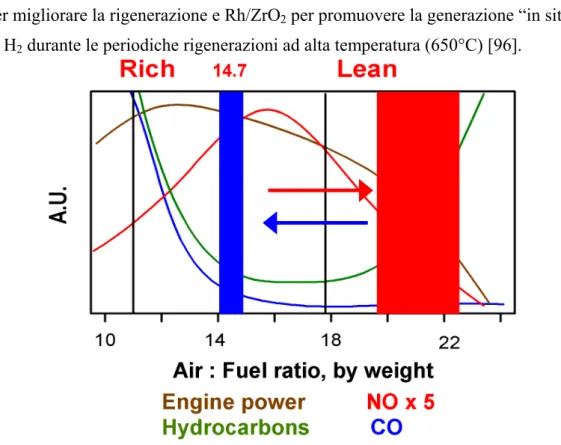
In questi ultimi anni è cresciuto l’interesse per il controllo delle emissioni di NOx da fonti veicolari, con particolare attenzione alla riduzione catalitica in presenza di un eccesso di ossigeno, cioè in condizioni di combustione magra. Uno sviluppo recente è rappresentato dai catalizzatori tipo “Toyota” che sono basati sul concetto di accumulo e riduzione (storage/reduction), nei quali l’NO viene ossidato ed accumulato sul catalizzatore come nitrato in condizioni di eccesso di ossigeno. Modificando poi per brevi periodi di tempo le condizioni di alimentazione da ossidanti (aria/combustibile > 14,7 p/p) a riducenti (aria/combustibile < 14,7 p/p) il nitrato immagazzinato viene ridotto a N2 e H2O. Questi catalizzatori sono però molto sensibili alla presenza di zolfo e non possono essere utilizzati con i carburanti diesel attualmente in commercio.
Obiettivo di questo lavoro di tesi è stato quello di ottimizzare e migliorare la comprensione del meccanismo di reazione dei catalizzatori “storage-reduction” per l’abbattimento degli NOx nelle emissioni di autoveicoli in presenza di un eccesso di ossigeno.
Lo studio è stato inizialmente focalizzato sulle proprietà dei precursori del Pt, fase attiva nei processi di storage-reduction, sulla composizione della fase di accumulo (Ba, Mg ed una loro miscela equimolare) e del supporto (γ-Al2O3 o Mg(Al)O).
E’ stata effettuata una dettagliata caratterizzazione chimico-fisica dei materiali preparati tramite analisi a raggi X (XRD), area superficiale, porosimetria, analisi di dispersione metallica, analisi in riduzione e/o ossidazione in programmata di temperatura (TPR-O), che ha permesso una migliore comprensione delle proprietà dei catalizzatori.
Vista la complessità delle miscele gassose reali, sono state utilizzate, nelle prove catalitiche di laboratorio, alcune miscele più semplici, che tuttavia potessero rappresentare in maniera significativa le condizioni reali di esercizio.
Il comportamento dei catalizzatori è stato studiato utilizzando differenti miscele sintetiche, con composizioni che permettessero di comprendere meglio il meccanismo. L’intervallo di temperatura in cui si è operato è compreso tra 200-450°C.
Al fine di migliorare i catalizzatori, per aumentarne la resistenza alla disattivazione da zolfo, sono state effettuate prove alimentando in continuo SO2 per verificare la resistenza alla disattivazione in funzione della composizione del catalizzatore.
Inoltre, per comprendere meglio il meccanismo della riduzione, i catalizzatori sono state sottoposti a prove che ne determinassero la capacità di accumulo complessiva di NOx e la rigenerabilità, verificato le specie prodotte.
Infine, si è migliorata la comprensione del ruolo svolto dalla concentrazione dell’agente riducente e dell’effetto della durata della fase riducente.
Le differenti prove catalitiche e le differenti alimentazioni hanno permesso di ipotizzare il meccanismo della reazione di riduzione, mediante l’analisi dei fattori coinvolti e dei prodotti ottenuti.
2 INTRODUZIONE
2.1 L’ATMOSFERA
La parola atmosfera (dal greco ατμός "vapore" e σφαίρα "sfera") designa l’involucro gassoso che avvolge un pianeta o in generale un corpo celeste. La Terra ha una atmosfera complessa e divisa in più strati, che in ordine di altezza sono: Troposfera, Stratosfera, Mesosfera, Termosfera, Esosfera (Fig. 2.1). Il 99% dell’atmosfera terrestre si trova entro i primi 30 Km dalla superficie, ci protegge dalle radiazioni ultraviolette, dall’impatto delle particelle ad alta energia provenienti dallo spazio e da escursioni termiche che potrebbero rendere impossibile qualsiasi condizione ambientale.
L’atmosfera si compone di un mix di gas presenti con diverse concentrazioni: si hanno gas classificati come permanenti, in quanto la loro concentrazione non ha esibito significative variazioni da quando sono disponibili dati sperimentali, ed i gas classificati come variabili che, al contrario, partecipando ad una vasta serie di reazioni chimiche con altri gas e particelle presenti in atmosfera, esibiscono variazioni sensibili su archi di tempo molto brevi.
Alla prima categoria appartengono l’azoto, l’ossigeno, l’argon e l’anidride carbonica; alla seconda appartengono invece l’ozono (0-0,07 ppm in prossimità della superficie terrestre), il vapore acqueo (1-3 ppm fra 20 e 30 km), il biossido di zolfo e il biossido di azoto. Molti dei fenomeni che avvengono nell’atmosfera terrestre possono essere classificati per tipologia e quota, esistono inoltre forti correlazioni fra proprietà chimico-fisiche dei fenomeni e l’altitudine. Per questo motivo è possibile tracciare una naturale stratificazione dell’atmosfera dove ciascuno strato rappresenta un’ipotetica sfera che circonda il globo terrestre caratterizzata da composizione, caratteristiche termiche e termodinamiche, tipologie di interazione con la radiazione solare mediamente omogenee. Con riferimento alla fig. 2.1 è indicata la successione di tali strati: troposfera (fino a 10 km circa) tropopausa (da 10 a 15 km), stratosfera (fino a 50 km), stratopausa (attorno ai 50 Km), mesosfera (fino ad 80 km), ionosfera (fino a 300 km), termosfera (fino a 500 Km).
La troposfera è lo strato dell’atmosfera terrestre a diretto contatto con il pianeta ed è lo strato in cui si verificano quasi tutti i fenomeni meteorologici (le turbolenze possono estendersi fino alla porzione inferiore della stratosfera) ospitando l’80% della massa d’aria ed il 99% del vapore acqueo contenuto nell’atmosfera terrestre. L’altezza della troposfera è variabile e va da un minimo di circa 8 chilometri in corrispondenza dei poli ad un massimo di circa 18 chilometri in corrispondenza dell’equatore. L’aria della troposfera è riscaldata dalla superficie terrestre ed ha una temperatura media globale di 15°C al livello del mare, che diminuisce con l’altitudine (0,65°C ogni 100 m di quota) fino ai circa -60°C della tropopausa. L’altezza varia anche stagionalmente essendo maggiore nei mesi estivi e minore in quelli invernali.
Fig. 2.1 Atmosfera: variazione con l’altitudine della densità, temperatura,
La concentrazione di vapore acqueo oltre che diminuire con l’aumentare della quota varia anche con la latitudine e sarà massima all’equatore, dove può superare il 3%, e diminuisce andando verso le regioni polari dove sarà minima.
La tropopausa è un sottile strato a temperatura costante (circa -55°C) che separa la troposfera dalla stratosfera.
La stratosfera si estende, partendo da una quota base variabile in base alla latitudine, a circa 50 chilometri di altitudine. La stratosfera è una sorta di barriera alla penetrazione dei moti verticali della troposfera anche se alcuni rimescolamenti sono possibili in certe regioni delle medie latitudini nei mesi primaverili ed invernali. Questi scambi modificano la posizione dei Jet Stream, le correnti in cui le velocità superano i 100 nodi (185 Km/h).
Nella stratosfera la temperatura dell’aria rimane relativamente costante fino ad un’altitudine di 25 chilometri, quindi aumenta gradualmente fino a raggiungere il valore di circa 0°C. La regolazione termica della stratosfera, visto che il vapore acqueo presente è scarso, è gestita da uno strato di ozono localizzato ad un’altitudine compresa fra i 20 ed i 30 chilometri. Le molecole di ozono assorbono le radiazioni ultraviolette, aventi una lunghezza d’onda compresa fra 290 nm e 320 nm e dannose per la vita perché possono essere assorbite dagli acidi nucleici nelle cellule, convertendole in energia cinetica che provoca il riscaldamento della stratosfera.
Approssimativamente è stato stimato che il 90% dell’ozono presente in atmosfera si trova nella stratosfera.
La mesosfera si estende approssimativamente dai 50 ai circa 80 chilometri di altitudine ed è caratterizzata dalla graduale diminuzione della temperatura che raggiunge il suo minimo (-83°C) all’altitudine di 80 chilometri, grazie alle trascurabili concentrazioni di ozono e di vapore acqueo. Con l’aumentare della distanza dalla superficie della Terra la composizione chimica dell’aria diventa fortemente dipendente dall’altitudine e l’atmosfera si arricchisce di gas leggeri (He e H2). A grandi altitudini i gas residui cominciano a stratificarsi in base alla loro massa molecolare sotto l’azione della forza gravitazionale. In questo strato hanno origine le stelle cadenti, cioè i piccoli meteoriti che di solito non riescono a raggiungere la superficie terrestre perché bruciano prima di raggiungere la Terra, lasciando scie luminose. Oltre la mesopausa, alla quota di circa 100 Km, l’aria è
tanto rarefatta da non opporre una resistenza tangibile al moto dei corpi e diventa possibile il moto orbitale. Per questo motivo, in astronautica la mesopausa viene considerata il confine con lo spazio essendo uno strato di transizione fra la mesosfera e la termosfera.
La termosfera si estende approssimativamente dagli 80 chilometri ed è caratterizzata da un graduale aumento della temperatura, che raggiunge i 1200°C, dovuto all’assorbimento della intensa radiazione solare da parte delle molecole di ossigeno che assieme all’azoto, ad un’altitudine di 100-200 Km, è ancora il principale componente. La composizione chimica ha una predominanza di azoto e ossigeno, ma cambia sempre più con l’altitudine: a circa 550 Km di quota, questi due gas cessano di essere i componenti principali dell’atmosfera, e vengono spodestati da elio e idrogeno.
La termosfera assieme alla porzione più esterna della mesosfera costituisce la ionosfera, una zona in cui i gas sono allo stato di ioni (particelle con carica elettrica per aver perso o acquistato elettroni). Queste particelle ionizzate sono molto importanti per le telecomunicazioni in quanto hanno la capacità di riflettere al suolo le onde radio provenienti dalla Terra in una direzione diversa da quella di provenienza. La termosfera è anche sede del fenomeno delle aurore polari.
L’esosfera è la regione più distante dalla superficie della Terra e la zona di transizione tra l’atmosfera terrestre e lo spazio interplanetario. La termosfera e l’esosfera insieme costituiscono l’alta atmosfera che contiene anche la magnetosfera che sul lato illuminato della Terra raggiunge un’altezza di circa 64.000 Km. La magnetosfera contiene le fasce di Van Allen che si interrompono in corrispondenza delle zone polari. La magnetosfera intercetta e devia le radiazioni ionizzanti altrimenti dannose per gli esseri viventi. La temperatura media dell’esosfera è di circa 700°C anche se l’escursione termica fra il periodo in cui si ha il minimo irraggiamento solare (circa 300°C) e quello in cui si ha il maggior irraggiamento solare (circa 1700°C) è molto alta.
La parola Troposfera deriva dal greco "Tropos" che significa variazione, proprio perché all’interno di questa sfera troviamo i maggiori valori di pressione e densità. La troposfera è il luogo della vita sia per la flora sia per la fauna che ne utilizzano alcuni dei gas per vivere.
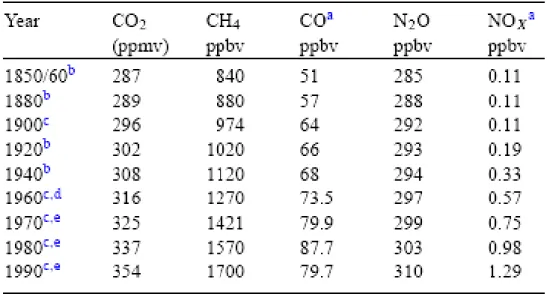
Componenti Concentrazione (% volume) Massa (t * 109) Componenti Concentrazione (% volume) Massa (t * 109) N2 78,1 3.920.000 H2 5 x 10-5 0,19 O2 20,9 1.200.000 N2O 2,8 x 10-5 1,95 Ar 0,934 73.000 CO 1 x 10-5 0,5 CO2 0,0330 2.300 Xe 9 x10-6 Ne 0,00182 65 O3 4 x 10-6 0,2 He 5,2 x 10-4 3,8 NO2 2 x 10-6 0,018 CH4 1,6 x 10-4 3,7 NH3 6 x 10-7 Kr 1,1 x 10-4 15,2 SO2 2 x 10-7 0,060
Tab. 2.1 Composizione dell’aria secca nella Troposfera.
Ogni variazione delle concentrazioni riportate in Tab. 2.1 prende il nome di
contaminazione; nel linguaggio comune però questa parola è stata sostituita con
il termine inquinamento che riguarda sia una aggiunta di sostanze estranee all’elenco sopra riportato sia la presenza o una combinazione di contaminanti in quantità e/o con persistenza tali che possono causare, direttamente o indirettamente, un effetto nocivo misurabile agli esseri umani, agli animali e alle piante o interferire con il godimento della vita e dei beni. Anche in questa tesi per semplicità si parlerà di inquinanti.
Uno dei principali componenti è il vapore acqueo, che attraverso i processi di cambiamento (condensazione ed evaporazione) rilascia grandi quantità di energia che sono la sorgente primaria di alcuni processi atmosferici (ad esempio gli uragani). Il vapore acqueo inoltre è un gas serra in grado di trattenere la radiazione infrarossa emessa dalla Terra.
L’anidride carbonica (CO2), nonostante sia presente in piccole quantità, ha due funzioni importanti la prima delle quali è la fotosintesi clorofilliana delle piante che la utilizzano assieme all’acqua per ricavarne energia e ossigeno. La seconda è legata all’effetto serra che rende vivibile il nostro pianeta riflettendo parte dell’irraggiamento solare e trattenendo parte del calore che altrimenti sarebbe ceduto dalla crosta terrestre nel libero spazio. Se così non fosse infatti le temperature durante la notte sarebbero di molti gradi sotto lo zero (anche -20°C) e di giorno sarebbero al contrario molto alte.
2.2 INQUINAMENTO ATMOSFERICO
La storia dell’inquinamento dell’aria e dei suoi effetti biologici ha origini antiche, tanto che anche le civiltà del passato si sono rese colpevoli di alterazioni ecologiche. Nell’antica Grecia sono diversi gli episodi che testimoniano lo scarso rispetto dell’uomo nei confronti dell’ambiente circostante. Ad Atene, una parte degli scarichi fognari era condotta fuori città attraverso dei canali, mentre il resto delle case che non era collegata alla rete fognaria scaricava per le strade.
Vi erano anche canali a cielo aperto e talvolta gli stessi ruscelli erano utilizzati come scarichi naturali. Tutto ciò procurava seri problemi di inquinamento ambientale: ancora fino al VI secolo a.C. gli Ateniesi potevano infatti bere l'acqua del fiume Eridano, che in seguito divenne però molto inquinato. Nella “Costituzione degli ateniesi” Aristotele, ad esempio, fissa i doveri di dieci sorveglianti della città incaricati di verificare il lavoro degli spazzini, per impedire loro di gettare le immondizie a non meno di 2 Km dalla città, dove altrimenti queste avrebbero finito per inquinare i pozzi necessaria ad una città di 250mila abitanti.
L’aria di Roma invece era pesante; nel 61 d.C. Seneca si esprime in termini di “gravitas urbis”, il fetore, la fuliggine, la pesantezza dell’aria e la presenza di vapori pestiferi, che rendevano faticosa la respirazione e imbrattavano le candide tuniche, ed Orazio descrive lo sgradevole “fumus” che incombeva sulla città sotto forma di spessa cappa. Le attività domestiche erano le fonti principali di contaminazione, ma anche i processi di estrazione dei minerali causarono deturpazioni ambientali notevoli, come nel caso dell’Isola d’Elba.
In Gran Bretagna gli effetti funesti del carbone erano noti fin dal 1200, tanto che il re Edoardo I nominò con l’incarico di migliorare la qualità dell’aria della città una commissione che bandì l’utilizzo del carbone in quanto “pregiudizievole alla salute” (1285). Addirittura intorno al 1310, il problema ambientale (inquinamento da fumi e scarico di detriti durante la costruzione di un mulino ad acqua) venne usato dal re Edoardo II come pretesto di persecuzione politica dei cavalieri Templari.
A Londra nel XIII-XIV secolo erano state promulgate disposizioni tendenti a garantire la qualità dell’aria e alla fine del 1600 si parlava di fumo che “uccide le
api ed i fiori, impedendo a nulla di sbocciare”.
Oggi, in Italia l’art. 2 del D.P.R. n. 203 (24/05/1988) per “inquinamento atmosferico” intende: “ogni modificazione della normale composizione o stato fisico dell’aria atmosferica, dovuta alla presenza nella stessa di una o più sostanze in quantità e con caratteristiche tali da alterare le normali condizioni ambientali e di salubrità dell’aria; da costituire pericolo ovvero pregiudizio diretto o indiretto per la salute dell’uomo; da compromettere le attività ricreative e gli altri usi legittimi dell’ ambiente; alterare le risorse biologiche e gli ecosistemi ed i beni materiali pubblici e privati”; si tratta, quindi, di un fattore ben definito dalla legislazione.
I processi naturali possono provocare, soprattutto in scala locale, imponenti immissioni di sostanze in grado di alterare la normale composizione dell’aria: ad esempio le eruzioni vulcaniche, l’attività biologica del terreno, aerosol di origine marina, pollini. Fortunatamente, di norma, essi sono ben distribuiti nel tempo e nello spazio, andando a interessare aree vaste; pertanto, la diluizione che subiscono è tale che raramente costituiscono un problema per l’ambiente.
Gli effetti di cui ci si preoccupa sono ovviamente le modificazioni dell’atmosfera indotte dalle attività umane, che i normali fenomeni naturali di auto-depurazione non riescono a neutralizzare e che possono modificare il clima o l’atmosfera. Ogni attività umana, infatti, rilascia sostanze chimiche che prima o poi confluiscono nella grande discarica che è la biosfera (Fig. 2.2) dove subiscono ulteriori trasformazioni. Dalla microscala individuale (delle piccole attività quotidiane) alla grande scala (della produzione industriale) tutti gli inquinanti contribuiscono a modificare l’ambiente, a condizione che la sostanza sia presente o in concentrazione sufficientemente alta o, se in bassa concentrazione, per un periodo sufficientemente lungo nel tempo.
In figura 2.3 [3] è rappresentata una distribuzione spazio/tempo delle sostanze inquinanti; la maggior parte di queste si riscontrano nella scala locale mentre le specie moderatamente longeve contribuiscono ad inquinamento atmosferico urbano/regionale.
Fig. 2.2 Processi ed attività che contribuiscono a modificare l’ecosistema.
Le specie ancora più longeve contribuiscono a variazioni globali (effetto serra, piogge acide, distruzione dello strato di ozono, ecc.). Una scala spazio/tempo può essere così sintetizzata:
• MICROSCALA < 1 km, secondi/minuti con alterazioni acute della qualità dell’aria (traffico),
• PICCOLA SCALA < 10 km, ore con alterazioni acute della qualità dell’aria date dagli inquinanti primari (sorgenti puntiformi, aree urbane ed industriali), • MESOSCALA 10-100 km, ore-giorni con produzione inquinanti secondari in
atmosfera (Ozono troposferico),
• MACROSCALA > 100 km con precipitazioni acide, inquinamento transfrontaliero (trasporto e diffusione non omogenei),
• SCALA GLOBALE che porta ad effetto serra, assottigliamento strato di ozono stratosferico (alterazioni globali composizione atmosfera),
Fig. 2.3 Vita media dell’inquinante in una scala spazio/tempo [3].
2.2.1LO SMOG
La parola smog nel linguaggio comune viene utilizzata per indicare la quasi totalità dei fenomeni di inquinamento atmosferico o, almeno, quelli di tipo urbano (Fig. 2.4). In realtà, questa forma di contaminazione presenta caratteristiche ben precise, anche se molto variabili, ed è diffusa in moltissime aree. Il termine fu coniato a Londra nel 1905 per descrivere una combinazione di fumo (smoke) e nebbia (fog). Lo smog chimicamente è costituito da complesse miscele di decine di composti, organici e non, che cambiano a seconda della zona geografica ed economica in cui ci troviamo. Lo smog risulta presente in moltissime metropoli e città costituisce un’emergenza ambientale specialmente nelle stagioni calde e quando l’aria è stagnante.
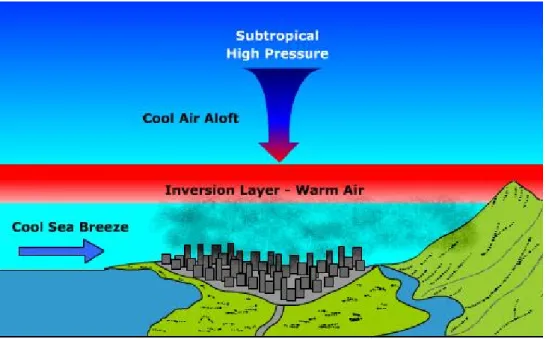
Il ristagno è favorito dall’inversione termica (Fig. 2.5): la temperatura dell’aria al di sopra del suolo, in condizioni normali, diminuisce con l’altitudine il calo è pari:
• a circa 6°C/Km, se l’aria è satura di umidità, • a circa 10°C/Km, se secca,
Fig. 2.4 Los Angeles con lo smog (in alto), ed in un giorno pulito (in basso).
Fig. 2.5 Rappresentazione dell’inversione termica per una città come Los
Il fenomeno interessa l’atmosfera fino all’altezza di circa 10 Km e deriva dal fatto che il livello più prossimo alla superficie terrestre viene riscaldato dal suolo, si espande e diviene meno denso di quello sovrastante. L’aria calda sale, quindi, attraverso quella fredda, che scende a rimpiazzarla; a sua volta, questa si riscalda e tende a risalire, e così via. Si creano, in questo modo, condizioni di instabilità e gli inquinanti vengono facilmente dispersi.
Talvolta, però, questo normale andamento viene turbato quando, per esempio, uno spessore di aria fredda fluisce a bassa quota e spinge quella più calda a spostarsi a maggiore altitudine. Se ciò si verifica, la sua temperatura decresce dal suolo sino a una certa altitudine, ma oltre questa quota si trovano strati più caldi (cioè di inversione) che costituiscono una sorta di “coperchio” per i sottostanti. In questo modo, i contaminanti immessi nell’atmosfera sono intrappolati nelle quote più basse, non in movimento, e tale situazione può restare stazionaria a lungo, fino a quando, cioè, le condizioni meteorologiche non mutano e lo strato di inversione si rompe.
Un ulteriore aspetto è l’aumentata attività fotochimica, in quanto la luce solare facilita reazioni tra i composti intrappolati, in particolare gli idrocarburi e gli NOx. Da esse si originano gli inquinanti secondari, alcuni dei quali altamente tossici.
Si parla allora di smog fotochimico o fotosmog, segnalato per la prima volta nel 1944 nell’area di Los Angeles, e particolarmente evidente nei mesi estivi e durante le ore più calde.
Per comprendere le cause, o pressioni, che determinano una certa situazione ambientale i livelli di qualità, i punti di forza e di debolezza dell’ambiente locale e le soluzioni, o risposte, messe in pratica per il miglioramento della situazione ambientale. viene utilizzato, come modello organizzativo degli elementi fondamentali per l’integrazione delle conoscenze in materia ambientale, lo schema organico denominato “DPSIR” [4]:
• Driving forces, cioè l’origine e le cause generatrici primarie di inquinanti; • Pressures, come ad esempio le emissioni, gli scarti, i reflui immessi
nell’ambiente;
• Impacts, impatti sulla salute e sul benessere che vengono generati da queste alterazioni su bersagli quali ecosistemi e salute;
• Responses, a indicare le risposte politiche, amministrative, tecnologiche che possono agire sui determinanti, sulle pressioni (limiti emissivi, tecnologie pulite), sullo stato (bonifiche).
Uno schema DPSIR (Fig. 2.6), applicato all’inquinamento, dell’aria si basa su una serie di relazioni causali che raccordano i vari elementi, particolarmente utile per capire gli effetti prodotti dagli interventi, per valutare la necessità/opportunità di pianificare nuove misure, per stabilire priorità di attuazione di provvedimenti concorrenti [4].
Fig. 2.6 Schema del modello DPSIR sulla qualità dell’aria [4].
Poiché gli esseri umani stanno contaminando da millenni l’aria, non è facile individuarne la composizione “normale”. I dati più accettati sono riportati in Tabella 2.l. in essa prevalgono alcune specie chimiche (gas permanenti), la cui concentrazione non cambia apprezzabilmente nel tempo, quali N2, O2 e i gas nobili. Altre molecole, seppur presenti in misura estremamente ridotta, possono influenzare notevolmente la qualità della vita sul pianeta.
Diverse sono le possibili classificazioni degli inquinanti atmosferici. In primo luogo, essi si possono trovare nell’atmosfera sia sotto forma gassosa, liquida
ultimi sono, di solito, di minore importanza, anche se talvolta possono costituire serio pericolo in determinati ambienti (per esempio, polvere di cemento o particelle fuligginose acide nelle vicinanze della fonte). Viceversa, alcuni gas sono di interesse pressoché universale, facilmente rinvenibili in ogni zona industriale e metropolitana e quest’ultimi saranno trattati con maggiore dettaglio.
Una particolare specie di inquinanti sono i Composti Organici Volatili (VOC) tutte le sostanze organiche che, esposte all’aria, passano allo stato gassoso: VOC sono l’acetone, l’alcool etilico o metilico, il benzene, ecc. Tra i VOC vengono escluse anche tutte le sostanze organiche gassose a temperatura ambiente. Tali sostanze sono per lo più combustibili o solventi.
Le emissioni preponderanti derivano da perdite per evaporazione di solventi, di combustibili dagli autoveicoli e dai depositi durante le operazioni di rifornimento o di travaso dai serbatoi, di prodotti della decomposizione anaerobica di rifiuti interrati e da gas delle reti di distribuzione.
Tra le fonti di VOC si deve sottolineare anche l’apporto dato dalle foreste, dove viene emessa una grande quantità di isoprene.
AEREOSOL DESCRIZIONE
Polveri
Particelle solide che conservano le caratteristiche chimiche del materiale di partenza da cui si sono formate per
frantumazione.(Diametro ≈ 100 μm)
Particolato
Particelle (solide e/o liquide) che restano sospese in atmosfera per tempi più o meno lunghi. Queste particelle possono essere costituite da diverse sostanze: sabbia, cenere, polvere, fuliggine, sostanze silicee di varia natura, sostanze vegetali, composti metallici, fibre tessili naturali e artificiali, sali, elementi come il carbonio o metalli (Pb, Fe, ecc.). (Diametro ≈ 10 μm o 2.5 μm)
Esalazioni
Particelle solide formatesi per condensazione di vapori prodottesi ad elevate temperature (combustioni incomplete). Possono avere composizione chimica identica ai prodotti di partenza o alle loro forme ossidate (ossidi metallici). Fumo Particelle solide e liquide di diametro < 0,5 μm, originatesi
dalla combustione di sostanze organiche
Nebbia Aereosol liquido prodottosi per condensazione ad alta umidità dimensioni > 1 μm
Smog Aereosol misto di Nebbia e Fumo
Tab. 2.2 Forme in cui si possono trovare gli inquinanti [5,6].
Una classificazione degli inquinanti è invece riportata nella tabella 2.3 e prevede la divisione in:
• Inquinanti primari, che vengono direttamente immessi nell’atmosfera sia a causa dell’attività umana che da processi naturali e manifestano la loro tossicità nella forma e nello stato in cui sono liberati a seguito di uno specifico processo chimico.
• Inquinanti secondari che si formano per reazione chimica o fisica degli inquinanti primari con l’atmosfera o nell’atmosfera, attivati o meno dall’energia solare e/o sotto influenza di catalizzatori chimici o fisici; essi
alcuni siano responsabili di rilevanti effetti tossici. Alcune di tali sostanze sono di scoperta relativamente recente (ultimo dopoguerra) e si ritrovano, in particolare, tra i costituenti dello smog fotochimico (O3, P.A.N., ecc.).
CLASSE INQUINANTI PRIMARI
INQUINANTI SECONDARI
Composti contenenti zolfo SO2, H2S SO3, H2SO4, Solfati
Composti contenenti azoto NO, NH3 NO2, Nitrati
Composti organici Idrocarburi (C1-C5) Chetoni, Aldeidi, Acidi
Ossidi di carbonio CO ---
Alogeni HF, HCl, HBr, CFC ---
Tab. 2.3 Classificazione generale degli inquinanti dell’aria [5,6].
Le principali reazioni chimiche che contribuiscono a formare gli inquinanti secondari sono le ossidazioni, soprattutto dei composti di C, N, S. Altre reazioni altrettanto importanti sono quelle fotochimiche, dove l’energia necessaria per lo svolgersi della reazione chimica è fornita dai fotoni emessi dal sole ed assorbiti dai reagenti, che producono i radicali liberi per fotodissociazione (Fig. 2.7). La catena delle reazioni e gli inquinanti che vi partecipano sono poco noti, ma si conoscono alcuni precursori (NOx e VOC) e si considera l’O3 come il principale tracciante.
Fig. 2.7 Principali reazioni dagli inquinanti primari ai secondari [5,6].
I primi casi di smog fotochimico vennero segnalati negli anni ‘40 a Los Angeles, ma negli ultimi anni il fenomeno si è ampiamente diffuso ed ha destato preoccupazione in tutto il mondo. Infatti, ormai da molto tempo, sono le zone cittadine a costituire i principali elementi di preoccupazione e di rischio per la qualità dell’aria. L’andamento è poco incoraggiante, se si pensa che nel mondo ormai il 50% della popolazione vive in ambienti con caratteristiche urbane, che sono pari a non più del 5% della superficie terrestre (di converso, su oltre metà delle terre emerse si trova solo il 5% della popolazione mondiale); la Banca Mondiale stima che entro il 2025 sarà raggiunto il 66%.
2.2.2INQUINANTI PRIMARI DELLA COMBUSTIONE
Tra le attività umane più rilevanti nella produzione di inquinanti c’è l’utilizzo di combustibili. Un combustibile di qualsiasi natura (carbone, olio combustibile, gas naturale, legno, ecc.) è costituito principalmente di carbonio e di idrogeno, la cui combustione completa stechiometrica produce principalmente CO2 e H2O secondo la reazione:
CxHy + (x+1/4 y) O2 → xCO2 + ½y H2O Oltre a questi composti se ne producono altri dovuti a:
9 Combustione incompleta (CO, particelle organiche incombuste Cn, particolato)
9 Impurezze o additivi dei combustibili (SO2, SO3, Pb, Benzene, ceneri)
9 Processi di ossidazione dell’azoto atmosferico a ossidi di azoto (NOx) durante le combustioni a temperatura elevata.
Il riscaldamento domestico rappresenta una sorgente importante ed a seconda del combustibile utilizzato possono cambiare le emissioni (dalla combustione del carbone si possono sprigionare oltre 100 prodotti organici) e quindi la loro distribuzione in ambito urbano. Un’altra caratteristica negativa di questa forma di contaminazione è quella di coincidere con la stagione più fredda, quando si hanno più frequentemente situazioni meteorologiche favorevoli all’accumulo di sostanze aero-diffuse (inversione termica, formazione di nebbie).
Oggi, è il traffico veicolare a determinare i più gravi fenomeni di degrado della qualità ambientale non solo limitatamente ai grandi centri urbani, anche se proprio nelle aree metropolitane ha la sua massima incidenza. La rete stradale nazionale si estende per oltre 800mila km e sono quasi 34 milioni le autovetture circolanti, pari a 59 ogni 100 abitanti (erano 14 solo 50 anni fa), con punte di 70 nelle grandi città. In Europa, nel 1970, ogni cittadino percorreva in auto in media 17 km al giorno; attualmente, il dato ammonta a 35. I principali componenti dei gas di scarico che preoccupano sono: CO, NOx, idrocarburi incombusti, composti organici volatili (tra i quali spiccano le aldeidi) ed il particolato. Non si possono, poi, tralasciare altre fonti, come le centrali termoelettriche (che in Italia
garantiscono il 64% della produzione energetica totale e rappresentano importanti sorgenti di SOx) e gli inceneritori di rifiuti solidi urbani, il cui impatto ambientale è quanto mai complesso, in relazione all’elevatissimo numero di composti che possono emettere (oltre 200, soltanto tra quelli organici).
Monossido di Carbonio
Il monossido di carbonio costituisce la più importante emissione di inquinanti atmosferici (dopo la CO2). La fonte principale sono i motori a scoppio, in cui può rappresentare una quantità importante nel gas di scarico. Il livello medio del CO in una atmosfera non inquinata si aggira su 0,1-0,2 ppm. Mentre in una grande città, a livello del suolo si aggira sui 20 ppm e in ora di punta è sui 100 ppm all’aperto e sui 295 ppm in un tunnel [7].
Il CO è particolarmente insidioso perché è privo di odore, colore e sapore e quindi la sua presenza non viene percepita. Inoltre i sintomi precoci dell’intossicazione - mal di testa, nausea e vomito, debolezza - sono molto generici e si possono facilmente confondere con quelli di altre patologie. La tossicità del gas (TWA 50 ppm) è dovuta al suo legame con l’emoglobina che dà luogo alla formazione di carbossiemoglobina (HbCO). L’affinità dell’emoglobina per il CO è circa 240 volte superiore a quella dell’emoglobina per l’ossigeno. Questo legame limita la capacità di trasporto e di rilascio di ossigeno ai tessuti provocando, quando si superano determinati livelli di HbCO, un quadro di ipo/anossia tessutale. A causa della stabilità del legame con l’emoglobina il CO ha dei tempi di eliminazione ematica piuttosto lunghi che variano in funzione della dose, del tempo, delle modalità di esposizione e delle caratteristiche individuali. In ossigeno al 21% (aria atmosferica) la concentrazione di CO si dimezza in 320-330 minuti, mediante somministrazione di ossigeno al 100% occorrono 40-80 minuti per dimezzarne la concentrazione ematica. L’ossigeno terapia in camera iperbarica (3 atm.) permette di ridurre a metà la quantità di CO nel sangue in un tempo inferiore ai 25 minuti.
Particolato
Il particolato è presente in ambiente incontaminato, seppure in concentrazioni modeste, innocue per gli organismi viventi. Nelle zone urbanizzate invece le concentrazioni aumentano considerevolmente, specie per quanto riguarda il PM10 (particelle microscopiche, il cui diametro è uguale o inferiore a 10 µm); cambia la
“forma” e la composizione delle singole particelle, le quali sono ricche di composti organici carboniosi, residui di combustione altamente tossici e cancerogeni. È un inquinante a grande impatto in quanto va ad influenzare il clima, la vegetazione, ha effetti degradativi su materiali e soprattutto effetti nocivi sulla salute umana. Il particolato agisce sulla biosfera provocando una diminuzione della visibilità atmosferica; allo stesso tempo diminuisce anche la luminosità assorbendo o riflettendo la luce solare. Negli ultimi anni si è notata una diminuzione della visibilità del 50%, ed il fenomeno risulta tanto più evidente quanto più ci si avvicina alle grandi aree abitative ed industriali. I PM10 hanno destato molto interesse da parte delle autorità mediche e scientifiche negli ultimi tempi, infatti l’OMS, sulla base di uno studio condotto nel 2000 in 8 città del mondo, stima che le polveri sottili siano responsabili dello 0,5% dei decessi registrati nell'anno. I valori limite sono definiti in Italia dal decreto-legge nr. 60 del 2 aprile 2002; tale decreto fissa due limiti accettabile di PM10 in atmosfera:
y Il primo è un valore limite di 50 µg/m³ come valore medio misurato nell'arco di 24 ore da non superare più di 35 volte/anno.
y Il secondo come valore limite di 40 µg/m³ come media annuale.
Nel processo della respirazione le particelle maggiori di 15 micron vengono generalmente rimosse già dal naso (Fig 2.8). Il particolato che si deposita nel tratto superiore dell’apparato respiratorio (cavità nasali, faringe e laringe) può generare vari effetti irritativi come l’infiammazione e la secchezza del naso e della gola; tutti questi fenomeni sono molto più gravi se le particelle hanno assorbito sostanze acide (come SOx, NOx, ecc.).
Per la struttura e a causa della loro elevata area superficiale, queste possono adsorbire ed assorbire dall’aria sostanze chimiche (anche cancerogene); trascinandole nei tratti respiratori e prolungandone i tempi di residenza ne accentuano gli effetti.
Si stanno però accumulando prove di un’importanza ancora maggiore della pericolosità delle particelle di diametro inferiore o pari a 2,5 µm (PM 2,5), che essendo più piccole penetrano nel sistema respiratorio a varie profondità e possono trascorrere lunghi periodi di tempo prima che vengano rimosse. Per questo sono le più pericolose, in quanto possono raggiungere gli alveoli e quindi
le interazioni sangue aria. Queste polveri aggravano le malattie respiratorie croniche come l’asma, la bronchite e l’enfisema.
Fig. 2.8 Livelli di deposizione polmonare a seconda del diametro delle
particelle.
Infine i PM2.5 provocano un maggior rischio di essere oggetto di malattie cardio-respiratorie. In particolare è stato messo in evidenza un aumento dell’1,28 per cento del numero di attacchi cardiaci per ogni 10 µg per metro cubo di PM 2,5.
Ossidi di Zolfo
Le emissioni di ossidi di zolfo (principalmente SO2) sono dovute all’uso di combustibili ad alto tenore di zolfo (diesel, olii pesanti) e quindi caratteristici di zone industriali e aree urbane dove l’elevata densità degli insediamenti ne favorisce l’accumulo.
Nella troposfera la concentrazione media di SO2 è di 0,1 ppb [8] mentre in ambito urbano la concentrazione è mediamente 20/40 volte più elevata. Fortunatamente si è assistito a un costante declino dei livelli di SO2 (grazie alla conversione degli impianti di riscaldamento domestico, ormai alimentati quasi esclusivamente a metano). A Londra, la concentrazione media annuale di SO2 è
Il biossido di zolfo è considerato il più pericoloso degli inquinanti atmosferici, a causa dell’ipersensibilità ad esso mostrata da alcune fasce di popolazione, come gli anziani o le persone soggette a malattie croniche dell’apparato respiratorio - cardiovascolare.
L’SO2 già a basse concentrazioni è una sostanza irritante per gli occhi, per la gola e per il tratto superiore delle vie respiratorie; a concentrazioni elevate può dar luogo a irritazioni delle mucose nasali, bronchiti e malattie polmonari; dall’apparato respiratorio entra quindi nel sangue per venire poi eliminato attraverso l’urina. L’esposizione prolungata a concentrazioni di alcuni mg/m3 di SO2 possono comportare incremento di faringiti, irritazione e resistenza al passaggio dell’aria, soprattutto in quelle persone che soffrono di insufficienza respiratoria da asma.
I suoi effetti risultano amplificati in presenza di nebbia, in quanto esso è facilmente solubile nelle piccole gocce d’acqua formando H2SO4. Le gocce più piccole possono arrivare fino in profondità nell’apparato polmonare causando bronco - costrizione, irritazione bronchiale e bronchite acuta.
Ossidi di Azoto
In termini di inquinamento atmosferico gli ossidi di azoto (NOx) che destano maggiore preoccupazione sono il monossido di azoto (NO) e il biossido di azoto (NO2).
Gli ossidi di azoto emessi in atmosfera possono avere origine sia naturale che antropica: i primi derivano dai processi di nitrificazione e denitrificazione, i secondi dalle combustioni.
Elevate emissioni di NOx derivano dalla combustione di combustibili fossili effettuata per produrre energia elettrica e per riscaldare gli ambienti commerciali e domestici. Altre fonti di emissione di NOx risultano essere le attività di raffineria del petrolio, della siderurgia, della produzione del coke, della chimica e petrolchimica e altre industrie coinvolte nei settori meccanico, agroalimentare e tessile. In ambiente urbano la maggior parte delle emissioni di NOx deriva dal traffico autoveicolare.
Gli ossidi di azoto, una volta emessi in atmosfera, hanno un tempo medio di persistenza di circa 4-5 giorni; in aree altamente inquinate essi raggiungono concentrazioni di alcune decine di ppb, anche se si possono rilevare punte
dell’ordine di 1 ppm. Costituendo una fonte primaria per la formazione dello smog fotochimico ed avendo una permanenza così lunga in atmosfera, gli NOx possono venire trasportati lontano dalle fonti di emissione e qui, per effetto della radiazione solare, possono dar luogo alla formazione degli ossidanti fotochimici e quindi produrre forme di inquinamento le cui origini risiedono altrove.
2.3 INQUINAMENTO DEGLI OSSIDI DI AZOTO
2.3.1CARATTERISTICHE DEGLI OSSIDI DI AZOTO
Sorgenti naturali e antropiche sono responsabili dell’emissione degli NOx nell’atmosfera. Tra le prime emerge il metabolismo microbico e in particolare la denitrificazione, attività respiratoria che utilizza nitrati come accettori terminali di elettroni con la formazione di NOx e N2. Essa è tipica di numerosi gruppi di microrganismi, tra cui funghi e batteri autotrofi ed eterotrofi, sia aerobi che anaerobi, in diversi ambienti, indipendentemente (entro certi limiti) dalla reazione del terreno. Le scariche elettriche possono, poi, operare la sintesi di NO a partire dalle molecole di O2 e di N2 presenti nell’aria.
Nonostante la produzione globale da fonti naturali sia certamente elevata (4-15 volte superiore a quella di origine antropica), finisce con il giocare un ruolo determinante la localizzazione in aree ridotte delle emissioni prodotte dall’uomo che portano ad alte concentrazioni di queste sostanze, tanto che, in ambienti fortemente inquinati, si raggiungono livelli di diverse centinaia di volte superiori a quelli che sarebbero presenti in assenza di attività umane.
Il 20% delle emissioni antropogeniche degli NOx proviene da impianti fissi, dove si forma per ossidazione dei composti azotati presenti nel combustibile e prende il nome di Fuel NOx (il tenore in N di carbone e oli minerali è all’incirca l’1%). Il restante 80% delle emissioni proviene invece dalla reazione tra O2 e N2 in presenza di una combustione quindi sia dai mezzi di trasporto (benzina, diesel, ecc.) che dagli impianti fissi (riscaldamento domestico, centrali termoelettriche, inceneritori di rifiuti, ecc.) e prende il nome di Thermal NOx. Attualmente, oltre il 70% della produzione di Thermal NOx è dovuto al sistema dei trasporti.
La reazione di formazione di thermal NOx è legata al seguente equilibrio: N2 + O2 ⇔ 2NO il cui meccanismo è stato proposto da Zeldovich [9]:
N2 + O* → NO + N* 1)
N* + O2 → NO+ O* 2)
Se si ipotizza che la concentrazione degli N* radicalici rimanga costante e il contenuto di O2 sia grande rispetto a quello di NO allora possiamo scrivere:
d[NO]/dt = 2K exp(-Ea/RT)[N2][O*]
Questa equazione mostra come la formazione di NO sia essenzialmente controllata dalla reazione 1), ma anche dalla temperatura (vedi Tab. 2.4) e dalla concentrazione dell’ossigeno atomico. Per effetto delle temperature elevate si possono generare radicali di azoto ed ossigeno che reagiscono secondo il meccanismo appena scritto. I radicali si formano con l’ausilio di molecole (M) dotate di elevate energie tali da poter rompere i legami chimici delle molecole di N2 e O2 (225 Kcal/mol e 118 Kcal/mol rispettivamente) secondo il seguente schema:
N2 + M → N• + N• + M O2 + M → O• + O• + M
Temperatura (°C) Concentrazione all’equilibrio di NO (ppm)
Tempo per formare 500 ppm di NO (sec) 27 1,1* 10 -10 - 527 0,77 - 1316 550 1370 1538 1380 162 1760 2600 1,10 1980 4150 0,117
Tab. 2.4 Dipendenza della formazione di NO dalla temperatura [10].
Dal punto di vista termodinamico l’NO è instabile [11]:
NO → ½ N2 + ½ O2 ΔG°f = - 86 Kj/mol
Le concentrazione di NO diventano significative per combustioni superiori ai 1200°C: d’altra parte NO in equilibrio in una miscela gassosa ad alta temperatura tenderà a dissociarsi nei reagenti N2 e O2 se la temperatura della miscela decresce lentamente. Ma se la temperatura della miscela è repentinamente abbassata, buona
scoppio dei motori è perfettamente adatto a espellere nell’atmosfera concentrazioni significative di NO).
Oltre all’NO e all’NO2 che costituiscono la stragrande maggioranza dei così detti NOx (90 % circa il primo e 10 % circa il secondo) in virtù, dei suoi possibili stati di ossidazione, l’azoto forma un gran numero di altri ossidi (N2O, N2O3, N2O5, NO3).
2.3.2EFFETTI DEGLI NOXSULLA SALUTE
Ogni giorno una persona respira da 15 a 20 Kg di aria, mentre ingerisce circa 2.5 Kg tra liquidi e solidi. Perciò un’alterazione nella composizione dell’aria, anche con piccole concentrazioni di sostanze nocive, può avere importanti ripercussioni sulla salute degli organismi che la utilizzano per respirare, come sulle sostanze organiche ed inorganiche che stanno a contatto con essa. Recentemente un gran numero di studi medici e biologici ha messo in evidenza l’importanza degli NOx negli organismi viventi.
Le caratteristiche più importanti di tutti gli NOx sono le seguenti [12]:
N2O: Ossido Nitroso o Protossido d’azoto. Gas incolore, non irritante, è anzi un
potente analgesico. Lunghe esposizioni possono portare a polineuropatia e mielopatia. Può altresì produrre nausea e una confusione persistente se l’esposizione è troppo rapida o eccessiva. L’effetto anestetico dell’ossido nitroso non è ben chiarito nei dettagli, ma si pensa che il gas interagisca con le membrane delle cellule nervose del cervello alterando la comunicazione intracellulare a livello delle sinapsi. L’N2O non è tossico per inalazione, benché - essendo inodore - possa provocare asfissia; il valore di TLV-TWA (Media Ponderata nel Tempo) per questo gas è 50 ppm. Le emissioni antropogeniche di N2O sono dovute principalmente agli impianti industriali per la produzione di HNO3 (0,07-0,37 Mtons N2O/anno per 52-64 Mtons di HNO3 prodotto in tutto il mondo); un’altra origine è da ricercare nei bruciatori a letto fluidizzato che operano a temperature più basse delle combustioni a fiamma.
NO: Ossido o monossido di azoto. Gas incolore, inodore, la cui tossicità è
TLV-TWA 25 ppm = 31 mg/m3, è irritante per gli occhi ed il tratto respiratorio. L’inalazione può causare edema polmonare, inoltre può avere effetti sul
sangue, causando formazione di metaemoglobina. Nei casi più gravi può portare alla morte. Nonostante questo l’NO è un importantissimo messaggero, in quanto trasmette ai globuli bianchi, presenti nel sangue, le informazioni necessarie a distruggere le cellule tumorali e i batteri; in secondo luogo trasmette ai neurotrasmettitori informazioni per dilatare i vasi sanguigni [13]. Comunque, a parte questa attività biologica, NO è un veleno per le trasformazioni enzimatiche dell’aminoacido arginina e deve quindi essere mantenuto nell’organismo a basse concentrazioni. Le concentrazioni emesse liberamente dal motore di una automobile costituiscono un reale rischio di tossicità. Studi a carattere epidemiologico hanno mostrato che le concentrazioni limite di ossidi d’azoto costituenti un rischio per persone in buona salute sono di 0.05 ppm, o superiori, per un’esposizione maggiore di 24 ore [14]. Questo valore è purtroppo spesso superato nelle città a traffico intenso durante le ore di punta o in estate l’NO può comunque legarsi all’emoglobina portando alla cianosi e addirittura alla morte. A contatto con aria e luce si ossida facilmente a NO2 (reazione fotochimica). E’ in equilibrio con la sua forma dimera N2O2.
NO2: Biossido di azoto o ipoazotite. Gas rosso-bruno ha un odore pungente, è
irritante e in grado di causare edema polmonare e infiammazione essudantiva (TLV-TWA 3 ppm = 5,6 mg/m3). Lunghe esposizioni a piccole dosi causano tosse, mal di testa e problemi gastrointestinali. Esposizioni acute all’NO2 possono essere dannose per la salute umana, agisce principalmente come sostanza ossidante che può danneggiare le membrane e le proteine cellulari. Per esposizioni acute a concentrazioni molto elevate si possono avere risposte infiammatorie delle vie aeree, anche in soggetti sani. Tuttavia, i soggetti asmatici o i pazienti con malattie polmonari croniche ostruttive sono senza dubbio più suscettibili alle basse concentrazioni. Sulla base delle evidenze attualmente disponibili, l’Organizzazione Mondiale della Sanità (OMS) ha proposto un valore guida orario di 200 µg/m3. Diversi studi, sia epidemiologici che sperimentali, hanno inoltre evidenziato che l’esposizione cronica a NO2 può essere causa di effetti respiratori cronici. Per la protezione della popolazione dagli effetti cronici, l’OMS ha proposto un valore guida
medio annuale di 40 µg/m3, adottato anche dalla Direttiva del Consiglio d’Europa 1999/30/CE del 22 Aprile 1999 che ne dispone il rispetto entro il 2010. Per esposizioni che vanno da alcuni minuti fino ad un’ora, un livello di 50-100 ppm di NO2 causa infiammazioni polmonari per un periodo di 6-8 settimane. Esposizioni a 500 ppm e oltre di NO2 portano alla morte entro 2-10 giorni. E’ in equilibrio con la forma dimera N2O4.
N2O3: Anidride nitrosa. Gas instabile che decompone facilmente dando NO e
NO2.
N2O5: Anidride nitrica. Gas instabile, che reagisce rapidamente con l’acqua per
formare HNO3.
NO3: Triossido di azoto. Si forma per reazione tra NO2 ed O3 per originare NO3 ed O2 (con paradossale miglioramento della qualità dell’aria nelle aree urbane in quanto abbassa la concentrazione di O3). Il triossido di azoto è un gas molto instabile e reagisce con NO2 formando l’anidride nitrica N2O5.
La nocività degli NOx è inoltre legata al fatto che essi concorrono a dar luogo, in presenza dell’irraggiamento solare, ad una serie di reazioni fotochimiche secondarie che portano alla formazione di vari inquinanti noti comunemente con il nome di “smog fotochimico”. Infine, gli NOx contribuiscono alla formazione di piogge acide e, favorendo l’accumulo di nitrati al suolo e nelle acque, possono provocare alterazioni degli equilibri ecologici ambientali (eutrofizzazione).
2.3.3LO SMOG FOTOCHIMICO
Esattamente con il termine smog fotochimico si intende la miscela di composti ossidanti presente nei bassi strati della troposfera, ove si forma a seguito di complessi meccanismi di reazione fotochimica che, in presenza di radiazione solare, coinvolgono quali precursori principali gli idrocarburi non metanici e gli ossidi di azoto.
Lo smog fotochimico contiene un’ampia varietà di sostanze di interesse ambientale: le principali sono costituite dall’O3, dal NO2 e da alcuni composti organici reattivi, tutti inquinanti in grado di determinare effetti nocivi sulla salute e sugli ecosistemi e di indurre danni ai materiali da costruzione.
I meccanismi di interazione dei composti nella troposfera responsabili della formazione dello smog fotochimico sono di notevole complessità e, come tali, danno luogo ad un’ampia varietà di potenziali effetti sull’ambiente, tabella 2.5. Gli NOx, insieme agli SOx, sono i principali responsabili dell’acidificazione delle precipitazioni, oltre che risultare particolarmente nocivi per la vegetazione; i composti organici volatili e gli ossidi di azoto agiscono, altresì, come precursori nella formazione e distruzione di O3, mentre i metalli pesanti e i microinquinanti determinano fenomeni di bioaccumulo di sostanze nocive. Agli effetti localizzati nelle immediate vicinanze delle emissioni primarie si vengono, inoltre, a sovrapporre quelli nelle zone non direttamente interessate dalle fonti, a seguito del trasporto atmosferico degli inquinanti su media e larga scala e delle trasformazioni fotochimiche durante il percorso delle masse d’aria.
Impatto Ambientale Causa
Acidificazione SOx; NOx
Eutrofizzazione NOx; NH3
Produzione di O3 NOx; VOC
Bioaccumulo di sostanze Metalli pesanti; Inquinanti organici
Tab. 2.5 Responsabili della formazione dello smog fotochimico.
La formazione dello smog fotochimico è complessa in quanto la sua composizione varia nello spazio e nel tempo in relazione alle concentrazioni dei precursori presenti nelle masse d’aria che sono soggette al continuo movimento sotto l’effetto dei venti.
Le reazioni che portano a formazione di smog fotochimico sono lunghe e complesse, di queste si è solo ipotizzato lo schema principale.
Il monossido di azoto è ossidato a NO2 con la seguente reazione termica: 1) 2NO + O2 ⇔ 2NO2
biossido di azoto, è tra gli inquinanti primari, una molecola che assorbe radiazioni UV dello spettro solare in quantità significativa dando luogo alla sua fotodissociazione [15,16]:
2) NO2 + λ (< 430 nm) → NO + O
L’ossigeno atomico così prodotto inizia una catena complessa di reazioni che portano alla formazione di ozono (forte ossidante in grado di attaccare gli acidi grassi delle membrani cellulari) che può a sua volta riossidare il biossido di azoto a triossido di azoto.
Le reazioni che avvengono sono le seguenti [17]:
3) O2 + O → O3
4) NO2 + O3 → NO3• + O2 5) NO + O3 → NO2 + O2
Un’ulteriore incremento di O3 (reazione 3) si registra quando altri ossidanti occupano il ruolo dell’ozono nell’ossidazione dell’NO ad NO2 (reazioni 6 e 7); questi ossidanti sono i radicali liberi originatisi per fotodissociazione:
6) NO + ROO• → NO2 + RO• 7) NO + HOO• → NO2 + HO• 8) NO2 + λ (< 430 nm) → NO + O•
9) O + H2O → 2 HO•
L’O3 è un gas tossico, ed una volta presente in troposfera in concentrazione elevata ha effetti negativi sulla salute dell’uomo, delle piante, sui materiali plastici ed anche sul clima. La quantità di ozono presente in troposfera dipende quindi dalle reazioni di produzione (3) e distruzione (5), regolate dall’intensità della radiazione solare e dalla quantità di NOx. Praticamente l’NO2 forma ozono ed l’NO lo distrugge.
In aria inquinata da scarichi di autoveicoli e cioè in presenza di VOC incombusti, l’NO viene sequestrato e contemporaneamente si forma l’NO2. Si forma più O3 di quanto se ne distrugge, con conseguente accumulo di O3.
Nelle reazioni che costituiscono lo smog fotochimico i radicali convertono rapidamente NO a NO2 e questo permette alla concentrazione di NO di diminuire ed alla concentrazione di O3 di aumentare e di dare luogo alla formazione di inquinanti secondari quali i perossiacilnitrati (P.A.N. [18,19]), che anche in concentrazioni intorno ai 0,05 ppm, provocano irritazione agli occhi e all’apparato respiratorio. La reazione di formazione dei P.A.N. è la seguente:
10) O3 + R• → R(CO)-OO•
11) R(CO)-OO• + NO2 → R(CO)OO-NO2 (P.A.N.)
La pericolosità ambientale dei P.A.N. è associata alla sua persistenza: esso tende ad accumularsi nelle zone più alte e fredde della troposfera da dove diffonde verso le zone sottostanti più calde, dissociandosi termicamente con produzione di radicali e NO2. L’elevata reattività dei P.A.N. a riformare NO2 e radicali perossidici è fortemente dipendente dalla temperatura: ad esempio il suo tempo di vita medio alla temperatura di 27 °C è di circa 30 min., mentre se la temperatura è di 17°C il tempo di vita è di circa tre giorni. I P.A.N. costituiscono una riserva stabile negli strati più freddi della media e alta troposfera sia di NOx, sia di radicali iniziatori di reazioni secondarie. A causa della sua via di formazione esclusivamente fotochimica è possibile osservare concentrazioni atmosferiche elevate di P.A.N. solo se sono attivi ed intensi in atmosfera i processi ossidativi. Per questa ragione i P.A.N. vengono considerati come indicatori di attività fotochimica. Il tempo di vita medio li rende utili come indicatori di fenomeni di trasporto a breve distanza.
L’andamento delle concentrazioni di NO, NO2 e O3 nell’arco della giornata dipenderà quindi dalla presenza del sole che come si è visto promuove la quasi totalità delle reazioni; un esempio di questo andamento è dato dalla figura 2.9 [18,19].
Fig. 2.9 Concentrazioni medie nelle varie ore di NO, NO2 e O3 in una città.
La permanenza di NO e NO2 nell’atmosfera di una città non supera i 20-25 giorni, mentre il protossido di azoto può rimanere nell’atmosfera anche per vari anni. Come si è visto un’atmosfera ricca di inquinanti può dar luogo ad una varietà di reazioni alcune delle quali possono essere raffigurate con le figure 2.10 e 2.11 [20,21]. Inoltre se gli NOx non vengono abbattuti in ambito urbano possono raggiungere inalterati la stratosfera e qui reagire con lo strato di ozono distruggendolo.
Fig. 2.10 Trasformazioni chimiche degli NOx in atmosfera: (==>) processi
fotochimici,(→) processi termici in fase gas,(⋅⋅⋅⋅>) deposizioni secche, (--->) reazioni eterogenee.
2.3.4IL BUCO DELL’OZONO
Come già riportato precedentemente l’ozonosfera è uno strato dell’atmosfera terrestre compreso tra i 20 e i 50 km di quota, caratterizzato da una concentrazione di ozono relativamente alta.
La concentrazione di ozono in stratosfera è il risultato del bilanciamento fra reazioni di formazione e distruzione (Fig. 2.12, [21]). Se non intervengono altri fattori, la quantità di O3 raggiunge quindi un cosiddetto stato stazionario soggetto a normali oscillazioni stagionali poiché regolato dalla quantità di luce e di O2 presente. Per effetto delle correnti stratosferiche l’O3 inoltre viene trasportato dalle regioni tropicali a quelle polari dove è quindi presente in quantità superiore.
Fig. 2.12 Formazione e distruzione di ozono.
La quantità di ozono totale sopra una certa località si misura in Unità di Dobson (DU) che dà l’altezza espressa in millesimi di cm che dovrebbe avere la
colonna cilindrica di base unitaria se contenesse solo ozono alla pressione di 1 atm e 0°C (Es: 1 DU corrisponde ad uno spessore di 0.01 mm).
La quantità di ozono all’equatore si mantiene pressoché costante anche se prossima ai minimi per tutto l’anno (DU = 250) mentre alle alte latitudini l’ozono raggiunge il minimo (DU = 300) all’inizio della stagione fredda e il massimo all’inizio della stagione calda (DU = 400).
L’assorbimento della radiazione ultravioletta nell’ozonosfera produce un’inversione nell’andamento della temperatura in funzione della quota: mentre nella troposfera la temperatura diminuisce al crescere della quota, nell’ambito dell’ozonosfera essa aumenta al crescere della distanza dalla superficie terrestre.
A livello della stratosfera, lo strato di ozono crea una sorta di schermo protettivo che assorbe le dannose radiazioni ultraviolette provenienti dal Sole, consentendo la vita sulla Terra. Questo tipo di radiazioni, infatti, altamente energetiche e penetranti, possono alterare e danneggiare il DNA degli esseri viventi. Negli anni ‘70 alcuni ricercatori rilevarono che il naturale assottigliamento stagionale dello strato di ozono, che periodicamente si osserva al di sopra del continente antartico nei mesi di settembre e ottobre (la cosiddetta “primavera australe”), stava assumendo dimensioni allarmanti (Fig. 2.13) [22]. Il fenomeno, chiamato deplezione ma comunemente noto come “buco dell’ozono”, avviene naturalmente e ha un’origine ancora non chiara, e può perdurare anche per parecchi mesi; tuttavia, nel 1985, i rilevamenti compiuti dalla stazione scientifica inglese Antarctica Survey evidenziarono una diminuzione del 65% della concentrazione dell’ozono, localizzata per il 95% negli strati atmosferici compresi tra 13 e 22 km di distanza dalla superficie del pianeta.
Fig. 2.13 La diminuzione dell’ozono stratosferico (periodo 1980-1991),
concentrazione di ozono espressa in unità di Dobson (UD).
Cloro Fluoro Carburi (CFC)
La causa della formazione del “buco” dell’O3 è stata individuata nell’immissione in atmosfera di massicce quantità di composti di origine antropogenica, chiamate genericamente ODS (Ozone-Depleting Substances). Tra queste vi sono: i CFC (clorofluorocarburi); i cosiddetti halons (composti estinguenti come il bromoclorodifluorometano, bromotrifluorometano, dibromotetrafluoroetano); il metilbromuro; il tetracloruro di carbonio; il metilcloroformio.
Fig. 2.14 Formula di struttura dei CFC.
I clorofluorocarburi non sono tossici e sono chimicamente inerti e proprio per queste ottime caratteristiche, il loro utilizzo è stato massiccio: sono stati impiegati come liquidi refrigeranti nei frigoriferi e nei condizionatori, come solventi, come
isolanti termici, come propellenti, nella produzione di schiume espanse, negli estintori (Fig. 2.15).
Fig. 2.15 Utilizzi dei CFC negli U.S.A. prima della loro messa al bando.
Queste molecole complesse sono estremamente persistenti ed inerti nei confronti dei normali processi di degradazione che naturalmente provvedono a ripulire l’atmosfera dalla maggior parte degli inquinanti. Sono quindi in grado di raggiungere l’ozonosfera e di decomporre le molecole di O3. Sotto l’azione dei raggi ultravioletti, infatti, le molecole dei CFC si decompongono in atomi di Cl e in altri derivati clorurati, che, a loro volta, reagiscono con l’O3 e lo convertono in O2, liberando ClO che va a degradare altre molecole di O3 (Fig. 2.17) [21].
![Fig. 2.32 Fotografie del monolite a struttura quadrata o esagonale e rappresentazione grafica dello strato sottile di γ -Al 2 O 3 [48]](https://thumb-eu.123doks.com/thumbv2/123dokorg/8224896.128556/97.892.161.773.148.774/fotografie-monolite-struttura-quadrata-esagonale-rappresentazione-grafica-sottile.webp)
![Fig. 2.38 Effetto della struttura dell’idrocarburo sulla relativa temperatura di light-off [82]](https://thumb-eu.123doks.com/thumbv2/123dokorg/8224896.128556/109.892.270.664.209.649/fig-effetto-struttura-idrocarburo-relativa-temperatura-light-off.webp)