2
3 SOMMARIO
RIASSUNTO ... 5
1. INTRUDUZIONE ... 6
1.1 ALLEVAMENTO PER IL RIPOPOLAMENTO E PER LA REINTRODUZIONE ... 6
1.2 PRINCIPALI SPECIE SELVATICHE DI AVIFAUNA ... 12
1.2.1 IL FAGIANO ... 12
1.2.2 LA PERNICE ROSSA ... 18
1.2.3 LA STARNA ... 23
1.3 RIPRODUZIONE IN CATTIVITÀ ... 27
1.3.1 SCELTA DEI RIPRODUTTORI ... 28
1.3.2 TECNICA DI ALLEVAMENTO IN COPPIA FISSA, PARCHETTO E/O COLONIA ... 31
1.3.3 DISINFEZIONE ... 34
1.3.4 RACCOLTA DELLE UOVA ... 36
1.3.5 CONSERVAZIONE DELLE UOVA ... 38
1.3.6 INCUBAZIONE E SCHIUSA ... 41
1.3.7 SPERATURA ... 48
1.3.8 PERFORMANCE RIPRODUTTIVE: FERTILITÀ E SCHIUSA ... 48
1.3.9 MORTALITÀ EMBRIONALE ... 53
1.3.10 PRINCIPALI CAUSE DI MORTALITÀ EMBRIONALE ... 54
2. SCOPO DELLA RICERCA ... 71
2.1 PREMESSA ... 71
2.2 – OBIETTIVI DELLO STUDIO ... 72
3. MATERIALI E METODI ... 73
3.1 SPECIE OGGETTO DELLO STUDIO ... 73
3.2 NUMERO DI SOGGETTI E LORO PROVENIENZA ... 73
3.3 MODALITÀ DI INCUBAZIONE E DI SCHIUSA ... 74
4
3.5 RILIEVI EFFETTUATI E LORO MODALITÀ DI ESECUZIONE ... 75
3.6 STRUMENTI OPERATIVI: MOSE, SDE, DCM ... 76
3.6.1 MANUALE OSSERVAZIONE SVILUPPO EMBRIONALE (MOSE)- ISTRUZIONI D’USO ... 76
3.6.2 SCHEDA DETERMINAZIONE ETÀ EMBRIONE (SDE)- istruzioni d’uso ... 78
3.6.3 QUADRO SINOTTICO PER LA DETERMINAZIONE CAUSE DI MORTE (DCM)– ISTRUZIONI D’USO ... 79
4. RISULTATI ... 80
4.1. SVILUPPO EMBRIONALE ... 80
4.2 MESSA A PUNTO DEGLI STRUMENTI OPERATIVI (MOSE, SDE E DCM) ... 86
5. DISCUSSIONI ... 86
5.1 DETERMINAZIONE DELL’ETÀ DI MORTE... 86
5.2 VALUTAZIONE DEGLI STRUMENTI OPERATIVI (MOSE, SDE E DCM) ... 88
6.CONCLUSIONI ... 96
7. BIBILIOGRAFIA E SITOGRAFIA ... 98
8. ALLEGATI ... 103
8.1. MOSE – MANUALE OSSERVAZIONE SVILUPPO EMBRIONALE ... 103
8.1.2 SIGLE ... 129
8.2 SDE- SCHEMA DETERMINAZIONE ETÀ EMBRIONE ... 134
5
RIASSUNTO
Parole chiave: allevamento, sviluppo embrionale, fagiano, pernice, starna, schiusa
L'allevamento in cattività di molte specie di uccelli selvatici, è ancora oggi caratterizzato da performance riproduttive non comparabili con quelle di altri avicoli allevati per scopi alimentari. Inoltre, i dati disponibili in merito allo sviluppo embrionale delle specie selvatiche, sono ancora alquanto insufficienti, riferendosi più spesso a specie più note quali quelle allevate intensivamente. Invece, la possibilità di stimare l'età di morte dell'embrione in maniera abbastanza accurata, aiuterebbe a individuare le eventuali cause di morte dell’embrione e, conseguentemente, migliorare la schiusa delle uova.
Per questo motivo è stato condotto uno studio comparativo sullo sviluppo embrionale di fagiano (Phasianus colchicus), pernice (Alectoris rufa) e starna (Perdix perdix), specie diffusamente allevate in Italia a scopo faunistico-venatorio. Per ognuna di queste specie, sono state contemporaneamente incubate 100 uova, tutte deposte nello stesso giorno della nona settimana di deposizione. Durante il periodo di incubazione, ogni giorno sono state prelevate 3 uova per ogni specie, procedendo immediatamente alla loro apertura, alla loro descrizione macroscopica, all’esecuzione di foto e, infine, di diversi rilievi morfometrici sull’embrione.
Le osservazioni macroscopiche effettuate ai diversi stadi di sviluppo embrionale, hanno permesso di determinare il giorno in cui diversi organi, parti anatomiche e/o strutture embrionali diventavano riconoscibili. In questo modo, quindi, è stato possibile ottenere sufficienti informazioni allo scopo di stimare l'età di morte dell'embrione con una approssimazione di circa un giorno. Inoltre, è stato anche rilevato uno sviluppo tendenzialmente più tardivo dello sviluppo embrionale e quindi di schiusa, della starna, rispetto al fagiano e alla pernice, ritardo complessivamente stimato in circa 12 ore.
Infine, i dati e le informazioni raccolte attraverso questo studio, hanno permesso di mettere a punto una serie di “strumenti” utili per giungere ad una rapida determinazione dell’età di morte dell’embrione da una parte, e dall’altra delle possibili cause nonché delle azioni da intraprendere allo di ridurre tale mortalità. Questi strumenti sono il MOSE (Manuale per l’Osservazione dello Sviluppo Embrionale), lo SDE (Scheda per la Determinazione dell’Età dell’Embrione), ed infine, il DCM (quadro sinottico per la Determinazione delle Cause di Morte).
ABSTRACT
Key words: Breeding, embryo development, pheasant, red-legged partridge gray partridge, hatchability
In captivity condition the rearing of many game bird species is affected by a low hatching rate. Also, there is a lack of specific references about its embryo development. The exact estimation of embryos death age is the basis to diagnose the causes of death during incubation and to improve hatchability.
For these reasons a comparative study of embryo development was carried out on pheasant (Phasianus colchicus), red-legged partridge (Alectoris rufa) and grey partridge (Perdix perdix). For each specie, 100 eggs laid in the same day of the 9th laying
week were incubated contemporarily. At least 3 eggs for each specie were opened daily during the incubation. Embryos were photographed, described in a macroscopic manner and the main measurements of anatomic portions were taken.
The day of appearance of new organs and body portion was determined and the study allowed sufficient elucidation of the development stages to estimate macroscopically embryo age within an approximation of about one day. A general delay in the embryo development and hatching time of the grey partridge was observed in comparison to pheasant and red-legged partridge.
Finally, data collected by mean the study have been used to develop some useful tools for determing embryo death age ; these tools are particularly the MOSE (Manuale per l’Osservazione dello Sviluppo Embrionale) and SDE (Scheda per la Determinazione dell’Età dell’embrione), which allow the operator to determine the embryo death age, and the DCM (quadro sinottico per la Determinazione Cause di Morte), that according with the embryo death age, provide support for determining possible causes of death of the embryo and actions for reducing or remove their effect (death) on embryo life and hatchability.
6
1. INTRUDUZIONE
1.1 ALLEVAMENTO PER IL RIPOPOLAMENTO E PER LA REINTRODUZIONE Il ripopolamento è l’intervento di immissione, in un’area appropriata, di individui appartenenti ad una determinata specie al fine di incrementare la dimensione della popolazione già presente nell'area considerata. Questa tecnica è ormai diventata di uso comune per diverse specie selvatiche quali lepri, pernici e starne ma in particolar modo per il fagiano. Gli esemplari che vengono introdotti possono avere diverse provenienze; in particolare, essi possono essere catturati in zone specifiche denominate “Zone di Ripopolamento e Cattura”, possono essere prelevati da allevamenti nazionali oppure si ricorre all’importazione dall’estero (Cocchi et al., 1998). Nel nostro paese gli allevamenti e di conseguenza la pratica del ripopolamento, sono più diffusi nelle aree settentrionali, mentre al sud e nelle isole si calcola un significativo calo.
Negli ultimi anni il ripopolamento, soprattutto di fagiani, è aumentato fino a diventare una pratica annuale; ciò si spiega in gran parte con la crescente richiesta da parte del mondo venatorio (Cocchi et al., 1998).
Non è da sottovalutare anche un importante dato sociale che influenza l’aumento delle zone di caccia.
La caccia infatti viene relegata in terreni una volta sottoposti a coltura ed oggi non più sfruttati, cioè nelle cosiddette “zone marginali”. L’esodo della popolazione rurale e il crescente inurbamento degli ultimi anni ha fatto si che molti terreni siano rimasti completamente disabitati e quindi soggetti ad un inevitabile processo di degradazione. I terreni abbandonati dall’agricoltura sono destinati alla scomparsa della selvaggina nel giro di pochi anni ed il loro sfruttamento venatorio , produce circa 7-8 kg di carne per ettaro per anno. Anche per queste ragioni, in passato si è pensato di convertire questi terreni alla phroduzione faunistica, facendo si che si ripopoli la selvaggina stanziale e, allo
7
stesso tempo, che sorgano nuovi allevamenti per ottenere i soggetti adatti al ripopolamento (Casanova, 1981).
In seguito alla crescente diffusione del ripopolamento faunistico-venatorio, sono stati anche condotti diversi studi allo scopo di verificare se, così come condotto, il ripopolamento fosse una pratica realmente vantaggiosa; inoltre, si ritiene che gli esemplari reintrodotti abbiano un minore successo riproduttivo, che possano compromettere la sopravvivenza dei nuclei familiari naturalmente adattati al territorio e caratterizzati da maggiori chance di sopravvivenza e, infine, di essere caratterizzati da una ridotta prolificità (Meriggi et al., 1997).
Per questo motivo, l’obiettivo principale degli allevamenti di selvaggina finalizzati al ripopolamento è quello di produrre un reale miglioramento qualitativo della produzione, ovvero non più una selezione di individui che si adattino meglio alle condizioni di allevamento o più produttivi, ma la produzione di individui che mantengano e conservino i caratteri funzionali, aumentando così le loro chance di sopravvivenza in natura una volta immessi (Cocchi et al., 1998).
I problemi che si incontrano nell’allevamento intensivo di questi animali sono principalmente tre:
1) la modifica del patrimonio genetico dei soggetti allevati;
2) le alterazioni morfologiche e comportamentali indotte dalle tecniche di allevamento;
3) le condizioni igienico-sanitarie.
Per meglio comprendere l'origine di queste problematiche, basta porsi nella posizione dalla quale l'allevatore affronta la sua attività e cioè quella di produttore e venditore di soggetti di allevamento. In pratica, per quanto lo riguarda più da vicino, egli sente come prioritaria l'esigenza di disporre di
8
soggetti che si adattino facilmente alle condizioni di allevamento, che producano molte uova e, magari, con una alta percentuale di schiusa. Detto questo, si può facilmente capire il perché, solitamente, negli allevamenti si tende a selezionare individui maschi con minore aggressività, femmine con maggiore produzione di uova e senza prestare alcuna attenzione alla loro propensione alla cova. Inoltre, così facendo, la continua selezione dei caratteri legati alla produttività “quantitativa” porta senza dubbio ad una riduzione della diversità genetica, riduzione che sebbene non “rilevante” in condizioni di cattività, ma potrebbe, almeno in teoria, risultare fortemente penalizzante ai fini della vita in natura, non lasciando così presupporre buone performance riproduttive e di sopravvivenza (Cocchi et al., 1998). È dimostrato anche che l’incrocio tra consanguinei, pratica molto frequente nelle condizioni di cattività di cui sopra, può indurre sterilità nel maschio. Per limitare questi rischi, si può ricorrere a frequenti “rinsanguamenti” con soggetti di origine naturale. In tal senso, una buona abitudine sembra essere quella di introdurre in allevamento animali di cattura come riproduttori; uno studio condotto da Fronte et al. (2005), dimostra che così facendo è possibile produrre fagiani in quantità simile, o di poco inferiore, che con riproduttori da generazioni selezionati in allevamento; il vantaggio di ciò, in pratica, consisterebbe nel fatto che in una generazione non vengano a perdersi significative caratteristiche genetiche tipiche dei fagiani selvatici, con grande beneficio dal punto di vista faunistico (Fronte et al., 2005). Una loro più spiccata capacità di adattamento in natura con conseguenti migliori performance riproduttive, nonché una migliore sopravvivenza, potrebbe compensare nel complesso una eventuale riduzione di produzione in allevamento.
Per quanto riguarda il secondo problema, ossia le alterazioni morfologiche e comportamentali indotte dalla cattività, queste possono diminuire la capacità di adattamento dei soggetti e quindi la loro sopravvivenza in natura. Un esempio di modificazione fisiologica fondamentale riguarda l’alimentazione; una dieta carente
9
di fibra grezza, quale quella comunemente utilizzata in cattività, può provocare una consistente diminuzione della lunghezza dei ciechi, con la conseguenza di una maggiore difficoltà dei soggetti ad adattarsi al cibo disponibile in natura (Schulze, 1992; Paci et al., 1990). Lo studio condotto da Anttila (1999) sulla starna mostra come il cambio repentino dal mangime usato in allevamento, a quello che gli animali trovano in natura una volta rilasciati, provochi una notevole perdita di peso soprattutto nella prima settimana di rilascio, questo è dovuto non solo ad una maggiore sospettosità verso il nuovo cibo da parte degli animali, ma anche ad una minore digeribilità dei nuovi cibi per una differente composizione della dieta. Nemmeno un periodo di 6 settimane di cibo naturale prima di essere rilasciate è sufficiente a condizionare questi soggetti a mangiare il cibo trovato in natura (Anttila
et al., 1999).
Ancora, gli animali provenienti dagli allevamenti, al momento della loro immissione, presentano, rispetto ai soggetti della stessa età già presenti in natura, un peso maggiore e un aumento della lunghezza delle ali e del tarso, indicatori questi delle maggiori dimensioni corporee (Bagliacca et al., 1998). Questo fattore dipende principalmente dalla scelta dell’allevatore di ceppi di mole maggiore da utilizzare come riproduttori, dalle condizioni d’allevamento come ad esempio la disponibilità ad libitum di cibo di alta qualità, e l’assenza di predatori (Bagliacca et al., 1998). È stato dimostrato con uno studio condotto sui fagiani, come i soggetti selvatici presentino una mole corporea minore rispetto a quella dei soggetti provenienti da allevamenti, questo dato è principalmente correlato al regime alimentare praticato negli allevamenti più che a fattori di origine genetica (Santilli et al., 2002).
In merito, è stato osservato che l’aumento generalizzato della mole corporea, come detto tipico dei soggetti di allevamento al momento dell'immissione, renda questi soggetti, in particolar modo il fagiano, incapaci di spiccare il volo agilmente, con involo “a colonna” e decolli lenti con “angolazioni acute”, al contrario dei soggetti
10
selvatici che spiccano il volo rapidamente con angolo di decollo “ottuso” per mettersi più rapidamente fuori dalla portata dei predatori; in alcuni casi l’animale proveniente d’allevamento preferisce fuggire “di pedina” rendendosi un facile bersaglio per i predatori terrestri (Bagliacca et al., 2003, Petrini et al., 1995). In verità le diverse caratteristiche d’involo tra i fagiani allevati e quelli selvatici può dipendere, oltre che dal peso dell’animale, anche da diversi altri fattori come la struttura corporea, lo sviluppo muscolare, la ginnastica funzionale. In particolare i soggetti provenienti da allevamento presentano un minore sviluppo della muscolatura pettorale a favore di quella delle zampe, avendo meno possibilità di esercitarsi al volo (Cocchi et al., 1998). Alcuni di questi fattori sono strettamente correlati alla razza, e la selezione di ceppi ad esempio più leggeri come quelli importati dal Nord America può risolvere in parte il problema; altri fattori, invece, possono essere modificati da diverse tecniche d’allevamento (Bagliacca et al., 2003). Inoltre studi sui fagiani, hanno evidenziato come nelle femmine l’aumento del peso corporeo sfavorisca la sopravvivenza in natura, mentre al contrario la lunghezza del tarso sia strettamente correlato al suo successo in natura.
Nei maschi, sempre per quanto riguarda il fagiano, la lunghezza dello sperone, sembra avere un ruolo fondamentale; nel fagiano d’allevamento, la lunghezza dello sperone influenza positivamente sia la sopravvivenza in natura sia l’attrazione sessuale, al contrario, nel fagiano selvatico, questo carattere risulta fondamentale per il predominio territoriale, ma sembra essere un carattere svantaggioso per l’accoppiamento (Bagliacca et al., 2003).
Uno studio condotto sulla sopravvivenza di starne dopo il rilascio, ha evidenziato che mentre nel primo periodo si osserva una minore sopravvivenze delle femmine rispetto al maschio, già ad undici settimane dal rilascio questo dato si equilibra tra i due sessi; i dati riportati entro il primo mese di rilascio, mostrano uno stretto legame tra la mortalità data dalla predazione e le alterazioni morfologiche, infatti i soggetti più predati erano quelli con le ali più corte e un peso inferiore rispetto agli altri
11
soggetti liberati ancora in vita. Se ne deduce che, almeno nel primo periodo di rilascio, sono i soggetti più leggeri e piccoli, probabilmente i più debilitati perché peggio adattatisi alla vita selvatica, ad essere maggiormente predati (Scarselli et al., 2000).
Sempre a carico delle alterazioni comportamentali, è necessario segnalare tutte quelle che riguardano i comportamenti acquisiti grazie al contatto con i genitori, ovvero dovuti all’imprinting; è dimostrato, infatti, che pulcini “imprintati” sull’uomo o sulle macchine incubatrici, in futuro possono sviluppare problemi di riconoscimento del partner sessuale con conseguente basso successo riproduttivo una volta immessi in natura (Lorenz, 1965); inoltre, in allevamento il mancato contatto coi genitori impedisce il normale apprendimento delle strategie antipredatorie (Bagliacca et al., 1998; Papeschi et al., 1997). Un’ altro aspetto importante, soprattutto nelle prime fasi di vita, per la sopravvivenza dei soggetti una volta liberati, è l'assuefazione all'uomo; infatti soggetti provenienti da allevamenti in cui vengono adottate le tecniche volte a minimizzare il contatto con l'uomo (barriere visive, particolari disposizione delle luci), hanno maggiori possibilità di sopravvivenza (Bagliacca et al., 1998).
Tutte queste alterazioni, in definitiva, possono essere facilmente tradotte in una più che probabile maggiore vulnerabilità nei confronti dell'azione predatoria.
Infine l’aspetto sanitario, che nella fattispecie rappresenta un rischio maggiore non per i soggetti introdotti ma per le popolazioni naturali; per questo la profilassi igienico-sanitaria in allevamento è importante e necessaria e si deve applicare a tutti i settori dell’allevamento. Si consiglia di applicare il “tutto vuoto sanitario” all’interno dell’allevamento per permettere la disinfezione e sanificazione dei vari ambienti, comprese le attrezzature e l’incubatoio, per limitare la diffusione di agenti patogeni infettivi o parassitari. Il controllo igienico va esteso, oltre che agli ambienti e alle attrezzature, in particolare alle
12
uova, ai depositi di mangimi e ai silos, ai depositi e condutture dell’acqua, e si consiglia il controllo microbiologico di quest’ultima. Il veterinario d’allevamento deve provvedere ai programmi di vaccinazione, ai controlli sanitari degli animali introdotti in allevamento e alla certificazione degli animali al momento della liberazione o consegna (Bagliacca et al., 1998).
Diversi studi effettuati sul fagiano, dimostrano che i soggetti di allevamento presentano una positività maggiore di quelli selvatici per quanto riguarda la malattia di Newcastle, la Bronchite Infettiva e la Marble Spleen Disease; in allevamento bisogna attuare una profilassi di routine contro la principali malattie infettive e praticare trattamenti antiparassitari prima di immettere i soggetti in natura (Cocchi et al., 1998).
Per quanto riguarda invece gli animali provenienti da altri allevamenti o di cattura introdotti in allevamento, è consigliabile la quarantena in un ambiente isolato per effettuare accertamenti diagnostici , controlli sanitari e le vaccinazioni (Bagliacca et
al., 1998).
1.2 PRINCIPALI SPECIE SELVATICHE DI AVIFAUNA 1.2.1 IL FAGIANO
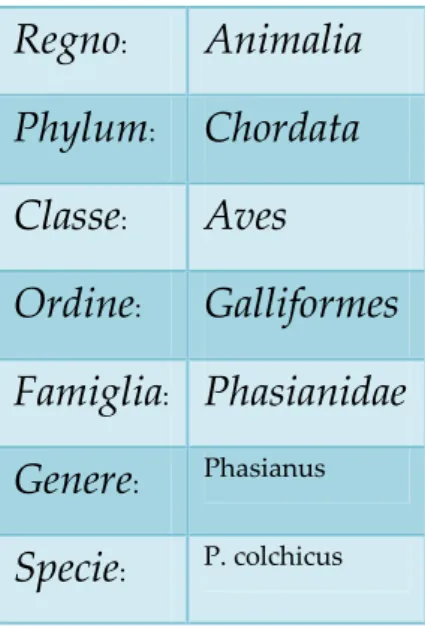
Il fagiano appartiene all’ordine dei galliformi, genere Phasianus; una descrizione della sua classificazione zoologica è riportata nello schema 1.
E’ possibile fare una classificazione a seconda del colore delle piume del groppone e tenendo conto dei luoghi d’origine:
• Groppone rosso-marrone: fagiani occidentali
13
Schema 1: Classificazione zoologica del fagiano (www.wikipedia.org)
Regno
:Animalia
Phylum
:Chordata
Classe
:Aves
Ordine
:Galliformes
Famiglia
:Phasianidae
Genere
: PhasianusSpecie
: P. colchicusAi fini dell’allevamento industriale, i più interessanti sono quelli appartenenti al primo gruppo, ossia:
• Fagiano comune (Phasianus colchicus)
• Fagiano mongolico (Phasianus c. mongolicus)
• Fagiano principesco (Phasianus c. principalis)
Dei fagiani orientali a schiena verde, sono da citare il fagiano Torquato (Phasianus colchicus torquatus) originario del sud-est della Cina ed importato in Europa nel 1700, il Formosano ed il Versicolor.
CARATTERISTICHE GENERALI
14
Il genere Phasianus è un uccello che presenta precise caratteristiche morfologiche; le dimensioni sono medie, la testa è relativamente piccola rispetto al corpo, il becco è robusto, arcuato, le narici ovali e ricoperte da una scaglia cartilaginea (www.agraria.org); le guance e l’area attorno agli occhi si presentano nude, coperte da piccole papille cutanee e da alcune rade piume; le ali sono corte, larghe e rotonde, sostenute da una forte muscolatura che consente un volo rapido e lineare sulle corte distanze, preceduto da un rumoroso battito d’ali mentre l’apertura alare è compresa tra 70 e 90 cm; la coda si presenta molto lunga e ricurva verso il basso e nei maschi può raggiungere anche i 50 cm di lunghezza; le zampe sono forti e massicce, dotate di robusti speroni nella parte posteriore del tarso nei maschi (www.wikipedia.org). La vista è particolarmente sviluppata e permette di percepire movimenti ad alcune centinaia di metri; anche l’udito e l’olfatto sono ben sviluppati. È una specie onnivora, ma essendo principalmente granivora e insettivora, normalmente frequenta i boschi circondati da campagne fertili dove si reca in cerca di cibo (Cocchi et al., 1998).
Il dimorfismo sessuale è molto accentuato in questa specie; in genere i maschi presentano una colorazione molto più appariscente e vivace rispetto alla femmina, con tonalità nella zona della testa e del collo violaceo verdastre con riflessi metallici. La femmina presenta un piumaggio più uniforme. Come già detto solo nel maschio è presente lo sperone, lo sviluppo di quest’ultimo sembra essere tra i principali elementi di scelta da parte della femmina, la quale orienta la sua scelta sessuale verso gli esemplari con sperone più lungo. (Romboli, 2008). Sempre nel maschio, l’area che circonda l’occhio è nuda, fatta eccezione per la presenza di piccoli ciuffi di penne nella parte inferiore; la stessa, è inoltre coperta da piccole papille ben evidenti, di color rosso scarlatto, denominate caruncole; queste strutture, tra l’altro, sono parzialmente erettili. Durante le esibizioni di corteggiamento i maschi le estendono in gonfie pieghe che scendono fin sulle guance (Cocchi et al., 1998). Le femmine, per contro, sono caratterizzate da dimensioni minori rispetto al maschio e da una
15
colorazione più pallida tendente al beige, grigio-bruno chiaro dovutaad esigenze di mimetizzazione (Romboli, 2008). Questo stesso tipo di piumaggio è presente anche nel maschio nei primi tre mesi di vita. Nella femmina, invece, non sono presenti le caruncole intorno all’occhio (www.agraria.org). Nella parte posteriore della testa del maschio sono presenti due ciuffi di penne che durante il periodo riproduttivo si trasformano in cornetti (Romboli, 2008).
COMPORTAMENTO
Il fagiano ha una vita principalmente diurna. Nelle prime ore della giornata e nel pomeriggio esso si dedica principalmente alla ricerca del cibo, mentre nelle ore centrali della giornata, si dedica invece alla pulizia del piumaggio e al riposo; infine,trascorre le ore notturne principalmente sugli alberi, sotto ai cespugli o tra la fitta vegetazione, al riparo da potenziali predatori e/o altri pericoli. Le fasi di attività hanno periodicità giornaliera e variano rispetto alla stagione e allo stato fisiologico dell’animale (www.agraria.org).
Possiede un volo forte e rapido, principalmente orizzontale, ma in genere non lungo né alto, con potenti battute d'ala e planate; al “frullo”, molto fragoroso, talvolta si alza in verticale. È un ottimo “pedinatore” e all'approssimarsi di un pericolo preferisce allontanarsi di corsa alla ricerca di un rifugio, levandosi in volo solo se minacciato da vicino (www.ittiofauna.org). Al di fuori del periodo riproduttivo, il fagiano tende a formare gruppi sociali; questa caratteristica, offre tutti i notevoli vantaggi del gruppo come, ad esempio, una più facile ricerca del cibo e una riduzione delle perdite dovute alla predazione (Cocchi et al., 1998). I maschi formano gruppi meno numerosi, a causa della maggiore aggressività rispetto alle femmine e dell’antagonismo, aspetti tipici di questa specie; inoltre i gruppi sono contraddistinti da una rigida gerarchia. Da questo punto di vista, le femmine invece possono essere fedeli ad un solo gruppo oppure, talvolta, si associano a gruppi diversi in momenti
16
diversi; in questo caso, di solito, queste sono soggetti più giovani o più deboli gli adulti tendono invece a rimanere sempre nello stesso gruppo. I gruppi delle femmine sono più numerosi, composti da circa 20-30 soggetti (www.wikipedia.org). Con l’inizio della stagione riproduttiva questa organizzazione cambia, i gruppi si dissolvono gradualmente e si ha la formazione dell’harem, costituito da un maschio e da un numero di femmine che va da due a cinque. Talvolta si possono verificare legami monogami stabili ma, generalmente, il maschio forma un harem e si accoppia con più femmine; il suo successo riproduttivo è strettamente legato al territorio ed alle femmine che difende e infatti, all’inizio del periodo primaverile, è possibile assistere a spettacolari combattimenti per conquistare e difendere il proprio areale riproduttivo (www.agraria.org). L’accoppiamento è preceduto da un rituale di corteggiamento, che consiste in una serie di posture rituali mediante le quali le femmine sono invitate all’accoppiamento. L’accoppiamento avviene 5-6 giorni prima della deposizione delle uova; durante questo periodo il maschio sorveglia e difende le femmine dell’harem e questo permette loro di incrementare le riserve lipidiche, da utilizzare successivamente per affrontare il periodo riproduttivo. Il nido viene costruito in un luogo appartato, in una depressione del terreno riempita con foglie secche ed erbe e le prime deposizioni hanno inizio a metà marzo (www.wikipedia.org). La femmina depone da 10 a 15 uova, di colore verde oliva-grigiastro, del peso di 30-35 grammi, nell’arco di tre settimane. La cova viene condotta esclusivamente dalla femmina, raramente anche dal maschio (www.agraria.org).
17
Foto 3: nell’ordine, uovo di fagiano, starna e pernice
La schiusa avviene dopo 23-25 giorni di cova, di norma 24 e i pulcini sono in grado di abbandonare il nido in cerca di cibo entro poche ore dopo la schiusa. In media il 10-15 % delle uova risulta non fecondo o contiene embrioni morti. Durante i primi 12-15 giorni di vita i pulcini non si allontanano dalla madre, poiché non sono in grado di regolare la temperatura corporea (www.avianweb-wild bird web.com). All’età di 3-4 settimane cominciano ad essere più indipendenti e vivaci e sono già in grado di effettuare piccoli voli, (Romboli, 2008), ma la madre continua a seguire la prole fino all’età di 10-12 settimane e in autunno i gruppi familiari si sciolgono formando gruppi di individui di età e sesso differenti.
DISTRIBUZIONE GEOGRAFICA E HABITAT
Il fagiano ha origini principalmente asiatiche, la sua distribuzione naturale lo colloca infatti nelle regioni dell’Asia centro-occidentale/orientale, dal Caucaso fino all’isola di Formosa. In Europa, tra il 500 e l’800 d.C. e fin dall’epoca Romana, in Italia sono state importate diverse sottospecie di fagiano, in seguito è stato introdotto anche nel Nord America, nelle Isole Hawaii ed in Nuova Zelanda (Cramp et al., 1980). Questa specie è stata integrata, se non completamente ricostituita artificialmente, in tempi più recenti con soggetti provenienti dagli allevamenti in cattività. In particolare in Italia sono stati importati riproduttori di ceppi diversi di fagiano provenienti
18
dall’Inghilterra, dagli USA, dagli stati dell’area ex Sovietica e dalla Francia, che a sua volta aveva importato direttamente riproduttori anche da Formosa. Per questo motivo in Italia non si può parlare di una popolazione di fagiano comune con caratteristiche ben definite, in quanto i soggetti presenti sul territorio sono costituiti da ibridi delle varie sottospecie di Phasianus colchicus, mongolicus e torquatus e delle due sottospecie del Phasianus Versicolor (Bagliacca et al., 2004).
Foto 4: Distribuzione geografica del fagiano (vet.unipi.it/Dpa/mbagliac/appunti/fauna31.pdf)
1.2.2LAPERNICEROSSA
La pernice rossa (Alectoris rufa rufa) appartiene all’ordine dei galliformi, genere
Alectoris; una descrizione della classificazione zoologica è riportata nello schema 2.
La Pernice rossa ha 5 sottospecie:
· Alectoris rufa rufa
· Alectoris rufa corsa
· Alectoris rufa hispanica
· Alectoris rufa intercedens
· Alectoris rufa australis (www.wikipedia.org)
19
Schema 2: Classificazione zoologica della pernice
Regno: Animalia Phylum: Chordata Subphylum: Vertebrata Classe: Aves Ordine: Galliformes Famiglia: Phasianidae Genere: Alectoris
Specie: Alectori rufa
CARATTERISTICHE GENERALI
Foto 5: Pernice rossa (Alectoris rufa rufa)
La pernice rossa ha dimensioni medie e corporatura massiccia, becco tozzo leggermente arcuato verso il basso, ali corte ed arrotondate; per questa ragione, infatti, raramente prende il volo ma, come il fagiano, preferisce correre a lungo e solo in caso di pericolo imminente spicca il volo (www.agraria.org). La coda è breve e
20
rossiccia, i tarsi sono provvisti di una sorta di sperone nel maschio, che di rado compare anche nella femmina. In entrambi i sessi , il piumaggio è di colore bruno-olivastro nelle parti superiori, guance e gola bianche, presenta un collare di colore nero che si sfrangia in tante piccole macchie scure, petto macchiato di nero, caratteristica che la fa distinguere dalle altre specie appartenenti al genere Alectoris. I fianchi sono grigi barrati di bianco, castano e nero all’apice e anche questa è una caratteristica peculiare dell’Alectoris rufa nella quale è presente una sola barratura nera, mentre nella Alectoris graeca e Alectoris chukar è presente una doppia barratura (Giuzio et al. , 2005; Bagliacca et al., 2008). Il becco e le zampe sono rosse. In volo, vista da sotto, si riconosce per le tipiche barrature dei fianchi e per il collare nero, che si continua nel petto con una “sgocciolatura” nera. In lontananza è difficilmente distinguibile dalle altre pernici (www.ittiofauna.org).
La lunghezza media è di 30-34 cm e il peso medio è di 340-630 g. Il dimorfismo sessuale non è così marcato come nel fagiano, tuttavia vi sono alcune caratteristiche diverse tra maschi e femmine: il maschio è più massiccio e presenta una testa più grande rispetto alla femmina, uno sperone composto da due tubercoli e una pupilla copulatrice rossastra al centro della cloaca (Giuzio et al., 2005).
Nel maschio adulto è sempre presente uno sperone metatarsale nella regione posteriore della zampa, si tratta di una struttura arrotondata e composta da due tubercoli. Nelle femmine è normalmente assente anche se compare in quelle più vecchie, ma con delle differenze, essendo più piccolo, appuntito e privo di tubercoli. Inoltre durante il periodo riproduttivo nei maschi è possibile notare un ulteriore elemento di distinzione che consiste in una papilla copulatrice, di colore rossastro, visibile al centro della cloaca (Giuzio et al., 2005).
COMPORTAMENTO
La pernice rossa, al contrario del fagiano, è una specie principalmente monogama (www.animaliitaliani.org). La stagione riproduttiva è compresa tra aprile/maggio e
21
luglio e già da febbraio si iniziano a formare le coppie. Nei mesi di giugno-settembre compaiono le covate, ed è proprio in questo periodo che si forma il gruppo familiare costituito da uno o entrambi i genitori. Al di fuori della stagione riproduttiva invece, tra ottobre-marzo, si formano i gruppi invernali, ovvero più famiglie che si aggregano e costituiscono gruppi di 10-30 individui (Giuzio et al., 2005).
Alcune femmine sono capaci di deporre in due nidi diversi, dei quali uno sarà covato dal maschio e l’altro dalla femmina; in pratica la femmina depone in un primo nido circa 12 uova, poi ne depone altrettante in un secondo nido, mentre il maschio resta accanto alla femmina durante tutto il periodo di deposizione; infine il maschio va a covare il primo nido mentre la femmina si prenderà cura del secondo. Alla schiusa i genitori rimangono coi piccoli per almeno la prima settimana. La doppia nidificazione e la conseguente cova da parte del maschio, è stata osservata in diversi paesi ed in particolare in Inghilterra, Italia, Francia, Spagna e Portogallo. In Inghilterra è stato anche stimato che è circa il 70% delle femmine più anziane e una piccola parte di quelle giovani, ad adottare la doppia nidificazione (AA.VV., 1990). Le uova sono di colore rossastro con piccole macchie più scure; ne vengono deposte in media 12 per deposizione e covate per 23-25 giorni innanzitutto dalla femmina, ma spesso anche dal maschio.
La pernice si ciba prevalentemente di sostanze vegetali come semi e frutti, bulbi, foglie verdi, germogli, radici, infiorescenze, insetti e altri piccoli animali invertebrati (Giuzio et al., 2005).
DISTRIBUZIONE GEOGRAFICA E HABITAT
La pernice rossa non è un uccello comune in molti paesi; in alcune aree, esso è stato introdotto dall’uomo e per questo esso è presente in natura anche in alcuni paesi dell’Europa dell'ovest ed in Africa del nord-ovest (www.wikipedia.org).
22
La pernice rossa ha origine da popolazioni che si sono sviluppate in Spagna e col tempo si sono differenziate in tre principali sottospecie sviluppate o importate nell’Europa Sud occidentale:
· La specie Alectoris rufa rufa, si ritrova nella Francia centro-meridionale, nell’Appennino centro settentrionale, in Corsica e nell’Isola d’Elba; inoltre essa è stata introdotta nelle Baleari e nell’Inghilterra Meridionale.
· La specie Alectoris rufa ispanica, è presente principalmente nella penisola iberica settentrionale ed occidentale.
· La specie Alectoris rufa intercedens, è diffusa nella Spagna nord orientale e centro meridionale.
In Italia è stata introdotta la seconda e la terza specie; con la loro importazione, quindi, è stato prodotto un certo grado di inquinamento genetico della specie autoctona, dal punto di vista genetico già ampiamente “provata” dalla precedente costante ibridazione con la Coturnice orientale (Alectoris chukar) originaria del medio oriente (Giuzio et al., 2005; Bagliacca et al., 2008). In Italia è presente sull'Appenino ligure, su quello tosco-emiliano e nell'Isola d'Elba (www.wikipedia.org).
Gli habitat preferiti da questa specie sono le zone collinose aride, con sassaie, campi aperti e ricche di cespugli dove trovano rifugio e possono nidificare. Le coppie in primavera prediligono i campi di frumento, mentre i gruppi familiari prediligono i medicai. La presenza di sorgenti d’acqua sembra essere una caratteristica essenziale per la scelta del territorio, soprattutto nel periodo riproduttivo. In terreni dove è sempre a disposizione erba verde e rugiada,
23
Foto 6: Distribuzione geografiche della pernice (Alectoris rufa rufa)
(www.ittiofauna.org)
1.2.3LASTARNA
La starna (Perdix perdix) appartiene all’ordine dei galliformi, genere Perdix; una descrizione della sua classificazione zoologica è riportata nello schema 3.
Schema 3: Classificazione zoologica della starna
All’interno della specie Perdix Perdix, sono generalmente riconosciute 7 sottospecie, come per la pernice, ciascuna di esse tipiche di specifiche zone geografiche (www.wikipedia.org):
· Perdix perdix hispaniensis (porzione settentrionale della penisola iberica)
Regno: Animalia Phylum: Chordata Classe: Aves Ordine: Galliformes Famiglia: Phasianidae Genere: Perdix Specie: P. perdix
24
· Perdix perdix sphagnetorum (Olanda e Germania nord occidentale)
· Perdix perdix lucida (Finlandia, Polonia e Baltico)
· Perdix perdix armoricana (Bretagna, Normandia e Francia centrale e nord orientale)
· Perdix perdix canescens (Turchia, Caucaso, Iran e zona transcaucasica)
· Perdix perdix perdix (Scandinavia, Irlanda, Isole Britanniche ed Europa centrale, Alpi e Balcani)
· Perdix perdix robusta (dal fiume Ural alla Siberia sud occidentale e Kazakistan)
Alcuni autori riconoscono anche una sottospecie italica, originaria dell’Italia, considerata ormai estinta; si ritiene che la specie allevata in Garfagnana sia derivante dall’antico ceppo italico; anche un piccolo gruppo derivante sempre da questa sottospecie è presente nel Parco nazionale del Gran Sasso e Monti della Laga, ma il numero di soggetti è molto esiguo, meno di 100 esemplari (Bagliacca et al., 2008).
CARATTERISTICHE GENERALI
25
La starna ha medie dimensioni, il corpo è piccolo, rotondo e massiccio, con coda corta, ha una lunghezza tra 29 e 33 cm, le ali sono corte ed arrotondate e l’apertura alare è di circa 45-48 cm (www.wikipedia.org). Il becco è tozzo e incurvato verso il basso di color grigio come le zampe (Bagliacca et al., 2008). La testa e la gola sono di colore rosso mattone, le parti anteriori e superiori del corpo sono di color grigio-chiaro con sottili barrature scure che s’ingrossano verso il basso mentre i fianchi presentano larghe fasce di color bruno ruggine. Il peso medio è di circa 400 g, con lievi differenze tra maschi e femmine a seconda della fase del ciclo annuale (www.agraria.org).
Il dimorfismo sessuale non è molto spiccato ed è relativo soprattutto ad alcune caratteristiche della livrea. Il maschio infatti ha una macchia bruno scura sul petto a forma di ferro di cavallo comune comunque anche al 50% delle femmine anche se in quest’ultime la macchia è più chiara e solitamente incompleta. Per poter stabilire con certezza il sesso, è necessario osservare la colorazione e la striatura delle penne copritrici, che nei maschi presentano una sola barratura chiara longitudinale, mentre la femmina ne presenta due (Bagliacca et al. 2008).
26
Il piumaggio è principalmente di color grigio azzurro e castano rossiccio, i giovani sono più chiari degli adulti. I pulcini hanno una colorazione fulva con punteggiature e strisce nere (www.wikipedia.it).
COMPORTAMENTO
La starna è una specie “pedinatrice”; nel caso si trovi in pericolo essa si allontana di corsa molto velocemente tenendo la testa alta e si alza in volo solo se minacciata da molto vicino; altre volte, invece, tenta di eludere il pericolo accovacciandosi a terra. Possiede un volo rapido e deciso, diritto e a poca altezza dal suolo, caratterizzato da veloci battiti d'ala e planate. Trascorre la notte dormendo sul terreno, mentre al mattino e nel tardo pomeriggio va in cerca di cibo (www.ittiofauna.org). Di carattere socievole, conduce una vita gregaria ad eccezione che nel periodo della cova; in inverno le famiglie si fondono a formare gruppi plurifamiliari, i “gruppi invernali”; questi possono essere composti anche da più di 30 individui ciascuno. Nel mese di febbraio, nella fase pre-riproduttiva, questi gruppi si disgregano e inizia la formazione delle coppie. Durante questo periodo comincia un’intensa attività di canto ed il loro comportamento assume una forte territorialità. La voce della starna è tipica e produce una nota bassa, metallica, stridente e ritmica. Nel mese di aprile inizia la stagione riproduttiva, con la costruzione del nido che solitamente consiste in una depressione del terreno tappezzata di foglie. La deposizione avviene ad intervalli regolari, di uno due giorni e il totale di uova deposte può variare da 4 a 30, con una media di circa 15 uova a stagione. Le uova vengono covate principalmente dalla femmina e schiudono in circa 23-25 giorni, mentre le nascite sono concentrate in giugno anche se le schiuse possono andare avanti fino ad agosto (www.wikipedia.org). Si ciba soprattutto di sostanze vegetali, come semi di piante coltivate e selvatiche, cereali, frutta, bacche, erbe, foglie, gemme, e, in primavera, anche di insetti e loro larve, ragni, molluschi (ww.ittiofauna.org). Gli habitat preferiti
27
sono solitamente spazi aperti,erbosi o cespugliosi con siepi basse e piccoli boschi (www.wikipedia.org).
DISTRIBUZIONE GEOGRAFICA E HABITAT
La starna ha una distribuzione prevalentemente euroasiatica, anche se nei primi del novecento è stata introdotta in Canada e negli Stati Uniti settentrionali per scopi venatori. La starna è un uccello originario di steppe fredde, l’Italia centrale e i Balcani sono l’area più meridionale in cui vive (www.wikipedia.org). Frequenta zone coltivate alternate a incolti, brughiere, aree steppose e prative parzialmente boscose e cespugliose.
Foto 9: Distribuzione geografica delle sottospecie della starna (Perdix perdix): 1-armoricana, 2-sphagnetorum, 3-hispaniensis,4- italica, 5-belesiae, 6-perdix, 7-lucida, 8-robusta, 9-canescens (Foto da Scarselli et al, 2000)
1.3 RIPRODUZIONE IN CATTIVITÀ
L’allevamento degli animali selvatici non è particolarmente semplice, soprattutto in Italia dove, fatta eccezione per il fagiano, il progresso tecnico sembra non aver agevolato questo tipo di allevamento; questo si deduce dal fatto che, ancora oggi, si continua ad importare animali dall’estero e inoltre dal fatto che il ripopolamento è una tecnica che ancora non è attuata con pieno successo; al contrario, proprio gli
28
animali importati sono stati spesso causa di epidemie che hanno falcidiato la fauna locale (Casanova, 1981). Per questi motivi è importante creare allevamenti che forniscano riproduttori, ovvero soggetti capaci di moltiplicarsi in libertà e ai quali è affidato il compito di adattarsi e moltiplicarsi nei territori in cui verranno liberati, fino a raggiungere una densità tale che ragionevolmente ne permetta la caccia (Manetti, 1980).
1.3.1SCELTADEIRIPRODUTTORI
Il primo passo per l’allevatore è scegliere i riproduttori; in questo caso ci sono tre possibilità: acquistare degli animali adulti da altri allevamenti, procurarsi le uova che andranno poi incubate o prelevare soggetti in natura.
Nel primo caso l’acquisto dei riproduttori adulti andrà condotta presso allevamenti dove gli animali siano sotto controllo delle autorità sanitarie pubbliche, soprattutto per quanto riguarda malattie come la Pullurosi, molto diffusa anche tra i Galliformi. La Pullurosi, anche conosciuta come Diarrea bianca dei pulcini o Diarrea bacillare bianca (BWD), è una delle salmonellosi aviarie un tempo ritenuta flagello della avicoltura mondiale. È inoltre consigliabile, per evitare pericoli di consaguineità, acquistare riproduttori maschi da allevamenti differenti e possibilmente geograficamente distanti da quelli dove si preleveranno le femmine (Casanova, 1981). Gli svantaggi a cui si può andare incontro scegliendo direttamente i riproduttori sono vari, dall’acquisto di soggetti portatori di germi patogeni, all’acquisto di soggetti di scarso pregio.
Nel caso invece si voglia acquistare direttamente le uova, si potranno evitare i suddetti svantaggi; inoltre, il costo per la preparazione di impianti sarà molto minore. In questo caso, però, bisognerà attendere un anno prima di avere la prima cova. Ad un occhio poco esperto è consigliabile intraprendere la prima tecnica e acquistare i volatali adulti (Casanova, 1981).
29
Tenendo conto della diversa etologia e comportamento si distingue il fagiano dalla pernice e starna; comunque, per tutte e tre le specie considerate, si consiglia l’acquisto dei riproduttori entro Gennaio- metà Febbraio preferendo i nati nella primavera precedente (Casanova, 1981).
Il fagiano è per natura poligamo; i soggetti che saranno destinati alla riproduzione devono essere raggruppati in famiglie costituite solitamente da un maschio e cinque femmine (Manetti, 1980), ma in certi casi è possibile anche tenere un rapporto di uno a sette. Il dimorfismo sessuale, come già descritto precedentemente, è molto accentuato in questa specie, quindi nella distinzione tra maschi e femmine non vi saranno problemi; al contrario, bisognerà concentrarsi nella scelta di soggetti in condizioni di salute generale ottimali, vivaci, in buono stato di nutrizione e che nel peso e nella livrea rispettino gli standard.
La pernice e la starna, rispetto al fagiano, sono specie strettamente monogame e pertanto dovranno essere acquistati un numero uguali di maschi e femmine. Come per il fagiano bisognerà esaminare lo stato di salute, di nutrizione, la livrea. Il principale problema in queste due specie è che il dimorfismo sessuale non è molto accentuato, quindi la distinzione tra maschi e femmine può non essere apprezzata facilmente (Casanova, 1981). Vi sono però dei piccoli accorgimenti che possono aiutare nella distinzione. Come abbiamo già descritto, nella starna un metodo per distinguere il maschio dalla femmina può essere quello di osservare le penne copritrici mediane delle ali che si presenteranno di colore rossastro-bruno con una barratura più chiara sovrapposta alla nervatura centrale; nella femmina, invece, le copritrici saranno di colore più bruno e la barratura centrale più chiara si interseca con tre o quattro striature poste trasversalmente (Bagliacca et al., 2008). In generale la livrea nella femmina è più tendente al grigio mentre nel maschio più al rosso; anche il piumaggio del petto e le guance sembrerà più sbiadito. Nella pernice rossa, la distinzione è ancor più difficoltosa e l’unico modo per distinguere il maschio dalla femmina, non sempre valido, è osservare i tarsi che si presenteranno speronati nel
30
maschio; in generale si possono seguire le caratteristiche sessuali secondarie della starna (Casanova, 1981).
La scelta dei riproduttori selvatici da introdurre in allevamento è cambiata nel corso degli ultimi anni. Se prima si sceglievano caratteristiche che meglio si adattassero alle condizioni d’allevamento, come minore aggressività, alta produzione di uova, che rendevano questi animali perfetti alla vita in allevamento, negli ultimi anni questa tendenza è cambiata. Sebbene queste caratteristiche siano vantaggiose dal punto di vista dell’allevatore, bisogna tener conto che questo tipo di allevamento ha fini completamente diversi da quelli che possiamo ritrovare, ad esempio, nell’allevamento di specie domestiche, il cui scopo principale è quello di spingere la produzione al massimo e quindi le caratteristiche che meglio si adattano alle condizioni d’allevamento hanno un senso. In questo tipo di allevamento però il fine è quello di produrre soggetti andranno immessi in natura, e che quindi devono mantenere tutte le caratteristiche di ruralità che gli permetteranno di sopravvivere. Ecco perché, per quanto riguarda i riproduttori, si sceglieranno soggetti dal piumaggio integro e lucente, non solo perché indici di un buono stato di salute, ma perché è dimostrato come questi caratteri siano strettamente legati ad un livello maggiore di androgeni e quindi una maggiore aggressività nel maschio, e nella femmina ad una efficienza ovarica maggiore (Bagliacca et al., 1998).
L’utilizzo, almeno in parte, di riproduttori di origine selvatica, evita diversi svantaggi. Infatti il continuo utilizzo delle covate dello stesso allevamento porta all’instaurarsi di caratteri come l’aumento di pica e cannibalismo, l’aumento del peso individuale, la diminuzione di rusticità; anche la tecnica dello scambio di riproduttori tra gli allevamenti ha prodotto una somiglianza genotipica tra i soggetti dei diversi allevamenti portando ad una minore rusticità di questi animali (Bagliacca
et al., 1998).
Per questo si consiglia di adottare le diverse tecniche per la scelta dei riproduttori e per la rimonta degli stessi.
31
1.3.2 TECNICA DI ALLEVAMENTO IN COPPIA FISSA, PARCHETTO E/O
COLONIA
Nella usuali tecniche di allevamento a partire già da circa un anno di età, con l’approssimarsi dell’epoca degli accoppiamenti, i soggetti scelti per la riproduzione vengono collocati in adatte voliere, denominate “parchetti”. La scelta del luogo è molto importante, bisogna tener conto della anatomia e fisiologia degli animali, scegliendo come fondo il terreno naturale oppure la rete metallica.
L’inizio della deposizione varia a seconda di vari parametri come la specie avicola considerata, le condizioni climatiche locali e fattor individuali, ma solitamente si possono fornire le seguenti date :
• Fagiano : 1-15 aprile
• Starna e pernice rossa : 25- 30 Aprile
E’ importante tener presente che le femmine al secondo o terzo anno di produzione, possono anticipare la data di inizio della deposizione delle uova di circa una settimana o dieci giorni.
Come già sottolineato per altri aspetti, anche per quanto riguarda il rapporto numerico fra i sessi, è necessario tener conto di quello che accade in natura e delle diverse caratteristiche etologiche e comportamentali delle diverse specie. Il fagiano è poligamo e in natura tende a formarsi un piccolo harem, quindi per ogni maschio si formeranno gruppi da un minimo di 5 ad un massimo di 8 femmine, preferendo la prima scelta, poiché un numero eccessivo di femmine può portare alla deposizione di uova infeconde.
Per l’allevamento del fagiano è consigliato un terreno ben permeabile e che rimanga asciutto, per questo sono sconsigliati i terreni argillosi. I parchetti devono essere costruiti in luoghi opportuni, tranquilli ed appartati, lontani dai rumori della vita quotidiana che potrebbero impaurire gli animali, ombreggiati d’estate per evitare
32
temperature eccessive ma non troppo per evitare che il terreno diventi troppo umido (Casanova, 1981).
A seconda della specie in allevamento, si sceglieranno soluzioni di parchetti diversi, in sintonia con la specie e le sue attitudini. I fagiani riproduttori vengono allevati in parchetti a terra, ovvero voliere che abbiano dimensioni tali da permettere 1,5-2,0 mq a capo.
La pavimentazione è costituita dalla sovrapposizione di sabbia ad uno strato m di pietrisco o di ghiaia; la presenza di sabbia ha un ruolo fondamentale, infatti crea una buona superficie di appoggio per le zampe, uno strato assorbente ed impedisce la rottura delle uova deposte. E’ importante delimitare tutto il perimetro del parchetto con un cordolo di cemento interrato nel terreno e da cui sporga per circa 20 cm, sufficiente ad impedire l’accesso ai ratti. Il perimetro e la parte superiore verranno chiusi con una rete che potrà essere anche a maglia larga, in questo caso però bisogna circondare la base per un altezza di circa un metro, con altra rete a maglia fitta. Mentre la rete perimetrale deve essere ben tesa ed ancorata ai pali di sostegno, nella parte superiore deve essere fluttuante, questo impedisce ai fagiani di ferirsi urtandovi contro durante i voli.
In ogni parchetto è disposto un harem ed essendo i diversi parchetti attigui, è bene sistemare delle separazioni visive, questo perché nel maschio la vista delle femmine di un altro harem può determinare una diminuzione di interesse per le femmine a lui assegnate. All’ interno saranno disposti alcuni posatoi a circa 1 m da terra, una mangiatoia a tramoggia rifornibile dall’esterno e un abbeveratoio a sifone o collegato alla rete idrica. Inoltre si devono predisporre dei ricoveri per il riparo degli animali, solitamente circa 2 mq di superficie coperta ogni 5-6 soggetti (Casanova, 1981).
Al contrario del fagiano, la starna e la pernice rossa , sia allo stato libero che in allevamento, sono rigorosamente monogame quindi ad ogni maschio verrà assegnata una sola femmina e ogni coppia sarà inserita nel suo parchetto (Bagliacca
33
allevamento si ricorre all’accoppiamento forzato, ovvero le coppie sono selezionate dall’allevatore; mantenendo separati maschio e femmina fino al periodo dell’accoppiamento ed impedendo loro di vedere altri simili, i due si accettano senza problemi (Casanova, 1981).
Per quanto riguarda la pernice e la starna, i riproduttori vengono allevati in maniera differente a seconda che siano soggetti da ripopolamento o soggetti da rimonta per l’allevamento. In ogni caso l’allevamento dei riproduttori va effettuato esclusivamente in coppie che vengono disposte nelle voliere da riproduzione tra Gennaio e Marzo.
I soggetti destinati alla reintroduzione e ripopolamento vengono allevati a terra e effettuano la cova diretta della prole in appositi parchetti da riproduzione. Essendo destinati alla reintroduzione non sono permessi metodi artificiali per il contenimento della pica, quali debeccaggio, occhiali, parabecco o anelli da becco; solamente è concesso, fino ad una età di 30 giorni, oscurare gli ambienti di allevamento ed eventualmente illuminare le mangiatoie e gli abbeveratoi con fonti di luce calmanti (Bagliacca et al., 1998). L’unico metodo per contenere l’aggressività dei soggetti è un buon inerbimento dei parchetti, una vegetazione sufficientemente fitta con erbe con funzione di rifugio o con funzione alimentare (sorgo, girasole mais e infestanti spontanee). Nel caso del fagiano, deve essere anche presente una vegetazione arbustiva ed arborea, che consenta, in linea con il suo comportamento di passare la notti o di sfuggire ai predatori sugli alberi, di inalberarsi (Bagliacca et al., 1998). Ogni parchetto deve avere una superficie minima 15-20 mq che per metà sarà ricoperta di vegetazione, almeno un mq deve essere adibito con sabbia per permettere i bagni di polvere per l’eliminazione dei parassiti esterni e che verrà sostituita ogni anno, deve essere presente una mangiatoia e un abbeveratoio (Bagliacca et al., 2008).
La copertura del parchetto è data da una rete morbida con un’altezza minima di 4 metri per permettere agli animali di esercitarsi nel volo; ai lati deve essere impedita
34
la visione sia dell’uomo, per minimizzare la familiarizzazione con l’essere umano, che di altri esemplari.
Le voliere a terra devono rispettare una determinata densità di animali al suo interno, per quanto riguarda il fagiano in un’età compresa tra i 30 e i 60 giorni la densità deve essere di un minimo di 0,5 mq/capo, mentre per soggetti di età oltre i 60 giorni deve essere di minimo 1mq/capo; per le pernici e le starne di età compresa tra i 30 e i 60 giorni la densità non deve superare i 0,25 mq/capo (Bagliacca et al., 1998). Prima della fine dell’estate le famiglie devono essere rimosse, i giovani da rimonta trasferiti nelle voliere comuni, in questo modo si può effettuare il tutto vuoto sanitario e la risemina.
Per quanto riguarda invece i soggetti riproduttori (parents), l’allevamento viene effettuato all’aperto o sotto tettoie, in gabbie sopraelevate con fondo in rete metallica. La coppia viene messa insieme tra Dicembre e Gennaio per la starna, e tra Gennaio e Febbraio per la pernice rossa.
Le gabbie hanno dimensioni minime di 30x40 cm con un’altezza minima di 20 cm, possono essere in metallo o in legno, anche in questo caso almeno tre lati devono essere coperti per non permettere la visone di altre coppie e il pavimento è realizzato in rete zincata, mentre la parte superiore è formata da una rete morbida che può permettere la fuoriuscita della testa (Bagliacca et al., 2008).
1.3.3DISINFEZIONE
La disinfezione in avicoltura ha un ruolo fondamentale; mentre la pulizia deve essere garantita sempre, la disinfezione è bene attuarla soprattutto in momenti e luoghi particolari come ad esempio in azienda di produzione, in incubatoio prima dello stoccaggio, all’inizio dell’incubazione e durante quest’ultima. A seconda dei locali in cui ci troviamo e delle varie fasi verranno attuati diversi trattamenti. A partire già dalla prima fase, ovvero in allevamento, la disinfezione dovrà essere attuata periodicamente e si farà distinzione se durante il vuoto sanitario, ovvero quando l’allevamento è senza animali all’interno, o in presenza di animali; nel primo caso
35
non essendoci animali si procederà ad una disinfezione più completa ed aggressiva: verranno rimosse tutte le attrezzature e, tolte le deiezioni, verranno lavate, disinfettate e disinfestate all’esterno dell’allevamento; verrà quindi attuato un lavaggio e una disinfezione liquida prima di reinserire attrezzature e lettiera e si procederà ad una disinfezione gassosa (Sauveur, 1988).
Le operazioni di sanificazione, disinfezione e disinfestazione devono essere attuate anche alle gabbie e alle strutture stesse del capannone con determinati disinfettanti (sali quaternari d’ammonio, iodofori ecc.) e antiparassitari (organofosforici, piretrine e piretro idi ecc.)(Mani, 2008).
Nell’attuare tutte queste operazioni è bene rivolgere particolare attenzione alle zone meno raggiungibili, come gli angoli delle gabbie, le crepe dei muri e dei pavimenti e di tutte quelle aree che possono fungere da rifugio ai parassiti (Mani, 2008).
Per quanto riguarda l’igiene all’interno delle voliere è indispensabile invece il “tutto vuoto” sanitario, si procederà quindi alla disinfezione del terreno con calciocianammide e alla lavorazione profonda dello stesso seguita dalla semina di sorgo, mais a granella piccola e girasole (Mani, 2008). Così facendo si riduce al minimo il rischio di diffusione di malattie protozoarie e parassitarie, inoltre la presenza di queste colture porta notevoli vantaggi come la protezione dalle intemperie, l’apporto di alimenti freschi e granaglie che, oltre ad integrare la dieta, favoriscono l’ambientamento dei soggetti una volta liberati essendo gli stessi che troveranno in natura (Mani, 2008).
Nel caso invece in cui la sanificazione si attui in presenza di animali, si dovrà tener conto della salute di questi ultimi, si procederà quindi ad una nebulizzazione con disinfettanti.
Un altro momento critico è il periodo dell’incubazione. Anche in questo caso si differenzia nuovamente se tra un ciclo e l’altro o in presenza di uova; nel primo caso, in assenza di uova, si attuerà una disinfezione a carico dei locali, delle celle di conservazione, delle celle d’incubazione e quelle di schiusa rimuovendo le
36
attrezzature che verranno lavate e disinfettate all’esterno dei locali prima di essere reinserite all’interno, rimuovendo gusci e piumini, e attuando una disinfezione gassosa (Sauveur, 1988). Se in presenza delle uova invece si procederà con una disinfezione gassosa o nebulizzazione di disinfettanti; non è ammesso il lavaggio delle uova e il Dipping (trattamenti delle uova con antibiotici) (Mani, 2008). Tutti questi trattamenti hanno lo scopo di diminuire le probabilità di contaminazioni sia verticali, ovvero trasmesse direttamente dalla madre all’embrione all’interno dell’uovo, che orizzontali ovvero dal momento in cui l’uovo raggiunge la cloaca, che possono provenire dal tubo digerente (feci), ovidutto, lettiera, materiale da covo, aria (pulviscolo), personale, attrezzature di trasporto e stoccaggio. La profilassi contro la trasmissione orizzontale, prevede che le uova siano disinfettate prima di essere conservate e questo può essere fatto con varie tecniche:
1) Trattamento di fumigazione con formalina gassosa: è la tecnica preferenziale e maggiormente efficace, deve essere praticata subito dopo la deposizione possibilmente prima del raffreddamento delle uova
2) Trattamento con UV: questo trattamento è caratterizzato da un marcato effetto germicida ed ha il vantaggio di non creare col tempo forme di patogeni resistenti
3) Trattamento con ozono 4) Spruzzatura con H2O2
Si ricorda che per effettuare il trattamento con formalina gassosa è obbligatorio attenersi alle relative norme di sicurezza.
La profilassi contro la trasmissione verticale prevede l’infiltrazione di antibiotici che deve essere attuata su uova lavate e disinfettate, utile contro micoplasmi ma anche contro germi penetrati per contaminazione orizzontale (Sauveur, 1988).
1.3.4RACCOLTADELLEUOVA
La raccolta delle uova deve essere effettuata almeno due volte al giorno, in genere a metà mattinata e prima del tramonto; si deve tener presente che anche il momento di
37
deposizione varia da specie a specie, infatti, le fagiane depongono nel tardo pomeriggio mentre la starna e la pernice nelle primissime ore del mattino o della sera (Casanova, 1981). E’ bene evitare una eccessiva permanenza della uova nei parchetti durante le ore più calde. Ad esempio in ambienti e stagioni particolarmente calde, al momento della raccolta delle uova, se la temperatura ambientale supera i 27 °C in allevamento, è bene raccogliere le uova almeno quattro volte al giorno (appunti Bagliacca), questo eviterà all’uovo di permanere ad una temperatura elevata che potrebbe fargli perdere una quantità eccesiva di acqua per evaporazione, e potrebbe far iniziare lo sviluppo embrionale. È consigliata la raccolta delle uova almeno una volta al giorno finchè la temperatura ambientale non supera i 20 °C, temperatura adatta per la dormienza dell’embrione; oltre questa temperatura ambientale è bene effettuare la raccolta almeno due volte al giorno (Bagliacca et al., 2008).
Le uova dopo essere state raccolte non possono essere disposte subito nelle incubatrici, questo perché la deposizione avviene giornalmente e giustificherebbe la messa in funzione dell’incubatrice stessa. Occorre perciò conservarle in modo idoneo fino a che non si sia raggiunto il numero prestabilito per dare inizio all’incubazione. In allevamento può essere utile disporre le uova appena raccolte, con l’apice infilato nella sabbia o nel riso contenuto in una cassetta. Al momento della raccolta e in ogni caso prima di immetterle nell’incubatrice le uova devono essere controllate per vedere se rispondono ai canoni richiesti, in genere infatti le prime uova si scartano perché difettose essendo troppo piccole, oppure con guscio eccessivamente sottile, rugoso o incrinato, è bene scartare le uova con evidenti difetti come forme anomale (Romboli et al., 2008). Appena si incomincia a raccogliere uova che presentino le caratteristiche tipiche richieste della specie, si potrà iniziare la loro raccolta e conservazione per l’incubazione (Casanova, 1981).
Nel caso si trovino uova rotte o frammenti di guscio, è bene accertarsi che non vi sia la possibilità di incursione da parte di animali esterni; appurato questo si può supporre che qualche riproduttore, generalmente la femmina, rompa le uova per
38
cibarsene, in questo caso si consiglia di individuare il colpevole, se si tratta di soggetti di pregio si può procedere alla spuntatura del becco od all’apposizione degli occhiali antipica (Casanova, 1981).
1.3.5CONSERVAZIONEDELLEUOVA
La conservazione è un periodo delicato per lo sviluppo dell’uovo. Analizziamo le condizioni che possono influenzare lo sviluppo durante lo stoccaggio (AA.VV, 2003).
FATTORI CHE INFLUISCONO LO STOCCAGGIO
LUOGO: è consigliato stoccare le uova in ambienti separati dalla stanza dove si trovano le incubatrici sia per motivi igienici, le uova infatti potrebbero essere sporche, sia per differenza di temperatura.
TEMPERATURA: la temperatura è in stretta correlazione alla durata dello stoccaggio, periodi più lunghi di stoccaggio richiedono temperature più basse. Molti studi sono stati condotti per definire la temperatura ottimale durante il periodo di stoccaggio allo scopo di massimizzare la schiusa (Fasenko et al., 2001; Meijerhof, 1992; Proudfoot et al., 1990), studi che mostrano come la temperatura, l’umidità, la durata di stoccaggio e l’orientamento delle uova giochino un ruolo fondamentale nello sviluppo durante lo stoccaggio e l’incubazione. Tutti gli autori sono concordi che lo sviluppo embrionale sia soppresso ad una temperatura definita come lo “zero fisiologico”, ovvero la temperatura in cui non avviene lo sviluppo dell’embrione. In verità lo sviluppo embrionale non è rilevabile con metodi microscopici, ma questo non esclude che vi possano essere processi metabolici cellulari in corso (Fasenko, 2007). Lo “zero fisiologico” si considera intorno ai 20-21 °C e fino a temperature più alte 26,7 °C , 28-29 °C, la spiegazione al fatto che il “range” sia così esteso può trovar luogo nei diversi e più moderni metodi di determinazione di sviluppo degli embrioni, dalla scelta di uova fresche o meno (Fasenko, 2007; Souveur, 1988).
39
Le uova durante lo stoccaggio devono quindi essere mantenute ad una temperatura al di sotto dei 20-21 °C, al di sotto dello zero fisiologico, per mantenere la dormienza dell’embrione, in particolare per lunghe conservazioni (oltre i 7 giorni) è consigliata una temperatura di 12-15 °C, per conservazioni più brevi (3-7 giorni) è consigliata una temperatura di 16-18 °C (Souveur, 1988). Inoltre le basse temperature hanno lo scopo di prevenire la crescita batteriche (Fasenko, 2007).
La temperatura influisce anche sul PH che aumenta da 7,6 prima della deposizione a 9,0-9,5, questa stabilizzazione avviene più o meno velocemente a seconda della temperatura ambientale, equilibrandosi in 6-8 giorni alla temperatura di 10-12 °C, o in 3-4 giorni alla temperatura di 16-18 °C (Souveur, 1988).
Prendendo in considerazione un periodo di stoccaggio di 9 giorni, si riconoscono due fasi differentemente sensibili alla temperatura, dal giorno 1-3 l’abbassamento di temperatura fino ai 12-13 °C influisce negativamente sulla schiusa delle uova diminuendola; al contrario dal giorno 6-9 l’abbassamento di temperatura ha effetto opposto aumentando la schiusa, questo potrebbe essere dovuto all’eliminazione di germi più deboli nei primissimi stadi di sviluppo a causa dello stress da raffreddamento; inoltre anche il peso corporeo alla schiusa aumenta con l’abbassamento della temperatura durante il periodo di stoccaggio mentre risulta diminuito col prolungarsi di questo periodo, anche se questo dato potrebbe essere falsificato per la perdita degli embrioni più deboli e meno sviluppati per lo stress da raffreddamento (Rao, 1989).
DURATA CONSERVAZIONE: la durata dello stoccaggio è strettamente correlata alla temperatura come già illustrato, inoltre maggiore è la durata della conservazione, minore sarà la schiusa e maggiore sarà la durata dell’incubazione (Souveur, 1988). Studi condotti su uova di pollo stoccate per 2, 4, 6, 8, 10, 12, 14, e 16 giorni hanno dimostrato come lo stoccaggio fino a 8 giorni non influisca la schiusa, mentre oltre questo periodo si nota una significativa diminuzione della schiusa