1
UNIVERSITÀ DI PISA
FACOLTÀ DI MEDICINA E CHIRURGIA
Dipartimento di Neuroscienze
SEZIONE DI OFTALMOLOGIA
Direttore: Prof. Marco NardiCorso di Laurea Specialistica in Medicina e Chirurgia
Tesi di Laurea
VARIAZIONI A BREVE TERMINE DELLA
PRESSIONE ENDOCULARE DOPO
FACOEMULSIFICAZIONE IN PAZIENTI
CON GLAUCOMA
Candidato: Relatori:
Annalisa Di Giacomo Chiar.mo Prof. Marco Nardi
Chiar.mo Dr. Michele Figus
2
Indice
VARIAZIONI A BREVE TERMINE DELLA PRESSIONE
ENDOCULARE DOPO FACOEMULSIFICAZIONE IN PAZIENTI
CON GLAUCOMA ... 4 Riassunto ... 4 INTRODUZIONE ... 6 LA CATARATTA ... 6 Definizione ed epidemiologia ... 6 Classificazione ... 6 Diagnosi ... 23 Terapia chirurgica ... 24 IL GLAUCOMA ... 46 Definizione ed epidemiologia ... 46 Classificazione ... 49 Diagnosi ... 54 Terapia ... 56 TECNICHE ... 75
CHIRURGIA DELLA CATARATTA ... 75
Cenni al passato ... 75
Facoemulsificazione ... 78
IL TONO ENDOCULARE E MECCANISMI DI MISURAZIONE ... 87
Tono oculare ... 87
Fattori modificanti ... 87
Calcolo della IOP ... 90
STUDIO CLINICO ... 97
Introduzione ... 97
Metodi ... 98
Risultati ... 101
3 BIBLIOGRAFIA ... 106
4
VARIAZIONI A BREVE TERMINE DELLA
PRESSIONE ENDOCULARE DOPO
FACOEMULSIFICAZIONE IN PAZIENTI CON
GLAUCOMA
RIASSUNTO
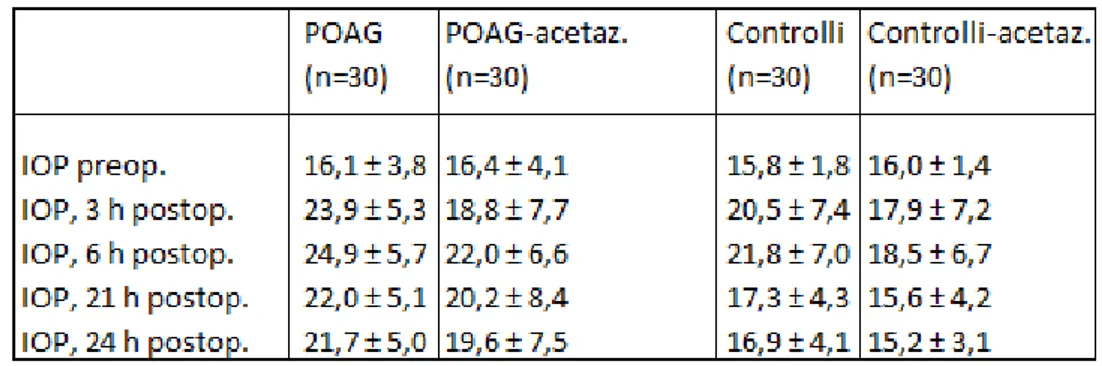
Obiettivo: scopo dello studio è valutare le variazioni a breve termine della pressione endoculare dopo facoemulsificazione in pazienti affetti da glaucoma e non, e gli effetti dell’acetazolamide nel
controllare la pressione endoculare in questi pazienti. Metodo: in questo studio prospettico multicentrico (hanno
partecipato 6 cliniche oculistiche universitarie) sono stati inclusi 120 pazienti che dovevano essere sottoposti ad un intervento chirurgico per la cataratta: 60 affetti da glaucoma primario ad angolo aperto (POAG) ben controllato e 60 di controllo. Metà dei pazienti hanno ricevuto acetazolamide (250 mg) per os a distanza di 1 e 6 ore dopo l’intervento. Entrambi i gruppi di pazienti, quelli trattati con acetazolamide e quelli a cui invece non è stata somministrata, son stati classificati in base all’età e alla densità della cataratta. Tutti i pazienti son stati sottoposti ad una procedura standard di facoemulsificazione: è stata misurata loro la pressione endoculare, mediante il tonometro di Goldmann, la mattina stessa dell’intervento e successivamente a 3, 6, 21 e 24 ore post-operatorie.
Risultati: i pazienti con POAG hanno mostrato un incremento significativo della pressione endoculare dopo l’intervento ad ogni tempo di misurazione. Il 20% (6 su 30) dei pazienti con POAG non trattati con acetazolamide hanno registrato almeno un valore di
5 pressione endoculare oltre i 30mmHg. Nei pazienti trattati, invece, l’acetazolamide ha determinato una riduzione marcata della pressione endoculare nel post-operatorio, i cui valori non hanno mai superato i 30mmHg. Il gruppo di controllo presentava alti valori di pressione endoculare nelle prime 6 ore dopo l’intervento con successiva normalizzazione.
Conclusioni: un significativo incremento a breve termine della pressione endoculare dopo facoemulsificazione viene riscontrato sia in pazienti con POAG che in pazienti normali; questo incremento pressorio non risulta pericoloso nei pazienti non glaucomaotsi mentre potrebbe esserlo nei pazienti con POAG. L’utilizzo dell’acetazolamide per via sistemica permette un adeguato controllo della IOP e potrebbe rappresentare uno standard terapeutico nel management post-operatorio dei pazienti con POAG operati di cataratta.
6
INTRODUZIONE
LA CATARATTA
DEFINIZIONE ED EPIDEMIOLOGIA
La cataratta è una patologia caratterizzata dall’opacizzazione del cristallino e rappresenta la prima causa di cecità nel mondo. Stime della Organizzazione Mondiale della Sanità (OMS) rivelano che la cataratta è responsabile del 50% dei casi di cecità reversibile nel mondo, causando la perdita della vista in circa 20 milioni di persone. L’incidenza di questa patologia aumenta con l’età, arrivando ad interessare più del 65% dei soggetti oltre gli 85 anni. Nei paesi in via di sviluppo (Asia, Africa) la percentuale di soggetti che arrivano a perdere la vista a causa della cataratta è significativamente maggiore rispetto ai paesi con adeguate condizioni socio-economiche per il fatto che non possono avvalersi della chirurgia, che a tutt’oggi rappresenta l’unica terapia per il trattamento della cataratta (1).
CLASSIFICAZIONE
La cataratta può essere classificata in base a diversi parametri. A seconda dell’epoca di insorgenza: che sia presente fin dalla nascita o che
sia insorta in un periodo successivo, classifichiamo la cataratta in: Acquisita
Congenita
Nell’ambito della cataratta acquisita, questa può essere classificata in base al meccanismo eziopategentico in :
7 Cataratta secondaria a traumi
Cataratta secondaria a trattamenti farmacologici Cataratta secondaria a malattie sistemiche
Cataratta secondaria a patologie oculari primitive
Cataratta senile
E’ il tipo di cataratta più diffuso: l’allungamento della vita media e il miglioramento delle tecniche diagnostiche hanno determinato un aumento di incidenza di questa patologia.
Esistono diversi sottotipi morfologici di cataratta senile: Cataratta sottocapsulare
La cataratta sottocapsulare anteriore è localizzata subito sotto la capsula del cristallino ed è associata a metaplasia fibrosa dell’epitelio lenticolare. La cataratta sottocapsulare posteriore, che si presenta davanti alla capsula posteriore, si manifesta con opacità simili a vacuoli, granuli o placche alla biomicroscopia con lampada a fessura, mentre in retroilluminazione appare nera. A causa della localizzazione centrale sull’asse visivo, un’opacità sottocapsulare posteriore provoca una maggiore riduzione dell’acuità visiva rispetto ad una cataratta nucleare o corticale. La visione da vicino è solitamente più compromessa rispetto a quella da lontano. I pazienti sono particolarmente infastiditi in condizioni di miosi, come quella prodotta dai fari delle automobili nella guida notturna o alla luce del sole.
Cataratta nucleare
Inizia con un’accentuazione dei processi fisiologici di invecchiamento a carico del nucleo del cristallino. Si associa spesso alla comparsa di miopia secondaria ad un aumento dell’indice refrattivo del nucleo del cristallino e dell’aberrazione sferica. Di conseguenza alcuni pazienti anziani riescono nuovamente a leggere senza necessità di utilizzare gli occhiali (“seconda vista dell’anziano”). La sclerosi nucleare è caratterizzata, nello stadio
8 iniziale, da un ingiallimento secondario alla deposizione di pigmento uro-cromatico. Questo tipo di cataratta viene valutato meglio mediante la biomicroscopia con lampada a fessura obliqua piuttosto che con la retroilluminazione. Nel caso di forme avanzate il nucleo appare di colore marrone (cataratta brunescente). Dal punto di vista chirurgico queste forme di cataratta, di consistenza più dura, risultano più impegnative.
Cataratta senile: a) Sottocapsulare posteriore; b)Sottocapsulare posteriore in
retroilluminazione; c) Nucleare; d) Nucleare in retroilluminazione
Cataratta corticale
Può coinvolgere la corticale anteriore, posteriore o equatoriale. Questa forma inizia con la presenza di fessure e vacuoli tra le fibre del cristallino, dovuti all’idratazione della corteccia. Successivamente l’opacizzazione assume il classico aspetto cuneiforme (a cuneo) o radiale (a raggiera), che inizia solitamente nel quadrante infero-nasale. Spesso i pazienti con cataratta corticale riferiscono abbagliamento in presenza di luce diffusa.
9 Cataratta ad “albero di Natale”
Poco frequente, è caratterizzata dalla presenza di depositi policromatici, simili ad aghi, nella parte profonda della corticale e nel nucleo; i depositi si possono presentare singolarmente o in associazione ad altre opacità.
Cataratta senile: a) Corticale; b) In retroilluminazione; c) Ad albero di Natale; d) In
retroilluminazione
La cataratta senile può inoltre essere classificata in base all’evoluzione: Cataratta non matura
Viene definita cataratta non matura un’opacizzazione non completa, e quindi parziale, del cristallino. Il deficit visivo risulterà correlato al grado e alla sede di opacizzazione.
Cataratta matura
In questa forma il cristallino risulta completamente opacizzato: il deficit visivo sarà totale.
10 Cataratta ipermatura
Il quadro della cataratta ipermatura è caratterizzato dalla presenza di pieghe e corrugamenti della capsula anteriore, secondari all’accumulo di acqua nel cristallino.
Cataratta morgagnana
Si tratta di una forma ipermatura in cui la liquefazione totale della corticale permette al nucleo di scivolare inferiormente.
Classificazione della cataratta in base all'evoluzione: a) Matura; b) Ipermatura con
corrugamento della capsula anteriore; c) Morgagnana con liquefazione della corticale e scivolamento inferiore del nucleo; d) Liquefazione totale della corticale e scivolamento
11
Cataratta secondaria a traumi
La cataratta può insorgere in seguito a traumi oculari contusivi o penetranti, all’esposizione a raggi infrarossi (cataratta dei soffiatori di vetro) o radiazioni ionizzanti, a shock elettrico.
Traumi contusivi
La cataratta conseguente a traumi contusivi è caratterizzata dalla comparsa di opacità assiali posteriori classicamente di forma stellata, che possono rimanere stabili oppure andare incontro a progressione con peggioramento del deficit visivo. Un trauma contusivo determina lesioni da impatto diretto e da contraccolpo: le lesioni dirette sono responsabili della comparsa dell’anello di Vossius, che si può talvolta ritrovare a livello della capsula lenticolare anteriore come conseguenza del deposito di pigmenti iridei in seguito all’impatto tra la faccia anteriore del cristallino e la faccia posteriore dell’iride. Le lesioni da contraccolpo sono da attribuirsi all’effetto lesivo delle onde meccaniche che si creano in seguito ad un insulto a distanza e che viaggiano lungo la linea di concussione. Quando la superficie anteriore dell’occhio viene colpita bruscamente si verifica un rapido accorciamento del diametro antero-posteriore del globo oculare e contemporaneamente un allungamento del diametro equatoriale: questo stiramento equatoriale può comportare una lacerazione del cristallino, delle fibre della zonula o di entrambi. La combinazione di lesioni dirette, da contraccolpo e dello stiramento equatoriale è responsabile della formazione di cataratta traumatica.
12 Traumi penetranti
Nel caso invece di traumi penetranti con lacerazione della capsula lenticolare si verificano alterazioni del cristallino che possono rimanere stabili se di modesta entità, ma che tendenzialmente progrediscono fino all’opacizzazione corticale totale. Dislocazione e sublussazione del cristallino sono reperti che si ritrovano comunemente in associazione con la cataratta di origine traumatica, insieme a facolisi, emorragia retrobulbare, ipoema, neuropatia ottica traumatica, distacco di retina, blocco pupillare, glaucoma ad angolo chiuso, rottura del globo oculare (2).
Cause di cataratta traumatica: a) Trauma penetrante; b) Trauma da impatto; c) Shock
elettrico e folgorazione; d) Radiazioni infrarosse (cataratta dei soffiatori del vetro); e) Radiazioni ionizzanti
13
Cataratta secondaria a trattamenti farmacologici
Il fatto che farmaci quali i corticosteroidi, la fenotiazina e i miotici siano correlati all’insorgenza di cataratta è ben noto ormai da decenni. Ulteriori associazioni con opacità lenticolari sono state riportate meno frequentemente in seguito a terapia con citostatici, deferoxamina, fenitoina, isotretinoina, contraccettivi orali, allopurinolo, agenti antimalarici sintetici, diazepam, tetracicline e sulfamidici. In seguito ad osservazioni sperimentali si pensa che anche altri farmaci possano rivelarsi catarattogeni. Tra tutti i farmaci, quelli che più frequentemente determinano l’insorgenza di cataratta nell’ambito degli effetti collaterali sono sicuramente i corticosteroidi (3).
Cataratta nelle malattie sistemiche
Sono molte le patologie sistemiche che si correlano all’insorgenza della cataratta.
Diabete mellito
Il diabete mellito è responsabile non solo della cataratta ma anche di modificazioni dell’indice refrattivo del cristallino, nonché dell’ampiezza dell’accomodazione. La cataratta diabetica classica è rara: l’iperglicemia che caratterizza la malattia è responsabile di elevati livelli di glucosio nell’umor acqueo, che diffonde nel cristallino. A livello della lente, il glucosio viene metabolizzato in sorbitolo dall’enzima aldoso-reduttasi; il sorbitolo si accumula nel cristallino causando un’iperidratazione osmotica della lente. Nelle forme lievi questa condizione altera l’indice refrattivo, provocando fluttuazioni della refrazione direttamente proporzionali al livello di glucosio nel plasma (miopia da iperglicemia). Si possono formare vacuoli corticali fluidi che evolvono, con il tempo, in franche opacità. La caratteristica della cataratta diabetica classica è la presenza di opacità corticali “a fiocchi di neve”, tipica dei pazienti diabetici giovani. Questa forma di cataratta può scomparire in modo spontaneo oppure maturare in alcuni giorni. Parallelamente, nell’ambito della popolazione dei pazienti
14 diabetici, la cataratta senile si presenta più precocemente, manifestandosi con opacità nucleari che tendono a progredire rapidamente.
Distrofia miotonica
Circa il 90% dei pazienti affetti da distrofia miotonica sviluppa, nel corso della terza decade di vita, opacità corticali iridescenti. Tali opacità non sono associate a compromissione funzionale ma evolvono in una cataratta sottocapsulare posteriore stellata nella quinta decade con conseguente impedimento funzionale. Occasionalmente la cataratta può precedere la miotonia.
Dermatite atopica
Circa il 10% dei pazienti affetti da dermatite atopica grave sviluppa cataratta tra la seconda e la quarta decade di vita. Le opacità sono spesso bilaterali e hanno la tendenza a maturare velocemente. La caratteristica di questa forma è la presenza di una placca sottocapsulare anteriore densa, a scudo, che crea pieghe nella capsula anteriore. E’ possibile riscontrare anche opacità sottocapsulari posteriori che ricordano una cataratta complicata.
15 Neurofibromatosi di tipo 2
La neurofibromatosi di tipo 2 è associata ad opacità corticali posteriori o sottocapsulari posteriori.
Cataratta nelle malattie sistemiche: a) Opacità corticali "a fiocchi di neve nel diabete"; b)
Cataratta diabetica avanzata; c) Cataratta sottocapsulare posteriore stellata nella distrofia miotonica; d) Cataratta avanzata sinistra in paziente con distrofia miotonica; e) Cataratta avanzata bilaterale in paziente con dermatite atopica; f) Cataratta a scudo sottocapsulare
anteriore in dermatite atopica Cataratta secondaria a patologie oculari primitive
La cataratta secondaria (complicata) si manifesta come conseguenza di molti altri disturbi oculari primitivi.
Uveite cronica anteriore
L’uveite cronica anteriore è la causa più frequente di cataratta secondaria. L’incidenza è correlata alla durata dell’infiammazione intraoculare che si traduce in un’interruzione persistente della barriera sangue-acqueo o
16 sangue-vitreo. Un ruolo importante è svolto anche dall’utilizzo di steroidi, topici o per via sistemica. Il segno precoce è la presenza di un riflesso lucente policromatico al polo posteriore del cristallino, che non va incontro a progressione se l’uveite viene arrestata. Al contrario, in caso di persistenza dell’infiammazione, si sviluppano opacità anteriori e posteriori che possono progredire. La presenza di sinechie posteriori sembra essere un fattore che predispone ad una più rapida progressione dell’opacità.
Glaucoma congestizio acuto ad angolo chiuso
Il glaucoma congestizio acuto ad angolo chiuso può causare la formazione di piccole opacità grigio-bianche anteriori, sottocapsulari o capsulari, in campo pupillare: queste opacità rappresentano aree di infarto localizzato dell’epitelio del cristallino e sono patognomoniche di un pregresso attacco di glaucoma acuto ad angolo chiuso.
Miopia elevata
La miopia elevata (patologica) è associata ad opacità lenticolari sottocapsulari posteriori e a sclerosi nucleare ad esordio precoce, che aumentano l’errore refrattivo miotico. La miopia semplice, tuttavia, non è associata alla formazione di tale cataratta.
17 Distrofie retiniche ereditarie
Le distrofie retiniche ereditarie, come la retinite pigmentosa, l’amaurosi congenita di Leber, l’atrofia girata e la sindrome di Stickler, possono essere associate allo sviluppo di opacità sottocapsulari posteriori. L’intervento di estrazione di cataratta può in alcuni casi migliorare l’acuità visiva anche in presenza di gravi alterazioni retiniche.
Cataratta secondaria: a) Cataratta sottocapsulare posteriore precoce uveitica; b) Opacità
anteriori uveitiche; c) Estese sinechie posteriori e opacità lenticolari anteriori; d) Glaukomflecken
Cataratta congenita
La cataratta congenita ha un’incidenza di 3:10.000 nati vivi: nei due terzi dei casi è bilaterale. La causa della cataratta può essere identificata nel 50% dei casi che presentano opacità bilaterali. La più comune è riconducibile ad una mutazione genetica, solitamente autosomica dominante. Le altre cause sono rappresentate da anomalie cromosomiche, come la sindrome di Down, disturbi del metabolismo come la galattosemia e danni intrauterini come l’infezione rubeolica. Anche l’aniridia può associarsi alla presenza di
18 cataratta congenita. Le cause della cataratta congenita unilaterale rimangono ancora poco chiare e sono state identificate con precisione soltanto nel 10% dei casi. In genere si tratta di forme sporadiche, senza evidenza di familiarità o associazione a malattie sistemiche, che nella maggior parte dei casi compaiono in neonati a termine sani. L’associazione più frequente
riscontrata è con la persistenza del vitreo primario iperplastico. Esiste una forma particolare, la cataratta ereditaria congenita, che
rappresenta circa il 25% dei casi. La modalità di trasmissione è più frequentemente autosomica dominante, ma può essere anche autosomica recessiva o X-linked. I genitori e i discendenti presentano analogie nella morfologia delle opacità e spesso anche nell’indicazione alla chirurgia. Sono stati mappati circa 10 loci per la cataratta AD. La forma isolata si accompagna ad una prognosi visiva migliore rispetto alla forma associata ad altre patologie oculari o a malattie sistemiche: infatti queste forme sono spesso parziali alla nascita. Per tale motivo l’intervento chirurgico viene effettuato quando il bambino è più grande, quando le complicanze correlate all’intervento sono inferiori e la correzione del difetto refrattivo residuo risulta più agevole.
Le caratteristiche morfologiche della cataratta congenita sono importanti perchè possono essere indicative dell’eziologia, della modalità di trasmissione e degli effetti sulla vista:
Opacità nucleari
Sono confinate al nucleo embrionario o fetale del cristallino e possono
essere dense o pulverulente e fini (simili alla polvere). Opacità lamellari
Interessano una particolare lamella del cristallino sia anteriormente sia posteriormente e in alcuni casi sono associate ad un’estensione radiale, detta a cavaliere. Possono essere a trasmissione AD e si presentano in modo
19 isolato oppure in neonati affetti da malattie metaboliche e infezioni intrauterine.
Cataratta coronarica (sopranucleare)
E’ localizzata nella corticale profonda e circonda il nucleo come una corona;
è solitamente sporadica e solo occasionalmente ereditaria. Opacità puntiformi bluastre (cataratta puntata cerulea)
Sono comuni, non compromettono la visione e possono associarsi ad altre
forme di cataratta. Opacità suturale
Segue le suture anteriori e posteriori a Y. Si presenta isolata o associata ad
altre forme di opacità. Cataratta polare anteriore
Può essere piatta oppure proiettarsi come un cono in camera anteriore (cataratta piramidale). Nel primo caso le opacità sono centrali, di diametro inferiore a 3 mm, bilaterali in un terzo dei casi e senza ripercussioni funzionali. Le opacità piramidali sono spesso circondate da un’area di opacità corticale e possono ridurre l’acuità visiva. Occasionalmente entrambe le forme di cataratta polare anteriore si possono associare a persistenza della membrana pupillare, aniridia, anomalia di Peters e
lenticono anteriore. Cataratta polare posteriore
Si può associare talvolta alla persistenza della membrana ialoidea, lenticono
posteriore e persistenza del vitreo primario iperplastico. Opacità “a goccia d’olio” centrali
20 Cataratta membranosa
E’ una forma rara e può essere associata alla sindrome di Hallermann-Streiff-Francois. Si manifesta quando il materiale lenticolare riassorbito in parte o in toto lascia formazioni bianche come il gesso comprese tra la capsula anteriore e quella posteriore.
Molte condizioni pediatriche sistemiche si possono associare alla presenza di cataratta congenita. La grande maggioranza è estremamente rara.
Metaboliche
1. Galattosemia: è caratterizzata da una grave compromissione dell’utilizzo del galattosio causata dalla mancanza dell’enzima galattosio-1-fosfato uridiltransferasi (GUPT). L’ereditarietà è di tipo AR. Le manifestazioni sistemiche di questa grave patologia compaiono durante l’infanzia e includono deficit della crescita, letargia, vomito e diarrea. L’esame delle urine dopo assunzione di latte permette di identificare la sostanza riducente. L’eliminazione di latte e derivati dalla dieta consente di evitare l’insorgenza di epatosplenomegalia, insufficienza renale, anemia, sordità e handicap mentale. La patologia può condurre all’exitus se non vengono adottate le adeguate precauzioni. La cataratta si presenta come un’opacità “a goccia d’olio” centrale che si sviluppa nei primi giorni o nelle prime settimane di vita in un’ampia percentuale di pazienti. L’eliminazione del galattosio dalla dieta previene la progressione della cataratta e induce una regressione delle modificazioni iniziali del cristallino.
2. Sindrome di Lowe (oculo-cerebro-renale): si tratta di un errore congenito del metabolismo degli aminoacidi trasmesso con modalità X-linked, ragion per cui colpisce prevalentemente soggetti di sesso maschile. Le manifestazioni sistemiche includono l’handicap mentale, la sindrome di Fanconi (a carico del tubulo renale prossimale), l’ipotonia muscolare, la fronte prominente e gli occhi incavati. E’ una delle poche condizioni in cui
21 cataratta e glaucoma congeniti posso coesistere. La cataratta è sempre presente: il cristallino, piccolo, sottile e simile a un disco (microfachia) può essere caratterizzato da lentiglobo posteriore. La cataratta può essere capsulare, lamellare, nucleare o totale. I soggetti di sesso femminile affetti da questa sindrome manifestano piccole lesioni corticali puntiformi, senza compromissione visiva. Il glaucoma congenito è presente nel 50% dei casi. 3. Altri disordini metabolici associati alla cataratta congenita sono l’ipoparatiroidismo, lo pseudoiperparatiroidismo, la mannosidasi, la malattia di Fabry, l’ipoglicemia e l’iperglicemia.
Infezioni intrauterine
1.Rosolia congenita: si associa a cataratta nel 15% dei casi. Il virus non è in grado di oltrepassare la capsula lenticolare dopo il sesto mese di gestazione, pertanto la lente diventa immune. Sebbene le opacità lenticolari (mono- o bilaterali) siano di solito presenti alla nascita, possono occasionalmente svilupparsi dopo molte settimane o mesi. Le opacità possono essere nucleari, di aspetto denso e perlato, oppure coinvolgere diffusamente tutto il cristallino. Il virus può persistere nella lente fino a 3 anni dopo la nascita. 2.Altre infezioni intrauterine che possono associarsi alla cataratta sono la toxoplasmosi, la varicella, l’infezione da CMV e da HSV.
Anomalie cromosomiche
1.Sindrome di Down (trisomia21): le manifestazioni cliniche includono handicap mentale, fessure palpebrali inclinate verso l’alto, piega epicantale, prognatismo, brachicefalia con conseguente appiattimento occipitale, mani corte e larghe e lingua protrudente. La cataratta si presenta circa nel 5% dei pazienti; le opacità, di vario tipo, sono solitamente simmetriche e si manifestano nella tarda infanzia.
22 2.Altre anomalie cromosomiche associate alla cataratta sono la sindrome di Patau (trisomia 13) e la sindrome di Edwards (trisomia 18).
23 DIAGNOSI
Negli stadi iniziali la cataratta ha minimi effetti sulla visione. Con il progredire della malattia i sintomi diventano più importanti: visione offuscata, visione doppia o entrambe, che possono rappresentare la prima manifestazione della patologia; le immagini possono apparire ingiallite e i colori meno vivaci; la lettura può diventare difficoltosa a causa della diminuzione del contrasto tra le lettere e lo sfondo; incremento della miopia e necessità di cambiare frequentemente occhiali: questo effetto può temporaneamente controbilanciare la presbiopia determinando un miglioramento della vista (“seconda vista dell’anziano”). Questo miglioramento svanisce progressivamente con l’avanzare della cataratta, al punto che neanche occhiali più potenti riusciranno a correggere la vista del paziente. Insorge fotosensibilizzazione che può rendere difficoltosa o addirittura impossibile la guida notturna a causa dell’abbagliamento provocato dai fari delle auto (pazienti con cataratta sottocapsulare posteriore diffusa risultano particolarmente sensibili all’abbagliamento causato dalle luci notturne per il fatto che il fascio di luce diffonde attraverso il cristallino opacizzato); nei casi molto avanzati la pupilla, che normalmente è nera, risulta lattescente o giallastra: la vista dei pazienti a questo stadio della malattia risulta molto compromessa, tanto che riescono a distinguere solamente luci ed ombre (4).
Per porre diagnosi sarà necessario effettuare alcuni esami dopo aver condotto un’accurata anamnesi volta alla valutazione dei sintomi riferiti dal paziente e alla loro eventuale evoluzione nel tempo.
Dovranno essere svolti test per valutare:
1. L’acuità visiva: si tratta di esaminare la capacità di un soggetto di distinguere elementi separati di un determinato target e identificarli come un insieme. Essa è quantificata come l’angolo minimo di
24 separazione (sotteso al punto nodale dell’occhio) tra due oggetti che permette di percepirli come separati. L’esame dell’acuità visiva condotto con ottotipi che utilizzano i caratteri di Snellen o con un sistema Log Mar, ci indirizza sulla perdita funzionale dell’occhio e quindi sui tempi necessari per programmare il prossimo controllo o l’intervento di facoexeresi.
2. Biomicroscopia con lampada a fessura: l’esame deve essere condotto dopo aver dilatato la pupilla. Ci permette di valutare l’entità delle opacità e la loro sede e quindi il tipo di cataratta.
3. Sensibilità al contrasto: è una misura della quantità minima di contrasto necessaria per riconoscere un oggetto in esame. La cataratta modifica la sensibilità al contrasto alle medie ed alte frequenze spesso indipendentemente dalla acuità visiva residua del paziente.
TERAPIA CHIRURGICA
Valutazione pre-operatoria
Quando un paziente è affetto da cataratta, oltre ai comuni esami che una generica visita richiede (esame alla lampada a fessura, cheratometria, esame del visus, tonometria, oftalmoscopia), occorre eseguire altre indagini come la biometria, la tomografia a coerenza ottica (OCT), la gonioscopia e la topografia.
Biometria
Misura la distanza fra le strutture anatomiche. Nella comune pratica clinica l’ecobiometria serve a misurare la lunghezza assiale di un occhio che si appresta ad essere sottoposto ad un intervento per un impianto di cristallino artificiale.
25 anteriore della cornea, la superficie anteriore del cristallino, la superficie posteriore del cristallino,la superficie anteriore della retina. In realtà il biometro registra solo l’intervallo di tempo tra la ricezione di un eco e la ricezione dell’altro eco. Conoscendo la velocità degli ultrasuoni nelle varie parti dell’occhio, l’apparecchio determina la distanza che ci interessa. L’esame biometrico è considerato fondamentale nella fase pre-chirurgica per i pazienti che debbano sottoporsi all’impianto di un cristallino artificiale, sia esso post-cataratta, sia correttivo di un difetto rifrattivo, in quanto tutte le formule di calcolo del valore della lente artificiale si basano sul parametro della lunghezza dell’occhio.
L’estrazione chirurgica del cristallino sottrae circa 20D al sistema refrattivo oculare. L’occhio afachico è molto ipermetrope: la moderna chirurgia della cataratta prevede l’impianto di una lente intraoculare (IntraOcular Lens, IOL), nella stessa posizione del cristallino estratto. La biometria permette di eseguire il calcolo del potere della lente per raggiungere l’emmetropia oppure, in alternativa, la refrazione postoperatoria desiderata. Nella sua forma più semplice, la biometria coinvolge due parametri oculari: (a) la cheratometria, che corrisponde alla curvatura della superficie anteriore della cornea (meridiano più curvo e più piatto), espressa in diottrie o millimetri di raggio di curvatura; (b) la lunghezza assiale, che rappresenta la dimensione antero-posteriore espressa in millimetri e che può essere misurata con i metodi illustrati di seguito.
1. Biometria ultrasonica A-scan: l’onda ultrasonica attraversa l’occhio e, dopo aver urtato contro le strutture intraoculari, ritorna alla sonda. Il tempo di ritorno consente di produrre un tracciato visualizzato sul monitor. Tale esame può essere effettuato a contatto diretto o, in modo più preciso, utilizzando il metodo ad immersione, che prevede l’utilizzo di un bagno liquido in modo tale che la sonda non tocchi la cornea: dopo l’istillazione di un collirio anestetico viene posizionata
26 una coppa sclerale riempita con soluzione acquosa. Sul tracciato si possono identificare le varie strutture oculari e si può misurare la distanza dalla superficie anteriore della cornea dalla retina. La massima riflessione dell’onda ultrasonica viene ottenuta quando l’asse del fascio ultrasonico è allineato con l’asse visivo. Sul monitor dell’oscilloscopio, ciascuno spike del tracciato rappresenta un’eco riflessa. Per poter ottenere misurazioni precise e affidabili è necessaria una certa esperienza da parte dell’operatore.
2. Zeiss IOL Master: è un metodo non a contatto in cui si utilizzano due fasci laser coassiali e parzialmente coerenti che producono un pattern di interferenza (interferometria a coerenza parziale). La riproducibilità delle misurazioni è ottima e non dipende dall’abilità dell’operatore come nel caso della biometria ultrasonica. Lo IOL Master è un sistema biometrico completo che consente anche di realizzare la cheratometria, di misurare la profondità della camera anteriore e il diametro corneale, ed è dotato di formule per il calcolo del potere della lente. E’ possibile inoltre immagazzinare i dati e confermare la costante A. Infine, tale metodo consente di effettuare l’analisi dell’occhio afachico, pseudoafachico e riempito di silicone, mentre il suo utilizzo è più limitato in presenza di opacità sottocapsulari dense.
3. Formule per il calcolo del potere della lente: esistono numerose formule che includono parametri addizionali, come la profondità della camera anteriore e il “ fattore chirurgico” individuale, e sono state sviluppate per ottimizzare l’accuratezza della refrazione desiderata.
4. Costante A personalizzata: è il processo che consente di calcolare con precisione la messa a punto della lente. Il calcolo della costante A si basa sul confronto con almeno 20 casi di occhi medi. Tale funzione è già incorporata nella maggior parte degli apparecchi
27 biometrici moderni. Per esempio, se nella maggior parte dei casi si riscontra un errore costante di +1D, si può utilizzare una nuova costante A personalizzata per migliorare gli esiti dell’intervento.
Biometria: a) IOL master; b) Scansione ideale; c) Biometria ultrasonica A-scan a contatto
diretto; d) Una scansione tipica
OCT
Il Visante OCT è uno strumento di ultima generazione che attraverso una fonte luminosa prodotta da un diodo ad alta frequenza attraversa la superficie anteriore dell’occhio fino all’iride e al cristallino. Trattandosi di un’immagine ad alta frequenza, il dettaglio delle strutture oculari attraversate è elevato. Questo strumento consente lo studio accurato della cornea, dell’iride, del cristallino, della pupilla e dell’angolo sclerocorneale. Tale strumento fornisce dati qualitativi ma anche quantitativi, in quanto munito di un software di elaborazione che consente di effettuare misurazioni delle strutture oculari analizzate. L’applicazione di questo apparecchio è molto estesa nella pratica clinica, in quanto consente di studiare la morfologia della cornea, misura lo spessore corneale punto a punto, determina l’ampiezza della camera anteriore e ne visualizza il contenuto,
28 mostra inoltre la morfologia e l’aspetto dell’iride e del cristallino e l’eventuale opacamento di quest’ultimo; consente infine di misurare l’ampiezza dell’angolo sclerocorneale. Tali misure sono del tutto riproducibili e ripetibili. Questo strumento svolge un ruolo fondamentale nel controllo dei pazienti che hanno subìto un trattamento chirurgico con laser ad eccimeri o un impianto di una lente intraoculare; è infatti possibile studiare le modificazione tissutali indotte dalla tecnica chirurgica e
monitorarle nel tempo.
Analizzata la superficie oculare si procede all’acquisizione di informazioni morfologiche delle strutture più interne dell’occhio.
Gonioscopia
La gonioscopia è l’esame che consente, mediante l’utilizzo di un’opportuna lente a contatto (lente di Goldmann) di visualizzare l’angolo sclerocorneale, struttura oculare importante perché deputata al mantenimento di corretti valori di pressione intraoculari. Tale esame si effettua mediante l’instillazione di gocce anestetiche, si appoggia all’occhio la lente su cui è stato precedentemente steso un velo di gel per migliorarne l’appoggio e si esamina alla lampada a fessura.
Topografia
Il topografo è uno strumento dotato di un lettore ottico, che misura il raggio di curvatura praticamente per ogni singolo punto della cornea, e di un microprocessore in grado di ricostruire l’immagine della superficie corneale stampandola. L’acquisizione dell’esame avviene per mezzo della proiezione sulla superficie della cornea di un disco formato da numerosi cerchi concentrici egualmente distanziati tra loro (disco di Placido); una telecamera registra l’immagine del disco riflessa. Infine un computer analizza tale immagine confrontandola con alcune sfere di riferimento al fine di ricostruire la superficie corneale. La rappresentazione della superficie corneale è costituita da una mappa colorata, in cui i diversi colori
29
rappresentano valori differenti di curvatura.
I topografi più moderni consentono di acquisire informazioni relative non solo alla superficie anteriore della cornea, ma anche alla superficie posteriore; in alcuni casi si può avere una mappa punto a punto degli spessori corneali. La topografia corneale è un esame molto importante nello studio di alcune condizioni patologiche come il cheratocono, ma soprattutto rappresenta un fondamentale esame pre-chirurgico quando si debba operare il segmento anteriore dell’occhio. Nell’intervento di cataratta la topografia corneale indica dove collocare l’incisione corneale e permette di verificarne gli effetti sull’astigmatismo. Nella chirurgia refrattiva consente di escludere la presenza di un cheratocono prima dell’intervento e di studiare il risultato della chirurgia in termini di diottrie, centratura della procedura, dimensioni della zona ottica e rapporti con la pupilla.
Refrazione post-operatoria
La refrazione post-operatoria ideale è spesso rappresentata dall’emmetropia, in modo che il paziente utilizzi gli occhiali solo per vicino (la IOL non permette l’accomodazione). Nella pratica clinica, la maggior parte dei chirurghi ricerca un lieve grado di miopia (0,25 D circa) per sopperire a eventuali errori del calcolo biometrico. Infatti, i pazienti accettano di buon grado una miopia lieve, anzi la considerano vantaggiosa; al contrario, l’ipermetropia post-operatoria, che obbliga il paziente all’uso degli occhiali per vicino e per lontano, è scarsamente tollerata. La decisione in merito alla refrazione post-operatoria deve anche tenere conto della condizione dell’occhio adelfo. Nel caso in cui l’occhio controlaterale presenti una buona acuità visiva, tale da non richiedere un intervento chirurgico, ma un considerevole errore refrattivo, la refrazione post-operatoria dell’occhio operato non deve variare più di 2 D rispetto all’altro occhio, in modo da evitare disturbi nella visione binoculare. Oppure, se l’ametropia è estrema, si può proporre al paziente la lente refrattiva nell’occhio adelfo per
30 indirizzare entrambi gli occhi all’emmetropia. Alcuni pazienti accettano l’idea della monovisione, in cui l’occhio non dominante viene lasciato con una miopia di -2D in modo da consentire la lettura, mentre l’occhio dominante viene lasciato emmetropico. Attualmente sono disponibili nuove lenti che consentono gradi di multifocalità quando il paziente desidera una maggiore indipendenza dagli occhiali dopo l’intervento. Per conseguire tale obiettivo, diventa fondamentale la questione della correzione pre-operatoria dell’astigmatismo.
31
Lenti intraoculari
La lente intraoculare è costituita dall’ottica (l’elemento refrattivo centrale) e dalle aptiche, che sono in contatto con le strutture oculari (sacco capsulare, solco ciliare, angolo camerulare) e permettono la stabilizzazione ottimale dell’ottica (centraggio). La moderna chirurgia della cataratta, che garantisce la conservazione del sacco capsulare, consente di posizionare la lente nella sua corretta collocazione, “nel sacco”. In caso di interventi complicati da rottura della capsula posteriore, tuttavia, la lente deve essere collocata in una posizione alternativa, sempre in camera posteriore, ma con le aptiche nel solco ciliare oppure in camera anteriore con le aptiche appoggiate nell’angolo camerulare. Quest’ultimo tipo di lente è definito AC-IOL (Anterior Chamber IntraOcular Lens, lente intraoculare da camera anteriore), mentre i primi due tipi sono definiti PC-IOL (Posterior Chamber Intraocular Lens, lente intraoculare da camera posteriore).
Tipi di lenti
La tipologia delle lenti è numerosa e in continua evoluzione.
1. IOL rigide: richiedono, per l’inserimento, un’incisione più larga del diametro dell’ottica, che è spesso di 5 mm. Sono composte interamente da PMMA (polimetilmetacrilato) e in genere sono utilizzate prevalentemente nei Paesi in via di sviluppo, in cui sono più economiche e di facile reperibilità.
2. IOL pieghevoli: possono essere piegate con una pinza oppure caricate in un iniettore o in un dispositivo dedicato all’inserimento e
quindi inserite attraverso un’incisione più piccola. a. IOL in silicone: a tre pezzi con aptiche ad ansa o monopezzo con
le aptiche piatte, si correlano ad una minore incidenza di opacità della capsula posteriore rispetto alle lenti in PMMA. Sono meno frequentemente associate a contrazione della camera anteriore rispetto alle IOL acriliche.
32 b. IOL acriliche: tre pezzi e monopezzo, possono essere idrofobiche (contenuto in acqua <1%) o idrofiliche (contenuto in acqua 18-35%). Alcune IOL acriliche idrofobiche inibiscono l’opacizzazione della capsula posteriore. I materiali idrofobici possiedono un indice refrattivo molto più alto rispetto alle lenti idrofile e che quindi sono più sottili.
c. IOL in hydrogel: sono simili alle lenti acriliche idrofiliche, ma hanno un contenuto d’acqua elevato (38%) e una maggiore incidenza di opacizzazione della capsula posteriore.
3. IOL multifocali: consentono la visione da vicino e da lontano. Le cosiddette IOL accomodative cercano di piegare e variare la distanza focale, sebbene in pratica l’ampiezza dell’accomodazione sia modesta. Le IOL pseudo-accomodative agiscono in modo refrattivo o difrattivo.
4. Altre caratteristiche: attualmente sono disponibili IOL che filtrano la luce blu per evitare che la retina venga danneggiata da alcune lunghezze d’onda della luce; ottiche asferiche per ridurre al minimo le aberrazioni sferiche e IOL toriche per correggere l’astigmatismo corneale preesistente.
Anestesia
Nella maggior parte dei casi, l’intervento chirurgico per cataratta viene effettuato in anestesia locale (AL), mentre l’anestesia generale viene riservata ai bambini, ai soggetti con ritardo mentale e in presenza di tremore del capo.
Blocco peribulbare
E’ la modalità di AL utilizzata più frequentemente. Si ottiene con l’iniezione di anestetico attraverso la cute o la congiuntiva con un ago di 25mm.
33 Blocco sottotenoniano
Prevede il passaggio di una piccola cannula con la punta smussa attraverso un’incisione a livello della congiuntiva e della capsula di Tenone a 5 mm dal limbus, nello spazio sottotenoniano. L’anestetico viene iniettato oltre l’equatore del bulbo oculare. Sebbene l’anestesia sia buona e le complicanze ridotte, l’acinesia è variabile.
Anestesia topica-intracamerulare
Prevede l’anestesia iniziale della superficie oculare con gocce o gel (proximetacaina allo 0,5%, lidocaina al 2%), eventualmente seguita dall’iniezione in camera anteriore o dall’infusione di lidocaina all’1% diluita priva di conservanti, in genere durante l’idrodissezione. Sebbene l’analgesia sia adeguata, occorre avvertire il paziente che non si tratta di un’anestesia vera e propria e che la sensibilità durante l’intervento sarà mantenuta. Nonostante l’assenza di acinesia, la maggior parte dei pazienti riesce a collaborare in modo adeguato fissando un punto di fissazione presente nel microscopio operatorio.
Estrazione extracapsulare di cataratta
L’estrazione extracapsulare di cataratta (ExtraCapsular Cataract Extraction, ECCE) rappresentava la tecnica più utilizzata dalla maggior parte del chirurghi negli anni Ottanta, epoca in cui l’impiego delle IOL diventò più diffuso. Essa costituiva a sua volta un’evoluzione dell’estrazione intracapsulare. Sebbene la tecnica richiedesse l’esecuzione di un’incisione relativamente larga sulla circonferenza limbare (8-10 mm), essa era di facile apprendimento, di realizzazione relativamente semplice e non richiedeva l’acquisto di apparecchiature costose. In pratica utilizzando un ago a punta smussa o cistotomo si realizzava una capsulotomia “ad apriscatole”, attraverso la quale si estraeva il nucleo del cristallino e si aspirava il materiale corticale, lasciando intatta la capsula posteriore; si procedeva quindi all’impianto della IOL nel sacco capsulare. La sutura dell’incisione,
34 tuttavia, provocava un astigmatismo corneale non indifferente, che rallentava il processo di guarigione, anche perché spesso i punti dovevano essere rimossi circa 3 mesi dopo l’intervento e l’astigmatismo poteva persistere ancora per un certo periodo di tempo.
Facoemulsificazione
La facoemulsificazione è diventata la tecnica chirurgica di elezione negli ultimi 15 anni. L’incisione più piccola rispetto a quella dell’ECCE rende l’intervento più sicuro grazie alla possibilità di evitare la decompressione del bulbo. Inoltre, la procedura è associata ad un astigmatismo post-operatorio trascurabile e a una più precoce stabilizzazione della refrazione (di solito 3 settimane per incisioni di 3 mm). I problemi post-operatori correlati alla riparazione della ferita, quali il prolasso dell’iride, sono quasi totalmente scomparsi. Uno svantaggio della tecnica è rappresentato dalla necessità di apparecchiature più complesse per la riduzione del nucleo del cristallino in piccoli frammenti, i quali devono poi essere estratti attraverso la piccola incisione.
La tecnica chirurgica si avvale dei seguenti passaggi fondamentali: 1. Preparazione:
a. Iniezione dell’anestetico locale nel sacco congiuntivale.
b. Iniezione di iodopovidone al 5% nel sacco congiuntivale e disinfezione della cute palpebrale.
c. Delimitazione del campo chirurgico con applicazione del telo trasparente in modo da escludere le ciglia e i margini palpebrali. Introduzione di uno speculum.
2. Incisioni:
a. Due incisioni di servizio auto sigillanti a 180° l’una rispetto all’altra, la prima a 30-60° a sinistra dell’incisione principale.
35 b. L’incisione corneale, di solito temporale, può essere nella cornea
chiara o limbare.
c. Iniezione di materiale viscoelastico nella camera anteriore. 3. Capsuloressi circolare, centrale o continua: viene realizzata mediante
cistotomo o con ago a punta smussa, e comporta due movimenti: a. Taglio, in cui si applica una forza vettoriale tangenziale lungo la
direzione della lacerazione.
b. Strappo, in cui una forza vettoriale centripeta tira e lacera la capsula.
4. Idrodissezione per separare il nucleo e la corteccia dalla capsula in modo che il nucleo possa essere ruotato più facilmente e con maggior sicurezza.
a. Inserimento di una cannula smussa da 26 G con liquido appena al di sotto del margine della ressi e iniezione del liquido al di sotto della capsula.
b. Si osserva un’onda di idrodissezione, a patto che vi sia un buon riflesso rosso.
c. Inserimento della punta del faco e aspirazione della corticale superficiale e dell’epinucleo.
5. Tecnica dei quattro quadranti (“divide et impera”) per la rimozione del nucleo.
a. “Scolpitura” del nucleo con la punta del facoemulsificatore per creare un solco.
b. Dopo la rotazione del nucleo con un secondo strumento inserito attraverso l’incisione di servizio, si esegue un secondo solco ad angolo retto rispetto al primo.
c. La punta del facoemulsificatore e il secondo strumento vengono inseriti sulle pareti opposte del solco. Si provoca la rottura del nucleo esercitando la forza nelle due direzioni opposte.
36 d. Rotazione del nucleo di 90° e spaccatura del solco
perpendicolare, come precedentemente descritto. e. Ogni quadrante viene a turno emulsificato e aspirato. 6. Tecnica di faco chop nucleare:
a. Nella faco chop orizzontale, il chopper a punta smussa viene inserito orizzontalmente sotto la capsula per poi essere girato verticalmente quando raggiunge l’equatore.
b. La faco chop verticale viene realizzata con un chopper appuntito con il quale non è necessario oltrepassare la capsuloressi.
c. Il nucleo viene tagliato in diversi frammenti, ciascuno dei quali viene poi emulsificato e aspirato.
7. Aspirazione della corticale residua: i frammenti corticali sono catturati dal vuoto, attirati centralmente e aspirati.
8. Impianto della IOL:
a. Iniezione di materiale viscoelastico nel sacco capsulare.
b. Piegamento e inserimento della IOL nel sacco capsulare; si può utilizzare un iniettore speciale per inserire la IOL preventivamente piegata.
c. Centraggio della IOL. 9. Conclusione:
a. Aspirazione del materiale viscoelastico.
b. Chiusura delle incisioni di servizio con un getto di soluzione fisiologica.
c. Somministrazione di una dose di steroide e antibiotico mediante iniezione sottocongiuntivale.
37
Complicanze
Nell’ambito della chirurgia della cataratta le complicanze possono insorgere in qualunque fase della procedura.
Rottura della capsula posteriore
Si tratta di un’evenienza potenzialmente grave perché si accompagna a perdita di vitreo e, seppur raramente, emorragia espulsiva. Le complicanze a lungo termine della perdita di vitreo, soprattutto se non adeguatamente gestita, sono deformazione pupillare, uveite, sindrome da contatto vitreale, sindrome da prolasso vitreale, endoftalmite, glaucoma secondario, dislocazione posteriore della IOL, distacco di retina ed edema maculare cistoide.
Questa complicanza si manifesta con un improvviso aumento di profondità della camera anteriore e dilatazione pupillare, migrazione posteriore del nucleo che non si avvicina più alla punta del facoemulsificatore, possibile aspirazione del nucleo nella punta del facoemulsificatore e visualizzazione diretta della rottura capsulare o del vitreo.
La gestione dipende dal momento in cui è avvenuta la rottura capsulare, dalle dimensioni e dalla presenza di prolasso del vitreo: la sostanza viscoelastica dispersiva può essere iniettata dietro il materiale nucleare per spingerlo in camera anteriore e per prevenire l’erniazione anteriore del vitreo. Si inserisce successivamente un supporto che viene fatto scivolare sotto i frammenti di cristallino per coprire la rottura capsulare, e i frammenti di cristallino vengono rimossi tramite una manovra di viscoespressione o con il facoemulsificatore stesso se si desidera mantenere una mini-incisione. Si rimuove tutto il vitreo dalla camera anteriore e dalla ferita con il vitrectomo. Una rottura di piccole dimensioni della capsula posteriore consente di impiantare agevolmente nel sacco una IOL da camera posteriore, mentre, in caso di rotture più ampie, è in genere possibile impiantare una IOL da camera posteriore a tre pezzi nel solco ciliare
38 sostenuta dal sacco capsulare. In caso di supporto capsulare insufficiente, può essere necessario suturare la IOL al solco oppure impiantare una IOL da camera anteriore con l’aiuto di un supporto. Tuttavia, la presenza di una IOL in camera anteriore è associata ad un maggior rischio di complicanze, quali la cheratopatia bollosa, l’ipoema, le pieghe iridee e le irregolarità della pupilla.
Vi sono condizioni in cui non è opportuno neanche impiantare una IOL da camera anteriore: in questi casi è più sicuro non impiantare la IOL e optare per una correzione del difetto refrattivo con le lenti a contatto, oppure procedere all’impianto secondario della IOL in un momento successivo.
Introduzione di un supporto dietro i frammenti nucleari in seguito alla rottura della capsula posteriore
Inserimento di una IOL in camera anteriore: a) Inserimento di un supporto; b)
39 Migrazione posteriore di frammenti di cristallino
La dislocazione di frammenti del cristallino in camera vitrea, in seguito a disinserzione della zonula o rottura della capsula, è rara, ma potenzialmente grave. Le complicanze di questa evenienza sono glaucoma, uveite cronica, distacco di retina ed edema maculare cistoide cronico. Inizialmente, l’uveite e l’ipertono vanno trattati. Il paziente va poi inviato ad un chirurgo vitreoretinico per programmare un intervento di vitrectomia via pars plana e rimuovere i frammenti di nucleo.
Dislocazione posteriore della IOL
La dislocazione di una IOL da camera posteriore nella cavità vitrea indica un impianto inappropriato ed è un’evenienza rara, ma grave, soprattutto se associata a perdita posteriore di materiale nucleare. Nel caso in cui la IOL non venga rimossa, si possono presentare emorragia vitreale, distacco retinico, uveite ed edema maculare cistoide cronico. Il trattamento prevede una vitrectomia via pars plana, con rimozione, riposizionamento o sostituzione della IOL a seconda dell’estensione del supporto capsulare.
40 Emorragia sopracoroidale
Rappresenta un sanguinamento nello spazio sopracoroidale che può avere come esito un’estrusione dei tessuti intraoculari (emorragia espulsiva) oppure contatto delle superfici retiniche. E’ una complicanza rara, ma temibile e assai meno probabile in caso di facoemulsificazione. La provenienza del sanguinamento è un’arteria ciliare posteriore breve o lunga, che va incontro a rottura. Non si conosce la causa reale di questa grave condizione, ma i fattori predisponenti sono l’età avanzata, le patologie cardiovascolari e la perdita di vitreo. Questo tipo di complicanza si manifesta con riduzione progressiva della profondità della camera anteriore, aumento della pressione endoculare, prolasso di iride, prolasso di vitreo, perdita del riflesso rosso del fundus e comparsa di un rigonfiamento scuro dietro il forame pupillare. Nei casi gravi si assiste all’estrusione di tutti i tessuti intraoculari attraverso l’incisione. Il trattamento immediato prevede la chiusura della ferita. La sclerotomia posteriore può essere utile, ma anche peggiorare il sanguinamento e innescare un circolo vizioso, con perdita dell’occhio. Il trattamento post-operatorio prevede l’utilizzo di steroidi topici e sistemici per ridurre l’infiammazione intraoculare. Per la gestione tardiva si può ricorrere all’ecografia per valutare la gravità. L’intervento chirurgico può essere effettuato 7-14 giorni dopo, quando il coagulo ematico si è riassorbito. Si drena il sangue e si procede a una vitrectomia via pars plana con scambio aria-fluido. Sebbene la prognosi funzionale sia grave, in alcuni casi è possibile salvaguardare un’acuità visiva utile.
Endoftalmite post-operatoria acuta
L’endoftalmite acuta è una complicanza devastante della chirurgia endoculare. L’incidenza stimata dopo chirurgia della cataratta è circa lo 0,15%. Nel 90% dei casi i microrganismi responsabili sono Gram-positivi (S. epidermidis, S. aureus, Streptococcus spp.), nel restante 10% Gram-negativi (Pseudomonas spp., Proteus spp.). Le fonti di infezione spesso non
41 sono identificabili con certezza, ma si ritiene che la flora batterica delle palpebre e della congiuntiva siano le più frequentemente implicate; sono considerate altre potenziali fonti di infezione anche gli strumenti contaminati, la flora batterica del chirurgo e del personale di sala.
Data la gravità dell’infezione, un’attenzione particolare andrà rivolta alla prevenzione: importante il trattamento pre-operatorio di eventuali infezioni preesistenti quali la blefarite, la congiuntivite o la dacriocistite; la riduzione della conta microbica sulla superficie dell’occhio mediante l’instillazione di iodopovidone e la delimitazione del campo chirurgico con teli sterili; la profilassi antibiotica, che prevede la somministrazione di fluorochinolonici topici da 1 ora a 3 giorni prima dell’intervento, l’iniezione intracamerale di cefuroxime al termine della procedura e un’ulteriore iniezione sottocongiuntivale dopo l’operazione.
Clinicamente l’endoftalmite si manifesta con dolore e riduzione dell’acuità visiva in associazione a chemosi, iperemia congiuntivale e secrezione purulenta, essudato fibrinoso e ipopion, vitreite con impossibilità di visualizzare il fundus.
Il cardine della terapia è rappresentato dall’iniezione intravitreale di antibiotici e steroidi. In caso di mancato miglioramento o peggioramento dei segni clinici si dovrebbe prendere in considerazione la vitrectomia.
Endoftalmite batterica acuta: a) Opacamento corneale; b) Essudato fibrinoso e ipopion;
42 Endoftalmite cronica ad esordio tardivo
Si sviluppa in seguito a un intervento chirurgico per cataratta, nei casi in cui un microrganismo a bassa virulenza rimane intrappolato nel sacco capsulare. L’esordio avviene in media a 9 mesi dall’intervento. I microrganismi più frequentemente coinvolti sono Propionibacterium acnes e occasionalmente S. epidermidis, Corynebacterium spp. O Candida parapsilosis. Si manifesta con una riduzione dell’acuità visiva lieve e progressiva ma senza dolore, associata ad uveite anteriore di basso grado (talvolta si rilevano precipitati cheratici a grasso di montone) e alla presenza di una placca capsulare che tende ad espandersi, composta dall’insieme di microrganismi sequestrati nella corticale residua all’interno della parte periferica del sacco capsulare. L’ipopion è infrequente. La diagnosi dovrebbe essere confermata mediante la coltura di umor acqueo e vitreo. Il trattamento prevede la rimozione del sacco capsulare, della corticale residua, della IOL e la vitrectomia via pars plana. Successivamente si può prendere in considerazione un impianto secondario della IOL. La terapia antibiotica prevede l’iniezione intravitreale di vancomicina.
Endoftalmite cronica ad esordio tardivo: a) Uveite anteriore con precipitati a grasso di
montone; b) Miglioramento del quadro in seguito a terapia con steroidi topici; c) Recidiva severa dopo cessazione della terapia steroidea; d) Opacizzazione del sacco capsulare
43 Opacizzazione della capsula posteriore
L’opacizzazione della capsula posteriore, accompagnata dal calo dell’acuità visiva, è la più comune complicanza tardiva di un
intervento di cataratta eseguito senza complicanze. La riduzione dell’acuità visiva si accompagna ad alterazioni della sensibilità al contrasto, che sono causa di abbagliamento e di diplopia monoculare. Questa evenienza si verifica con maggior frequenza in caso di IOL in PMMA e silicone rispetto a quelle in materiale acrilico. Un segno caratteristico è la comparsa delle Perle di Elsching (cellule vescicolari o di Weds), dovute alla proliferazione e alla migrazione di un residuo equatoriale di cellule dell’epitelio lenticolare verso la zona di contatto tra la capsula posteriore e i residui di quella anteriore. In retroilluminazione, appaiono come vacualizzazioni a livello della capsula posteriore. Un altro segno importante, meno frequente e a comparsa più precoce, è la fibrosi capsulare, dovuta alla fibrosi delle cellule epiteliali. Il trattamento consiste nella creazione di un’apertura nella capsula posteriore con laser Nd:YAG.
Opacizzazione della capsula posteriore: a) Perle di Elsching; b) Fibrosi capsulare; c)
44 Contrazione della capsula anteriore
Dopo l’introduzione della capsuloressi rotonda continua, la contrazione dell’apertura della capsula anteriore (fimosi capsulare) è diventata una delle complicanze post-operatorie più frequenti. Insorge diverse settimane dopo l’intervento ed è associata a fibrosi sottocapsulare. La contrazione progredisce tipicamente fino a un periodo massimo di 3 mesi. Nei casi gravi, può essere necessaria la capsulotomia con laser Nd:YAG. L’incidenza massima si osserva nel caso di IOL in silicone con le aptiche piatte, contrariamente a quanto avviene per le IOL a tre pezzi con l’ottica in materiale acrilico e le aptiche in PMMA. Anche la capsuloressi di piccole dimensioni è un fattore rilevante.
45 Altre complicanze
Edema corneale, dislocazione della IOL, distacco di retina, edema maculare cistoide.
a) IOL decentrata con un'aptica nell'angolo e l'altra nel sacco capsulare; b) Sublussazione inferiore della IOL
46
IL GLAUCOMA
DEFINIZIONE ED EPIDEMIOLOGIA
Il glaucoma rappresenta la seconda causa di cecità nel mondo dopo la cataratta e risulta quindi una malattia dal grave impatto socio-economico. Il glaucoma ha probabilmente un impatto maggiore sulla popolazione rispetto alla cataratta dal momento che esso causa una cecità irreversibile: si stima che 5,2 milioni di persone siano cieche a causa di questa patologia (il 15%
del numero globale di persone affette da cecità). Viene classicamente definito glaucoma una patologia oculare caratterizzata
da:
Aumento della pressione intraoculare (IOP) Escavazione della testa del nervo ottico Riduzione progressiva del campo visivo
Tale definizione comprende le caratteristiche peculiari di questa malattia e i principali effetti patologici, ma risulta semplicistica se consideriamo i pazienti affetti da glaucoma a pressione normale oppure le persone con un alto tono endoculare, le quali non necessariamente svilupperanno una riduzione del campo visivo per un danno alla retina e al nervo ottico.
Alla base del glaucoma vi è un aumento pressorio dovuto ad un eccessivo accumulo di umor acqueo il cui scarico, attraverso la rete trabecolare situata nell’angolo irido-corneale, viene ad essere ostacolato.
47 Produzione e deflusso di umor acqueo
L’umor acqueo viene prodotto a livello dei processi ciliari: sono circa 70, disposti radialmente, formati da creste lamellari inserite nella faccia interna del corpo ciliare. Il processo di produzione di umor acqueo si articola in due fasi: a livello dello stroma dei corpi ciliari si forma un filtrato a partire dal plasma, da cui successivamente si forma l’umor acqueo attraverso la barriera ematoacquosa. Questo processo si realizza attraverso due meccanismi:
Secrezione attiva dall’epitelio non pigmentato, che è responsabile del 90% della fuoriuscita di umor acqueo, come risultato di un processo metabolico regolato da numerosi sistemi enzimatici, soprattutto dalla pompa Na+/ K+ -ATPasi, che secerne ioni Na+ nella camera posteriore. L’acqua defluisce passivamente secondo il gradiente osmotico. La secrezione di Cl־ a livello della superficie delle cellule non pigmentate può costituire un fattore limitante del deflusso. Anche l’anidrasi carbonica svolge un ruolo importante, ma il meccanismo esatto è incerto. La secrezione di umor acqueo è diminuita da fattori che inibiscono il metabolismo attivo, come l’ipossia e l’ipotermia, ma è indipendente dal livello di pressione intraoculare (IOP).
Secrezione passiva mediante ultrafiltrazione e diffusione (dipendenti dal livello della pressione idrostatica capillare, dalla pressione oncotica a dal livello di IOP): in condizioni normali si ritiene che svolga un ruolo minimo nella produzione di umor acqueo.
Esistono dei fattori che determinano una riduzione della produzione di umor acqueo, tra cui alcuni farmaci (β-bloccanti, simpaticomimetici, inibitori dell’anidrasi carbonica), procedure ciclodistruttive (es. la ciclocrioterapia e l’ablazione laser) e l’inattivazione del corpo ciliare (condizione che può verificarsi come conseguenza di un distacco del corpo ciliare stesso,
48 infiammazione dell’epitelio secernente associata ad iridociclite o distacco di retina).
Attraverso la pupilla l’umor acqueo passa dalla camera posteriore a quella anteriore e da quest’ultima lascia l’occhio attraverso due diverse vie:
Via trabecolare: è responsabile del 90% della fuoriuscita di acqueo. L’acqueo scorre attraverso il trabecolato nel canale di Schlemm e viene quindi drenato dalle vene episclerali nel circolo sistemico. Questa via è dipendente dalla pressione e dal volume, cosicchè all’aumentare della pressione aumenta la fuoriuscita. Il deflusso trabecolare può essere favorito da farmaci (miotici, simpatico-mimetici), laser trabeculoplastica e trabeculectomia.
Via uveosclerale (non convenzionale): è responsabile del restante 10% di deflusso. L’umor acqueo passa nello spazio sovracoroidale attraverso il corpo ciliare e viene drenato dalla circolazione venosa del corpo ciliare, della coroide e della sclera. Il deflusso uveosclerale è diminuito dai miotici e favorito dall’atropina, dai simpatico-mimetici e dalle prostaglandine. Una parte dell’umor acqueo viene drenata attraverso l’iride.
Deflusso irideo: poco rilevante, si verificherebbe per riassorbimento diretto da parte dell’iride.
49 CLASSIFICAZIONE
A seconda della presenza o dell’assenza di fattori associati (particolari patologie oculari o sistemiche) che abbiano contribuito al rialzo pressorio, classifichiamo il glaucoma in:
Primario Secondario
A seconda dell’epoca di insorgenza: che sia presente fin dalla nascita o che sia insorto in un periodo successivo, classifichiamo il glaucoma in:
Congenito Acquisito
A seconda del meccanismo con cui il deflusso di umor acqueo viene ostacolato, classifichiamo il glaucoma in:
Ad angolo aperto Ad angolo chiuso
Nei glaucomi primari, l’aumento di IOP non è associato ad altri disturbi oculari, mentre nel glaucoma secondario un fattore riconoscibile oculare o non oculare altera il deflusso di umor acqueo, che, a sua volta, determina un innalzamento della IOP. I glaucomi secondari possono essere congeniti o acquisiti e ad angolo aperto o chiuso.