1
RIASSUNTO
Il trapianto di pancreas rappresenta, ad oggi, l’unica terapia in grado di ristabilire, nel soggetto con diabete mellito di tipo 1, una secrezione endogena di insulina responsiva ai normali feed-back di controllo, e quindi uno stato di euglicemia stabile in assenza di somministrazione di insulina esogena. Attualmente i trapianti di pancreas hanno rilevanza clinica concreta, per l’elevato numero di interventi eseguiti e per i risultati positivi in termini di sopravvivenza dei riceventi, di durata dell’insulino-indipendenza e di miglioramento delle complicanze croniche del diabete. Nella maggior parte dei casi il trapianto di pancreas viene associato al trapianto di rene in pazienti diabetici con insufficienza renale terminale, ma si possono eseguire anche trapianto di pancreas dopo il rene e trapianto di pancreas isolato. Il drenaggio portale-enterico è la tecnica chirurgica maggiormente utilizzata, in quanto rappresenta la soluzione più fisiologica per l’organo trapiantato. L’introduzione della ciclosporina e, più recentemente, del tacrolimo nella terapia immunosoppressiva dei pazienti sottoposti a trapianto d’organo ha determinato un significativo aumento sia della sopravvivenza dell’organo che della spettanza di vita del paziente. A fronte di questo risultato positivo, tali farmaci hanno un impatto importante sul metabolismo glucidico e lipidico. Esistono pochi dati in letteratura che confrontino gli effetti metabolici a lungo termine degli inibitori della calcineurina. Pertanto, in questo elaborato di tesi sono stati studiati 52 pazienti trapiantati di rene e pancreas con drenaggio portale-enterico e randomizzati a ricevere ciclosporina o tacrolimo, in associazione a micofenolato mofetile e steroidi, e ne sono stati valutati, con follow-up fino a quattro anni, sopravvivenza, funzione degli organi trapiantati e cambiamenti di vari parametri metabolici. I risultati ottenuti indicano che ciclosporina e tacrolimo inducono
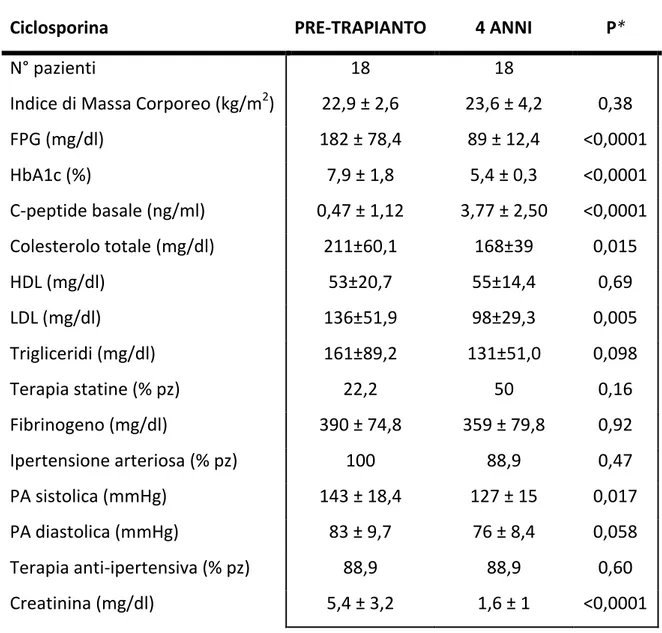
2 simile sopravvivenza dei pazienti, nonché del pancreas e del rene trapiantati. Inoltre, a distanza di quattro anni dal trapianto i principali parametri del metabolismo glucidico e lipidico sono risultati sovrapponibili nei due bracci di trattamento, anche se i pazienti trattati con ciclosporina necessitavano più frequentemente di terapia con farmaci ipocolesterolemizzanti. Nel complesso i risultati dello studio dimostrano che ciclosporina e tacrolimo hanno sostanzialmente simile efficacia e sovrapponibile tollerabilità nei pazienti trapiantati di rene e pancreas con drenaggio portale venoso.
3
Capitolo 1
IL TRAPIANTO DI PANCREAS
1.1 Premessa
Il diabete mellito è una malattia cronica dovuta a carenza assoluta o relativa di insulina, associata a gradi variabili di insulino-resistenza da parte dei tessuti periferici e caratterizzata da alterazioni del metabolismo glucidico, lipidico e proteico.
Si tratta di una sindrome eterogenea comprendente varie forme cliniche, di cui le più frequenti sono rappresentate dal diabete di tipo 1 e dal diabete di tipo 2 (da soli rappresentano oltre il 90% di tutti i casi). Nel tipo 1, per motivi non ancora del tutto chiariti, la carenza di insulina è dovuta alla distruzione autoimmune delle cellule beta delle isole di Langerhans. Nel diabete tipo 2 sono presenti, e talora prevalgono, fenomeni di resistenza dei tessuti all'azione dell'insulina.
La prevalenza e l'incidenza del diabete variano notevolmente in rapporto alla zona geografica considerata. In Italia si ritiene che, complessivamente, il numero dei pazienti diabetici si aggiri intorno ai 3-4.000.000 (prevalenza di circa il 5-6%). E' inoltre da sottolineare che, in base alle previsioni dell'Organizzazione Mondiale della Sanità, il numero dei pazienti diabetici appare destinato ad un continuo e rapido aumento.
La malattia ha un impatto socio-sanitario di estrema rilevanza non solo per questa sua notevole diffusione, ma anche perché gravata da complicanze acute
4 e croniche che sono purtroppo ancora molto frequenti, spesso invalidanti e non di rado direttamente causa di morte. L’effetto cronico dello squilibrio metabolico è polidistrettuale e può alterare la funzione dell’apparato cardio-vascolare, dei reni, degli occhi e del sistema nervoso. In particolare, l’insufficienza coronarica e l’insufficienza renale terminale rappresentano le principali cause di mortalità; l’infarto del miocardio è 2-3 volte più frequente nei pazienti diabetici e circa 10/1.000.000 di persone sane sviluppa annualmente una sindrome uremica. Il diabete è inoltre la causa più frequente di cecità acquisita nella popolazione in età lavorativa. Circa il 10% dei pazienti diabetici viene sottoposto a un’amputazione maggiore di arto(1).
Ne consegue che gli obiettivi principali della terapia del diabete devono essere mirati non solo all'eliminazione degli eventi acuti e dei sintomi dovuti all'iperglicemia, ma anche e soprattutto alla prevenzione delle complicanze croniche della malattia. Da questo punto di vista, mentre è ormai definitivamente appurato che quanto migliore è il controllo metabolico tanto maggiore è la probabilità di evitare, o almeno rallentare, lo sviluppo di retinopatia, nefropatia, neuropatia e macroangiopatia, è altrettanto ben dimostrato che l'ottimizzazione del controllo comporta un’aumentata frequenza di episodi di ipoglicemia (evento questo che ha non solo ripercussioni negative a livello psicologico per il paziente, ma che può condurre anche a morte)(2).
Per questo la ricerca biomedica sta sviluppando, e in parte applicando, terapie e trattamenti che mirano a migliorare il controllo metabolico, limitando altresì il rischio di ipoglicemie. Si inseriscono in quest’ambito approcci terapeutici che sembrano essere in grado di ripristinare il normale feed-back tra i livelli circolanti di glucosio (e altri metaboliti) da un lato e la secrezione insulinica dall'altro. Ci si riferisce, da questo punto di vista, essenzialmente al trapianto di pancreas endocrino inteso come sola componente endocrina (le isole di
5 Langherans) o come organo nel suo complesso (pancreas in toto): entrambi gli approcci si prefiggono, ciascuno con valenze cliniche e/o sperimentali specifiche, di ripristinare il patrimonio di cellule beta distrutto e di consentire, quindi, la normalizzazione dei livelli di glucosio circolante in assenza di terapia insulinica esogena(3).
Grazie all’incremento dell’attività di prelievo d’organo, all’evoluzione della tecnica chirurgica ed alla messa a punto di nuovi farmaci immunosoppressori, i risultati ottenuti con il trapianto di pancreas sono nettamente migliorati(1). Negli anni tale procedura ha assunto rilevanza clinica concreta, per l’elevato numero di interventi eseguiti e per i risultati positivi in termini di sopravvivenza dei riceventi, di durata dell’insulino-indipendenza (che ha raggiunto livelli tali da ripagare il rischio operatorio iniziale) e di miglioramento del profilo metabolico e dell’evoluzione delle complicanze croniche del diabete(3).
Il primo trapianto di pancreas sull’uomo è stato eseguito da Kelly e Lillehei nel 1966 presso l’Università del Minnesota a Minneapolis (USA)(4). Da allora oltre 30.000 pazienti diabetici, per la maggior parte con diabete di tipo 1, hanno usufruito di tale procedura(5).
In Italia, i primi casi di trapianto di pancreas sono stati segnalati al Centro Nazionale Trapianti nel 1992 e, al luglio 2009, tali trapianti risultano essere stati, nel complesso, circa 1000, di cui il 70‑75% rappresentati da trapianto combinato pancreas e rene (6).
1.2 Tipi di trapianto
Circa il 75% dei trapianti di pancreas è eseguito simultaneamente a quello di rene (Simultaneous Pancreas-Kidney-SPK) in pazienti con insufficienza renale
6 terminale, anche prima dell’inizio della dialisi (trapianto preemptive). Generalmente entrambi gli organi provengono dallo stesso donatore cadavere, ma è anche possibile prelevare il pancreas da un donatore cadavere e il rene da un donatore vivente. In tali pazienti, il trapianto combinato pancreas e rene può così risolvere contemporaneamente il problema metabolico e quello renale, e quindi riscattare dall’insulino-dipendenza e dalla necessità del trattamento dialitico (o dalla sua incombenza, quando il trapianto venga eseguito prima dell’ingresso in dialisi)(5,7,8).
In circa il 15-20% dei pazienti il trapianto di pancreas avviene dopo quello di rene (Pancreas After Kidney-PAK) in pazienti post-uremici. Nel restante 5-10% dei casi il pancreas è l’unico organo ad essere trapiantato (Pancreas Transplant Alone-PTA) in pazienti con funzione renale ancora ragionevolmente conservata ma con controllo metabolico particolarmente scarso e/o complicanze croniche in progressione. Quindi, complessivamente, circa il 90-95% di trapianti di pancreas avviene in pazienti con insufficienza renale cronica (in atto o pregressa)(5,7,8).
La sopravvivenza dei pazienti in caso di trapianto SPK, PAK o PTA è, rispettivamente, 95%, 95% e 98% a un anno dal trapianto e 90%, 89% e 94% a tre anni. Nelle stesse categorie, la sopravvivenza del pancreas (che equivale a una condizione di normoglicemia in assenza di terapia insulinica) è risultata 85%, 78% e 78% a un anno, e 80%, 63% e 63% a tre anni. E’ importante sottolineare come, nel tempo, i risultati circa la funzione del pancreas trapiantato (soprattutto nel PAK e nel PTA) siano in continuo e progressivo miglioramento. Ad esempio, per il PAK, la sopravvivenza del pancreas ad un anno era, negli USA, 57% nel periodo 1987-1992, e 79% nel periodo 2001-2003. Per il PTA, i rispettivi valori sono passati dal 55% al 76%. Quindi, l’esperienza mondiale indica un’eccellente sopravvivenza del paziente e una buona
7 sopravvivenza del pancreas trapiantato, con ulteriori margini di miglioramento. Va altresì ricordato che nel caso di trapianto combinato pancreas e rene anche la sopravvivenza del rene è molto buona (91,6% a un anno)(9).
Dati più recenti evidenziano che la sopravvivenza attuariale dei pazienti trapiantati di pancreas e rene, pancreas dopo rene e pancreas isolato è, a 15 anni dal trapianto, rispettivamente del 56%, 42% e 59% (10).
Al contempo, nelle suddette categorie di riceventi, l’emivita del pancreas trapiantato è risultata, nell’ordine, di 12, 7 e 9 anni (interventi eseguiti nel periodo 1998‑1999)(11).
1.3 Effetti sull’aspettativa di vita
Come abbiamo precedentemente accennato, i pazienti con diabete mellito presentano un tasso di mortalità significativamente superiore rispetto a quello della popolazione non diabetica. Inoltre, la presenza di complicanze croniche (in particolare nefropatia e neuropatia) comporta un ulteriore e notevole aumento del rischio di mortalità.
Nei pazienti diabetici con insufficienza renale, il trapianto combinato di rene e pancreas è considerato un intervento salva-vita. Infatti, la sopravvivenza nel tempo dei pazienti sottoposti a trapianto SPK è significativamente migliore rispetto a quella dei pazienti che rimangono in lista d’attesa (o comunque in trattamento dialitico) o che ricevono un trapianto di rene da donatore cadavere. In uno studio condotto su circa 13.000 pazienti, il rischio di mortalità a 5 anni (considerato pari a 1 negli individui in dialisi) è risultato significativamente più basso in caso di trapianto combinato di pancreas e rene (0,40) e di trapianto di solo rene da donatore cadavere (0,75)(12). A 10 anni la sopravvivenza era del
8 67% nei soggetti riceventi pancreas e rene e del 46% in quelli trapiantati con rene da donatore cadavere. Gli effetti favorevoli del trapianto combinato dei due organi rispetto al mantenimento in dialisi o al trapianto di rene da cadavere sono stati osservati in diversi altri studi (10,13-15).
Gli effetti positivi del trapianto combinato di rene e pancreas sulla sopravvivenza dei riceventi sembrano dipendere essenzialmente da una marcata riduzione degli eventi cardiovascolari(16). Da segnalare che, per quanto riguarda la sopravvivenza dei pazienti, alcuni autori riportano una superiorità dell’SPK anche sul trapianto di rene (senza il pancreas) da donatore vivente(17), mentre altri autori sottolineano che le due procedure (trapianto di pancreas-rene e di solo pancreas-rene da donatore vivente) hanno una efficacia simile nei pazienti diabetici tipo 1 e con insufficienza renale(18).
Per quanto riguarda il trapianto di pancreas dopo rene e quello di pancreas isolato, tali procedure sono state inizialmente associate a un impatto negativo sulla spettanza di vita dei pazienti, con un rischio di mortalità (calcolato a 4 anni dall’intervento) aumentato significativamente in caso di pancreas dopo rene (p<0,03) e ai limiti della significatività statistica (p<0,06) in caso di pancreas isolato(15). Tuttavia, dopo un’analisi più approfondita della casistica (con esclusione, ad esempio, dei pazienti iscritti in più di un centro), è stato dimostrato che il trapianto di pancreas dopo rene e quello di pancreas isolato hanno in realtà un effetto neutro sulla mortalità(10,19). In particolare, la sopravvivenza dei pazienti a 4 anni dall’inizio dell’osservazione è risultata del 90,5% in caso trapianto di pancreas isolato e dell’88,3% dopo trapianto di pancreas dopo rene, percentuali leggermente superiori a quelle dei pazienti rimasti in lista per un tempo equivalente (87,3 e 81,7%, rispettivamente)(20). Pertanto, è possibile affermare che, al momento attuale, il trapianto combinato di rene e pancreas ha un effetto positivo sulla prognosi quoad vitam; il trapianto
9 di pancreas dopo rene e di pancreas isolato non sembrano invece influire sulla spettanza di vita dei pazienti, ma sono comunque in grado di migliorarne la qualità di vita mediante l’eliminazione dell’instabilità metabolica e un effetto positivo sulle complicanze croniche del diabete.
1.4 Effetti metabolici
Il trapianto di pancreas, nelle sue varie accezioni, ripristina la secrezione endogena di insulina e i meccanismi della sua regolazione, normalizzando stabilmente e nel lungo periodo i valori glicemici e l’emoglobina glicata, nonché eliminando il rischio di ipoglicemie (10,21).
Un importante studio condotto negli USA (Diabetes Control and Complication Trials-DCCT) ha dimostrato che il trapianto di pancreas, in pazienti con diabete mellito di tipo 1, consente il raggiungimento di livelli di emoglobina glicata più bassi rispetto a quelli di pazienti in trattamento intensivo con insulina (6% vs 7%)(22,23).
I test di tolleranza orale al glucosio (OGTT), eseguiti allorché la terapia steroidea è ridotta ai livelli di mantenimento, hanno dimostrato una secrezione insulinica buona ma ritardata, mentre i livelli glicemici, normali nei valori basali, ritornano alla norma solo a 180 minuti come nei soggetti non diabetici con intolleranza al glucosio. Si è inoltre osservata una normalizzazione sia della prima che della seconda fase di secrezione insulinica in risposta al carico endovena di glucosio(24,25,26-28).
Vengono ripristinate la secrezione di glucagone e, almeno in parte, la risposta controregolatoria all’ipoglicemia(10,21).
10 La produzione epatica di glucosio si normalizza, il profilo lipidico migliora (i livelli di trigliceridi e di colesterolo LDL diminuiscono, mentre aumentano le concentrazioni di colesterolo HDL) e si hanno effetti positivi sul metabolismo proteico(10,29,30).
1.5 Effetti sulle complicanze
E’ facilmente intuibile come la normalizzazione dei livelli glicemici, che si può ottenere mediante il ripristino della secrezione endogena di insulina da parte del pancreas trapiantato, elimini le complicanze acute del diabete.
Meno semplice da definire è l’effetto del trapianto sulle complicanze croniche della malattia: si tratta infatti di pazienti con grave danno vascolare, motivo per cui le complicanze, soprattutto se in fase avanzata, non sempre possono regredire; d’altra parte, nel caso di trapianto combinato di rene e pancreas, possono risentire favorevolmente anche della recuperata funzione renale.
Negli studi con follow-up sufficientemente prolungato è stato osservato che la retinopatia tende a regredire o almeno a stabilizzarsi in una percentuale elevata di casi (fino a oltre l’80%), e comunque più frequentemente rispetto a quanto osservato nei gruppi di controllo(10,21,31,32). La terapia con steroidi, che fa parte delle strategie antirigetto, può peraltro accelerare la progressione della cataratta(33).
Il trapianto di pancreas è in grado, restaurando un adeguato compenso glicometabolico, di far regredire le lesioni tipiche della nefropatia diabetica (alterazioni glomerulari, ispessimento delle membrane, proliferazione dell’interstizio). In due studi successivi, pubblicati nel 1998(34) e nel 2006(35), Fioretto ha preso in considerazione 8 pazienti diabetici di tipo 1 con nota
11 nefropatia diabetica sottoposti a trapianto di pancreas isolato. Le biopsie renali eseguite al momento del trapianto dimostravano il danno glomerulare tipico della nefropatia diabetica con espansione della matrice mesangiale. Dopo un periodo di follow-up di 5 anni, nonostante l’adeguato compenso glicometabolico, si confermava la persistenza di tali lesioni. Una successiva rivalutazione a 10 anni permetteva invece di verificare una risoluzione delle lesioni mesangiali con miglioramento anche di aspetti relativi ai capillari glomerulari. Da questi studi è emerso per la prima volta che fenomeni quali per esempio l’espansione interstiziale sono reversibili e che i tubuli atrofici possono essere riassorbiti.
Se questo è quanto emerso dagli studi sui reni nativi e sull’evoluzione della nefropatia diabetica, altri studi hanno invece indagato alcuni aspetti metabolici, influenzati dal trapianto di pancreas, in grado di ridurre la possibilità di evoluzione verso la nefropatia cronica da trapianto. P. Fiorina(36), nel 2007, ha dimostrato che nei soggetti sottoposti a trapianto simultaneo di rene e pancreas si verifica un miglioramento del metabolismo dei fosfati a livello renale (valutato mediante 31P - spettroscopia in risonanza magnetica), rispetto ai soggetti sottoposti a solo trapianto di rene, suggerendo che il ripristino della funzione β cellulare possa influenzare positivamente anche tali aspetti.
Infine, studi funzionali dopo trapianto di pancreas hanno documentato un miglioramento del controllo pressorio e una riduzione rapida e significativa della proteinuria(37), mentre la clearance della creatinina può ancora peggiorare(10). E’ tuttavia da tener presente che alcuni farmaci immunosoppressori (in particolare gli inibitori della calcineurina) sono nefrotossici, pertanto in caso di trapianto di pancreas dopo rene o trapianto isolato la funzione renale deve essere ragionevolmente ben conservata (filtrato glomerulare di almeno 60 ml/min nel trapianto di pancreas isolato)(10,21).
12 Anche la neuropatia autonomica e quella periferica possono migliorare dopo trapianto di pancreas(10,21). Lo studio con il più lungo follow-up in pazienti affetti da diabete mellito tipo 1 con neuropatia sottoposti a trapianto di pancreas è stato pubblicato nel 1997(38). Nello studio venivano valutati 115 pazienti prima e dopo il trapianto e i risultati erano confrontati con un gruppo di controllo di 92 pazienti. Nei 10 anni di follow-up i pazienti del gruppo di controllo hanno mostrato un progressivo peggioramento della neuropatia, come evidenziato dai test neurofisiologici eseguiti. Al contrario, i pazienti portatori di trapianto di pancreas funzionante mostravano un significativo miglioramento dei parametri di conduzione nervosa motoria e sensitiva già dopo 1 anno dal trapianto, e un significativo miglioramento della neuropatia autonomica dopo 5 anni dal trapianto. In generale, il 60% dei pazienti trapiantati ha avuto un miglioramento della funzionalità motoria, il 50% della funzionalità sensitiva e il 30-45% della funzionalità autonomica. Gli stessi effetti di miglioramento della neuropatia sono stati osservati nei pazienti che avevano ricevuto il trapianto isolato di pancreas così come in quelli che avevano ricevuto il trapianto di rene e pancreas, a dimostrare come l’effetto non fosse secondario alla correzione dello stato di uremia bensì al ripristino della funzione pancreatica(39).
La neuropatia autonomica è stata associata ad un aumento della mortalità(40). Alla luce di quanto sopra esposto è lecito supporre che il miglioramento della neuropatia dopo trapianto di pancreas si traduca in un miglioramento della sopravvivenza del paziente? Esiste uno studio che ha tentato di dare una risposta a questa domanda(41). Sono stati valutati 545 pazienti affetti da diabete mellito e che presentavano neuropatia. Di questi pazienti, 257 erano stati sottoposti a trapianto di pancreas. Durante lo studio 116 pazienti sono deceduti: il tasso di mortalità era significativamente più elevato nei pazienti diabetici che avevano anche un’alterazione dei parametri della neuropatia autonomica
13 rispetto ai pazienti con test normali. I pazienti che presentavano una moderata neuropatia (ma non quelli con severa neuropatia) e che avevano un trapianto di pancreas funzionante, hanno avuto una sopravvivenza più elevata rispetto a coloro che hanno perso la funzionalità del pancreas nei primi tre mesi dal trapianto.
Per quanto riguarda gli effetti sulle complicanze macrovascolari, il trapianto combinato di pancreas e rene si associa a riduzione dell’aterosclerosi coronarica e di quella carotidea, nonché a minor incidenza di infarto del miocardio ed edema polmonare(16,42,43). Sebbene pochi siano i dati attualmente disponibili al riguardo, anche il trapianto di pancreas isolato sembra avere conseguenze favorevoli sull’apparato cardiocircolatorio, come dimostrato dal miglioramento di alcuni parametri funzionali miocardici (valutati mediante ecocardiografia) e dalla diminuzione della pressione arteriosa(44). Peraltro, l’arteriopatia periferica agli arti inferiori non viene favorevolmente influenzata dal trapianto di pancreas(45).
1.6 Indicazioni e controindicazioni
Si ritiene che il trapianto combinato di pancreas e rene sia indicato nei pazienti con diabete tipo 1 e insufficienza renale cronica, siano essi in dialisi o in trattamento conservativo (trapianto preemptive), in assenza delle controindicazioni assolute o relative più avanti riportate (10,21,46,47). La Tabella 1.1 riassume i criteri generali di inclusione o esclusione dei pazienti per il trapianto di rene e pancreas.
In termini prognostici, cioè di prolungamento della spettanza di vita, il vantaggio del trapianto SPK è tanto maggiore quanto più precoce è l’intervento a causa
14 dell’accelerazione del decorso delle complicanze cardiovascolari e dell’aggravamento della neuropatia nei pazienti uremici (anche in trattamento conservativo). Il trapianto preemptive è quindi più vantaggioso rispetto al trapianto eseguito in un paziente già dializzato. Inoltre, nei pazienti in dialisi, la percentuale di successo è maggiore quanto più breve è il periodo di dialisi(48).
Tabella 1.1: Criteri generali di inclusione e/o esclusione per il trapianto di
rene-pancreas.
_________________________________________________________________
Criteri generali di inclusione
Età compresa tra 18 e 55 anni (>55 anni da valutare caso per caso) Presenza di diabete mellito tipo 1
Insufficienza renale cronica secondaria a diabete Grave sindrome nefrosica
Assenza di controindicazioni Criteri generali di esclusione
Insufficiente riserva cardiaca
-Patologia coronarica non correggibile -Frazione di eiezione cardiaca <40% -Recente infarto acuto del miocardio
Arteriopatia cronica periferica diffusa, non correggibile Abuso di sostanze tossiche quali alcool e droghe
Problemi psichiatrici Obesità
15 Nel caso di trapianto di pancreas dopo rene, la scelta si basa sulla necessità di normalizzare la glicemia per meglio preservare il rene trapiantato, nonché sulle indicazioni valide in caso di trapianto di pancreas isolato(10,21,46,47). In particolare, si ricorda che le indicazioni a quest’ultima tipologia di trapianto, così come definite dall’ADA (American Diabetes Association)(46)e confermate dalla SID (Società Italiana di Diabetologia)(47), sono rappresentate dalla presenza di diabete mellito di tipo 1 instabile, con ripetuti episodi di ipoglicemia alternati a iperglicemia, difficilmente controllabili con la terapia insulinica esogena, oppure dalla presenza di problemi clinici e psicologici legati alla terapia insulinica esogena, tanto gravi da risultare invalidanti. Ovviamente, considerata la “vaghezza” della definizione di diabete instabile, si raccomanda che i pazienti con le caratteristiche sopra riportate debbano, prima del definitivo inserimento in lista, essere sottoposti a valutazione diagnostico-terapeutica estremamente attenta da parte dello specialista diabetologo. Peraltro, la SID(47) e vari autori(10,21) includono, tra le indicazioni per il trapianto di pancreas isolato, anche la presenza di complicanze croniche del diabete in evoluzione.
Talvolta può essere difficile decidere se, in presenza di nefropatia non francamente terminale, sia opportuno procedere a un trapianto SPK o vi sia ancora margine per un PTA. E’ infatti noto che l’uso di farmaci inibitori della calcineurina (tacrolimo o ciclosporina) determina un calo del filtrato glomerulare di circa il 25% o anche superiore in presenza di nefropatia diabetica. In ogni caso, il decadimento della funzione renale può essere accelerato dalla tossicità farmacologica. In presenza di sindrome nefrosica o di proteinuria grave (> 3g/dl) il rischio di perdita accelerata della funzione renale dopo PTA è aumentato, sebbene siano noti casi di netto miglioramento della proteinuria fino alla scomparsa della sindrome nefrosica(48). Rispetto al livello di
16 funzione renale, valori di clearance della creatinina < 50 ml/min comportano un rischio maggiore di sviluppare insufficienza renale cronica dopo PTA(49).
Le controindicazioni al trapianto di pancreas sono per molti aspetti simili a quelle da tener presenti in ogni tipologia di trapianto. Esse comprendono: positività per HIV (salvo protocolli specifici), neoplasie attive (da valutare caso per caso), infezioni attive o croniche resistenti al trattamento, insufficienza cardiaca grave e/o cardiopatie non correggibili, grave insufficienza respiratoria cronica, grave aterosclerosi polidistrettuale, anomalie congenite del tratto urinario gravi e non correggibili (valido per trapianto di rene), trombosi venosa iliaca bilaterale, coagulopatie persistenti e non trattabili, ritardo mentale severo in contesto sociale sfavorevole, problemi psicologici gravi, abuso di alcol, tossicodipendenza, obesità, età superiore a 60 anni(50).
Oltre a queste controindicazioni generali, in caso di trapianto SPK è necessario sempre indagare sull’eventuale presenza di controindicazioni specifiche, spesso riguardanti il sistema cardiovascolare come conseguenza della macroangiopatia. Il cuore è il primo organo bersaglio, sia rispetto al circolo coronarico che alla validità di pompa. La presenza di arteriopatia periferica deve essere anch’essa valutata attentamente, sia in termini di fattibilità tecnica del trapianto (disponibilità di assi vascolari idonei all’impianto degli organi) che in termini prognostici. Se infatti da un lato è spesso possibile eseguire il trapianto in presenza di situazioni di arteriopatia grave, dall’altro è necessario considerare che la presenza di arteriopatia obliterante cronica conclamata è comunque indice della gravità delle complicanze croniche del diabete ed ha implicazioni prognostiche negative nel medio-breve termine. Anche la presenza di neuropatia autonomica, difficile da valutare e quantificare, si correla ad una prognosi alquanto sfavorevole(51).
17 Infine, come ricordato in precedenza, nel caso di trapianto di pancreas dopo rene o pancreas isolato la funzione renale deve essere ragionevolmente conservata(50).
1.7 Procedure chirurgiche
Trapianto di pancreas è oggi sinonimo di trapianto dell’intero organo con un segmento di duodeno, utilizzato per drenare la secrezione esocrina (graft pancreatico-duodenale); è realizzato con organi prelevati da donatori cadavere. In realtà il pancreas può essere trapiantato anche in forma segmentaria (coda e parte del corpo) da donatore cadavere, quando sono danneggiati il duodeno o la testa della ghiandola, o da donatore vivente(52,53).
Il prelievo di pancreas, compatibile con quello di tutti gli altri organi, è ormai abitualmente eseguito nel contesto di una procedura multi organo: grazie a particolari accorgimenti tecnici messi a punto da Starlz, è infatti possibile prelevare contemporaneamente sia il pancreas sia il fegato, pur avendo i due organi importanti strutture vascolari in comune. Il prelievo di pancreas e di intestino, per trapianto isolato in due riceventi, è molto delicato, richiede esperienza e, soprattutto, fattiva collaborazione tra équipe chirurgiche(54).
Dopo il prelievo epatico il peduncolo arterioso del pancreas è composto dal moncone dell'arteria splenica e dell'arteria mesenterica superiore, che vengono anastomizzate su un graft iliaco ad Y prelevato dallo stesso donatore. Il peduncolo venoso è costituito dalla vena porta (la vena mesenterica superiore è legata al bordo inferiore del pancreas, mentre la vena splenica è legata alla parte terminale della coda del pancreas).
18 L’accesso per il trapianto di pancreas può avvenire attraverso un’incisione iliaca a J, addominale trasversa o mediana. Il pancreas può essere posizionato in sede extra- o intraperitoneale. L’accesso mediano è il più diffuso e l’organo viene più spesso posizionato in sede intraperitoneale in fossa iliaca destra(51,55).
Le principali varianti chirurgiche riguardano il drenaggio venoso e quello delle secrezioni esocrine. Il deflusso venoso è solitamente (circa 75% dei casi) realizzato nella circolazione sistemica, più spesso nella vena iliaca destra o nella vena cava inferiore. Il drenaggio cavale è semplice e consente di orientare la porta in direzione decisamente ortodromica rispetto al flusso venoso sistemico; può essere adottato di routine o riservato a pazienti con vene iliache poco accessibili (pelvi strette o profonde) o non disponibili (pregressi trapianti, esiti di trombosi). Il pancreas può essere drenato anche nella vena iliaca sinistra ma la disposizione di questo vaso rende più difficile creare una buona geometria vascolare. Quindi nel trapianto SPK il pancreas è solitamente posizionato a destra e il rene a sinistra(51).
Nel drenaggio venoso portale (25%) più spesso il pancreas è posizionato in sede intraperitoneale, nel centro dell’addome, con la testa verso l’alto, adagiato sulla radice mesenterica(56). E’ possibile drenare il pancreas nella porta anche alloggiando l’organo a livello del fianco destro dietro il colon ascendente, in posizione retro-peritoneale(57).
Le secrezioni esocrine possono essere drenate nell’intestino (drenaggio enterico) o nella vescica (drenaggio vescicale): nel primo caso il pancreas è orientato con la testa verso l’alto, nel secondo caso verso la pelvi(56).
Si configurano dunque le seguenti varianti tecniche: a. drenaggio sistemico-vescicale
b. drenaggio sistemico-enterico c. drenaggio portale enterico.
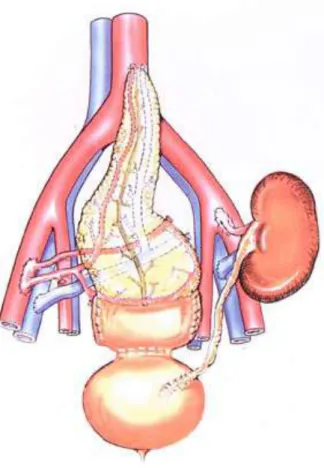
19 1.7.1 Drenaggio sistemico-vescicale
La tecnica di drenaggio sistemico vescicale (Figura 1.1), con uso dapprima di cuffia duodenale e poi di graft duodenale, ha migliorato i risultati del trapianto di pancreas e ne ha consentito un reale sviluppo clinico. Attualmente è ancora usata soprattutto per i trapianti solitari di pancreas o quando vi siano dubbi circa la conservazione del segmento duodenale. Infatti, la gestione di un’eventuale fistola duodenale sarà più facile ed avrà un decorso migliore (minore rischio di sepsi) in caso di anastomosi duodeno-vescicale anziché duodeno-enterica dal momento che un viscere defunzionalizzato, il graft duodenale, viene anastomizzato ad uno sterile, la vescica(52).
20 Da un punto di vista gestionale il drenaggio esocrino in vescica consente di dosare l’amilasi urinaria quale marker per la diagnosi del rigetto pancreatico (sospettato in caso di calo dell’amilasuria)(21,58-61). Inoltre, tramite cistoscopia è possibile visualizzare la mucosa del duodeno ed eseguire biopsie a livello dell’organo trapiantato(21,60,62-64). Questi rilievi sono più utili nei trapianti solitari per la mancanza del “rene sentinella”(52).
Un ulteriore vantaggio è rappresentato dal fatto che il drenaggio urinario permette l’inattivazione degli enzimi pancreatici(55) ed evita la temibile contaminazione da parte di materiale intestinale, associata alla perdita dell’anastomosi enterica(61); d’altro canto, un’eventuale deiscenza dell’anastomosi duodeno-vescicale può essere trattata in maniera conservativa mediante posizionamento di catetere vescicale tipo Foley(55).
Purtroppo però il drenaggio sistemico-vescicale è una tecnica non fisiologica, rispetto sia al drenaggio endocrino che esocrino. Proprio a quest’ultimo aspetto sono legati i maggiori svantaggi di questa tecnica che è associata a complicanze urologiche e metaboliche specifiche.
Le complicanze metaboliche sono causate dalla “perdita” cronica con le urine di liquidi e bicarbonati (di cui sono ricche le secrezioni pancreatiche), che condiziona l’insorgenza di disidratazione, acidosi metabolica ipercloremica ed iponatriemia(21,52,61,64,65). L’elevata morbilità a lungo termine è inoltre gravata da un alto indice di complicanze urologiche quali ematuria, fistola, pancreatite da reflusso, infezioni urinarie recidivanti, cistiti/uretriti chimiche, stenosi e/o digestione enzimatica dell’uretra, calcolosi vescicale, tumori vescicali, balanite, epididimite, prostatite, ascesso prostatico(21,60,61,65-68).
Nonostante l’elevata frequenza (dal 50 al 77% dei casi), raramente tali complicanze esitano in una perdita dell’organo trapiantato o del paziente(66,67,69), ma ne compromettono a tal punto la qualità di vita da
21 richiedere, in circa un quarto dei pazienti, una cosiddetta “conversione cisto-enterica”(52,55,59).
Tale procedura è più frequente nei maschi rispetto alle femmine (24% vs 16%) e può rendersi necessaria anche a distanza di anni dal trapianto. Nei riceventi di trapianti solitari di pancreas, la conversione precoce (< 6 mesi) aumenta il rischio di perdita dell’organo per rigetto. Inoltre, circa il 25% dei pazienti sviluppa complicanze chirurgiche che richiedono un reintervento. Occasionalmente le complicanze post-operatorie possono comportare la perdita dell’organo e perfino il decesso del paziente(52).
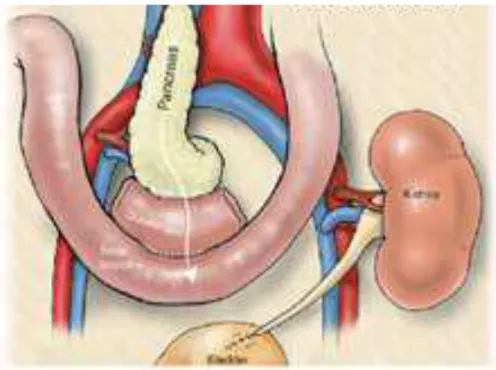
1.7.2 Drenaggio sistemico-enterico
E’ proprio grazie agli ottimi risultati ottenuti con la conversione cisto-enterica, nonché al perfezionamento della tecnica chirurgica e ai progressi nel campo della terapia immunosoppressiva, che è insorto nuovo interesse per il drenaggio enterico (Figura 1.2)(61).
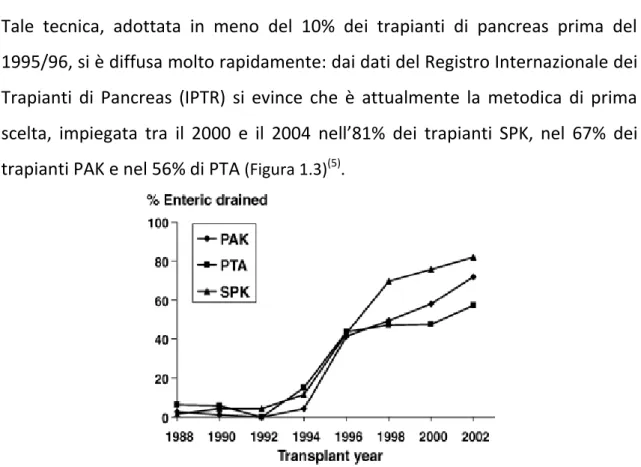
22 Tale tecnica, adottata in meno del 10% dei trapianti di pancreas prima del 1995/96, si è diffusa molto rapidamente: dai dati del Registro Internazionale dei Trapianti di Pancreas (IPTR) si evince che è attualmente la metodica di prima scelta, impiegata tra il 2000 e il 2004 nell’81% dei trapianti SPK, nel 67% dei trapianti PAK e nel 56% di PTA (Figura 1.3)(5).
Figura 1.3: Percentuale di trapianti di pancreas con drenaggio enterico, eseguiti
negli USA, suddivisi per categoria di trapianto.
Tra i fattori che hanno contribuito al successo del drenaggio enterico delle secrezioni pancreatiche, in primis il fatto che la metodica è più fisiologica e preserva l’integrità morfo-funzionale del pancreas; evita inoltre le complicanze metaboliche ed urologiche correlate al drenaggio delle secrezioni esocrine in vescica.
Non bisogna tuttavia dimenticare le possibili complicanze che derivano da tale tecnica, la più temibile delle quali è rappresentata dalla deiscenza dell’anastomosi, con conseguente fuoriuscita di materiale enterico in cavità addominale. Inoltre, la posizione dell’organo trapiantato all’interno della cavità addominale rende difficoltoso il monitoraggio della funzione pancreatica e il riconoscimento tempestivo di eventuali episodi di rigetto, la cui incidenza fortunatamente si è notevolmente ridotta per l’avvento di sempre più efficaci
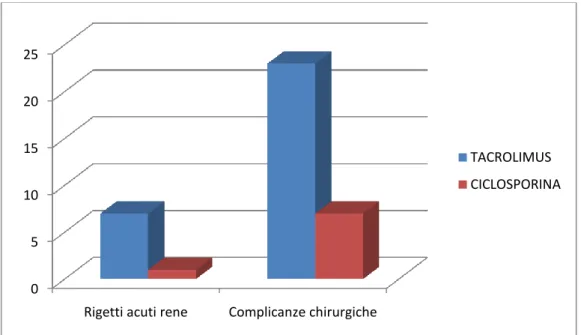
23 terapie immunosoppressive (Tacrolimo, Micofenolato Mofetile, anticorpi monoclonali e policlonali)(21,59-61).
Non vi è, fra i chirurghi, consenso unanime riguardo la superiorità dell’una o dell’altra tecnica di drenaggio delle secrezioni esocrine(70-72).
Secondo i più recenti dati pervenuti all’IPTR e all’UNOS(5), confermati da diversi trial retrospettivi(73) e prospettici(74), non si riscontrano differenze statisticamente significative nel tasso di sopravvivenza dell’organo trapiantato (pancreas o rene) e del paziente, in funzione del tipo di derivazione delle secrezioni esocrine.
La percentuale di eventi trombotici risulta invece più alta nei trapianti eseguiti con drenaggio enterico (5,5-11,6%) rispetto a quelli con derivazione vescicale delle secrezioni (5,0-7,2%)(5). La spiegazione più probabile è il crescente tasso di rigetto non prontamente riconosciuto nei trapianti con drenaggio enterico, che si manifesta come trombosi dell’innesto(75).
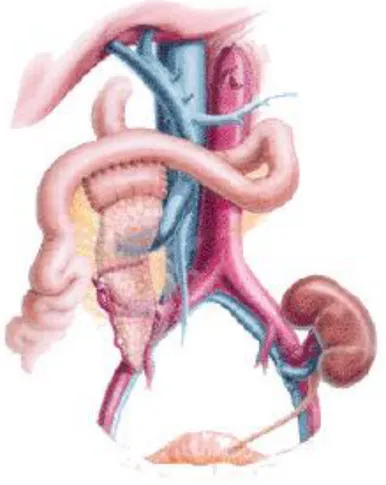
1.7.3 Drenaggio portale-enterico
La tecnica di drenaggio portale-enterico (Figura 1.4), adottata su larga scala solo intorno alla metà degli anni ’90(5), è stata proposta per i suoi teorici vantaggi correlati al mantenimento di una situazione molto vicina alla normale fisiologia dell’organo, sia per quanto riguarda le secrezioni esocrine che per quelle endocrine(76).
La procedura più diffusa è quella che prevede di posizionare il pancreas in sede intraperitoneale centrale al davanti della radice mesenterica(56). Con l’organo in questa posizione è necessario disporre di un graft arterioso ad Y lungo, per poter raggiungere l’arteria iliaca comune di destra. Inoltre al termine del trapianto il pancreas è tipicamente “immerso” tra le anse dell’intestino tenue
24 risultando mal esplorabile ecograficamente e poco accessibile per la biopsia percutanea(51).
Figura 1.4: Trapianto di pancreas con drenaggio portale enterico.
La tecnica descritta da Boggi supera queste difficoltà consentendo di usare un graft arterioso corto e rendendo l’organo facilmente accessibile per l’esplorazione ecografica e la biopsia percutanea. Essa prevede il posizionamento dell’organo nella regione del fianco destro, dietro il colon ascendente; per isolare la vena mesenterica superiore si procede scorrendo davanti della testa del pancreas e della terza porzione duodenale. Il drenaggio enterico viene realizzato in un’ansa digiunale, preparata alla Roux, e trasposta a
25 livello del fianco destro attraverso una breccia creata nel mesocolon. La posizione finale retroperitoneale dell’organo lo rende più facilmente esplorabile agli ultrasuoni essendo meno frequente la sovrapposizione intestinale(57).
In generale il drenaggio portale non è consigliabile nei pazienti obesi, con mesentere spesso, e quando la vena mesenterica è esile; è invece preferibile quando i vasi iliaci non sono disponibili (precedenti trapianti) o non sono idonei (pelvi profonde e strette, esiti di trombosi venosa iliaca)(51).
Come precedentemente accennato, il drenaggio venoso portale (PVD) è una tecnica che riproduce la fisiologia dell'organo: sarebbe dunque, teoricamente, la soluzione ideale in termini di azione dell’insulina e metabolismo lipidico(21). In caso di derivazione venosa sistemica (SVD), infatti, l’insulina prodotta dalla componente endocrina del pancreas viene immessa direttamente nel circolo sistemico, bypassando il fegato: ne deriva un’iperinsulinemia periferica, sia a digiuno che post-prandiale(24,77,78), che può favorire l’insorgenza di potenziali complicanze, in particolare dislipidemie, ipertensione e aterosclerosi accelerata(79,80) (con conseguente aumento del rischio di malattia coronarica e morte(81)). Non vi sono in realtà solide evidenze che confermino tali effetti dell’iperinsulinemia indotta dal trapianto(10). Larsen ha osservato che lo spessore medio dell’intima della carotide, importante marker di rischio cardiovascolare, tende a ridursi dopo trapianto di pancreas con drenaggio venoso sistemico, a dispetto dell’iperinsulinemia(82,83); analogamente, altri studi hanno constatato un rallentamento nella progressione del processo aterosclerotico in riceventi un trapianto SPK con derivazione sistemica(42). La mancanza di studi comparati tra i due tipi di drenaggio venoso non ci consente di appurare se il drenaggio portale possa determinare benefici ancora maggiori su questi parametri.
E’ indubbio comunque che la tecnica di drenaggio portale-enterico consente di raggiungere un profilo metabolico ottimale, in cui l’euglicemia si sposa con livelli
26 di insulinemia sicuramente più bassi di quelli osservati in caso di drenaggio venoso sistemico(84) e comparabili con i livelli di insulina di soggetti non diabetici trapiantati di rene che seguono lo stesso schema di terapia immunosoppressiva(24,85,86).
Per quanto riguarda gli effetti sul profilo lipidico, non si sono riscontrate differenze significative, tra i due tipi di drenaggio (PVD e SVD), nelle concentrazioni plasmatiche dei lipidi totali a digiuno; può però variare la composizione delle lipoproteine(30,87).
Huges et al.(88), in uno studio condotto in gruppi di pazienti non randomizzati, hanno evidenziato molteplici differenze nel profilo lipidico (sebbene in realtà non sia stata studiata la possibile influenza di variabili quali la creatininemia, più elevata nel gruppo con SVD, e il dosaggio della ciclosporina, minore nei pazienti con drenaggio PV): in particolare, nel gruppo che aveva ricevuto un trapianto con drenaggio venoso sistemico si è osservato un aumento della concentrazione delle LDL e un maggior contenuto di Apo B nelle VLDL e nelle IDL; al contrario, il drenaggio portale delle secrezioni endocrine sembrerebbe migliorare il profilo lipoproteico, determinando una riduzione della concentrazione di colesterolo libero, LDL, VLDL e Apo B. In uno studio precedente di Carpentier et al.(89) non si era invece riscontrata alcuna differenza nel contenuto di Apo B nelle VLDL. Anche Petruzzo et al. (90), confrontando due gruppi randomizzati di pazienti diabetici con uremia che avevano ricevuto un trapianto SPK (gli uni con drenaggio PV e gli altri con drenaggio SV) e con medesimo schema di terapia immunosoppressiva, non rilevarono significative differenze nei livelli di colesterolo e trigliceridi.
Il dato di costante riscontro è rappresentato dall’aumento, nei soggetti con drenaggio sistemico, dei livelli dell’enzima Transferasi degli Esteri del Colesterolo (CET), così come accade negli stati iperinsulinemici. Tali livelli
27 enzimatici risultano essere superiori a quelli osservati nei trapiantati di solo rene non diabetici. Non è ancora stabilito se l’incremento dei livelli del CET abbia un ruolo nei meccanismi di sviluppo dell’aterosclerosi (85).
Dunque, nonostante la recente enfasi(84,91-94) attribuita alle vantaggiose conseguenze metaboliche del drenaggio portale-enterico, è difficile trarre conclusioni uniformi dagli studi finora effettuati, i cui risultati sono spesso contraddittori e inficiati dall’esiguo numero di pazienti, dalla mancanza di appropriati casi-controllo e/o da un inadeguato periodo di follow-up (24,92-94). Argomento di dibattito è anche l’esito del trapianto di pancreas in funzione del tipo di derivazione delle secrezioni endocrine.
Alcuni dati clinici, supportati da recenti verifiche sperimentali(95), indicano che il drenaggio venoso portale può ridurre il tasso di rigetto(52)(forse per il transito attraverso il circolo portale degli antigeni di provenienza dal graft (55,96)).
Philosophe et al.(97) hanno dimostrato una significativa superiorità del drenaggio venoso portale, in termini di sopravvivenza del pancreas (79% per PVD vs 65% per SVD, a 3 anni dal trapianto; P=0.008) e tasso di rigetto dell’organo (21% per PVD vs 52% per SVD, a 3 anni dal trapianto; P<0,0001).
Tuttavia, sia Petruzzo(90) che Lo(87) non hanno riscontrato differenze nella sopravvivenza a 5 anni del paziente, del rene e del pancreas trapiantati. Secondo i dati pervenuti all’IPTR e all’UNOS(5) il tasso di sopravvivenza del paziente e dell’organo trapiantato è simile nelle due tipologie di drenaggio endocrino, per tutte le categorie di trapianto.
In assenza di significativi vantaggi di una procedura sull’altra, la maggior parte dei trapianti vengono ancora eseguiti con drenaggio venoso sistemico, in quanto vi è una maggiore esperienza chirurgica, maggiore flessibilità nell’eseguire sia una derivazione enterica che vescicale e una probabile minore mortalità del paziente(15).
28
1.8 Considerazioni sui rischi
Il trapianto di pancreas comporta rischi relativi alla procedura chirurgica in sè (soprattutto quando eseguito nei pazienti con insufficienza renale cronica), nonché rischi dovuti all’uso della terapia antirigetto (in particolare infezioni e rischio neoplastico).
Tuttavia, grazie al miglioramento delle procedure chirurgiche(9,10,21,57) e ai progressi del trattamento immunosoppressivo(9,10,21), tali rischi appaiono contenuti.
In uno studio eseguito su oltre 9000 pazienti è stato osservato che la mortalità nei primi 90 giorni dal trapianto era pari a 3,6%, 2,3% e 1,5% rispettivamente nel trapianto di pancreas e rene, pancreas dopo rene e pancreas isolato(20). Nel medesimo studio veniva riportato che nel periodo da uno a 4 anni dopo il trapianto la mortalità complessiva era del 4,4%: in tale gruppo, le infezioni e le neoplasie rappresentavano non trascurabili cause di morte (rispettivamente 24 e 7,8%)(20). Nel complesso, si ritiene che la mortalità per neoplasie nei pazienti trapiantati di pancreas sia dello 0,6%(98).
Tenendo ben presente tutto questo, va comunque sottolineato che, come visto nei precedenti paragrafi, la sopravvivenza è significativamente più elevata nei pazienti che ricevono un trapianto combinato di pancreas e rene, rispetto a chi non è trapiantato(10,21); inoltre, nel trapianto di pancreas dopo rene e di rene isolato, la sopravvivenza nei pazienti che hanno ricevuto il trapianto è simile a quella di coloro che sono in lista di attesa(10,21).
29
Capitolo 2
LA TERAPIA IMMUNOSOPPRESSIVA
2.1 Premessa
L’introduzione della ciclosporina(99) e, più recentemente, del tacrolimo (FK 506)(100) nella terapia immunosoppressiva dei pazienti sottoposti a trapianto d’organo, ha determinato un significativo aumento sia della sopravvivenza dell’organo che della spettanza di vita del paziente. A fronte di questo risultato positivo vi è l’insorgenza di effetti collaterali legati alla somministrazione a lungo termine di questi farmaci (soprattutto, da un punto di vista metabolico, alterata tolleranza ai carboidrati e dislipidemia).
La malattia cardiovascolare rappresenta, nel suo insieme, la principale causa di morbilità e mortalità nel paziente trapiantato. L’alterazione del metabolismo glucidico aumenta la morbilità e la mortalità dei pazienti favorendo insorgenza e progressione delle complicanze micro- e macrovascolari. La prevalenza della malattia diabetica insorta dopo trapianto d’organo oscilla tra il 6 e il 30% (6-19% dopo trapianto renale; 8-14% dopo trapianto di cuore; 6-30% dopo trapianto di fegato).
Il diabete sembra anche condizionare la funzionalità e la sopravvivenza a lungo termine dell’organo trapiantato. Uno studio(101) ha riportato un tasso di sopravvivenza del rene a 12 anni dal trapianto del 48% nei soggetti che sviluppavano la malattia diabetica, in contrapposizione al 70% che si osservava nei soggetti che non sviluppavano il diabete. Risulta quindi evidente
30 l’importanza di diagnosticare e trattare efficacemente le alterazioni del metabolismo glucidico che insorgono nei soggetti sottoposti a trapianto d’organo.
L’iperglicemia dopo trapianto d’organo riconosce cause varie: ischemia dell’organo trapiantato, rigetto, uso terapeutico di ciclosporina, steroidi e tacrolimo (FK 506). Il diabete mellito insorge generalmente entro il primo anno di trattamento (più frequentemente entro i primi sei mesi) e, in alcuni casi, può essere reversibile. Differenze razziali ed età dei riceventi giocano un ruolo molto importante: la prevalenza è infatti più alta nei soggetti Africani/Americani, nei soggetti con età più elevata e con familiarità per diabete(102).
2.2 I farmaci immunosoppressori
La ciclosporina è il farmaco che ha garantito l’attuale grado di successi di sopravvivenza a lungo termine dell’organo trapiantato(103). La ciclosporina, così come il tacrolimo, esercita un effetto di tipo inibitorio sul segnale di attivazione dei linfociti T, andando in questo modo a sopprimere la risposta immunitaria cellulo-mediata precoce a stimoli di natura antigenica o regolatoria(104). Attraverso il legame con la ciclofillina (proteina citoplasmatica), la ciclosporina determina la formazione di un complesso in grado a sua volta di legare la calcineurina, bloccandola. In questo modo viene meno l’attività enzimatica serina-treonina fosfatasica della calcineurina stessa, necessaria per la traslocazione della componente citosolica del Fattore Nucleare dei linfociti T attivati (NF-Atc) verso il nucleo cellulare: a questo livello, a seguito dell’interazione con la componente nucleare (NF-Atn), avviene il legame con la regione promoter del gene dell’interleuchina 2, con conseguente attivazione
31 della trascrizione genica. La mancata produzione di interleuchina 2 impedisce la differenziazione e la successiva proliferazione delle cellule T citotossiche dirette contro il trapianto.
Il tacrolimo (FK 506) è stato introdotto più recentemente nella pratica clinica(104,105). Il farmaco, strutturalmente diverso dalla ciclosporina, è un macrolide prodotto dallo Streptomyces Tsukubaensis; esso lega, sempre a livello citoplasmatico, un recettore (FK 506 Binding Protein) venendo così a creare un complesso capace di associarsi alla calcineurina, bloccando (come la ciclosporina) la cascata di eventi intracellulari ed intranucleari culminante nella trascrizione del gene dell’interleuchina 2(106).
Sia ciclosporina che tacrolimo causano insulino-resistenza(107). Nel caso della ciclosporina, tale effetto sembra mediato da un difetto post-recettoriale dell’azione insulinica. Più importanti sembrano essere gli effetti sulla secrezione di insulina. La ciclosporina interferisce con la sintesi della pro-insulina e il successivo clivaggio e rilascio dell’ormone. Il farmaco sembra inibire il trasporto intracellulare dell’ormone dal sito di sintesi ai granuli di secrezione. In vitro, l’esposizione di isole pancreatiche umane al farmaco provoca una riduzione nella secrezione insulinica associata ad un concomitante aumento del contenuto residuo insulinico. A livello molecolare, il farmaco agisce attraverso i canali del calcio e dello cAMP, coinvolgendo la fosfodiesterasi calciomodulina dipendente e le proteine regolatorie Gs e G1.
L’effetto del tacrolimo sulla funzione della beta-cellula è stato ben caratterizzato da un punto di vista morfologico(108): è stata infatti osservata la presenza di degranulazione e vacuolizzazione del reticolo endoplasmatico rugoso, dell’apparato di Golgi e dei mitocondri. Il farmaco sembra in grado di inibire la trascrizione del gene dell’insulina provocando in ultimo una riduzione della sua sintesi e secrezione. In uno studio pubblicato recentemente, Bugliani
32 ha dimostrato che beta-cellule pancreatiche umane esposte a tacrolimo vanno incontro a degranulazione, ridotta secrezione insulinica e aumentata apoptosi(109). Inoltre, il farmaco ha indotto numerose alterazioni a livello di espressione genica. Tali effetti sono risultati significativamente più marcati rispetto a quelli causati dalla ciclosporina.
Se i risultati delle esperienze condotte in vitro indicano un chiaro effetto sulla funzione della beta-cellula, in vivo i risultati appaiono controversi. Studi condotti in cani sottoposti ad autotrapianto intrasplenico di isole pancreatiche suggerirebbero un effetto dose-dipendente della ciclosporina. Al contrario, recenti studi eseguiti in pazienti con trapianto di fegato indicherebbero che nè la monoterapia a lungo termine con ciclosporina nè con tacrolimo svolgerebbe effetti deleteri sulla sensibilità insulinica, sulla prima fase di secrezione insulinica e sulla sintesi di insulina(110).
Per quanto riguarda gli effetti degli inibitori della calcineurina sul metabolismo lipidico, in numerosi studi(111,112) la terapia con ciclosporina è stata associata ad aumentati livelli di colesterolo totale, LDL e trigliceridi. Tali effetti sembrerebbero correlati alla concentrazione del farmaco nel sangue(113). Le concentrazioni dei lipidi nel plasma aumentano durante i primi tre mesi dal trapianto, per poi ridursi successivamente senza mai raggiungere i livelli pre-trapianto.
Meno frequente è l’associazione tacrolimo e iperlipidemia(114,115). Studi comparati hanno dimostrato che il tacrolimo influisce in misura minore sul metabolismo lipidico rispetto alla ciclosporina(116,117); inoltre, se sostituito alla ciclosporina nello schema di terapia, è in grado di ridurre le concentrazioni di colesterolo e trigliceridi(118).
Tuttavia, l’evidenza che nei pazienti in terapia con ciclosporina la dose di prednisone era generalmente più elevata rispetto all’associazione
33 tacrolimo/steroidi ha focalizzato l’attenzione sul ruolo degli steroidi nel determinare le alterazioni del metabolismo lipidico nei pazienti trattati con ciclosporina(119-124).
A tal proposito, diversi studi in pazienti trapiantati di rene e pancreas hanno dimostrato che la conversione dello schema terapeutico da ciclosporina-prednisone a ciclosporina-azatioprina, oppure la sospensione dell’assunzione dello steroide, determinava generalmente una riduzione dell’incidenza di ipertensione e diabete (o della necessità di terapia ipertensiva o anti-diabetica), nonché un miglioramento del profilo lipidico. In uno studio(123) si è dimostrato che la cessazione del prednisone aveva effetti positivi anche nei pazienti che assumevano tacrolimo.
Quindi, sembrerebbe ragionevole cercare di ridurre il più possibile la dose di steroidi o, in alternativa, ricorrere a farmaci con minori effetti collaterali(124). Tuttavia, se da un lato la sospensione del trattamento con prednisone offre numerosi vantaggi metabolici, dall’altro può aumentare il rischio di rigetto e deve essere quindi attentamente ponderata(125).
L’incremento dei livelli di colesterolo durante il trattamento con ciclosporina riconosce diverse cause. In studi su modelli animali, si è visto che il farmaco può agire riducendo la secrezione dei lipidi biliari(126) (questi effetti non sono però stati confermati in pazienti trapiantati di fegato(127)). Può determinare una riduzione del catabolismo delle LDL, probabilmente come effetto dell’inibizione della sintesi del recettore per queste lipoproteine(128) piuttosto che per un’aumentata sintesi da parte del fegato di lipoproteine contenenti Apo B(129). Alcuni autori hanno inoltre osservato, in pazienti trapiantati di rene, un effetto della ciclosporina di riduzione dell’attività lipolitica post-eparinica sia a livello epatico che a livello periferico(130), sebbene recenti evidenze non supportino questa osservazione(131).
34 Per quanto riguarda il tacrolimo, non è stato ad oggi effettuato nessuno studio per dimostrare i meccanismi alla base degli effetti del farmaco sui livelli plasmatici di lipidi.
Gli steroidi rappresentano a tutt’oggi una pietra miliare nella terapia immunosoppressiva dei pazienti trapiantati(104).
Il loro meccanismo d’azione nel controllo del rigetto è complesso e multiforme: esercitano un blocco diretto sull’interleuchina 1 e indiretto sulle interleuchine 2, 6 e 15, inibiscono la presentazione dell’antigene e l’attivazione dei linfociti T, inibiscono la migrazione di cellule immuni sul sito e hanno un effetto antiinfiammatorio.
Sono farmaci di prima scelta nel trattamento del rigetto acuto ed impiegati costantemente nei primi mesi del trapianto. Tuttavia, a causa dei numerosi effetti collaterali legati alla loro somministrazione e grazie alla disponibilità di nuovi e potenti farmaci, la loro importanza è ridimensionata.
In un paziente con glicemia a digiuno normale sottoposto a terapia steroidea, l’effetto che si osserva è quello di una variabile associazione di difetti nell’utilizzazione del glucosio dopo carico. L’analisi dei test di tolleranza dopo somministrazione di steroidi rivela un aumento dei livelli plasmatici di insulina accompagnato da un incremento variabile dei livelli glicemici. Questo pattern, caratterizzato da aumento dei livelli glicemici in concomitanza con un aumento dei livelli insulinemici, è caratteristico degli stati di insulino-resistenza.
Vari meccanismi sono stati proposti per spiegare la riduzione nell’azione dell’insulina: aumentata produzione epatica di glucosio, ridotto effetto soppressivo dell’insulina, ridotta utilizzazione insulino-mediata di glucosio a livello dei tessuti periferici (muscolo e tessuto adiposo).
I glucocorticoidi aumentano l’attività degli enzimi chiave della gluconeogenesi ed il rilascio dei precursori gluconeogenetici dai tessuti periferici (aminoacidi e
35 lattato). Il trattamento cronico con steroidi determina anche un aumento dei livelli circolanti di glucagone che a sua volta contribuisce ad aumentare la produzione epatica di glucosio. L’insulino-resistenza periferica indotta dallo steroide è la conseguenza di un’inibizione del legame recettoriale dell’insulina e della riduzione dei trasportatori insulino-dipendenti del glucosio (GLUT4).
Sia la terapia corticosteroidea che gli inibitori della calcineurina, oltre ad avere effetti negativi sull’omeostasi glucidica, sono strettamente correlati con lo sviluppo di ipertensione arteriosa e dislipidemia, tutti fattori che contribuiscono ad aumentare l’incidenza di malattia cardiovascolare nel paziente sottoposto a trapianto.
Il sirolimo (Rapamicina) è un potente farmaco immunosoppressivo recentemente introdotto nella pratica clinica(132).
Mentre ciclosporina e tacrolimo inibiscono la produzione di citochine da parte dei T-linfociti, questo farmaco inibisce la risposta dei T linfociti alle citochine. Il sirolimo agisce infatti a livello di una tappa post-recettoriale dell’interleuchina 2 bloccando il ciclo di replicazione cellulare del T-linfocita a livello della fase S. Il farmaco è ben tollerato e gli unici effetti metabolici sembrano essere sul metabolismo lipoproteico, associati a una maggior tendenza alla trombocitopenia.
L’associazione sirolimo, ciclosporina e steroide ha ridotto, nel trapianto renale, l’incidenza di rigetto acuto a meno del 10% suggerendo la possibilità di limitare al minimo il trattamento con steroidi(133).
Il micofenolato mofetile, derivato sintetico organico ottenuto dalla fermentazione naturale del Penicillum, la cui forma biologicamente attiva è rappresentata dall’acido micofenolico, è un inibitore selettivo dell’enzima Inosina Monofosfato Deidrogenasi, in grado di determinare dunque il blocco della sintesi purinica de novo(134). Lo stop della sintesi purinica produce l’arresto
36 in fase S del ciclo cellulare dei linfociti, sia B che T, che non possono ulteriormente proliferare. La sua tossicità sul midollo osseo può causare episodi di neutropenia, trombocitopenia ed anemia, ma sono segnalati anche effetti collaterali sul tubo gastroenterico (crampi addominali, nausea, anoressia).
Al momento attuale la terapia immunosoppressiva vive momenti di grandi aspettative grazie a nuovi farmaci ormai prossimi alla sperimentazione clinica. Queste nuove molecole agiscono su diverse vie che mediano il legame cellula-cellula con il comune scopo ultimo di ottenere un’efficace immunosoppressione con quanti meno effetti collaterali, soprattutto a lungo termine (ad esempio, l’insorgenza di neoplasie).
L’ultima frontiera in campo trapiantologico è il raggiungimento e il mantenimento della tolleranza intesa come non-responsività immunologica in assenza di terapia immunosoppressiva. A partire dagli studi pioneristici di Medawar del 1950, sono stati fatti passi da gigante verso l’induzione della tolleranza immunologica in modelli sperimentali di trapianto(133). Anche se gli intimi meccanismi non sono ancora del tutto noti, l’induzione della non-reattività dei cloni di T linfociti rappresenta l’obiettivo finale che si sta cercando di ottenere attraverso azioni sul timo (tolleranza di tipo centrale) o sul sistema immune periferico (tolleranza di tipo periferico), con l’attivazione/induzione di apoptosi e con l’attivazione di cellule immunocompetenti ad attività regolatoria/soppressiva.
L’aspettativa è che la crescente disponibilità di nuove molecole possa permettere una più fedele individualizzazione e personalizzazione del trattamento, riducendo sensibilmente anche l’incidenza di diabete dopo trapianto.
37
2.3 Le fasi della terapia immunosoppressiva
La terapia immunosoppressiva consta di due fasi fondamentali:
- la fase di “induzione” comincia appena il paziente viene allertato per il trapianto e ha lo scopo di azzerare completamente il sistema immunitario per poter meglio accettare l’organo;
- la fase di “mantenimento”, più lieve rispetto a quella di induzione, si protrarrà per tutta la vita del paziente (o fino al rigetto dell’organo) e ha lo scopo di proteggere l’organo trapiantato dall’attacco del sistema immunitario dell’ospite.
2.3.1 Terapia di induzione
I farmaci disponibili per la terapia di induzione sono distinguibili in due classi: 1) Anticorpi T-cell depleting, policlonali (Timoglobuline, ATG) o monoclonali (Campath, OKT3). Questi farmaci bloccano l’interazione tra il Complesso Maggiore di Istocompatibilità e il Recettore delle T Cell, per cui il linfocita perde funzionalmente i propri recettori e diviene incapace di rispondere allo stimolo della Antigen Presenting Cell. Sono farmaci molto potenti, utilizzati generalmente nella terapia del rigetto acuto steroido resistente e in protocolli per l’induzione della tolleranza. Presentano notevoli svantaggi: eccessiva immunosoppressione con maggiore incidenza di malattie opportunistiche ed emoproliferative; sindrome da rilascio di citochine seguita talvolta da gravi sintomi cardiocircolatori, gastroenterici e febbre elevata; necessità di somministrazione prolungata con rischio di grave leucopenia.
2) Anticorpi T-cell non depleting (Zenapax o Simulect). Si tratta di anticorpi monoclonali di tipo chimerico (basiliximab, Simulect) o umanizzato (daclizumab, Zenapax) diretti contro la subunità alfa (TAC antigene) dell’interleuchina 2.
38 Vengono bloccati in questo modo solo i linfociti attivati, rispettando le altre vie stimolate dall’interleuchina 2 (monociti e cellule Natural Killer).
Sono farmaci ottimamente tollerati, non sembrano indurre malattie linfoproliferative, non posseggono immunogenicità di rilievo e non producono malattia da rilascio di citochine; sporadicamente sono stati segnalati episodi di edema polmonare acuto nel corso della prima somministrazione.
La differenza principale tra le due molecole è nella loro farmacodinamica: a parità di durata d’azione (circa 30-40 giorni dopo la prima infusione), per il basiliximab sono sufficienti due somministrazioni a dose fissa (20 mg in prima e quarta giornata), mentre per il daclizumab sono necessarie due o cinque somministrazioni a distanza di due settimane l'una dall'altra e a dose di 5 mg/kg. Dal 1993 al 2002, l’utilizzo di ATG è passato dallo 0% al 39%, quello di Zenapax dallo 0% al 16%, e quello di Simulect dallo 0% al 25%(135). Nel trapianto simultaneo di rene e pancreas sono stati usati sia gli agenti T-cell depleting che T-cell non depleting, mentre nel trapianto di pancreas isolato e nel pancreas dopo rene sono stati impiegati preferenzialmente i T cell depleting. Più recentemente le due classi di farmaci sono state utilizzate in combinazione, soprattutto nel trapianto di pancreas isolato(5).
Esaminando i dati dei trapianti di pancreas isolato eseguiti dal 2000 al 2004 e che ricevevano tacrolimo e micofenolato mofetile, l’analisi univariata ha mostrato una significativa differenza (p<0,03) nei tassi di sopravvivenza del graft pancreatico ad un anno dal trapianto in relazione alla terapia di induzione usata, risultando del 91% nei pazienti che avevano ricevuto T cell non depleting, 85% nei riceventi depleting, 90% nei riceventi terapia combinata, e 86% in quelli che non l’avevano ricevuta(5). L’utilizzo di T cell non depleting, sia da solo che in combinazione con depleting, sembra essere superiore all’utilizzo dei soli T cell depleting e all’assenza di terapia di induzione.
39 2.3.2 Terapia di mantenimento
I farmaci inibitori della calcineurina (ciclosporina e tacrolimo) rappresentano una componente fondamentale negli schemi di terapia immunosoppressiva a seguito di trapianto di pancreas.
La ciclosporina, così come il tacrolimo, esercita un effetto di tipo inibitorio sul segnale di attivazione dei linfociti T, andando in questo modo a sopprimere la risposta immunitaria cellulo-mediata precoce a stimoli di natura antigenica o regolatoria.
Mentre fino ai primi anni novanta la ciclosporina rappresentava praticamente il 100% degli inibitori della calcineurina utilizzati nel trapianto di pancreas, dalla seconda metà del decennio lo schema maggiormente impiegato è diventato quello che utilizza il tacrolimo in combinazione con il micofenolato mofetile(100,135,136). I vantaggi che il tacrolimo sembra avere, nel trapianto di pancreas, sono rappresentati da una maggiore sicurezza nei confronti del rigetto del trapianto renale o pancreatico(137), da una migliore sopravvivenza dell’organo e da un minor rischio di trombosi. Inoltre, con gli schemi che utilizzano il tacrolimo, sono descritti protocolli di terapia nei quali si è reso possibile sospendere lo steroide(138-141). D’altro canto, però, il tacrolimo sembra associarsi a una maggiore incidenza di diabete mellito post-trapianto. Secondo alcuni autori(142), mentre nell’immediato post trapianto non emergono differenze significative in termini d’impatto sul metabolismo glucidico tra tacrolimo e ciclosporina, nel medio e lungo termine i soggetti in terapia con tacrolimo tenderebbero ad avere una più elevata incidenza di intolleranza glicemica (78% vs 70%), un’emoglobina glicata più alta (5.3% vs 5.0%), ed una glicemia a digiuno superiore (81 vs 78 mg/dl), senza raggiungere comunque differenze significative.