INDICE
INTRODUZIONE
1.IL DIABETE MELLITO. Pag. 1 Cenni storici pag. 1
Classificazione pag. 3 Epidemiologia pag. 5 Patogenesi pag. 7
2.COMPLICANZE CRONICHE. Pag.14 Meccanismi Patogenetici pag.15 Controllo Glicemico e Complicanze pag.19 Complicanze Oculari pag .22 Complicanze Renali pag. 23
3. COMPLICANZE CARDIOVASCOLARI. Pag. 24
Cardiomiopatia Diabetica pag. 24
Prove Epidemiologiche pag. 25
Modificazioni Strutturali pag.25
Meccanismi della Cardiomiopatia diabetica pag. 26
Disfunzione del SNA Cardiovascolare pag. 31
Correlazione tra la Disfunzione Ventricolare e le Modificazioni
Strutturali pag. 35
4. IL TRAPIANTO DI PANCREAS. Pag. 38
Introduzione pag. 38
Criteri d’Inclusione ed Esclusione, forme di Trapianto pag. 41
Tecniche Chirurgiche pag. 47
Terapia Immunosoppressiva pag. 50
Follow Up pag. 54
5. VALUTAZIONE PRETRAPIANTO. Pag. 56
Esami Ematochimici, Urinari, Tests pag. 57
Esami Strumentali Generali pag. 57
Valutazione dell’Apparato Cardiovascolare pag. 58
6. MATERIALI E METODI Pag. 60
Popolazione in studio pag. 60
Dati relativi al Trapianto pag. 60
Dati anamnestici, biometrici e bioumorali pag. 61
Dati strumentali pag. 61
7.RISULTATI Pag. 66 Soggetti sottoposti a trapianto combinato di Rene-Pancreas pag. 69 Soggetti sottoposti a trapianto di solo Pancreas pag. 74
8.DISCUSSIONE Pag. 77
10. RINGRAZIAMENTI Pag. 82
11. BIBLIOGRAFIA Pag. 83
INTRODUZIONE
1. IL DIABETE MELLITO: cenni storici 1 .
Il termine diabete deriva dal greco “diabaino” vale a dire “passare attraverso” con riferimento al passaggio dello zucchero nelle urine.
Da almeno quattromila anni, la condizione patologica del diabete è conosciuta in campo medico, e la prima evidenza storica è riportata nel papiro egizio di Ebers, scritto intorno al 1550 A.C, nel quale si identifica la poliuria come sintomo e si consigliano alcuni rimedi per combattere l’eccessivo bisogno di urinare, non risulta tuttavia ancora presente la differenziazione tra diabete
Successivamente, testi indiani risalenti al 800-600 A.C. riportavano nell'Ayur Veda che gli insetti e le mosche erano attratti dall'urina di alcune persone, la quale aveva un gusto dolce, e che questo era associabile a certi disturbi.
Il gusto dolce delle urine rimase per secoli un elemento fondamentale della semeiotica medica. Si sarebbe dovuto attendere il II secolo d.C. quando Areteo di Cappadocia, nel suo famoso trattato "SUL DIABETE" operò una sintesi di conoscenze fino allora note, differenziando chiaramente le condizioni di diabete mellito e diabete insipido.
Si ritiene che Areteo sia stato il primo a coniare il termine "diabete", con riferimento al passaggio delle sostanze dolci nelle urine dei malati. Egli, infatti, descrive il diabete come “ lo scioglimento delle membra e della carne nell’urina”.
Questo lavoro rimase un classico testo per l'insegnamento e la pratica medica del diabete sino al milleottocento. Infatti, l'illustre medico italiano Giovan Battista Morgagni (1682-1771) scrisse nel 1761 vari capitoli dedicati alla descrizione, diagnosi, terapia e persino le cause (patogenesi) della malattia diabetica nelle sue varie manifestazioni. La maggior parte delle informazioni riportate dal Morgagni risalgono chiaramente ad Areteo e l'unico sostanziale innovamento riguardava cenni alla restrizione dietetica dei pazienti, che non era descritta nei testi classici.
Inoltre, il Morgagni scrisse con grande intuito scientifico: “La causa (del diabete) non può essere una”.
Questa frase accuratamente descrive lo stato attuale delle conoscenze sulla patogenesi del diabete, che è considerato avere molteplici origini.
1859. Claude Bernard dimostro l’aumentato contenuto in glucosio del sangue diabetico, e riconobbe nell’iperglicemia la manifestazione fenotipica principale del diabete.
1869. Langherans, ancora studente di medicina, descrisse le formazioni insulari all’interno del parenchima pancreatico che ora portano il suo nome.
1889. Von Mehring e Minkowski dimostrarono che i cani potevano essere resi diabetici tramite la pancreasectomia.
1921. Dopo la morte di numerosi cani da esperimento, Banting e Best riuscirono finalmente a tenere in vita un animale i cui dotti pancreatici erano stati legati e la cui porzione esocrina del pancreas era degenerata.
L’estratto ricavato dalla restante porzione di pancreas fu in grado di abbassare rapidamente la concentrazione di glucosio nel sangue e nelle urine di un cane diabetico pancreasectomizzato, un secondo cane diabetico era prossimo al coma e dopo la somministrazione dell’estratto riprese a camminare.
1922. Un ragazzo diabetico di 14 anni ricevette l’estratto pancreatico purificato e migliorò immediatamente.
1923. Banting ottenne insieme a John Macleod il Premio Nobel per la fisiologia e la medicina per la scoperta dell’Insulina.2
IL DIABETE MELLITO: classificazione, patogenesi.
Con il termine diabete mellito s'indica un gruppo eterogeneo di affezioni, caratterizzate da alterazioni del metabolismo dei carboidrati, delle proteine e dei lipidi, che condividono il fenotipo dell’iperglicemia.
Esistono differenti tipi di diabete causati da una complessa interazione di fattori genetici, ambientali e comportamentali, tuttavia le alterazioni metaboliche riscontrate in questa patologia possono essere ricondotte, nella maggior parte dei casi, o a una riduzione della secrezione insulinica da parte delle cellule -pancreatiche, oppure a gradi variabili di insulinoresistenza, alterata secrezione insulinica e aumentata produzione epatica di glucosio.
Le alterazioni metaboliche riscontrate nel paziente con DM determinano alterazioni fisiopatologiche secondarie in molteplici organi e tessuti che impongono un ingente peso sull’individuo e sul sistema sanitario, nei paesi occidentali, infatti, il DM rappresenta la causa principale di ESRD, di amputazione d’arto non traumatiche, di cecità nell’adulto.
Classificazione.3,4
Attualmente il DM è classificato in base al processo patogenetico che conduce all’iperglicemia, invece che ai criteri dell’età d’esordio o del tipo di terapia come avveniva in passato.
La classificazione comprende:
1. Diabete mellito tipo I: legato alla distruzione delle cellule -pancreatiche e che solitamente determina insufficienza insulinica assoluta.
2. Diabete mellito tipo II: che può variare da una forma con predominante insulinoresistenza e carenza insulinica relativa, ad una forma con predominante difetto secretorio e insulinoresistenza.
3. Diabete mellito gestazionale: la resistenza insulinica correlata alle alterazioni metaboliche dell’ultimo periodo di gravidanza aumenta le richieste d’insulina e può condurre allo sviluppo d’iperglicemia o ad alterata tolleranza glucidica.
4. Altri tipi specifici di DM:
Difetti genetici della funzione - cellulare caratterizzati da mutazioni a livello di : Fattore di trascrizione nucleare degli apatociti (HNF) 4, MODY 1.
Glucochinasi, MODY 2. HNF-1, MODY 3.
Fattore di promoter insulinico (IPF) 1, MODY 4 HNF-1 , MODY 5.
DNA mitocondriale
Conversione della proinsulina o dell’insulina.
Difetti genetici nell’azione dell’insulina. Insulinoresistenza di tipo A. Leprecaunismo.
Sindrome di Rabson-Mendenhall. Diabete lipoatrofico.
Malattie del pancreas esocrino: pancreatiti, pancreasectomia, neoplasia, fibrosi cistica, emocromatosi, pancreopatia fibrocalcolosica.
Endocrinopatie: acromegalia, sindrome di Cushing, feocromocitoma, ipertiroidismo, aldosteronoma, somatostatinoma.
Indotto da farmaci: pentamidina, acido nicotinico, glucocorticoidi, ormoni tiroidei, diazossido, agonisti - adrenergici, tiazidici, fenitoina, interferone a, inibitori delle proteasi, clozapina, - bloccanti.
Infezioni: rosolia congenita, citomegalovirus, coxackie.
Forme rare di DM immunomediato: sindrome dell’uomo rigido, anticorpi antirecettore dell’insulina.
Altre sindromi genetiche talvolta associate a DM: sindrome di Down, sindrome di Klinefelter, corea di Huntington, sindrome di Turner.
Nonostante il lungo elenco sopra riportato la quasi totalità dei pazienti affetti da DM è riconducibile al tipo I o al tipo II.
Infatti, circa il 90% dei pazienti diabetici è affetto da DM tipo II e circa il 10 % soffre di DM tipo I.
Il diabete mellito tipo I, come precedentemente detto è secondario alla distruzione delle cellule -pancreatiche tuttavia in base al meccanismo che porta alla distruzione delle cellule insulari può a sua volta essere classificato in due sottogruppi il tipo IA e il tipo IB.
Il tipo IA origina dalla distruzione immunomediata delle cellule , e solitamente conduce ad un deficit insulinico assoluto. Nel tipo IB invece il processo di distruzione è idiopatico.
Il DM tipo II è un gruppo eterogeneo di disordini solitamente caratterizzati da gradi differenti d’insulinoresistenza, alterata secrezione insulinica e aumenta produzione di glucosio epatico. Diversi difetti genetici e metabolici nell’azione e/o nella secrezione dell’insulina determinano il fenotipo del DM tipo II.
L’identificazione di specifici processi patogenetici nel diabete mellito tipo II ha importanti potenziali implicazioni terapeutiche, poiché diventano via via disponibili agenti farmacologici mirati verso specifiche alterazioni metaboliche.
Gli altri tipi di DM comprendono specifici difetti genetici nella secrezione o nell’azione insulinica e una serie di condizioni che alterano la tolleranza glucidica.
Il diabete giovanile ad insorgenza nell’età adulta (maturity onset diabetes of the young, MODY) è un fenotipo di DM caratterizzato da ereditarietà autosomica dominante, insorgenza precoce dell’iperglicemia e alterazioni della secrezione insulinica.
Cinque diverse varianti di MODY5, dovute a mutazioni nei geni codificanti per fattori di trascrizione o glucochinasi delle cellule insulari sono state identificate finora e tutte sono trasmesse come carattere autosomico dominante. Il MODY 2, la variante più comune, è caratterizzata da mutazioni nel gene che codifica per la glucochinasi, un enzima presente esclusivamente a livello epatico, dove svolge un ruolo di fondamentale importanza nel metabolismo del glucosio, e a livello pancreatico dove è coinvolto nel meccanismo di secrezione insulinica. Come risultato della mutazione della glucochinasi, più elevati livelli di glucosio sono necessari per indurre la risposta secretoria insulinica.
I MODY 1, 3, 5 sono causati da mutazioni nei geni codificanti fattori di trascrizione nucleari presenti a livello epatico (HNF-4 , HNF-1 , HNF-1 ) , questi sono espressi anche a livello pancreatico e mediano la trascrizione di geni coinvolti nello sviluppo delle insule e nella secrezione insulinica. Infine il MODY 4 è una rara condizione caratterizzata dalla mutazione a livello del gene promoter dell’insulina (IPF-1, insulin promoter factor –1) il quale è un fattore di trascrizione che regola lo sviluppo del pancreas ma anche la trascrizione del gene dell’insulina. Mutazioni inattivanti omozigoti determinano, infatti, agenesia pancreatica, mentre mutazioni eterozigoti determinano DM ad insorgenza precoce.
La comprensione dei meccanismi molecolari che sta alla base dei MODY è stata importante, poiché a permesso di identificare punti critici nel controllo della funzione
- cellulare.
Diabete mellito tipo I: epidemiologia 6 .
Nel 1985 i malati di diabete, in tutto il mondo, erano 30 milioni, nel 1995 circa 135 milioni, nel 2001 circa 177 milioni. Nel 2030 saranno 370 milioni (+ 110%).
Quattro milioni di persone muoiono ogni anno nel mondo a causa del diabete (9% dei decessi globali) 7. Il diabete mellito di tipo II rappresenta l’85-95% di tutti i casi dei Paesi sviluppati,
mentre il diabete di tipo I rappresenta circa il 10%. Nel 1995 il continente con il più alto numero di diabetici era l’Europa, con 33 milioni di malati, seguito dalle Americhe con 31 milioni e dal Sud Est Asiatico con 28 milioni. I costi per il diabete di tipo II rappresentano tra il 3 e il 6 per cento della spesa sanitaria totale in 8 Paesi europei. In Italia nel 2030 i malati di diabete saranno 5 milioni e 400 mila.
Nel 2001 i dati epidemiologici del DM 8 potevano essere cosi schematizzati:
Popolazione totale - 5.8 miliardi
Popolazione adulta (20 - 79 anni) - 3.4 miliardi
Numero di persone con diabete (20 - 79 anni) - 177 milioni Prevalenza di diabete stimata (20 - 79 anni) - 5.2%
Numero di persone con diabete di tipo I (tutti i gruppi d’età) - 5.3 milioni Prevalenza di diabete di tipo I stimata (tutti i gruppi d’età) - 0.09%
La patologia diabetica mostra una chiara tendenza, in tutti i paesi industrializzati, ad un aumento sia dell’incidenza sia della prevalenza. L’accresciuta prevalenza nel mondo del diabete tipo II, soprattutto legata all’aumento del benessere ed allo stile di vita, ha portato l’OMS a parlare di vera e propria “epidemia”. Stime e proiezioni sul periodo 1994 - 2010 indicano la triplicazione a livello mondiale dei casi di diabete mellito tipo II. Per l'Europa Occidentale è stato previsto un aumento dei casi di diabete mellito tipo II del 27.5% dal 1994 al 2000 e del 54.9% dal 1994 al 2010. Il numero dei diabetici negli Stati Uniti (dove il diabete rappresenta la settima causa di morte) è salito da 1.6 milioni nel 1958 ad 8 milioni nel 1995, mentre in Italia la prevalenza è aumentata dal 2,5% (negli anni 1970) all’attuale 4-4,5%. Anche per il diabete tipo I molti dati epidemiologici evidenziano un aumento dell’incidenza (circa il raddoppio per ogni generazione in taluni casi). Per l'Europa occidentale è stato previsto un aumento dei casi di diabete tipo I del 18.3% dal 1994 al 2000 e del 36% dal 1994 al 2010.
Per esempio la Scandinavia ha la più alta incidenza di DM di tipo I (in Finlandia l’incidenza è di 35/100000 per anno). I paesi che si affacciano sul Pacifico hanno un’incidenza inferiore di DM tipo I, (in Giappone e Cina l’incidenza è di 1 - 3 casi ogni 100000 abitanti per anno) 6; l’Europa
settentrionale e gli Stati Uniti presentano incidenze intermedie (8 –17 casi per 100000 anno). Si ritiene che l’aumento del rischio di DM tipo I, rifletta la frequenza degli alleli HLA ad alto rischio tra i gruppi etnici nelle diverse aree geografiche.
La prevalenza del DM tipo II è più alta in certe isole del Pacifico, intermedia in paesi come l’India e gli Stati Uniti, e relativamente bassa in Russia e Cina, tale variabilità è probabilmente legata sia a fattori genetici che ambientali. Inoltre esiste una discreta variabilità nella prevalenza del DM tra le diverse etnie all’interno di uno stesso Paese, infatti, la prevalenza del DM è circa due volte maggiore negli afroamericani, negli ispanoamericani, e nei nativi rispetto alla popolazione bianca; inoltre l’insorgenza è più precoce nei primi due gruppi che nella popolazione bianca non ispanica.
Diabete mellito tipo I: patogenesi.
Autoimmunità. 9, 10
Il DM tipo I deriva dalla distruzione progressiva e selettiva delle cellule pancreatiche, che conduce in un intervallo di tempo variabile ad una carenza assoluta d’insulina, che diviene insufficiente a far fronte alle richieste metaboliche dell’organismo.
Le cause che conducono alla riduzione della massa globale di cellule sono solo parzialmente note, si ritiene tuttavia che concorrano nella genesi del danno fattori genetici, ambientali, e immunologici.
Gli individui con suscettibilità genetica hanno alla nascita una normale massa di cellule , ma iniziano a perderle in seguito all’instaurarsi di un processo distruttivo immunomediato che avviene nell’arco di mesi o anni. Si pensa che tale processo possa essere innescato da uno stimolo infetttivo e/o ambientale e sia sostenuto da una molecola specifica della cellula .
Una volta iniziato il processo distruttivo, le cellule residue aumentano la produzione e la secrezione d’insulina in modo tale da compensare la riduzione di numero, e permettere il
pertanto l’individuo è del tutto asintomatico e non presenta alterazioni metaboliche evidenti, al contrario iniziano a comparire markers immunologici che testimoniano l’innesco del processo autoimmune.
Il diabete mellito tipo I è preceduto ed associato ad una risposta cronica autoimmune nei confronti d’antigeni delle beta cellule pancreatiche.
I vari autoanticorpi diretti contro determinati autoantigeni della beta cellula pancreatica - quali quelli diretti contro la glutammicodecarbossilasi detti GADA, quelli contro gli autoantigeni IA-2 della tirosinfosfatasi, quelli contro l'insulina endogena detti IAA e quelli contro aspecifici autoantigeni betacellulari detti ICA - sono i marcatori principali di questa fase preclinica del diabete di tipo I e ci permettono ultimamente di tentare una predizione della malattia.
Attualmente siamo però in grado di predire il diabete di tipo I, con sufficiente sicurezza, solo nei parenti di primo grado di pazienti affetti da diabete di tipo I, mentre il margine d'errore è ancora inaccettabile quando si vuole predire la malattia nella popolazione generale. A questo proposito è necessario ricordare come solo il 10% di tutte le nuove diagnosi di diabete tipo I proviene da soggetti con parenti affetti (casi familiari) mentre il 90% proviene da soggetti senza storia familiare (casi sporadici). Si ritiene oggi che una precoce maturazione autoimmune possa accompagnare e favorire in maniera determinante lo sviluppo clinico del diabete. A supporto starebbero il fatto che il rischio ed il tempo necessario allo sviluppo del diabete sono entrambi correlati al titolo di autoanticorpi “precoci” anti- cellula pancreatica (ICA, IA-2/IA-2beta/IA-2JM) e al numero di quest'ultimi contemporaneamente presenti nell'individuo a rischio.
Ultimamente sono stati meglio definiti i probabili meccanismi di maturazione dell'autoimmunità associata al diabete di tipo I con la dimostrazione, che una risposta autoimmune nei confronti dell'antigene tirosinfosfatasico della beta cellula (nei confronti dei suoi vari autoantigeni 2, IA-2beta e IA-2JM) si verifica già nei primi anni di vita (dati ottenuti recentemente da studi prospettici di neonati sani provenienti da genitori uno dei quali con diabete, da genitori entrambi sani e membri adulti di famiglie con storia di diabete di tipo I) 11 e che il progressivo ampliamento
(spreading) della risposta autoimmune ai diversi antigeni della tirosinfosfatasi, con massima specificità per quello JM, si verifica nella stragrande maggioranza dei casi entro i primissimi anni
di vita ed rappresenterebbe il miglior indicatore (indiretto) della distruzione autoimmune della beta cellula (rappresentando quindi un surrogate marker da utilizzarsi eventualmente negli studi di prevenzione) che si estrinseca poi clinicamente nella sindrome diabetica nel corso di un tempo relativamente variabile. L'anticorpo per la regione JM (iuxtamembrane) dell'antigene IA-2JM compare generalmente per primo negli infanti scrinati e determinerebbe una più rapida progressione per il diabete (diabete ad insorgenza infantile rispetto a quello del giovane o del giovane adulto) sia quando presente da solo ma soprattutto quando eventualmente si verifica il fenomeno dello spreading autoanticorpale con la comparsa associata degli autoanticorpi anti IA-2 e IA-2beta. Ciò suggerisce che probabilmente la regione JM possa contenere qualche antigene criptico nei confronti del quale è primariamente diretta l'autoimmunità anticellula pancreatica e la cui identificazione potrebbe aiutare la prevenzione primaria della malattia. E' stato anche ipotizzato che l'autoanticorpo anti IA-2JM possa influenzare la processazione dell'antigene determinando un’attivazione delle T cellule con inasprimento ed autoperpetuazione della cascata autoimmune antibetacellula, i cui indicatori indiretti sarebbero gli autoanticorpi IA-2 e IA2-beta. Il ruolo della componente genetica HLA sarebbe quello di favorire lo spreading di questi autoanticorpi anche se in alcuni bambini la presenza di alcune specificità autoanticorpali si associa egualmente allo sviluppo del diabete anche in assenza degli aplotipi di suscettibilità. Le conclusioni, per ora solo su dati ancora parziali trattandosi di studi prospettici che necessitano di molti anni per giungere alle loro conclusioni definitive, parrebbero indicare che l'autoimmunità anti beta cellula pancreatica è probabilmente un fenomeno patologico che inizia molto precocemente, nel corso della vita dell'individuo a rischio, e che una terapia immunologica può operare efficacemente solo quando può intervenire prima che la maturazione e lo spreading autoanticorpale abbiano avuto la possibilità di esprimersi a pieno, in questo modo operando un vero stop alla cascata autoimmune e non un mero rallentamento della sua progressiva evolutività.
Anticorpi anti-cellule insulari (ICA, Islet Cell Antibodies).
Questi anticorpi sono presenti in più del 95% dei casi di diabete di tipo I in fase iniziale e tendono poi a ridursi sino alla loro scomparsa. Si tende ad attribuire a questi anticorpi un ruolo
predittivo della comparsa di diabete 12: è stato visto che il 50% dei parenti di primo grado
(genitori, fratelli, figli) di soggetti con diabete e portatori d’anticorpi ICA hanno sviluppato il diabete entro nove anni dalla loro evidenziazione. Il valore predittivo è ancora più alto (63%) se i soggetti avevano nel sangue anche anticorpi anti-insulina (IAA).
Anticorpi anti-insulina (IAA, Insulin Auto Antibodies).
Questi anticorpi possono comparire in circolo prima dell'esordio clinico del diabete e sono associati ad un elevato rischio di malattia nei parenti di primo grado di soggetti con diabete di tipo I. Presentano una correlazione inversa sia con l'età sia con la durata della fase preclinica: più elevati sono i livelli di IAA, più rapida sembra essere la progressione verso la malattia, per tale motivo sono un valido marker di predizione della malattia solo in soggetti d’età inferiore ai 10 anni. E' stata osservata un'associazione significativa tra positività autoanticorpale e presenza di HLA DR4.
Questi anticorpi IAA sono importanti per due ordini di motivi. Innanzitutto, sono stati riscontrati in molti soggetti considerati a rischio per il diabete e tale riscontro è spesso parallelo a quello degli ICA descritti precedentemente, aumentando il fattore di rischio per la malattia. Inoltre essi erano alla base di difficoltà terapeutiche quando si utilizzava insulina non di sintesi. La somministrazione di insulina induceva la formazione di questi anticorpi che si legavano ad essa e ne bloccavano l'azione. Poteva però accadere che l'insulina, imprevedibilmente, si liberava da questo legame e poteva indurre crisi ipoglicemiche, in qualunque momento della giornata. Questi anticorpi si rendevano quindi responsabili di una grave instabilità della malattia. Con l'avvento dell'insulina ricombinante di sintesi, identica a quella umana, questi anticorpi reattivi sono scomparsi.
Anticorpi anti-GAD (GAD Glutamic Acid decarboxylase auto antibodies) 13.
Questi anticorpi sono più sensibili e più specifici rispetto agli ICA. Nell'uomo esistono due isoforme di GAD, che differiscono tra loro per peso molecolare (65kD e 67kD), per derivazione
genica e per distribuzione tissutale. La GAD65 rappresenta l'isoforma predominante nelle isole pancreatiche, nelle quali è espressa sia dalle cellule a sia dalle cellule e sembra localizzata a livello delle microvescicole sinaptiche. Essa è codificata da un gene situata nel cromosoma due e presenta un'omologia del 65% con la GAD67. Autoanticorpi antiGAD65 ed antiGAD67 sono stati riportati nei soggetti sia prima sia ala momento della diagnosi di diabete, tuttavia la GAD65 sembra rappresentar l'isoforma dominante.
Autoanticorpi anti - tirosinafosfatasi insulare IA-2
Sono stati dimostrati in soggetti con diabete di tipo I, prima ed al momento dell'esordio clinico della malattia, sono autoanticorpi che reagiscono con due proteine insulari di 37kD (IA2) e di 40kD (IA2b). Sono altamente predittivi di futura comparsa della malattia in parenti di 1° grado di soggetti con diabete di tipo I. Quindi ricapitolando, le evidenze del coinvolgimento del sistema immune nel diabete di tipo I sono:
ICA, islet cell autoantibodies, che sono un gruppo di autoanticorpi diretti contro molecole
espresse dalle cellule delle isole pancreatiche, come il GAD (decarbossilasi dell’acido glutammico), IA-2 (auto antigene insulare di tipo II, una tirosin fosfatasi), Insulina, e un ganglioside insulare.
Infiltrato linfocitario intenso (insulite), si osserva di frequente nelle insule dei casi di recente
insorgenza. L’infiltrato consiste per lo più di linfociti CD8+ e macrofagi.
L’aumento dell’espressione di molecole di classe I così come una espressione aberrante di
Figura 1.
Isola di Langherans normale
Figura 2.
Insulite, si noti l’infiltrazione
linfo - plasmacellulare massiva, che altera e scompagina l’architettura della struttura.
Malgrado il processo distruttivo continui tuttavia le manifestazioni cliniche del DM non si producono se non dopo la perdita di più dell’ottanta percento della massa cellulare , a questo punto esistono ancora cellule residue che sono però in numero insufficiente per mantenere la tolleranza glucidica.
Questo periodo di tempo, può durare da alcuni mesi a due anni dopo la diagnosi. Quando si manifestano i primi sintomi del diabete la maggioranza delle cellule endocrine del pancreas che producono l'insulina è ormai distrutta (l'80-90% del totale) e si rende quindi necessaria la somministrazione di insulina come farmaco, per riportare la glicemia a livelli normali.
A questo punto, nei soggetti in cui si verifica la "luna di miele", le cellule ancora funzionanti riprendono momentaneamente la produzione di insulina, consentendo al paziente una riduzione o addirittura una sospensione delle iniezioni. Purtroppo questo fenomeno è solo temporaneo, dal momento che anche questo 10-20% di cellule "attive" nella produzione dell'ormone cessa poi la sua funzione: non si tratta quindi di una guarigione. Tuttavia questa fase fugace di produzione endogena si esaurisce quando le ultime cellule sono distrutte dal processo autoimmune e l’individuo diventa completamente carente dell’ormone.
Figura 3-Progressione del DM Tipo I.
Genetica 10, 14
Le evidenze che mostrano una suscettibilità genetica a sviluppare il DM di tipo I sono molteplici, tra queste le più significative sono la variabilità dell’incidenza secondo la razza (il DM
è più frequente nei soggetti del nord Europa, mentre lo è molto meno nei soggetti di altre razze come gli asiatici); l’aggregazione familiare, infatti, circa il 6% dei bambini che hanno un parente di primo grado affetto da diabete sviluppano a loro volta la patologia, la concordanza del 70 % tra gemelli omozigoti.
Studi vari hanno evidenziato che lo sviluppo del DM richieda l’ereditarietà di un certo numero di geni sufficienti a conferire la suscettibilità, almeno uno dei geni principali coinvolti nel determinare la suscettibilità al DM tipo I è situato sul cromosoma 6, in corrispondenza della regione HLA.
Questa regione contiene i geni che codificano per gli antigeni del sistema maggiore d’istocompatibilità, e in particolare le molecole MHC II, le quali hanno la funzione di legare e presentare epitopi di antigeni processati ai linfociti T Helper (CD4+), innescando, di fatto, le risposte immuni. Si capisce pertanto che mutazioni nei geni che codificano per tali proteine potrebbero modificare l’affinità del sito di legame, rendendo possibile il legame e quindi la presentazione anche di autoantigeni.
La regione HLA-D contiene tre classi di geni, indicati con le sigle DP, DQ, DR, e ciascuno di questi presenta un elevato polimorfismo possedendo ciascuno numerosi alleli.
La maggior parte degli individui affetti da DM tipo I (circa il 95%) presenta gli alleli DR3 e/o DR4 15, mentre nella popolazione generale la prevalenza di questi antigeni è solo del 40 %.
Il mappaggio più fine dei loci HLA ha dimostrato che gli aplotipi DQA1*0301, DQB1*0302 e DQA1*501, DQB1*0201 sono associati con maggior evidenza al DM tipo I16,17; questi aplotipi sono presenti nel 40 % dei bambini diabetici, e solo nel 2% della popolazione sana degli USA. Si ritiene che le modificazioni genetiche delle molecole di classe II del sistema HLA compromettano il riconoscimento ad opera delle cellule T, o possano modificare la presentazione dell’antigene in seguito alle variazioni del sito di legame
In questo modo gli antigeni del sistema maggiore d’istocompatibilità possono modulare la risposta immune contro autoantigeni presenti a livello delle cellule b pancreatiche.
Oltre all’associazione con l’aplotipo HLA almeno 17 diversi loci genetici possono contribuire alla suscettibilità per il DM tipo IA come per esempio i polimorfismi della regione promoter del gene dell’insulina che sembrano responsabili di circa il 10% della predisposizione al DM tipo IA. Sebbene il DM tipo IA sia chiaramente associato a diversi genotipi predisponenti, la maggior parte degli individui con tali aplotipi non sviluppa il DM, inoltre la maggior parte dei pazienti affetti da tale patologia non ha parenti di primo grado con DM. Questo indica con certezza che oltre alla suscettibilità genetica entrano in gioco altri fattori: primo fra tutti l’ambiente.
Ambiente.18, 19
Stabilito che una suscettibilità genetica sia presente nei soggetti che sviluppano il DM tipo IA, la domande che ci possiamo porre sono quali fattori scatenino la risposta autoimmune.
Sono stati proposti nel corso degli anni numerosi eventi ambientali in grado di innescare la risposta immunitaria, tuttavia nessuno di questi è stato conclusivamente associato al DM.
Tra i possibili fattori sono stati chiamati in causa virus in particolare coxackie 20 e rosolia, ma anche parotite, morbillo, epstein-barr, nonché una precoce esposizione alle proteine del latte vaccino e ai composti della nitrosourea.
In particolare Tre anni fa, Kaufman ed Allen J. Tobin di UCLA hanno dimostrato che un piccolo segmento di GAD (decarbossilasi dell’acido glutamico) è strutturalmente simile ad un segmento di una proteina del coxsackie. La loro interpretazione era che quando il sistema immune attaca questa proteina virale, attaca involontariamente il GAD, che si trova sulla superficie delle cellule
.
Tuttavia i virus coxsackie non possono essere la causa di tutto il diabete di tipo I. Circa uno su cinque diabetici non ha una risposta immunitaria a GAD e la loro malattia può essere innescata da un altro agente.
Gli inneschi, possibili su cui si è focalizzata l’attenzione, includono le nitrosammine usate come conservanti degli alimenti e una proteina presente nel latte vaccino.
Studi epidemiologici, infatti, hanno dimostrato una correlazione tra il consumo di latte vaccino e il DM tipo IA.
2. COMPLICANZE CRONICHE DEL DIABETE MELLITO.
Le complicanze croniche del DM colpiscono molti apparati e sono responsabili della maggior parte della morbilità e mortalità associate a questa malattia. Le complicanze croniche possono essere suddivise in complicanze vascolari e non vascolari. Le complicanze vascolari sono ulteriormente suddivise in micro (retinopatia, neuropatia, nefropatia) e macrovascolari (coronaropatia, vasculopatia periferica, malattia cerebrovascolare). Le complicanze non vascolari comprendono disturbi come la gastroparesi, le disfunzioni sessuali, e le alterazioni cutanee. Questa suddivisione è alquanto arbitraria poiché è probabile che multipli processi patologici siano coinvolti in tutte le forme di complicanze.
Il rischio di complicanze croniche aumenta in funzione della durata dell'iperglicemia; solitamente diventano manifeste nella seconda decade d’iperglicemia. Giacché il DM di tipo II può avere un lungo periodo asintomatico d’iperglicemia, gli individui affetti da DM di tipo II hanno complicanze al momento della diagnosi. Le complicanze microvascolari del DM. sia di tipo I sia di tipo II, derivano dall'iperglicemia cronica. Studi clinici prospettici randomizzati su un ampio numero di pazienti con DM di tipo I o di tipo II hanno dimostrato in modo conclusivo che una riduzione dell'iperglicemia cronica previene o riduce la retinopatia, la neuropatia e la nefropatia. Anche altri fattori non completamente definiti modulano lo sviluppo delle complicanze. Per esempio, nonostante un DM di lunga durata, alcuni soggetti non sviluppano mai nefropatia o retinopatia. Molti di questi pazienti hanno un controllo glicemico del tutto sovrapponibile a quello dei pazienti che sviluppano le complicanze microvascolari. A causa di queste osservazioni, si sospetta che esista una suscettibilità genetica per lo sviluppo di particolari complicanze. Tuttavia, i loci genici responsabili di questa suscettibilità non sono stati ancora identificati.
Le evidenze che suggeriscono un ruolo patogenetico per l'iperglicemia cronica nello sviluppo delle complicanze macrovascolari sono meno conclusive, ma alcuni risultati depongono a
suo favore. Per esempio, gli eventi coronaropatici e la mortalità da due a quattro volte più frequenti nei pazienti con DM tipo II. Questi eventi sono correlati ai livelli di glicemia a digiuno e
post prandiali, così come alla HbAlc. Anche altri fattori (dislipidemia e ipertensione) rivestono ruoli importanti nello sviluppo delle complicanze macrovascolari.
Meccanismi patogenetici delle complicanze. 21,22,23,24,25,26
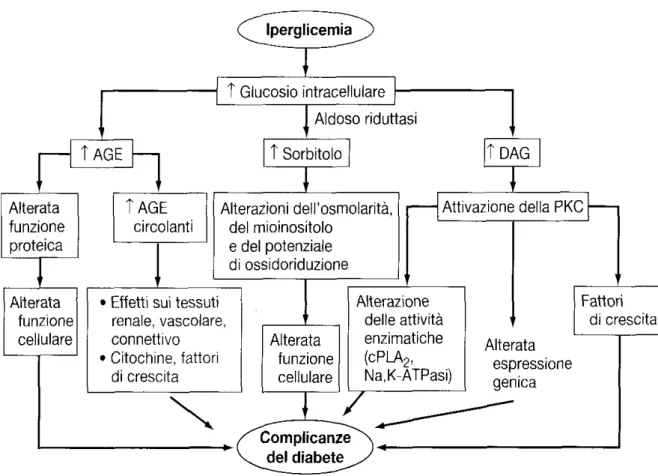
Sebbene l'iperglicemia cronica sia un importante fattore eziologico che induce le complicanze del DM, i meccanismi che determinano la disfunzione cellulare e d'organo non sono noti.
Tre teorie principali, che non sono mutuamente esclusive, sono state proposte per spiegare come l'iperglicemia possa condurre alle complicanze croniche del DM.
Un'ipotesi suggerisce che l'aumento dei livelli di glucosio intracellulare determini la formazione di prodotti terminali di glicosilazione avanzata (advanced glicosilation end products, AGE). Quando la concentrazione plasmatica del glucosio raggiunge e permane a livelli elevati si può avere il fenomeno della glicosilazione non enzimatica delle proteine.
Secondo questo processo il glucosio sarebbe in grado di reagire con i gruppi –NH2 (aminici) delle
catene laterali dei residui aminoacidici delle proteine, per formare delle BASI DI SCHIFF, le quali con il tempo possono andare incontro ad un riarrangiamento intramolecolare che le trasforma prima in composti più stabili noti come Prodotti di AMADORI e successivamente in composti irreversibili noti come AGEs.
Gli AGE una volta formatisi possegono delle caratteristiche chimiche e biologiche tali da risultare patogeni.
Proprietà chimiche
1. Sono in grado di formare legami crociati tra proteine (per es., collageno, proteine della matrice extracellulare), alterandone la struttura, ma anche di intrappolare proteine plasmatiche.
2. Accelerare l'aterosclerosi; nei grandi vasi, infatti, il legame crociato con le LDL può rallentare il loro efflusso dall’intima.
3. Promuovere la disfunzione glomerulare; nei capillari glomerulari le proteine plasmatiche, come l’albumina, possono legarsi alla membrana basale glicosilata spiegando così l’ispessimento della stessa.
4. Ridurre la sintesi d’ossido nitrico, indurre disfunzione endoteliale e alterare la composizione e la struttura della matrice extracellulare.
5. Le proteine che hanno cross-reagito sono resistenti alla proteolisi.
6. Il cross legame AGE indotto nel collagene di tipo IV può infine alterare nella membrana basale glomerulare l’interazione con proteine strutturali come la laminina o proteoglicani alterandone la struttura a funzione.
Proprietà biologiche:
1. Gli AGEs possono interagire con recettori di membrana presenti su differenti tipi cellulari come monociti, macrofagi, endotelio, mesangio, inducendo migrazione monocitaria, secrezione di fattori di crescita, aumento di produzione di matrice, aumento della permeabilità capillare, aumento attività procoagulante.
Il livello sierico degli AGE è correlato ai livelli di glicemia e questi prodotti si accumulano non appena la velocità di filtrazione glomerulare diminuisce.
Una seconda ipotesi proposta per spiegare come l'iperglicemia cronica determini le complicanze del DM è basata sull'osservazione che l'iperglicemia aumenta il metabolismo glucidico attraverso la via del sorbitolo.
Il glucosio intracellulare è prevalentemente metabolizzato attraverso la fosforilazione e la successiva glicolisi, ma quando il glucosio intracellulare è aumentato, una certa quota di glucosio viene convertita a sorbitolo a opera dell'enzima aldoso riduttasi.
Concentrazioni aumentate di sorbitolo alterano diversi aspetti della fisiologia cellulare (riduzione del mioinositolo, alterato potenziale ossidoriduttivo) e possono portare a disfunzioni cellulari.
Tuttavia, la verifica di questa teoria nell'uomo, usando inibitori dell'aldoso riduttasi, non ha dimostrato effetti benefici sulla retinopatia, la neuropatia o la nefropatia.
Una terza ipotesi postula che l'iperglicemia aumenti la formazione del diacilglicerolo, inducendo l'attivazione di certe isoforme di proteinchinasi C (PKC) che, a loro volta, modulano una varietà di eventi cellulari che determinano le complicanze correlate al DM. Per esempio, l'attivazione della PKC da parte del glucosio altera la trascrizione dei geni della fibronectina, del collagene di tipo IV, delle proteine contrattili e delle proteine della matrice extracellulare nelle cellule endoteliali e nei neuroni in vitro.
Sebbene l'iperglicemia cronica sia un importante fattore eziologico che induce le complicanze del DM, i meccanismi che determinano la disfunzione cellulare e d'organo non sono noti. Tre teorie principali, che non sono mutuamente esclusive, sono state proposte per spiegare come l'ipeglicemia possa condurre alle complicanze croniche del DM. Un'ipotesi suggerisce che l'aumento dei livelli di glucosio intracellulare determini la formazione di prodotti terminali di glicosilazione avanzata (advanced glicosilation end products, AGEs) attraverso la glicosilazione non enzimatica delle proteine cellulari. La glicosilazione non enzimatica deriva dall'interazione del glucosio con i gruppi aminici sulle proteine. Gli AGE sono in grado di formare legami crociati tra proteine (per es., collageno, proteine della matrice extracellulare), accelerare l'aterosclerosi, promuovere la disfunzione glomerulare, ridurre la sintesi di ossido nitrico, indurre disfunzione endoteliale e alterare la composizione e la struttura della matrice extracellulare. Il livello sierico degli AGE è correlato ai livelli di glicemia e questi prodotti si accumulano non appena la velocità di filtrazione glomerulare diminuisce.Una seconda ipotesi proposta per spiegare come l'iperglicemia cronica determini le complicanze del DM è basata sull'osservazione che l'iperglicemia aumenta il metabolismo glucidico attraverso la via del sorbitolo. Il glucosio intracellulare è prevalentemente metabolizzato attraverso la fosforilazione e la successiva glicolisi, ma quando il glucosio intracellulare è aumentato, una certa quota di glucosio viene convertita a sorbitolo a opera dell'enzima aldoso riduttasi. Concentrazioni aumentate di sorbitolo alterano diversi aspetti della fisiologia cellulare (riduzione del mioinositolo, alterato potenziale ossidoriduttivo) e possono portare a disfunzioni cellulari. Tuttavia, la verifica di questa teoria
nell'uomo, usando inibitori dell'aldoso riduttasi, non ha dimostrato effetti benefici sulla retinopatia, la
neuropa-tia o la nefropaneuropa-tia.Una terza ipotesi postula che l'iperglicemia aumenti la formazione del diacilglicerolo, inducendo l'attivazione di certe isoforme di proteinchinasi C (PKC) che, a loro volta, modulano una varietà di eventi cellulari che determinano le complicanze correlate al DM. Per esempio, l'attivazione della PKC da parte del glucosio altera la trascrizione dei geni della fibronectina, del collagene di tipo IV, delle proteine contrattili e delle proteine della matrice extracellulare nelle cellule endoteliali e nei neuroni in vitro.
Figura 4. Complicanze del Diabete Mellito.
I fattori di crescita sembrano svolgere un ruolo importante nelle complicanze legate ai DM. Il fattore di crescita dell'endotelio vascolare (vascular endothelial growth facfor, VEGF) è
con laser.Il fattore di crescita trasformante beta (trasforming growth factor , TGF ) è aumentato nella nefropatia diabetica e sembra stimolare la produzione della membrana basale di collagene e fibronectina da parte delle cellule mesangiali.
Si suppone che altri fattori di crescita, come il fattore di crescita derivato dalle piastrine, il fattore di crescita epidermico, il fattore di crescita insulino - simile di tipo I, l'ormone della crescita, e anche l'insulina svolgano un ruolo nelle complicanze del DM. Sebbene l'iperglicemia agisca come fattore di innesco per le complicanze del DM, non è ancora noto se gli stessi processi fisiopatologici sono operativi in tutte le complicanze o se alcuni processi predominano in certi organi. Infine, anche lo stress ossidativo e la generazione di radicali liberi, come conseguenza dell'iperglicemia, possono promuovere lo sviluppo delle complicanze del DM.
Controllo glicemico e complicanze. 27
II Diabetes Control and Complications Trial (DCCT) ha fornito prove definitive che la riduzione dell'iperglicemia cronica può prevenire molte delle complicanze precoci del DM di tipo I. Questo vasto studio clinico multicentrico, condotto su 1400 individui affetti da DM di tipo I ha confrontato il trattamento intensivo e quello convenzionale e ha quindi valutato lo sviluppo di retinopatia, nefropatia e neuropatia.
I soggetti appartenenti al gruppo del trattamento intensivo erano sottoposti a somministrazioni multiple d’insulina ogni giorno e ricevevano un intenso supporto educativo, psicologico e medico. I soggetti nel gruppo del trattamento convenzionale invece, erano sottoposti a due iniezioni giornaliere d’insulina e ad una valutazione nutrizionale, educativa e clinica ogni tre mesi. L'obiettivo nel primo gruppo era la normoglicemia: nel secondo era la prevenzione dei sintomi del diabete.
Gli individui del gruppo di trattamento intensivo raggiunsero livelli di HbAlc sostanzialmente più bassi (7,2%) degli individui del gruppo in trattamento convenzionale.
I risultati del DCCT hanno dimostrato che il miglioramento del controllo glicemico riduceva la retinopatia proliferativa e non proliferativa (riduzione del 47%), la microalbuminuria (riduzione del 39%), la nefropatia clinica (riduzione del 54%) e la neuropatia (riduzione del 60%). Un
migliore controllo glicemico rallentava anche la progressione delle complicanze diabetiche precoci. Vi fu una tendenza non significativa verso la riduzione degli eventi macrovascolari. I risultati del DCCT indicavano che gli individui del gruppo di trattamento diabetico intensivo avrebbero "guadagnato" 7,7 anni addizionali di vista, 5,8 anni in più senza malattia renale allo stadio terminale (endstage renal disease, ESRD) e 5,6 anni in più senza amputazione di un arto inferiore.
Considerando l'insieme delle complicanze del DM, i soggetti del gruppo di trattamento diabetico intensivo avrebbero goduto di ulteriori 15,3 anni di vita senza significative complicanze microvascolari o neurologiche del DM rispetto ai soggetti sottoposti a terapia standard.
Questo si traduce in 5,1 anni in più d’aspettativa di vita per i soggetti del gruppo di trattamento intensivo. Il benefìcio del migliore controllo glicemico durante il DCCT persisteva anche dopo il termine dello studio, quando il controllo glicemico si riduceva.
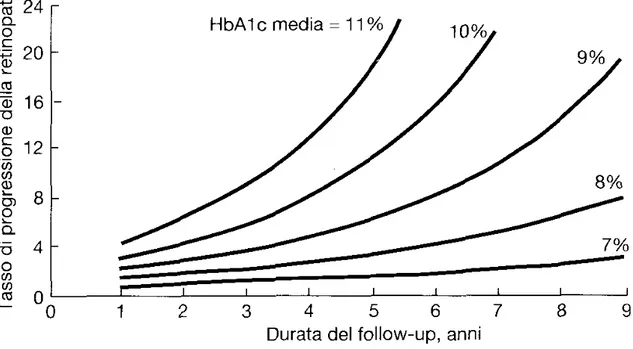
Figura 5-La progressione della retinopatia negli individui seguiti nell’ambito del DCCT è rappresentata in funzione della durata del follow - up con curve diverse per i diversi valori di HbA1c. (da The DCCT research group, Diabetes 44: 968,1995.)
glicemico. Perciò, non esiste una soglia ottimale al di sotto della quale ridurre i valori di HbAIc e prevenire le complicanze del DM. L'implicazione clinica di quest’osservazione è che l'obiettivo della terapia è di raggiungere un livello di HbAIc il più possibile vicino al normale, senza esporre il paziente a un rischio eccessivo d’ipoglicemia.Grandi discussioni sono sorte per stabilire se i risultati del DCCT siano applicabili agli individui affetti da DM di tipo II, nei quali predominano l'insulinoresistenza, l'iperinsulinemia e l'obesità. Sono emerse considerazioni sul fatto che terapie associate ad un incremento ponderale e la terapia insulinica addizionale potrebbero peggiorare la sottostante insulinoresistenza e l'iperinsulinemia. Ciò nonostante, la maggior parte dei dati disponibili avvalorano l'estrapolazione dei risultati del DCCT agli individui con DM di tipo II. L’United Kingdom Prospective Diabetes Study (UKDPS) ha valutato il decorso della malattia più di 5000 individui con DM di tipo II per più di 10 anni. Questo complesso e importante studio ha utilizzato regimi multipli di trattamento e ha monitorato gli effetti del controllo glicemico intensivo e i fattori di rischio sullo sviluppo delle complicanze diabetiche. I soggetti con una recente diagnosi di DM di tipo II furono suddivisi a caso in due gruppi: 1) trattamento intensivo usando varie combinazioni di insulina, una sulfonilurea o metformina; 2) terapia convenzionale usando modificazioni alimentari e farmacoterapia con l'obiettivo di prevenire i sintomi. Inoltre, gli individui venivano assegnati a caso a diversi regimi antiipertensivi. I soggetti in trattamento intensivo raggiungevano una HbAIc del 7%, rispetto al 7,9% del gruppo in trattamento standard. Lo studio UKDPS ha dimostrato che ogni punto percentuale di riduzione dell'HbAIc era associalo ad una riduzione del 35% delle complicanze microvascolari, ad una riduzione del 25% delle morti associate a DM e ad una riduzione del 7% della mortalità generale. Come nel DCCT, vi era una relazione continua tra il controllo glicemico e lo sviluppo delle complicanze. Sebbene non vi fosse un effetto statisticamente significativo del controllo glicemico sulle complicanze cardiovascolari, era evidente una riduzione del 16% degli infarti miocardici fatali e non fatali.Una delle principali conclusioni dell'UKPDS è che uno stretto controllo pressorio riduceva significativamente sia le complicanze macrovascolari sia quelle microvascolari. Infatti, gli effetti benefìci del controllo pressorio erano maggiori degli effetti benefici del controllo glicemico. La riduzione della pressione, sia pure senza arrivare, ai valori consigliati (a livelli moderati (144/82
mmHg) diminuiva il rischio di morte associata al DM, di ictus, di eventi microvascolari, di retinopatia e di insufficienza cardiaca (riduzioni del rischio tra il 32 e il 56%). Il migliore controllo glicemico non riduceva in modo definitivo (ne peggiorava) la mortalità cardiovascolare, ma era associato ad un miglioramento del rischio legato al profilo lipidico, come una riduzione dei trigliceridi e un aumento delle lipoproteine ad alla densità (HDL). Riduzioni simili nei rischi di retinopatia e nefropatia furono osservali anche in un piccolo studio in soggetti giapponesi magri affetti da DM di tipo II. Sottoposti a controllo glicemico intensivo o a terapia standard con insulina (studio Kumamoto). Questi risultati dimostrano l'efficacia del miglioramento del controllo glicemico in individui di diversa etnia con DM ad eziologia presumibilmente diversa (cioè in soggetti fenotipicamente diversi da quelli del DCCT e dell'UKPDS). I risultati del DCCT, dell'UKPDS e dello studio Kumamoto avvalorano l'idea che l'iperglicemia cronica rivesta un ruolo causale nella patogenesi delle complicanze microvascolari del diabete. Questi studi fondamentali dimostrano il valore del controllo metabolico ed enfatizzano l'importanza del controllo glicemico intensivo in tutte le forme di DM, nonché della diagnosi precoce e dello stretto controllo pressorio nel DM di tipo II.
Complicanze oculari nel diabete mellito. 28,27
Negli Stati Uniti il DM è la causa principale di cecità nella fascia d'età tra i 20 e i 74 anni. La gravita di questo problema è sottolineata dal fatto che gli individui affetti da DM hanno una probabilità 25 volte superiore di diventare ciechi rispetto agli individui senza DM. La cecità è principalmente il risultato di una retinopatia diabetica progressiva e di un edema maculare clinicamente significativo. La retinopatia diabetica è classificata in due stadi non proliferativa e proliferativa. La retinopatia diabetica proliferativa solitamente compare verso la fine della prima decade o l'inizio della seconda decade di malattia ed è caratterizzata da microaneurismi vascolari
della retina, emorragie puntiformi ed essudati cotonosi. La retinopatia lieve non proliferativa progredisce verso una malattia estesa, caratterizzata da modificazioni del calibro dei vasi, anomalie microvascolari intraretiniche e più numerosi microaneurismi ed emorragie. I meccanismi fisiopatologici invocati nella retinopatia non proliferativa comprendono la perdita dei periciti retinici, l'aumento della permeabilità dei vasi retinici alterazioni del flusso ematico retinico e l'abnorme microvascolarizzazione della retina, tutte lesioni che determinano ischemia retinica.
La comparsa di neovascolarizzazione in risposta all'ipossia retinica è il carattere distintivo della retinopatia diabetica proliferativa. Questi vasi neoformati possono svilupparsi in corrispondenza del nervo ottico e/o della macula e possono rompersi facilmente, determinando emorragie del vitreo, fibrosi e, distacco retinico. Non tutti gli individui con retinopatia non proliferativa sviluppano la retinopatia proliferativa, ma più è grave la malattia non proliferativa, maggiore è la possibilità d’evoluzione verso la retinopatia proliferativa entro cinque anni. Questo crea una chiara opportunità per un precoce riconoscimento e trattamento della retinopatia diabetica. Per contro, l'edema maculare clinicamente significativo può comparire quando è presente solo retinopatia non proliferativa. La fluoroangiografia è spesso utile per identificare l'edema maculare, che è associato ad una probabilità del 25% di una moderata perdita visiva nei successivi tre anni. La durata, del DM, e il grado di controllo glicemico sono gli indici migliori dello sviluppo di retinopatia. La retinopatia non proliferativa è presente in quasi tutti gli individui con DM da più di 20 anni (incidenza del 25% entro cinque anni e dell'80% entro 15 anni del DM di tipo I). Sebbene esista una suscettibilità genetica per la retinopatia, essa influenza meno lo sviluppo della retinopatia rispetto alla durata del DM e al grado di controllo glicemico.
Complicanze renali del diabete mellito. 29,30
La nefropatia diabetica è la causa principale di malattia renale allo stadio terminale (ESRD), negli Stati Uniti, e una delle cause principali di morbilità e mortalità correlate al DM. Nei soggetti, con DM la proteinuria è associata a marcata riduzione della sopravvivenza e aumentato
rischio di malattia cardiovascolare. Gli individui con nefropatia diabetica spesso presentano anche retinopatia diabetica.
Come per altre complicanze microvascolari, la patogenesi della nefropatia diabetica è correlata all'iperglicemia cronica. I meccanismi attraverso i quali l'iperglicemia cronica determina ESRD, anche se non completamente definiti, sono i seguenti; interazione di fattori solubili (fattori di crescita, angiotensina II, endotelina, AGE), alterazioni emodinamiche nel microcircolo renale (iperfiltrazione glomerulare, aumentata pressione capillare glomerulare) e modificazioni strutturali nel glomerulo (aumento della matrice extracellulare, ispessimento della membrana basale, espansione mesangiale, fibrosi). Alcuni di questi effetti possono essere mediati attraverso i rccettori dell'angiotensina. Il fumo accelera il declino della funzione renale. La storia naturale della nefropatia diabetica è caratterizzata da una serie di eventi in certa misura prevedibili. Sebbene tale sequenza di eventi sia stata definita solo per gli individui affetti da DM di tipo I, una sequenza simile è probabile anche per il DM di tipo II. Iperperfusione glomerulare e ipertrofia renale si sviluppano nei primi anni dopo l'insorgenza del DM e si riflettono in un incremento della velocità di filtrazione glomerulare (glomerular filtration rate, GFR). Durante i primi cinque anni di DM un ispessimento della membrana basale del glomerulo, ipertrofia glomerulare ed espansione del volume mesangiale si verificano non appena il GFR ritorna nella norma. Dopo 5 -10 anni di DM tipo I, circa il 40% degli individui inizia ad eliminare piccole quantità d’albumina con le urine (microalbuminuria). La microalbuminuria, e la presenza di 30 - 300 mg/die d’albumina nella raccolta delle urine delle 24 ore, o di 30 - 300 g/mg di creatinina in un campione d’urine. La comparsa di microalbuminuria, nefropatia incipiente, nel DM di tipo I è un indice molto importante di progressione verso la proteinuria franca (>300 mg/die).
La pressione arteriosa può aumentare leggermente a questo punto ma solitamente rimane nel range di normalità. Una volta instauratasi una franca proteinuria, vi è un declino stabile
nel GFR e, circa il 50.% degli individui va incontro a una ESRD nell’arco di 7 - 10 anni. Le modificazioni patologiche precoci e le anomalie dell'escrezione d’albumina sono reversibili con la normalizzazione della glicemia. Tuttavia, una volta che la nefropatia diventa manifesta le alterazioni patologiche sono verosimilmente irreversibili.
La nefropatia che si sviluppa nel DM di tipo II differisce da quella del DM di tipo I per i seguenti aspetti:
1) La microalbuminuria o la nefropatia manifesta può essere presente al momento della diagnosi di DM di tipo II, indicando il suo lungo periodo asintomatico;
2) l'ipertensione accompagna la microalbuminuria o la nefropatia franca più frequentemente nel DM tipo II;
3)la microalbuminuria può essere meno indicativa della progressione verso la nefropatia franca.
3. COMPLICANZE CARDIOVASCOLARI DEL DIABETE MELLITO
Mortalità da cardiopatia ischemica nel Diabete Mellito tipo I
Il Diabete di tipo II è responsabile di più del 90% di tutti casi di diabete e la maggior parte degli studi sul rischio di cardiopatia ischemica ha analizzato la popolazione di mezza età o anziana. Tuttavia, una raccolta inferiore di dati identifica nei pazienti con diabete di tipo I un aumentato rischio di cardiopatia ischemica.
Nello studio di Framingham, 292 pazienti con diabete di tipo I monitorati per 20 - 40 anni avevano una mortalità cumulativa per CAD che era approssimativamente quattro volte maggiore di quella osservata nei non diabetici (35% versus 8% prima dei 55 anni).31
A prescindere dall’età d’insorgenza del diabete, i primi decessi correlati a CAD si avevano entro quarantanni e la frequenza della mortalità cumulativa aumentava a frequenze simili nei successivi 20 anni. L’aumento della mortalità per CAD dopo l’età di 30 anni appariva particolarmente evidente nei pazienti con complicanze renali, che avevano un rischio stimato di CAD 15 volte superiore rispetto a quello dei pazienti senza proteinuria persistente.
Studi osservazionali su altre popolazioni hanno prodotto risultati simili 32, 33
Questi dati identificano la proteinuria persistente come un potente fattore predittivo dello sviluppo di CAD in questa popolazione.
LA CARDIOMIOPATIA DIABETICA.
Una serie di dati accumulati nel corso degli anni, grazie a studi sperimentali, epidemiologici, anatomopatologici, e clinici hanno mostrato che il diabete mellito determina cambiamenti nella funzione e nella struttura del cuore che sono indipendenti dall’ipertensione, patologia coronarica, o da altre cause note di patologia cardiaca.
Questi dati supportano l’esistenza di una Cardiomiopatia Diabetica.
Prove Epidemiologiche.
I dati del Framingham Heart Study hanno corroborato le prime osservazioni che suggerivano l’esistenza di una cardiomiopatia diabetica. Nella coorte del Framingham, dopo aggiustamento per età, pressione arteriosa, livelli di colesterolo, obesità e una storia di CAD, la presenza di diabete ha quadruplicato il rischio di cardiopatia ischemica negli uomini di 65 o più anni. Nelle donne di 35 - 64 anni d’età, il diabete ha comportato un aumento di cardiopatia ischemica di otto volte e di quattro volte nelle donne più anziane. 34
Modificazioni strutturali del cuore nel diabete.
Numerosi studi su animali, e uomini hanno mostrato la presenza di modificazioni strutturali del miocardio che si verificano in parallelo con le alterazioni funzionali, in assenza d’ipertensione, coronaropatia, o difetti di conduzione intraventricolare. 35, 36
In uno studio sperimentale con 54 topi OLETF (diabete tipo II), che presentano obesità media, iperglicemia postprandiale, e iperinsulinemia, la bassa velocità del picco di flusso transmitralico durante la prima parte della diastole, e il prolungato tempo di decelerazione era associato alla presenza di fibrosi extracellulare e all’aumento dei recettori per TGF - 1 sui miociti del ventricolo sinistro.
A 15 settimane d’età, il rapporto tra l’area del tessuto collagene e il campo visivo della parete del ventricolo è risultato essere più elevato nei topi OLETF rispetto a quelli non diabetici, allo stesso
modo il rapporto tra il contenuto di tessuto collageno e il peso secco del tessuto cardiaco, è risultato significativamente aumentato negli OLEFT rispetto ai controlli.37
Questi risultati indicano che la fibrosi cardiaca nei soggetti con diabete di tipo II inizia a manifestarsi già ad uno stadio precoce. In altri studi, usando tecniche particolari per quantificare le modificazioni nella morfologia cardiaca che accompagnano il diabete indotto con la somministrazione di streptozotocina, i risultati mostrano che il tempo per raggiungere la tensione massima e il tempo di rilassamento dei muscoli papillari è prolungato, mentre il rapporto tra la massa cardiaca e il peso corporeo è aumentato, e che il volume dei componenti la matrice extracellulare è aumentato di tre volte rispetto agli animali non diabetici.
Allo stesso tempo, questi studi dimostrano anche che il volume, la densità della superficie, e l’area totale dei capillari è ridotta, così come il volume della frazione mitocondriale dei miociti, mentre è aumentata la distanza che l’ossigeno deve compiere durante la diffusione dai capillari ai mitocondri. 38
La fibrosi rappresenta quindi la principale modificazione anatomopatologica riscontrabile nella cardiomiopatia diabetica. Il processo fibrotico può interessare sia il tessuto perivascolare sia quello interstiziale, e con la progressione del diabete si assiste ad un’aumentata perdita di miociti che sono sostituiti dal tessuto fibroso.
In uno studio autoptico di nove pazienti diabetici (sei con insufficienza cardiaca), Regan e al. 39
hanno descritto, oltre alla fibrosi, un accumulo interstiziale di materiale PAS positivo (periodic acid Schiff), glicoproteine, nei cuori dei soggetti diabetici. Una simile evidenza morfologica per la cardiomiopatia diabetica è stata ottenuta da Nunoda et al. 40 in sette soggetti di controllo e nove
pazienti diabetici senza ipertensione arteriosa o cardiopatia ischemica. Le biopsie miocardiche ottenute dal ventricolo destro mostravano, infatti, che il diametro medio delle cellule cardiache era significativamente maggiore nei diabetici rispetto ai soggetti sani.
Più recentemente, il grado di fibrosi nei cuori di pazienti diabetici è stato quantificato mediante ecocardiografia tissutale con analisi backscatter, che è direttamente correlata al contenuto di collagene del tessuto miocardico. In uno studio coinvolgente ventisei pazienti con diabete di tipo I, asintomatici e senza ipertensione o coronaropatia, il segnale d’integrated backscatter nel setto e
nella parete posteriore è risultato più elevato nei diabetici che nei controlli. La più probabile spiegazione per quest’aumento di riflettività acustica del miocardio risiede nell’aumentato contenuto di tessuto connettivo.
Evidenze sperimentali hanno dimostrato che il tessuto collagene è uno dei principali determinanti dello scattering ecocardiografico, e che esiste una relazione diretta tra i depositi di collagene e l’intensità del segnale di backscatter. 41
Quindi, l’aumento della riflettività del tessuto miocardico, nel soggetto diabetico può rappresentare un marker precoce di cardiomiopatia diabetica.
Meccanismi della cardiomiopatia diabetica
Lo sviluppo della cardiomiopatia diabetica è probabilmente multifattoriale. Meccanismi putativi includono alterazioni metaboliche, fibrosi del miocardio, alterazioni del microcircolo coronarico, la disfunzione autonomica, e la resistenza insulinica.
Disturbi metabolici
Alterazioni nell’apporto e nell’utilizzazione di substrati
I cambiamenti metabolici nei diabetici sono innescati direttamente dall’iperglicemia. 42 Il
difetto primario nel cuore del paziente diabetico risiede nell’alterata utilizzazione della glicolisi e nell’ossidazione del glucosio. 43 Aumentate evidenze suggeriscono che l’alterato apporto e
utilizzazione dei substrati energetici da parte delle cellule cardiache potrebbe essere l’iniziale insulto nella patogenesi di questa specifica patologia del tessuto cardiaco. 44 una significativa
riduzione nell’apporto e nell’utilizzazione del glucosio da parte del miocardio è stato osservato in cardiomiociti diabetici isolati 45 e nei pazienti diabetici. 46
La principale restrizione all’utilizzazione del glucosio è rappresentata da un rallentamento nel trasporto attraverso la membrana plasmatica delle cellule cardiache, probabilmente legato alla deplezione dei transportatori del glucosio (GLUTs) 1 e 4 47,48, che può essere tuttavia corretto con
Un secondo meccanismo per la riduzione dell’ossidazione del glucosio si manifesta attraverso l’aumento dell’ossidazione degli acidi grassi, che ha un effetto inibitorio sulla piruvato deidrogenasi 50.L’importanza potenziale di questo meccanismo è esemplificata dall’osservazione
che gli animali diabetici con bassi livelli di trigliceridi sono resistenti allo sviluppo della cardiomiopatia 51. Entrambi questi meccanismi patogenetici sono potenzialmente reversibili nelle
prime fasi della malattia, infatti, la disfunzione cardiaca può essere migliorata con un miglioramento del controllo metabolico.
Studi su cuori di topi geneticamente diabetici hanno dimostrato che l’alterato metabolismo cellulare intacca la funzione contrattile del miocardio 52. La disfunzione contrattile si manifesta
come incremento della pressione telediastolica del ventricolo sinistro, riduzione della pressione sviluppata durante la sistole, riduzione della gittata cardiaca, e nella forza di contrazione.
Il tasso d’utilizzazione del glucosio esogeno, per la glicolisi, era il 48% del controllo, mentre l’ossidazione del glucosio era depressa al 16% del controllo, e l’ossidazione del palmitato era aumentata di due volte.
L’aumento dell’espressione del GLUT-4 in cuori perfusi di topi geneticamente diabetici, normalizzava sia il metabolismo sia la funzione cardiaca. Questi risultati supportano strettamente il ruolo che l’alterato metabolismo del glucosio gioca nella cardiomiopatia diabetica 53.
Simili risultati sono stati ottenuti in uno studio ecocardiografico. In topi geneticamente diabetici (db/db), a sei settimane di età, sia la funzione diastolica che quella sistolica non erano modificate, ma a 12 settimane erano ridotti, l’accorciamento frazionale, la velocità di accorciamento circonferenziale delle fibre e il rapporto E/A del flusso transmitralico, indicando lo sviluppo della cardiomiopatia diabetica. Queste modificazioni funzionali non si osservavano nei topi (db/db) che esprimevano recettori GLUT-4 umani, confermando di fatto che l’alterato metabolismo cardiaco può causare disfunzione contrattile nei topi db/db e che questo processo è associato all’apporto e all’utilizzazione di substrati.
Tuttavia, la principale alterazione nel metabolismo dei carboidrati nel miocardio diabetico non è da ricercare nella glicolisi ma nella ossidazione del piruvato 54,55.
Metabolismo degli acidi grassi liberi.
Elevati livelli di FFA sono ritenuti uno dei principali fattori che contribuiscono alla patogenesi del diabete.
Gli FFA accrescono la resistenza insulinica e innescano la morte cellulare. Disturbi del metabolismo degli FFA possono essere un importante contributo al funzionamento anormale del miocardio nel diabete. Questi cambiamenti sono caratterizzati dall’aumento della concentrazione di FFA circolanti causato da un’aumentata lipolisi del tessuto adiposo. Oltre all’inibizione dell’ossidazione del glucosio, elevati livelli circolanti e intracellulari di FFA possono determinare un’abnorme richiesta d’ossigeno per il loro metabolismo e accumulo intracellulare d’intermedi potenzialmente tossici 44,56. Un alterato metabolismo degli FFA è stato dimostrato nella
cardiomiopatia dilatativa idiopatica, infatti, in questa, il tasso di uptake di FFA è inversamente proporzionale alla severità della disfunzione miocardica 57. E’ possibile che un simile difetto
contribuisca allo sviluppo della cardiomiopatia diabetica. L’alterata ossidazione del glucosio indotta dal metabolismo degli FFA può rappresentare il principale fattore nello sviluppo della cardiomiopatia, e può spiegare perchè la funzione ventricolare tende a migliorare con il miglioramento metabolico. Inoltre, la disponibilità di carnitina, essenziale per il metabolismo degli FFA, è usualmente ridotta nei pazienti diabetici, inoltre studi su topi resi diabetici mediante streptozotocina mostrano che la cardiomiopatia è correlata con la riduzione dei livelli sierici e miocardici di carnitina 58.
Alterazione dell’omeostasi del calcio.
Lo stress ossidativo causato da specie tossiche può giocare un ruolo critico, nel rimodellamento subcellulare e nell’alterato trasporto del calcio. L’alterazione nella funzionalità delle proteine regolatrici e contrattili, della Ca2+-ATPase presente sulla membrana del reticolo
sarcoplasmatico e dello scambiatore Na+-Ca2+ della membrana plasmatica, possono contribuire
all’alterato metabolismo lipidico e dei carboidrati nel diabete. Questi cambiamenti risiedono probabilmente nell’accumulo di molecole tossiche come radicali liberi e nell’abnorme contenuto