UNIVERSITA’ DI PISA
DIPARTIMENTO DI RICERCA TRASLAZIONALE DELLE NUOVE
TECNOLOGIE IN MEDICINA E CHIRURGIA
Corso di Laurea Specialistica in Medicina e Chirurgia
Tesi di Laurea
L'epidemia di
Clostridium difficile
nella Azienda Ospedaliero-Universitaria Pisana
negli anni 2012 e 2013
RELATORE
Dott. Francesco MENICHETTI
CANDIDATO
Marco COTRUFO
2
Sommario
L'infezione da Clostridium difficile rappresenta la principale forma di diarrea nosocomiale associata ad antibiotici. Essa è responsabile di aumento della mortalità e prolungamento dei tempi di degenza. Il Clostridium difficile, batterio gram-positivo, è presente nell'ambiente ospedaliero in forma di spore e si trasmette ai pazienti mediante contatto diretto o indiretto. La disbiosi, alterazione della composizione e quantità del microbioma intestinale causata da antibiotici, costituisce condizione necessaria allo sviluppo della patologia. Altri fattori di rischio sono l'età >65 anni, l'uso di inibitori di pompa protonica, la presenza di comorbidità e di uno stato di immunodeficienza.
L'obiettivo di questo lavoro è caratterizzare l'epidemia di CDI all'interno della Azienda Ospedaliero-Universitaria Pisana in termini di epidemiologia, esito, fattori di rischio, caratteristiche cliniche e comorbidità nel biennio 2012-2013. I dati relativi ai test effettuati nel biennio oggetto di studio provengono dall'archivio informatico del laboratorio di Microbiologia Universitaria. Con opportuna selezione è stato possibile individuare prima gli episodi di CDI ed in seguito i pazienti, quindi valutare la documentazione clinica di soli 139. Nel biennio 2012-2013 nella AOUP sono stati effettuati 70 test/10.000 giornate di degenza, il 10% dei quali è risultato positivo per una incidenza di 4,4 test positivi/1000 ricoveri. La frequenza di test è superiore nei reparti di area medica. Sono stati individuati 301 episodi di CDI di cui 254 primi episodi e 47 episodi di recidiva. E' stato confermato un andamento endemo-epidemico dell'infezione con una presenza continua e sostenuta a livello di ospedale e cluster di episodi osservabili nei singoli reparti. La mortalità a 30 giorni è del 6%, la percentuale di recidiva è del 17%. La popolazione è prevalentemente >65 anni con rapporto M:F pari a 1. I deceduti hanno un'età media superiore ai guariti e recidivati. Le principali comorbidità sono risultate essere le malattie cardiovascolari (53%), neoplasia (35%) e malattie cerebrovascolari (26%). La durata della diarrea, l'intervallo sintomi/terapia e l'intervallo sintomi/test sono risultati maggiori nel gruppo dei decessi. Lo studio della terapia ha mostrato la tendenza a somministrare dosi eccessive di farmaci specifici (vancomicina >1000mg/die e metronidazolo >1500mg/die) e per periodi brevi (<10 giorni). L'analisi univariata ha individuato la febbre come fattore predittivo positivo di recidiva e il sondino naso-gastrico, la chirurgia recente e la durata del ricovero come fattori predittivi negativi. Il dato sulla durata del ricovero è stato confermato dall'analisi Random Forest e necessita di ulteriori indagini di conferma, costituendo una osservazione inattesa e per le implicazioni che potrebbe avere in termini di atteggiamento clinico.
3
Indice
Introduzione ... 4 Eziologia ... 5 Patogenesi ... 8 Epidemiologia ... 12 Fattori di rischio ... 14 Caratteristiche cliniche ... 16 Diagnosi di laboratorio ... 17 Decorso e Prognosi... 19 Terapia ... 20 Prevenzione ... 22 L'epidemia pisana ... 23 Pazienti e Metodi ... 23 Risultati ... 25Test per CDI ... 25
Episodi di CDI ... 26
Pazienti con CDI ... 29
Analisi statistica ... 42
Discussione ... 43
Test per CDI ... 44
Episodi di CDI ... 44
Pazienti con CDI ... 45
Conclusioni ... 48
4
Introduzione
L'infezione da Clostrodium difficile ( Clostridium Difficile Infection - CDI ) è una patologia con manifestazioni cliniche di varia intensità dovuta alla proliferazione intestinale del patogeno. Il quadro clinico più comune è la diarrea. In alcune manifestazioni dell'infezione, però, spesso le più gravi, la diarrea è assente. L' acquisizione di C. difficile può essere comunitaria o nosocomiale. Mentre l'infezione comunitaria ricopre un ruolo marginale da un punto di vista di impatto della malattia sullo stato di salute della popolazione, l'evento nosocomiale rappresenta la più comune causa di diarrea tra i pazienti ricoverati. CDI, in particolare, rientra nel gruppo delle diarree nosocomiali da antibiotici, pur non rappresentandone la totalità.
L'interesse medico per il Clostridium difficile è relativamente recente. La storia di questo patogeno, infatti, è legata prevalentemente all'uso degli antibiotici e si evolve da un punto di vista epidemiologico e clinico come conseguenza del loro utilizzo, spesso in assenza di indicazioni.
L'identificazione di C. difficile come agente eziologico della colite associata ad antibiotico avviene nel 1978, ad opera di Bartlett con uno studio pubblicato sul New England Journal of
Medicine1. Da questo momento appare chiaro che C. difficile rappresenta la specie di
Clostridium più comune associata a patologia nell'uomo. Alla sua identificazione come causa
della diarrea associata ad antibiotico hanno contribuito in misura diversa tre filoni di ricerca incentrati rispettivamente su caratteristiche del batterio, colite pseudomembranosa e colite associata ad antibiotici nel roditore.
Hall and O'Toole pubblicarono la prima descrizione di C. difficile nel 19352 riportando che dalla flora colica di neonati sani era possibile isolare un batterio allora battezzato Bacillus
difficilis, perché difficile da coltivare. Subito dopo fu dimostrato che il germe produceva una
tossina letale in iniezioni intraperitoneali nel roditore3. L'importanza dello stesso nella patologia umana sfuggì a studi successivi perché non fu possibile dimostrare l'associazione tra
C. difficile ed una sindrome istotossica da clostridium. Gli studi avevano però
sistematicamente omesso di indagare un coinvolgimento gastrointestinale.
La colite pseudomembranosa fu descritta per la prima volta nel 1893 da John Finney. Il primo caso, per ovvi motivi, non era correlato all'uso dell'antibiotico, ma successivamente lo stesso
5
reperto anatomo-patologico diventò la lesione per antonomasia della colite associata ad antibiotico. Negli anni '50 e '60 veniva indicata come colite da Staphylococcus aureus, in quanto le coprocolture spesso rivelavano alti livelli di S. aureus, mentre non venivano eseguiti test per anaerobi obbligati. Negli anni '70 e '80, lo stesso quadro patologico venne definito come associato alla clindamicina. Nel 1974, infatti, alcuni ricercatori a St.Louis notarono che circa il 20% dei pazienti che ricevevano un trattamento con clindamicina sviluppavano diarrea e di questi la metà aveva una colite pseudomembranosa all'esame endoscopico4. La pubblicazione di questi dati diede il via a ricerche più dettagliate sul ruolo dell'antibiotico nella colite pseudomembranosa e portò verso la ricerca di un agente eziologico.
Un modello di criceto in cui la vancomicina preveniva la diarrea da clindamicina confermò il sospetto che la causa potesse essere un batterio gram-positivo5. A questo si aggiunse la dimostrazione della presenza di una tossina fecale ad alto titolo, neutralizzabile con una antitossina efficace nella gangrena gassosa6. I sospetti ricaddero, quindi, su un membro della famiglia Clostridium e guidarono i ricercatori verso l'isolamento di diverse specie dal cieco dei criceti. Fu poi dimostrato che una specie in particolare, il Clostridium difficile, era in grado di causare la malattia in altri criceti sia in forma di coltura che di filtrato, ovvero mediante tossina. L'associazione con la patologia nell'uomo è stata provata quando la stessa tossina isolata nel criceto è stata ritrovata nelle feci di pazienti affetti da diarrea associata ad antibiotico mediante l'uso di test di citotossicità1.
Dalla sua scoperta, C. difficile è diventato un problema in termini di infezioni nosocomiali a livello mondiale. Si presenta in forme che variano da diarrea lieve a presentazioni cliniche di maggiore gravità come la colite pseudomembranosa ed il megacolon tossico. La recente individuazione di ceppi di C. difficile più virulenti all'interno di presidi ospedalieri ha prodotto un crescente interesse per questa infezione nosocomiale incrementando la domanda per metodi più rapidi di diagnosi e trattamenti più aggressivi della infezione da C. difficile7–9.
Eziologia
il Clostriudium difficile appartiene al genere Clostridium che include altre 200 specie descritte. Si tratta di batteri gram-positivi di forma bastoncellare, anaerobi, sporigeni. Le specie appartenenti a questo genere sono ubiquitarie, si ritrovano nel terreno in qualsiasi zona del pianeta e come componenti della flora intestinale sia dell'uomo che di numerosi animali. E' stato riportato che più del 70% della popolazione è colonizzata con specie di Clostridium a
6
concentrazioni di 108-109 cellule per grammo di feci10. Specie di Clostridium possono inoltre essere isolate da cavità orale ed uretra e come parte della flora vaginale di donne sane11. In base all'analisi della sequenza di DNA ribosomiale 16S, i clostridi possono essere divisi in 11 gruppi di omologia. La maggior parte delle specie clinicamente rilevanti appartiene al gruppo di omologia 112.
In quanto anaerobi, i clostridi sono caratterizzati da metabolismo fermentante, i cui prodotti terminali sono etanolo ed acidi grassi a catena corta: butirrato, valerato, succinato, caproato13. Il sistema dei citocromi dei clostridi è incompleto, le specie risultano quindi ossidasi negative. Molte di queste sono inoltre negative per la presenza di catalasi e perossidasi12, caratteristica che rende i clostridi suscettibili all'azione tossica dell'ossigeno e quindi l'anaerobiosi necessaria per il loro isolamento.
I metodi di identificazione tradizionali per le specie di Clostridium si basano su profili di fermentazione dei carboidrati, rilevazione mediante gascromatografia di acidi grassi a catena corta, valutazione della morfologia mediante colorazione Gram, ricerca di tossine specifiche e test biochimici . Molte specie sono state isolate da campioni clinici, ma solo poche di queste sono regolarmente associate a quadri patologici nell'uomo.
I clostridi producono una grande varietà di proteine biologicamente attive tra cui emolisine, enzimi proteolitici ed altre tossine. Sono proprio queste ultime le responsabili dell'azione patogena di questi batteri. Le tossine prodotte sono molto diverse tra loro: eurotossine, enerotossine, collagenasi, proteasi ed altre necrotossine. Le più note sono sicuramente la tossina botulinica e quella tetanica.
Le infezioni causate da clostridi possono essere clinicamente distinte in infezioni invasive e dei tessuti molli e intossicazioni. Le prime sono causate da organismi endogeni della flora intestinale o acquisiti tramite trauma. L'interruzione della continuità cutanea costituisce, infatti, la via preferenziale per la contaminazione con terra, acqua e materiale fecale. Le intossicazioni, invece, sono dovute ad ingestione di tossina preformata con il cibo - come nel caso del botulino - o a produzione endogena di tossina, come nella diarrea associata a C.
difficile. Ad eccezione della contaminazione di pazienti a rischio in ambiente ospedaliero o
para-ospedaliero da parte di Clostridium difficile, i clostridi raramente causano infezione per contagio interumano.
Le spore dei clostridi sono responsabili del
alla loro lunga sopravvivenza nel terreno o nel cibo, le spore possono diffondersi attraverso l'aria come parte della polvere che normalmente si solleva. Le cellule in stato vegetativo sono generalmente suscettibili ai disinfettanti in uso
essicazione ed esposizione a numerosi disinfettanti
di persistere nell'ambiente anche in seguito alle normali procedure di igienizzazione. Tutte le caratteristiche sopracitate per il genere
cui identificazione microbiologica si basa su esame
caratteristiche colturali, microscopiche e gascromatografiche.
Per l'esecuzione dell' esame colturale, il materiale fecale o altro materiale biologico deve essere seminato su terreno CCFA (cicloserina
essere potenziata con aggiunta di taurocolato di sodio, che facilita la germinazione delle spore, o pretrattando il campione con shock di etanolo che elimina altre specie presenti nel campione, ma a cui le spore di
invece, permette di osservare una caratteristica morfologia della colonia: tipicamente dopo
Gram, C. difficile si presenta come bacillo gram
della coltura. Il batterio ha forma lunga e sottile con spora ovalare che non deforma il corpo cellulare, situata in posizione subterminale. A volte, due cellule possono posizionarsi in adiacenza in corrispondenza del polo
caratteristica conformazione bisporale
clostridi sono responsabili della persistenza nell'ambiente e del contagio
alla loro lunga sopravvivenza nel terreno o nel cibo, le spore possono diffondersi attraverso l'aria come parte della polvere che normalmente si solleva. Le cellule in stato vegetativo sono
tibili ai disinfettanti in uso, ma le spore possono sopravvivere essicazione ed esposizione a numerosi disinfettanti14–16. Questo permette ai
nell'ambiente anche in seguito alle normali procedure di igienizzazione. tiche sopracitate per il genere sono proprie anche di Clostridium difficile cui identificazione microbiologica si basa su esame colturale e conseguente valutazione delle
, microscopiche e gascromatografiche.
esame colturale, il materiale fecale o altro materiale biologico deve essere seminato su terreno CCFA (cicloserina-cefoxitina-fruttoso agar) la cui specificità può essere potenziata con aggiunta di taurocolato di sodio, che facilita la germinazione delle pretrattando il campione con shock di etanolo che elimina altre specie presenti nel campione, ma a cui le spore di C. difficile resistono. La semina su terreni contenenti sangue, invece, permette di osservare una caratteristica morfologia della colonia: tipicamente dopo 24-48 ore di incubazione in agar sangue la colonia ha un diametro di 3
margini lobati, grigia, opaca e
(figura 1.1). A volte può essere presente alone emolitico verdastro di tipo
ore di incubazione, la colonia presenta un centro convesso di colore più chiaro che conferisce l’aspetto "ad uovo fritto". L’odore è caratteristico e ricorda lo sterco di cavallo. All'esame microscopico con colorazione di si presenta come bacillo gram-positivo o gram-variabile a seconda dell'età della coltura. Il batterio ha forma lunga e sottile con spora ovalare che non deforma il corpo cellulare, situata in posizione subterminale. A volte, due cellule possono posizionarsi in adiacenza in corrispondenza del polo cellulare che contiene la spora ad
conformazione bisporale (figura 1.2).
7
tenza nell'ambiente e del contagio. Oltre alla loro lunga sopravvivenza nel terreno o nel cibo, le spore possono diffondersi attraverso l'aria come parte della polvere che normalmente si solleva. Le cellule in stato vegetativo sono no sopravvivere a caldo, Questo permette ai clostridi patogeni nell'ambiente anche in seguito alle normali procedure di igienizzazione.
Clostridium difficile, la
colturale e conseguente valutazione delle
esame colturale, il materiale fecale o altro materiale biologico deve fruttoso agar) la cui specificità può essere potenziata con aggiunta di taurocolato di sodio, che facilita la germinazione delle pretrattando il campione con shock di etanolo che elimina altre specie presenti nel resistono. La semina su terreni contenenti sangue, invece, permette di osservare una caratteristica morfologia della colonia: tipicamente dopo 48 ore di incubazione in agar sangue la colonia ha un diametro di 3-5 mm con margini lobati, grigia, opaca e non emolitica . A volte può essere presente alone emolitico verdastro di tipo α. A 48-72 ore di incubazione, la colonia presenta un centro convesso di colore più chiaro che conferisce l’aspetto "ad uovo fritto". L’odore da lo sterco di cavallo. copico con colorazione di
variabile a seconda dell'età della coltura. Il batterio ha forma lunga e sottile con spora ovalare che non deforma il corpo cellulare, situata in posizione subterminale. A volte, due cellule possono posizionarsi in che contiene la spora ad assumere la
La identificazione definitiva saggi biochimici.
E' possibile identificare i ceppi di
di tipizzazione, utilizzate in particolare per studi epidemiologici. Il ceppo su cui fino ad oggi si è concentrata l'attenzione della comunità scientifica è il NAP
identificato mediante elettroforesi su gel a campo pulsato endonucleasi di restrizione
descritto per la prima volta come responsabile delle epidemie di Europa e Nord 2002-200317, presenta peculiar
grave, probabilmente a causa della maggiore capacità di produrre tossina
percentuale più bassa di risposta alla fidaxomicina e più alta incidenza di recidiva presenta resistenza ai fluorochinoloni
ha implicazioni di tipo clinico anche se risulta utile negli studi di correlazione dei casi di infezione durante le epidemie ed ha permesso di migliorare l'utilizzo delle
controllo dell'infezione17.
Patogenesi
Il presupposto allo sviluppo dell'infezione è la presenza del patogeno nell'intestino. Va fatta qui una distinzione tra soggetti che stabilmente albergano in maniera asintomatica
- i cosiddetti portatori sani
ingestione. Il contagio avviene in maniera diretta, per contatto con la fonte, o indiretta, per Anche la gascromatografia
essere d'aiuto nell'identificazione per la presentazione di un profilo tipico dovuto alla produzione di acido butirrico ed isocaproico (inserire figura del profilo alla gascromatograf
La identificazione definitiva, suggerita dalle suddette caratteristiche, è condotta mediante
E' possibile identificare i ceppi di C. difficile con l'utilizzo di diverse metodologie molecolari di tipizzazione, utilizzate in particolare per studi epidemiologici. Il ceppo su cui fino ad oggi concentrata l'attenzione della comunità scientifica è il NAP-1 - come viene indicato se identificato mediante elettroforesi su gel a campo pulsato - o B1 - se identificato mediante endonucleasi di restrizione - più comunemente noto come ribotipo 027. Ques
descritto per la prima volta come responsabile delle epidemie di Europa e Nord
culiari caratteristiche: 1) è associato allo sviluppo di patologia più grave, probabilmente a causa della maggiore capacità di produrre tossina
percentuale più bassa di risposta alla fidaxomicina e più alta incidenza di recidiva presenta resistenza ai fluorochinoloni19. Ad oggi, comunque, la tipizzazione del batterio non ha implicazioni di tipo clinico anche se risulta utile negli studi di correlazione dei casi di infezione durante le epidemie ed ha permesso di migliorare l'utilizzo delle
Il presupposto allo sviluppo dell'infezione è la presenza del patogeno nell'intestino. Va fatta qui una distinzione tra soggetti che stabilmente albergano in maniera asintomatica
portatori sani - e soggetti che invece lo acquisiscono dall'ambiente est
Il contagio avviene in maniera diretta, per contatto con la fonte, o indiretta, per
8 Anche la gascromatografia può essere d'aiuto nell'identificazione per la presentazione di un profilo tipico dovuto alla produzione di acido butirrico ed isocaproico (inserire figura del profilo alla gascromatografia). caratteristiche, è condotta mediante
con l'utilizzo di diverse metodologie molecolari di tipizzazione, utilizzate in particolare per studi epidemiologici. Il ceppo su cui fino ad oggi come viene indicato se se identificato mediante più comunemente noto come ribotipo 027. Questo ceppo, descritto per la prima volta come responsabile delle epidemie di Europa e Nord America del i caratteristiche: 1) è associato allo sviluppo di patologia più grave, probabilmente a causa della maggiore capacità di produrre tossina17, 2) ha una percentuale più bassa di risposta alla fidaxomicina e più alta incidenza di recidiva18, 3) . Ad oggi, comunque, la tipizzazione del batterio non ha implicazioni di tipo clinico anche se risulta utile negli studi di correlazione dei casi di infezione durante le epidemie ed ha permesso di migliorare l'utilizzo delle tecniche di
Il presupposto allo sviluppo dell'infezione è la presenza del patogeno nell'intestino. Va fatta qui una distinzione tra soggetti che stabilmente albergano in maniera asintomatica C. difficile scono dall'ambiente esterno per Il contagio avviene in maniera diretta, per contatto con la fonte, o indiretta, per
9
contatto con oggetti, superfici o persone contaminate. In questo secondo caso, le spore, che costituiscono la forma infettiva del patogeno, facilmente superano l'acidità gastrica alla quale sono costituzionalmente resistenti e giungono nell'intestino dove possono trasformarsi in cellule vegetative anche grazie all'azione dei sali biliari20.
Prima di proseguire nell'analisi delle fasi del processo patogenetico, è bene focalizzare l'attenzione sulla spora e sulla sua localizzazione nell'ambiente. L'ambiente nosocomiale lato sensu è ricco di spore di C. difficile che per loro natura resistono alle normali misure igieniche adottate e facilmente penetrano nell'organismo annidandosi nell'intestino. L'ambiente ospedaliero, però, non è considerato l'unica fonte di infezione. Nella specie umana sono stati individuati due principali reservoir del patogeno: i portatori sani ed i neonati. In alcuni studi epidemiologici su soggetti senza manifestazioni cliniche e recenti contatti con strutture ospedaliere, infatti, è stato riscontrato un tasso di portatori nella popolazione di circa 2%21, mentre in osservazioni su popolazioni di pazienti ricoverati in ospedale con anamnesi negativa per recente ospedalizzazione si riscontra un percentuale di portatori compresa tra 0.6% e 13%22. I soggetti portatori di C. difficile costituiscono un reservoir del patogeno. Per quanto riguarda i neonati, Rousseau dimostra che è possibile isolare C. difficile dall'intestino del 45% di neonati, il 13% dei quali sono portatori di ceppo tossigeno23. I portatori sani del batterio, siano essi adulti o lattanti, eliminano il microrganismo mediante le feci in forma vegetativa e di spora, contribuendo a mantenere alta la carica batterica ambientale24,25. Sono state proposte come possibili fonti di infezione anche prodotti a base di carne26, molluschi bivalve27, ovini e suini28, rondini29 e ratti urbani30. La molteplicità delle fonti di infezione è confermata da uno studio del 2013 che ha analizzato mediante sequenziamento completo del genoma la relazione tra i ceppi isolati dai pazienti ricoverati per infezione da C. difficile in un periodo di tre anni nella contea di Oxford. I ricercatori hanno osservato che 45% delle infezioni erano causate da batteri geneticamente distinti da tutti quelli analizzati fino a quel momento31. Tutto ciò delinea un quadro di presenza ubiquitaria del patogeno e, allo stato attuale, difficoltà nell'identificare e quindi controllare una fonte predominante di infezione. La presenza di C. difficile nell'intestino non è sufficiente a causare il processo patologico. Un ruolo fondamentale è da attribuire alla disbiosi, distruzione della normale flora batterica durante il trattamento antibiotico per altra patologia. Va ricordato, in ogni caso, che la terapia antibiotica di per sé causa una patologia diarroica in assenza di C. difficile, questa può aggravarsi se al momento della terapia C. difficile è presente nell'intestino o se il paziente è esposto al contagio.
10
L'intestino sottoposto a terapia antibiotica rappresenta un ambiente ideale per la germinazione delle spore di C. difficile. I due presupposti perché la patologia si verifichi, sono infatti la presenza delle spore e la scomparsa delle specie saprofite. Superata la convinzione che il ruolo del microbioma residente si esaurisse a competizione per nutrienti e siti di ancoraggio sull'epitelio32, si è giunti a delineare le vie di segnalazione molecolari attraverso le quali i batteri commensali esercitano un'azione protettiva nei confronti della CDI, limitando l'infezione ad una colonizzazione asintomatica in pazienti non sottoposti a terapia antibiotica. Sostanze prodotte e liberate dai batteri (LPS e flagellina) sono in grado di legarsi a recettori di membrana TLR e MyD88 presenti sulla superficie delle cellule epiteliali e dendritiche dell'epitelio33e moderare la risposta infiammatoria della mucosa. Questa azione si manifesta in termini di rapporto tra linfociti T regolatori e pro-infiammatori come conseguenza di alti livelli di IL-10 e TGF-β34. La presenza di batteri commensali è stata inoltre associata a produzione di IgA35. Alla luce di queste osservazioni, si comprende come la somministrazione di antibiotico interrompa una condizione di tolleranza facendo venir meno i saprofiti e quindi e predisponga allo sviluppo di flogosi della mucosa . Questa può manifestarsi come diarrea da antibiotico o, in presenza di C. difficile e di altri fattori favorenti, come CDI.
Dopo la sporulazione, le cellule di C. difficile aderiscono alla mucosa del colon mediante interazione tra proteine di superficie batteriche e dell'ospite. In particolare, sono state identificate numerose adesine (proteine S-layer, Cwp66, Cwp88, CwpV, Fbp68, GroEL)36–39, flagelline (FliD e FliC)40 ed enzimi idrolitici (ialuronidasi e proteasi) che si pensa possano facilitare l'adesione mediante degradazione della matrice extracellulare mucosa41.
La virulenza del C. difficile, però, è dovuta principalmente alla produzione di due tossine ad alto peso molecolare, TcdA e TcdB, originariamente descritte come enterotossina e citotossina, che modificano il citoscheletro cellulare e causano l'effetto citotossico nell'epitelio intestinale.
La regione del genoma deputata alla produzione delle tossina è stata identificata come locus di patogenicità PaLoc. Contiene 5 geni: tcdA e tcdB, per la produzione di tossina A e B, tcdR, genere che regola la trascrizione dei precedenti in positivo, e tcdC, un inibitore della trascrizione e tcdE, la cui funzione è poco chiara, ma si ipotizza abbia un ruolo nel rilascio extracellulare delle tossine42. Le tossine A e B sono proteine ad alto peso molecolare di 270 kDa (B) e 308 kDa (A)43. Il meccanismo di penetrazione della tossina all'interno del citosol
11
degli enterociti è stato studiato prevalentemente per la tossina B44, essendo questa sempre presente nei ceppi tossigenici e quindi probabilmente associata alla patogenicità del germe. La tossina è composta da un dominio di riconoscimento del recettore, un dominio intermedio idrofobico ed un dominio terminale effettore. La proteina è inoltre dotata di attività auto proteasica. Il legame della proteina al recettore di membrana ne stimola l'endocitosi ed il passaggio in un lisosoma, il cui pH acido determina un cambio conformazionale ed il passaggio del dominio effettore nel citoplasma. Qui un secondo cambio conformazionale attiva le proprietà auto-proteasiche ed il dominio effettore viene liberato nel citosol dove agisce come monoglucosiltransferasi e modifica alcune GTP-binding proteins coinvolte nei processi di riorganizzazione del citoscheletro di actina e delle giunzioni strette. Il risultato finale è la distruzione della cellula e quindi della continuità epiteliale con conseguente alterazione dei processi di assorbimento che è alla base della tipica diarrea acquosa.
Oltre all'azione citotossica, è stato osservato da parte della tossina A un ruolo di induttore della risposta infiammatoria. I meccanismi con cui la proteina batterica indurrebbe infiammazione nell'ospite includono aumento di produzione di sostanza P e IL-8 e stimolazione dei macrofagi presenti nella lamina propria con produzione di TNF-α43.
Esistono variazioni nella espressione dei geni del locus PaLoc.
I ceppi TcdA+ TcdB+ sono i più comuni e costituiscono circa il 65% degli isolati45. Ceppi TcdA- TcdB+ sono stati correlati a casi di malattia particolarmente gravi, mentre non sono stati riportati ceppi TcdA+ TcdB-46. Quest'ultima osservazione è importante ai fini della diagnosi in quanto il test PCR attualmente in uso ricerca esclusivamente il gene TcdB, presente nel 97% dei ceppi45.
Altra variazione del locus PaLoc è quella osservata in ceppi 027: il gene tcdC include una mutazione che impedisce l'espressione della corrispondente proteina e che permette alla cellula batterica di produrre una maggiore quantità di tossina42.
Negli ultimi anni è stato segnalato che l'azione patogena di C. difficile può essere anche sostenuta da una terza tossina denominata CDT (Clostridium difficile toxin) o B1 o tossina binaria, a causa della necessità, per la sua sintesi della presenza di due geni cdtA e cdtB contenuti nel locus CdtLoc47. Si tratta di una tossina del tipo AB con attività ADP-ribosiltranferasica actino-specifica, simile per struttura e sequenza alle tossine prodotte da altre specie di Clostridium48. B1 è presente nel 6%-12% degli isolati di C. difficile, compresi
12
ceppi 02749. Il suo ruolo è tutt'ora incerto in termini di patogenesi: mentre mostra citotossicità in prove in vitro, un inoculo in criceto di ceppi TcdA- TcdB- CTD+ non produce uno stato patologico50. Poiché è disponibile un saggio PCR per il rilevamento di CTD, sarebbe utile provare la sua associazione con il ceppo 027 per utilizzarlo come alternativa nella tipizzazione del batterio.
Un ruolo fondamentale nella patogenesi dell'infezione è ricoperto dall'interazione del patogeno con il sistema immunitario dell'ospite. In particolare, gli studi sull'immunità dell'ospite sono riusciti in parte a spiegare la variabilità interindividui in termini di gravità di manifestazioni cliniche e recidiva. Sono disponibili molte informazioni circa la produzione di anticorpi nei confronti di diversi antigeni batterici espressi dalla cellula in stadio vegetativo, ma poco si sa ancora sul ruolo che la risposta immune nei confronti della spora gioca nello sviluppo della patologia. Poiché le spore sono composte nel loro strato più esterno da glicoproteine e peptidoglicano15, sarebbe sensato ritrovare una risposta specifica nei confronti di questi antigeni. Prove in vitro di fagocitosi di spore da parte dei macrofagi hanno invece mostrato come dopo l'endocitosi le spore persistano all'interno dei leucociti provocando intossicazione e morte cellulare51. Sicuramente la risposta umorale si correla alle manifestazioni cliniche, ma il peso di questa variabile così come il ruolo delle singole classi di immunoglobuline sono tutt'ora poco conosciute. In circa il 60% dei soggetti adulti è possibile riscontrare una risposta umorale in forma di IgG ed IgA dirette contro le tossine di C.
difficile52, probabilmente dovuta ad una iniziale esposizione all'antigene in età neonatale e mantenuta da stimolazione continua per ingestione di spore. Bassi valori di IgA nelle feci e ridotto numero di cellule produttrici di IgA nella mucosa colica sono stati correlati con maggiore durata dei sintomi e recidiva della CDI53,54. Anche bassi livelli di IgM anti-tossina A e B a 3 giorni dall'inizio dei sintomi sono stati associati ad un aumento del rischio di recidiva così come il basso titolo IgG al 12esimo giorno dalla comparsa della sintomatologia38,55. E' stato notato, comunque, che i pazienti con comorbidità e CDI grave o sistemica subiscono meno l'effetto protettivo del sistema immunitario56 a conferma del fatto che le condizioni cliniche del paziente rimangono un valido predittore di esito a prescindere dalla risposta umorale.
Epidemiologia
L'epidemiologia dell'infezione da C. difficile è molto cambiata negli anni con un complessivo aumento sia del numero di casi che della gravità. Con più di 300.000 nuove diagnosi ogni
13
anno, ad oggi si tratta della più comune causa di diarrea in ambiente ospedaliero, responsabile di circa il 30% dei casi.
Di particolare interesse sono i dati provenienti dal Canada, che bene si interpretano considerando l'emergenza di ceppi ipervirulenti. Nel 2004, Pepin et al. hanno riportato un aumento dell'incidenza di CDI nel periodo 1991-2003 da 36 a 156 per 100.000 abitanti57. Nel 2005, Loo et al.58 riportano i risultati di uno studio osservazionale in 12 ospedali del Quebec che mostrano un aumento dell'incidenza da 6 a 22 per 1000 ricoveri ed un aumento della mortalità da 1.5% a 6.9% in confronto ad un simile studio effettuato nel 1997. Entrambi gli studi riconducono il preoccupante andamento dell'incidenza e della mortalità all'emergere del ceppo ipervirulento 027 che indurrebbe infezioni più aggressive con tassi di ospedalizzazione più elevati. E' vero, però, che anche le infezioni comunitarie sono in aumento. In uno studio del 2012 si riporta che il 40% dei pazienti con una infezione da C. difficile comunitaria necessitano di ospedalizzazione59. La pubblicazione di Kang et al. considera le infezioni nosocomiali di un ospedale di terzo livello nell'intervallo 2005-2011 ed osserva una incidenza compresa tra 3.2 e 8.3 casi per 10000 giornate di degenza con notevole andamento crescente della casistica60.
I dati europei sull'epidemia da C. difficile ricalcano in parte le rilevazioni d'oltreoceano. Nello studio di prevalenza delle infezioni nosocomiali sponsorizzato dal ECDC nel 2012, le infezioni da C. difficile rappresentano il 48% delle patologie infettive del tratto digerente, che costituiscono a loro volta il 7% delle infezioni ospedaliere. In particolare il Clostridium
difficile si classifica ottavo tra i germi causa di infezioni nosocomiali. In una indagine del
2008 che include dati di 34 nazioni europee è riportata una incidenza della infezione da C.
difficile di 4.1 casi ogni 10.000 giornate di degenza con un ampia variabilità interistituzionale
(0.0 - 36.3), ed una stima di una infezione ogni 435 ricoveri61. In uno studio francese del 2009 è riportata una incidenza di 2.28 ogni 10.000 giornate di degenza negli ospedali e 1.15 ogni 10.000 giornate di degenza nelle strutture di riabilitazione o RSA62.
Le informazioni in letteratura circa l'epidemiologia dell'infezione da C. difficile in Italia sono tutt'ora scarse. Esse permettono in ogni caso di delineare un quadro che non si discosta da quello di altri paesi europei. Ad oggi lo studio osservazionale con campione più grande è quello pubblicato nel 2013 da Di Bella et al. che raccoglie dati provenienti da 5 ospedali romani negli anni compresi tra il 2006 ed il 2011. Gli autori riportano un totale di 402 campioni di feci positivi alla ricerca della tossina, ovvero una incidenza compresa tra 0.3 casi
14
ogni 10.000 giornate di degenza del 2006 e 2.3 casi ogni 10.000 giornate di degenza del 201163. Mellace et al., invece, analizzando dati provenienti dai reparti di medicina interna di un unico ospedale, riportano una incidenza di 23.3 casi ogni 10.000 giornate di degenza ed attribuiscono questo tasso - tra i più alti presenti in letteratura - alla selettività dello studio nei confronti di particolari unità operative64. A metà strada tra i due precedenti si attesta lo studio di Sansone et al. con una incidenza di 6.2 casi ogni 10.000 giornate di degenza e di 5 casi ogni 1000 ricoveri65. Guastalegname et al. Riportano, nella loro osservazione delle infezioni da C.
difficile in un'unica struttura ospedaliera romana, un numero di casi che raddoppia dal 2012 al
2013 passando da 1.26 a 2.61 episodi ogni 1000 ricoveri66. E' da porre in rilievo, inoltre, come anche in Italia si verifichino episodi di infezione particolarmente grave ricondotti alla diffusione dei ceppi 02767.
Oltre all'aumento dell'incidenza dei casi di infezione da C. difficile, è possibile individuare alcuni fenomeni epidemiologici in corso che stanno modificando le caratteristiche dell'epidemia.
Oltre al già noto ribotipo 027, altri ceppi stanno emergendo come causa dell'infezione. In particolare, la prevalenza del ribotipo 078 è aumentata dal 3 al 13% in Europa. Questo è associato a più alta mortalità, colpisce una popolazione più giovane e si associa ad infezioni comunitarie invece che nosocomiali68. In Italia si assiste all'emergere del ceppo 018, resistente ai fluorochinoloni69.
Il profilo del paziente tipo colpito da infezione da C. difficile è in corso di cambiamento. Anche pazienti una volta ritenuti a basso rischio - più giovani e privi di esposizione a terapia antibiotica - sono interessati dall'infezione così come pazienti che non sono stati soggetti ad ospedalizzazione nei mesi precedenti l'episodio infettivo, in cui l'infezione è di origine comunitaria70.
Fattori di rischio
Poiché la patogenesi dell'infezione da C. difficile riconosce come momenti fondamentali l'inoculo del germe, la disbiosi e la debilitazione dell'ospite, i tre principali fattori di rischio a cui si può attribuire il crescente numero di casi di infezione sono: ospedalizzazione, modalità di utilizzo della terapia antibiotica e invecchiamento della popolazione con un crescente numero di soggetti riconosciuti come fragili71.
15
L'ospedalizzazione espone il paziente non solo ad un reservoir caratteristico, ma anche a vettori per la trasmissione delle spore. Oggetti, superfici e persone presenti all'interno dell'ospedale rappresentano, infatti, una fonte di inoculo in un ambiente in cui il controllo della trasmissione risulta particolarmente difficoltoso per il frequente contatto del malato con ciò che lo circonda72. L'isolamento di C. difficile da oggetti di uso comune in ambiente ospedaliero e su più del 30% delle superfici73,74 suggerisce che il paziente ricoverato sia esposto al rischio di acquisizione attraverso ingestione delle spore tramite il personale o direttamente tramite contatto con oggetti e superfici. La prova di questa assunzione è fornita dall'associazione in positivo della durata dell'ospedalizzazione con la percentuale di pazienti colonizzati da C. difficile75,76. Ne consegue che aumentando il numero di colonizzati, sia più probabile lo sviluppo di infezione.
Al pari dell'ospedalizzazione, la presenza nella storia recente del paziente di terapia antibiotica - in particolare nei 3 o 4 mesi precedenti l'evento infettivo - è ben documentata da tempo come fattore di rischio per infezione da C. difficile77. La rassegna sistematica della letteratura pubblicata da Bignardi classifica i diversi tipi di antibiotico in base alla disponibilità di evidenza scientifica78. Tutti gli antibiotici, compreso il metronidazolo, sono associati con lo sviluppo di C. difficile, con prevalenza di fluorochinoloni e cefalosporine79. In aggiunta, L'uso di più antibiotici in terapia multipla e la prosecuzione della terapia antibiotica con farmaci non efficaci su C. difficile sono associati ad un maggior rischio di recidiva80–82. Il ruolo degli antibiotici nella perturbazione della flora intestinale commensale è provato non solo da osservazioni cliniche, ma anche da studi fisiologici come quello proposto da Young e Smith83. Analisi molecolari su campioni di feci di pazienti sottoposti a terapia antibiotica ha rivelato come questa effettivamente cambi la composizione della flora intestinale, evento che predisporrebbe alla colonizzazione da parte di C. difficile ed incrementerebbe la suscettibilità della mucosa all'azione delle tossine.
Una età superiore ai 65 anni correla sia con un maggior rischio di infezione da C. difficile che con un aumento di morbilità e mortalità. Il rischio di mortalità è stato quantificato da Zilberberg et al. che riportano un rischio di morte nei primi 30 giorni dall'infezione più alto del 68% nei pazienti anziani rispetto ai pazienti più giovani84. Nella rassegna della letteratura pubblicata da Di Bella et al.85 vengono messi in evidenza alcuni dati che mostrano come gli anziani costituiscano una parte di popolazione ad alto rischio. Il numero di infezioni da C.
16
negli anni 1996-200386. I dati provenienti dalle notifiche obbligatorie di infezione in Ohio mostrano che più di metà dei casi di CDI nosocomiale ha origine nelle RSA, dove notoriamente gli anziani costituiscono una percentuale preponderante degli ospiti87. Nel
National Vital Statistics Report del 2008, l'infezione da C. difficile è classificata come
diciottesima causa di morte nella fascia di popolazione con età >65 anni88 e nello stesso documento del 2011, il 91% delle morti da enterocolite da C. difficile riguarda pazienti con età superiore ai 65 anni89.
Ai fattori di rischio primari si aggiungono le comorbidità ed i fattori di rischio secondari che contribuiscono ad un aumento della morbilità e mortalità dell'infezione. Tra i più comuni fattori di rischio modificabili ci sono il fumo, che aumenta il rischio dell'80%90, l'uso di sondino naso-gastrico e la terapia con soppressori della produzione gastrica di acido91.
L'alimentazione tramite sondino potrebbe far aumentare il rischio di sviluppare infezione da
C. difficile di circa tre volte91, dati che suggeriscono come l'impegno del medico debba essere la precoce rimozione del dispositivo e la ripresa di alimentazione spontanea. Molti studi, poi, indicano l'uso di inibitori di pompa protonica o dei recettori istaminici di tipo 2, come fattore di rischio per CDI, nonostante l'associazione non sia unanimemente accettata. Lo studio caso-controllo di Aseeri et al.92 propende per una correlazione positiva, ipotesi che trova supporto nel modello di patogenesi dell'infezione che vedrebbe facilitato il fenomeno di colonizzazione a seguito di una modulazione della barriera acida gastrica e di calo del numero di neutrofili93. Di opinione contraria invece è lo studio effettuato da Leonard et al.94.
In aggiunta ai già citati, sono stati riportati come fattori di rischio secondari anche la chemioterapia95 e la somministrazione di terapia antibiotica per via orale in preparazione di chirurgia sul colon96 . Entrambi si spiegano con l'effetto dei farmaci sulla flora intestinale.
Caratteristiche cliniche
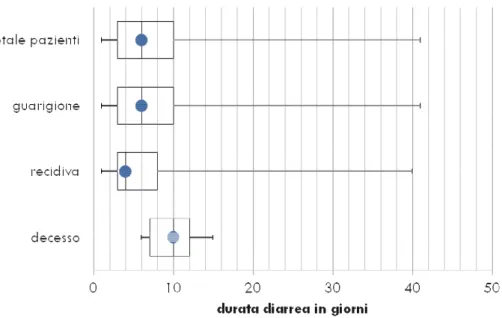
La principale manifestazione della CDI è la diarrea. Questa di definisce come la presenza di 3 o più scariche nelle 24 ore con consistenza compresa tra il grado 5 ed il grado 7 della scala di Bristol97. La diarrea compare in un periodo compreso tra pochi giorni e pochi mesi dalla fine del trattamento antibiotico, con una mediana di 9 giorni, o 13 se si considera il lasso di tempo dal momento del ricovero98. C. difficile causa solo una parte delle diarree associate ad antibiotico, stimata tra il 10% ed il 25%99. In aggiunta alla diarrea, possono associarsi altri
17
segni e sintomi non specifici come nausea, vomito, febbre, letargia, disidratazione. Da un punto di vista di profilo ematochimico, le forme diarroiche di intensità lieve ed intermedia di associano a leucocitosi nel 50% dei casi100. Il quadro di colite è suggerito dalla presentazione clinica con dolorabilità e dolenza dei quadranti addominali inferiori che può essere confermato con endoscopia o tecniche di imaging. All'esame endoscopico la mucosa si caratterizza nei casi lievi per presenza di edema e vasodilatazione e nei casi più gravi per la presenza di pseudomembrane, (accumuli di cellule infiammatorie, debris cellulari e batteri) che non hanno però ruolo patognomonico poiché è dimostrato che anche altre specie batteriche possono causare quadro simile101,102. L'esame ecografico mostra ispessimento della parte del colon , mentre la TAC può mettere in evidenza segni tipici di flogosi colica: l'uso di questi indicatori nella pratica clinica rimane però dubbio103. Infine, sepsi, ileo paralitico, megacolon tossico e shock sono manifestazioni gravi della CDI ed in un terzo dei casi non sono associati a diarrea104.
La presenza di diarrea deve essere l'innesco di un percorso diagnostico indirizzato alla conferma della diagnosi di CDI. Elementi altri rispetto alla clinica che possono rafforzare il sospetto di CDI sono la recente somministrazione di antibiotici e la presenza di contatti sospetti con ambiente ospedaliero lato sensu, compreso il recente contatto con personale sanitario o la degenza in RSA. Particolare attenzione meritano i pazienti con età avanzata o condizioni di immunodeficienza per i quali la soglia di sospetto clinico va mantenuta più bassa e la frequenza di ricerca del C. difficile conseguentemente più alta.
Diagnosi di laboratorio
La diagnosi di infezione da C. difficile è sospettata dal clinico sulla base del quadro sintomatologico, ma necessita di conferma mediante test di laboratorio. Esistono diverse tecniche diagnostiche con sensibilità e specificità differenti.
L'analisi di laboratorio delle feci per confermare la diagnosi di C. difficile va eseguita su campioni diarroici a meno che non si sospetti che il paziente soffra di una delle gravi manifestazioni prive di diarrea105. I giorni trascorsi dal ricovero alla comparsa della diarrea sono di fondamentale importanza in termini di diagnosi differenziale. Mentre la diarrea comparsa nei primi 3 giorni del ricovero può essere causata da una grande varietà di patogeni comunitari, dopo il terzo giorno C. difficile costituisce la principale causa di feci non formate43. Molti laboratori, infatti, non eseguono diagnostica differente da quella per C.
18
difficile su campioni di feci diarroiche raccolti dopo 72 ore dal ricovero. La ricerca di C. difficile viene inoltre consigliata per campioni di pazienti con età superiore ad un anno con
diarrea altrimenti inspiegabile associata all'uso di antibiotici.
E' opinione condivisa nella comunità scientifica che il testare feci non diarroiche così come l'esecuzione di più test su campioni prelevati dallo stesso paziente non migliori l'accuratezza del test, ma contribuisca alla generazione di risultati di difficile interpretazione - discordanti o positivi asintomatici - e ad un aumento dei costi. I bambini al di sotto dei 2 anni hanno un'alta percentuale di colonizzazione per cui in questa popolazione l'analisi delle feci per C. difficile non è consigliata. Le indicazioni all'esecuzione del test sono dunque: 1) età > 2 anni; 2) paziente sintomatico con almeno 3 scariche di feci non formate 3 nelle 24 ore; 3) utilizzo del test in prova singola 4) utilizzo del test solo per diagnosi e non per conferma dell'efficacia della terapia105.
Il test di citotossicità è il test con migliori prestazioni. Si tratta di una prova di neutralizzazione della citotossicità eseguito unendo un campione di feci a cellule in coltura per verificare prima l'effetto citopatico sulla coltura e poi la sua scomparsa dopo aggiunta di anticorpi anti tossina B. L'uso di questo test, nonostante la sua sensibilità (98%) e specificità (99%), è poco diffuso a causa dei costi e dei tempi di esecuzione piuttosto lunghi (24-48h)46. La coltura cellulare su terreno altamente selettivo (agar ridotto con cicloserina-cefoxitina-fruttosio) ha una sensibilità superiore a quella del test di citotossicità 106,107, ma bassa specificità per l'incapacità di distinguere ceppi tossigeni da ceppi non produttori di tossine. Per ovviare a questa mancanza ed aumentare la specificità, si può eseguire da coltura un test EIA o un test di citotossicità43. Anche la coltura è laboriosa e necessita di lunghi tempi di esecuzione a causa dei 3-5 giorni necessari al C. difficile per crescere in piastra, permette però di condurre studi sul fenotipo e l'identificazione del ceppo108.
Il test EIA per la ricerca dell'enzima glutammato deidrogenasi (GDH) ha una buona sensibilità, ma specificità troppo bassa a causa della sua incapacità di distinguere ceppi tossigeni e non se utilizzato in esclusiva. Viene dunque usato in combinazione con altri test in un algoritmo di diagnosi a due step economico e sufficientemente sensibile109 in cui ad un test di screening GDH positivo si fa seguire una prova di citotossicità o un test EIA per tossine.
19
Il test EIA per tossina A/B è un test rapido, ma meno sensibile della prova di coltura tossigena e del test per GDH. E' particolarmente importante per l'ottimale rendimento del test che il campione sia conservato a temperatura appropriata dopo prelievo (4°C) e che non passino più di 6 ore tra il prelievo e l'analisi110. Nonostante i suoi limiti è tutt'ora il test più ampiamente utilizzato nei laboratori per il costo ridotto ed il rapido risultato105.
Il metodo diagnostico più recente per l'identificazione di C. difficile in campioni fecali è la PCR, che ha come target i geni contenenti le tossine A e B. In questo modo si dimostra con un unico test la presenza del batterio e la sua capacità di produrre tossina. Non è possibile però dimostrare l'associazione tra la sintomatologia ed il patogeno, che deve essere presunta dalla clinica. Inoltre il test risulta positivo per i portatori sani di ceppi tossigeni, caratteristica che il medico deve considerare per evitare il trattamento a pazienti sintomatici. Il test ha un ottimo profilo di sensibilità (100%) e specificità (99%)110, un tempo di esecuzione di 45-180 minuti111, ma un costo più elevato rispetto ai test EIA112. Nell'algoritmo diagnostico proposto da Fenner113, la PCR trova posto come test dirimente in caso di discordanza tra GDH e EIA per tossina.
Decorso e Prognosi
Formulare una predizione circa l'esito dell'infezione da C. difficile rimane uno dei problemi fondamentali della patologia e costituisce un fattore limitante nella gestione del paziente. Se è vero, infatti, che la maggior parte dei pazienti con CDI va incontro a guarigione, si riportano percentuali ridotte di infezioni gravi o molto gravi ed una fetta consistente di soggetti che sviluppa recidiva. Le infezioni gravi rappresentano un problema per l'elevata mortalità - a seconda della casistica, è compresa tra il 35 e l'80%114, con una percentuale di decessi direttamente attribuibili all'infezione stimata attorno al 2%105 . Le recidive rappresentano, invece, una importante causa di morbilità con costi elevati sia in termini economici che di salute. La loro incidenza è stimata attorno al 10-20% dei casi di CDI114.
Poter individuare precocemente i pazienti a rischio di infezione grave o recidiva potrebbe permettere di monitorare più attentamente il decorso clinico per scorgere con sufficiente anticipo i segnali di malattia così da limitarne gli effetti attraverso interventi terapeutici appropriati.
La definizione di infezione grave da C. difficile, così come riportata nelle linee guida prodotte da ESCMID (European Society of Clinical Microbiology and Infectious Diseases), è quella di
20
un episodio di CDI che si risolve con decesso, colectomia o ricovero in terapia intensiva97. Numerosi fattori sono stati correlati positivamente con l'infezione grave, ma nessuno di questi o loro combinazioni si sono dimostrati sufficientemente accurati per la formulazione della prognosi115. Rimane tuttavia il problema della identificazione precoce di questi pazienti perché si ritiene che in questi casi, caratterizzati da elevate percentuali di insuccesso della terapia medica, un intervento chirurgico tempestivo possa migliorare la sopravvivenza71. La recidiva è definita come una ricomparsa della sintomatologia nelle 8 settimane successive al primo episodio dopo intervallo asintomatico e completamento della terapia iniziale97. La recidiva può essere dovuta a deficit del sistema immunitario o ad alterazione persistente della flora intestinale. A supporto della prima teoria c'è l'osservazione di più bassi livelli di IgG anti-tossina A in pazienti che sviluppano recidiva55. A confermare l'alterazione del microbioma sono invece dati sulla minore diversità in termini di specie della flora dei pazienti recidivanti116 e circa l'efficacia del trapianto di feci in confronto ad altri tipi di terapia117. Le variabili che più spesso sono state associate a recidiva sono: età, uso di antibiotici dopo la diagnosi di CDI, uso di inibitori di pompa protonica e ceppo118.
Terapia
Linee guida per la terapia dell'infezione da C. difficile sono state elaborate sia dalla IDSA (Infectious Diseases Society of America)105 che dalla ESCMID (European Society of Clinical Microbiology and Infectious Diseases)97. Di seguito si farà riferimento alla seconda.
Il trattamento della CDI è prevalentemente di tipo medico, basato sulla somministrazione di antibiotici. Altri interventi con intento terapeutico contemplati dalle linee guida sono il trapianto di feci, la terapia con immunoglobuline, l'uso di probiotici e farmaci leganti le tossine. L'intervento chirurgico in forma di colectomia totale è suggerito solo in caso di perforazione intestinale o precipitazione delle condizioni cliniche (megacolon tossico, addome acute ed ileo paralitico) nonostante l'uso di terapia antibiotica al massimo dosaggio.
A seguito della diagnosi di CDI è opportuno adottare tutte le misure necessarie al controllo dell'infezione ed alla prevenzione della sua diffusione, come sarà illustrato nella sezione successiva. Le misure che riguardano invece il paziente infetto sono: interruzione della terapia antibiotica in corso, terapia di supporto con fluidi ed elettroliti, revisione dell'uso di
21
inibitori di pompa protonica. E' sconsigliato l'utilizzo di inibitori della motilità intestinale. La successiva scelta del trattamento dipende dalla gravità dell'infezione e dal numero di recidive o dal rischio che queste si sviluppino.
Una prima distinzione va operata in infezioni lievi/moderate e infezioni gravi. Le seconde sono definite come episodi di CDI con uno o più segni/sintomi specifici di colite grave o decorso caratterizzato da shock e coinvolgimento sistemico.
Le infezioni lievi/moderate sono trattate con metronidazolo 500 mg tid per 10 giorni somministrato per os, trattamento poco costoso, ma caratterizzato da alcune problematiche. Tra queste, la probabile resistenza di determinati ceppi tra cui 027119 e caratteristiche farmacocinetiche meno favorevoli come l'assorbimento intestinale che ne modifica la concentrazione nel sito attivo120. Inoltre, il metronidazolo, può causare la comparsa di effetti collaterali, seppur lievi121,122. Da notare che è accettabile anche un comportamento di tipo conservativo, ovvero interruzione della terapia antibiotica e attento monitoraggio del paziente per 48 ore.
Negli episodi di infezione grave è invece consigliata la vancomicina per os che ha profilo farmacocinetico migliore120, non essendo assorbita a livello intestinale, ma ha un costo più elevato e può causare la selezione di enterococchi vancomicino-resistenti (VRE) soprattutto in occasione di epidemie in cui il suo utilizzo cresce a livello di popolazione123. Il dosaggio previsto è di 125 mg qid per 10 giorni per os, che può essere aumentato a 500 mg qid in caso di ileo paralitico124.
Se l'infezione è classificata come prima recidiva, il trattamento può includere indistintamente vancomicina o fidaxomicina. Quest'ultima è il capostipite di una nuova classe di antibiotici, i macrociclici, con peculiari caratteristiche farmacologiche. Si tratta, infatti, di un farmaco specifico per C. difficile che agisce sia sulla trascrizione genica che sulla sporulazione e produzione di tossine125–127. La sua selettività, e conseguente risparmio del microbioma intestinali, è probabilmente alla base del minor tasso di recidiva128,129.
In quei casi in cui il trattamento antibiotico ripetuto non assicura la scomparsa dell'infezione, può essere considerato il trapianto di feci come valida opzione terapeutica130.
22
Prevenzione
Le strategie di prevenzione dell'infezione da C. difficile sono basate su isolamento da contatto, stretta osservanza delle norme igieniche e antibiotic stewardship.
L'isolamento da contatto ha l'obiettivo di impedire la trasmissione delle spore da un paziente infetto ad un altro in maniera diretta o indiretta, quindi mira a contenere la diffusione delle spore all'ambiente circostante. I presidi utilizzati per questo scopo sono i guanti, i camici monouso, i copriscarpe. In particolare, l'uso obbligatorio di guanti per pazienti infetti è stato dimostrato diminuire l'incidenza di CDI da 7.7 a 1.5 casi per 1000 ricoveri in uno studio effettuato a Minneapolis131, dato che conferma il ruolo del personale sanitario nella diffusione dell'infezione. Inoltre, l'utilizzo di presidi medici dedicati e l'assegnazione del paziente infetto ad una camera singola - ove possibile - o ad una coorte, incide positivamente sul controllo dell'infezione, come dimostrato dallo studio di McFarland et al. in cui i pazienti in camera singola avevano una probabilità di trasmissione significativamente inferiore rispetto a quelli in stanza doppia (7% vs 17%)132.
Le norme igieniche da osservare per la prevenzione della CDI includono il lavaggio delle mani con acqua e sapone per tutte le persone che vengono in contatto con il malato105. L'uso di soluzioni a base di alcool non sono efficaci nei confronti delle spore133. L'igiene ambientale va invece assicurata mediante l'utilizzo di prodotti a base di cloro o perossido di idrogeno vaporizzato134.
Antibiotic stewardship, infine, si riferisce all'insieme delle buone pratiche che hanno come
obiettivo quello di ridurre l'uso di antibiotici sulla base dell'evidenza scientifica. In particolare, è bene ricordare che le terapie antibiotiche con farmaci ad ampio spettro vanno limitate in favore di terapie mirate, basate sull'antibiogramma o sulla epidemiologia locale.
23
L'epidemia pisana
La persistente diffusione di casi di CDI nell’ospedale di Pisa, che ha interessato gran parte dei reparti di degenza e sembra tuttora continuare, ci ha indotti ad utilizzare il sistema di Alert microbiologico (che riporta in tempo reale la positività della tossina per C. difficile) per ricostruire l’andamento dell’epidemia pisana nel periodo 2012-2013.
Pazienti e Metodi
La fonte primaria dei dati è costituita dall'archivio informatico del laboratorio di Microbiologia Universitaria della Azienda Ospedaliero-Universitaria Pisana (AOUP).
Lo studio ha considerato il test immuno-enzimatico (EIA) per la ricerca delle tossine A e B utilizzato per la diagnosi di CDI dal laboratorio di Microbiologia Universitaria. Il test viene eseguito su campioni di feci idonei (Bristol Chart 5-7) provenienti da pazienti con diarrea. Il risultato del test appare in tempo reale nel sistema di Alert microbiologico aziendale che include C. difficile tra i microrganismi sentinella (insieme con KPC, legionella, pneumococco).
La selezione di tutti i test effettuati nel periodo compreso tra il 28/11/2011 ed il 31/12/2013 con l’anagrafica relativa ha individuato il numero totale di test effettuati. Sono poi stati esclusi i test provenienti da strutture sanitarie esterne all'ospedale e sono stati selezionati i test eseguiti nel biennio (01/01/2012 e 31/12/2013).
Il totale dei test effettuati nella AOUP nel biennio 2012 e 2013 ed i test risultati positivi sono stati utilizzati per le valutazioni statistiche idonee a determinare l’incidenza retrospettiva dell'infezione da C. difficile in ospedale e per ciascun reparto. I dati relativi ai denominatori utilizzati (numero di ricoveri annuali e numero giornate di degenza) sono stati tratti dal Report di attività aziendale 2012-2013.
In seguito, i test positivi ridondanti o relativi a campioni di pazienti con meno di 18 anni sono stati esclusi per ottenere il totale episodi di CDI.
Gli episodi di CDI sono stati classificati come primi episodi e recidive sulla base di criteri temporali: si è definita come recidiva la positività del test di uno stesso paziente intervenuta > 14 giorni dalla prima documentazione.
24
La raccolta delle informazioni relative al ricovero è stata condotta solo per i primi episodi. E' stato possibile consultare solo il 55% delle cartelle cliniche (139/254): alcune in versione cartacea, accedendo direttamente all'archivio di reparto, altre in versione digitale mediante l'uso dell'interfaccia aziendale Facile+. La restante parte delle cartelle è inaccessibile a causa delle procedure di trasferimento e digitalizzazione in corso presso la AOUP.
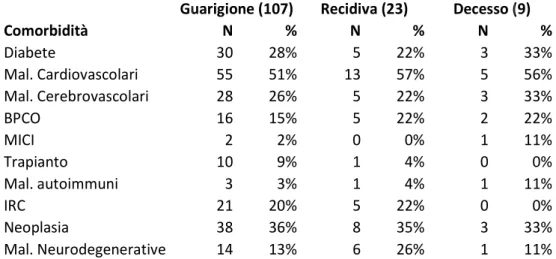
Dalla cartella clinica si sono acquisite informazioni relative a: età, sesso, fattori di rischio , parametri ematochimici, terapia ed esito. La valutazione delle comorbidità ha preso in considerazione: diabete, malattie cardiovascolari, malattie cerebrovascolari, broncopneumopatia cronica ostruttiva, malattie infiammatorie croniche intestinali, insufficienza renale cronica, neoplasia e malattie neurodegenerative. Inoltre è stato annotato quanti pazienti avevano subito un trapianto d'organo.
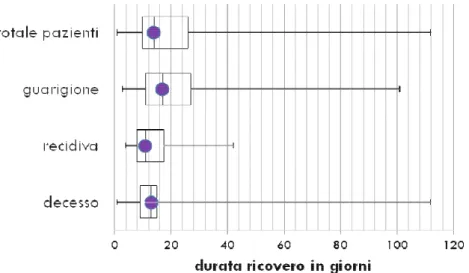
I pazienti sono stati suddivisi in tre gruppi in base all'esito: guarigione, recidiva e decesso ed è stata quindi condotta l'analisi comparativa dei dati relativi.
L'analisi statistica è stata condotta con l'obiettivo di individuare differenze significative tra il gruppo dei guariti e quello dei recidivati, essendo il gruppo dei deceduti troppo piccolo per risultare statisticamente rilevante.
Per l'analisi della variabile continua "durata del ricovero" sono stati utilizzati il test non parametrico di Mann-Whitney e la regressione logistica univariata. Per le variabili binarie sono stati utilizzati il test del chi-quadro con correzione di Yates e la regressione logistica univariata. L'utilizzo della regressione logistica multivariata, non perseguibile per l'esiguità delle variabili e del campione, è stata sostituita con analisi Random Forest.
Risultati
Test per CDI
I test per la ricerca delle tossine di Universitaria nel biennio 2012
Figura 2.1: origine e metodo di selezione dei dati
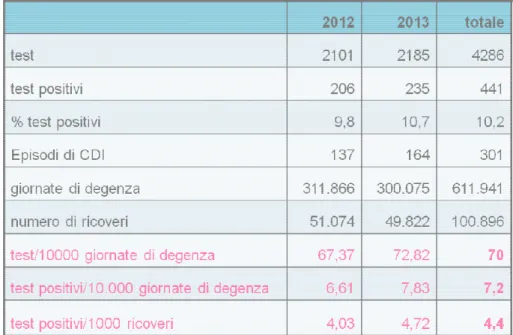
La frequenza dei test in due anni (numero di test/10.000 giornate di degenza) è risultata pari a 70 (67 nel 2012 e 72 nel 2013).
frequenze di test compresa tra
figura 2.2, nei reparti medici la frequenza di test è maggiore rispetto ai reparti chirurgici ed alle terapie intensive.
Figura 2.2: relazione tra test/10.000 giornate
reparto
I test per la ricerca delle tossine di C. difficile eseguiti dal Laboratorio di Microbiologia Universitaria nel biennio 2012-2013 sono stati 4286 relativi a 301 episodi. (Figura 2.1).
: origine e metodo di selezione dei dati
est in due anni (numero di test/10.000 giornate di degenza) è risultata pari a 70 (67 nel 2012 e 72 nel 2013). Il dato relativo ai singoli reparti risulta disomogeneo con
compresa tra 3 e 308 ogni 10.000 giornate di degenza.
figura 2.2, nei reparti medici la frequenza di test è maggiore rispetto ai reparti chirurgici ed
: relazione tra test/10.000 giornate-degenza e test positivi/10.000 giornate degenza per tipo di
25
eseguiti dal Laboratorio di Microbiologia 2013 sono stati 4286 relativi a 301 episodi. (Figura 2.1).
est in due anni (numero di test/10.000 giornate di degenza) è risultata pari a relativo ai singoli reparti risulta disomogeneo con 308 ogni 10.000 giornate di degenza. Come mostrato dalla figura 2.2, nei reparti medici la frequenza di test è maggiore rispetto ai reparti chirurgici ed
Lo stesso indice è stato calcolato per i 441 test positivi (10,2% del totale) con una frequenza pari a 6,6/10.000 g.d. nel 2012 e 7,8/10.000 g.d. nel 2013. Il dato complessivo per i due anni è di 7,2 test positivi ogni 10.000 d.g..
Il numero di test positivi è stato rapportato al numero di ricoveri ospedalieri: 4,4 test positivi ogni 1000 ricoveri (range 0
Tabella 2.1: frequenza di test e frequenza di test positivi per giornate di degenza e ricoveri.
Episodi di CDI
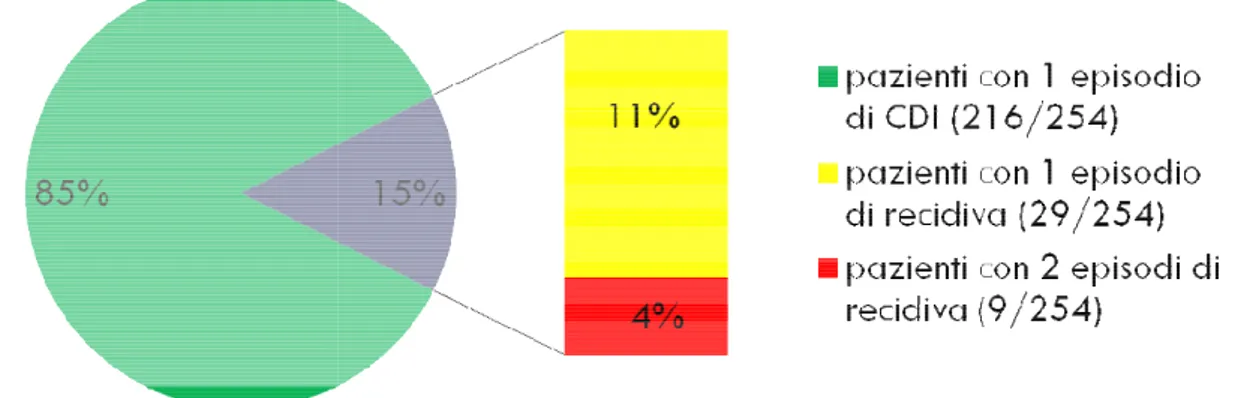
301 episodi di CDI sono stati individuati
stati distinti in primi episodi e recidive. I primi episodi costituiscono l'84% (254/301) del totale, mentre le recidive il restante 16% (47/301)
Figura 2.3: primi episodi e recidive di CDI
Lo stesso indice è stato calcolato per i 441 test positivi (10,2% del totale) con una frequenza pari a 6,6/10.000 g.d. nel 2012 e 7,8/10.000 g.d. nel 2013. Il dato complessivo per i due anni è di 7,2 test positivi ogni 10.000 d.g..
vi è stato rapportato al numero di ricoveri ospedalieri: 4,4 test positivi ogni 1000 ricoveri (range 0-34) (tabella 2.1).
: frequenza di test e frequenza di test positivi per giornate di degenza e ricoveri.
no stati individuati 441 test positivi (vedi figura 2.1). Gli episodi sono stati distinti in primi episodi e recidive. I primi episodi costituiscono l'84% (254/301) del
cidive il restante 16% (47/301) (figura 2.3).
episodi e recidive di CDI
26
Lo stesso indice è stato calcolato per i 441 test positivi (10,2% del totale) con una frequenza pari a 6,6/10.000 g.d. nel 2012 e 7,8/10.000 g.d. nel 2013. Il dato complessivo per i due anni è
vi è stato rapportato al numero di ricoveri ospedalieri: 4,4 test positivi
: frequenza di test e frequenza di test positivi per giornate di degenza e ricoveri.
figura 2.1). Gli episodi sono stati distinti in primi episodi e recidive. I primi episodi costituiscono l'84% (254/301) del
Gli episodi sono equamente distribuiti tra donne (152/301) e uomini (149/301). Si individua invece una differenza tra i sessi per le sole recidive che riguardano gli uomini per il 64% (30/47) e donne per il 36% (17/47) (figura 2.
Figura 2.4: percentuale di uomini e donne in totale casi, primi episodi e recidive di CDI
Nel complesso gli episodi si distribuiscono tra i reparti in maniera d (215/301) dei primi episodi è presente in reparti di ar
area chirurgica, l'8% (23/301) proviene da campioni prelevati in ambulatorio e solo il 4% (13/301) degli episodi si è verificato in pazienti ricoverati nelle unità di terapia intensiva
Una distribuzione simile si ritrova nell
distribuzione delle recidive presenta invece delle differenze con una ancora maggiore rappresentatività dei reparti di area medica, nei quali si concentra il 77% (36/47) degli episodi, e degli ambulatori
reparti chirurgici (figura 2.5
Figura 2.5: distribuzione per tipologia di reparto del totale, dei primi
Gli episodi sono equamente distribuiti tra donne (152/301) e uomini (149/301). Si individua invece una differenza tra i sessi per le sole recidive che riguardano gli uomini per il 64%
e per il 36% (17/47) (figura 2.4).
: percentuale di uomini e donne in totale casi, primi episodi e recidive di CDI
Nel complesso gli episodi si distribuiscono tra i reparti in maniera d primi episodi è presente in reparti di area medica, il 17% (50/301)
area chirurgica, l'8% (23/301) proviene da campioni prelevati in ambulatorio e solo il 4% (13/301) degli episodi si è verificato in pazienti ricoverati nelle unità di terapia intensiva
Una distribuzione simile si ritrova nell'analisi della localizzazione dei primi episodi. La distribuzione delle recidive presenta invece delle differenze con una ancora maggiore rappresentatività dei reparti di area medica, nei quali si concentra il 77% (36/47) degli episodi, e degli ambulatori (17% - 8/47) e solo il 6% (3/47) degli episodi che avvengono i reparti chirurgici (figura 2.5).
: distribuzione per tipologia di reparto del totale, dei primi episodi e delle recidive di CDI
27
Gli episodi sono equamente distribuiti tra donne (152/301) e uomini (149/301). Si individua invece una differenza tra i sessi per le sole recidive che riguardano gli uomini per il 64%
: percentuale di uomini e donne in totale casi, primi episodi e recidive di CDI
Nel complesso gli episodi si distribuiscono tra i reparti in maniera disomogenea. Il 71% 17% (50/301) è in reparti di area chirurgica, l'8% (23/301) proviene da campioni prelevati in ambulatorio e solo il 4% (13/301) degli episodi si è verificato in pazienti ricoverati nelle unità di terapia intensiva.
'analisi della localizzazione dei primi episodi. La distribuzione delle recidive presenta invece delle differenze con una ancora maggiore rappresentatività dei reparti di area medica, nei quali si concentra il 77% (36/47) degli 8/47) e solo il 6% (3/47) degli episodi che avvengono in