FACOLTA’ DI AGRARIA
Corso di laurea specialistica in Biotecnologie agro-industriali curriculum Vegetale
ELABORATO
FINALE
La pigmentazione nel fiore di Lilium
Candidato Relatori
Domenico Prisa Dott. ssa Laura Pistelli Dr. Gianluca Burchi
INDICE
1 - INTRODUZIONE: IL LILIUM 5 1.1 - Caratteristiche botaniche 5 1.2 - Coltivazione 6 1.3 - Avversità 7 1.4 - Miglioramento genetico 9 1.5 - Aspetti economici 102 - IL COLORE DEI FIORI 12
2.1 - I pigmenti 13
2.1.1 - I flavonoidi 14
2.1.2 - I carotenoidi 16
2.1.3 - Le betalanine 17
2.2 - FATTORI CHE INFLUENZANO LA PIGMENTAZIONE 18
2.2.1 - Il pH 18 2.2.2 - La temperatura 19 2.2.3 - La luce 20 2.2.4 - Gli zuccheri 21 2.2.4.1 - Saccarosio 21 2.2.4.2 - Glucosio e fruttosio 23 2.2.5 - Elementi nutritivi 24
2.2.6 - Stimolatori della formazione di antociani 26
2.2.6.1 - Bion 26
2.2.6.2 - La kinetina 27
3 - LA GENETICA DEL COLORE DEI FIORI 27
3.1 - La forma delle cellule epidermiche 27
3.2 - Miglioramento genetico mediante biotecnologie 28
PARTE SPERIMENTALE 31
1 - SCOPO DELLA RICERCA 31
2 - MATERIALI E METODI 32
2.1 - Materiale vegetale 32
2.2 - Epoche e densità d’impianto, trattamenti colturali 32 2.3 - Trattamenti effettuati sugli steli ai fini della valutazione della longevità 33 2.4 - Trattamenti per il miglioramento del colore dei tepali 34 2.5 - Rilievi sulla longevità delle infiorescenze, sulle dimensioni dei bocci e sugli
aborti fiorali
35
2.6 - Rilievi sul colore 35
2.7 - Spettrocolorimetro 36
2.8 - Elaborazione dei dati 37
3 - RISULTATI 38
3.1 - Analisi effettuate sugli steli 38
3.2 - Dimensione dei bocci fiorali 42
3.4 – Analisi dei dati ottenuti dallo spettrocolorimetro 49
4 - DISCUSSIONE E CONCLUSIONI 51
BIBLIOGRAFIA 53
Ringraziamenti
In uno dei momenti più importanti della mia vita, vorrei rivolgere un pensiero a tutti coloro che durante il corso di studi mi sono stati vicini.
Vorrei ringraziare la dott.ssa Laura Pistelli, per la disponibilità e l’aiuto fornitomi nella stesura dell’elaborato finale.
Il dr. Gianluca Burchi che mi ha aiutato, capito e consigliato durante tutto lo svolgimento degli esperimenti e nella stesura della tesi.
Il dr. Antonio Grassotti per avermi dato l’opportunità di poter svolgere questo lavoro di tesi presso il (C.R.A.-Istituto Sperimentale per la Floricoltura di Pescia)
Un ringraziamento particolare al sig. Fernando Pierandrei per i suoi consigli e la sua amicizia e al sig. Stefano D’Andrea per la sua disponibilità e l’aiuto nell’elaborazione dei dati della prova.
Un grazie di cuore alla mia famiglia, che mi ha dato la possibilità di poter arrivare a questo traguardo. Spero che in questo momento possiate essere orgogliosi e in parte ripagati per tutti sacrifici che avete fatto in questi anni per me.
INTRODUZIONE
Capitolo 1 - Il Lilium
1.1 - Caratteristiche botaniche
Anticamente il nome latino ha tratto origine dal termine greco Leiron utilizzato da Teofrasto per indicare il “Madonna Lily”.
Il genere comprende circa ottanta specie di piante bulbose appartenenti alla famiglia delle Liliaceae che sono originarie dell’emisfero settentrionale. Il Lilium ha un areale di diffusione vastissimo, che comprende zone temperate dell’Europa e dell’Asia, al di sopra dell’equatore, e l’America Settentrionale. In senso longitudinale, tale area si estende, attraverso l’Europa e l’Asia, sino al Kamchatka, e dall’isola di Vancouver a oriente, attraverso la Nuova America, fino alla Nuova Scozia. Il L. neilgherrense è la specie rinvenuta più a sud, a 3000 metri nell’India meridionale; il L.
martagon, reperito in Siberia, quello con areale più a nord (M. De Ranieri et al., 1984).
Le varietà commerciali più importanti possono essere distinte in tre tipologie principali: ibridi Asiatici (‘Pollyanna’,’Elite’,’Vivaldi’), ibridi Orientali (‘Casablanca’, ‘Star Gazer’) e ibridi Longiflorum (‘Snow Queen’, ‘ White Fox’). Negli ultimi anni è stata inserita la tipologia degli ‘LA’, caratterizzata da ibridi interspecifici derivanti da incroci tra ‘Asiatici’ e ‘Longiflorum’. In Italia la produzione commerciale è caratterizzata per il 70% dagli “Ibridi Asiatici”, per il 20% dagli “ Ibridi Orientali” e per il 10% dagli “Ibridi Longiflorum”.
Gli organi di riproduzione vegetativa del Lilium, i bulbi, in genere sono costituiti da scaglie carnose sovrapposte ad embrici, non tunicate. Su stelo eretto le foglie, lanceolate o lineari, sono inserite in ordine sparso, talvolta verticillate; all’ascella portano talvolta bulbilli. I fiori sono grandi, appariscenti, spesso profumati, eretti, orizzontali o penduli, solitari o inseriti in un racemo o falso ombrello, con pochi o molti fiori; il perianzio è deciduo; i tepali sono segmenti liberi, variabili in forma e portamento, non troppo larghi alla base, tutti provvisti di nettario; gli stami sono sei, i filamenti sottili, affusolati gradualmente dalla base all’apice, le antere dorsofisse, l’ovario a tre
celle, lo stilo generalmente lungo, il frutto costituito da capsule con molti semi. Il numero cromosomico somatico è generalmente 2n = 24 ( diploide).
Se si tiene presente la larga distribuzione delle specie comprese nel genere e negli habitats diversi da cui originano, è evidente che la gamma di esigenze colturali è piuttosto varia secondo i gruppi di specie. Quasi tutte sono rustiche ma alcune, specialmente quelle originarie dei Paesi caldi e quelle che hanno un inizio di sviluppo piuttosto precoce, abbisognano di strutture di protezione negli ambienti di coltivazione.
1.2 - Coltivazione
I Lilium prediligono condizioni ambientali analoghe a quelle di origine, cioè suoli vulcanici molto porosi, climi ad inverno piuttosto asciutto e periodo estivo mitigato da frequenti piogge. Le piante richiedono ombreggiamento sulla parte basale e per tale motivo hanno uno sviluppo migliore se coltivate tra basse siepi di sempreverdi o in terreni boscosi piuttosto aperti. Le specie Americane, che sono in genere prive del secondo palco di radici alla base dello stelo, hanno talvolta bulbi rizomatosi o stoloniferi. Sembrano prediligere terreni costituiti da un composto che contenga in abbondanza residui di foglie o torba.
Il ciclo produttivo del Lilium può essere diviso in due fasi: la propagazione, finalizzata all’ottenimento di materiale sano (bulbetti) in quantità elevata da destinare alla produzione, e l’ingrossamento, durante il quale i bulbilli vengono portati alle dimensioni e al peso ideale per la produzione di fiori commercialmente validi. Le varietà oggi in commercio necessitano di ambienti di coltivazione con temperature oscillanti tra i 12-15°C di notte e i 21-25°C di giorno. Temperature più basse provocano il rallentamento della crescita, ma allo stesso tempo il miglioramento della qualità, con produzione di steli più lunghi e robusti con un elevato numero di fiori.
Il Lilium è una pianta molto esigente in termini di luce, pur non essendo una longidiurna obbligata. L’insufficienza di luce nel periodo invernale può portare all’aborto o all’abscissione dei fiori (prevalentemente quelli apicali). Nelle varietà più sensibili ciò rende necessario ricorrere all’illuminazione artificiale con l’utilizzo di lampade a vapore di sodio da 400 W ciascuna che, fissate a due metri dal suolo, coprono 8-9 m2 di coltura. Anche l’eccesso di luminosità è negativo, tendendo a favorire la produzione di steli corti. In questo caso le piante devono essere ombreggiate mediante reti, in grado di trattenere l’intensità luminosa fino al 70% (Grassotti e Magnani, 1988). La distanza di impianto è funzione della stagione, del calibro dei bulbi e delle varietà; varia da 35 a 60 bulbi per mq per il calibro 14-16, 35-55 bulbi per mq per quello 16-18, 25-50 bulbi per mq per
quello 18-20, 25-35 bulbi per mq per quello 20-22, a 25-30 bulbi per mq per il calibro >22. La densità minore si adotta nei mesi poveri di luce e quella maggiore nelle colture primaverili.
Per l’impianto bisogna scegliere un terreno ben drenato, con pH di 5,5-7,5, ammendato se argilloso con sostanza organica umidificata o torba bionda, lavorato ad una profondità di 40 cm per favorire lo sgrondo, con un basso livello di salinità. Come concimazione di base bisogna interrare 1 m3 ogni 100 mq di letame molto maturo e concimi chimici con titoli dosati a seconda dei risultati dell’analisi chimica. Si ritiene che il miglior rapporto N:P:K sia pari a 1,0:0,5:1,5. Alcuni autori consigliano una concimazione mediante fertirrigazione ogni due settimane con 2,5 gr/l di nitrato di sodio o di calcio e 1,5 gr/l di cloruro di potassio (Grassotti et al., 1981).
Circa 3 settimane dopo la germogliazione e 3 settimane prima della fioritura si deve somministrare nitrato di calcio alla dose di 1 Kg per 100 mq, come fertirrigazione sottochioma. L’acqua che viene impiegata deve essere di buona qualità, con un contenuto di sali minore di 500 mg/l. Di solito si pianta su terreno ben umido e si irriga abbondantemente per farlo aderire al bulbo; successivamente si mantiene il substrato ad una umidità costante, ma senza ristagni in quanto la carenza d’acqua può causare ritardi nella crescita ed aborto dei fiori.. Prima dell’impianto si può stendere a terra una rete come quelle dei crisantemi, per sostenere gli steli in fioritura.
Gli steli vengono recisi quando i primi boccioli sono ben colorati e si iniziano a divaricare i petali. Dopo la raccolta, viene sfogliata la parte basale dello stelo, che in seguito viene messo in acqua contenente Chrysal-Garofano VB, per almeno 4 h, e poi conservato nelle celle frigorifere, in acqua e in posizione eretta. Per controllare l’altezza delle piante in modo da ottenere una pianta armonica, si può ricorrere all’uso di prodotti nanizzanti applicati per immersione del bulbo in preimpianto e per irrigazione del vaso alla germogliazione. Bisogna fare comunque attenzione all’eccesso di nanizzante, che può provocare l’ingiallimento delle foglie basali, ed agli sbalzi di umidità, per evitare danni al fogliame. L’utilizzazione di film plastici per la pacciamatura assicura, oltre a un controllo delle infestanti, anche dei riflessi positivi sul materiale prodotto (Grassotti e Magnani 1988).
1.3 - Avversità
La coltivazione del Lilium è spesso messa in pericolo dall’attacco di nematodi, batteri e funghi che sono portatori di malattie. Il loro controllo dipende principalmente dalla qualità del materiale utilizzato e dall’uso dei giusti prodotti chimici.
Generalmente i Lilium sono attaccati da diversi fitofagi sia nella parte epigea (steli e fiori) sia in quella ipogea (radici e bulbi). I fitofagi più pericolosi della parte epigea sono soprattutto afidi e
tripidi (Myzus persicae, M. solani, M. circumflexus, M. lili, Frankliniella occidentalis, Thrips
tabaci) che provocano con l’apparato boccale la deformazione degli organi vegetativi e favoriscono
la trasmissione dei virus. Gli attacchi si evidenziano con l’arricciamento delle foglie e dei germogli, e sui boccioli causano delle macchie traslucide, i fiori sono piccoli, deformi e decolorati e in alcuni casi si ha anche l’aborto dei boccioli. I fitofagi della parte ipogea (Agrotis segetum, A. ipsilon) provocano lesioni dei bulbi e sono pericolosi soprattutto allo stadio larvale, quando fuoriescono dal terreno per nutrirsi delle foglie più basse e del fusto a livello del colletto. Possono scavare anche delle gallerie all’interno del bulbo provocando gravi problemi alla coltura.
La dannosità dei nematodi e’ dovuta sia alla loro azione diretta che alle possibili infezioni di funghi, batteri e virus, di cui possono essere vettori. Tra le specie più pericolose si ricordano: Meloidogyne
incognita, Aphelechoides fragarie, Ditylenchus dipesaci, Pratylenchus penetrans. I nematodi
attaccano principalmente le radici, da cui traggono i succhi cellulari ed in cui depositano le uova, portando alla necrosi dei tessuti, che divengono flaccidi e inconsistenti, ed all’ingiallimento ed appassimento della pianta (Di Genova, 2000).
Numerose e gravi sono le patologie fungine del Lilium. Le principali specie che attaccano la parte ipogea sono Fusarium oxysporum, Phytophthora, Pythium e Collettotricum, che causano generalmente marciumi radicali sui bulbi con formazione di macchie, conseguente alterazione dello stelo ed ingiallimento delle foglie. Tra i funghi che attaccano la parte epigea si ricordano
Rhizoctonia solani, che, nel caso di lievi attacchi, provoca delle macchie bruno chiare sulle foglie
basali mentre, nel caso di gravi attacchi, causa delle macchie anche sulle foglie apicali fino a compromettere la fioritura. La Botritys elliptica si manifesta con piccole macchie circolari sulle foglie che vanno ingrandendosi fino ad occupare tutta la superficie fogliare e, in seguito, anche sul resto della pianta. Le temperature medie e tassi alti di umidità favoriscono lo sviluppo di questo patogeno (Di Genova, 2000)..
Le malattie di origine virale che possono colpire il Lilium sono numerose: il CMV (Cucumber Mosaic Virus), l’AMV (Arabic Mosaic Virus), il TMV (Tabacco Mosaic Virus), il TRSV (Tabacco Ring-Spot Virus), l’LVX (Lily Virus X), il TBV (o “ Virus della rottura del colore del tulipano”) e LSV (o “Virus senza sintomi del Giglio”). Tra questi, LSV (Lily Simptomless Virus) è il più comune dei virus del Lilium, colpisce quasi tutti gli ibridi coltivati ed è, inoltre, l’unico specifico. La sua presenza limita lo sviluppo vegetativo della pianta, diminuisce il numero e la grandezza dei fiori, rendendo la pianta più suscettibile ad attacchi patogeni di Botritys e Fusarium. La trasmissione avviene comunemente attraverso gli afidi. Per ottenere piante esenti da virus vengono utilizzate delle tecniche quali la termoterapia, la chemioterapia e la coltura in vitro di apici meristematici.
1.4 - Miglioramento genetico
In seguito all’introduzione sul mercato di nuovi ibridi provenienti dagli Stati Uniti, si è avuta intorno alla metà del ‘900 un aumento della produzione di Lilium in Italia. L’utilizzo di nuove tecnologie come la PCR e l’identificazione di nuovi marcatori molecolari ha permesso la caratterizzazione genomica di nuove varietà e un continuo miglioramento delle caratteristiche fisiologiche e morfologiche, permettendo anche l’abbattimento di barriere come l’autoincompatibilità e la maschiosterilità che in passato non permettevano gli incroci. Sicuramente possiamo dire che negli Stati Uniti e nei Paesi del centro Europa queste tecnologie negli ultimi anni hanno fatto passi da gigante, a differenza dell’Italia che si trova sempre ad importare materiale dall’estero con conseguenze economiche problematiche per i nostri floricoltori
Generalmente i punti primari che vengono ricercati nei programmi di miglioramento genetico su questa bulbosa sono:
Individuazione di ibridi in grado di rispondere positivamente alla forzatura, così da assicurarne la coltivazione per fiore reciso durante tutto l’arco dell’anno;
Reperimento di nuove forme e colori dei fiori, per rispondere alle continue richieste di novità da parte del mercato, obiettivo raggiungibile sia attraverso incroci intra- ed inter-specifici, sia mediante tecniche di ingegneria genetica;
Risanamento da virus, mediante la coltivazione ‘in vitro’ di apici meristematici, e controllo di fitopatie (soprattutto Fusarium oxysporum f.sp. lilii), individuando forme resistenti (anche mediante il ricorso all’ingegneria genetica);
Ampliamento della versatilità di impiego dei bulbi per la coltivazione sia per fiore reciso che per vaso;
Incremento dell’indice di moltiplicazione, mediante la propagazione massale in vitro;
Riduzione del periodo necessario all’ottenimento di bulbi di tipo commerciale sia attraverso trattamenti termici al materiale di propagazione, che utilizzando seme F1;
Individuazione di varietà che presentino una maggiore durata in vaso degli steli fiorali nelle fasi di post-raccolta, che conservino al meglio le caratteristiche qualitative dei fiori e delle foglie anche dopo frigoconservazione, che presentino colori brillanti anche se coltivate in periodo autunno-invernale.
Un programma di breeding fu avviato anche in Italia presso l’Istituto Sperimentale per la Floricoltura di Pescia, a partire dall’anno 1984. Diversi ibridi di Lilium sono stati sottoposti a
trattamento mediante irraggiamento con Raggi X, per ottenere mutanti solidi in possesso di buoni caratteri commerciali. I vari cicli di selezione delle progenie, derivanti dai diversi programmi di incroci, hanno permesso di individuare, moltiplicare, ingrossare e valutare alcune decine di cloni sulla base di diversi obiettivi tra i quali: idoneità alla coltivazione in pien’aria nel periodo estivo, resistenza a Botrytis elliptica, fiori con nuove forme e nuovi colori, maggiore lunghezza dello stelo fiorale, fiori senza polline, materiale idoneo alla coltivazione in vaso, varie tipologie di punteggiatura e lunghezza del ciclo di coltivazione (Grassotti e Nesi, 2002).
Un ulteriore obiettivo nei programmi di miglioramento genetico è stato l’ottenimento di ibridi interspecifici, attraverso il superamento di barriere di incompatibilità pre- e post-zigotica, che siano in possesso di caratteri agronomicamente e commercialmente validi e che presentino caratteri di resistenza a stress abiotici (freddo, siccità, salinità) e biotici (funghi, batteri, virus), rinvenibili nelle diverse specie.
Per quanto riguarda l’utilizzo di tecnologie innovative riguardanti il trasferimento di geni, le piante ornamentali si trovano in una posizione favorevole visto che non sono produzioni commestibili ed inoltre sono coltivate in superfici relativamente limitate ed in ambienti chiusi (serre). Metodi di trasformazione genetica comunemente utilizzati sono quelli del trasferimento mediante
Agrobacterium (tumefaciens e rhizogenes), della biobalistica e della elettrotransfezione (Griesbach,
1994), che permette di inserire DNA direttamente in meristemi di semi, bulbi.
La tecnologia del DNA ricombinante ha aperto nuove strade nel miglioramento genetico, grazie all’introduzione di fattori di resistenza ad alcune fitopatie ed alla possibilità di intervenire sul colore, sulla forma del fiore e sulla taglia della pianta.
1.5 - Aspetti economici
La floricoltura italiana è tradizionalmente penalizzata, quale comparto produttivo, dalla limitata disponibilità di materiale vegetale di provenienza nazionale, in particolare per quanto riguarda i bulbi da fiore. Ogni anno vengono importati, prevalentemente dall’Olanda, oltre seicento milioni di bulbi, con una spesa di circa cento milioni di euro e con una incidenza negativa sul bilancio import-export del settore florovivaistico (AIPH/Union Fleurs, 1998, 2005) (Tab. 1).
Tab. 1 – Importazione di bulbi da fiore in Italia nel 1997 e nel 2004 (AIPH/Union Fleurs, 1998, 2005).
Provenienza Tonnellate (1997) Tonnellate (2004)
OLANDA 15.846 14.679 EUROPA 16.193 14.880 MONDO 16.212 14.902
TAB. 2 - Principali bulbose da fiore reciso importate dall’Olanda in Italia (AIPH/Union Fleurs, 1998, 2005)
SPECIE N. BULBI IMPORTATI
Tulipani 76,7 milioni
Iris 82,5 milioni
Gladioli 320,5 milioni
Lilium 559,0 milioni
Tra i bulbi maggiormente coltivati per il fiore reciso figurano Lilium, Tulipani, Gladioli, Fresie e Iris (Grassotti e Nesi, 2002). I Lilium risultano senza dubbio la specie più importante dal punto di vista economico, con bulbi che possono costare da 0,13 a 1,80 Euro e steli fioriti che sul mercato possono essere venduti da 0,25 a 2,60 Euro (Grassotti et al., 2002).
Attualmente vengono coltivate in Italia diverse varietà di Lilium dei tre principali gruppi commerciali. Il 70% appartiene al gruppo degli “Ibridi asiatici”, il 20% al gruppo degli “Ibridi orientali”, il 10% a quelli degli “Ibridi longiflorum”.
La coltivazione del Lilium è particolarmente rilevante per la Campania, che nel 1987 deteneva il 10% della superficie nazionale coltivata a Lilium, passata nel 1994 al 32%(dati I.S.T.A.T.,1994). e nel 2001 a circa il 50%, con una produzione di 104 milioni di steli (ISMEA,2004), di cui 18 milioni in pien’aria ed 86 milioni in serra. Le altre regioni italiane maggiormente interessate alla coltivazione del Lilium sono il Lazio (24 milioni di steli), la Toscana (22 milioni), la Puglia (13 milioni) e la Sicilia (10 milioni) (ISMEA,2004).
Capitolo 2 - Il colore dei fiori
Il fenomeno della colorazione nei fiori è regolato principalmente dal tipo, dalla quantità e dalla stabilità dei pigmenti presenti nei tessuti, dal pH delle cellule vacuolari e dalla traslocazione dei pigmenti stessi dal sito di produzione. I pigmenti che maggiormente interessano il colore dei fiori sono: i flavonoidi, i carotenoidi, le betalanine e, in misura minore, la clorofilla. Anche i fattori ambientali come la luce, la temperatura, gli zuccheri e i metalli possono influenzare il colore (Davies e Schwinn, 1997; Griesbach, 2005).
A livello commerciale si ha l’esigenza non solo di ricercare fiori di qualità ma anche di aumentare le varietà di colori disponibili. Per alcune specie, infatti, è disponibile solo un ristretto spettro di colori dei fiori, mentre in altre specie alcuni colori sono assenti (come ad esempio il blu in rosa, garofano, Lilium e gerbera). Grazie all’ingegneria genetica utilizzata dai ricercatori da lungo tempo, si potrebbe ottenere l’introduzione di nuovi colori dedicando una maggiore attenzione verso queste nuove tecnologie. Questo è oggi dimostrato dalla maggiore attenzione che istituti di ricerca pubblici e molte compagnie biotecnologiche private hanno nei confronti di questo settore.
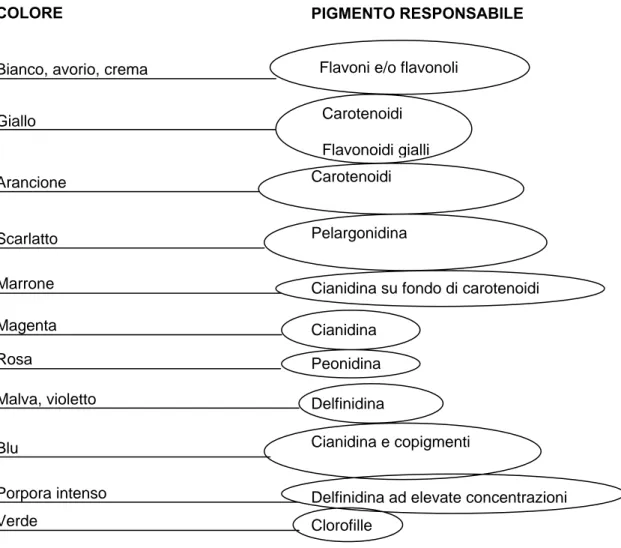
2.1 - I pigmenti
I colori dei frutti e dei fiori sono di particolare importanza nell’ecologia delle piante perché provvedono, grazie alla loro vasta gamma, di attrarre gli insetti impollinatori che permettono la diffusione delle specie anche in zone molto lontane dal luogo di origine. Come detto, sono quattro i principali pigmenti deputati a questa funzione: i flavonoidi e le betalanine, che si trovano all’interno dei vacuoli cellulari, non sono chimicamente correlati e sono mutualmente esclusivi, non essendo mai stati trovati insieme; la clorofilla ed i carotenoidi, che sono invece chimicamente correlati e localizzati all’interno dei plastidi e si trovano nel citoplasma delle cellule (Griesbach, 2005).
I flavonoidi generalmente interessano le colorazioni dei fiori rosa, rosso, arancio, scarlatto, porpora, blu, blu scuro e, in qualche caso, anche giallo. Inoltre essi danno intensità alla maggior parte dei colori bianco o crema (Davies e Schwinn, 1997).
I carotenoidi, determinano le colorazioni gialle, arancio e rosse e contribuiscono ad ampliare la gamma dei colori dei flavonoidi producendo, in combinazione con questi, i colori giallo, arancio, scarlatto e marrone scuro (Davies e Schwinn, 1997).
Le betalanine determinano i colori giallo, arancio, rosso e porpora nei tessuti fiorali solo di poche specie di piante, essendo limitate ad alcune famiglie appartenenti principalmente dell’ordine delle
Caryophyllales (Davies e Schwinn, 1997).
La produzione di ogni pigmento avviene indipendentemente dagli altri: infatti, in molti casi un difetto nel pathway biosintetico dei flavonoidi non ha effetti su quello dei carotenoidi e della clorofilla (Griesbach, 2005). Per i fiori bianchi si ritiene generalmente che siano privi almeno di una parte di questi pigmenti, ma la loro assenza nei petali potrebbe essere dovuta a fattori diversi come il malfunzionamento dei geni coinvolti nella trascrizione del colore, la loro mancata espressione o un errore nel meccanismo di traslocazione (Zaiton et al. , 2003)
Fig 2 - Fiori di Lilium
Fig 3 - Basi chimiche del colore dei fiori nelle angiosperme (da “I composti fenolici di interesse biologico, http://members.xoom.virgilio.it/alberto_chim/Fenoli.pdf )
2.1.1 - I flavonoidi
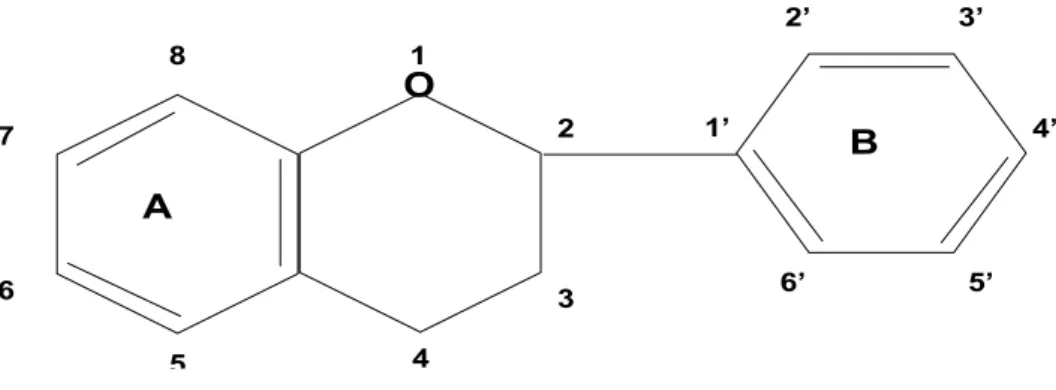
I flavonoidi sono dei composti fenil-propanoidi generalmente solubili in acqua e conservati nel vacuolo. Tutti i flavonoidi, generalmente, posseggono uno scheletro base C6-C3-C6 e gli atomi di carbonio all’interno dello scheletro vengono originati da due distinti pathways (l’unità C6 deriva dall’acido cinnamico, mentre l’unità C6-C3 deriva dalla condensazione testa-coda di 3 unità di acetato (Salisbury e Ross, 1992).
L’enzima chiave nella biosintesi dei flavonoidi, la calcone sintasi (CHS), catalizza la condensazione in più stadi di tre unità di acetato, derivanti da malonil-CoA, con un opportuno derivato dell’acido cinnamico, normalmente il p-cumaril-CoA, con conseguente formazione di un calcone (4,2’,6’-tetraidrossicalcone) dal quale si originano tutte le strutture dei flavonoidi. I precursori dei flavonoidi, quindi derivano entrambi da carboidrati: Il malonil-CoA, che si forma a partire da
acetil-Bianco, avorio, crema
Giallo Arancione Magenta Marrone Scarlatto Rosa Malva, violetto Blu Porpora intenso Verde
Flavoni e/o flavonoli
Carotenoidi Flavonoidi gialli Carotenoidi
Pelargonidina
Cianidina su fondo di carotenoidi Cianidina
Peonidina Delfinidina
Cianidina e copigmenti
Delfinidina ad elevate concentrazioni Clorofille
CoA e CO2 con una reazione catalizzata da acetil- CoA carbossilasi, e il p-cumaril-CoA, che viene
fornito dal metabolismo del fenilpropanoidico (Salisbury e Ross, 1992).
La biosintesi dei flavonoidi, come parte del più vasto processo biosintetico dei fenil-propanoidi, è uno degli aspetti maggiormente studiato e caratterizzato. Anni di ricerche di genetica e di biochimica sui passaggi enzimatici di questo processo sono stati recentemente integrati dalle ricerche dei biologi molecolari (Davies e Schwinn, 1997). I geni che codificano la maggior parte degli enzimi coinvolti nella biosintesi delle antocianine sono stati individuati e clonati, ed anche la conoscenza dei fattori che regolano questo processo è molto avanzata (van Tunen e Mol, 1991; Heller e Forkmann, 1993).
Tra i flavonoidi più comuni, solo i calconi e le antocianine hanno colori significativi, e queste ultime sono di gran lunga i pigmenti più diffusi ed importanti (Davies e Schwinn, 1997). Nei tessuti dei petali le antocianine sono situate specificamente nei vacuoli delle cellule epidermiche, mentre nelle brattee, come in Poinsettia ed in Hydrangea, queste sono localizzate nei vacuoli delle cellule interne (Asen, 1976). La struttura chimica delle antocianine consiste nel tipico scheletro C15 dei
flavonoidi in cui i tre anelli (uno cromonico, uno aromatico ed uno eterociclo) sono glicosilati con uno o più zuccheri ( glucosio, galattosio e ramnosio) ed acilati con uno o più acidi cinnamici (acido cumarico, ferrulico, malonico o caffeico) attaccati in posizioni specifiche (Salisbury e Ross, 1992). Le antocianine private dello zucchero e dei radicali acilici sono chiamate antocianidine (Griesbach, 2005). Le principali antocianidine sono sei, tre delle quali sono comunemente rintracciabili: la pelargonidina, che produce i colori arancio, rosa e rosso; la cianidina, che produce i colori rosso o malva; la delfinidina, che produce i colori porpora, blu o blu scuro (Davies e Schwinn, 1997). Le altre antocianidine ( peonidina, petunidina e malvidina) sono invece riscontrabili solo su alcune piante (Griesbach,2005).
Quando sono poste in vitro, in condizioni simili a quelle comunemente riscontrate nei vacuoli delle cellule fiorali, le antocianine da sole non esistono in una forma colorata stabile (Asen, 1976). Un sufficiente livello di stabilità viene raggiunto attraverso la copigmentazione, cioè la formazione di complessi molecolari con sostanze denominate copigmenti (Brouillard e Dangles, 1993).
I copigmenti ricadono rapidamente in una delle seguenti due classi: i flavonoli (i principali dei quali sono il kempeferolo, la miricetina e la quercitina) ed i flavoni (apigenina, tricetina e luteolina) (Griesbach, 2005). Questi composti sono direttamente responsabili del colore dei fiori solo in pochissimi casi, mentre attraverso la copigmentazione, i flavoni e i flavonoli possono più facilmente esercitare la loro influenza sulla percezione del colore (Brouillard e Dangles, 1993). Il colore dei petali dipende anche dalla quantità delle antocianine presenti: per esempio, in Viola ed in Tulipa, un
livello molto elevato di antocianine produce un colore dei fiori molto vicino al nero (Davies e Schwinn, 1997).
Fig 4. Struttura base dei flavonoidi (da Salisbury e Ross, 1992)
A O B 1 4 5 6 7 8 1’ 2’ 3’ 4’ 5’ 6’ 2 3 2.1.2 - I carotenoidi
I carotenoidi sono un gruppo ubiquitario di pigmenti delle piante che differiscono notevolmente dai flavonoidi nella struttura e nella compartimentazione. Sono pigmenti idrofobici, liposolubili, con una struttura basata normalmente su una catena a quaranta atomi di carbonio derivante dal generale processo biosintetico degli isoprenoidi. Se la loro magior funzione è proteggere i tessuti fotosintetici dalla foto-ossidazione, tuttavia i carotenoidi possono anche determinare pigmentazioni colorate in organi come i frutti e i fiori (Davies e Schwinn, 1977). In questi ultimi, i carotenoidi sono sintetizzati e conservati nei cromoplasti, plastidi specializzati differenziatisi da cloroplasti o plastidi non fotosintetici.
Due comuni gruppi di carotenoidi associati al colore dei fiori sono i caroteni e i loro derivati ossigenati, le xantofille, associati rispettivamente ai colori arancione e giallo. Oltre seicento carotenoidi naturali sono stati isolati e identificati ed alcune specie ornamentali sono molto ricche di carotenoidi, sia in quantità che in diversità: per esempio, in narciso (Narcissus spp.) il livello di beta-carotene può raggiungere il 16,5% del peso secco nella corona fiorale, mentre in circa quaranta specie e varietà di Rosa gialla ben 75 differenti carotenoidi sono stati identificati (Davies e Schwinn, 1997)
Fig 5. Struttura base dei carotenoidi (www.food-info.net/images/didehydroastaxanthin.jpg)
2.1.3 - Le betalanine
Le betalanine sono pigmenti vacuolari azotati, contengono come cromoforo l’acido betalamico, composto importante nella formazione di tutte le betalanine, con un derivato della diidrossifenilalanina (DOPA). Questa reazione porta alla formazione delle betacianine rosse e violette, che si possono trovare nelle barbabietole rosse o nel fiore di Portulaca. La condensazione dell’acido betalamico con un aminoacido o aminoacido derivato ( es. 3- metoxytiramina) porta alla formazione delle betaxantine gialle e arancioni. Betacianine e betaxantine possono essere classificate in diverse sottoclassi, basate sulle caratteristiche chimiche dell’acido betalamico coniugato. L’utilizzo di luce, fitochimici e ormoni ha un drammatico effetto nell’accumulo di betalanine.(Grotewold, 2006) La conversione di tirosina a DOPA è portata da una tirosinasi tipo fenoloxidasi, un gruppo di enzimi bifunzionali che permettono l’idrossilazione dei fenoli a o-difenoli. In aggiunta, partecipando alla formazione dell’acido betalamico, l’enzima tirosinasi ossida anche DOPA a dopaquinone, contribuendo alla biosintesi del cyclo-DOPA, che coniugato all’acido betalamico forma il cromoforo di tutte le betacianine e betanidine. Lo studio del percorso biosintetico delle betalanine è un obiettivo attraente per i biotecnologi per diversi motivi: il processo produce colori attraenti, il numero di step enzimatici è basso ed il precursore necessario, la tiroxina, è presente in tutte le piante ( Davies e Schwinn, 1997).
2.2 - Fattori che influenzano la pigmentazione
2.2.1 - Il pH
Molti fattori sono importanti nel determinare il colore finale nel tessuto e, tra questi, ricordiamo il livello di ossigenazione ed il pH del vacuolo.
Si assume generalmente che i fiori rossi contengano, tra le antocianidine, prevalentemente cianidina e che i fiori blu contengano delfinidina. Tuttavia ci sono molte eccezioni: ad esempio Griesbach riporta nella sua review (2005) che il colore rosso della Petunia exserta Stehman dipende dalla presenza della delfinidina mentre quello della cultivar a fiori rossi di Petunia x hybrida Vilm. dalla cianidina, e che fiori che contengono cianidina possono essere sia rossi, come negli ibridi di Rosa L., sia blu, come in Meconopsis grandis Prain Tutte le antocianidine poi, eccetto la pelargonidina, hanno la capacità di produrre fiori blu (Asen, 1976). Tutta questa variabilità nell’effetto cromatico delle antocianidine è dovuta al pH riscontrabile nel vacuolo, che esercita un notevole effetto sulla struttura secondaria delle antocianine e, pertanto, sul colore del fiore che ne risulta. Differenze nel pH del vacuolo possono pertanto determinare il fatto che fiori contenenti le stesse antocianine abbiano diversi colori (Stewart et al., 1975; Yoshida, 1995). Un abbassamento del pH infatti causa uno spostamento verso la forma cationica rossa delle antocianine mentre un incremento del pH determina uno spostamento verso le forme blu chinonoidali (Brouillard e Dangles, 1993).
Il pH di estratti vacuolari dalle cellule dei petali è di solito leggermente acido, tuttavia un range di pH da 2,5 a 7,5 è stato riscontrato da Stewart et al. (1975) in una ricerca sui tessuti dei petali di 20 specie. Inoltre il pH può variare anche tra cultivar all’interno di una specie, e perfino in diversi stadi di sviluppo di un singolo fiore; ad esempio, Asen et al. (1977) hanno trovato che il pH degli estratti della corolla di Ipomea tricolor cv Heavenly blue varia da 6,5 a 7,5 durante l’apertura del fiore, causando una variazione di colore dal rosso delle gemme al blu chiaro dei fiori aperti. Yoshida (1995 ) è riuscito a confermare e sviluppare queste osservazioni utilizzando un microelettrodo capace di misurare il pH di cellule di petali vive.
Il ph può influenzare notevolmente anche il colore di forme complesse stabili di antocianidine dotate di un sistema orto-diidrossilico (cianidine, delfinidine e petunidine) con alcuni metalli (molibdeno, ferro, stagno, alluminio, titanio, cromo, uranio e piombo) (Griesbach, 2005).
Dal punto di vista pratico, il colore dei petali durante la senescenza, nel caso in cui questo sia dovuto prevalentemente alle antocianine, potrebbe essere modificato variando il pH dei vacuoli. Ad esempio, il trattamento di fiori recisi con zuccheri ritarda la proteolisi e, quindi, l’incremento del
pH: come conseguenza, si può evitare la comparsa della colorazione blu nei petali durante la senescenza (Halevy e Mayak, 1979).
2.2.2 - La temperatura
Come già detto, le antocianine sono i pigmenti che determinano prevalentemente i colori dal rosso al viola e al blu (van Tunen e Mol, 1991). La temperatura è uno dei principali fattori esterni che influenzano l’accumulo di antocianine nei tessuti delle piante: le basse temperature in genere aumentano la loro concentrazione mentre le elevate temperature la diminuiscono.
Diversi lavori hanno considerato gli effetti della temperatura sulla sintesi degli antociani e sullo sviluppo del colore nei frutti di mele durante le fasi di conservazione postraccolta. In alcuni sistemi di piante, le basse temperature hanno determinato un incremento del livello di trascrizione di geni i cui prodotti sono o enzimi chiave del percorso generale biosintetico dei fenil-propanoidi, come la fenilalanina ammonia liasi (PAL), o geni i cui prodotti catalizzano reazioni coinvolte nella biosintesi di flavonoidi ed antocianine, come la CHS, la calcone isomerasi (CHI) e la diidro flavonol riduttasi (DFR) (Shvartz et al. 1997).
Certamente, uno dei fattori responsabili per la più bassa concentrazione delle antocianine nelle piante in presenza di temperature elevate è una ridotta biosintesi (Shvartz et al. 1997). Tuttavia, le temperature possono influenzare non solo la sintesi, ma anche la stabilità delle antocianine. Perciò, la diminuzione della concentrazione di tali pigmenti ad elevate temperature deve essere ricondotta sia ad un decremento nella sintesi, che ad un aumento nella degradazione (Shaked-Sachray et al., 2002; Oren-Shamir et al., 2003).
Dato che il successo economico delle ornamentali dipende in gran parte dalla qualità del colore e che, in genere, i colori sbiaditi diminuiscono il valore del prodotto, diverse ricerche sono state condotte per studiare il ruolo della temperatura sul colore dei fiori. A prescindere dalle ben note conoscenze sui danni diretti causati dalla conservazione a basse temperature su specie sensibili al freddo, in cui lo stress determina una negativa variazione del colore dal rosso al blu-porpora (come nelle brattee delle poinsettie conservate al di sotto dei 10°C), si riportano due interessanti lavori di Shaked-Sachray et al., (2002) e di Oren-Shamir et al. (2003) che hanno studiato l’effetto combinato di elevate temperature e dell’incremento di concentrazioni metalliche sull’accumulo delle antocianine nei fiori di Aster e Anigozanthos. In Aster, cv Sungal e Suntana, è stato osservato che un’elevata temperatura (29°C/21°C giorno/notte) causava la decolorazione (dal porpora-blu scuro al porpora chiaro) di una varietà (Sungal) ma non influenzava la pigmentazione dell’altra (Suntana) rispetto ad un regime termico di 17°C/9°C. Nella prima cultivar, la concentrazione antocianica (in
questo caso solo cianidina) nei fiori cresciuti a temperature più alte era circa la metà di quelli cresciuti a temperature più basse. Tuttavia l’incremento della temperatura causava in entrambe le cultivar una diminuizione dell’attività degli enzimi PAL e CHI che sintetizzano gli antociani. Quindi la differenza tra le due varietà deve essere ricondotta nella diversa stabilità dei loro pigmenti alle elevate temperature. Le elevate temperature hanno causato una drammatica diminuzione dei pigmenti antocianici anche nei fiori di Anigozanthos cv Mini Ranger.
Simili risultati sono stati ottenuti anche da Black et al. (1991) su azalea (Rhododendron sp. cv Gloria). In questa specie, una maggiore intensità di colore è stata registrata mantenendo le piante ad un regime termico di 18°C/16°C (giorno/notte) rispetto ad un regime termico di 29°C/27°C.
2.2.3 - La luce
La biosintesi delle antocianine richiede luce. L’incremento dell’intensità di colore delle mele rosse o di quelle bicolori mediante l’uso di luce artificiale nelle fasi postraccolta ha costituito da molto tempo un modello utilizzato da diversi ricercatori per approfondire le conoscenze su questo fenomeno (Saks et al., 1990).
I fiori che si aprono sotto basse intensità luminose spesso hanno colori sbiaditi: ciò è stato verificato da diversi autori su rosa (Biran e Halevy, 1974), petunia (Weiss e Halevy, 1991), lisianthus (Halevy e Kofranek, 1984), garofano (Koyama e Uda, 1994) e bocca di leone (Sang et al., 1992). La bassa intensità di luce causa una scarsa pigmentazione attraverso due meccanismi: 1) una reazione mediata dai fotorecettori localizzati nei petali, come i fotorecettori UV, i criptocromi ed i fitocromi; 2) una reazione mediata dalla produzione di zuccheri da parte delle foglie o degli steli.
Kawabata et al. (2002) hanno dimostrato che in Lilium (cv Acapulco) e violaciocca (cv Pigmy Rose) la produzione di antocianine è una reazione mediata da risposte fotomorfogeniche localizzate nel fiore: infatti, ombreggiando i fiori con diverse pellicole, hanno riscontrato una riduzione della biosintesi delle antocianine. In Lilium tuttavia, quando la pianta intera veniva ombreggiata, la concentrazione delle antocianine diveniva più bassa rispetto alle piante con i soli fiori ombreggiati: ciò a causa del fatto che il trattamento riduceva la concentrazione degli zuccheri totali dal 3.0% all’1.6% causando di conseguenza una scarsa biosintesi di antocianine. Al contrario, in violaciocca l’ombreggiamento delle piante intere non riduceva la concentrazione delle antocianine rispetto alle piante con i soli fiori ombreggiati, probabilmente perché la riduzione riscontrata nella concentrazione totale di zuccheri dal 4.7% al 3.7% non era sufficiente per determinare lo stress da carenza di zuccheri.
Sang et al. (1992) hanno osservato che le cultivar Do Bong e Chun Bong di fiori recisi di
Antirrhinum majus, se trattate con diversi livelli di saccarosio e tenuti o all’oscurità, o con bassi
livelli di luce (500-1000 lx), o con alti livelli di luce (5000-10000 lx), mostravano un innalzamento del contenuto di antocianine all’aumentare dell’intensità di luce. Inoltre, studiando gli effetti di luce artificiale a diversa lunghezza d’onda fornita da lampade a luce blu, rossa, bianca calda, bianca fredda, fluorescente e incandescente, sulla colorazione di Antirrhinum sp., gli stessi autori hanno trovato che il contenuto delle antocianine è risultato più elevato con l’utilizzo di luce fluorescente e luce blu ed inferiore utilizzando lampade rosse ed incandescenti. L’efficienza migliore per una buona colorazione dei fiori è risultata quella fornita da lampade fluorescenti con lunghezza d’onda pari a 470 e/o 600 nm.
L’effetto positivo di elevati livelli di luce sul colore dei fiori è stato dimostrato anche da Black et al. (1991) su azalea (cv Gloria), in cui una irradiazione di 1110 µmol m-2 s-2 ha determinato una maggiore intensità di colore rispetto ad irradiazioni più basse.
2.2.4 - Gli zuccheri
2.2.4.1 – Saccarosio
Gli zuccheri svolgono un importante ruolo nel mantenimento della qualità dei fiori recisi in quanto la quantità di zuccheri contenuta negli steli recisi è limitata. Il saccarosio rappresenta la più importante forma di carbonio assimilata fotosinteticamente che viene trasportata nelle piante e costituisce la principale fonte di carbonio per la crescita dei petali (Woodson e Wang, 1987).
E’ noto che continui trattamenti postraccolta con saccarosio nell’acqua di conservazione migliorano l’apertura dei fiori e prolungano la durata in vaso di molte specie, ma in alcuni casi questi trattamenti determinano anche un aumento della concentrazione di antocianine nei petali e, quindi, la comparsa di colorazioni a tinte più forti, come ad esempio in garofano (Koyama e Uda, 1994), in rosa (Parups e Molnar, 1972), in pisello odoroso (Lathyrus odoratus L.) (Ichimura e Hiraya, 1998) ed in lisianthus (Ichimura e Korenaga, 1998).
Le antocianine sono sintetizzate attraverso diversi passaggi enzimatici quali la CHS, la CHI e la DFR. Relativamente a questi enzimi, Tsukaya (1991) ha riportato che, in petunia, l’espressione del gene della CHS è indotta dal saccarosio, mentre Kusuhara et al. (1996) hanno riportato che, in lisianthus, il saccarosio induce un incremento dell’espressione dei geni per la CHI, DFR e CHS. Pertanto, lo stimolo dell’espressione delle antocianine nei fiori recisi da parte del saccarosio appare determinata dall’induzione dell’espressione di geni coinvolti nella loro biosintesi.
Si ritiene che gli zuccheri non agiscano solo come segnale specifico per l’attivazione dell’espressione genica della biosintesi delle antocianine, quanto piuttosto come fonte del metabolismo dei carboidrati, specificatamente la fosforilazione degli esosi, dalla quale l’induzione della sintesi antocianica è dipendente (Vitrac et al., 2000). Inoltre è stato dimostrato che la trasduzione del segnale correlato alla fosforilazione degli zuccheri deve interagire con il segnale delle gibberelline per indurre l’espressione genica e l’accumulo delle antocianine nelle corolle (Neta
et al., 2000).
Ichimura e Hiraya (1998) hanno riscontrato un aumento della concentrazione delle antocianine nei fiori di Lathyrus odoratus L. in seguito a trattamenti con solo saccarosio (100 g/l) o con tiosolfato d’argento (STS) (0.2 mM) e saccarosio (100 g/l). In 4 cultivar di lisianthus, invece, Ichimura e Korenaga (1998) hanno riscontrato un incremento delle antocianine nei petali in seguito a continui trattamenti con 20 g/l di saccarosio in combinazione con 200 mg/l di idrossichinolina-solfato.
Un miglioramento dell’intensità di colore è stato riscontrato anche nei tepali di Lilium asiatico in seguito a trattamenti per circa 6 ore con saccarosio (10%) e STS (1 mM) (Sindhu e Pathania, 2003). Sempre in Lilium, però nel tipo orientale (cv Stargazer), l’addizione del 2% di zuccheri nella soluzione in vaso non ha influenzato né la longevità né le dimensioni dei fiori, ma ha determinato un significativo aumento del contenuto antocianico e, pertanto, una più elevata intensità del colore dei tepali (Han, 2003). La defogliazione dei Lilium orientali, pratica comunemente effettuata prima della commercializzazione, non ha influenzato l’apertura, la longevità e la dimensione dei fiori aperti, ma ha determinato una colorazione più chiara dei petali quando gli steli venivano messi in soluzione senza zucchero. L’addizione di zucchero nella soluzione in vaso ha controbilanciato gli effetti negativi della defogliazione sul colore dei petali.
Un basso contenuto in zuccheri, associato con una scarsa colorazione dei fiori, è stato riscontrato da Kofranek (1985), mentre Boo et al. (1997) hanno dimostrato come condizioni ambientali in grado di determinare un incremento dell’accumulo degli zuccheri (basse temperature ed elevate intensità di luce) determinassero indirettamente anche un incremento della sintesi delle antocianine ed una maggior colorazione dei petali.
Gli effetti positivi del saccarosio sulla colorazione dei fiori è stata dimostrata anche da Sang et al. (1992) su Anthirrinum, specie in cui il contenuto di antocianine risultava più alto sotto diversi regimi luminosi (oscurità, luminosità bassa o elevata) in seguito all’aggiunta di saccarosio nella soluzione conservante nelle percentuali del 10-20% (all’oscurità), 4% (bassa intensità luminosa) e 2% (elevata intensità luminosa).
Il ruolo della luce e del saccarosio sulla biosintesi di antocianine e sulla colorazione dei fiori di Lilium e violaciocca sono state ampliamente studiate anche da Kawabata et al. (2002), come già esposto nel precedente paragrafo dedicato alla luce.
2.2.4.2 - Glucosio e fruttosio
Il glucosio è un monosaccaride a sei atomi di carbonio noto anche come destrosio, è uno zucchero aldeidico estremamente importante in natura, appartenente alla famiglia degli aldoesosi E’ accertato che il glucosio è presente in tutti gli organismi viventi del mondo in forma libera o combinata. Il fruttosio è un chetoesoso detto anche levulosio perché levogiro. E’ uno zucchero naturale che si trova in molti frutti e nel miele, nonché nel saccarosio nel quale è legato con legame glucosidico al glucosio.
Oltre ad avere l’importante funzione di fonte di carbonio e di energia negli ultimi anni sono apparsi numerosi studi sul ruolo degli esosi come molecole segnale. Gli esperimenti effettuati su lievito e su organismi unicellulari hanno messo in luce l’enorme quantità di sensori dello zucchero, che modulano nella pianta la crescita, lo sviluppo e lo stress.(Filip Rolland, et al.,2006) sia l’interazione che esiste fra gli zuccheri e gli ormoni delle piante.
L’azione degli zuccheri come molecole segnale si esprime attraverso l’attivazione e inattivazione dell’espressione di geni. L’intero profilo di trascrizione del genoma rivela che le vie biosintetiche dei flavonoidi e delle antocianine sono fortemente sovraregolate dalla concentrazione degli zuccheri. In colture in vitro di Arabidopsis ( Arabidopsis thaliana) è stato osservato che aumentando la concentrazione degli zuccheri le foglioline diventavano di colore rosso. Tutto questo indica la forte correlazione che esiste fra le vie biosintetiche degli antociani e la concentrazione degli zuccheri. (Solfanelli et al.,2006)
Inoltre è stato visto che in colture in vitro di Lisianthus contenenti chitosano, diverse concentrazioni di zuccheri (fruttosio, glucosio), inducevano l’accumulo delle antocianine nei petali.(Uddin et al., 2004)
2.2.5 - Elementi nutritivi
Per migliorare la colorazione di frutta o fiori, buoni risultati si possono ottenere regolando la somministrazione di N, P e K con le fertilizzazioni. Già nel 1986 Borkowski e Szwonek eseguirono delle prove sperimentali su piante di pomodoro, cv Remiz, cresciute su substrato di torba di sfagno a differenti livelli di potassio (da 200 a 1000 mg l-1). Il colore rosso dei pomodori era risultato meno intenso con l’utilizzo di bassi livelli di potassio, mentre i frutti cresciuti con una concentrazione di 1000 mg l-1 mostravano una colorazione rossa più intensa.
Su piante da fiore, in letteratura si riportano una serie di prove condotte su gladiolo che hanno evidenziato l’effetto positivo di concimazioni a base di azoto e potassio sul colore delle spighe fiorali di diverse cultivar (Accati et al., 1994; Devecchi e Barni, 1997).
Nowak e Stroka (2001) riscontrarono un notevole effetto della nutrizione fosfatica sulla crescita e sulla qualità della Impatiens hawkeri cv Pago Pago. Le foglie e i fiori di piante soggette a carenza di fosforo avevano mostrato un colore più scuro, aumentando il loro valore ornamentale. Anche in
Pelargonium lo stress da carenza di fosforo aveva determinato un colore più scuro degli anelli
porpora presenti sulle foglie di questa specie (Baas et al., 1995). Una colorazione più rossiccia o porpora delle foglie di piante sottoposte a carenza di fosforo è stata dimostrata da Shuman (1992) come dovuta ad un aumento della produzione di antociani.
Beel e Piens (1990) riscontrarono invece un benefico effetto sulla qualità e sull’intensità del colore dei fiori utilizzando concimi a rilascio controllato (Osmocote o Nutricote) rispetto alla concimazione tradizionale con fertilizzanti solubili in acqua.
Quando le modeste escursioni termiche giornaliere o le temperature troppo elevate determinano una scarsa colorazione rossa dei frutti, è una pratica comune somministrare solfato potassico per via fogliare su melo, melanzana, melone o pomodoro al fine di ottenere una miglior colorazione rossa dei frutti stessi (dati non pubblicati). Sulla base di queste esperienze tecniche, Burchi et al. (2005) hanno condotto alcune prove al fine di valutare l’efficacia di diversi trattamenti fogliari con solfato potassico (K2O, 2 g/l) per migliorare la colorazione dei fiori di Lilium asiatico, riducendo le perdite
di brillantezza e di intensità di colore a carico dei tepali che si evidenziano nelle coltivazioni invernali a causa della ridotta radiazione solare. Sia le prime prove effettuate sulle cv Prato ed Elite,
sia ulteriori prove effettuate sulle cv Allegretto, Fangio e Samur (Burchi et al., in corso di stampa) hanno mostrato l’efficacia dei trattamenti effettuati
Come già detto, l’associazione di antocianine con altri flavonoidi e composti simili (copigmentazione) offre una logica spiegazione delle numerose variazioni nelle colorazioni blu e rosa in diversi range di pH. Anche alcuni metalli possono chelarsi con le antocianine che contengono un gruppo orto-diidrossilico per formare complessi metallici intensamente colorati e stabili in un range di pH in cui le antocianine da sole sarebbero prive di colore (Asen, 1976). Delle sei più comuni antocianidine, solo la cianidina, la delfinidina e la petunidina, con i loro glicosidi, formano chelati metallici. Nessun chelato sufficientemente colorato può essere formato con ioni metallici bivalenti. Nel range di pH da 4 a 6, la cianidina 3,5-diglucoside forma complessi stabili di colore blu intenso con ferro e alluminio, mentre non ne forma con cobalto, nichel, calcio, magnesio e bario (Asen, 1976). Chelati di colore blu intenso, stabili a pH tra 4 e 7, si formano anche con stagno, titanio, cromo, uranio e piombo. Tuttavia, questi metalli sono presenti in piccole tracce nei fiori e non in tutte le piante, per cui è poco probabile che i metalli, eccetto il ferro e l’alluminio, possano essere coinvolti nella determinazione e nel miglioramento del colore dei fiori, tanto più in quelli che contengono antocianidine che non formano chelati metallici (pelargonidina, peonidina e malvidina) (Asen, 1976).
Diversi studi hanno esaminato l’effetto di metalli diversi sulla stabilità delle antocianine e sul colore in soluzione. Mazza e Miniati (1993) hanno riportato che ioni di stagno, rame ed alluminio sono capaci di formare complessi stabili con le antocianine. Nei fiori, il principale effetto dei metalli su tali pigmenti è un cambiamento del loro colore (Kondo et al., 1992).
Shaked-Sachray et al. (2002) e Oren-Shamir et al. (2003) hanno studiato l’effetto del magnesio sulla stabilità delle antocianine sottoposte ad elevate temperature in diverse specie. Il trattamento con magnesio sulle piante incrementava la concentrazione degli antociani negli organi nei quali essi si accumulavano, diminuendo la percentuale della degradazione antocianica. Questo vale sia per i fiori di Aster sp. e Anigozanthos sp. che per le giovani foglie fotosintetizzanti delle piante di cocoplum (Chrysobalanus icaco). Poiché il trattamento con Mg non influenzava le attività degli enzimi PAL e CHI, l’incremento dei livelli delle antocianine probabilmente non era dovuto alla aumentata sintesi. Pertanto è possibile che il trattamento con Mg porti alla formazione di un complesso antocianina-metallo stabile, inibendo quindi la sua degradazione ad alte temperature. Un prodotto comunemente utilizzato nel postraccolta di diverse specie da fiore reciso è il tiosolfato d’argento (STS). Lee e Suh (1996), nel Lilium ibrido orientale cv Stargazer, hanno riscontrato un colore rosso più intenso dei fiori recisi sia con un pretrattamento con STS 4mM, sia con un trattamento in una soluzione conservante contenente AgNO3 0.2mM + saccarosio 3%.
Analogamente, Sindhu e Pathania (2003), su Lilium ibrido asiatico cv Alaska e Vivaldi, hanno riscontrato un miglioramento della qualità dei fiori, incluso un incremento dell’intensità del colore, dopo un trattamento con STS 1mM + saccarosio 10% per 6 ore.
2.2.6 - Stimolatori della formazione di antociani
2.2.6.1 - Bion
L’Acibenzolar-s-methyl (formulato commerciale Bion, Syngenta), di formula bruta C8H6N2OS2, è
un attivatore delle difese delle piante dagli stress biotici, indicato per la difesa delle batteriosi del nocciolo, del pomodoro e del fuoco batterico del pero. Come è noto, le piante si difendono dalle infezioni parassitarie anche grazie a un meccanismo noto come SAR (systemic activated resistance) o resistenza sistemica acquisita. In seguito ad una infezione della pianta, infatti, viene attivato un processo interno mediato dalla formazione di acido salicilico, con il quale si ottiene la sintesi di proteine attive sugli organi di penetrazione del patogeno o sull’agente patogeno medesimo (Muccinelli, 2004).
L’Acibenzolar-s-methyl non manifesta un’azione diretta sul patogeno, ma attiva i meccanismi naturali di difesa della piante aumentandone la resistenza nei confronti di diverse malattie. In pratica, nelle piante sensibili induce la SAR sostituendosi all’acido salicilico e producendo nelle medesime le stesse modificazioni biochimiche osservate con l’attivazione biologica naturale, ma con modalità nettamente più efficienti che garantiscono una protezione superiore e più affidabile. E’ dotato di proprietà sistemiche e viene assorbito velocemente dalle piante con traslocazione in senso acropeto e basipeto all’interno delle stesse (Iriti et al., 2004). Per il suo particolare meccanismo d’azione il prodotto deve essere distribuito 2-3 giorni prima dell’instaurarsi dell’infezione. E’ stato anche visto che in trattamenti con il Bion su uva (cv Merlot), oltre ad aumentare la resistenza della pianta, si aveva un considerevole aumento della sintesi delle antocianine, in particolare della malvidine-3-glucoside, malvidine 3-(6-O-acetyl) glucoside e malvidine 3-(6-O-p-coumaroyl) glucoside, che sono aumentate più del doppio. Questi dati sono stati ottenuti grazie all’utilizzo di un fluorimetro (RF-10Axl fluorimetric detector) con eccitazione a 330 nm ed emissione a 374 nm e con SPD-Avp UV detector che assorbe a 520 nm (Iriti et al., 2004).
Figg.8-9. Struttura base del Bion (fig 8) e della kinetina (fig 9)
fig.8 fig. 9
2.2.6.2 – La kinetina
La kinetina (N6 – furfuriladenina) è una citochinina che è stata isolata nel 1955 da DNA seminale. Il termine di “citochinine” è utilizzato in botanica per indicare genericamente molecole che influiscono sulla crescita dei vegetali, promuovendone la divisione cellulare e la differenziazione. La kinetina, in particolare, è da tempo utilizzata per ritardare l’invecchiamento delle piante, sebbene non ne allunghi la vita. Se la kinetina è applicata sulle foglie, queste non ingialliscono ma rimangono verdi, e ciò accade anche se le foglie sono state tagliate. E’ noto che in molte piante, con la progressione dell’invecchiamento, diminuiscono non solo i livelli delle citochinine ma anche la capacità di sintetizzarle. L’allungamento dei tempi di invecchiamento delle piante ad opera della kinetina è stato studiato e dimostrato, ma ciò che regola questo meccanismo d’azione non è stato ancora chiarito (Pinelli e Veraldi, 2004). Alcuni studi indicano che le citochinine proteggono gli acidi grassi poliinsaturi delle membrane cellulari dal danno ossidativo. Per quanto riguarda gli effetti biologici della kinetina sulle piante, la loro funzione si esplica sulla dominanza apicale, contrastandola, sulla senescenza ritardandola, e nel favorire l’allungamento della parte aerea rispetto a quella radicale influenzata, invece, dalle auxine nel caso di coltura in vitro (Accati E., 1986) .
Capitolo 3 – La genetica del colore dei fiori
3.1 - La forma delle cellule epidermiche
La percezione del colore dei fiori può dipendere anche dalla natura fisica delle cellule epidermiche. Per esempio, in molte specie le cellule epidermiche dei petali hanno forma conica. Si ritiene che ciò aumenti l’effetto dei pigmenti cellulari aumentando la proporzione di luce che entra nelle cellule rispetto alla quantità di luce riflessa. Un esempio di ciò è stato riscontrato in Anthirrhinum, in cui
cellule epidermiche coniche normali e cellule epidermiche piatte a causa di una mutazione genetica (mixta, dovuta all’inserzione del trasposone Tam4) si differenziano per un apparente effetto di ridotta intensità di pigmentazione nelle cellule piatte (Noda et al., 1994).
3.2 – Miglioramento genetico mediante biotecnologie
Programmi di miglioramento genetico mediante incrocio e selezione vengono da lungo tempo portati avanti con lo scopo di produrre nuove varietà con originali combinazioni di colori. Tuttavia, l’applicazione di questa tecnica tradizionale impone dei forti limiti, come ad esempio la casualità, e quindi l’imprevedibilità, dell’ottenimento di nuovi colori, la limitatezza dei colori conseguibili (dipendente dalle combinazioni di colori dei fiori presenti nelle linee parentali), i periodi di attesa dei risultati, più o meno lunghi in relazione alla durata del ciclo sessuale delle colture oggetto della ricerca. L’approccio biotecnologico, per la manipolazione diretta del colore dei fiori a livello molecolare, appare quindi molto attraente e promettente.
La conoscenza dettagliata delle vie biosintetiche dei flavonoidi è stata la condizione primaria per mettere a punto tecniche molecolari atte ad ampliare il range di colori dei fiori, modificando il pattern antocianico. Conoscendo gli enzimi coinvolti, il percorso biosintetico dei flavonoidi può essere seguito in ogni suo passaggio, partendo dal precursore, p-cumaril CoA, fino alla produzione di antociani. Tutti gli enzimi implicati nel processo, eccetto la antocianidina sintasi (ANS), sono stati determinati e caratterizzati ed i relativi geni sono stati isolati (Martens et al., 2003). Il colore dei fiori è stato quindi modificato con successo in piante transgeniche dei generi Petunia, Gerbera,
Eustoma, Nicotianana, Rosa, Dendrathema, Dianthus (Davies e Schwinn, 1997).
Il primo fiore transgenico è stato ottenuto da Meyer et al. (1987) con l’inserimento del gene codificante per l’enzima DFR in Petunia, che ha reso possibile la sintesi della pelargonidina e l’ottenimento di un nuovo colore del fiore.
Questo lavoro ha dato inizio ad una serie di nuovi studi ed esperimenti che, ancora oggi, impegnano molti ricercatori. L’inserimento di geni implicati nella biosintesi dei flavonoidi, mediato da
Agrobacterium tumefaciens, ha condotto in molti casi ad un’alterazione del colore dei fiori senza
determinare contemporaneamente variazioni dei caratteri preesistenti (Elomaa et al., 1993; Griesbach, 1995).
Prove di confronto fra linee colorate e linee non colorate di Zantedeschia sp. hanno evidenziato chiaramente le attività enzimatiche della CHS, della DFR e della flavanone 3-idrossilasi (FHT), indicando di conseguenza un blocco genetico, per le linee non colorate, nello step successivo che vede coinvolto l’enzima ANS, attivo nella formazione di cianidina. Una maggiore attività
dell’enzima flavonoide 3’-idrossilasi (F3’H) potrebbe guidare verso un maggiore accumulo dei precursori della cianidina (Martens et al., 2003).
Seitz et al. (2003), in un lavoro condotto su Zantedeschia aethhiopica cv. Nili e su ibridi di
Osteospermum cv. Zimba, hanno caratterizzato l’attività degli enzimi coinvolti nella via biosintetica
di antociani responsabili della colorazione arancio, rossa e blu dei fiori, dimostrando che la mancanza di uno solo di tali enzimi determina la formazione di petali con colori differenti, fino al bianco nel caso estremo in cui si tratti di un blocco del set completo di enzimi. In cv Nili, la riduzione del diidroflavonolo (diidroquercetina) catalizzata da DFR porta alla formazione di leucoantocianidine, substrato dell’enzima ANS per l’ottenimento di antocianidine. La presenza di infiorescenze bianche ha suggerito l’ipotesi che la mancanza di antocianine fosse da imputare ad un blocco nella biosintesi a livello dell’enzima ANS, che utilizza le leucoantocianidine come substrato per l’ottenimento delle antocianine. Prove di confronto fra tessuti fiorali della cv Nili bombardati con vettori contenenti il gene per la ANS e con vettori nudi, hanno evidenziato, nel primo caso, la comparsa di macchie rosse in corrispondenza del tessuto colpito (Seitz et al., 2003).
L’impiego di sequenze antisenso è risultato essere un metodo efficiente per inibire l’espressione di alcuni geni nelle piante. Nella varietà a fiori rossi Terra Regina di Gerbera (Elomaa et al., 1993) è stata introdotta una sequenza antisenso di cDNA che codifica per l’enzima CHS (gchs1) e si è ottenuto un blocco nello step iniziale della via biosintetica dei flavonoidi. L’analisi Southern ha consentito successivamente di confermare l’integrazione della sequenza antisenso nel genoma della
Gerbera. E’ stato possibile anche valutare un probabile effetto gene-dosatore, in quanto la ridotta
pigmentazione fiorale è stata osservata negli individui con un numero maggiore di copie geniche per genoma (Elomaa et al., 1993).
Anche Deroles et al. (1998), inserendo nel genoma sequenze antisenso per l’enzima CHS, hanno ottenuto piante transgeniche di lisianthus. Il vasto range di colori ottenuto è risultato dipendente dalla maggiore, minore o addirittura assente espressione dell’enzima. Sempre in lisianthus, il gene antisenso per la flavanone sintasi (FNS) ha prodotto fiori di colore magenta a partire da fiori porpora (Nielsen et al., 2002), mentre in garofano l’introduzione di sequenze antisenso per l’enzima flavanone 3-idrossilasi (FHT) ha portato all’attenuazione del colore rosso-arancio dei fiori (Zuker et
al., 2002).
In orchidea, tramite l’utilizzo di tecniche di analisi RAPD, AFLP e SSR, Zaiton et al., (2003) hanno identificato frammenti di DNA presenti solo in linee mutanti a fiori bianchi di Dendrobium cv Sonia. Il medesimo gruppo ha anche messo a punto una tecnica di trasformazione mediata dall’Agrobacterium su Dendrobium sp. e Oncidium lanceanum. Il tentativo di ottenere Oncidium
calcone sintasi (chs). Sequenze antisenso dei geni psy e chs sono state inserite nel genoma di
Oncidium e le analisi per confermare l’avvenuta integrazione di tali geni nel genoma delle piante
trasformate sono in corso (Zaiton et al., 2003).
In garofano, l’inserimento dei geni per l’enzima flavonoide 3’,5’-idrossilasi (F3’5’H), isolato da
Petunia, e per il citocromo b5 ha consentito di ottenere fiori di colori blu e viola veramente unici
(Fukui et al., 2003). Questa attività di ricerca ha portato al rilascio, da parte di Florigene Ltd, delle prime varietà geneticamente modificate relativamente all’introduzione di nuovi colori, lanciate con successo sul mercato floricolo (Dianthus cv MoondustTM, cv MoonshadowTM, cv MoonvistaTM, cv MoonliteTM) (Griesbach, 2005).
Grazie alle tecniche di ingegneria genetica, è stato possibile inserire nel genoma delle piante anche il gene per la proteina verde fluorescente (GFP), estratto dalla medusa Aequorea victoria (Mercuri
et al., 2002), la cui espressione potrebbe consentire lo sviluppo di una nuova classe di colore dei
fiori. La caratteristica della proteina GFP di generare nei petali una fluorescenza nel campo del visibile potrebbe anche fornire un nuovo metodo di monitoraggio fenotipico o fisiologico e la possibilità di discriminare piante transgeniche.
PARTE SPERIMENTALE
1 - Scopo della ricerca
Il Lilium costituisce una delle colture più importanti sia nel mercato floricolo italiano che in quello internazionale. La sua elevata popolarità è dovuta principalmente alle sue caratteristiche ornamentali quali il colore dei fiori e delle foglie, l’altezza degli steli, la forma delle infiorescenze e l’architettura della pianta, che rendono il Lilium una delle colture più apprezzate e conosciute in tutto il mondo.
Spesso accade che la qualità della pianta sia influenzata dalla stagione di coltivazione, derivando una peggiore qualità per le coltivazioni autunnali e invernali rispetto a quelle estive, riconoscibile dal precoce appassimento e abscissione dei tepali, dall’ingiallimento fogliare causato in molti casi dalle condizioni di oscurità e di basse temperature, dall’aborto o incompleta apertura dei fiori apicali, e dalla diminuzione di brillantezza e attenuazione dell’intensità del colore dei tepali, dovuta ad una minore radiazione solare. Questo fenomeno è più evidente nei fiori di Lilium con tonalità rosse, rosa e arancio ed è prevalentemente dovuto ad una ridotta sintesi di antociani.
La biosintesi di antociani è indotta come già detto da diversi fattori, quali ad esempio l’elevata escursione termica giornaliera o la stessa radiazione solare. Per riuscire ad aumentare la biosintesi di antociani nei prodotti vegetali si possono usare diverse strategie, generalmente impiegate per migliorare l’aspetto di prodotti orto-frutticoli; buoni risultati sono stati ottenuti su melanzana, melone, pomodoro e mele con la somministrazione di solfato potassico per via fogliare, quando le basse escursioni termiche determinano una scarsa colorazione dei frutti. Le concimazioni a base di azoto e potassio hanno portato un effetto positivo su diverse cultivars di piante da fiore, tra cui il gladiolo (Accati et al., 1994; DeVecchi e Barni, 1997).
Tra i vari trattamenti possibili per il miglioramento dell’apertura dei fiori e il prolungamento della durata in vaso di molte specie è noto l’utilizzo degli zuccheri (in particolare del saccarosio) nell’acqua di conservazione; in alcuni casi un ulteriore effetto positivo osservato è stato l’aumento della concentrazione delle antocianine nei petali, e quindi la comparsa di colorazioni a tinte più forti. Recentemente sono apparsi dei risultati interessanti sull’ aumento della concentrazione delle antocianine in uva (cv Merlot) trattata con un nuovo prodotto acibenzolar-s-methyl (Bion) (Iriti et al., 2004). Altri studi effettuati su kinetina invece hanno permesso di evidenziare un rallentamento dell’invecchiamento della pianta, favorendo un allungamento della parte aerea rispetto a quella radicale (Accati, 1986)
Alla luce di tutte queste conoscenze, presso il C.R.A.-Istituto Sperimentale per la Floricoltura di Pescia (CRA-ISF)e l’azienda Campetti sono state condotte prove sperimentali sul Lilium cresciuto in stagione sfavorevole (autunno/invernale) al fine di migliorare la colorazione dei fiori, valutarne la longevità degli steli e analizzare la percentuale di aborti su piante trattate e non trattate.
Una nuova metodologia è stata adottata per la misurazione dei parametri relativi al colore, che ha previsto l’impiego di spettrocolorimetro impiegato in altri processi industriali.
L’utilizzo di questa tecnica consente di ridurre i tempi di misurazione del colore con risposte immediate e molto accurate.
2 - Materiali e metodi
2.1 - Materiale vegetale
Sono state utilizzate 4 cultivars di Lilium i cui bulbi, provenienti dall’Olanda, sono stati forniti dall’azienda Campetti, di Campetti Brunello, localizzata in Pescia:
L1: cv Fangio, con fiori di colore Fucsia, diametro dei bulbi 20/22 cm L2: cv Tresor, con fiori di colore Arancio, diametro bulbi 16/18 cm L3: cv Menorca, con fiori di colore Salmone, diametro bulbi 18/20 cm L4: cv Cavalese, con fiori di colore Bianco/rosa, diametro bulbi 18/20 cm
Le prove sono state effettuate in due località: presso l’Azienda Sperimentale del CRA-ISF di Pescia (fig.10) e presso una Azienda tradizionale della zona (la stessa azienda Campetti, fig.11)
fig.10 fig.11
2.2 – Epoche e densità d’impianto, trattamenti colturali