Riassunto……….2
INTRODUZIONE………..…....5
LA TERAPIA ANTIBIOTICA NEI PAZIENTI CRITICI……….………….6
Principi generali per una corretta somministrazione dei farmaci antibiotici………7
Caratteristiche generali degli antibiotici……….8
Influenza dei diversi meccanismi fisiopatologici nell’ alterare la disponibilità degli antibiotici nel paziente critico………...10
LA TEICOPLANINA 10 Struttura e meccanismo d’azione………14
Spettro d’azione e attività in vitro………..……….……….17
Farmacoresistenza………..……….……….18
Proprietà farmacocinetiche: assorbimento, distribuzione e concentrazioni plasmatiche………..19
Metabolismo ed eliminazione………...……….22
Effetti degli stati patologici sulla farmacocinetici……….23
Efficacia terapeutica………..………..24
Batteremie……….….25
Endocarditi………...……….26
Infezioni delle ossa e delle articolazioni………..………….26
Infezioni delle basse vie respiratorie……….………29
Infezioni della pelle e dei tessuti molli………..………29
Altre infezioni………...…….30
Trattamento empirico dei pazienti neutropenici………30
Profilassi………...………..31
Tollerabilità……….34
Nefrotossicità………34
Ototossicità………35
Reazioni anafilattiche e “red man sindrome………...………35
Dose e modo di somministrazione………..……….36
Parametri PK/PD e teicoplanina………37
Modalità di dosaggio………...….38
TEICOPLANINA IN AMBIENTE CRITICO: OTTIMIZZAZIONE DEL DOSAGGIO………..……40
STUDIO CLINICO……….………....46
OBIETTIVI DELLO STUDIO………47
SOGGETTI, MATERIALI E METODI……….………….47
Disegno dello studio……….…48
Campione oggetto dello studio………..48
Il protocollo……….49
Analisi dei dati….………...…52
RISULTATI……….…..55
RIASSUNTO
La Teicoplanina è un antibiotico glicopeptidico prodotto dalla fermentazione di
Actinoplanes teichomyceticus, descritto per la prima volta nel 1978 e introdotto nella
pratica nel 1988.
L’attività battericida di teicoplanina è dovuta all’inibizione della sintesi del peptidoglicano componente principale della parete cellulare dei batteri gram-positivi. Numerosi studi hanno messo in evidenza l’eccellente attività battericida di teicoplanina nei confronti dei batteri gram-positivi e Staphylococcus aureus in particolare (incluse specie isolate resistenti a meticillina e oxacillina) e in generale la sua equivalenza di attività rispetto alla vancomicina.
Il principale determinante farmacodinamico di efficacia per gli antibiotici glicopeptidici è il mantenimento di una concentrazione plasmatica minima (Cmin) sopra
la MIC dell’agente eziologico (Cmin>MIC). L’efficacia terapeutica si raggiunge per
valori di concentrazioni maggiori di 10mg/l, Concentrazioni maggiori (20mg/l) sono necessarie per le infezioni gravi, specialmente se localizzate a livello d’organo.
OBIETTIVI DELLO STUDIO:
1) Il presente studio è teso a stabilire l’utilità di strategie di ottimizzazione del dosaggio di teicoplanina nel trattamento di gravi infezioni da batteri Gram-positivi in un reparto di rianimazione.
2) Lo studio si propone di valutare se la somministrazione di teicoplanina è efficace nella terapia delle infezioni da batteri gram positivi, se la somministrazione continua offre risultati clinici almeno equivalenti rispetto alla somministrazione intermittente e se le due sommininistrazioni differiscono relativamente all’induzione di effetti collaterali (IR).
3) Infine si valuterà per alcuni pazienti, il potere batteriostatico e battericida della concentrazione ematica di teicoplanina per il ceppo batterico isolato proprio di ciascun paziente.
SOGGETTI, MATERIALI E METODI
Trial clinico di confronto tra la modalità di somministrazione in infusione intermittente (modalità standard) e infusione endovenosa continua. Il campione è costituito da 16 pazienti ricoverati nell’Unità di Terapia Intensiva Universitaria IV dell’ospedale Santa Chiara di Pisa.
In tutti i pazienti è stata somministrata teicoplanina in 3 dosi da carico (10 mg/kg) a distanza di 12 ore l’una dall’altra, successivamente per e somministrazioni di mantenimento i pazienti sono stati trattati secondo le seguenti modalità:
- Gruppo “INTERMITTENTI”: terapia con teicoplanina secondo lo schema standard (infusione di 1 ora ogni 24 ore) e ottimizzazione del dosaggio secondo modelli adattativi bayesiani.
- Gruppo “CONTINUI”: terapia con teicoplanina secondo lo schema modificato (infusione continua di 24 ore) e ottimizzazione del dosaggio secondo modelli adattativi bayesiani .
Per l’ottimizzazione del dosaggio si è preso come target minimo di riferimento il raggiungimento di valori di concentrazione ematiche tra i 10 e i 20 mg/L.
Durante il periodo di carico sono stati eseguiti sempre due prelievi ematici per la determinazione delle concentrazioni sieriche di teicoplanina mediante le quali prevedere la dose di farmaco da somministrare secondo le due modalità nel periodo di mantenimento.
La concentrazione di teicoplanina ottenuta al termine della fase di carico e alcune caratteristiche del paziente (età, sesso, peso, altezza, creatininemia) sono state analizzate dal software MWPharm vers. 3.60 (Medi\Ware, Groeningen, Olanda). Il programma ha disegnato l’andamento previsto delle concentrazioni plasmatiche prevedendo la concentrazione minima di teicoplanina nel siero di ciascun paziente. Successivamente, inserendo nel programma la dose di mantenimento prestabilita e pari a 10mg/kg è stata valutata nuovamente la Cmin.
Nel caso in cui tale valore di concentrazione fosse risultato inferiore ai limiti stabiliti la dose è stata modificata sino a che il modello bayes non ha predetto concentrazioni di valle nel range di riferimento.
Il dosaggio della teicoplanina sierica è stato ripetuto nei giorni successivi, generalmente dopo la prima dose di mantenimento per gli intermittenti e dopo 24h per i continui, per confermare la previsione effettuata.
In alcuni pazienti in cui si è registrata evidenza colturale di infezione da batteri gram-positivi sono stati eseguiti degli ulteriori prelievi (picco e valle per gli intermittenti, valle per i continui). Questi prelievi sono stati utilizzati oltre che per dosare teicoplanina sierica anche per ricavare il potere batteriostatico e battericida del siero contro il ceppo isolato in ciascun paziente. Il potere batteriostatico/battericida è stato testato con il metodo a 96 pozzetti standardizzato da NCCLS/CLSI.
CONCLUSIONI
Il lavoro presentato ha trovato le sue basi nei numerosi studi presenti in letteratura che hanno messo in evidenza l’eccellente attività battericida di teicoplanina nei confronti di batteri gram-positivi e di Staphylococcus aureus. Tale attività è stata dimostrata anche nel nostro studio
Questo studio ha inoltre confermato che l’efficacia del trattamento con teicoplanina è determinata da alcuni importanti fattori: le caratteristiche del paziente, che possono influire sulla cinetica del farmaco (per esempio: edemi periferici, insufficienze d’organo, stati settici); i valori di MIC90 per teicoplanina del
microrganismo responsabile dell’infezione; le tipologia di somministrazione del farmaco.
Al fine di ottimizzare il trattamento è necessario considerare la possibilità di modificare il dosaggio in base a tali variabili, avvalendosi di tre strumenti principali:
1) il monitoraggio delle concentrazioni del farmaco (TDM) 2) una strategia adattativa o bayesiana del dosaggio
3) la possibilità di utilizzare metodiche alternative per la somministrazione di
teicoplanina che migliorino dal punto di vista qualitativo l’esposizione al farmaco
Il nostro protocollo teso all’ottimizzazione della terapia si è dimostrato di grande utilità infatti ci ha permesso di rivedere i dosaggi, tarandoli sulle caratteristiche di ciascun paziente, in un totale di 6 casi su sedici.
La tipologia delle modifiche adottate in termini di dose è stata però molto differente: nel gruppo “intermittenti” è stato necessario un aumento della dose per quattro pazienti su otto mentre per i continui in un paziente la dose è stata dimezzata ed in un altro ridotta di un quarto rimanendo comunque al di sopra dei target di riferimento.
Dall’analisi statistica emerge che i due gruppi in fase di mantenimento, cioè quando viene somministrata teicoplanina secondo le due diverse modalità, non differiscono significativamente per quanto riguarda l’andamento della clearance renale, dei globuli bianchi e dei valori di PaO2/fiO2. L’infusione continua sembra però offrire
A prescindere dalle considerazioni di tipo statistico l’infusione a boli e quella continua offrono due tipologie di esposizione molto differenti dal punto di vista qualitativo, l’infusione continua è inafatti sicuramente il metodo più fisiologico.
Inoltre, mantenere il livello di concentrazione costante è di particolare importanza per l’efficacia della terapia antimicrobica impostata con un antibiotico tempodipendente come teicoplanina, si garantisce infatti, una volta adattato il dosaggio per il singolo paziente, Cmin >MIC per il 100% della durata del trattamento.
Questo dato è stato confermato dal calcolo del potere batteriostatico del siero contro S.Aureus che in somministrazione continua è sempre paragonabile ai picchi dell’infusione intermittente Il potere battericida si presenta più elevato nel gruppo di studio seppur in maniera non significativa.
Inoltre se prendiamo in considerazione l’aspetto economico della somministrazione intermittente versus continua notiamo che la riduzione del dosaggio effettuata in quest’ultimo regime di terapia si accompagna ad un risparmio economico che per un paziente è stato superiore a 500 euro).
Il lavoro presentato rappresenta uno studio pilota che offre però risultati anche dal punto di vista statistico molto promettenti nonostante la piccola casistica inserita.
LA TERAPIA ANTIBIOTICA
NEI PAZIENTI CRITICI
Le infezioni nosocomiali e quelle associate a misure interventistiche rappresentano un importante gruppo di patologie nei pazienti critici e in particolar modo nella popolazione ricoverata nelle unità di terapia intensiva.
Lo studio EPIC (European Prevalence of Infection in Intensive Care) riporta infatti una prevalenza delle infezioni nosocomiali del 20,6% con un tasso di incidenza da circa 5 a 10 volte maggiore rispetto agli altri reparti1.
Oltre all’aumento della morbilità e della mortalità le infezioni nosocomiali2,3 pongono problemi terapeutici perché riconducibili a patogeni resistenti4, circa il 70% infatti sono dovute a microrganismi resistenti ad uno o più antibiotici.5
L’emergenza e l’espansione di germi resistenti in UTI è favorita dalle ampie possibilità di trasmissione crociata, dalla caduta delle difese immunitarie dell’ospite e non per l’ultimo dall’elevato utilizzo degli antibiotici.6
In particolar modo la gravità della patologia sottostante, le procedure invasive, la durata della permanenza in UTI e le terapie antibiotiche precedentemente effettuate sono considerati fattori di rischio maggiori per lo sviluppo di infezioni sostenute da germi multiresistenti.7
Tre tipi di infezione in particolare ricoprono circa il 60% di tutte le infezioni nosocomiali:
- polmoniti (in genere associate al ventilatore)
- infezioni delle vie urinarie (associate al catetere vescicale)
- batteremie (associate all’utilizzo di presidi medici intravascolari) Richards ed al. hanno osservato che nei pazienti con polmonite lo
da catetere vescicale sono per il 19% dei casi attribuibili ad E.Coli mentre nel caso delle batteremie sono stati isolati nel 39% dei casi Staphylococci Coagulasi negativi, (S.Aureus 12%, Enterococci 11%).8
Principi generali per una corretta somministrazione dei farmaci antibiotici
Date le considerazioni sopra riportate si deduce come e perché gli antibiotici siano tra i farmaci più frequentemente prescritti nel trattamento dei pazienti critici9.
Non c’è niente di peggio che l’utilizzo di antibiotici inappropriati o a dosi inappropriate: questo può portare al fallimento della terapia o al ritardo della risposta clinica in ciascun paziente; allo stesso tempo si contribuisce alla promozione della colonizzazione e dello sviluppo di patogeni resistenti10.
Guardando al recente passato notiamo che la selezione di ceppi resistenti è cronologicamente correlata alla pressione antibiotica causata da un utilizzo sconsiderato degli stessi.
Questo è accaduto negli anni ’60 con l’insorgenza di ceppi di Staphilococcus aureus meticillina-resistenti, negli anni ’80 con la crescita di batteri Gram-negativi β-lattamasi-producenti11 e negli anni ’90 con lo
sviluppo di ceppi di enterococchi vancomicina-resistenti. Negli ultimi anni è stata registrata una diminuzione nella sensibilità di Staphilococcus aureus nei confronti degli antibiotici glicopeptidici12, una resistenza di
Pseudomonas aeruginosa ai fluorochinoloni13, concludendo con il recente
isolamento di Staphilococcus aureus completamente vancomicina-resistente14,15.
Fra le cause imputate nel fallimento di una terapia antibiotica possiamo includere un inadeguato spettro di attività nei confronti del microrganismo isolato, la presenza di immunodepressione da parte dell’
ospite, una patologia di base molto severa, l’ insorgenza di reazioni avverse all’ antibiotico stesso, una inappropriata durata della terapia, la superinfezione da parte di altri patogeni.
La scelta dell’antibiotico appropriato all’ inizio sella terapia è diventata quindi moralmente obbligatoria, soprattutto in seguito alla pubblicazione di numerosi studi che dimostrano che una iniziale scelta non adeguata può essere responsabile di un alto numero di fallimenti terapeutici e di un incremento della morbilità e mortalità nei pazienti di terapia intensiva16,17,18,19.
Sicuramente l’utilizzo di un antibiotico appropriato in termini di spettro rimane il capostipite principale della cure antimicrobiche in tarapia intensiva ma negli ultimi dieci anni è stata dimostrata di pari importanza, nel conseguimento del successo clinico e dell’eradicazione microbiologica, la scelta di un corretto regime in termini di dosaggio e frequenza di somministrazioni.20,21,22,23,24 ,25
La dose e gli intervalli di tempo tra le varie somministrazioni dovrebbero essere scelti prendendo in considerazione la relazione tra farmacocinetica e farmacodinamica di ogni classe farmacologica.
Questa raccomandazione si fonda sull’integrazione tra la suscettibilità in vitro del microrganismo coinvolto e gli indicatori farmacocinetici qualitativi e quantitativi ottenuti in vivo:
- AUC: area under the plasma concentration-time curve - Cmax: picco di concentrazione plasmatica
- Cmin: minima concentrazione plasmatica26.
Sono stati identificati tre determinanti principali per ottenere la massima efficacia da una terapia antimicrobica: la durata del tempo nella quale la concentrazione del farmaco supera la MIC; il rapporto Cmax/MIC e il rapporto AUC/MIC.
Prendendo in considerazione questi tre determinanti gi antibiotici sono stati distinti in tempodipendenti ( β-lattamici, glicopeptidi) e
conentrazionedipendenti.
In particolare è stato dimostrato che per gli antibiotici tempodipendenti (come teicoplanina) t>MIC dovrebbe essere almeno il 50% per assicurare una efficacia terapeutica27,28 tuttavia t>MIC per il 100% del dosaggio
garantirebbe un risultato terapeutico ottimale nei pazienti immunocompromessi.29
Per le considerazioni soprariportate bassi livelli plasmatici del farmaco dovrebbero essere evitati per impedire la ripresa della proliferazione batterica che inizia appena le concentrazioni si portano al di sotto della MIC.
Per impedire la presenza di intervalli “drug-free” si può ricorrere al frazionamento della dose totale (da due a sei volte in un giorno) e in alcune situazioni all’applicazione di infusione continua endovenosa. Infatti a parità di dosaggio giornaliero l’infusione continua potrebbe rappresentare la modalità di somministrazione migliore per gli antibiotici tempodipendenti garantendo concentrazioni “steady-state” per intervalli di tempo maggiori.30,31,32.
Caratteristiche generali degli antibiotici
Le proprietà chimico-fisiche il peso molecolare ed il grado di legame con le proteine plasmatiche sono le caratteristiche intrinseche di maggior rilievo che condizionano la disponibilità di un antibiotico.
I farmaci antimicrobici possono essere distinti in due grandi gruppi: gli idrofilici e i lipofilici. Data l’impossibilità di diffusione passiva attraverso la membrana della cellula eucariotica, gli antibiotici idrofilici (β-lattamici, glicopeptidi, amminoglicosidi), sono caratterizzati da un punto di vista farmacodinamico dall’inattività nei confronti dei microrganismi
intracellulari e da un punto di vista farmacocinetico da un Vd (volume di distribuzione) limitato allo spazio extracellulare e da una maggiore eliminazione per via renale.
Viceversa gli idrofilici diffondendo liberamente le membrane cellulari sono caratterizzati dal punto di vista farmacodinamico dall’attività contro patogeni intracellulari mentre dal punto di vista farmacocinetico hanno elevato Vd e nel caso in cui presntino un basso peso molecolare dalla possibilità di penetrare anche attraverso alcune barriere anatomiche (come ad es. la barriera emato encefalica)33, inoltre vista la natura lipofilica vengono principalmente eliminati attraverso il metabolismo epatico.
In accordo con la natura idrofilica/lipofilica, la farmacocinetica di un antimicrobico dovrebbe essere correlata con le diverse condizioni patologiche che presentano i pazienti critici.
Influenza dei diversi meccanismi fisiopatologici nell’ alterare la disponibilità degli antibiotici nel paziente critico
Le variazioni a livello del contenuto dei fluidi extracellulari e/o a livello della funzione renale o epatica possono essere considerati i più frequenti e rilevanti meccanismi fisiopatologici responsabili delle alterazioni della disponibilità degli antibiotici nel paziente critico.
Gli antibiotici idrofili escreti per via renale devono essere considerati a più alto rischio di presentare variazioni sostanziali anche giornaliere nella concentrazione plasmatica, il che può richiedere un continuo aggiustamento della dose in base alle caratteristiche del paziente. Per esempio, per quanto riguarda il Volume di Distribuzione (Vd), è ormai noto che la presenza di
edemi, ascite, versamenti pleurici, causando diluizione nel compartimento extracellulare, può diminuire la concentrazione dell’ antibiotico a livello tissutale o ematico. In accordo con l’idrofilia o la lipofilia dell’antibiotico stesso, l’effetto netto della diluizione può essere sostanziale o ininfluente.
In effetti, poiché gli antibiotici idrofili hanno un volume di distribuzione limitato allo spazio extracellulare (< 0.3-0.4 L/kg), la loro concentrazione a livello plasmatico o a livello interstiziale può diminuire drammaticamente a causa della formazione di essudati.34,35
D’altra parte, per quanto riguarda gli antibiotici lipofili, che presentano grandi volumi di distribuzione(>1L/Kg), la diluizione del liquido interstiziale può risultare poco rilevante in conseguenza delle maggiori concentrazioni intra- ed extracellulari37. Variazioni significative
delle concentrazioni plasmatiche e nei liquidi extracellulari degli antibiotici idrofili escreti per via renale possono verificarsi per i cambiamenti nella funzionalità renale, frequenti nel paziente critico. Al contrario, la disponibilità degli antibiotici lipofili cambia significativamente in base alla funzionalità epatica, anche se la metabolizzazione di questi farmaci è alterata solo in presenza di gravi alterazioni come per es. cirrosi o epatite acuta. Inoltre variazioni giornaliere della funzionalità epatica, tali da determinare alterazioni nella farmacocinetica degli antibiotici, sono rare anche nel paziente critico36. I pazienti che hanno subito trapianto di fegato, nelle prime settimane dopo il trapianto, possono ovviamente rappresentare una eccezione a quanto detto37.
Si può concludere quindi che gli antibiotici idrofili sono a più alto rischio di variazioni farmacocinetiche giornaliere; devono quindi essere monitorati e la loro dose deve essere sempre messa in rapporto alle patologie di base per evitare sotto- o sovra-esposizioni.
Condizioni fisiopatologiche che alterano la farmacocinetica degli antibiotici nel paziente critico
I pazienti critici spesso presentano particolari condizioni fisiopatologiche o iatrogene che possono influenzare la distribuzione e l’eliminazione degli antibiotici; la conoscenza di queste condizioni può essere fondamentale per ottimizzare la terapia in questi pazienti.
I dati esposti supportano l’ipotesi in merito all’opportunità di adattare la terapia antibiotica in base alle necessità dei pazienti, soprattutto quelli critici, considerando la farmacocinetica di ogni farmaco. L’adattamento della terapia deve essere impostato mediante l’impiego di diverse figure specialistiche, compresi il microbiologo, l’infettivologo e il farmacologo clinico, a supporto dell’intensivista e di altri specialisti per impostare il miglior management possibile della terapia antibiotica nell’intero ospedale e diminuire così l’insorgenza di resistenze e i costi per l’antibioticoterapia.
Condizioni fisiopatologiche che alterano la farmacocinetica degli antibiotici nel paziente critico.
PAZIENTE CRITICO
Variazioni nel liquido
extracellulare Variazioni nella clearance renale
Aumenta in caso di: - Versamento pleurico - Ascite - Mediastinite - Edema - Presenza di drenaggi chirurgici - Ipoalbuminemia Diminuisce in caso di: - Insufficienza renale - Dialisi Aumenta in caso di: - Abuso di farmaci - Ustioni - Farmaci vasoattivi - Ipoalbuminemia - Leucemia - Presenza di circoli iperdinamici Diluizione o perdita dell’antibiotico Aumento dell’escrezione renale del farmaco
Riduzione dell’escrezione renale del farmaco
Considerare un aumento della dose da somministare Considerare un aumento della dose da somministare Considerare una diminuizione della dose da somministare
LA TEICOPLANINA
Teicoplanina, precedentemente conosciuta come teichomycina A2 è un antibiotico glicopeptidico prodotto dalla fermentazione di Actinoplanes
teichomyceticus38, descritto per la prima volta nel 1978 e introdotto nella
pratica clinica italiana dieci anni dopo39.
Simile alla vancomicina dal punto di vista della struttura chimica, del meccanismo di azione, dello spettro di attività e della via di eliminazione (principalmente renale), teicoplanina possiede caratteristiche uniche nell’ambito degli antibiotici glicopeptidici, come, ad esempio, la possibilità di scelta tra somministrazione endovenosa e intramuscolare in unico bolo giornaliero, viste le proprietà legate alla lunga emivita plasmatica della molecola.
Struttura e meccanismo d’azione
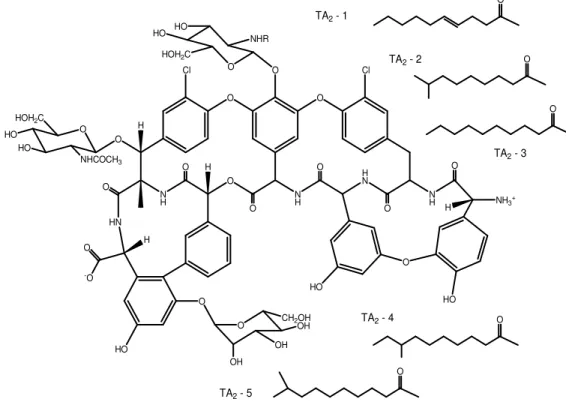
Teicoplanina è una miscela di 5 componenti strettamente legati tra loro (definiti da TA-2 a TA-5) con peso molecolare compreso tra 1875 e 1891 Da e una molecola più polare, teicoplanina TA-3, che ha peso di 1562 Da40.
Le componenti del complesso TA-2 che costituisce il 90-95% di teicoplanina differiscono solamente nella struttura acilica dell’acido grasso componente della porzione N-acil-glucosaminica della molecola.
Teicoplanina, come vancomicina, presenta uno scheletro eptapeptidico che lega residui di idrofenilglicina a formare una struttura tetraciclina. Questa porzione, che rappresenta il core aglicone della molecola, è composta da amminoacidi aromatici legati tra loro più tre sostituenti: D-mannosio, N-acetil-glucosamina e un residuo N-acil-glucosaminico legato ad un gruppo arilico41, a quest’ultimo si legano gli
acidi grassi che caratterizzano i cinque differenti gruppi del complesso teicoplanina.
La componente più polare (TA-3) può essere trasformata nel core aglicone attraverso la perdita dei due sostituenti mannosio e glucosamina.
Le componenti TA-2 hanno attività antibatterica comparabile in vitro mentre TA-3 risulta essere più attiva nei confronti di Staphylococcus e meno attiva nei confronti di Streptococcus e Enterococcus42.
O O H O Cl O O NHR HO HO HOH2C O Cl HN N H O H O O O N H H N N H O H NH3 + HO HO O O O HOH2C HO HO NHCOCH3 H O -O HO O O OH CH2OH OH OH O O O O O TA2 - 1 TA2 - 2 TA2 - 3 TA2 - 4 TA2 - 5
Fig. 1 Struttura chimica di teicoplanina. TA-1/TA-5 sono componenti del complesso, ognuna caratterizzata da un acido grasso specifico (R).
L’attività battericida della teicoplanina è dovuta all’inibizione della sintesi del peptidoglicano componente principale della parete cellulare dei batteri gram-positivi: l’antibiotico infatti lega il residuo amino-acil-D-alanil-D-alanin terminale del muramilpentapeptide43; questo legame
previene il trasferimento dei precursori della parete cellulare dai carriers lipidici di membrana ai siti di costruzione della parete cellulare.
Questo meccanismo non è efficace nei confronti dei batteri Gram-negativi perché la grande molecola polare di teicoplanina non può penetrare la loro membrana esterna ricca di lipidi44.
Spettro d’azione e attività in vitro
Numerosi studi hanno messo in evidenza l’eccellente attività battericida di teicoplanina nei confronti di Staphylococcus aureus, incluse specie isolate resistenti a meticillina e oxacillina e in generale la sua equivalenza di attività rispetto alla vancomicina45. Anche gli Streptococchi mantengono un’elevata suscettibilità nei confronti di teicoplanina46, invece la sensibilità degli Stafilococchi coagulasi-negativi nei confronti di teicoplanina e vancomicina è differente dato l’isolamento di alcuni ceppi di
S.Haemolitycus più suscettibile alla vancomicina47.
Studi confermano che Clostridium difficile, C. perfringens,
Propionicbacterium acnes, Corynebacterium jeikeium ed altri corinebatteri
multi-resistenti sono sensibili a basse dosi di teicoplanina (MIC90 0.3/0.8
mg/dL)48,49.
La concentrazione minima battericida della teicoplanina (MBC:definita come la minima concentrazione che porta all’uccisione del 99.9% dei batteri inoculati) è sempre maggiore della minima concentrazione inibente il 90% della crescita batterica (MIC90) per Streptococcus pneumoniae, Staphylococcus aureus, Staphylococcus epidermidis e in alcuni studi isolati anche per stafilococchi
coagulasi-negativi50.
L’aumento della quantità di unità formanti colonie (cfu) da 104 a 106
non ha un effetto significativo sul valore di MIC90 per numerosi
MIC9051. L’attività battericida in vitro della teicoplanina, come per la
vancomicina, è lenta, ed è probabilmente legata alla frazione libera di farmaco52 inoltre decresce molto in presenza di sangue umano e siero, mentre come accade per altri antibiotici glicopeptidici, è aumentata in presenza di espettorato di pazienti con fibrosi cistica. L’attività battericida di teicoplanina nei confronti di Staphylococcus epidermidis è ridotta quando il batterio è incorporato all’interno di complessi di fibrina.
Teicoplanina, gli antibiotici aminoglicosidici e le penicilline in dosi subinibitorie mostrano sinergismo nei confronti di stafilococchi coagulasi-negativi ed enterococchi in particolare Enterococcus faecalis e
Staphylococcus aureus.
Per quanto riguarda invece le caratteristiche in vivo nello studio in modelli animali di endocarditi stafilococciche, teicoplanina e vancomicina agiscono allo stesso modo nel ridurre la carica batterica all’interno delle vegetazioni esaminate, ma teicoplanina esplica la sua azione più a lungo, potendosi dimostrare una sterilizzazione delle vegetazioni valvolari fino a 10 giorni dopo la fine del trattamento53.
Farmacoresistenza
La resistenza agli antibiotici glicopeptidici può manifestarsi singolarmente, come nel caso di alcuni stafilococchi coagulasi-negativi resistenti a teicoplanina e suscettibili a vancomicina o come nel caso di alcuni enterococchi resistenti a vancomicina ma suscettibili a teicoplanina; oppure in maniera duplice come nel caso di alcuni enterococchi altamente resistenti sia a teicoplanina che a vancomicina.
I primi dati riguardo l’acquisto di farmacoresistenza da parte di ceppi di Enterococcus risalgono al 1988, studi successivi ne hanno poi dimostrato le diverse tipologie fenotipiche.
Il fenotipo Van A degli enterococchi resistenti alla vancomicina determina anche la resistenza alla teicoplanina. Il meccanismo è identico per entrambi i farmaci: i ceppi Van A hanno acquisito due geni (van A e Van H) il cui prodotto enzimatico (D-alanil-D-lattato) si sostituisce al normale precursore della parete batterica (D-alanil-D-alanina) ed impedisce di conseguenza il legame con i due antibiotici glicopeptidici54, in alcuni
ceppi la farmacoresistenza è plasmide mediata mentre in altri ceppi resistenti il plasmide non è stato identificato e ciò lascia intendere che esista un altro meccanismo in grado di spiegare l’insorgere di tale resistenza.
I ceppi di enterococchi con fenotipo Van B sono invece spesso sensibili all’azione di teicoplanina55 poiché tale antibiotico è uno scarso induttore dell’enzima responsabile della modificazione della parete batterica.
Gli enterococchi appartenenti al fenotipo Van C, (E.Gallinarium, E.casseliflavus) e i Van D, che non sono generalmente patogeni umani, sono caratterizzati da elevata resistenza nei confronti di vancomicina (MIC 64 mg/dL) e scarsa resistenza verso teicoplanina (MIC 4mg/dL)56.
Il fenomeno di resistenza a teicoplanina, è stato osservato anche in alcuni ceppi di stafilococchi, ma i meccanismi che ne sono alla base non sono stati ancora identificati del tutto; tuttavia, anche in un ceppo batterico inizialmente sensibile si può sviluppare resistenza durante la terapia.
S.haemolitycus è stato il primo ceppo nel quale si sono riconosciuti,
seppur bassi, livelli di resistenza ai glicopeptidi. Questo tipo di resistenza oggi è stata descritta anche per S.epidermidis e S.aureus. In genere la resistenza nei confronti di teicoplanina in questi ceppi è da 2 a 4 volte più alta rispetto alla vancomicina57.
Nel 1998 è stato descritto un ceppo di S.aureus definito GISA (glyopeptide-intermediate S.aureus) con MIC di 8 mg/dL associato a
fallimento terapeutico58. Lo studio di questo ceppo ha fornito la possibilità di intuire il meccanismo che sottostà allo sviluppo della farmacoresistenza per tutto il genere, sembra infatti che tali batteri abbiano acquisito la capacità di bloccare l’antibiotico prima che questo si leghi con il proprio sito d’azione sulla parete cellulare attraverso una sovrapproduzione di leganti per i glicopeptidi (PBP2 e PBP2’)59.
Proprietà farmacocinetiche: assorbimento, distribuzione e concentrazioni plasmatiche.
L’assorbimento di teicoplanina per via intramuscolare è equivalente a quello per via endovenosa infatti una singola dose di 6 mg/kg di teicoplanina, somministrata per via intramuscolare o endovenosa, è associata a valori di concentrazione massima (Cmax) plasmatica pari a 43.2
mg/L 30 minuti dopo la somministrazione del farmaco, per arrivare a 12.3 mg/L 4 ore dopo60.
La somministrazione a 18 volontari sani di una singola dose endovenosa di teicoplanina di 15, 20 e 25 mg/kg ha prodotto Cmax di 194,
197 e 253 mg/L e concentrazione minima (Cmin) a 24 h di 10,5, 13,6 e 19,8
mg/L, con valori di area sottesa alla curva concentrazione/tempo (AUC) di 1444, 1756 e 2379 mg/L*h, rispettivamente (vedi grafici).
Correlazione dose/concentrazioni di teicoplanina 0 50 100 150 200 250 300 15 20 25
d o s e s o mminis t rat a in 18 vo lo nt ari s ani(mg / Kg )
cmin cmax
Correlazione dose/AUC per teicoplanina
0 500 1000 1500 2000 2500 15 20 25
dose som m inistarta in 18 volontari sani (m g/kg)
A
U
C AUC
Questo dimostra come parametri farmacocinetici quali AUC e Cmax
siano direttamente correlati alla dose di farmaco somministrata61.
In due gruppi di pazienti neutropenici trattati con teicoplanina alla dose di 6 mg/kg/die per via endovenosa, lo steady-state è stato raggiunto dopo 14 giorni. Dopo 1 ora la concentrazione plasmatica era compresa tra 12,5 e 41 mg/L e lo steady-state dopo 3 ore era 22 mg/L. Bisogna comunque considerare una notevole variabilità individuale nei parametri utilizzati nell’analisi farmacocinetica62, 63.
Nei neonati e nei lattanti una dose carico di 15 mg/kg/12h seguita da una dose giornaliera di 8 mg/kg sembra necessaria per mantenere una dose plasmatica maggiore di 10 mg/L. In 52 neonati, la maggior parte dei quali erano prematuri, il valore di Cmin dopo una dose di carico di 10 mg/kg era di
6,9 mg/L e dopo la quinta dose giornaliera di 6 mg/kg il valore di Cmin era
di 8 mg/L. I valori di Cmin erano maggiori dopo una dose di carico di 15
mg/Kg (12,6 mg/L) e dopo una dose di mantenimento di 8 mg/kg per 5 giorni (14,5 mg/L)64.
Lo stato stazionario (steady-state) per teicoplanina, compreso tra 14 e 23mg/L, viene raggiunto dopo una dose di carico di 6-12 mg/kg/12 h per 2 dosi e poi ogni 24 h65.
Recentemente Pea et al66, hanno dimostrato che dosi di carico di
teicoplanina (800 mg q12h) permettono di raggiungere concentrazioni plasmatiche minime (Cmin) in tempi più brevi rispetto ad un protocollo standard (800 mg q24). In tal modo la popolazione batterica è esposta a concentrazioni efficaci di teicoplanina in tempi minori, assicurando una migliore e più rapida guarigione clinica del paziente ed eventualmente eradicazione dell’infezione.
L’apparente volume di distribuzione in seguito a somministrazione endovenosa di una dose variabile tra 6 e 15mg/kg allo steady-state sembra variare fra 0,8 e 1,6 L/kg67.
A seguito di somministrazione endovenosa o intramuscolare, teicoplanina si distribuisce nei tessuti, compresi cute, tessuto adiposo, tessuto osseo, polmone e rene. Essa penetra negli essudati, nel fluido peritoneale e nelle cavità articolari; penetra anche nei granulociti neutrofili aumentando la loro attività battericida.
Teicoplanina penetra nel tessuto miocardico; in 32 pazienti sottoposti a bypass coronarico la concentrazione a livello del miocardio atriale, dopo iniezione endovenosa di teicoplanina 6 mg/kg al momento dell’induzione dell’anestesia, risulta essere di 70,6 mg/Kg, all’incirca 3,7 volte la concentrazione plasmatica . Allo stesso modo in 17 pazienti a cui è stata
somministrata, per via endovenosa, teicoplanina 12 mg/kg, dopo 50 min dalla somministrazione a livello atriale si avevano concentrazioni di 140 mg/kg, all’incirca 2,8 volte la concentrazione plasmatica. In 17 pazienti a cui è stata somministrata per via endovenosa una dose di teicoplanina di 800 mg, dopo 4h, la concentrazione risultava a livello miocardico di 43 mg/kg, a livello pericardico di 26 mg/kg e a livello del grasso mediastinico di 3,2 mg/kg68.
Teicoplanina si accumula anche a livello del tessuto mammario; in 21 pazienti a cui sono stati somministrati 400 mg di teicoplanina prima di un intervento chirurgico a livello della mammella, sono state valutate concentrazioni di 2,8 mg/kg, l’11% della concentrazione plasmatica69.
La concentrazione a livello del liquor in pazienti con sintomi di infiammazione meningea dopo neurochirurgia, in seguito a somministrazione endovenosa di teicoplanina 400 mg, varia fra 0,5 e 1 mg/l.
Teicoplanina non penetra la barriera ematoencefalica, ma tramite iniezione intraventricolare di 20 mg/24-48 o 5mg nei bambini, si possono ottenere all’interno del liquido cefalorachidiano concentrazioni >40 mg/L
70.
Il legame di teicoplanina con le proteine plasmatiche si aggira intorno al 90% ed è direttamente proporzionale fino ad una concentrazione di 300 mg/l. La proteina che principalmente lega la teicoplanina sembra essere l’albumina, seconda solamente ad una α1-glicoproteina acida71.
Metabolismo ed eliminazione
I metaboliti derivano dall’idrossidazione del componente A2-3 della catena degli acidi grassi. I due metaboliti identificati Ω1 e Ω2 hanno simile
spettro di attività battericida, ma considerevole minor attività (dall’ 1,5 al 12%) rispetto alla teicoplanina. Le proprietà farmacocinetiche dei singoli
componenti di teicoplanina (A3-1, A2-1, A2-2, A2-3, A2-4, A2-5) sono stati studiati da Bernareggi et al. (1990), in tale studio si è hanno osservato che all’aumentare della lipofilia (da A2-1 a A2-5) la frazione libera, il Vdss,
la clearance totale, la clearance renale e l’escrezione urinaria totale diminuivano, mentre il Vdss e la clearance renale di farmaco non legato
aumentavano. Comunque le differenze tra i componenti individuali sono minime e nella pratica clinica teicoplanina può essere considerata come una singola molecola72.
La clearance totale di teicoplanina dopo somministrazione in volontari sani di dosi comprese tra 3 e 30 mg/kg varia da 10 a 13 ml/h/kg, la clearance renale negli stessi soggetti varia da 8 a 12 ml/h/kg73; mettendo in evidenza che il filtro renale è il meccanismo preponderante nell’eliminazione di questo farmaco.
Teicoplanina attraversa il filtro renale per filtrazione glomerulare passiva34.
La clearance totale e renale di teicoplanina sono correlate con la clearance della creatinina e sono ridotte in pazienti con alterata funzionalità renale. Teicoplanina non viene rimossa dal circolo durante il trattamento dialitico indipendentemente dal tipo di membarana utilizzata (basso-alto flusso)74.
Nei pazienti tossicodipendenti, trattati con teicoplanina per la presenza di endocarditi batteriche, i valori di clearance totale e renale sono maggiori di quelli riportati nei volontari sani e i valori di eliminazione di teicoplanina sono quasi dimezzati75.
Effetti degli stati patologici sulla farmacocinetica
La farmacocinetica della teicoplanina è stata studiata in pazienti con insufficienza renale, in tossicodipendenti trattati per endocarditi batteriche e in pazienti ustionati.
La clearance renale e totale è correlata alla clearance della creatinina e diminuisce in pazienti con insufficienza renale con clearance della creatinina compresa tra 13 e 22 ml/min. In questi pazienti, dopo somministrazione endovenosa di 3 mg/kg di teicoplanina, la clearance renale è stata valutata fra 1,1 e 4 ml/h/kg (all’incirca 0,07-0,28 l/h) con valori di t½β che variano tra 280 e 667 ore76, 77.
In pazienti con storia di tossicodipendenza con abuso di droghe iniettate per via endovenosa, trattati per endocardite batterica con 10-15 mg/kg/12h per meno di 10 somministrazioni e 10-15 mg/kg/24h nelle somministrazioni successive, la clearance renale e la clearance totale sono maggiori e più variabili di quanto abitualmente riportato per i volontari sani. Il valore di t½β si riduce a 78 ore37.
Efficacia terapeutica
Fin dalle prime sperimentazioni, trials terapeutici condotti su teicoplanina, hanno messo in evidenza l’efficacia di questo farmaco nel trattamento delle infezioni da batteri Gram-positivi e nella terapia empirica dei pazienti immunocompromessi con malattie ematologiche soggetti a chemioterapia aggressiva.
L’efficacia terapeutica di teicoplanina contro S.aureus è stata valutata in 18 studi comparativi e in 46 studi senza controllo ed è stata somministrata in totale in 3161 pazienti, l’infezione includeva sia MRSA che MSSA. Negli studi comparativi vancomicina e teicoplanina hanno mostrato differenze importanti per quello che riguarda gli effetti sia clinici che batteriologici. Teicoplanina è stata somministrata in dosi di 6mg/kg/die o di 400mg/die sia in momoterapia che in associazione con amminoglicosidi e/o β-lattamici.
Teicoplanina ha raggiunto tassi di successo clinico-batteriologico rispettivamente dell’81.8% e dell’84.6% negli studi comparativi mentre dell’88.1% e dell’87.5% rispettivamente negli studi non comparativi78.
Teicoplanina è sicura ed efficace nel trattamento delle infezioni da gram-positivi includendo ad esempio endocarditi, osteomieliti ed artriti settiche. Teicoplanina inoltre ha un ruolo importante nella proflassi chirurgica.
Batteremie
Le batteremie nosocomiali in genere derivano da catetere intravenoso, operazioni chirurgiche o infezioni respiratorie, il patogeno che è coinvolto in tale patologie è in relazione con le precedenti terapie antimicrobiche effettuate e con il grado di compromissione dell’ospite: nelle unità di terapia intensiva i batteri gram-positivi sono una causa eziologia in aumento.
In particolar modo si è visto che sono gli Enterococchi vancomicina-resistenti (VRE) a causare più spesso questo tipo di infezione soprattutto nei pazienti precedentemente trattati con β-lattamici e/o chinolonici79.
L’incidenza dell’infezione da VRE è in crescita e sfiora circa in quarto delle infezioni ospedaliere negli Stati Uniti. In Europa, anche se circa l’8% della popolazione è portatrice dell’organismo, raramente causa manifestazioni cliniche. Le possibilità terapeutiche sono abbastanza limitate, ampicillina si utilizza se il ceppo è sensibile altrimenti per i ceppi Van-B e Van-C il farmaco di prima scelta è teicoplanina.
Studi sull’efficacia di teicoplanina nel trattamento di batteriemie da
Staphilococcus aureus in pazienti non neutropenici sono poco significativi
e mal comparabili fra loro.
In uno studio comparativo condotto su 39 pazienti con batteriemia e infezione intravascolare, compresa l’endocardite, teicoplanina 6 mg/kg/die
dopo una dose di carico 6 mg/kg/12h e vancomicina 15 mg/kg/12h hanno dimostrato efficacia comparabile in pazienti con batteriemia causata da
Staphilococcus aureus o altri cocchi Gram-positivi.
In un altro studio comparativo in cui teicoplanina e vancomicina erano somministrate singolarmente nel trattamento di batteriemie dovute a
Staphilococcus aureus e di altre gravi infezioni da Gram positivi, entrambi
i farmaci erano ugualmente efficaci80.
Usata in monoterapia, la teicoplanina a dosaggi di 400-800 mg/die raggiunge guarigione clinica e negativizzazione delle colture nell’84-93% dei pazienti con batteriemia da Staphilococcus aureus81.
Il dosaggio ottimale di teicoplanina nel trattamento delle batteriemie causate da staphilococcus aureus deve essere ancora stabilito .
Endocarditi
Le cause eziologiche prevalenti di endocardite sono Staphylococchi e Streptococchi, la mortalità si aggira intorno al 30%.
I glicopeptidi vengono utilizzati quando i patogeni responsabili dell’infezione sono resistenti ai β-lattamici.
Teicoplanina e vancomicina hanno potere battericida meno rapido rispetto a penicilline e amminoglicosidi ed è stato registrato fallimento terapeutico quando teicoplanina e vancomicina sono state utilizzate in monoterapia, infatti l’elevato grado di legame con le proteine plasmatiche e le grandi dimensioni della molecola riducono la capacità di teicoplanina nel penetrare le vegetazioni endocardiche.
Gli studi riguardo l’efficacia di teicoplanina sono scarsi per le difficoltà che si hanno nello standardizzare il trattamento e per il piccolo numero di pazienti arruolabili. In un review del 1994 si conclude che l’efficacia di teicoplanina nel trattamento delle endocarditi va dal 40% al 100%.
Studi americani non pubblicati registrano tassi di successo del 20%, 64% e 79% nel trattamento di endocarditi da S.aureus in un piccolo numero di pazienti, studi europei riportano gli stessi tassi di successo.
Si conclude che dosaggi 400 mg/die hanno minor capacità di successo ma dosaggi di 6mg/kg/die combinati con un altro antibiotico sono da preferirsi alla monoterapia condotta con le stesse dosi.
È importante considerare che l’efficacia di teicoplanina in monoterapia nel trattamento delle endocarditi da S.aureus è pari a quella in associazione nel caso in cui i dosaggi siano pari a 12mg/kg/die e i livelli plasmatici del glicopeptide siano >20mg/dL82.
Infezioni delle ossa e delle articolazioni
Le infezioni delle ossa e delle articolazioni sono in netta crescita negli ultimi anni soprattutto dopo l’avvento della chirurgia protesica.
Le osteomieliti sono più frequentemente causate da S.aureus (in particolar modo nei bambini) mentre nei pazienti chirurgici più spesso sono da ricondursi a S.epidermidis. I cocchi β-emolitici invece sono implicati nelle infezioni ossee dei neonati e nei bambini.
Circa il 90% delle artriti settiche è causato da S.aureus, anche se
Haemophilus Influenzae è più comune nei bambini.
Nella scelta del trattamento rientrano sicuramente molti fattori, il tipo di patogeno coinvolto, la sua suscettibilità ai farmaci, la frequenza dei dosaggi e la necessità di raggiungere concentrazioni terapeutiche nel tessuto osseo e nel liquido sinoviale; da non sottovalutare poi è la possibilità di una toilette chirurgica a sostegno della terapia medica.
Teicoplanina presenta molti fattori che la rendono utile nel trattamento delle infezioni di ossa e articolazioni: è attiva contro batteri gram-positivi (inclusi i meticillino resistenti), l’efficacia e la sicurezza sono
garantite, inoltre può essere prescritta anche nelle terapie domiciliari grazie alla possibilità di somministrazione in unico bolo giornaliero83.
Nella maggior parte dei casi teicoplanina raggiunge concentrazioni nel tessuto osseo e nel liquido sinoviale sopra la MIC per i patogeni più comuni. Alle dosi di 6 mg/kg/die per 8 giorni si raggiungono concentrazioni sieriche di valle intorno a 10 mg/L e picchi di concentrazione che vanno da 20mg /l a 50mg/L; utilizzando invece boli da 12 mg/kg/die le concentrazioni di valle si stabiliscono intorno a 20mg/dl al terzo giorno di terapia con picchi tra 40 mg/L e 100 mg/l. Il trattamento medico delle osteomieliti si protrae per 4-6 settimane, 2-3 per le artriti settiche ed anche in questo caso sale a sei se è coinvolta una articolazione di tipo protesico.
L’efficacia di teicoplanina per questo tipo di infezioni è stata valutata in più di uno studio agli inizi degli anni 90.
Nello studio di Lewis, et aL. sono stati sottoposti a trattamento 172 pazienti con una dose media di teicoplanina di 289 mg/die ed è stato registrato buon esito in 149 di questi soggetti (87%)84.
Nello studio di Le Frock invece sono stata utilizzate dosi più elevate (12mgKg ogni 8 h per tre dosi carico poi 6 mg/kg ogni 24h per 4-6 settimane) e si è osservata guarigione nel 90% dei pazienti con osteomielite acute e sempre nel 90% dei pazienti con osteomielite cronica85.
Per concludere in 26 studi che hanno valutato più di 1000 pazienti il tasso medio di successo per teicoplanina il tasso di successo medio è del 85% (range 50-100%) con un intervallo di dose di 200mg/die o 25 mg/kg/die86.
Infezioni delle basse vie respiratorie
Studi comparativi hanno valutato l’efficacia di teicoplanina somministrata insieme a ciprofloxacina rispetto alla somministrazione singola di ciprofloxacina o ceftriaxone, in pazienti di età superiore a 65 anni, con polmonite nosocomiale da batteri Gram-positivi. In tutti gli studi è stata dimostrata una maggiore efficacia nei pazienti trattati con teicoplanina+ciprofloxacina rispetto a ciprofloxacina o ceftriaxone in monoterapia87.
Dopo somministrazione parenterale di teicoplanina 200 o 400mg/die è stata dimostrata guarigione clinica nel 91-93% dei pazienti con polmonite, la maggior parte dei quali con patologia polmonare di base, compresa neoplasia. In questi pazienti è stata dimostrata anche negativizzazione degli esami colturali eseguiti su lavaggio bronco-alveolare; la negativizzazione è stata ottenuta nel 89% dei pazienti con infezione da Staphilococcus aureus e nel 100% dei pazienti con infezione streptococcica88.
In due studi multicentrici, uno Europeo ed uno Italiano, la guarigione clinica in caso di polmonite da Gram-positivi è stata dimostrata nel 92% dei pazienti trattati con teicoplanina 200-400 mg/die89.
Infezioni della pelle e dei tessuti molli
La guarigione clinica in pazienti con infezioni dei tessuti molli causata da batteri gram positivi è stata osservata in studi condotti in un numero ridotto di pazienti, dopo terapia con teicoplanina 200-800 mg o 3,6-6,8 mg/kg in monosomministrazione endovenosa o intramuscolare, l’efficacia del trattamento è stata osservata nell’89-100% dei casi90, 91.
Le infezioni erano provocate per lo più da Staphilococcus aureus o da Staphilococcus epidermidis92.
In uno studio non randomizzato tra somministrazione endovenosa e intramuscolare di teicoplanina 3 mg/kg, Staphilococcus aureus è stato
eradicato nel 100% dei 18 i pazienti che avevano assunto il farmaco per via endovenosa, ma solo nel 56% dei 16 pazienti trattati con somministrazione intramuscolare48.
Altre infezioni
Nel trattamento della diarrea e della colite associata a Clostridium difficile la somministrazione orale di teicoplanina 100 mg/12 h e vancomicina 500 mg/6h risulta terapeutica nel 96-100% dei casi. L’infezione da Clostridium difficile tende a permanere maggiormente nei pazienti trattati con vancomicina, rispetto a quelli che hanno ricevuto teicoplanina.
Trattamento empirico dei pazienti neutropenici
La prevalenza di infezioni da Gram-positivi in pazienti neutropenici e neoplastici è aumentata negli ultimi anni e si considera appropriato, per tali condizioni, instaurare una copertura antibiotica per questi ceppi batterici93. Benché siano stati eseguiti numerosi studi sull’efficacia di
teicoplanina, rimangono controversie riguardo alla reale necessità di somministrare antibiotici, riguardo all’antibiotico da somministrare e riguardo al timing di introduzione dell’antibiotico a regime empirico (vedi grafico) da utilizzare per la popolazione dei pazienti neutropenici.94.
Risposta complessiva e in pazienti con batteriemia trattati con glicopeptidi 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
Risposta complessiva Risposta in pazienti con batteriemie da Gram + p er ce n tu a le d i ri sp o st a Teicoplanina vancomicina
Grafico: risposta complessiva e risposta in pazienti con batteremia da Gram+ (risoluzione del quadro febbrile, dei segni clinici e negativizzazione colture) in trattamento con
teicoplanina/ceftazidime/amikacina o vancomicina/ceftazidime/amikacina. (Menichetti et al, 1993)
Quando viene utilizzata nel trattamento dei pazienti neoplastici con neutropenia, la teicoplanina mostra efficacia simile a vancomicina, in associazione a piperacillina o tobramicina e a ceftazidime o amikacina(vedi grafico)95.
Teicoplanina è associata ad una minore incidenza di superinfezioni da Candida ed è meglio tollerata25, 26.
Profilassi
Profilassi in chirurgia
È orma ben chiarito da tempo che l’antibiotico-profilassi riduce significativamente l’incidenza delle infezioni post-operatorie in tutte le categorie chirurgiche96, 97. La profilassi antimicrobica è diventata terapia standard nelle operazioni “pulite”, “contaminate” o “sporche” caratterizzate da un alto rischio infettivo a causa della contaminazione del campo operatorio da parte della flora endogena; è standard anche nei casi di
chirurgia maggiore, infatti, nonostante venga eseguita in condizioni ottimali, presenta comunque rischi infettivi causati dalla flora esogena98.
CHIRURGIA TIPOLOGIA PATOGENO
Cardiaca Toracica Vascolare Ortopedica Neurologica Altro*
S.aureus (MS&MR), CNS (MS&MR), Corynebacterium spp. S.aureus (MS&MR), CNS (MS&MR) Streptococcci, anerobi. S.aureus (MS&MR), CNS (MS&MR).
S.aureus (MS&MR), CNS (MS&MR). S.aureus (MS&MR), CNS (MS&MR). S.aureus (MS&MR), CNS (MS&MR)
MS: meticillinosensibile, MR:meticcilinoresistente,
CNS: staphylococci coagulasi negativi.
*chirurgia plastica, chirurgia della mammella, ernioplastica. Tabella: batteri gram-positivi più spesso causa di infezioni post-operatorie.
Lo Staphyilococcus aureus è responsabile dal 70% al 90% delle infezioni postoperatorie nella chirurgia cardiaca, toracica, ortopedica e neurologica (vedi tabella)99
Teicoplanina è di scelta per la profilassi perioperatoria rispetto alla vancomicina a causa dell’eccellente grado di penetrazione tissutale, della bassa tossicità e della lunga emivita.
Una dose iniziale di teicoplanina pari a 12 mg/kg permette di raggiungere concentrazioni sieriche e nel tessuto cardiaco che eccedono di molto la MIC90 per MRSA e CNS, questo dosaggio permette di ridurre lo
sviluppo di infezioni postoperatorie nella chirurgia cardiaca100.
Nella chirurgia vascolare d’elezione si è dimostrato che una singola dose preoperatoria da 400mg di teicoplanina è di efficacia pari al trattamento con metronidazolo e cefradine (tre dosi ciascuno). Teicoplanina (in dose singola) è considerata anche una buona alternativa alla amoxicillina per la prevenzione delle endocarditi nei pazienti sottoposti a manovre odontoiatriche101.
Nella chirurgia ortopedica un singola dose di teicoplanina (400 mg) è di efficacia e sicurezza pari a dosi multiple di cefepime nella prevenzione delle infezioni in seguito all’inserzione di protesi articolari102.
Risultati preliminari interessanti sono stati ottenuti anche nel trattamento profilattico dei pazienti ustionati103 e nella mastoplastica
ricostruttiva104.
Profilassi nelle infezioni correlate all’uso di cateteri venosi centrali
L’efficacia di teicoplanina nel prevenire le infezioni CVC correlate a Gram-positivi o le infezioni dei tessuti molli è stata studiata in un numero esiguo di pazienti con leucemia e portatori di catetere di Hickman per la somministrazione della chemioterapia.
Comparata con il placebo, la somministrazione endovenosa di teicoplanina 400 mg 2 ore prima dell’inserimento del catetere è associata ad una diminuita incidenza (p<0,05) di infezioni da Gram-positivi correlate a catetere [7 su 40 (17,5%) vs 16 su 40 (40%)].
Le infezioni dei tessuti molli correlate a CVC sono presenti nel 33% dei pazienti a cui viene somministrata teicoplanina e nel 44% dei pazienti a cui viene somministrato placebo e la necessità di rimozione del CVC occorre in 1 e 3 pazienti trattati con teicoplanina e placebo rispettivamente105.
In uno studio non comparativo, nessuno dei 30 pazienti ai quali è stata somministrata teicoplanina 400mg al momento dell’inserzione del catetere e 24 ore dopo, ha sviluppato infezione da batteri Gram-positivi nelle 2 settimane successive106.
In conclusione la somministrazione profilattica di teicoplanina sembra ridurre lo sviluppo precoce di infezioni CVC correlate; questa profilassi può essere importante nei pazienti neutropenici, che hanno una elevata incidenza di questo tipo di infezioni, anche se persiste il dubbio riguardo all’insorgenza di resistenza a teicoplanina.
Tollerabilità
L’analisi statistica, inerente agli studi preclinici e ai dati provenienti da studi effettuati dopo la commercializzazione del farmaco in Europa, evidenzia che uno o più effetti collaterali sono stati riportati dal 10,3% di 3377 pazienti (Davey, Williams 1991). Reazioni anafilattiche sono state segnalate nel 2,6% dei pazienti, reazioni di tipo locale nel 1,7%, alterazioni della funzionalità epatica e renale nell’1,7% e nello 0,6% dei casi rispettivamente, comparsa di febbre nello 0.8% ed ototossicità nello 0.3% dei casi.
L’incidenza o il tipo di reazione avversa non è influenzata dall’età del paziente o dalla dose del farmaco maggiore di 10 mg/kg, ma l’incidenza di febbre e rash cutanei aumenta con la dose di farmaco somministrata. Teicoplanina meno frequentemente rispetto al vancomicina causa insufficienza renale, specie in associazione ad antibiotici aminoglicosidici o reazioni anafilattiche tipo “red man syndrome” 107, 108.
Nefrotossicità
In studi condotti su animali gli antibiotici glicopeptidici hanno dimostrato, a parità di peso, lo stesso grado di nefrotossicità; nell’uomo però, teicoplanina viene somministrata a dosaggi più bassi rispetto a vancomicina (rispettivamente <15 mg/kg/die vs 30mg/kg/die).
Esistono conferme che teicoplanina in monoterapia presenta minor grado di nefrotossicità rispetto a vancomicina; infatti una metanalisi di 9 studi (includendo lo studio di Kureishi et al.109 e lo studio di Charbonneau
et al.110) dimostra differenze altamente significative per lo sviluppo di
nefrotossicita con percentuali di 4,8% per teicoplanina contro il 10,7% per vancomicina (P=0,0005).
Ototossicità
Ototossicità è stata riscontrata in 11 dei 3377 pazienti trattati con teicoplanina70 ed esistono altri casi riportati di perdita dell’udito dopo somministrazione di tale antibiotico; tuttavia tale deficit è registrato spesso dopo interventi di chirurgia maggiore o in condizioni di instabilità emodinamica e i casi riportati potrebbero essere non di più rispetto a quelli normalmente registrati nei pazienti che presentano tali problematiche.
A sostegno di tale ipotesi è il fatto che mai è stata registrata ototossicità legata all’utilizzo di antibiotici glicopeptidici in modelli sperimentali animali111.
Reazioni anafilattiche e “red man syndrome”
Reazioni da ipersensibilità sono la causa più comune di sospensione del trattamento con teicoplanina: studi condotti negli Stati Uniti riportano probabilità di sviluppo di rash e febbre rispettivamente del 7% e 6%; inoltre in studi comparativi il tasso di sviluppo di tali reazioni è lo stesso per entrambi gli antibiotici glicopeptidici112.
Come già accennato, nei casi in cui il trattamento è prolungato nel tempo o condotto con alto dosaggio si ha maggior rischio di sviluppo di reazioni anafilattiche.
Reazioni allergiche possono manifestarsi nei pazienti precedentemente trattati con vancomicina113, questa rimane però una evenienza molto rara. Dai dati riportati in letteratura, anche se rimangono alcuni pareri contrari, emerge che i pazienti con anamnesi positiva per reazioni alla vancomicina possono comunque essere trattati con teicoplanina114; inoltre non è stato ancora determinato con sicurezza il
grado di cross-reazione tra i due antibiotici.115
La “red man” o “neck man” sindrome è caratterizzata da eritema e prurito a livello del collo e della porzione superiore del torace, è spesso
associato con infusioni rapide di vancomicina, in genere ma non sempre in seguito alla prima dose. Il meccanismo fiiopatologico è principalmente da ricondursi al rilascio di istamina, dato supportato dall’efficacia della profilassi con gli antistaminici e dalla risoluzione del quadro clinico se tali farmaci vengono somministrati precocemente dopo la comparsa della sintomatologia. Teicoplanina non causa “red man syndrome” in volontari sani e risulta essere estremamente rara negli studi condotti su pazienti (3 casi su 6696 soggetti trattati)116.
Dose e modo di somministrazione
Teicoplanina viene somministrata per via endovenosa (solitamente in bolo) o per via intramuscolare.
Negli adulti con funzionalità renale normale si inizia la somministrazione con una dose di carico di 6 mg/kg/12h, seguita da una mono-somministrazione giornaliera della stessa dose. La somministrazione endovenosa e dosaggi più elevati sono raccomandabili in presenza di infezioni gravi. Pazienti con artrite settica devono essere trattati con dose di mantenimento di 12 mg/kg/die.
In pazienti neutropenici con febbre il trattamento empirico delle complicanze infettive prevede una dose carico di 6-12 mg/kg/12h che deve essere seguita da una dose di mantenimento di 6 mg/kg/die.
In pazienti con endocardite da Staphilococcus aureus, le concentrazioni plasmatiche di teicoplanina devono essere superiori a 20 mg/L quando teicoplanina è utilizzata in monoterapia, benché in questi pazienti è consigliabile l’associazione di aminoglicosidi fino alla seconda settimana di trattamento.
Nei pazienti con insufficienza renale acuta o cronica la dose di 6 mg/kg utilizzata negli adulti con funzionalità renale normale deve essere
somministrata nei primi tre giorni di trattamento; in seguito la dose deve essere adattata in modo da mantenere una concentrazione plasmatica >10mg/L.
Il dosaggio plasmatico è utile anche nei pazienti con storia di abuso di sostanze stupefacenti per via endovenosa per assicurare una dose plasmatica efficace di teicoplanina117.
PAZIENTI CON INFEZIONI DA GRAM POSITIVI
DOSE DA CARICO DOSE DI
MANTENIMENTO
ADULTI o ANZIANI
Funzione renale normale 6mg/kg (o 400mg) ev ogni 12h per 3 volte
6mg/kg (o 400mg) ev ogni 24h Insufficienza renale moderata (ClCr 40-60 ml/min) 6mg/kg (o 400mg) ev ogni 12h per 3 volte
6mg/kg ( o400mg) ev ogni 48h Insufficienza renale grave (ClCr <40 ml/min) o dialisi* 6mg/kg (o 400mg) ev ogni 12h per 3 volte
6mg/kg (o 400mg) ev ogni 72h PROFILASSI CHIRURGICA Ortopedica o vascolare 6-12mg/kg (o 400-800 mg) ev in dose singola Cardiochirurgia 12mg/kg (o 400-800 mg) ev in dose singola
*in caso di dialisi è necessario eseguire monitoraggio delle concentrazioni plasmatiche.
Tabella: Farmacocinetica clinica di teicoplanina.Wilson A.P.:Clin Pharmacokinet. 2000; 39 (3): 167-183.
Parametri PK/PD e teicoplanina
L’analisi degli studi clinici e la valutazione dei risultati ottenuti in laboratorio, sia in vitro che in modelli animali di infezione, hanno mostrato che teicoplanina raggiunge la sua massima efficacia quando le concentrazioni plasmatiche (o nel mezzo di coltura) rimangono al di sopra dei valori di MIC dei microrganismi patogeni per tempi sufficientemente lunghi, a prescindere dalla via e dalle modalità di somministrazione. Infatti,
teicoplanina, al pari altri farmaci inibitori della sintesi e del rimaneggiamento della parete batterica, quali le betalattamine, e il più recente linezolid (appartenente alla classe degli oxazolidinoni), risulta particolarmente efficace quando le concentrazioni plasmatiche sono superiori ai valori di MIC del patogeno per almeno il 40-60% del tempo che intercorre tra due somministrazioni. Tale comportamento dipende dal fatto che, verosimilmente, per ottenere una sufficiente inibizione della sintesi della parete con conseguente riduzione della popolazione batterica presente nel sito d’infezione, è necessario far si che il maggior numero di microrganismi sia esposto al farmaco nel momento in cui essi vanno incontro a replicazione cellulare. Infatti, una delle cause di minor sensibilità ai chemioterapici inibitori della parete è rappresentata dallo stato di quiescenza del batterio. Approfondite analisi hanno quindi dimostrato che percentuali di tempo pari a quelle indicate sopra rappresentano un obiettivo importante ai fini della guarigione clinica del paziente in trattamento con teicoplanina. Il tempo sopra i valori di MIC90 (espresso
come t>MIC) rappresenta quindi il più importante parametro farmacocinetico che predice l’efficacia di un trattamento con teicoplanina. Pertanto, è necessario che la dose di teicoplanina sia tale affinché le concentrazioni plasmatiche del farmaco rimangano superiori a quelle di MIC90 per tempi sufficientemente lunghi118.
Modalità di dosaggio
I metodi disponibili per la valutazione delle concentrazioni di teicoplanina nei fluidi biologici includono:
- il saggio microbiologico
- le reazioni dei recettori per gli enzimi di fase solida
- le tecniche di immunofluorescenza con polarizzazione (FPIA) - la cromatografia liquida ad elevate prestazioni (HPLC).
Il saggio microbiologico è stato il primo metodo utilizzato per quantificare le concentrazioni di teicoplanina nel siero, ma per la lunga durata della tecnica (circa 24 h), per la bassa specificità, per l’elevata quantità di siero necessaria durante l’analisi e per la elevata dipendenza dagli operatori, è stato abbandonato nella pratica routinaria.
Per l’utilizzo di routine anche l’HPLC, sebbene rappresenti la migliore tecnica in assoluto, grazie alle elevate doti di sensibilità, specificità e riproducibilità, risulta complicata da eseguire per diversi motivi e richiede lunghi tempi di svolgimento. Inoltre, sempre dal punto di vista tecnico, la riproducibilità delle analisi, ovvero la variabilità, è significativamente inferiore a quella di altri metodi.
FPIA è stata designata come la tecnica più rapida per il dosaggio plasmatico di teicoplanina. Con questo metodo è presente un’interferenza limitata anche quando teicoplanina è dosata in presenza di altri antibiotici, benché questa tecnica non distingua la frazione libera di farmaco da quella legata alle proteine plasmatiche, soprattutto all’albumina, nè sia in grado di riconoscere le singole frazioni di teicoplanina presenti nella miscela come invece è possibile mediante cromatografia HPLC119.
TEICOPLANINA IN AMBIENTE CRITICO:
OTTIMIZZAZIONE DEL DOSAGGIO.
Il principale determinante farmacodinamico di efficacia per gli antibiotici glicopeptidici è rappresentato dal mantenimento di una concentrazione plasmatica minima (Cmin) costantemente al di sopra della
MIC dell’agente eziologico (Cmin>MIC).
In riferimento a teicoplanina, nel corso di una valutazione clinico-farmacologica retrospettiva è stato osservato che quando Cmin era superiore
a 10 mg/L l’efficacia clinica di teicoplanina nella terapia delle gravi infezioni ospedaliere era del 60-65% dei casi, mentre saliva al 75-80% quando Cmin era > 20 mg/L.
Correlazione concentrazione plasmatica minima di teicoplanina e probabilita di guarigione clinica
0 10 20 30 40 50 60 70 80 90 100 1 2 3 4 5 6 Cmin (mg/L) % guariti