07/10/14 12:52
Sommario
1 INTRODUZIONE ...4
2 DEFINIZIONE DI DIABETE MELLITO...9
3 CENNI STORICI... 10
4 CLASSIFICAZIONE DEL DIABETE MELLITO... 12
5 EPIDEMIOLOGIA DEL DIABETE MELLITO... 14
5.1 Cenni di epidemiologia sul DM2...14
5.2 Epidemiologia e fattori di rischio del DM1 ...15
Incidenza e prevalenza del DM1 ...15
Andamento nel tempo ...17
6 EZIOPATOGENESI DEL DM1 ... 21
6.1 Fasi della distruzione beta-cellulare ...21
6.2 Significato degli autoanticorpi...23
6.3 Eziopatogenesi del DM1 B ...25
7 QUADRO CLINICO D’ESORDIO DEL DM1 E DIAGNOSI ... 26
Nuovi criteri diagnostici (ADA 2014) ...28
8 COMPLICANZE ACUTE E CRONICHE DEL DM1 ... 29
8.1 Complicanze acute del DM1 ...29
Chetoacidosi Diabetica ...29
Ipoglicemia ...37
8.2 Complicanze croniche del DM1...49
Meccanismi delle complicanze croniche ...52
Controllo glicemico e complicanze...53
9 EPIDEMIOLOGIA DEI FATTORI DI RISCHIO CARDIOVASCOLARI NEL DM1 ... 70
9.1 Elementi che influenzano il rischio cardiovascolare nel DM1129 130...70
Suscettibilità genetica alla CVD nel DM1...70
Correlazione tra le complicanze microvascolari ed RCV nel DM1 ...71
Ruolo della glicemia e del suo controllo ...75
Ruolo dei tradizionali fattori di rischio cardiovascolari nel DM1 ...78
Stile di vita ...81
9.2 Il rischio cardiovascolare nel giovane con DM1 ...82
9.3 DM1 VERSUS DM2: differenze nell’entità e nell’origine del rischio cardiovascolare...85
Ipertensione...87
Obesità...87
Differenze di genere ...88
Iperglicemia ...89
Nefropatia ...89
Ruolo di nuovi fattori di rischio...90
9.4 “The Double Diabetes”...92
Adiponectina...95
Strategie terapeutiche ...97
Conclusione ...99
9.5 “Metabolic Memory” ... 100
10 COMPLICANZE CARDIOVASCOLARI NEL DM1... 104
10.1 Aspetti di epidemiologia della CVD nel DM1 ... 104
10.2 Quadro clinico... 106
Aterosclerosi precoce ed accelerata... 107
CAN ... 113
Cardiomiopatia Diabetica (DCM)... 125
Insufficienza cardiaca nel DM1... 137
11 TERAPIA MEDICA DEL DM1 ... 140
11.1 Goals Glicemici secondo ADA 2014... 140
11.2 Terapia insulinica nel DM1, raccomandazioni ADA 2014... 141
11.3 Farmacocinetica delle preparazioni insuliniche e regimi insulinici... 143
Preparazioni insuliniche... 144
11.4 Terapie emergenti... 149
12 TERAPIA CHIRURGICA DEL DIABETE MELLITO DI TIPO 1: IL TRAPIANTO DI PANCREAS ... 151
12.1 Introduzione... 151
12.2 Cenni di epidemiologia del PT... 152
12.3 Possibili candidati al PT e tipologie di PT ... 153
12.4 Tecniche chirurgiche ... 154
12.5 Sopravvivenza del paziente e dell’organo... 157
12.6 Pancreas graft rejection ... 158
12.7 Cenni di terapia immunosoppressiva ... 160
12.8 Rischio infettivologico ed oncologico ... 160
12.9 Effetti metabolici, sulle complicanze macrovascolari, sulle complicanze microvascolari... 160
13 SEZIONE SPERIMENTALE: SCOPO DELLO STUDIO... 167
14 MATERIALI E METODI ... 169
15 RISULTATI ... 181
16 DISCUSSIONE... 198
17 BIBLIOGRAFIA... 208
18 RINGRAZIAMENTI ... 244
1 INTRODUZIONE
La IFD (International Diabetes Federation) nel 2011 ha stimato la presenza di 366 milioni di diabetici in tutto il mondo, con la previsione che nel 2030 questa cifra possa salire a 552 milioni.
Negli USA, nel 2011 il diabete ha causato 4,6 milioni di morti e ha comportato l’11% della spesa sanitaria per gli adulti (fonte IDF: www.idf.org).
Il diabete si manifesta con i suoi segni e sintomi riferibili all’iperglicemia e con quelli riferibili alle sue complicanze, acute,che possono mettere il paziente a rischio per la vita, come l’ipoglicemia e la chetoacidosi diabetica, e croniche, a carico di diversi organi e sistemi, tra cui il rene, la retina, il sistema nervoso periferico, ed il sistema cardiovascolare. In ultimo, le complicanze del diabete possono portare ad una serie di eventi estremamente sfavorevoli,come alla perdita dell’acuità visiva, all’insufficienza renale terminale con necessità di dialisi/trapianto, all’amputazione degli arti inferiori, all’infarto miocardico e cerebrale (stroke).
In sintesi pertanto, il diabete comporta una ridotta sopravvivenza e una ridotta qualità della vita 12.
Il DCCT dimostrato che il controllo glicemico intensivo riduce le complicanze vascolari a lungo termine dell’iperglicemia nel DM1.
Sfortunatamente le complicanze del diabete continuano ad essere un’importante causa di morbidità e mortalità, e gli ECV rappresentano la principale causa di morte 3.
In aggiunta, un controllo aggressivo aumenta il rischio di ipoglicemie, nel DCCT più
Nelle ultime decadi tuttavia sono stati fatti importanti progressi tra cui, la diffusione della pratica del SMBG 6, lo sviluppo di analoghi dell’insulina con profilo farmacocinetico più favorevole 7, la dimostrazione dei benefici del trattamento intensivo sulle complicanze micro 3, 8 e macrovascolari 4, la terapia con pompa ad infusione sottocutanea, e recentemente il CGM.
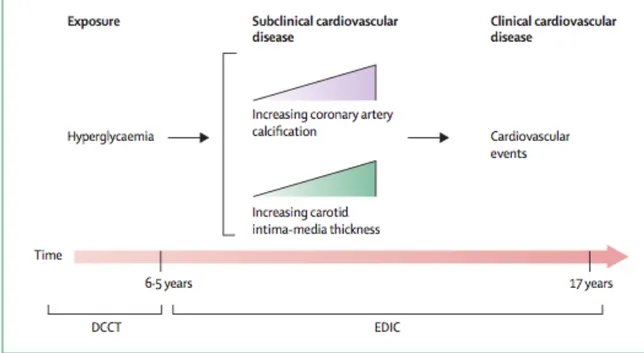
Mentre l’ipoglicemia continua ad essere l’ostacolo principale alla terapia insulinica intensiva, lo sviluppo di analoghi dell’insulina ad azione lenta o del CSII 9 ne hanno ridotto il rischio, rischio che verosimilmente si ridurrà ulteriormente con la diffusione del CGM 10. Quanto alle complicanze macrovascolari, lo studio DCCT/EDIC ha dimostrato che il controllo glicemico intensivo per un periodo medio di 6,5 anni riduce il rischio di ECV del 57 %, in un follow up di 17 anni 4.
Nonostante ciò, nella popolazione dei DM1 reale, e non quella ideale dei trials clinici, mentre il tasso di complicanze microvascolari ha subito una forte riduzione nella ultime decadi 11-13, non si può dire la stessa cosa della malattia macrovascolare e della CVD 3, 13. Con lo scopo di combattere questa tendenza, delle linee guida sono state pubblicate, allo scopo di prevenire la CVD nel giovane con DM114-17.
Queste linee guida sottolineano l’importanza di un controllo glicemico intensivo, ed il concomitante controllo di tutti gli altri fattori di rischio cardiovascolari tradizionali, tra cui profilo lipidico e pressorio18, il cui controllo purtoppo spesso non è raggiunto 19-21.
Come anticipato, il rischio di complicanze, una volta che il diabete è insorto, dipende molto dalla durata di malattia e dal grado di controllo glicemico.
A questo riguardo un preziosissimo strumento per il clinico è l’HbA1c, che offre una stima della glicemia negli ultimi 2-3 mesi.
L’Hb glicata però non è totalmente informativa, visto che un sottogruppo di individui, anche mantendendo valori ottimali, sviluppa complicanze.
Esiste una serie di possibili spiegazioni a riguardo, come ad esempio una verosimile suscettibilità individuale allo sviluppo delle complicanze, come si è visto per esempio per l’ “Haptoglobin genotype “ 22.
Un’altra possibilità è che un ruolo patogenetico possa essere svolto dalle fluttuazioni della glicemia, più che dal suo valore medio nel tempo stimato dalla HbA1c.
Se questa ipotesi fosse vera, vi sarebbero delle implicazioni nella gestione della terapia ipoglicemizzante.
Con i nuovi sistemi di monitoraggio, come il GCM queste oscillazioni potrebbero essere colte in maniera più compiuta, e con studi longitudinali di appropriata numerosità potrebbe esser possibile capire se queste svolgano un ruolo patogenetico o meno nello sviluppo delle complicanze croniche del DM 23-26.
Degna di nota è la relazione del DM con l’epidemia di Obesità.
L’aumento spaventoso dell’incidenza di obesità a livello mondiale, non solo incrementa il rischio di sviluppare DM2, dove l’insulino resistenza gioca il ruolo principale, ma non risparmia i DM1, sommandosi così il problema dell’insulino secrezione (da malattia autoimmunitaria) a quello dell’insulino resistenza, secondaria ad obesità, e configurando quindi la possibilità del “Double Diabetes”27.
Il link tra IR e Obesità è verosimilmente costituito dal rilascio di citochine infiammatorie da parte degli adipociti, come suggerito da una serie di studi.
Infine, potremmo ricordare alcune delle sfide degli ultimi anni nel campo del diabete mellito di tipo 1.
Una di queste consisterebbe nella possibilità di aggiungere aggiungere alla terapia insulinica nei DM1 agenti insulino-sensibilizzanti, come il GLP-1, la metformina, e altre terapie, le quali sono in corso di valutazione in appositi trials.
Un’altra sfida sarebbe quella di poter caratterizzare da un punto di vista genetico i soggetti diabetici, per valutare se ci sono particolari genotipi associati ad un maggior o minor rischio di sviluppare una certa complicanza e non un’altra, e magari poter ricevere un’apposita terapia.
E’ quanto si sta cercando di fare con l’ ”Haptoglobin genotype” 22.
Infine, vi è la possibilità, suggerita da studi della ricerca di base, che la l’iperglicemia attivi contestualmente molteplici vie molecolari che in ultimo portererebbero alle complicanze micro e macrovascolari e che tali vie, una volta attivate, non vengano spente da un eventuale miglioramento glicemico, compromettendo il recupero del tessuto28.
Se questa teoria, detta “teoria della memoria metabolica”, si dimostrasse vera, costituirebbe un enorme bene il poter disporre di terapie che vadano ad agire anche sugli “stressors” attivati dall’iperglicemia ma non spenti dal ritorno all’euglicemia.
Se questo fosse possibile, vi potrebbe essere anche una regressione del danno d’organo già instauratosi, dal punto di vista anatomo- ed istopatologico.
Purtoppo, allo stato dell’arte, non esistono nella pratica clinica terapie efficaci in questo senso.
Risultati promettenti però si stanno avendo col VEGF nella terapia dell’edema maculare, che può verificarsi in corso di retinopatia diabetica.
Risultati forti sembrano aversi infine anche col trapianto di pancreas, nei soggetti DM1, come suggerisce ad esempio il benefico effetto sulla funzione diastolica nel post-trapianto, a fronte dei costi rappresentati dai rischi chirurgici e dalla necessità di una terapia immunosoppressiva a vita.
La sezione sperimentale di questa tesi tratterà gli effetti del trapianto isolato di pancreas (TPA) sulla funzione cardiaca e sul profilo di rischio cardiovascolare, studio che presenta un gruppo di controllo rappresentato dai pazienti rimasti ancora in lista d’attesa al termine
Per concludere ricordiamo infine che, mentre la qualità di vita del paziente DM1 continua a migliorare, questi ha comunque un’aspettativa di vita ridotta rispetto alla popolazione generale, come dimostrato in una serie di studi 21, 29-31 e questo rappresenta un dramma, considerdando che purtoppo all’oggi non è possibile guarire dal DM1: non è possibile arrestare il processo autoimmunitario o restituire al paziente ciò che questi ha perso, dopo la distruzione beta cellulare. Attualmente vi sono ricerche in questo senso.
2 DEFINIZIONE DI DIABETE MELLITO
Il Diabete mellito comprende un gruppo di disturbi metabolici che tra loro condividono il fenotipo dell’iperglicemia, per un difetto di secrezione dell’insulina o della sua azione, presenti in differente grado.
L’alterazione metabolica associata al DM causa una serie di modificazioni fisiopatologiche in vari organi e sistemi, con un enorme impatto sull’individuo affetto e sul sistema sanitario che lo prende in carico.
Negli USA, il DM è la principale causa di insufficienza renale terminale, di amputazione non traumatica degli arti inferiori e di cecità nell’adulto.
Esso inoltre predispone alle malattie cardiovascolari.
Per via della crescente incidenza e prevalenza a livello mondiale, nel prossimo futuro il DM continuerà ad essere un importantissima causa di mortalità e morbidità 32.
3 CENNI STORICI
Il termine diabete deriva dal greco “diabaino” vale a dire “passare attraverso” con riferimento al passaggio dello zucchero nelle urine.
Da almeno quattromila anni, la condizione patologica del diabete è conosciuta in campo medico, e la prima evidenza storica è riportata nel papiro egizio di Ebers, scritto intorno al 1550 A.C., nel quale si identifica la poliuria come sintomo e si consigliano alcuni rimedi per combattere l’eccessivo bisogno di urinare, non risulta tuttavia ancora presente la differenziazione tra diabete mellito e diabete insipido.
Successivamente, testi indiani risalenti al 800-600 A.C. riportavano nell'Ayur Veda che gli insetti e le mosche erano attratti dall'urina di alcune persone, la quale aveva un gusto dolce, e che questo era associabile a certi disturbi.
Il gusto dolce delle urine rimase per secoli un elemento fondamentale della semeiotica medica. Si sarebbe dovuto attendere il II secolo d.C. quando Areteo di Cappadocia, nel suo famoso trattato "Sul Diabete" operò una sintesi di conoscenze fino allora note, differenziando chiaramente le condizioni di diabete mellito e diabete insipido. Si ritiene che Areteo sia stato il primo a coniare il termine "diabete", con riferimento al passaggio delle sostanze dolci nelle urine dei malati.
Egli, infatti, descrive il diabete come “ lo scioglimento delle membra e della carne nell’urina”. Questo lavoro rimase un classico testo per l'insegnamento e la pratica medica
Infatti, l'illustre medico italiano Giovan Battista Morgagni (1682-1771)
scrisse nel 1761 vari capitoli dedicati alla descrizione, diagnosi, terapia e persino le cause (patogenesi) della malattia diabetica nelle sue varie manifestazioni. La maggior parte delle informazioni riportate dal Morgagni risalgono chiaramente ad Areteo e l'unico sostanziale innovamento riguardava cenni alla restrizione dietetica dei pazienti, che non era descritta nei testi classici.
Inoltre, il Morgagni scrisse con grande intuito scientifico: “La causa (del diabete) non può essere una”. Questa frase accuratamente descrive lo stato attuale delle conoscenze sulla patogenesi del diabete, che è considerato avere molteplici origini.
1859. Claude Bernard dimostrò l’aumentato contenuto in glucosio del sangue diabetico, e riconobbe nell’iperglicemia la manifestazione fenotipica principale del diabete.
1869. Langherans, ancora studente di medicina, descrisse le formazioni insulari all’interno del parenchima pancreatico che ora portano il suo nome.
1889. Von Mehring e Minkowski dimostrarono che i cani potevano essere resi diabetici tramite la pancreasectomia.
1921. Dopo la morte di numerosi cani da esperimento, Banting e Best riuscirono finalmente a tenere in vita un animale i cui dotti pancreatici erano stati legati e la cui porzione esocrina del pancreas era degenerata.
L’estratto ricavato dalla restante porzione di pancreas fu in grado di abbassare rapidamente la concentrazione di glucosio nel sangue e nelle urine di un cane diabetico pancreasectomizzato; un secondo cane diabetico era prossimo al coma e dopo la somministrazione dell’estratto riprese a camminare.
1922. Un ragazzo diabetico di 14 anni ricevette l’estratto pancreatico purificato e migliorò immediatamente.
4 CLASSIFICAZIONE DEL DIABETE MELLITO
Il DM è attualmente classificato da OMS e ADA (linee guida 201418) sulla base di criteri patogenetici, ovvero in base al meccanismo patogenetico col quale insorge l’iperglicemia, piuttosto che su criteri usati in passato quali l’età d’esordio od il tipo di terapia.
Abbiamo quattro principali categorie eziologiche: il Diabete di tipo 1, il Diabete di tipo 2, altri tipi specifici di diabete ed infine il diabete gestazionale.
I) DM di tipo 1:
distruzione beta cellulare che porta a progressivamente ad una completa insufficienza insulinica. A sua volta riconosciamo due forme:
A. Immunomediata; B. Idiopatica
II) DM di tipo 2:
può variare da una forma con predominante insulino-resistenza ed insufficiente produzione insulinica compensatoria, ad una forma in cui il difetto secretorio prevale sull’insulino-resistenza.
III) Altri tipi specifici di diabete: include concettualmente
- rare forme causate da mutazioni su singoli geni, ad esempio il MODY (‘matury-onset DM of the young’ , che a sua volta racchiude in se numerose varianti, a seconda
- DM secondario ad altre condizioni patologiche.
Ad esempio post-pancreatite grave, trauma o chirurgia del pancreas; secondario ad endocrinopatie come ad esempio l’acromegalia, la sindrome di cushing, il glucagonoma; ad infezioni (rosolia congenita, citomegalovirus, coxackie virus);
- Indotto da farmaci (es. glucocorticoidi, agonisti beta adrenergici, tiazidici, fenitoina, interferon-alpha, clozapina) o da veleni come il Vacor.
IV)Diabete gestazionale:
insorge durante la gravidanza. Dopo il parto, la puerpera ritorna in uno stato euglicemico, ma vi è un aumentato rischio di sviluppare in futuro DM2.
5 EPIDEMIOLOGIA DEL DIABETE MELLITO
Nel 2011 la prevalenza mondiale del DM è approssimativamente di 360 milioni, e questo numero sembra destinato a salire a 552 milioni nel 2030.
Di questi circa il 95 % ha DM2 32, 34,35.
Inoltre si stima che altri 300 milioni di individui abbiano un fenotipo metabolico a rischio per il DM2, con IGT (impaired glucose tolerance), DMG e IR con euglicemia (dati della IDF, International Diabetes Association).
DM1 e DM2 insieme costituiscono la quasi totalità dei pazienti diabetici, con DM1 tra il 5-10 % ed il DM2 tra il 90 ed il 95 %.
Sebbene l’incidenza di entrambi sia in aumento, quella del tipo 2 maggiormente di quella di tipo 1, per via della sempre più importante diffusione di uno stile di vita “occidentale “ nei paesi in via di sviluppo, con la dilagante pandemia di obesità ed uno stile di vita sempre più sedentario.
5.1 Cenni di epidemiologia sul DM2
E’ la forma principale di diabete nell’adulto, anche se negli ultimi decenni si sta assistendo ad un’anticipazione dell’esordio, per i motivi accennati sopra.
La prevalenza del DM2 al di sopra dei 20 anni è stata stimata del 4,5 %, e varia a seconda della fascia d’età: dall’ 1,5 % trai 20 ed i 39 anni, al 20 % negli individui al di sopra dei 75 anni.
5.2 Epidemiologia e fattori di rischio del DM1
Il Diabete di tipo 1 2 è un disturbo caratterizzato dalla distruzione delle beta cellule pancreatiche, che culmina con la totale perdita di produzione insulinica.
Nella maggior parte dei casi si tratta di un disturbo di natura immunologica (tipo 1A) mentre in una piccola parte dei casi si ha una perdita o insufficienza delle beta cellule idiopatica (tipo 1B).
L’ipotesi eziologica più accreditata è che una serie di fattori ambientali, non ancora ben definiti, inneschi un processo autoimmunitario a carico delle beta cellule, in soggetti geneticamente predisposti, sebbene esistano ipotesi alternative 36, 37.
Di qui l’importanza dei vari studi epidemiologici fatti, che hanno tentato di chiarire l’importanza relativa dell’ambiente e della genetica.
Il DM1 comprende il 5-10 % dei casi totali di diabete 38.
Molto più comune è il DM2 caratterizzato da una combinazione di resistenza all’azione dell’insulina e inadeguata secrezione compensatoria, pertanto qui abbiamo uno squilibrio tra insulino resistenza ed insulino secrezione, ma l’insulino resistenza è il primum movens. Il DM1 è stato, e continua ad essere, la più frequente forma di diabete nel bambino e nell’adolescente, sebbene, con la pandemia di obesità, il DM2 stia divenendo più frequente che nel passato trai ragazzi 39, 40.
Incidenza e prevalenza del DM1
La sua prevalenza è approssimamente di 1 su 300 giovani negli US al di sotto dei 18 anni; per quanto riguarda l’incidenza, studi epidemiologici importanti suggeriscono un aumento del 2-5 % annuale.
Trai più importanti studi epidemiologici citiamo il progetto DIAMOND della WHO 41 42, l’EURODIAB 4344, lo studio SEARCH 39, 40.
Lo studio DIAMOND, cominciò nel 1990, per iniziativa della WHO, con lo scopo di stabilire l’incidenza del DM1.
In un primo resoconto, del 2000, veniva riportata l’incidenza dal 1990 al 1994 del DM1 in ragazzi al di sotto dei 14 anni, in 50 paesi, per un numero totale di 19164 casi su 75 milioni di bambini 41. Un dato importante era la spiccata variabilità dell’incidenza da un paese all’altro.
Si andava per esempio dallo 0,1/100000 l’anno in Cina e Venezuela, al 36,5/100000 l’anno della Finlandia e al 36,8/100000 l’anno della Sardegna.
I valori più bassi erano riportati in Cina e Sud America, quelli più alti in Sardegna, Finlandia, Svezia, Norvegia, Portogallo, UK, Canada e Nuova Zelanda.
Si notò anche anche all’interno di uno stesso paese poteva esistere una spiccata variabilità. Un esempio è offerto proprio dall’Italia, dove in Sardegna si ha un incidenza molto maggiore che nel resto dell’Italia.
La fascia d’età con più alta incidenza era 10-14 anni. Non vennero riscontrate significative differenze di genere.
Gli autori dello studio ipotizzarono che le differenze tra un paese all’altro 45, 46 fossero riconducibili a differenze nella genetica e nei fattori ambientali.
Lo studio statunitense SEARCH invece, che arruolò giovani al di sotto dei 20 anni, aveva invece l’obiettivo di valutare come variavano incidenza e prevalenza del DM1 in base all’età, sesso e razza.
Andamento nel tempo
Dallo studio DIAMOND, SEARCH ed EURODIAB risultati abbastanza concordanti nel senso di un aumento nel tempo dell’incidenza, approssimatamente del 2-5 % annuo.
Fattori di rischio per lo sviluppo di DM1 Età, sesso, razza, genotipo, stagionalità.
Età
Il DM1 è il principale tipo di diabete nel giovane, prendendo più dell’ 85 % di tutti i casi di DM al di sotto dei 20 anni 39.
Quanto al tasso di incidenza per fascia d’età, esso cresce progressivamente a partire dalla nascita, per raggiungere il massimo valore trai 10 ed i 14 anni 40, 42, ed infine decresce, senza però mai azzerarsi.
Infatti un quarto delle diagnosi è fatta nell’adulto 47 e vi sono casi aneddotici diagnosi nella nona decade di vita 46.
Il 10% degli adulti inizialmente diagnosticati come DM2, sono poi successivamente riclassificati come DM1, dopo aver cercato gli anticorpi tipici del DM148.
Quando insorge nell’adulto, generalmente la distruzione delle cellule beta è più lenta che nei casi ad esordio giovanile, col prolungamento quindi del periodo di “honey moon”.
Genere
Nonostante le patologie autoimmuni siano di gran lunga più frequenti nel sesso femminile, nel DM1, quando esso colpisce il giovane, non vi sono differenze di genere 49, quando invece colpisce nell’età adulta, sembra preferire il sesso maschile (perlomeno negli europei)5051-53.
Razza
Questo legame è stato ben esplorato nello studio SEARCH, su 9174 giovani americani, appartenenti a diverse etnie/razze
Dallo studio è emerso che esiste una certa differenza di prevalenza ed incidenza tra le diverse razze e si è visto che ad esempio i bianchi non ispanici erano più colpiti degli afroamericani, i quali a loro volta erano più colpiti degli ispanici.
Trai vari geni che possono avere un ruolo predisponente (o protettivo) verso il DM1, i più importanti sono sicuramente quelli del complesso HLA (Human leukocyte antigen) sul cromosoma 6, ed in particolare HLA di classe II.
Ci sono due aplotipi HLA II considerati a forte rischio di DM1 54.
Tuttavia, sebbene circa il 90-95 % dei giovani con DM1 presenti uno o entrambi gli aplotipi a rischio, tra quelli che li presentano, solo una piccolissima quota (< 5 %) sviluppa DM1.
Contano poi anche altri geni 54, 55.
Il ruolo della genetica è confermato anche da una serie di elementi, tra cui la familiarità e la forte differenza di concordanza tra gemelli omozigoti ed eterozigoti 56.
Quanto al primo punto, sebbene la maggior parte dei nuovi casi di DM1 sorgano in individui con anamnesi familiare muta, soggetti che hanno un parente di primo grado con DM1 hanno un rischio di sviluppare la stessa malattia nel corso della vita di 1 a 20, contro l’1 a 300 della popolazione generale 57.
Infine è stata stabilita un’associazione tra DM1 ed altre malattie autoimmuni, a carico di altri organi come tiroide, surrene, stomaco 58.
Stagionalità
Specialmente nello studio SEARCH è emersa una certa stagionalità.
In altre parole, l’esordio era più frequente in certi mesi dell’anno che in altri: picco in tardo autunno, inverno e primavera 59, e probabilmente alla base c’è la stagionalità delle infezioni virali che fanno da trigger al processo autoimmune.
Inoltre l’insorgenza di DM1 si è vista essere più frequente in quegli individui nati nei mesi primaverili-estivi che in quelli nati in autunno – inverno 60.
La supplementazione con olio di fegato di merluzzo (ricco in Vitamina D) durante la gravidanza 63 e nel primo anno di vita 64 sembra comportare un minor rischio di sviluppare DM1.
Altri fattori di rischio
Quali siano i trigger ambientali che innescano il processo autoimmune non è ben noto. Molto è stata studiata l’influenza della dieta, senza però ottenere risultati forti.
Ad esempio i risultati della precoce introduzione di latte vaccino nella dieta del lattante sono equivoci 65-68, così come per l’introduzione del glutine 69-71.
Sembra che la supplementazione con Vit D durante la gravidanza 72 ed in età pediatrica 73 riduca il rischio di sviluppare fenomeni autoimmunitari tra cui il DM1, anche se le evidenze non sono poi così schiaccianti da consigliarne la supplementazione per questo motivo.
6 EZIOPATOGENESI DEL DM1
6.1 Fasi della distruzione beta-cellulare
Nel DM1 si assiste a distruzione beta cellulare, con progressiva insufficienza insulinica, che al termine del processo è completa32.
La forma 1A ha patogenesi autoimmune, mentre nella 1B la causa del processo è sconosciuta. Nella forma 1A, si ritiene in sintesi che fattori ambientali non ben identificati, fungano da trigger per un processo autoimmune, progressivo, T-helper driven.
Come solitamente avviene per le malattie autoimmunitarie, frequentemente il DM1 si associa ad altre malattie autoimmuni, come la M.di Addison, M.di Graves, la tiroidite di Hashimoto, la celiachia, la gastrite autoimmune, ma, differentemente da quanto accade di solito per queste, non è più frequente nel sesso femminile.
Come descritto nel paragrafo sull’epidemiologia, è la forma più frequente in età pediatrica, tanto che in passato la sua dizione alternativa era “Diabete Giovanile “. Questa terminologia può però esser ingannevole,dal momento che un quasi quarto dei casi insorge nell’adulto, e comunque, anche se raramente può colpire ad ogni età.
Nella storia naturale del DM1A riconosciamo,schematizzando, cinque fasi, come si può notare dalla figura:
Fig. 6.1. Fasi della distruzione beta-cellulare.Tratta da Harrison et al.,18°edizione
1)Fase della suscettibilità genetica
Non è ancora intervenuto il trigger ambientale. Abbiamo solo un maggior rischio rispetto alla popolazione generale di sviluppare DM1 in futuro per via di una genetica sfavorevole. Come anticipato, circa la metà del rischio genetico è imputabile alla presenza di certi aplotipi HLA anzicchè altri (HLA DR 3 e/o HLA DR 4),la rimanente metà ad altri geni.
2)Evento precipitante
Solo una minoranza dei pazienti con suscettibiità genetica sviluppa DM1.
In questi, si suppone che un evento ambientale, non ancora identificato, inneschi, secondo modalità non ancora perfettamente conosciute, il processo autoimmune.
Va anche considerato che un’ulteriore difficoltà è posta dal fatto che tra inizio del processo autoimmune e l’esordio clinico del DM1 passano mesi/anni, e questo aspetto rende più difficile trovare il nesso causale.
Finora sono state fatte varie ipotesi,e trai possibili agenti trigger possiamo citare alcuni virus (in particolare il virus della rosolia ed i coxsackie virus), alcuni alimenti, come le proteine del latte vaccino, il consumo di patate (forse per le tossine di streptomyces che le contaminano)74 ed altro, di cui si è parlato precedentemente.
3) Evidenze di processo autoimmune in atto
Compaiono gli anticorpi diretti contro antigeni espressi dalle beta-cellule e compaiono le alterazioni istopatologiche dell’insulite, ovvero, se si facesse una biopsia pancreatica per studiare gli Isolotti di Langherans (manovra che non va fatta nella pratica clinica quotidiana), si osserverebbe una flogosi delle insule pancreatiche, con infiltrato
infiammatorio, costituito da linfociti T helper, CTL, macrofagi ed alti livelli locali di citochine infiammatorie, come ad esempio il TNF-alfa, IFN-gamma,IL-1.
Gli autoanticorpi non hanno un ruolo distruttivo, a differenza dei linfociti T autoreattivi, il cui effetto tossico sembra essere perlomeno in parte mediato dalle sovracitate citochine.
4) Presenza di anomalie metaboliche iniziali
Col progredire del processo autoimmune ed il ridursi del patrimonio beta-cellulare, compaiono delle anomalie pre-cliniche, evidenziabili con dei test di laboratorio (che però non vengono normalmente usati nella pratica clinica).
Si perde infatti la pulsatilità della secrezione insulinica ed il picco precoce a seguito di carico endovenoso di glucosio.
5) Esordio clinico della malattia
Avviene quando l’80-90 % del patrimonio beta cellulare è distrutto.
In genere l’esordio clinico avviene nel corso di eventi che comportano un aumento delle richieste di insulina, come ad esempio durante la pubertà o durante infezioni intercorrenti. La velocità di distruzione beta cellulare varia da individuo ad individuo, in alcuni è più lenta, in altri è più veloce.
Dopo la presentazione clinica vi può essere una fase di “honey moon”, durante la quale, per via del permanere di una piccola quota di beta cellule, il controllo glicemico è ottenuto con un dosaggio di insulina modesto. Tuttavia questa fase, se c’è, non dura in eterno. Per certi versi,questo aspetto ci ricorda la terapia del Parkinson con L-DOPA.
6.2 Significato degli autoanticorpi
Gli autoanticorpi nel diabete mellito di tipo 1 non hanno un ruolo patogenetico, bensì possono avere valore diagnostico, in quanto marker di un processo autoimmune in atto, e
prognostico, perché entro certi limiti, danno qualche informazione sul rischio futuro di sviluppare DM1.
Sono detti ICA (Islet Cell Autoantibodies), e sono un gruppo di autoanticorpi diretti contro diversi epitopi espressi dalle isole pancreatiche, tra cui il GAD (decarbossilasi dell’acido glutammico), l’insulina, l’IA-2/ICA-512 ed un ganglioside insulare.
In commercio vi sono metodi per determinare il titolo anticorpale anti-GAD 65.
Qual è il loro significato clinico ?
Permettono di classificare il DM come di tipo 1, e permettono di identificare trai soggetti non diabetici, quelli a rischio di sviluppare DM1.
Qualche dato:
-gli ICA sono presenti nella maggioranza degli individui con diabete di recente insorgenza (>75 %), ma anche nel 5-10 % degli individui con DM 2 e nel 3-4 % dei parenti di primo grado di individui affetti da DM1.
-in uno studio recente 75, 76 si è valutato il rischio di progressione del diabete dal momento della sieroconversione verso la positività degli ICA, in tre coorti pediatriche da Finlandia, Germania ed USA.
Tra questi, 585 erano positivi ad almeno due tipologie di ICA e di questi il 70 % sviluppò DM1 nei 10 anni successivi, e l’84 % nei 15 anni successivi.
Questo dato significa che all’aumentare del numero di classi ICA +, aumenta la probabilità di sviluppare DM1.
Un altro dato importante emerso da questo studio è che, una volta avutasi la sieroconversione (ICA+), il rischio di sviluppare DM1 era simile in chi aveva familiarità per DM1 ed in chi non ce l’aveva.
Quindi la sequenza degli eventi che porta a sviluppare DM1 sembra essere la stessa nei casi sporadici ed in quelli familiari.
Altro studio: se vi è anche un’ alterata secrezione insulinica, vi è un rischio del 50 % di sviluppare DM1 nell’arco dei successivi 5 anni; se invece la secrezione insulinica è normale, il rischio scende al 25 %.
Quale da un punto di vista clinico è il comportamento indicato? Dalle raccomandazioni dell’ADA 2014 18 ecco una possibile risposta:
dal momento che positività agli ICA non significa certezza di sviluppare DM1, e poichè nessun trattamento si è dimostrato in grado di prevenire la comparsa o ritardare la progressione del diabete di tipo 1 (nonostante siano in corso studi clinici per testare metodi che abbiano lo scopo di prevenire l’insorgenza di DM1 in chi ha evidenze di autoimmunità ,www.clinicaltrials.gov), la ricerca degli ICA non è raccomandata di routine nella popolazione generale.
Tuttavia, si potrebbe considerare l’opzione di screenare i parenti di soggetti DM1 (altro rischio), ma solo nell’ambito di programmi di ricerca18, 32 .
6.3 Eziopatogenesi del DM1 B
L’eziopatogenesi è ignota : si assiste a progressiva distruzione beta cellulare, senza che sia osservabile la presenza di un qualche marker di processo autoimmune in atto (es.ICA) o l’associazione con gli aplotipi HLA a rischio.
7 QUADRO CLINICO D’ESORDIO DEL DM1 E
DIAGNOSI
Mentre il processo autoimmune si realizza in un tempo relativamente lungo, nell’ordine di mesi/anni, l’esordio clinico del DM1 è generalmente improvviso, a differenza di quanto accade nel DM2, tanto che in quest’ultimo non è infrequente che alla diagnosi siano presenti già alcune delle classiche complicanze croniche come la nefropatia.
L’esordio spesso si realizza durante condizioni che provocano insulino-resistenza come malattie intercorrenti, traumi, stress, ecc.
Si manifesta con i sintomi della poliuria , nicturia, polidipsia, polifagia con calo ponderale, astenia e col tempo ritardo di crescita.
Non raramente si presenta con la complicanza acuta della chetoacidosi diabetica, situazione a rischio per la vita del paziente, e questo si verifica soprattutto in quelle aree in cui non vi è una diffusa educazione al riconoscimento dei sintomi del DM1, sia da parte dei pediatri che dei genitori.
Nello studio EURODIAB è stata valutata la modalità d’esordio clinico del DM1, in 24 centri in europa, per un numero totale di 1260 casi77.
Si è visto che la poliuria era il sintomo più frequente (96 %),seguito dalla perdita di peso (61 %) e dall’astenia (52%).
La durata dei sintomi era inferiore alle due settimane solo nel 25 % dei pazienti, dato che suggerisce che l’educazione sia del genitore che del pediatra nel riconoscere i sintomi, potrebbe permettere un’anticipazione della diagnosi, riducendo così il rischio e la gravità di complicanze acute come ad esempio la DKA.
La DKA infatti è stata la manifestazione d’esordio in ben il 43 % dei casi, e tra questi, il 33 % aveva un pH tra 7,3 e 7,1, il 9% aveva un pH inferiore a 7,1, pertanto una condizione di acidosi molto importante e pericolosa per la vita.
L’iperglicemia fa si che venga superata la soglia di riassorbimento tubulare renale del glucosio (180 mg/dl) e questo fa si che con le urine si perda glucosio.
Il glucosio è però una sostanza osmoticamente attiva, e con se trascina acqua, di quì la poliuria, da cui l’origine del nome ”diabete mellito”, con “diabete” per il “passare attraverso “, e “mellito” perché l’urina è dolce, differentemente da quello “ insipido “, che ha tutt’altra eziopatogenesi e presentazione clinica, con l’unico elemento a comune rappresentato dalla poliuria.
L’aumentato flusso urinario, può far si che il paziente (generalmente in età pediatrica), debba alzarsi di notte per mingere (nicturia), o che ricompaia l’enuresi dopo una fase di avvenuta acquisizione del controllo sfinteriale notturno. La poliuria determina polidipsia compensatoria, per attivazione del centro della sete, da riduzione della volemia ed aumento dell’osmolarità plasmatica.
Non potendo utilizzare il glucosio extracellurare, la cellula è costretta a demolire il suo patrimonio lipidico e proteico.
Per quanto riguarda il primo punto, questo porta ad un eccesso relativo di Acetil-CoA rispetto alle concentrazioni degli intermedi del Ciclo di Krebs; Acetil-CoA che verrà dirottato verso la Chetogenesi, con aumento della Chetonemia e della Chetonuria.
Per quanto riguarda il secondo punto, si assisterà ad una lisi delle proteine muscolari, che determinerà calo ponderale, nonostante si tenti il compenso con l’iperfagia, e l’astenia, sintomo quest’ultimo molto comune.
Alla lunga, se la situazione non verrà trattata, si avrà, oltre alle famose complicanze micro e macrovascolari, anche un ritardo di accrescimento staturo-ponderale (se il diabete
La storia naturale del diabete di tipo 1A è caratterizzata dalla progressiva distruzione beta cellulare, e quindi dal crescente bisogno di insulina esogena per sopperire al deficit endogeno.
L’identificazione dei pazienti a rischio di processo autoimmunitario a carico delle cellule beta e la scoperta di strategie per rallentarlo, fino a frenarlo, sono dei punti importanti dell’attuale ricerca scientifica, come è possibile osservare ad esempio nel lavori di Bonifacio e Ziegler.
All’esordio clinico della malattia, in genere è possibile osservare la presenza di una residua quota beta cellulare, in alcuni più cospicua che in altri. Questa quota permette di non usare dosaggi massimali di insulina esogena sin dall’inizio, ed il periodo in cui ciò è possibile è detto “honey moon”, al termine dello stesso, avremo livelli indosabili di C-peptide.
Nuovi criteri diagnostici (ADA 2014)
Premessa: il diabete mellito può solo esser sospettato clinicamente, ma la conferma diagnostica è solo laboratoristica 18.
La diagnosi di diabete mellito finora si è basata sul livelli plasmatici di glucosio, o della glicemia a digiuno [FPG = Fasting Plasma Glucose ] o della glicemia post-prandiale [2-h-PG = 2-h Plasma Glucose ] ovvero il valore glicemico misurato due ore dopo carico orale di glucosio (75 g) [OGTT = Oral Glucose Tolerance Test ] .
La novità è che recentemente è stata incluso il valore di HbA1c come terza opzione per la diagnosi di diabete mellito, con valore soglia del 6,5 % 417.
Fig 7.1. Tratta da Linee Guida ADA 2014
8 COMPLICANZE ACUTE E CRONICHE DEL DM1
8.1 Complicanze acute del DM1
Si possono classificare in base alla patogenesi in Iperglicemiche ed Ipoglicemiche.
Tra le iperglicemiche, la chetoacidosi diabetica è tipica del DM1, mentre lo stato iperosmolare iperglicemico è tipico del DM2.
Chetoacidosi Diabetica
Può anche essere la modalità di esordio del DM1, come anticipato, specie in quelle aree con scarsa educazione dei medici curanti e di conseguenza dei genitori al riconoscimento dei sintomi del DM.
Clinica
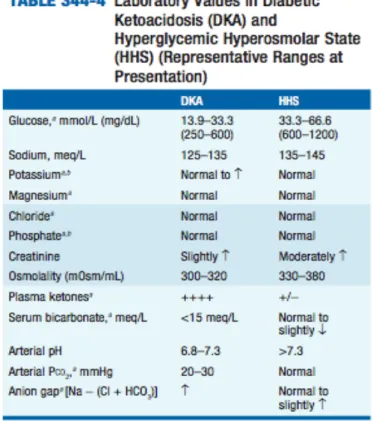
Un riassunto dei sintomi e delle condizioni cliniche precipitanti è scritto in tabella:
Fig 8.1. Tratta da Harrison et al., Principi di medicina interna, 18° edizione
Molto frequenti la nausea ed il vomito, il cui riscontro in un soggetto diabetico deve indurre all’esecuzione di ulteriori indagini di laboratorio.
Può esserci dolore addominale, che può simulare quello di un addome acuto chirurgico, ricordando ad esempio quello di una pancreatite acuta (dirimenti saranno gli esami di laboratorio, con amilasi pancreatica e lipasi normali) o di una perforazione intestinale. L’iperglicemia importante determina glicosuria e quindi ipovolemia, con tachicardia compensatoria nel tentativo di mantenere una valida pressione di perfusione tissutale. L’ipotensione è il risultato non solo della deplezione di volume circolante, ma anche della vasodilatazione periferica indotta dall’acidosi (metabolica).
Si assiste a tachipnea, nel tentativo di compensare l’acidosi metabolica con un’ aumentata eliminazione di acidi volatili, come l’anidride carbonica; vi è il caratteristico respiro di Kussmaul (atti respiratori rapidi e profondi) e l’alito ha il classico odore di frutta fermentata, per l’eliminazione polmonare dell’Acetone, l’unico corpo chetonico volatile.
Si ha generalmente un’alterazione dello stato mentale, nel senso della letargia, che può evolvere fino al coma. In questi casi tuttavia è bene escludere altre cause di alterazione dello stato di coscienza, come infezioni, ipossia, ecc.
Una gravissima complicanza della chetoacidosi diabetica è l’edema cerebrale, più frequente nei bambini.
I segni di un’infezione, che può precipitare la DKA, vanno sempre ricercati durante l’esame obiettivo.
Anche eventi ischemici possono (IMA,ictus) essere fattori precipitanti.
Per capire cosa scatena la DKA e quindi i fattori precipitanti, prima bisogna comprendere la sua fisiopatologia. Brevemente la DKA è il risultato della combinazione di due elementi:
carenza insulinica, relativa o assoluta, ed eccesso di ormoni controinsulari (glucagone
principalmente,ma anche cortisolo e ormone della crescita).
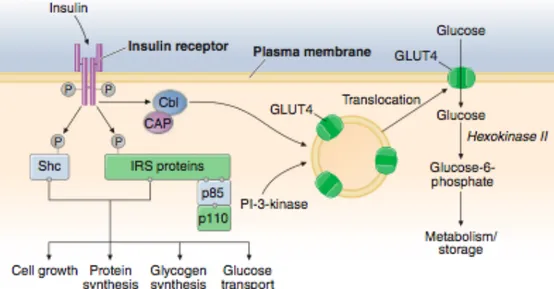
Il ridotto rapporto insulina/glucagone, favorisce la gluconeogenesi, la glicogenolisi, la formazione di corpi chetonici nel fegato, oltre che incrementare il rilascio di substrati dal tessuto adiposo e dal muscolo scheletrico (acidi grassi liberi, amminoacidi) verso il fegato. Contestualmente la carenza di insulina riduce i livelli di GLUT 4, il che riduce l’utilizzo del glucosio nel muscolo scheletrico e tessuto adiposo e quindi il metabolismo glucidico intracellulare.
Fig. 8.2. Tratta da Harrison et al., Principi di medicina interna, 18° edizione
Questo spiega la triade laboratoristica fondamentale della DKA, ovvero
-iperglicemia (250-600 mg/dl), versus lo stato iperosmolare iperglicemico, dove i livelli glicemici sono ancora più alti (600-1200 mg/dl);
-chetosi, cioè aumentati livelli di corpi chetonici circolanti;
-acidosi, perché i corpi chetonici sono composti acidi. Si pensi solo al loro nome: acido acetoacetico, acido beta-idrossi butirrico; eccezione è l’acetone (l’unico non acido, è un chetone).
Da ciò è intuibile come la DKA sia precipitata da tutti quegli eventi che acutamente riducono il rapporto insulina/glucagone:
ad esempio una malattia intercorrente come un’infezione (es. polmonite,IVU,
insulina; l’incapacità di implementare contestualmente il dosaggio dell’insulina fa parte del problema.
Altre cause possibili sono la completa sospensione della terapia insulinica per decisione del paziente; oppure per esempio sono a rischio quegli individui che fanno CSII con preparati a breve emivita, perché anche una breve interruzione della somministrazione di insulina, per esempio a causa di un malfunzionamento meccanico, porta rapidamente ad insufficienza insulinica.
Laboratorio
Il laboratorio aiuta molto nella diagnosi e nella diagnosi differenziale.
Oltre alla triade citata, patognomonica, troveremo una serie di incostanti alterazioni minori, ma comunque indicative.
Ricordiamo che ci troviamo nel corso di un’acidosi metabolica, anche se un’iperventilazione compensatoria potrebbe portarci ad uno di quei cosìdetti ‘stati misti’. Utili i dati dell’emogasanalisi, in cui troveremo una riduzione dei bicarbonati, un aumento del gap anionico (per consumo dei bicarbonati), una PaCO2 ridotta (per l’iperventilazione
compensatoria).
I depositi corporei di potassio, sodio, cloro, fosforo, magnesio sono ridotti nella DKA, per la perdita urinaria e col vomito; questo però non si riflette con accuratezza nei livelli sierici di queste sostanze a causa della disidratazione.
Inoltre l’acidosi contribuisce ad aumentare i livelli di potassio (per via dello scambiatore H+/K+ sulle membrane cellulari), quindi nonostante le perdite può risultare normale o aumentato.
L’osmolarità sierica, calcolata con la formula
[ 2 x (sodiemia + potassiemia) + (glicemia in mg su dl/18)+ (azotemia/2,8) ] è lievemente aumentata, anche se ad un grado di gran lunga inferiore rispetto a quello che si riscontra nello stato iperosmolare iperglicemico.
Va infine detto che il grado di acidosi e quello di iperglicemia, non necessariamente sono strettamente correlati: un gran numero di fattori determina i livelli di glicemia (apporto orale, perdita urinaria di glucosio).
La chetosi è aspetto cruciale della DKA perché la distingue dalla semplice iperglicemia. La diagnosi differenziale comprende infine la chetosi da digiuno, la chetoacidosi alcolica (con bicarbonati solitamente > 15 mEq/L) ed altre forme di acidosi con aumentato anion-gap.
Cenni di terapia della DKA
Prognosi
Con adeguato trattamento, la mortalità della DKA è bassa (< 5 %) ed è maggiormente correlata all’evento sottostante o precipitante , come un ‘ infezione od un infarto del miocardio.
La principale complicanza del trattamento della DKA è l’edema cerebrale, che spesso si sviluppa nel bambino, quando la DKA si sta risolvendo.
L’eziologia ed il trattamento ottimale dell’edema cerebrale non sono ben stabiliti, ma in ogni caso bisogna evitare un carico eccessivo di acqua libera.
Dopo il trattamento, medico e paziente dovrebbero rivedere la sequenza degli eventi che ha portato alla DKA, e soprattutto il paziente dovrebbe essere istruito nel riconoscere i sintomi della DKA, sui fattori precipitanti e sulla gestione della terapia in presenza di malattie concomitanti.
Durante una malattia o quando l’alimentazione per via orale orale è compromessa, i pazienti dovrebbero:
1)Monitorare frequentemente la glicemia;
2)Misurare i chetoni urinari se glicemia > 300 mg/dl; 3)Assumere liquidi per mantenere una buona idratazione; 4)Continuare con la stessa dose o aumentare l’insulina;
5)Recarsi dal medico di famiglia se si sviluppano disidratazione, vomito persistente o iperglicemia incontrollata 32.
Ipoglicemia
Essa costituisce il più comune e grave effetto indesiderato della terapia insulinica, danno evitabile, anche se a fronte di altri costi, col trapianto di pancreas.
L’ipoglicemia è di solito documentata in modo convincente dalla triade di Whipple 32 1) sintomi compatibili con l’ipoglicemia;
2) bassa concentrazione di glucosio misurata con metodica precisa (non con monitoraggio glicemico capillare);
3) risoluzione dei sintomi dopo ritorno all’euglicemia.
Il limite inferiore viene generalmente considerato 70 mg/dl (3,9 mmol/l), anche se in realtà, anche fisiologicamente, si possono raggiungere livelli venosi di glucosio ancor più bassi lontano dai pasti.
Valori al di sotto dei 55 mg/dl (3 mmol/l) con sintomatologia che prontamente regredisce con l’aumento dei livelli,confermano l’ipoglicemia.
Essa rappresenta il più comune effetto indesiderato della terapia insulinica nel DM1787932, sebbene tuttavia, di fronte ad un paziente diabetico ipoglicemico sia d’uopo considerare nella diagnosi differenziale tutte le altre possibili condizioni che posson provocare ipoglicemia, ad esempio insulinomi, deficit di ormoni controinsulari come glucagone e adrenalina, ed altro.
Fig. 8.4. Tratta da Harrison et al., Principi di medicina interna, 18° edizione
Considerare infine l’ipoglicemia come possibile spiegazione in un paziente con episodi di confusione mentale, alterato livello di coscienza o epilessia.
Epidemiologia dell’ipoglicemia in corso di terapie ipoglicemizzanti
Per quanto riguarda il Diabete di tipo 1 la frequenza degli episodi riportati è di gran lunga maggiore di quella riportata per il Diabete di tipo 2:
per DM1 l’incidenza di lievi episodi ipoglicemici “self reported “ è stimata essere 30 episodi l’anno, quella di episodi gravi (per esempio quelli richiedenti assistenza medica) di 3,2 l’anno 80-82; per DM2 invece si stimano rispettivamente 2-10 l’anno e 0,1-0,7 l’anno 81.
Presentazione clinica
Anzitutto dovremmo dire che non necessariamente un’ipoglicemia, anche grave, presenta una manifestazione clinica e tale questa evenienza, associata ad una peggior prognosi, è più frequente in alcune tipologie di pazienti diabetici di tipo 1, ad esempio quelli con Neuropatia Autonomica 83.
Quando clinicamente manifesta, l’entità delle manifestazioni cliniche è inversamente proporzionale al livello glicemico raggiunto.
Lievi ipoglicemie (58-69 mg/dL) possono essere asintomatiche, per aumento compensatorio della secrezione di ormoni controinsulari (Glucagone, Adrenalina)84.
Al di sotto di questi valori dovrebbero comparire i sintomi e segni sia da neuroglicopenia che da attivazione simpatica, come la sudorazione, il tremore, la tachicardia, l’appetito, l’ansia , aspetti che possono essere attenuati con ingestione di cibi e quindi carboidrati. Per livelli ancora più bassi (circa 43-54 mg/dl) si assiste a notevole peggioramento delle funzioni cognitive e dal punto di vista elettrofisiologico una riduzione dei potenziali evocati ed alterazioni elettroencefalografiche.
Infine (sotto circa i 27 mg/dl) predomina la sintomatologia cerebrale/neurologica,con crisi epilettiche, perdita di coscienza e coma 82, 84, 85.
Effetti cardio e cerebrovascolari dell’ipoglicemia
Ci sono una serie di osservazioni che suggeriscono come un abbassamento della glicemia possa scatenare eventi cardio e cerebrovascolari.
Alcune di queste osservazioni sono di tipo fisiopatologico, altre nascono da studi sorti a loro volta nel tentativo di spiegare un fenomeno noto come la “Dead in bed syndrome “. Da un punto di vista fisiopatologico, è noto che un episodio ipoglicemico si associa ad un picco di attivazione ortosimpatica e rilascio di catecolamine (di cui i sintomi descritti sopra)86-88; si ritiene quantomento verosimile che questo picco, comportando tachicardia ed un aumento pressorio acuto, possa esser un fattore destabilizzante per le placche aterosclerotiche 89.
Non solo, in questi frangenti, il lavoro cardiaco aumenta, così come la attivazione ed aggregazione piastrinica 90-92.
Pertanto diventa lecito perlomeno chiedersi se l’ipoglicemia possa realmente precipitare eventi ischemici cerebrali e cardiaci in pazienti ad alto rischio di malattie cardiovascolari
Inoltre, Snell-Bergeon et al.79 suggeriscono che episodi ripetuti di ipoglicemia potrebbero provocare disfunzione endoteliale 94 ed ATS accelerata 95 come si è visto in un piccolo studio fatto su pazienti non diabetici (metà dei quali IGT), nei quali, tramite CGM (continuos glucose monitoring), si è visto che i minuti al giorno di ipoglicemia correlavano positivamente con il cIMT (carotid intima-media thickness) un marker di ATS subclinica.
Inoltre, nei pazienti DM1, col CGM si è visto che rapide oscillazioni nel senso dell’ipo e dell’iperglicemia sono molto frequenti.
Il CGM ha un’alta sensibilità nel rilevare episodi ipoglicemici, dal momento che consente di scovare anche quelli asintomatici.
Fig. 8.5. Tracciato CGM in giovane con HbA1c pari a 5,6%, tratta da Hypoglicemia, Diabetes, and Cardiovascular Disease, di Snell-Bergeon et.al, 2012
Notare come questo paziente (vd.fig sopra), per ottenere un valore di HbA1c pari a 5,6%, passa il 22 % del tempo della registrazione (7 giorni in questo caso) in ipoglicemia (< 70 mg/dl).
Altri studi, fatti su giovani pazienti con DM1 confermano tale riscontro: in uno studio con CGM si è visto che vi è una media di 0,9 episodi ipoglicemici al giorno(< 65mg/dl)96, in un
altro studio97 si è visto che pazienti DM1 sperimentavano ipoglicemia (qui intesa < 70 mg/dl) per il 4-6 % del tempo.
Data tali premesse di fisiopatologia , si potrebbe pensare che un paziente come quello in figura, nonostante una HbA1c nel range dei non diabetici , sia ad aumentato RCV.
Fig. 8.6. Modello del rischio additivo cardiovascolare imputabile all’ipoglicemia, tratto da da “Hypoglicemia, Diabetes, and Cardiovascular Disease”, di Snell-Bergeon et.al, 2012.
Per quanto attiene al secondo punto, la “Dead in bed syndrome” è una condizione caratterizzata da morte verificatasi durante il sonno in giovani pazienti con DM1,
Queste morti sono state attribuite alle ipoglicemie notturne, sebbene non esistano ancora prove schiaccianti a riguardo 98-100.
Tuttavia alcuni studi sembrerebbero sostenere questa ipotesi.
In uno studio con 24 pazienti con DM1 101 durante il quale vi era monitoraggio continuo ECG e dei valori glicemici, si è visto che quando la glicemia scendeva al di sotto dei 63 mg/dL (< 3.5 mmol/L) concorrevano un aumento del cQT e altri disturbi minori del ritmo, cosa che invece non era documentabile quando i livelli glicemici notturni si mantenevano al di sopra dei 90 mg/dL (> 5 mmol/L).
In altri studi 102, 103 in cui veniva sperimentalmente indotta ipoglicemia sia in adulti sani che in pazienti con DM1 e DM2; in ambo i casi si notava un prolungamento del cQT (come nel primo studio citato 101) ed una riduzione dei livelli di potassio.
Alcuni autori suggeriscono che tali alterazioni ECG siano dovute all’ ipokaliemia, a sua volta dovuta all’increzione di catecolamine che segue l’episodio ipoglicemico.
Pertanto può l’ipoglicemia causare morte tramite aritmie? Servono ulteriori studi, con maggiore numerosità di pazienti per rispondere alla domanda.
Cenni sugli effetti cerebrali cronici dell’ipoglicemia
E’ noto che i pazienti diabetici hanno un rischio di stroke ischemico da 2 a 4 volte maggiore rispetto alla popolazione generale, in particolare chi ha DM2 104, 105. L’ipoglicemia potrebbe essere uno dei fattori favorenti, precipitando l’evento acuto su placca. Trai vari studi svolti, due sono molto interessanti.
In uno di questi 106 in una coorte di 22 pazienti DM1, tramite risonanza magnetica cerebrale si è visto che le lesioni cerebrali erano più comuni in quei pazienti che più frequentemente sperimentavano ipoglicemie.
In un altro studio107, condotto su pazienti adulti con DM2 si è visto che la frequenza di episodi ipoglicemici correlava positivamente col rischio di sviluppare demenza negli anni a venire.
Vi è nesso causale tra episodi ipoglicemici ed ECV-mortalità nei pazienti DM1?
In caso affermativo, l’ipoglicemia sarebbe un fattore di rischio indipendente per eventi cardiovascolari gravi, e gli interventi medici che la provocano, potrebbero aumentare il rischio degli stessi.
In una interessante review 78 si tenta di rispondere a questo quesito, indagando due aspetti:
1)Rapporto tra interventi medici che incrementano il rischio di episodi ipoglicemici ed il rischio di eventi cardiovascolari
Fondamentalmente la struttura base dei trials clinici svolti finora nel DM1 è stata la seguente: due bracci, uno con terapia insulinica intensiva, l’altro con terapia insulinica convenzionale, andando a vedere cosa succedeva nel tempo.
Nel DM1 il trial principe è stato il DCCT (Diabetes Control and Complication Trial)8 con il suo prosieguo, lo studio EDIC.
Nel DCCT furono arruolati 1441 pazienti, con durata media di DM1 di 5,7 anni ed età media di 27 anni. I pazienti furono divisi in due bracci, quello con terapia insulinica intensiva e quello con terapia insulinica convenzionale. Nel primo si raggiunse un livello di HbA1c media del 7,4 %, nel secondo del 9,1 % 4.
La durata media della terapia intensiva nel primo braccio fu di 6,5 anni, e la quasi totalià di questi pazienti venne seguita negli anni a venire (per un periodo medio di 10,5 anni) anche dopo che questi ebbero cessato la terapia aggressiva, tornando al trattamento
Durante lo studio DCCT/EDIC , trai vari parametri, vennero registrati episodi ipoglicemici gravi (ovvero tali da richiedere assistenza medica) e gli eventi cardiovascolari; tuttavia non furono riportati gli eventi cardiovascolari occorsi selettivamente tra coloro che sperimentarono questi episodi ipoglicemici gravi.
Nel braccio con terapia aggressiva, gli episodi ipoglicemici gravi riguardarono il 37 % dei partecipanti , versus il 10 % dei partecipanti nel braccio con terapia convenzionale, pertanto una forte differenza.
Da un punto di vista degli eventi cardiovascolari, durante il DCCT non si osservarono differenze significative trai due gruppi, mentre durante l’EDIC si osservò una forte riduzione degli stessi nel braccio intensivo.
Pertanto, alla luce di questi risultati, sembra che nel DM1, una terapia insulinica aggressiva non sia deleteria dal punto di vista cardiovascolare, nonostante un drammatico aumento della frequenza di episodi ipoglicemici, anche severi.
Questo dato inoltre suscitò interessanti ipotesi, tra cui quella della “Metabolic memory”28 con le sue possibili spiegazioni molecolari e importanti riflessioni sulla tipologia di pazienti cui riservare la terapia aggressiva e su chi non riservarla, alla luce del rapporto costo-beneficio, argomenti ben definiti anche nelle linee guida ADA 2014 18.
Conclusioni simili sono traibili dagli studi su pz DM2.
Sono stati fatti diversi trials,di cui si cita ad esempio UKPDS 108, 109, ACCORD, ADVANCE, VADT 110-112 nei quali si valutavano gli effetti di un controllo glicemico aggressivo versus un controllo convenzionale, facendo riferimento principalmente ai valori di HbA1c.
In questi trials, nel braccio del controllo glicemico aggressivo, il rischio ipoglicemico era più alto, vi era una modesta riduzione del rischio di un primo evento cardiovascolare,
In altri trials fatti in pazienti DM2 il goal non era tanto il raggiungimento di certi livelli di Hb glicata, quanto il confronto di nuovi farmaci con quelli in quel momento in uso nella pratica clinica, e tra questi potremmo citare ad esempio gli studi PROACTIVE 113, RECORD 114, HEART 2D 115, BARI 2D 116. In questi ultimi trials, i dati suggeriscono che le terapie che aumentano il rischio di ipoglicemia non sono associate ad un aumento del rischio di eventi cardiovascolari.
2)Gli episodi ipoglicemici non provocati da intervento medico, sono un fattore prognostico
negativo per l’ outcome cardiovascolare?
Sono stati fatti studi su pazienti ospedalizzati per SCA (Sindrome Coronarica Acuta,quindi angina instabile o infarto miocardico acuto); alcuni di essi erano osservazionali come ad esempio quello svolto da Svensson et al nel 2005 117 su 684 pazienti con DM2 ammessi in ospedale per SCA.
In questo studio, estrapolando i dati, la mortalità in funzione della glicemia è rappresentata da una curva a J: la mortalità era più alta nel pazienti ipoglicemici [ in questo studio l’ipoglicemia era definita come < 55 mg/dl (<3,0 mmol/L)] ed iperglicemici (valori > 6,5 mmol/L) al momento dell’ammissione.
In altri studi invece,tra cui il DIGAMI 2 118, pazienti presentatisi al Pronto Soccorso con SCA venivano randomizzati in un braccio in cui veniva somministrata per via infusionale insulina, glucosio e potassio , un braccio che faceva terapia standard.
Il razionale non era tanto la riduzione in se per se della glicemia, quanto il miglioramento del bilancio energetico miocardico.
A seguito dell’analisi dei dati e della correzione del rischio di mortalità in base ai possibili fattori confondenti, sembrò che l’ipoglicemia verificatasi prima dell’ospedalizzazione per malattia coronarica fosse associata ad un maggior rischio di futura mortalità; sembrò
invece che l’ipoglicemia indotta da terapia,quindi dall’intervento medico non aumentasse la mortalità.
Risultati concordanti vengono da studi fatti su pazienti ambulatoriali 119.
Riassumendo pertanto i dati finora disponibili, nessuno degli studi citati conferma o smentisce l’ipotesi che l’ipoglicemia, che frequentemente accompagna come effetto indesiderato le terapie ipoglicemizzanti in corso di DM1 e DM2, incrementi di per se la mortalità, per cause cardiovascolari e non.
Potrebbe darsi che gli episodi ipoglicemici registrati negli studi clinici finora fatti siano una sottostima della situazione reale, magari perché non sempre avvertiti dai pazienti, o non sempre registrati dai medici; potrebbe anche essere che l’ipoglicemia sia associata a comorbidità che invece hanno un ruolo causale, come ad esempio epatopatie, nefropatie, declino cognitivo, malattie oncologiche,ecc.
Servirebbero ulteriori indagini per esplorare queste possibilità.
Forse il possibile aumento del rischio cardiovascolare dovuto agli episodi ipoglicemici potrebbe contribuire a spiegare come mai non ci sia nei vari trials (sia DM1 che DM2) una riduzione degli ECV durante i trial stessi, a differenza degli evidenti miglioramenti per quanto attiene alle complicanze microvascolari del DM 79.
Ricapitolando, sebbene i vantaggi delle terapie che mirano ad uno stretto controllo della glicemia siano estremamente efficaci per le complicanze microvascolari, i vari trials clinici hanno fallito nel dimostrare una riduzione del CDV Risk nel breve termine.
Al contempo, queste terapie sicuramente si associano ad un maggior frequenza di episodi ipoglicemici; non è stato tuttavia ancora ne confermato, né smentito se questi causino o meno un aumento del rischio cardiovascolare, di stroke ischemico, di demenza.
Pertanto è opportuno chiedersi se adottare uno stretto controllo glicemico per tutti i pazienti DM1, oppure riservarlo a pazienti selezionati, ad esempio quei pazienti giovani per prevenire le complicanze microvascolari, mantenenendosi invece più prudenti in altri tipi pazienti, ad esempio quelli più anziani, e/o con comorbidità importanti, ad esempio CAD, demenza, nefropatia.
Non è un caso che tra le raccomandazione ADA 2014 vi siano diversi target di HbA1c per diverse tipologie di pazienti 18 segno che questa problematica è stata ben recepita.
8.2 Complicanze croniche del DM1
Le complicanze croniche del DM colpiscono molti organi ed apparati, e sono le responsabili di mortalità e morbidità dei pazienti diabetici 12032.
Esse possono esser concettualmente divise in:
-MICROVASCOLARI: Retinopatia, Nefropatia, Neuropatia diabetica;
-MACROVASCOLARI: Coronaropatia, Arteriopatia periferica, Vasculopatia cerebrale; -ALTRO: oculari (cataratta, glaucoma), malattia periodontale, maggior suscettibilità ad alcune tipologie di infezioni, manifestazioni dermatologiche.
Il rischio di complicanze croniche aumenta in funzione della durata della iperglicemia; in genere diventano manifeste clinicamente nella seconda decade di iperglicemia, anche se anomalie subcliniche sono detectabili anche dopo pochi anni dall’esordio. Infatti, le linee guida, come quelle della ADA 2014 18 o quelle di importanti società pediatriche come la ISPAD 121 suggeriscono opportuni screening.
Dal momento che nel DM2 vi può essere un lungo periodo asintomatico, buona parte degli individui, alla diagnosi presenta già complicanze.
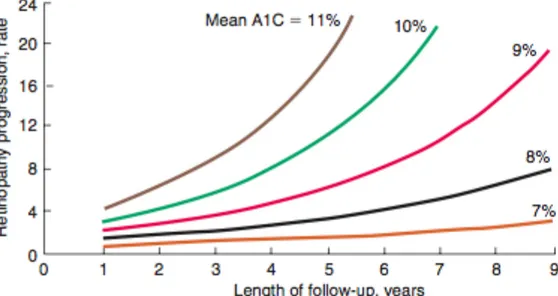
Le complicanze microvascolari sono il frutto dell’iperglicemia cronica ed ampi studi clinici randomizzati, condotti sia su pazienti DM1 che su pazienti DM2, hanno dimostrato in maniera incontrovertibile che il controllo glicemico riduce il rischio di svilupparle. Anche altri fattori, non ben definiti, giocano un ruolo nello sviluppo delle complicanze microvascolari, come suggerisce ad esempio il fatto che alcuni le sviluppino nonostante un ottimo controllo glicemico, od all’opposto, il fatto che altri non le sviluppino malgrado un pessimo controllo glicemico, o che magari tendano a svilupparne di un tipo ma non di un altro, ad esempio la nefropatia ma non la retinopatia.
Probabilmente vi è un importante ruolo della genetica,cioè vi è una suscettibilità genetica allo sviluppo di particolari complicanze.
Tuttavia i loci responsabili di questa suscettibilità non sono ancora stati identificati.
L’iperglicemia gioca un ruolo importante anche nello sviluppo delle complicanze macrovascolari, e nel prosieguo della trattazione se ne parlerà più dettagliatamente.
Qui ricordiamo solo che questo aspetto vale sia per DM2 che per DM1; in passato, invece, si tendeva erroneamente ad associare il DM2 con la macroangiopatia ed il DM1 con la microangiopatia 3, 122.
Meccanismi delle complicanze croniche
Sebbene l’iperglicemia sia ritenuta l’elemento scatenante, e forse non l’unico, per lo sviluppo delle complicanze croniche, i passaggi intermedi mediante i quali si determina il danno d’organo non sono perfettamente noti, ed all’oggi bisogna purtoppo accontentarsi solo di quattro ipotesi patogenetiche, raccordate da un possibile meccanismo unificante 32.
La prima ipotesi è che l’iperglicemia determini la formazione di AGEs, “Advanced glycosylation end products”, ovvero i prodotti terminali della glicosilazione avanzata. Secondo questa ipotesi, l’aumento della concentrazione del glucosio intra ed extracellulare, determina la glicosilazione non enzimatica di proteine intra ed extra cellulari, a livello dei loro gruppi amminici.
Questo a sua volta determina la formazione di legami crociati (per esempio a livello del collagene, della matrice extracellulare), e l’alterazione della struttura e funzione originaria di queste proteine; in ultima analisi queste alterazioni avrebbero una serie di conseguenze sfavorevoli, come l’accelerazione dell’aterosclerosi, induzione della disfunzione endoteliale, alterazioni a livello glomerulare, un’alterata composizione della matrice extracellulare, ecc. .
Il livello sierico di AGEs correla con la glicemia, ed i livelli aumentano ulteriormente se GFR si riduce.
La seconda ipotesi è che l’iperglicemia determini un’aumentata produzione di sorbitolo, attraverso l’enzima aldoso reduttasi; sorbitolo che a sua volta, indirettamente genererebbe ROS.