UNIVERSITA’ DEGLI STUDI DI PISA
Facoltà di Scienze Matematiche, Fisiche e Naturali
Laurea Magistrale in Biologia Applicata alla Biomedicina
Utilità della tecnologia microarray nella diagnosi
delle infezioni virali dell’apparato respiratorio
Relatore:
Prof. Dr. Luca Ceccherini-Nelli
Co-Relatore:
Dott.ssa Barbara Matteoli
Candidato:
Dei Alessandro
1. Introduzione
3
2. Infezioni virali dell’apparato respiratorio
6
2.1 Vie di trasmissione dei microrganismi 11
2.2 Meccanismi di difesa dell’apparato respiratorio 11
3. Virus respiratori
13
3.1 Virus a DNA responsabili di patologie del tratto respiratorio 15
3.1.1 Adenoviridae 15
3.1.2 Parvoviridae 18
3.2 Virus a RNA responsabili di patologie del tratto respiratorio 20
3.2.1 Orthomixoviridae 20
3.2.2 Paramyxoviridae 24
3.2.3 Coronaviridae 31
3.2.4 Picornaviridae 35
3.3 Virus respiratori di recente identificazione 39
4. L’emergente importanza del viroma
42
4.1 Il viroma 43
4.2 Batteriofagi associati ai tessuti dell’ospite 43
4.3 Virus eucarioti residenti 44
4.4 Interazioni tra viroma e sistema immunitario dell’ospite 45
4.5 Prospettive future 46
5. Metodi diagnostici di rilevazione dei virus respiratori
48
1.1 Metodi indiretti 49
1.2 Metodi diretti 49
1.2.1 Microscopia elettronica 50
1.2.2 Isolamento virale 50
1.2.3 Ricerca degli antigeni virali 51
1.2.4 Metodi molecolari 54 1.2.5 Microarray virali 59
6. Materiali e metodi
63
6.1 Campioni 63 6.2 Isolamento virale 64 6.3 Virologia molecolare 676.4 CLART PneumoVir Kit 70
7. Risultati_____________________
75
7.1 La popolazione oggetto di studio 75
7.2 Risultati metodi tradizionali 77
7.3 Risultati CLART PneumoVir 79
7.4 Risultati a confronto 83
7.5 Analisi dei campioni concordarti 84
7.6 Analisi dei campioni discordanti 88
8. Discussione
91
1
I
NTRODUZIONE
Le infezioni dell’apparato respiratorio (RTI) sono causa significativa di morbilità e mortalità in paesi industrializzati e in via di sviluppo, soprattutto in età pediatrica e senile. La World Health Organization (WHO) ha stimato che le RTI sono causa di oltre 4 milioni di morti all’anno. [1] Inoltre sebbene nei paesi industrializzati vi sia ampia disponibilità di strutture sanitarie, di personale qualificato e farmaci adeguati, le RTI rimangono comunque una delle principali cause di assenza dal lavoro, con conseguenze socio-economiche rilevanti.
In Europa nel 2008 sono state 220.000 le morti attribuite da queste patologie, 25.000 di queste riguardano la fascia di età 0-4 anni e altre 110.000 pazienti con più di 80 anni, le due categorie maggiormente a rischio. [2] Negli ultimi 3 anni si è verificato un fortissimo aumento dei casi d’influenza nel vecchio continente. I paesi con un significativo incremento dell’attività influenzale sono: Austria, Bulgaria, Francia, Ungheria, Irlanda, Italia, Lussemburgo, Olanda, Portogallo, Slovenia, Spagna, Svizzera e Regno Unito.
In Italia alle infezioni respiratorie sono attribuiti più di un terzo dei consulti medici. Nella stagione invernale 2012/2013 sono stati stimati quasi 5 milioni di casi di sola sindrome influenzale segnalati alla Rete Italiana Sorveglianza Influenza, con il picco di massima incidenza registrato nella quinta settimana del 2012. [3] Lo stesso sistema di sorveglianza epidemiologica dimostra come anno dopo anno i picchi d’incidenza registrati oscillino sempre su valori molto elevati, e ciò evidenzia la ricorrenza stagionale delle epidemie d’infezioni respiratorie acute e quindi il continuo ripetersi delle condizioni di emergenza diagnostiche e terapeutiche.
Tra le cause di ospedalizzazione in Italia secondo il Ministero della Salute i casi di polmonite occupano il quarto posto con una degenza media di 9,4 giorni per paziente e un costo decisamente elevato per la spesa sanitaria. Questi dati dimostrano come le infezioni del tratto respiratorio (RTI) rappresentano ancora oggi per morbilità, mortalità ed impatto economico, uno dei principali problemi di Sanità Pubblica [4].
Le RTI colpiscono soprattutto i neonati, gli anziani ed i soggetti immunocompromessi, dove frequentemente possono evolvere in quadri clinici gravi e portare alla morte del soggetto. Gli agenti eziologici delle RTI sono molteplici: batteri, funghi, protozoi, ma più della metà degli eventi infettivi ha origine virale. I virus più frequentemente associati alle infezioni del tratto respiratorio sono: Adenovirus (ADV), Bocavirus (BOV), Coronavirus (CoV), Enterovirus (ENTV), virus influenzali (INFLU A, B, C), Metapneumovirus (MetV), Parainfluenzavirus (IPV 1, 2, 3, 4a e b), Rinovirus (RV), Virus Respiratorio Sinciziale (RSV).
La straordinaria frequenza delle RTI è la conseguenza diversi fattori tra loro correlati [5]: La varietà degli agenti eziologici antigenicamente distinti
La loro grande diffusibilità
La breve durata dell’immunità che segue alle forme morbose più comuni. In base al distretto che il patogeno colonizza, le RTI sono suddivise in:
- Infezioni delle vie aeree superiori (URTI), quali riniti, tonsillite laringiti, faringiti, tracheiti che generalmente hanno un decorso benigno
- Infezioni del tratto respiratorio inferiore (LRTI), che interessano le basse vie respiratorie e comprendono bronchiti, bronchioliti, polmoniti interstiziali. (Figura 1)
(a) (b)
In questo contesto, a causa della severità delle patologie respiratorie, dell'aspecificità dei sintomi che esse manifestano e per i frequenti casi di coinfezione che insorgono specialmente nei bambini, la diagnosi di laboratorio assume un ruolo fondamentale rappresentando l’unico strumento utile nel fornire risultati a riguardo in breve tempo.
Al fine di poter avviare rapidamente una terapia mirata ed una adeguata gestione del paziente, è quindi necessario usare metodi diagnostici che permettano una identificazione multipla, rapida ed efficace dei possibili virus presenti nei campioni prelevati da pazienti affetti da sindromi respiratorie.
Oltre a portare giovamento alla salute dei pazienti, una diagnostica con queste caratteristiche permetterebbe di ridurre i tempi di ospedalizzazione e di conseguenza i costi, ed eviterebbe la somministrazione di una terapia antibiotica inappropriata, prevenendo fenomeni di farmaco-resistenza.
2
I
NFEZIONI
V
IRALI
D
ELL
’A
PPARATO
R
ESPIRATORIO
Le malattie infettive che interessano le vie respiratorie sono per lo più infezioni acute che prendono il nome in funzione del tratto dell'apparato respiratorio che coinvolgono (Tabella 2A). Sono suddivise in infezioni delle alte vie respiratorie (riniti; sinusiti; faringiti; faringo-tonsilliti; epiglottiditi, laringiti e tracheiti) ed infezioni delle basse vie respiratorie (bronchiti; bronchioliti e polmoniti interstiziali). Gli agenti eziologici coinvolti sono numerosi (batteri, miceti, micoplasmi e clamidie) e spesso causano re-infezioni nell'arco di una medesima stagione invernale. Tuttavia la causa più importante e frequente sono i virus, in particolare i virus influenzali [6, 7, 8]. Molto frequentemente, nello stesso individuo, si possono ritrovare diverse patologie respiratorie contemporaneamente che determinano sindromi aspecifiche e simil-influenzali, caratterizzate da febbre e infiammazione estesa delle prime vie respiratorie.
Riniti
Il raffreddore comune è la più diffusa infezione nell’uomo. E’ una patologia in genere lieve che consiste in un’intensa flogosi limitata alle mucose nasali e alla congiuntiva. L'eziologia delle rinite è in genere quasi esclusivamente virale, ed è solitamente correlata a infezioni in cui primeggiano i Rhinovirus (hRV), responsabili di circa il 40 % della casistica. [17] I Rhinovirus sono un genere ricco di sierotipi (più di 100) che danno luogo ad un'immunità tipo-specifica, sinonimo di suscettibilità alle re-infezioni, e che si trasmettono con grande efficienza per via aerea da soggetto a soggetto (alta contagiosità).
Altri virus come Coronavirus (CoV), riscontrato nel 10% dei casi, alcuni sierotipi di Adenovirus (AdV), Virus influenzali (INFV), e Parainfluenzali (hPIV), e Virus Respiratorio Sinciziale (RSV),
Coxsackie virus A (CoxV-A), ed Echovirus, possono dare una rinite clinicamente sovrapponibile al raffreddore specialmente nei bambini. Batteri e miceti sono cause rare di riniti, ma nel contesto di co-infezioni con agenti virali possono dare complicanze infettive a livello delle fosse nasali e dell'orecchio medio. [2, 13, 14, 15, 18, 19]
Sinusiti
La sinusite è un processo infiammatorio, acuto o cronico, delle mucose dei seni paranasali, spesso accompagnata da un processo infettivo primario o secondario. In caso di sinusite, la mucosa infiammata aumenta il proprio volume, determinando un restringimento degli osti di comunicazione tra seni paranasali e cavità nasali. Questo dà origine ad un ristagno del muco all'interno dei seni, che diviene un sito ideale per la crescita di batteri giunti dalle cavità nasali o dalla cavità orofaringea. Con una certa frequenza nei campioni di prelievi nasali è stata riscontrata la presenza di virus, che sono quindi stati inseriti tra i possibili responsabili della malattia. Nello specifico si tratta di hRV, ADV, INFV e hPIV spesso associati ad infezioni batteriche. [14,15, 20]
Faringiti e Faringo-tonsilliti
Si parla in maniera distinta di faringite, rino-faringite, faringo-tonsillite e tonsillite a seconda delle sedi prevalentemente coinvolte dal processo infettivo. La faringo-tonsillite può insorgere come unica manifestazione morbosa o può far parte di un più ampio quadro clinico. Gli agenti eziologici delle faringiti sono spesso di natura virale. Tra i virus più spesso implicati nell’infezione ritroviamo hRV e il CoV, ma anche gli AdV, il (CoxV), i INFV, il hPIV e l’RSV [21]. Solitamente nei bambini al di sotto dei 3 anni la faringite è quasi esclusivamente di origine virale. [15, 23, 24]
Laringiti
Il termine laringite acuta indica un quadro flogistico a carico della mucosa della laringe caratterizzata spesso da una transitoria disfonia o afonia dovuta all'interessamento delle corde vocali. Sono tra le affezioni più frequenti dell'albero respiratorio e possono presentarsi inizialmente ed improvvisamente come tali o risultare dall'estensione di processi infettivi delle vie respiratorie superiori [22]. Le forme acute possono poi evolvere a forme croniche in seguito ad un processo infiammatorio irreversibile e di lunga durata con conseguenti alterazioni della mucosa e della sottomucosa. L'eziologia delle laringiti è prevalentemente virale, tra cui spiccano i virus Parainfluenzali (hPIV-1 è il responsabile di circa il 50% delle laringiti) seguiti dai virus Influenzali. Meno frequentemente si osserva invece il Virus Respiratorio Sinciziale e, solo raramente, gli Adenovirus sono responsabili di laringiti.
Tracheiti e Bronchiti
Tracheiti e Bronchiti sono processi flogistici che prendono luogo rispettivamente a livello della trachea e dei bronchi, manifestandosi generalmente con raucedine, tosse, difficoltà respiratoria, ostruzione, e nelle forme più gravi dispnea, crup e febbre. Si dividono in patologie acute e croniche. Le forme acute colpiscono circa il 4% della popolazione adulta ogni anno e sono per lo più dovute all’estensione ai bronchi dei processi infettivi originatisi nelle vie aeree superiori [25], con cui condividono l'eziologia per lo più virale (soprattutto nei bambini). In questi distretti, assumono comunque grande importanza alcuni agenti batterici (S.pneumoniae ed H.influenzae), spesso causa di sovrapposizioni secondarie in quadri di distruzione epiteliale dovuti a precedenti infezioni virali. I virus maggiormente responsabili di tali processi infettivi sono: hRV, CoV, hPIV, INFV, RSV, AdV, virus del Morbillo, virus dell'Herpes Simplex. In ragione di quanto detto, le patologie infettive acute di questi distretti hanno un andamento per lo più stagionale tipicamente invernale dovuto a complicazioni di un raffreddore o di infezioni delle vie aeree superiori. Il ripetersi degli episodi acuti, non soltanto fornisce nuove occasioni di danno epiteliale, ma costituisce, un fattore predisponente al verificarsi di polmoniti. [14, 15, 26].
Bronchioliti
Per bronchiolite si intende un’infiammazione acuta dei bronchioli. Queste infezioni sono caratterizzate da edema, necrosi dell'epitelio respiratorio di rivestimento del bronchiolo ed incremento della secrezione di muco, che inducono uno spasmo bronchiale, iper-espansione polmonare ed ipossia. Gli agenti eziologici delle bronchioliti sono quasi esclusivamente virali (RSV; hPIV-1,2,3; AdV; hRV; INFV; CoxV B). RSV è il principale responsabile delle bronchioliti (70-75% dei casi), seguito dai virus Parainfluenzali, principalmente di tipo 3 (15-30% dei casi). Le bronchioliti da RSV si presentano con andamento stagionale, soprattutto in inverno e primavera, come casi isolati o episodi epidemici generalmente nosocomiali. Sono malattie tipiche dei primi 2 anni di vita, con la
massima incidenza nei primi 6 mesi, in cui rappresentano anche la principale causa di morte. E’ stato stimano che oltre 120000 bambini sotto l'anno di età vengono ospedalizzati ogni anno a causa
di questa sindrome ed oltre il 3% degli infanti subiscono la stessa sorte. [15, 27]
Polmoniti interstiziali
Le polmoniti acute e croniche sono processi flogistici generalmente di natura infettiva del parenchima polmonare, degli spazi alveolari o del tessuto interstiziale di sostegno. Le polmoniti sono tutt'oggi un grave problema sanitario, rappresentano la prima causa di morte per malattie infettive nel mondo, e la sesta causa di morte in assoluto nei paesi industrializzanti, la prima causa di mortalità tra le
infezioni nosocomiali nei paesi in via di sviluppo, fiancheggiate soltanto in alcuni casi, dalle diarree infettive. Negli Stati Uniti circa 2 milioni di persone si ammalano di polmonite ogni anno con un numero di decessi annui che si aggira tra le 40 e le 70 mila persone. In Italia si stimano circa 700.000 casi di polmonite/anno, con un’incidenza prevalentemente maschile di 10-12 casi/anno ogni 1.000 abitanti. Le fasce di età più colpite sono i soggetti son meno di 5 anni (circa 25 casi/1.000 abitanti anno) e gli anziani sopra i 75 anni di età (circa 30 casi/1.000 abitanti anno).
L'eziologia delle polmoniti è molto ampia e varia a seconda dell'ambiente, del cluster di popolazione, dell'area geografica e delle condizioni dei soggetti studiati (infanti, anziani, immunocompromessi, ospedalizzati). Le infezioni di natura batterica sono predominanti, mentre le forme virali sono più diffuse nell'infanzia (80%) rispetto all'età adulta (10-20%).
I virus a più elevato tropismo polmonare sono: INFV, hPIV, AdV
(
sierotipi 1, 2, 3, 4 e 7) ed RSV. Negli ultimi anni sono stati identificati grazie all'utilizzo dei NATs (nucleic amplification tests) altri agenti virali responsabili di polmonite, quali vanno segnalati per frequenza i Metapneumovirus umani(hMPV) [30] e per gravità i ceppi di H5N1 di virus influenzale ed i CoV associati a SARS. Per gli aspetti preventivi, l’approccio terapeutico e la gravità in cui spesso evolve la patologia dovute
ad uno stato di immaturità o compromissione immunologica, richiedono una particolare attenzione le polmoniti neonatali e le polmoniti in soggetti immunodepressi. [15, 27]
Le sindromi simil-influenzali
La rete italiana di sorveglianza dell’influenza (Italian Surveillance Influenza Network, InfluNet) definisce un caso di sindrome simil-influenzale (Influenza-like illness, ILI) come un brusco inizio di sintomi con febbre sopra i 38°C più almeno un sintomo sistemico (mal di testa, malessere, mialgia,
sudorazione o brividi o fatica) ed almeno un sintomo respiratorio (tosse e/o mal di gola) [28]. A differenza di molti agenti responsabili di RTI, il virus influenzale conferisce al soggetto colpito un
quadro clinico più specifico. Tuttavia, la diagnosi d’influenza può essere offuscata dalla presenza concomitante di sintomi specifici (come ad esempio febbre, tosse, mal di gola, rinorrea) e non specifici (ad esempio disturbi addominali), che possono essere attribuibili ad altri agenti patogeni piuttosto comuni nella popolazione e spesso co-circolanti al virus influenzale. Inoltre, altri agenti eziologici possono essere responsabili dell’insorgenza di quadri clinici sovrapponibili a quelli di ILI. Pertanto risulta spesso necessario confermare in laboratorio i casi di influenza ed effettuare una sorveglianza di tutti gli altri agenti patogeni che possono essere causa di una sindrome simil-influenzale. [29]
VIRUS RTIs
Rhinovirus Raffreddore, faringite, laringite acuta, sinusite, bronchite acuta, polmonite acuta
Coronavirus Raffreddore, faringite, laringite acuta, bronchite acuta
Virus Parainfluenzali Raffreddore, faringite, laringite acuta, laringotracheobronchite (croup), sinusite Virus Respiratori Sinciziali Raffreddore, croup, bronchite acuta, bronchiolite,
polmonite acuta
Virus Influenzali Raffreddore, faringite, laringite acuta, croup, sinusite, bronchite acuta, polmonite Adenovirus Raffreddore, faringite, laringite, sinusite,
bronchite acuta, bronchiolite, polmonite Metapneumovirus umano Raffreddore, laringite acuta, bronchiolite,
polmonite acuta
Rubeola Virus Raffreddore, bronchite acuta, polmonite acuta
Enterovirus Raffreddore, faringite, bronchite acuta, bronchiolite, polmonite acuta
Rubella Virus Raffreddore, bronchite
Varicella Zoster Raffreddore, infezioni della cavità orale, polmonite acuta
Herpes Simplex Faringiti, epiglottiti, infezioni cavità orale
Cytomegalovirus Faringite, infezioni della cavità orale, polmonite acuta Human Immunodeficiency
Virus (HIV) Faringite
Epstein Barr Epiglottite
2.1
Vie di trasmissione dei microrganismi
L’ingresso dei microrganismi all’interno delle basse vie respiratorie avviene solitamente per via aerogena, attraverso l’inalazione dall’ambiente circostante o da altri soggetti, malati o semplici portatori sani. Questo trasferimento avviene solitamente attraverso microgocce (goccioline di Flugge) di saliva eliminate con la tosse, gli starnuti o con il semplice linguaggio parlato. Le stesse microgocce possono al contempo depositare le particelle infettive su superfici, contaminandole e permettendo ai microrganismi di raggiungere le vie respiratorie attraverso il contatto superficie-mano-volto. Un’altra via di trasmissione è l’aspirazione, più comune nelle forme nosocomiali e tipica, ad esempio, della polmonite dovuta all’arrivo nelle basse vie di un inoculo massiccio di batteri residenti nella cavità orale (polmonite ab ingestis) o anche, più raramente, provenienti dallo stomaco. Un caso tipico è rappresentato dalle polmoniti nei soggetti intubati. Talvolta, alveoli e/o interstizio sono coinvolti per estensione di un evento infettivo delle medie vie respiratorie, che, in tal caso, partecipano con la loro patologia al processo delle più basse vie. Più rara, infine, la via ematica, attraverso la quale i microrganismi possono raggiungere le vie respiratorie anche da focolai infettivi presenti in distretti corporei lontani. [15, 16]
2.2
Meccanismi di difesa dell’apparato respiratorio
Nonostante sia protetto da numerose barriere di difesa naturale l'apparato respiratorio, a causa della sua funzione, è il distretto del corpo umano con maggiore incidenza e prevalenza di malattie da infezione. I meccanismi di difesa dell'albero respiratorio variano a seconda del distretto in cui ci si trova:
Cavità nasale (normalmente colonizzata):
- flora "commensale” prevalentemente batterica; - mucosa e barriera meccanica;
- trasporto muco-ciliare (verso la faringe); - IgA secretorie;
- interferone;
- azione di schermo dei turbinati; - azione di lavaggio delle secrezioni; Seni paranasali (normalmente sterili):
- mucosa, barriera meccanica;
Medie e basse vie (microrganismi in via di rimozione): - mucosa e barriera meccanica;
- trasporto muco-ciliare (verso la faringe); - riflesso della tosse;
- macrofagi alveolari; - IgG e IgA secretorie; - complemento; - surfattante.
Tra tutti i meccanismi a disposizione dell’apparato respiratorio per la propria difesa quelli dotati di maggiore efficacia sono la flora batterica residente nell'orofaringe, che compete con la crescita dei patogeni, il trasporto muco-ciliare e i macrofagi alveolari. Il trasporto muco-ciliare impedisce alle particelle di dimensioni maggiori di 10μm, inalate attraverso la respirazione, di proseguire il proprio viaggio attraverso le vie respiratorie, intrappolandole nel muco a livello della cavità nasale.
Le particelle che riescono a sfuggire a questi primi sistemi di difesa sono generalmente caratterizzate da dimensioni ancora minori che le consentono di raggiungere gli alveoli polmonari: a livello di queste strutture intervengono i macrofagi alveolari in grado di fagocitare il materiale esogeno e digerirlo o, in alternativa, di traportarlo ai linfonodi regionali. [2, 15]
3
V
IRUS
R
ESPIRATORI
I virus rappresentano gli agenti eziologici più diffusi nelle patologie del tratto respiratorio. Si tratta essenzialmente di patologie acute che possono colpire tutte le fasce d'età con conseguenze legate all'agente eziologico, alla concentrazione virale ed alla risposta dell'individuo. Si tratta essenzialmente di infezioni a diffusione stagionale che iniziano in autunno raggiungono il picco nei mesi invernali per diminuire in primavera fino a sparire quasi totalmente in estate.
Fra i virus a DNA, troviamo virus appartenenti alla famiglia: - Adenoviridae = human Adenovitus (hAdV)
- Parvoviridae = human Bocavirus (hBoV).
Fra i virus a RNA invece, spiccano le seguenti famiglie: - Orthomyxoviridae = virus influenzali A e B
- Paramyxoviridae = human Parainfluenzavirus 1-4 (hPIV1-4), virus respiratorio sinciziale (RSV), human Metapneumovirus (hMPV)
- Picornaviridae = human Rhinovirus (hRV), human Enterovirus (hEV), human Parechovirus (hPeV)
- Coronaviridae = human Coronavirus (hCoV-229E, hCoV- OC43, hCoV NL63, hCoV-HKU1, SARS CoV e MERS-CoV). [30]
3.1
Virus a DNA responsabili di patologie del tratto respiratorio
3.1.1 Adenoviridae
(a) (b)
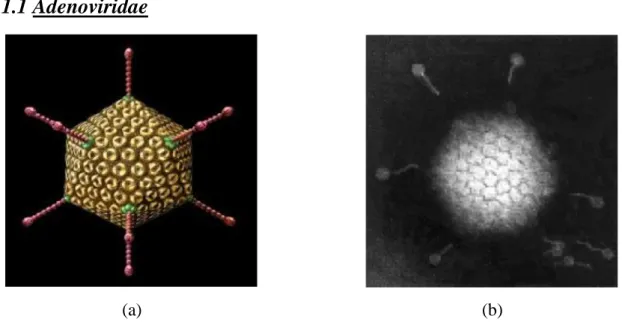
Figura 3.2 Modello 3D di Adenovirus (a) Adenovirus al TEM (b)
Gli Adenovirus sono virus nudi, il cui capside ha un diametro di 70-100 nm a simmetria icosaedrica. Il capside è formato da 252 capsomeri, di cui 240 esoni e 12 pentoni. Questi ultimi contengono una base, che forma parte della superficie del capside, e dalla tipica fibra sporgente verso l'esterno di varia lunghezza a seconda dei sierotipi, che è il bersaglio delle immunoglobuline neutralizzanti, nonché il sito di legame con i recettori cellulari CAR.
Ogni Adenovirus è costituito da una molecola di DNA lineare a doppio filamento (dsDNA) di circa 36.000 paia di basi, codificante per 30-40 geni, un numero maggiore rispetto a virus della medesima grandezza. Il ciclo di replicazione dura circa 24 ore e si compone di 2 fasi che sono separate dall’inizio della replicazione del DNA virale. I primi eventi del ciclo replicativo di Adenovirus iniziano al momento della sua interazione con la cellula ospite. Assorbimento, penetrazione, traslocazione del DNA virale nel nucleo ed espressione del set di geni precoci, i cui prodotti mediano la successiva espressione genica e replicazione del DNA virale, inducono la progressione del ciclo cellulare, bloccano l’apoptosi e contrastano le misure antivirali dell’ospite. Contemporaneamente con l’inizio della replicazione del DNA virale, la seconda fase del ciclo comincia con l’espressione dei geni tardivi e con l’assemblaggio dei virioni della progenie. Alla fine del ciclo, circa 104 nuovi virioni
completi sono stati prodotti per ogni cellula infettata e vengono liberati per lisi cellulare.
Gli Adenovirus hanno un elevato tropismo epiteliale. Il loro ingresso nelle cellule epiteliali sembra mediato dalle proteine fibrillari dei pentoni, che si legano ai recettori cellulari CAR (coxsackievirus and adenovirus receptors). Una volta agganciato alla superficie cellulare, Adenovirus viene internalizzato per endocitosi e sfugge dall’endosoma sfruttando il pH acido che si va creando al suo
interno. A questo punto i virioni vengono trasportati lungo i microtubuli verso il nucleo, perdono i polipeptidi che costituiscono il capside ed il loro DNA virale viene trasportato all’interno del nucleo cellulare per essere trascritto.
Gli Human Adenovirus (HAdV) sono responsabili di infezioni nell'uomo e sono divisi in 57 sierotipi differenti, e 6 specie (classificati dalla A alla G) tutte appartenenti al genere dei Mastadenovirus (Adenovirus dei mammiferi). Molti sierotipi di HAdV sono in grado, almeno in alcuni modelli di culture cellulari in vitro, di indurre una trasformazione delle cellule infettate. Alcuni tipi, in particolare 12, 18 e 31, presentano una notevole capacità oncogenica in animali da esperimento.
Epidemiologia dell’hAdV
Gli Adenovirus hanno una distribuzione ubiquitaria e le diverse specie e sierotipi possono provocare infezioni in diversi distretti corporei. Per quanto riguarda l’apparato respiratorio, le infezioni da Adenovirus possono essere sporadiche, endemiche ed epidemiche con un andamento stagionale caratterizzato da picchi nei mesi freddi (inverno e primavera). Il virus fu isolato per la prima volta negli anni cinquanta. Le infezioni dovute alle specie B e C, in particolare HAdV-1,2,5,6 e più raramente da 3, 7, 14 sono endemiche e colpiscono frequentemente in tenera età, anche se rimangono per lo più asintomatiche. Nei bambini il 7% delle infezioni respiratorie acute sono riconducibili a questo virus e di queste fino al 10% richiedono ospedalizzazione. Negli adulti le infezioni respiratorie da Adenovirus sono più rare, probabilmente ciò è dovuto a precedenti immunizzazioni, in essi, infatti, si riscontrano solo sporadicamente infezioni da sierotipi meno diffusi, quali HAdV-4, 7 e più raramente da HAdV-3.
Trasmissione e replicazione dell’hAdV
Le modalità di trasmissione del virus sono diverse e variano in funzione del sierotipo considerato. Può essere trasmesso per via aerea, attraverso le goccioline di aerosol che si producono tossendo, starnutendo o più semplicemente parlando. Un'altra modalità di trasmissione è quella per contatto
indiretto con superfici contaminate (maniglie, asciugamani) e successiva auto-inoculazione. Gli Adenovirus, infatti, sono estremamente resistenti a cambiamenti chimici e fisici dell'ambiente nel
quale si trovano, il che ne rende possibile la sopravvivenza anche per lunghi periodi al di fuori dei fluidi corporei. Un’altra via di trasmissione è quella oro-fecale, in quanto il virus è responsabile di enteriti soprattutto nei bambini e, talvolta, può replicare nell'intestino in maniera asintomatica e venire espulso nelle feci. L’immunità che segue all’infezione è duratura ed è difficile una re-infezione con lo stesso tipo di Adenovirus. Dato però il notevole numero di tipi antigenici, il rischio d’infezione da questo tipo di virus è sempre notevole.
Manifestazioni cliniche dell’hAdV
Nei soggetti sani le infezioni da Adenovirus provocano manifestazioni, che variano a seconda del distretto infettato, delle condizioni dell'ospite e del sierotipo infettante. Per quanto riguarda le infezioni delle vie aeree si possono osservare quadri clinici che vanno da forme asintomatiche a gravi polmoniti che in alcuni casi conducono il paziente a morte. Nel bambino l'infezione sintomatica fornisce un quadro con sintomi febbrili, rinorrea, tosse e sono responsabili anche di bronchioliti. Si possono verificare inoltre otite media ed adenite cervicale. La polmonite grave infantile è associata ai sierotipi di HAdV-3 e 7 ed ha una mortalità del 16%, in particolare nei bambini con età inferiore ai 2 anni che sono i più esposti all'insorgenza di gravi infezioni. Nell'adulto l'infezione è molto più rara con manifestazioni febbrili, faringodinia, tosse persistente con possibile interessamento polmonare nei casi in cui non si procede ad un trattamento farmacologico. Le infezioni da Adenovirus sebbene siano quasi sempre di scarsa rilevanza clinica, nei soggetti immunodepressi sono spesso più gravi. La mortalità può raggiungere il 60% ed è un grave problemi per i bambini trapiantati di midollo in cui l'incidenza dell'infezione arriva fino al 31%. In questi ultimi soggetti generalmente il coinvolgimento degli organi è spesso più esteso e le polmoniti sono complicanze comuni e gravi, inoltre frequentemente è interessato anche il fegato, con possibilità di epatiti fulminanti. Meno gravi anche se frequenti sono i danni al rene ed all'apparato urinario in generale, e sospette sono alcune diarree incoercibili. Nell’adulto immunodepresso generalmente le infezioni da Adenovirus sono meno devastanti e passano in secondo piano rispetto ai rischi correlati alle infezioni da virus erpetici.
Diagnosi dell’infezione da hAdV
L'accertamento diagnostico di Adenovirus si ottiene mediante l'isolamento su colture di cellule epiteliali del virus presente nel materiale patologico o, indirettamente, con il controllo di un movimento anticorpale specifico. I campioni clinici più versatili sono tamponi faringei, nasali, congiuntivali, rettali e di urina. La diagnosi d’infezione da Adenovirus può essere effettuata attraverso la tecnica ELISA su feci o su sistemi cellulari oppure attraverso il metodo della PCR che risulta specifico per accertare o meno una possibile infezione. Può essere svolta anche tramite l'immunofluorescenza, oppure con la fissazione del complemento (con antisieri specifici), usati soprattutto per i campioni fecali dove l'Ag abbonda. Per campioni più difficili (respiratori, urinari, congiuntivali) si fa l'immunofluorescenza indiretta sul campione spottato su di un vetrino, anche se per via della scarsa sensibilità di queste tecniche si preferiscono test basati sulla PCR tradizionale o Real-Time. La sierologia è sicuramente indicativa in caso di titolo anticorpale (di tipo IgM) elevato, mentre le IgG spesso rimangono per tutta la vita una volta subita l'infezione primaria, quindi risultano essere poco indicative ai fini diagnostici [31, 32, 33, 34].
3.1.2 Parvoviridae
Figura 3.3 Human Bocavirus: rappresentazione schematica (a); immagini al microscopio elettronico (b) (c)
I virus appartenenti alla famiglia Parvoviridae sono tra i virus a DNA più piccoli, con un virione dal diametro compreso tra 18-26 nm, composto interamente di proteine e DNA. Essi sono ampiamente distribuiti in animali a sangue caldo. Tra questi, Human Bocavirus fu identificato per la prima volta nel 2005 a Stoccolma (Svezia) da Allander e colleghi in un aspirato nasofarigeo. É un piccolo virus nudo, composto da una singola molecola di DNA lineare (ssDNA) di 5 kb racchiusa all’interno di un nucleocapside a simmetria icoesaedrica costituito da 60 subunità proteiche.
Human Bocavirus replica nel nucleo delle cellule infettate. Tra i virus a DNA, sembra essere quello che è più dipendente dalle funzioni cellulari in quanto, per replicarsi, ha bisogno che la cellula infettata entri in fase S. Contrariamente a Polyomavirus e Adenovirus, i Parvovirus non sono in grado di stimolare o indurre la sintesi di DNA in cellule a riposo, ma devono semplicemente aspettare che la cellula infettata entri in fase S.
Epidemiologia del BoV
HBoV è diffuso in tutto il mondo ed è altamente conservato: campioni prelevati in Australia, America, Asia ed Europa presentano una sequenza genica pressoché omologa. Alcuni studi hanno dimostrato una presenza dell’1,5-19% di hBoV nel tratto respiratorio di bambini ospedalizzati, sintomatici. La maggior parte dei bambini infetti ha meno di 24 mesi di vita, mentre negli adulti è raro identificare questo virus. Recentemente alcuni dati sierologici provenienti dal Giappone mostrano una sieroprevalenza del 71% in soggetti dai 0 ai 41 anni di età, nello specifico 5,6% nella fascia tra i 6 e gli 8 mesi e 94-100% di sieropositività in soggetti dai 6 anni in su. Il fatto che si ritrovi una sieroprevalenza così elevata sopra i 6 anni, senza però identificare il virus in questi soggetti, suggerisce lo sviluppo di un immunità permanete a seguito della prima infezione. Recenti studi hanno dimostrato la presenza di questo virus anche in Italia, la prevalenza del virus (3,5% circa dei soggetti
analizzati) è più elevata nei bambini (4,5%) che nei soggetti adulti (1,2%) con malattie respiratorie. Se l'andamento dell'infezione sia stagionale o meno non è ancora prevedibile con i dati fino ad ora raccolti, anche se si sono osservate differenze significative nell'andamento stagionale dell'infezione in anni diversi.
Trasmissione Dell’infezione da BoV
Per quanto riguarda le vie di trasmissione di HBoV, si ipotizza che possa avvenire per via aerea come per gli altri patogeni responsabili di infezioni a carico dell’apparato respiratorio, questo pare sia confermato dal fatto che nelle secrezioni respiratorie vi è un elevata carica virale. È inoltre ipotizzata la trasmissione diretta ed indiretta da superfici ed oggetti contaminati, vista la resistenza dei Parvovirus all'ambiente esterno ed ai disinfettanti, mentre la via di trasmissione oro-fecale non viene esclusa.
Sintomi dell’infezione da BoV
La sintomatologia legata ad HBoV non è ancora bene definita, come la sua reale identità patogena per l'uomo. I sintomi clinici più frequentemente descritti in soggetti in cui hBoV è l'unico virus individuato sono: tosse, rinorrea, febbre ed alcuni studi riportano l'insorgenza nel 42% di un otite media in questi soggetti. La diagnosi più frequente sia in casi di coinfezione, sia in casi dove non si osserva coinfezione, è quella di infezione alle vie aeree inferiori (bronchiti, bronchioliti e polmoniti), con frequentemente associata ostruzione delle vie aeree (wheezing) ed esacerbazione dell'asma (fino al 27% dei casi in alcuni trial). A livello clinico il decorso è sovrapponibile con altre infezioni virali delle vie aeree (RSV, hMPV), anche se l'infezione non rimane confinata al tratto respiratorio, perché il virus è stato ritrovato nel sangue e nelle feci. In particolar modo un caso d'isolamento del virus nelle feci di un bambino con sintomi respiratori e diarrea, non esclude una possibile implicazione del virus nell'insorgenza di patologie gastro-intestinali.
Diagnosi dell’infezione da BoV
Attualmente gli unici metodi utilizzati per ricercare questo virus sono quelli di biologia molecolare (PCR e PCR Real-Time). I campioni ideali alla ricerca di hBoV non sono ancora ben stati definiti, soprattutto per la mancanza di conoscenza del sito di replicazione di hBoV. Recentemente alcuni studi preliminari hanno cercato di ampliare il pannello diagnostico utile all'identificazione di hBoV, mediante l'utilizzo della sierologia [76, 77, 78, 79,80].
3.2
Virus a RNA responsabili di patologie del tratto respiratorio
3.2.1 Orthomixoviridae – Virus influenzali (tipo A, B e C)
(a) (b)
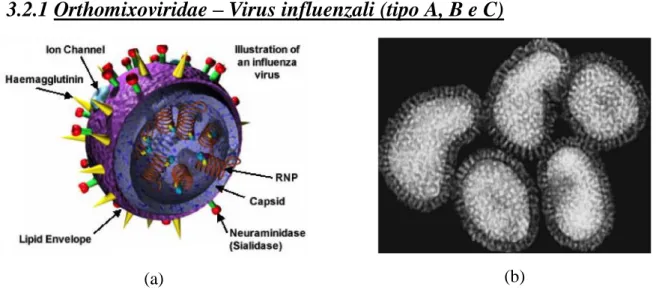
Figura 3.4 Modello di Orthomyxovirus (a) e suo aspetto al TEM (b)
I virus dell’influenza appartengono alla famiglia delle Orthomyxoviridae, è divisa in quattro generi: Virus Influenzali A, Virus Influenzali B, Virus Influenzali C e Togothovirus (a cui appartengono i
virus Togotho e Dhori, trasmessi da artropodi e di incerta e modesta patogenicità per l'uomo). Gli Orthomyxovirus vengono classificati nei tre tipi: A, B e C, in base all’antigenicità delle proteine
del core, ovvero gli antigeni maggiori NP (nucleoproteina) e M1 (proteina della matrice) [10]. Sono virus di forma sferica con un diametro di 80-120 nm, e hanno un envelope esterno costituito da un bilayer lipidico, dal quale sporgono due tipi di glicoproteine: l’emoagglutinina (HA, un trimero di 135 aa), e la neuroaminidasi (NA, un tetramero di 60 aa) (Figura 3.3). L’HA è il principale determinante antigenico responsabile del riconoscimento e dell’adesione ai recettori specifici delle cellule bersaglio contenenti un residuo di acido sialico. L’HA media la fusione tra la membrana virale e quella cellulare, per permettere l’ingresso del core virale nella cellula ospite. L’NA premette l’ancoraggio del virus alla membrana ospite grazie alla sua attività neuroaminidasica. Inoltre ha un ruolo nella liberazione dei virioni maturi dalla cellula infetta e ne impedisce l’aggregazione al di fuori della cellula ospite. I virus in grado di infettare la specie umana sono caratterizzati da 3 tipi di HA (H1, H2, H3) e due tipi di NA (N1, N2). L’envelope circonda un capside costituito da proteine della matrice (M1 e M2) che intervengono nell’assemblaggio del virus e nello stabilizzare la componente lipidica. La parte più interna è costituita dal core nucleocapsidico a simmetria elicoidale, in cui è contenuto il genoma virale: questo è costituito da 8 segmenti (7 nel sierotipo C) di RNA a singolo filamento a polarità negativa, associati alla nucleoproteina NP ed a 3 polimerasi (PB1, PB2 e PA) [35].
Epidemiologia del virus dell’influenza
I virus influenzali sono diffusi in tutto il mondo e sono tra i principali responsabili di affezioni alle vie respiratorie, si calcola che ogni anno circa il 20% dei bambini ed il 5% degli adulti della popolazione mondiale sviluppi un influenza sintomatica di tipo A o B. Questi virus sono da molto tempo causa di epidemie ricorrenti e sono famosi per le occasionali e fortunatamente più sporadiche, pandemie con spesso associata elevata morbosità e letalità.
L'andamento epidemico è a carattere stagionale e le epidemie tendono a manifestarsi per 6-8 settimane tra dicembre e marzo nell'emisfero boreale e tra maggio e settembre nell'emisfero australe (mesi freddi). Generalmente si presenta improvvisamente, raggiungendo il picco dopo 2-3 settimane e declinando in 5-6 settimane.
Alla base della epidemiologia dell'influenza vi è la marcata tendenza di tutti i virus influenzali a variare, cioè ad acquisire mutazioni nelle proteine di superficie, permettendo loro di aggirare l’esistente immunità specifica degli individui che in passato hanno subito l’infezione influenzale. Il virus dell’influenza si distingue dalle altre infezioni respiratorie per due caratteristiche: la prima consiste nel passaggio dell’infezione direttamente dall’animale all’uomo; la seconda, e più importante, consiste nella variazione degli antigeni virali NA e, soprattutto, HA. Questa variazione avviene principalmente per il virus influenzale di tipo A ed è responsabile della formazione di nuovi ceppi virali verso i quali la popolazione non possiede ancora anticorpi. Per questo motivo l’influenza viene considerata la maggiore patologia a carattere epidemico. Due sono meccanismi in grado di generare variabilità antigenica: l’antigenic drift e l’antigenic shift.
L’antigenic drift coinvolge sia i virus di tipo A sia quelli di tipo B; esso si verifica nei periodi interpandemici, ogni 1-3 anni e genera nuovi ceppi nell’ambito dello stesso sottotipo. Le epidemie che si verificano quindi sono limitate nel tempo e meno gravi. L’antigenic drift è dovuto a ripetute mutazioni (anche puntiformi) che causano una o più sostituzioni amminoacidiche a livello degli antigeni HA o NA. Si ha quindi una variazione nella struttura primaria dell’antigene, che può non venire più riconosciuto dagli anticorpi di una parte di popolazione, dando origine così ad epidemie locali. Alla base dell’antigenic drift vi è la mancata attività di proof reading da parte dell’RNA polimerasi virale, ciò permette quindi l’insorgenza di ripetuti errori nella sequenza genica che non vengono pertanto corretti [12, 13].
L’antigenic shift, invece, è detto riassortimento antigenico maggiore. Esso si verifica solo nel virus di tipo A ed è responsabile degli episodi pandemici ogni 10-12 anni, verso i quali nessun soggetto della popolazione è immune. Alla base dell’antigenic shift vi è il riassortimento genico tra un ceppo animale e uno umano. Ciò è reso possibile dalla segmentazione del genoma virale, per la quale uno
o più segmenti virali umani vengono sostituiti dal corrispondente segmento di origine animale. Il riassortimento può avvenire in un ospite intermedio, spesso rappresentato dal maiale. Se lo shift coinvolge simultaneamente sia gli antigeni HA che quelli NA si può verificare una pandemia, cioè una particolare forma di epidemia che travalica i confini di una nazione, espandendosi nei diversi continenti nel volgere di poco tempo, con conseguente aumento dei tassi di mortalità. Se invece lo shift riguarda solo gli antigeni HA il nuovo virus causerà pandemia, ma sarà clinicamente meno grave.
Proprio questo meccanismo di antigenic shift è alla base delle pandemie che hanno severamente colpito il secolo scorso. Tra queste la più devastante fu l'influenza spagnola con 40 milioni di decessi, il 50% dei quali in soggetti di età compresa tra i 20 ed i 40 anni.
Oltre a queste pandemie recentemente si sono verificati altri due casi a carattere pandemico/epidemico che hanno causato notevole allarme tra la popolazione mondiale e le Organizzazioni Sanitarie. Il primo riguarda la cosiddetta influenza aviaria H5N1 molto diffusa nel sud-est asiatico, il cui ospite naturale era rappresentato da numerose specie di uccelli. Nel 1997 ad Hong Kong si verificarono i primi casi umani mortali, quando si scoprì che il virus era in grado di infettare direttamente l'uomo senza dover passare da un altro ospite suscettibile. Nel dicembre 2003 in Vietnam si ebbe la ricomparsa dello stesso ceppo virale e da allora quasi 400 sono i casi d’infezione umana ricondotti all'influenza H5N1, con quasi il 50% di letalità, riportati in una dozzina di paesi tra Asia, Africa e Medio Oriente, zone in cui il virus è stabilmente insediato nella fauna avicola del posto - infatti l'infezione è contraibile solo per inalazione di materiale proveniente dagli animali infetti- e non vi è una trasmissione interumana di questo ceppo. Altri ceppi aviari responsabili d’influenza nell'uomo oltre la H1N1 (influenza spagnola) e la H5N1 (influenza aviaria) sono H9N2 (1999) e H5N2 (2006), essi fortunatamente non hanno mostrato la stessa virulenza dei primi due. Il secondo allarme influenza insorse nell’aprile 2009 con la comparsa in Messico di un esteso focolaio infettivo, con alcune decine di decessi, causato da un virus influenzale A (H1N1) definito come influenza suina. Questo nuovo ceppo con significativa deriva antigenica rispetto ai ceppi di H1N1 fino ad allora circolanti è il risultato di un triplo riassortimento virale (virus suino; virus aviario e virus umano), caratterizzato da una notevole trasmissibilità interumana. Nel giro di pochi mesi provocò alcune centinaia di migliaia di casi in quasi tutti i continenti (l'OMS dichiarò la pandemia). Fortunatamente, a parte il relativo elevato tasso di mortalità riscontrato nel primo focolaio infettivo, l'infezione in tutti gli altri soggetti ha avuto un decorso relativamente benigno.
Trasmissione del virus dell’influenza
L'infezione si contrae per arrivo del virus sulle mucose delle prime vie aeree o delle congiuntive per via aerea o per contatto diretto con persone infette che eliminano il virus, presente nella saliva e nel muco, mediante colpi di tosse, starnuti o durante la fonazione. A facilitare la diffusione virale è il fatto che il virus può essere trasmesso dal momento del contagio, quindi prima della comparsa dei sintomi clinici (incubazione di 1-4 giorni) e fino a 3-4 giorni successivi alla comparsa dei primi sintomi. Altra modalità di contagio è la trasmissione indiretta per contatto di superfici contaminate su cui il virus ha una discreta resistenza (2-3 gg).
Sintomi del virus dell’influenza
Il virus, una volta penetrato nell'organismo, s’impiantata nella mucosa delle vie aeree superiori dove supera l'ostacolo del muco grazie all'azione della proteina NA, in grado di rimuovere l'acido sialico largamente presente nel muco. Nella mucosa il virus inizia a replicare causando una rapida necrosi delle cellule delle vie aeree superiori ma può anche scendere fino alla trachea e ai bronchi. Il periodo d’incubazione varia da 1 a 3 giorni con picchi di 5 giorni e generalmente non vi sono fasi di viremia. Dall'esordio dei sintomi la malattia si risolve generalmente nell'arco di 5 giorni. I sintomi caratterizzanti l'influenza sono febbre, mialgia, brividi, tosse, cefalea, ecc. È importante sottolineare che nonostante l'infezione sia localizzata all'apparato respiratorio la sintomatologia è sistemica, a causa del rilascio di pirogeni endogeni (soprattutto interferone) durante l'infezione. L'influenza, sebbene nell'adulto sia autolimitante e spesso asintomatica (20% dei casi) o con un quadro simile al raffreddore o alla faringite può, talvolta, dare gravi complicazioni alle basse vie aeree (bronchioliti e polmoniti). Nei soggetti interessati da patologie polmonari croniche o in altri come anziani, donne gravide, diabetici, cardiopatici, immunodepressi l'infezione dal virus dell’influenza può presentare importanti complicazioni.
Diagnosi del virus dell’influenza
Nei periodi epidemici la diagnosi generalmente si basa sul riconoscimento dei sintomi clinico-epidemiologici. In altre situazioni invece l'aspecificità della sintomatologia, rende difficoltoso questo tipo di diagnosi. Ne consegue la necessità di una diagnosi di laboratorio attraverso metodi diretti o indiretti. Il campione più idoneo è rappresentato da secrezioni nasofaringee. Le prove dirette prevedono isolamento virale rapido su Shell-Vial e richiede 2 giorni per analizzare la comparsa dell'effetto citopatico e successivamente ulteriori indagini di tipizzazione e sub-tipizzazione virale. Per questo è preferibile usare metodiche più rapide come RT-PCR, o metodi immunoenzimatici ed immunocromatografici che richiedono meno di 1 ora di tempo. La sensibilità di questi test rapidi
varia a seconda del campione su cui si effettua l'indagine e sul metodo utilizzato, comunque si stima una sensibilità media del 70% ed una specificità intorno al 90%. Per quanto riguarda la sierologia si effettuano due prelievi a distanza di 2-4 settimane e si valuta l'eventuale innalzamento dei titoli anticorpali, indice di infezione recente. La ricerca delle IgM specifiche (indice di infezione in atto) non è sempre praticabile, perché lo sviluppo di IgM ed IgG dipende dalla precedente storia di infezioni da virus influenzali di ogni singolo individuo [35, 36, 37].
3.2.2 Paramyxoviridae
Virus parainfluenzali (HPIV-1, 2, 3 e 4)
(a) (b)
Figura 3.5 Modello di HPIV (a) e immagine di HPIV al TEM (b)
I virus parainfluenzali appartengono alla famiglia Paramyxoviridae, sottofamiglia Paramyxovirinae, genere Paramyxovirus. Essi possono infettare animali terrestri, mammiferi acquatici, volatili e alcuni rettili. Includono inoltre parecchi virus patogeni per il tratto respiratorio dell’uomo, simili per alcuni aspetti ai virus influenzali, ma da cui differiscono per le dimensioni e le caratteristiche degli antigeni di superficie. I virus parainfluenzali umani (hPIV) si distinguono antigenicamente in 5 tipi: 1, 2, 3, 4A e 4B. Tutti quanti causano infezioni respiratorie nell’uomo, anche se con epidemiologia e quadro clinico differente [3]. L’hPIV-1, 2 e 3 sono più diffusi rispetto al tipo 4; in particolare hPIV 1 e 2 sono associati a “croup” (laringotracheobronchite) e malattie dell’alto e basso tratto respiratorio, mentre hPIV 3 causa maggiormente bronchioliti e polmoniti. I virus parainfluenzali hanno forma generalmente sferica, con diametro variabile tra i 150 nm e i 250 nm. Possiedono un envelope lipidico, che deriva dalla membrana plasmatica della cellula ospite, contenente il nucleocapside a simmetria elicoidale; questo è costituito dalle nucleoproteine NP, presenti in maggior percentuale, e le proteine P ed L, ad attività RNA-polimerasica. Dall’envelope esterno sporgono 2 glicoproteine:
F e HN. La prima media la fusione con la cellula ospite e possiede attività emolisinica, la seconda è invece responsabile dell’attacco ai recettori delle cellule ospiti e possiede attività emoagglutinante e neuroaminidasica. Al di sotto dell’envelope si trova la proteina di matrice M che interagisce con il nucleocapside interno e le 2 proteine di superficie Il genoma è costituito da un singolo filamento di RNA a polarità negativa di lunghezza variabile compresa tra 15.000-16.000 nucleotidi. [38, 39, 40]
Epidemiologia dell’hPIV
Secondo l'OMS le infezioni respiratorie acute, in particolare le polmoniti provocano circa 4 milioni di morti ogni anno soprattutto tra i bambini di età inferiore ai 5 anni: la maggior parte di queste infezioni sono causate da Paramyxovirus.
Per quanto riguarda i virus parainfluenzali essi sono ubiquitari e causano infezioni respiratorie a tutte le età, soprattutto perché, la risposta immunitaria conseguente all'infezione da virus parainfluenzali è robusta, ma di breve durata, e frequenti sono i casi di reinfezione (sebbene più attenuati) ad opera degli stessi sierotipi. I più diffusi sono i sierotipi 1, 2 e 3, secondi solo a RSV per quanto riguarda le infezioni respiratorie gravi nei bambini, mentre raramente è stato isolato hPIV4, causa di infezioni negli infanti. A due anni di età quasi il 100% dei bambini è sieropositivo al virus parainfluenzale di tipo 3, che colpisce più frequentemente nel primo anno di vita, in particolare modo nei primi sei mesi. A cinque anni il 75% dei bambini risulta positivo contro i ceppi 1 e 2, di cui la maggioranza delle infezioni colpisce i bambini tra i 7 ed i 36 mesi di vita (picco stimato tra il secondo ed il terzo anno di vita). Non provocano epidemie così estese come nel caso dei virus influenzali, e le affezioni dovute al ceppo 3 sono presenti in percentuali diverse durante tutto l'anno, mentre i tipi 1 e 2 hanno incidenza massima nei mesi autunno-invernali. Il tipo 4 provoca una lieve malattia respiratoria, mentre gli studi di sieroprevalenza indicano che il 60-84% dei neonati dopo la nascita ha titoli anticorpali significativi, probabilmente di origine materna.
Trasmissione dell’hPIV
Il virus si trasmette per contatto indiretto, e successiva auto-inoculazione, con materiale e superfici infette in cui il virus sopravvive tra le 4 e le 10 ore a seconda che il materiale sia rispettivamente liscio o poroso. La trasmissione per via aerea non è particolarmente elevata nemmeno a distanza ravvicinata (60 cm) e nemmeno la modalità di trasmissione per contatto diretto è supportata a livello sperimentale, in quanto il virus sulle mani sopravvive per circa 10 minuti, di conseguenza è improbabile che il virus si trasmetta per stretta di mano o per qualunque altro contatto diretto.
Sintomi dell’infezione da hPIV
I Virus Parainfluenzali sono stati associati ad ogni tipo di patologia delle vie aeree superiori ed inferiori. Il virus replica nelle cellule epiteliali delle vie aeree superiori, dove di norma rimane confinata l'infezione (rinofaringe). Il tempo d’incubazione varia abbastanza e dipende in parte dal virus infettante: di solito 24-48 h per il virus della parainfluenza di tipo 3, e 4-5 gg per il tipo 1, mentre il periodo di malattia è di 3-4 giorni. Nei bambini l'infezione primaria è caratterizzata da riniti, faringiti, spesso febbre e bronchiti. Nei neonati (6-18 mesi) si possono avere le complicanze alle basse vie respiratori o un’otite media. Il sierotipo 4 non è associato ad importanti malattie nell'adulto, come nel bambino.
Diagnosi dell’infezione da hPIV
La diagnostica indiretta è utile solo in caso d’infezione primaria, mentre in casi di reinfezione la risposta immune è meno specifica e dà spesso cross-reattività. Il metodo migliore per l'identificazione è l'isolamento colturale tradizionale su linee cellulari continue di scimmia come le VERO. Questi virus però hanno una crescita lenta e producono un modesto effetto citopatico soprattutto nell’isolamento primario di hPIV. L’emoadsorbimento su globuli rossi di cavia può di solito consentire il rilievo di hPIV-1 e hPIV-3 infettanti da pochi giorni, e di hPIV-2 e hPIV-4 acquisiti da più tempo. Invece le Shell-Vials consentono un’identificazione rapida, ma la loro sensibilità non è elevata. L’immunofluorescenza diretta è molto specifica ma non altrettanto sensibile, nonostante l’utilizzo degli anticorpi monoclonali ne abbia incrementato la sensibilità. Per questi motivi sempre con maggior frequenza si ricorre a metodi molecolari come l’utilizzo della trascrittasi inversa nella polimerasi (RT-PCR).
I campioni usati per l'isolamento possono essere tamponi ed aspirati naso-faringei, lavaggi nasali e BAL, sui quali si possono effettuare l'identificazione e la tipizzazione virale mediante tecniche di biologia molecolare [38, 41, 42].
Virus respiratorio sinciziale (RSV)
(a) (b)
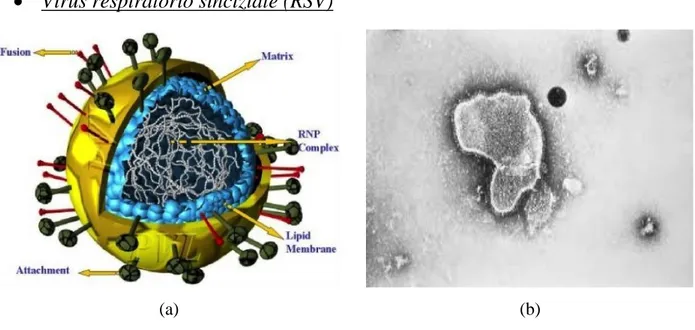
Figura 3.6 Struttura RSV (a) e immagine di RSV al TEM (b)
Il Virus Respiratorio Sinciziale è stato isolato nel 1956 ed immediatamente è stato riconosciuto come il principale agente di affezioni alle vie respiratorie in età pediatrica. Fa parte della Famiglia dei Paramyxoviridae; sottofamiglia Pneumovirinae; genere Pneumovirus. E' inoltre antigenicamente distinto in due sottotipi A e B. Il genoma a RNA lineare monocatenario a polarità negativa (circa 15 kb), contiene 10 geni, codificanti per 10 proteine strutturali e 2 non strutturali. La distinzione tra i sottotipi A e B è dovuta ad alcune differenze della proteina G dei due ceppi.
Epidemiologia dell’RSV
RSV è la più frequente causa d’infezione delle basse vie respiratorie della prima infanzia, con un’elevata virulenza e letalità. RSV si ripresenta ogni anno in forma di piccoli focolai epidemici durante i mesi più freddi (emisfero boreale tra novembre ed aprile), fornendo un notevole carico lavorativo agli ospedali, considerando che il 2-3% delle infezioni evolve in bronchioliti che richiedono ospedalizzazione. È un virus ubiquitario e l'incidenza nei primi 2 anni di vita è elevatissima, circa il 70% dei bambini sviluppa anticorpi anti-RSV durante il primo anno di vita e quasi il 100% entro il secondo anno. Il picco d’incidenza si ha nella fascia di età che va da dopo i 2-3 ai 6 mesi di vita. Nei primi mesi il neonato è protetto dalle immunoglobuline materne, mentre dopo i 6 mesi a causa dell'immaturità immunologica di questi soggetti, purtroppo la malattia si manifesta in maniera più severa. É stimato che le infezioni siano al mondo circa 65 milioni ogni anno, con circa 150.000 decessi. L'infezione colpisce oltre i bambini anche gli adulti, in forma più attenuata, anche se negli anziani e nei soggetti immunodepressi può dare forme cliniche di notevole gravità: è stimato che ogni inverno il 10% dei ricoveri di persone anziane è dovuto ad infezioni da RSV e la mortalità associata è di circa il 10%.
Trasmissione dell’RSV
Il virus, a trasmissione interumana, si trasmette per contatto diretto, in particolar modo delle mani, per via aerea attraverso le secrezioni respiratorie e per contatto indiretto di superfici e oggetti contaminati, con successiva auto-inoculazione. Le principali vie di ingresso del virus sono la mucosa congiuntivale e quella nasale. La sopravvivenza del virus su di una superficie varia in base al tipo di superficie e alla carica virale di partenza.
Sintomi dell’infezione da RSV
L'infezione da RSV inizia a livello della mucosa naso-faringea dove il danno è dato principalmente dalla replicazione massiccia dei virioni nell'epitelio respiratorio, in cui si ha la comparsa di un effetto citopatico caratterizzato dalla formazione di sincizi cellulari. In un secondo momento il danno è mediato soprattutto da fenomeni immunitari, in particolare nei casi in cui l'infezione diffonde, passando di cellula in cellula (non si assiste quasi mai ad una viremia), alle basse vie respiratorie, dove si verifica un importante infiltrazione linfocitaria peri-bronchiale, e la necrosi tissutale di bronchi e bronchioli che provocano l'ostruzione delle basse vie respiratorie. L'infezione rimane confinata alle alte vie respiratorie nella maggioranza dei casi, anche se nei bambini è spesso causa il 50-90% di ospedalizzazioni. Il 30% dei casi totali d’infezioni da RSV richiedono l'intervento del medico. Il periodo d’incubazione della malattia è di 3-5 giorni, periodo in cui si può già ritrovare nelle secrezioni naso-faringee un abbondante rilascio di virioni, che persiste per 2-3 settimane nei bambini, e 2-3 giorni negli adulti. L'infezione, qualora sia sintomatica si risolve in 3-5 giorni. Negli infanti sotto i 18 mesi la sintomatologia dell'infezione alle basse vie è caratterizzata da febbre modesta, dispnea (segnalata in circa il 10-50% delle bronchioliti associate a RSV) tachipnea, tachicardia, asma. Inoltre in circa un terzo dei bambini si sviluppa, come complicanza, un’otite media spesso ad eziologia batterica. Il sottotipo A è noto dare infezioni più severe rispetto al sottotipo B. Una buona parte delle infezioni vengono acquisite a livello nosocomiale data la precocità dell'incidenza dell'infezione da RSV, con possibilità di sviluppi epidemici. Sempre a livello nosocomiale, oltre i neonati, sono particolarmente suscettibili a questo patogeno i soggetti trapiantati di midollo, in cui l'infezione da RSV è associata ad un elevato rischio di mortalità.
Diagnosi dell’infezione da RSV
I campioni atti alla diagnosi di RSV sono tamponi o essudati naso-faringei e lavaggi nasali (nei bambini) per infezioni alle alte vie aeree, mentre per le basse vie aeree il materiale di elezione è il BAL. I metodi diretti più utilizzati sono la ricerca degli antigeni virali mediante immunofluorescenza o ELISA, direttamente sul campione (veloce e sensibile), o dopo isolamento rapido (Shell-Vials) che
richiede dalle 24 alle 48 ore. L'isolamento su linee cellulari umane (HeLa o Hep-2) con metodo classico richiede da 1 a 3 settimane prima che si osservi la comparsa dell'effetto citopatico (formazione di sincizi giganti). Su tamponi e lavaggi nasali si può inoltre condurre una RT-PCR, che permette la tipizzazione virale. La sierologia è poco utile ai fini diagnostici soprattutto nei neonati, e viene condotta su due campioni raccolti a distanza di 2-4 settimane, in cui la variazione del titolo anticorpale di almeno quattro volte è indicativa di infezione in atto [43, 44, 45, 46, 47].
Metapneumovirus (hMPV)
(a) (b)
Figura 3.7 Struttura e genoma di HMPV (a) e immagine di HPMV al TEM (b)
Il Metapneumovirus è un virus di recente scoperta, è stato isolato per la prima volta in Olanda nel 2001 dall'aspirato naso-faringeo di bambini che presentavano una sintomatologia simile a quella causata da RSV. Ha una organizzazione genica molto simile a quella del Pneumovirus aviario (virus della laringo-tracheite del tacchino), classificato fino ad allora come unico membro del genere dei Metapneumovirus, da cui ha ereditato il nome. Studi retrospettivi su campioni di siero raccolti a partire dal 1958 hanno dimostrato che la totalità della popolazione al di sopra degli 8 anni ha sviluppato anticorpi conto hMPV, ne consegue che non è un patogeno emergente.
hMPV fa parte della famiglia dei Paramyxoviridae, sottofamiglia Pneumovirinae, genere
Metapneumovirus. E' inoltre distinto sulla base di differenze geniche in due genotipi A e B. La struttura è analoga a quella di tutti i Paramyxovirus. Il genoma a RNA lineare monocatenario a
polarità negativa (circa 13 kb), ha una complementarietà del 80- 90% (a seconda dei sottotipi confrontati) con la sequenza genomica di RSV.
Epidemiologia dell’hMPV
hMPV è un virus ubiquitario, con un andamento epidemiologico stagionale, che presenta, nei climi temperati, il picco nei mesi di fine inverno e primaverili (dicembre e febbraio), mentre nei climi sub tropicali l'incidenza aumenta nei mesi primaverili. A prescindere dalla locazione, spesso i picchi d’infezioni da hMPV accompagnano o seguono quelli da RSV. Sono stati riscontrati in un gran numero di casi, co-infezioni di hMPV ed RSV con aggravamento del quadro clinico del paziente, infatti l’identificazione di hMPV può rappresentare un potenziale fattore di aggravamento dell’infezione respiratoria. [48] L'infezione colpisce soprattutto in età prescolare (< 5 anni), con un particolare rischio di sviluppo di forme gravi per i bambini sotto ai 2 anni. Uno studio ha mostrato che il picco d’incidenza si ha tra i 4 ed i 6 mesi di vita dell'infante, anche se mediamente l'infezione da hMPV insorge meno precocemente rispetto all'infezione da RSV. Ogni anno circolano 2-3 ceppi differenti di hMPV, che danno fenomeni epidemiologici localizzati, anche se è frequente lo scambio di genotipi tra una popolazione e l'altra, anche nello stesso anno. hMPV è responsabile del 10-20% delle infezioni delle basse vie respiratorie in bambini. Negli adulti l'incidenza è molto più bassa (circa il 3% delle ARI), ma negli immunodepressi il virus può instaurare infezioni croniche importanti a livello polmonare.
Trasmissione dell’hMPV
Si ritiene che l'hMPV si trasmetta per via aerea e probabilmente per contatto diretto di oggetti contaminati.
Sintomi dell’infezione da hMPV
hMPV è associato ad infezioni delle vie aeree in soggetti di tutte le età, con lo sviluppo di patologie più severe nei bambini, negli anziani e negli immunocompromessi: circa il 12% delle LRTI si deve a questo virus, secondo solo, come incidenza, a RSV. L'esordio della malattia si ha dopo un periodo d’incubazione di circa 5-6 giorni, e si manifesta tipicamente con un raffreddore, complicato in un terzo dei casi da un’otite media. L'infezione da hMPV è indistinguibile da quelle da RSV e, sebbene sia meno severa rispetto a quella indotta da RSV, hMPV è un importante causa di bronchioliti, polmoniti e croup nei bambini, in particolare in quelli di età inferiore ai 2 anni. Nell'adulto generalmente si manifesta con una sintomatologia simil-influenzale o raffreddore, mentre alcuni studi riportano un’elevata mortalità negli anziani colpiti da hMPV, che frequentemente vanno incontro all'insorgenza di polmoniti ed all'esacerbazione dell'asma.
Diagnosi dell’infezione da hMPV
L'isolamento di questo virus, con comparsa dell'effetto citopatico (10-21 giorni) è possibile solo su alcune linee cellulari di rene di scimmia LLCMK-2, anche se è stato dimostrato che anche alcuni cloni di VERO sono permissivi al virus ed alla comparsa dell'effetto citopatico. É inoltre riportato in letteratura l'utilizzo delle Shell-Vial per l'isolamento del virus in campioni pediatrici. La ricerca degli antigeni utilizzando anticorpi specifici in immunofluorescenza è utilizzata, anche se per via della sensibilità nettamente superiore sono da preferire i metodi molecolari (RT-PCR).
La ricerca indiretta degli anticorpi è poco indicativa a causa dell'elevata diffusione di questo virus (100% di sieroprevalenza negli adulti). La sierologia risulta utile solo in casi di sieroconversione, o di incremento di almeno 4 volte del titolo anticorpale [49, 50, 51, 52].
3.2.3 Coronaviridae (CoV)
(a) (b)
Figura 3.8 Struttura CoV (a) e CoV al TEM (b)
I Coronavirus sono un gruppo di 36 virus molto diffusi e responsabili dell'infezione di numerose specie animali (polli, tacchini, uccelli selvatici, pipistrelli, roditori, equini, suini, cani, felini e bovini) e nell'uomo. In Figura 3.9 sono raggruppati in 3 Generi diversi (Alpha-, Beta- e Gamma-coronavirus) e rientrano nella sottofamiglia dei Coronavirinae, a sua volta facente parte, insieme alla Sottofamiglia dei Torovirinae, della Famiglia dei Coronaviridae (Ordine dei Nidovirales).
Figura 3.9 Classificazione Coronavirus
Un quarto gruppo genetico, Delta-coronavirus, che includerebbe: BuCoV HKU11, THCoV HKU12 and MunCoV HKU13 è stato proposto, ma non è ancora stato rettificato dall'ICTV (Internetional Committee on Taxonomy Viruses). I primi due gruppi contengono agenti eziologici dei mammiferi, il terzo gruppo è rappresentato dai Coronavirus aviari, mentre i virus responsabili della sindrome respiratoria grave, cioè i SARS-Coronavirus (Severe Acute Respiratory Sindrome), non sono ancora stati ufficialmente classificati, in quanto si differenziano geneticamente e biologicamente da tutti e tre i generi.
Negli animali questi virus sono associati a sindromi respiratorie delle alte e basse vie, sindromi enteriche (gastroenteriti), epatiti, encefaliti e nei casi più gravi a patologie multiorgano (infezione respiratorie-enterica più pleurite, pancreatite, peritonite, miocardite ed encefalite). A causa dell'elevata mortalità che queste affezioni causano nei giovani animali d'allevamento, le infezioni da Coronavirus hanno una notevole importanza economica. I Coronavirus responsabili d’infezioni nell'uomo (hCoV) sono il Coronavirus 229E (Alpha-Coronavirus), ed il Coronavirus OC43 (Beta-Coronavirus), che condividono la stessa organizzazione del genoma e sono responsabili di riniti e rinofaringiti nell'uomo. Più recentemente sono stati isolati altri tre hCoV. Primo per patogenicità il SARS-Coronavirus descritto per la prima volta nel sud della Cina tra il 2002 ed il 2003, caratterizzato dall'elevato tasso di mortalità che ha causato in questo biennio serie preoccupazioni agli Organismi Sanitari Internazionali perché si temeva la diffusione in forma pandemica, che fortunatamente non si
verificò. Gli altri due hCoV di recente identificazione (isolati da casi d’infezioni respiratorie pediatriche) appartengono entrambi agli Alpha-coronavirus e sono NL63 e HKU1, in particolare dati preliminari indicano NL63 come frequente causa di infezioni pediatriche sia delle alte, che delle basse vie respiratorie.
I CoV sono virus rivestiti, di forma tondeggiante, con un diametro tra i 100 e i 150 nm. Dall'envelope si estroflettono per circa 20nm le glicoproteine S (spike) coinvolte nell'interazione con il recettore cellulare e target degli anticorpi (Figura 3.8). I CoV hanno un genoma a singolo filamento di RNA a polarità positiva di 27-32 kb a seconda del genotipo (non sono noti virus a RNA con un genoma più lungo). Il filamento di RNA nel nucleocapside prende rapporti con la proteina N che ha la funzione di stabilizzare il genoma virale. SARS-CoV ha un genoma di 29750 basi, con un organizzazione simile a quella degli altri Coronavirus, anche se presenta differenze significative da tutti e tre i gruppi della famiglia. Studi hanno evidenziato che il genoma di hSARS-CoV è molto simile ad un SARS-CoV che infetta alcuni animali selvatici (zibetto) e domestici delle aree rurali del sud della
Cina ed anche alcune specie di animali da allevamento, utilizzate nella gastronomia cinese. La somiglianza genetica dei due virus e il fatto che i primi ad ammalarsi sono stati ristoratori e
macellai, che venivano a contatto con questi animali, ha indotto la comunità scientifica a sostenere che il SARS-CoV umano derivi da un adattamento di specie del SARS virus zoologico.
Epidemiologia dei coronavirus
I genotipi virali hCoV-229E ed hCoV-OC43 sono ubiquitari e da tempo sono conosciuti come i principali responsabili, insieme ai Rhinovirus di affezioni alle alte vie respiratorie, in particolar modo del raffreddore. Sono responsabili di circa il 30% delle infezioni del tratto respiratorio nella popolazione generale, con particolare morbosità nel periodo primaverile/invernale. Per quanto riguarda SARS-CoV, a partire dal Novembre 2002, nel sud della Cina (Guangdong) per la prima volta è stata descritta un epidemia di polmonite atipica denominata SARS (Severe Acute Respiratory Syndrome), dove rimase circoscritta per i primi mesi. Dai soggetti malati è stato isolato questo nuovo Coronavirus, chiamato poi Severe Acute Respiratory Syndrome Related Coronavirus (SARS-CoV). Nel 2003 probabilmente inseguito ad un importante episodio di diffusione del virus in un hotel ad Hong Kong, molte persone residenti su di uno stesso piano contrassero l'infezione da un soggetto proveniente dalla Cina. Questi soggetti poi raggiungendo durante il periodo d’incubazione diverse destinazioni, hanno contribuito alla diffusione del virus in Canada, estremo Oriente, mentre in Europa si sono verificati solo casi individuali in cui l'infezione è certamente avvenuta in Asia. L'epidemia si è caratterizzata per casi di bronco-polmonite gravi ed elevata mortalità, intorno al 10% nella popolazione generale, e con picchi del 40-50% negli ultrasessantenni. Nel biennio 2002 e 2003 si