Università degli Studi Mediterranea di Reggio Calabria
Dottorato di Ricerca in
Scienze e Tecnologie Agrarie, Alimentari e Ambientali
XXVIII° CICLO
Curriculum
Produzioni Zootecniche nel Bacino del Mediterraneo
Valutazione dei potenziali effetti chimici e biologici da ingestione di
microplastiche nella spigola Dicentrarchus labrax (Linnaeus, 1758).
Coordinatore Dottoranda
Ch.ma Prof. ssa Maria Rosa Abenavoli Dott.ssa Cristina Pedà
Tutor
Ch.mo Dott. Manuel Scerra
Dott.ssa
Giulia Maricchiolo
Dott.ssa
Teresa Romeo
Alla mia nonnina, che mi ha trasmesso la passione per il mare.
I
INDICE
1. INTRODUZIONE pag. 1
1.1. INQUINAMENTO DA MARINE LITTER pag. 1
1.1.1. Mar Mediterraneo e marine litter pag. 3
1.2. LE MATERIE PLASTICHE pag. 4
1.2.1. Plastica in ambiente marino pag. 7
1.2.2. Degradazione della plastica in ambiente marino pag. 10
1.2.3. Impatto da plastic litter in ambiente marino pag. 12
1.3.LE MICROPLASTICHE pag. 16
1.3.1. Fonti e trasferimento delle microplastiche in ambiente marino pag. 17 1.3.2. Distribuzione delle microplastiche lungo la colonna d’acqua pag. 19
1.3.3. Impatto ambientale delle microplastiche pag. 19
• Ingestione di microplastiche da parte di organismi marini • Ingestione di microplastiche e rilascio di additivi
• Ingestione di microplastiche ed adsorbimento di inquinanti ambientali
1.3.4. Microplastiche nel Mediterraneo pag. 22
1.4. CLORURO DI POLIVINILE (PVC) pag. 23
1.4.1. Additivi nel PVC pag. 24
1.4.2. Inquinanti ambientali e PVC pag. 24
1.5. INQUINANTI AMBIENTALI pag. 25
1.5.1. Inquinanti e ambiente marino pag. 27
1.5.2. Additivi plastici pag. 28
II
1.5.4. Inquinanti organici persistenti (POPs) pag. 31
1.5.5. POPs e ambiente marino pag. 33
1.6. ANALISI ECOTOSSICOLOGICHE pag. 34
1.6.1. Livelli di organizzazione biologica pag. 35
1.6.2. Organismo “biondicatore” pag. 35
1.6.3. Biotrasformazione pag. 36
1.6.4. Biomarker pag. 37
1.6.5. Classificazione dei biomarker pag. 39
1.6.6. Alterazioni del DNA pag. 40
1.6.7. Risposte di proteine pag. 41
1.6.8. Prodotti metabolici pag. 41
1.6.9. Alterazioni istopatologiche pag. 42
1.7. SPECIE TARGET: LA SPIGOLA (Dicentrarchus labrax, Linnaeus, 1758) pag.43
1.7.1. Caratteristiche della specie pag. 43
• Morfologia
• Distribuzione geografica e batimetrica
• Biologia
1.7.2. Modello sperimentale pag. 46
2. OBIETTIVI pag. 48
2.1. OBIETTIVI GENERALI E SPECIFICI pag. 48
3. MATERIALI E METODI pag. 50
3.1. DISEGNO SPERIMENTALE pag. 50
III
3.1.2. Rilevazione parametri chimico-fisici pag. 51
3.1.3. Gestione delle spigole e somministrazione dei mangimi pag. 52
3.2. CAMPIONI DI PVC pag. 54
3.2.1. PVC nativo pag. 54
3.2.2. PVC marino pag. 55
3.2.3. Lavorazione campioni di PVC pag. 56
3.3. TRATTAMETI ALIMENTARI pag. 56
3.3.1. Mangime controllo pag. 57
3.3.2. Mangimi sperimentali pag. 59
3.4. CAMPIONAMENTO ED ANALISI pag. 60
3.5. INDICI MORFOMETRICI pag. 61
3.5.1. Indici biometrici pag. 61
3.5.2. Indici somatici pag. 62
3.6. ANALISI ECOTOSSICOLOGICHE pag. 62
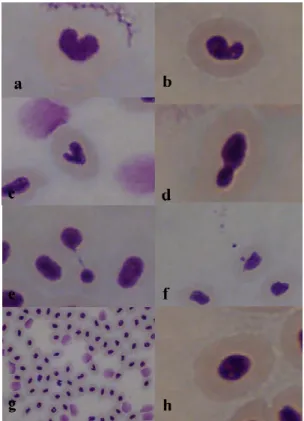
3.6.1. Erythrocytic Nuclear Abnormalities (ENA) assay pag. 62
3.6.2. Attività Etossiresorufina-O-deetilasi (EROD) pag. 64
3.6.3. Analisi Perossidazione Lipidica pag. 65
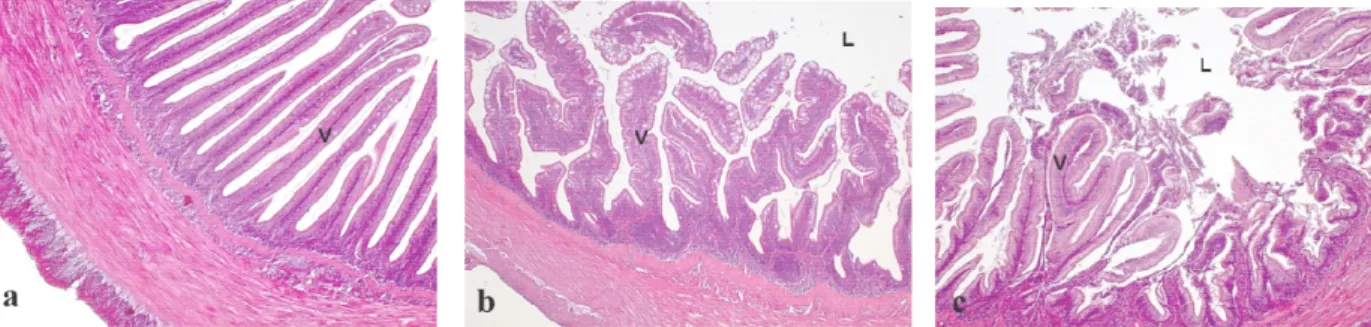
3.6.4. Analisi istologiche del fegato e intestino pag. 66
3.6.5. Analisi istologiche delle neoformazioni pag. 68
3.7. ANALISI CHIMICHE SUI CAMPIONI DI PVC E MANGIMI pag. 68
3.7.1. Analisi del di-(2-etilesil) ftalato (DEHP) pag. 68
3.7.2. Analisi dei composti organoclorurati (OCs) pag. 69
IV
3.8. ANALISI STATISTICA pag. 71
4. RISULTATI pag. 73
4.1. INDICI MORFOMETRICI pag. 73
4.1.1. Indici biometrici pag. 73
4.1.2. Indici somatici pag. 74
4.2. BIOMARKER pag. 76
4.2.1. ENA assay pag. 78
4.2.2. Attività Etossiresorufina-O-deetilasi (EROD) pag. 80
4.2.3. Livelli di Perossidazione lipidica (LPO) pag. 81
4.2.4. Indagini istologiche ed istomorfometriche pag. 82
4.2.5. Neoformazioni pag. 90
4.3. CONCENTRAZIONE CONTAMINANTI NEL PVC E NEI MANGIMI pag. 94
5. DISCUSSIONI pag. 96
6. CONCLUSIONI pag. 111
7. CONTRIBUTI SCIENTIFICI pag. 113
1
1.
INTRODUZIONE
1.1. INQUINAMENTO DA MARINE LITTER
I rifiuti solidi marini meglio definiti come marine litter comprendono qualsiasi materiale solido persistente, fabbricato o trasformato ed in seguito scartato, eliminato, abbandonato o perso in ambiente marino. Il marine litter può essere costituito da plastica, legno, metallo, vetro, gomma, vestiario, carta ecc, materiali costantemente rilasciati nell’ambiente marino e che nel tempo sono soggetti a fenomeni di dispersione e degradazione.Nonostante il progresso nella produzione di materiali altamente resistenti, ed il conseguente utilizzo, giochino un ruolo chiave nell’ ottimizzazione delle attrezzature e dei sistemi di trasporto migliorando lo stile di vita nella nostra società, non si possono sottovalutare i problemi ambientali connessi all’immissione nell’ambiente di tali materiali.
La ricerca ha ormai dimostrato che la presenza del marine litter influisca negativamente sullo stato di salute dell’ ecosistema marino, diventando un problema di rilevanza mondiale.Sono stati segnalati impatti con i rifiuti marini per 663 specie (CBD, 2012). Per oltre la metà delle specie segnalate (circa 370) sono stati riportati fenomeni di intrappolamento e di ingestione, con un incremento di oltre il 40% dopo la review del 1997 che vedeva interessate 247 specie (Laist, 1997). Dati disponibili riguardo il marine
litter identificato nelle acque del globo indicano che la tipologia e la fonte del marine litter sia strettamente correlato a ciò che noi abitualmente consumiamo (involucri
alimentari, contenitori per bevande, sigarette etc) ed utilizziamo per il trasporto ed altre attività non solo in mare. Infatti, i rifiuti solidi presenti in mare possono avere diversa origine, è possibile distinguere marine litter di origine marina (pescherecci, navi da crociera, navi mercantili, impianti di acquacoltura e piattaforme offshore di petrolio e gas)
2
e marine litter di origine terrestre (turismo, discariche, acque reflue non depurate e impianti industriali). Il gruppo di esperti sugli aspetti scientifici per la protezione dell’ambiente marino (GESAMP) ha stabilito che le fonti terrestri contribuiscono fino all’80% all’inquinamento marino globale (GESAMP, 1999). I livelli di litter che incidono sull’ambiente dipendono sia dalla tipologia e dal quantitativo, sia dal comparto ecosistemico su cui insistono (Galgani et al., 2013). Gli impatti che ne possono derivare sono i seguenti:
impatto igienico sanitario: contatto con acqua contaminata e consumo diretto di
organismi contaminati. Contaminazione da microrganismi di origine fecale o da agenti patogeni;
impatto ecologico: effetti letali o sub letali sia sulla fauna che sulla flora marina, in
seguito a fenomeni di ingestione, intrappolamento e bioaccumulo di sostanze chimico-tossiche; distruzione e alterazione di habitat ed introduzione di specie aliene;
impatto economico: costi diretti e perdita di reddito a causa di rifiuti marini che colpisce
una vasta gamma di settori marittimi compresa la navigazione, il turismo, l'acquacoltura e la pesca;
impatto sociale: riduzione dell’uso pubblico dell’ambiente, nello specifico dei settori
ricreativi, estetici e/o educativi di aree costiere come le spiagge (Kimo, 2000; Sheavly & Register, 2007).
Diverse leggi ed accordi internazionali regolano lo smaltimento dei rifiuti sia sulla terra che in mare. Per quanto concerne la questione dei rifiuti marini sia la London Dumping Convention (LCD) del 1972 che la Convenzione Internazionale per la prevenzione all’inquinamento causato da navi (MARPOL 73/78), hanno fornito un primo approccio per ridurre l’impatto ambientale, creando linee guida internazionali per la prevenzione
3
all’inquinamento da traffico navale (Sheavly & Register, 2007). Molti Stati e governi
nazionali hanno nel tempo attuato divieti o adottato misure di prevenzione.
Oltre alla leggi ed alle eventuali sanzioni, un senso di gestione ambientale è essenziale per una corretta tutela dell’ambiente.
1.1.1. Mediterraneo e marine litter
Anche per il Mediterraneo il rifiuti marini rappresentano una seria preoccupazione (UNEP, 2009; UNEP / MAP, 2011; MSFD, 2011).
Il Mediterraneo, infatti, è soggetto ad immissioni continue di rifiuti ed a causa della sua configurazione di bacino semi-chiuso, agli apporti fluviali ed ai venti rappresenta un’importante area di accumulo.
Tre miliardi di rifiuti solidi fluttuano o ricoprono i fondali marini nel mar Mediterraneo, di cui circa l’80% sono rappresentati da plastica. La fonte principale sono i rifiuti di origine terrestre con un importo medio di rifiuti solidi generati ogni anno per persona di 208-760 kg/anno ed un notevole aumento previsto entro il 2020. La loro densità aumenta inoltre fino al 40% durante i mesi estivi a causa del turismo generando cosí più del 75% dei rifiuti annuali durante la stagione estiva (Galgani et al., 2011).
Dal workshop del CIESM “The Mediterranen Science Commission”, tenutosi nel giugno 2014, è emerso che il Mediterraneo risulta una delle aree più impattate al mondo dal
marine litter. L’abbondanza e la distribuzione di rifiuti marini è stata riportata per
quest’area da diversi autori (Galgani et al., 1996, 2000; UNEP 2011; Fossi et al., 2012, 2014; Collignon et al., 2013; Pham et al., 2014; Angiolillo et al., 2015; Romeo et al., 2015b).
La plastica rappresenta la principale tipologia di rifiuti in tutti i comparti, le spiagge del Mediterraneo infatti riportano densità nel range di 1 polimero/m2, mentre un recente
4
studio su larga scala ha riportato densità di detriti galleggianti compresa tra 0 e 194,6 oggetti/km2, di cui 95,6% sono polimeri sintetici, con valori più alti nel mare Adriatico e
nel bacino algerino (Suaria & Aliani, 2014). Anche i canyons sottomarini rappresentano importanti siti d’accumulo e sui fondali marini l’abbondanza di detriti di plastica è notevolmente alta con valori medi che vanno da 0 a più di 100.000 rifiuti per Km2
(CIESM, 2014). Alcuni studi hanno anche sottolineato l’importanza dell’impatto che questa tipologia d’inquinante ha sugli organismi a diversi livelli ecosistemici (Fossi et al., 2012, 2014; Angiolillo et al.,2015; Romeo et al., 2015a).
Ad oggi una delle principali sfide per gli Stati membri dell'Unione Europea sta nell'attuazione della Direttiva Quadro sulla Strategia Marina (Marine Strategy
Framework Directive, 2008/56/CE) la quale stabilisce che gli stessi Stati si adoperino per
raggiungere o mantenere un buono stato ecologico (Good Environmental Status) delle proprie acque entro il 2020 (Galgani et al., 2013) sulla base di 11 descrittori qualitativi tra cui il D10 “marine litter”. L’obiettivo è di analizzare e valutare l’impatto del litter in mare, per prevedere le conseguenze a livello socio-economico e soprattutto possibili ripercussioni sulla saluta umana ed attuare protocolli di monitoraggio mirati a valutare e ridurne l’impatto.
1.2. LE MATERIE PLASTICHE
Le materie plastiche sono sostanze organiche, completamente o parzialmente sintetiche, generalmente prodotte dalla polimerizzazione di monomeri estratti a partire dal petrolio, carbone e dai gas naturali (Derraik 2002; Rios et al., 2007; Thompson et al., 2009). Dal punto di vista chimico sono polimeri, ad alto peso molecolare, costituiti da un gran numero di unità fondamentali, dette monomeri, uniti tra loro da legami chimici. Grazie alle proprietà chimico-fisiche (durezza, resistenza all’urto, bassa conducibilità termica,
5
resistenza ad acidi e basi), e soprattutto ai bassi costi di produzione (Laist, 1987), la plastica risulta adatta per la fabbricazione di un vasta gamma di prodotti ed in particolare un eccellente materiale da imballaggio (Andrady, 2011).Esistono diversi tipi di plastica. Solitamente possono differenziarsi in materiali termoplastici (che rendono la plastica morbida quando sottoposta ad elevate temperature), e materie plastiche termoindurenti (che presentano una struttura reticolata, che e non può essere alterata dal calore) (Lithner et al., 2011). Molte sostanze chimiche vengono utilizzate durante il processo di produzione della plastica, tra cui solventi, tensioattivi, iniziatori, catalizzatori e sottoprodotti (Lithner et al., 2011). Inoltre durante la produzione, la plastica viene trattata con additivi plastici tra cui i plastificanti al fine di potenziare le sue proprietà e renderla più resistente, lucida e malleabile (Browne et al., 2007; Thompson et al., 2009). La versatilità delle materie plastiche ha quindi portato ad un grande utilizzo negli ultimi tre decenni, rendendole di uso comune in diversi campi (Laist, 1987).
I polimeri plastici, sono considerati dal punto di vista biochimico inerti, poiché hanno un alto peso molecolare (5000-1 milione D) e dunque la loro disponibilità biologica è trascurabile risultando quindi per niente pericolosi per la salute umana o per l'ambiente (Toti, 2011). Residui di monomeri non reattivi possono però trovarsi spesso nel materiale polimerico, poiché raramente le reazioni di polimerizzazione vengono completate (Lithner et al., 2011).
A causa dell’uso di additivi a basso peso molecolare (<1000 D), della presenza di monomeri non reattivi, solventi, sottoprodotti e catalizzatori c’è la possibilità di esposizione dell’ ambiente ed anche dell’ uomo a questi componenti (Toti, 2011). Tali sostanze, infatti, possono essere rilasciate durante la produzione, uso e smaltimento delle plastiche, ed alcune di esse possono essere molto pericolose (Oehlmann et al., 2009;Teuten et al., 2009;Lithner et al., 2011). Queste stesse proprietà che tanto rendono
6
comune e diffuso l’utilizzo della plastica sono le stesse che la rendono un potenziale ed importante pericolo ambientale (Laist, 1987; Pruter, 1987).
Infatti risulta che più del 50% delle plastiche prodotte sono caratterizzate da composti pericolosi come residui di monomeri, additivi e sottoprodotti (Lithner et al., 2011).
La richiesta mondiale di materie plastiche aumenta ogni anno costantemente (Fig.1).
Fig.1. Dati relativi alla produzione annuale di plastica nel mondo.
Materiali convenzionali come vetro, metallo e carta vengono sostituiti da imballaggi in plastica visto i bassi costi di produzione, e quasi un terzo della produzione di plastica è impiegata in materiale da imballaggio di consumo (Andrady, 2011).
La domanda di materie plastiche è stata alimentata dalla continua innovazione che ha portato ad un aumento globale medio annuo nella produzione di materie plastiche e dei consumi di circa il 9% a partire dal 1950.
Rappresentato come il consumo pro capite questo si traduce in 100 kg di materie plastiche consumate per abitante nei paesi del Nord America e dell'Europa occidentale, raggiungendo i 140 kg per persona nel 2015 (OECD, 2010; Andrady et al., 2015).
7
In Europa, la domanda di materie plastiche varia significativamente da paese a paese anche in funzione delle densità degli abitanti, Belgio e Lussemburgo, Italia e Spagna sembrano consumare i più alti volumi di materie plastiche nonostante le loro dimensioni (Andrady et al., 2015).
A causa del consumismo, dell’eccessivo utilizzo di plastica e del meccanismo che ne consegue ”usa e getta”, la plastica rappresenta il 10% dei rifiuti prodotti in tutto il mondo (Barnes et al., 2009; Cole et al., 2011).
1.2.1. Plastica in ambiente marino
Tra le diverse forme di marine litter, particolare rilevanza assumono le materie plastiche o plastic litter che, attraverso lo smaltimento indiscriminato, si stanno diffondendo nell'ambiente marino (Gregory, 2009).
Le materie plastiche rappresentano la principale tipologia di rifiuti marini sia sulle spiagge che in mare aperto (comprese le quantità crescenti di microscopici frammenti di plastica derivanti dalla degradazione della plastica in mare) la cui percentuale varia costantemente tra il 60% e l'80% dei rifiuti marini totali (Derraik, 2002).
La maggior parte dei casi segnalati, relativi all’impatto del marine litter su organismi marini, sono legati a rifiuti plastici. Nell’ anno 2012, sono stati riportati il 57% di impatti legati alle reti fantasma (ghost nets) seguiti dal 11% da frammenti plastici, 10% materiale da imballaggio, altri rifiuti per la pesca (8%) ed il 6% per le microplastiche (CBD, 2012) (Galgani et al., 2013).
Oltre un milione di uccelli e 100.000 mammiferi marini muoiono ogni anno impigliandosi nelle reti da pesca o restando intrappolati in contenitori di plastica ed è riportato che oltre 180 specie di mammiferi, uccelli, pesci e invertebrati ingeriscono plastica (Laist, 1997; Derraik, 2002; Tomas et al., 2002).
8
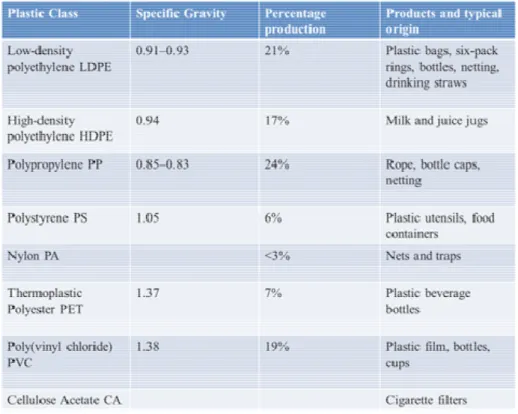
Attualmente, le materie plastiche sintetiche più diffuse sono il polietilene (PE) ad alta e bassa densità (HDPE, LDPE), polipropilene (PP),cloruro di polivinile (PVC), polistirene (PS) e polietilene tereftalato (PET).
Complessivamente, queste plastiche rappresentano il 90% della produzione mondiale totale ed è ormai ampiamente dimostato che la maggior parte dei rifiuti marino costieri sono costituiti da questi materiali (Andrady, 2011; Ivar do Sul & Costa, 2014).
Infatti, il loro ampio utilizzo e la loro richiesta sul mercato determinano grandi produzioni al punto da poter quindi rappresentare le plastiche comunemente ritrovate in ambiente marino (Tab. 1) (Andrady, 2011).
La maggior parte dei polimeri sintetici galleggia in acqua (ad esempio PE e PP). Di conseguenza notevoli quantità di rifiuti plastici fluttuano in mare e vengono trasportati dalle correnti (Thompson et al., 2009; Andrady, 2011). I polimeri che invece presentano una densità maggiore dell’acqua di mare (ad esempio PVC) tendono invece a stabilirsi in prossimità del punto in cui sono entrati nel comparto marino e possono quindi essere trasportati dalle correnti (Ivar do Sul & Costa, 2014).
Alcune delle proprietà fisico-chimiche (idrofobicità superficiale e galleggiamento) delle plastiche sommerse possono essere modificate dalla presenza di biofilm che rapidamente si estendono sulle superfici dei rifiuti plastici in mare influenzandone la distribuzione lungo la colonna d’acqua (Ivar do Sul & Costa, 2014).
Mentre le fonti terrestri contribuiscono per circa l’80% dei detriti di plastica in mare, circa il 18% dei detriti di plastica sono invece attribuiti al settore della pesca per l’utilizzo di poliolefine (PE e PP) e di nylon impiegati per la realizzazione di attrezzi da pesca (Timmers et al., 2005) e al settore dell’acquacoltura (Hinojosa & Thiel, 2009).
9
Le plastiche trasportate in mare dal vento, dai fiumi e dalle acque di ruscellamento possono accumularsi nell’ambiente marino e persistere nel tempo. Il processo di accumulo è influenzato da diversi meccanismi, processi fisici oceanografici (onde, correnti, gorghi), cicli lunari e maree, eventi naturali estremi e dall’attività antropica. Cumuli di plastica quindi si possono concentrare in diverse aree in mare aperto soprattutto a livello dei principali gyres subtropicali dell’oceano Atlantico e Pacifico (Law et al., 2010; Leichter, 2011; Eriksen et al., 2013, 2014) e dell’oceano Indiano (Barnes, 2004) formando "isole di plastica". Tra le isole di plastica individuate, non possiamo non citare il “Great Pacific Garbage Patch” (Moore et al., 2001;Kaiser, 2010).
10
1.2.2. Degradazione della plastica in ambiente marino
Sebbene i polimeri sintetici siano considerati notevolmente persistenti, nell’ambiente possono andare incontro a degradazione per azione combinata di processi abiotici e biotici, che portano seppur lentamente a una disgregazione della matrice polimerica ed al rilascio di additivi (CIESM, 2014; Lambert et al., 2014).
La degradazione è un processo chimico che riduce il peso molecolare medio di un polimero (Andrady, 2011).
La plastica può andare incontro a diversi meccanismi di degradazione a seconda dei fattori che intervengono, e la velocità di degradazione dipende dalla temperatura ambientale, dalla tipologia di polimero e dalla presenza degli additivi (Andrady, 2003). Processi abiotici agiscono come un primo fattore importante nella degradazione causando una perdita delle proprietà meccaniche e cambiamenti strutturali dei materiali e dei legami molecolari (Lambert et al., 2014). Per quanto riguarda i meccanismi di degradazione attivati dai fattori abiotici possiamo distinguere:
• Fotodegradazione, per azione della luce (di solito la luce solare);
• Degradazione termica, le elevate temperaturedeterminano il deterioramento molecolare del polimero come risultato del surriscaldamento, che provoca scissioni a livello della catena polimerica. Questo processo interessa tutto il polimero, non solo la parte superficiale, e si traduce in cambiamenti del peso molecolare, perdita della forza di trazione, cambiamenti di cristallinità, ridotta durata, fragilità ed alterazioni nel colore; • Degradazione ossidativa, i processi di degradazione ossidativa possono essere indotti dalla luce o dal calore;
• Degradazione idrolitica, tale processo degradativo e la sua velocità dipendendono dai legami covalenti idrolizzabili nel polimero. L’introduzione dell’ossigeno nel polimero
11
determina la formazione di gruppi funzionali favorendo i processi di degradazione biotici (Lambert et al., 2014).
Per quanto riguarda invece il processo degradativo biotico, la biodegradazione avviene ad opera di microrganismi che secernono enzimi extracellulari. I processi abiotici sono però fondamentali per l’inizio dei processi degradativi biotici poiché ne aumentano la superficie disponibile per la colonizzazione microbica. L’interazione nel corso del tempo tra fattori biotici ed abiotici favorisce il processo di degradazione poiché man mano si indebolisce la struttura del polimero e la plastica diventa più sensibile all’attività batterica (Lambert et al., 2014).
Generalmente i polimeri più utilizzati (PP e PE) a causa del loro alto peso molecolare non sono biodegradabili. Tuttavia, una volta in mare possono andare incontro a processi di foto-degradazione, seguito da fenomeni di degradazione termo ossidativa che rendono infine la plastica soggetta ad ulteriore azione microbica (biodegradazione) (Andrady, 2011; Ivar do Sul & Costa, 2014).
Il principale meccanismo di degradazione è sicuramente la fotodegradazione che risulta tra l’altro il più efficiente (Andrady, 2011). Questi meccanismi di degradazione portano ad un inevitabile indebolimento dell’integrità meccanica della plastica la quale a causa della fragilità della struttura e del moto ondoso si frammenta in particelle di dimensioni diverse che si disperdono in mare (Andrady, 2011).
Il destino della plastica in ambiente marino ed i suoi tempi di degradazione dipendono dalle caratteristiche strutturali del polimero, dai tempi di persistenza nell’ambiente ed inoltre sono influenzati dal tipo comparto in cui essa si trova dispersa. Per i rifiuti plastici dispersi lungo le spiagge o zone costiere la fotodegradazione risulta sicuramente il meccanismo principale. Ma se lo stesso materiale plastico si trova esposto alla luce
12
solare fluttuante in mare, i tempi di degradazione sono molto più lunghi (Andrady, 2011).
Alcuni studi (Andrady & Pegram, 1989,1993) dimostrano che i tempi di degradazione delle plastiche galleggianti in mare sono maggiori rispetto alle plastiche esposte semplicemente all’aria nello stesso sito a causa delle temperature più basse e della concentrazione di ossigeno inferiore degli ambienti acquatici. Tale differenza nei tempi di degradazione può essere accentuata anche in seguito agli effetti del fouling (Andrady, 2011). La fotodegradazione in ambiente marino non è quindi garanzia di biodegradabilità della plastica. Nonostante la plastica sia alterata dalla fotodegradazione, spesso anche ridotta nelle dimensioni, riesce comunque a mantenere un peso molecolare medio discretamente alto. I piccoli frammenti di plastica generati, a causa del fouling possono distribuirsi lungo la colonna d’acqua e andare incontro a degradazione batterica. Tale processo termina quando tutto il carbonio organico del polimero viene convertito in CO2 (Andrady, 2011).
1.2.3. Impatto da plastic litter in ambiente marino
La minaccia del plastic litter per l'ambiente marino è stata ignorata per lungo tempo, la sua importanza è stata riconosciuta solo di recente, tanto che si è assistito ad un incremento nell’ultimo decennio di studi che hanno contribuito ad incrementare la letteratura disponibile. Una review della letteratura scientifica, sull’interazione delle plastiche con il biota per l’area del Mediterraneo è stata effettuata da Deudero & Alomar, (2015). Dal 1986 al 2014, sono stati pubblicati 29 lavori che riportano l’interazione con diversi livelli di ingestione per 134 specie e diversi taxa, ed un totale di 17,334 organismi tra cui invertebrati marini, diversi teleostei, grandi pelagici, elasmobranchi e specie protette (mammiferi marini e tartarughe marine).
13
Infatti, gli organismi marini vanno incontro principalmente a fenomeni meccanici come l’ingestione o l’intrappolamento. Il fenomeno dell’intrappolamento è stato spesso descritto come importante fattore di mortalità. Tale fenomeno può inibire lo sviluppo e la crescita di un organismo, ostacolarne la mobilità, impedirne la nutrizione, infliggere ferite e causarne soffocamento o annegamento. La causa principale è riconducibile alla perdita o abbandono degli attrezzi da pesca, si stima infatti che il 10% di tutto il marine litter è costituito annualmente delle reti fantasma (Macfadyen et al., 2009). Tuttavia, si presume che un gran numero di perdite degli attrezzi non vengano segnalate (UNEP, 2009). Fenomeni di intrappolamento sono riportati per pinnipedi, cetacei, tartarughe marine, per oltre 56 specie di uccelli marini e per altre specie ancora. Per almeno il 43% delle specie di cetacei esistenti (Denuncio et al., 2011; Fossi et al., 2012, 2013), per tutte le specie di tartarughe marine (Tomas et al., 2002; Lazar & Gracan, 2011), per circa il 44% delle specie di uccelli marini (Mallory, 2008), e per molte specie di organismi (Laist, 1997; Moore et al., 2001; Thompson et al., 2004;. Browne et al., 2008; Boerger et al., 2010; Cole et al., 2013; Wright et al., 2013; Romeo et al., 2015a) sono stati riportati casi di ingestione (Galgani et al., 2013). In particolare gli organismi marini possono andare incontro ad ingestione di plastica accidentalmente o perché spesso confusi per altri organismi viventi (prede). Inoltre l’ingestione di plastiche può derivare anche da un’ingestione di tipo secondario, cioè dalla predazione di organismi a livelli trofici inferiori che precedentemente hanno già ingerito plastiche. Tali rifiuti di plastica potrebbero bloccare le appendici alimentari o ostacolare il passaggio del cibo attraverso il tratto intestinale, ma anche causare pseudo-sazietà con conseguente ridotta assunzione di cibo (Derraik, 2002; Thompson, 2006).La stessa galleggiabilità della plastica, può anche determinare nei pesci che la ingeriscono difficoltà a mantenere l’assetto.
14
Inoltre la presenza di plastica in mare potrebbe anche favorire il trasferimento e la distribuzione di organismi vegetali, animali e di comunità microbiche in differenti aree in cui potrebbero danneggiare o competere con la flora e fauna endemica. Si è ipotizzato che a causa dei processi di movimento delle plastiche in mare, può essere facilitata l'introduzione di specie aliene. Il briozoo Membranipora tuberculata, per esempio, si pensa abbia attraversato il mar di Tasmania, dall’ Australia alla Nuova Zelanda, ancorato a frammenti di plastica, e che balani abbiano attraversato l'oceano Atlantico del Nord fissati a rifiuti di plastica (Derraik, 2011).
Un altro aspetto emergente, fonte di importante preoccupazione è rappresentato dalle proprietà intrinseche delle plastiche. A tal riguardo, sono due le correnti di pensiero sulle quali il settore della ricerca si dibatte cercando di forinire nuovi modelli e prospettive. Negli ultimi anni, infatti, alcuni studi (Mato et al., 2001; Rios et al., 2007; Teuten et al., 2007, 2009; Rochman et al., 2013a, 2013b) hanno dimostrato come la plastica per mezzo della superficie idrofoba sia in grado di fungere da substrato per l’accumulo di inquinanti organici persistenti (POPs), quali policlorobifenili (PCB), pesticidi organoclorurati come il diclorodifeniltricloroetano (DDT) ed il diclorodifenildicloroetilene (DDE), idrocarburi policiclici aromatici (IPA) e metalli (Holmes et al., 2012) in ambiente marino a concentrazioni superiori dell’acqua di mare (Mato et al., 2001; Teuten et al., 2009). Ed inoltre, la plastica è in grado di rilasciare additivi plastici tra cui gli ftalati ed il bisfenolo (Teuten et al., 2009; Rochman, 2015). Per tale motivo la plastica a causa delle sue proprietà fisiche e chimiche, risulta costituita da un cocktail di sostanze chimiche (Rochamn, 2015), rappresentando un diretto (additivi) ed indiretto (POPs) veicolo di sostanze tossiche ed aumentando nello stesso tempo la sua persistenza nell’ambiente (Teuten et al., 2009).
15
Tuttavia altri studi, hanno dimostrato come le plastiche non rappresentino un sostanziale vettore nè di alcuni contaminanti ambientali (Koelmans et al., 2013; Herzke et al., 2015) nè di additivi plastici (Koelmans et al., 2014a) negli organismi marini ed in particolare che l’esposizione ai POPs da parte delle plastiche in seguito ad ingestione può essere considerata trascurabile rispetto all’apporto di POPs dovuto all’ingestione delle prede (Herkze et al., 2015) o ad altre possibili vie di contaminazione naturale come l’assorbimento dermico o attraverso le branchie (Koelmans, 2015).
La miscela di sostanze chimiche associate ai rifiuti di plastica marini (POPs e additivi plastici), può variare a seconda delle dimensioni e della tipologia di polimero ma anche dai livelli di contaminazione del sito in cui la plastica diventa un litter in mare (Rochamn, 2015). In particolar modo, le caratteristiche e la struttura dei polimeri (area di superficie, diffusività e cristallintà) possono influenzare il meccanismo di adsorbimento, come anche le piccole dimensioni che ne aumentano la capacità e la velocità di adsorbimento. Inoltre va considerato che poiché la plastica in ambiente marino rappresenta un collettore passivo di contaminanti ambientali, la tipologia e la concentrazione dei contaminati adsorbiti rifletteranno la tipologia e la concentrazione di tali sostanze presenti in mare, e saranno inoltre influenzate dalla distribuzione spaziale della plastica (Rochamn, 2015). In realtà gli effetti di tale processo non sono facilmente misurabili in quanto i tempi di permanenza della plastica in mare e l’azione di diversi fattori (fouling, degradazione biotica ed abiotica) possono modificare i tempi e la velocità di accumulo. La plastica in mare infatti, può andare incontro a processi di alterazione della sua struttura (aumento della superficie di adsorbimento e/o carica) che influenzano le modalità di accumulo e quindi il tasso di adsorbimento (Holmes et al., 2012; Rochman, 2015).
16
1.3. LE MICROPLASTICHE
Abbiamo visto come la plastica sia resistente alla degradazione, essa infatti permane nell’ambiente marino per moltissimi anni ed attraverso l’azione meccanica (vento, moto ondoso)ed a fenomeni di fotodegradazione, degradazione termica e biodegradazione si riduce gradualmente in frammenti microscopici (Fig.2) (Derraik, 2002; Andrady, 2011).
Fig.2. Microplastiche in ambiete marino ed interazione con gli organismi (Wright et al., 2013).
In mare questo processo è più lento che sulla terra a causa della temperatura inferiore delle acque. Di conseguenza la plastica non si degrada mai completamente ed in tempi molto lunghi (anche più di 500 anni) si riduce in polvere di plastica (da qui il termine di microplastica), trasportata per migliaia di chilometri negli oceani ed ingerita dagli organismi marini (Andrady, 2011; Cole et al., 2011).
Le microplastiche rappresentano un problema crescente nell’ambiente marino, così come il problema del loro impatto sugli organismi marini. Negli ultimi anni, c'è stato una crescente attenzione da parte di numerosi ricercatori sulle “microplastiche", definite come piccoli rifiuti di plastica quali pellet e scrubers, di dimensioni inferiori a 5 mm secondo la
17
NOAA,National Oceanic and Atmospheric Administration (Arthur et al., 2009), la cui origine può essere attribuita alla loro diretta immissione nell’ambiente marino (microplastiche primarie) o alla frammentazione di plastiche di dimensioni maggiori (microplastiche secondarie) (Derraik, 2002; Andrady, 2011; Cole et al., 2011). A causa delle loro proprietà chimico-fisiche e delle loro piccole dimensioni si disperdono facilmente in mare, diventando disponibili lungo la catena trofica a partire da microrganismi fino ad arrivare a consumatori di vertice.
Le microplastiche si accumulano principalmente negli strati superifciali della colonna d’acqua e come osservato nel corso di campagne oceanografiche esistono vaste aree nell’oceano Pacifico settentrionale e centrale (Moore et al., 2001; Kaiser, 2010; Eriksen et al., 2013), nell’oceano Atlantico (Law et al., 2010), nell’oceano Indiano (Reddy et al., 2006; Ogata et al., 2009) e nelle aree polari (Obbard et al., 2014) in cui esse sono state rilevate in alte concentrazioni. Studi recenti riportano, lo stesso fenomeno anche in aree del Mediterraneo (Collignon et al., 2012; De Lucia et al., 2014).
Tuttavia, nonostante il pericolo che le microplastiche rappresentano per i nostri mari, ed il crescente interesse da parte del settore scientifico non esistono ancora strumenti di valutazione condivisi per quantificare il loro impatto sulle risorse viventi, pertanto non è stato possibile proporre valori-limite ambientali per un controllo del rischio.
1.3.1. Fonti e trasferimento delle microplastiche in ambiente marino
Secondo Rand et al., (2010) e Sutherland et al., (2010) le microplastiche sono diffuse e ubiquitarie in ambiente marino, dalle spiaggie alle profondità marine ed in tutta la colonna d’acqua, con un’alta concentrazione in aree caratterizzate da particolari regimi idrodinamici. Una volta in mare, le microplastiche vengono trasportate dalle correnti oceaniche e distribuite in tutti i mari, dalle zone costiere alle zone oceaniche compresi
18
fiumi ed estuari. Le microplastiche si accumulano nelle spirali medio-oceaniche, ma i meccanismi di movimento e di trasporto in mare sono ancora in gran parte sconosciuti soprattutto lungo l'asse verticale (Ivar do Sul & Costa, 2014), dove sicuramente il vento gioca un ruolo fondamentale per il movimento verticale della plastica (Kukulka et al., 2012).
Le microplastiche possono entrare nell’ecosistema marino direttamente dalle reti fognarie e dagli ambienti costieri (fiumi e acque reflue) (Derraik, 2002) sotto forma di pellets con dimensioni inferiori ai 5 mm (microplastiche primarie). Generalmente tali pellets vengono utilizzati in campo industriale e domestico come abrasivi (Gregory, 1996), in cosmetica nei detergenti per il viso e nei cosmetici stessi (Zitko & Hanlon, 1991), nel campo medico come vettori per farmaci (Patel et al., 2009). Indirettamente possono invece generarsi in seguito a fenomeni di degradazione di meso e macroplastiche presenti in ambiente marino (microplastiche secondarie) (Browne et al., 2007; Cole et al., 2011). Il turismo costiero, la pesca sportiva e artigianale, traffico marittimo e attività in mare come l’acquacoltura e le piattaforme petrolifere sono tutte fonti dirette di plastica nell'ambiente marino, rappresentando un rischio per il biota sia come macroplastiche e meso che come microplastiche secondarie (Cole et al., 2011). Lo smaltimento indiscriminato di plastica può quindi contribuire ad un aumento della diffusione delle microplastiche secondarie negli ecosistemi marini.
Un'altra fonte importante di microplastiche deriva dalla produzione di pellets di resina, piccoli granuli di plastica dal diametro di pochi millimetri (Mato et al., 2001; Cole et al., 2011). In seguito a perdite accidentali durante il trasporto, sia a terra che in mare, a perdite dirette provenienti da impianti di trasformazione ed anche ad un loro uso inappropriato, queste materie prime entrano facilmente nell’ecosistema marino (Mato et al., 2001).
19
1.3.2. Distribuzione delle microplastiche lungo la colonna d’acqua
In mare le microplastiche posso distribuirsi lungo la colonna d’acqua a seconda della loro composizione, densità e forma. Possono infatti galleggiare in superficie o fluttuare lungo la colonna d’acqua oppure possono depositarsi sul fondo.
Generalmente le microplastiche a bassa densità come il polipropilene ed il polietilene sono state prevalentemente rilevate fluttuare in superficie (Derraik, 2002), ma la loro distribuzione può variare a seconda degli habitat, dell’incontro con masse d’acqua e per la presenza di biofouling. La presenza di biofilms e la colonizzazione da parte di organismi ne aumenta la densità che supera quella dell’acqua di mare favorendone la distribuzione lungo la colonna d’acqua ed in alcuni casi l’affondamento (Barnes et al., 2009; Andrady, 2011; Cole et al., 2011).
Le microplastiche ad alta densità (polivincloruro, poliesteri e poliammide) sono invece prevalentemente abbondanti sui fondali marini. In questo caso la loro posizione può variare perché in seguito alla presenza di turbolenze, forti correnti e possono essere temporaneamente riportate in sospensione (Cole et al., 2011).
Il processo di disincrostazione della plastica ad opera di organismi insieme ad altri meccanismi può determinare una riduzione della densità e riportare in sospensione le microplastiche. Questo movimento ciclico della plastica lungo la colonna d’acqua dovuto alla variazione di densità viene definito” bobbing “e regola la distribuzione delle microplastiche in ambiente marino (Andrady, 2011).
1.3.3. Impatto ambientale delle microplastiche
L’impatto ambientale delle microplastiche è complesso e si può manifestare attraverso meccanismi differenti influenzando gli ecosistemi e minacciando la biodiversità. Infatti le microplastiche possono veicolare specie aliene, alterare la struttura delle comunità
20
bentoniche, ma soprattutto provocare danni meccanici in seguito all’ingestione e favorire il trasferimento di contaminanti ambientali lungo la catena trofica (Teuten et al., 2007, 2009). Tuttavia alcuni studi, sottolineano come l’effetto vettore delle microplastiche sia ancora discutibile (Koelmans et al., 2013; Khan et al., 2015) o comunque trascurabile rispetto ad altre fonti di contaminazione in ambiente marino (Koelmans et al., 2013, 2014a,b;) e che inoltre, l’ingestione di alcune tipologie di microplastiche può alterare il percorso di biodisponibilità e l’assorbimento di alcuni contaminanti in un organismo marino (Khan et al., 2015; Koelmans, 2015).
• Ingestione di microplastiche
A causa delle loro piccole dimensioni e delle loro proprietà, le microplastiche sono presenti sia nell’ecosistema pelagico che bentonico diventanto biodisponibili per gli organismi lungo la catena trofica. L’ingestione di questi frammenti da parte degli organismi marini può avvenire passivamente o direttamente. Diversi studi effettuati su organismi zooplanctonici (Fossi et al., 2012, 2013; Cole et al., 2013) e il ritrovamento di microplastiche nei contenuti stomacali di organismi planctivori (Boerger et al., 2010) indicano la possibilità che questi frammenti vengano erroneamente scambiati per alimento (Moore et al., 2001; Fossi et al., 2012; Romeo et al., 2015a). Questa condizione può essere accentuata nelle aree di accumulo.
Inoltre la loro ingestione può essere accidentale, come nel caso di grandi predatori o addirittura dovuta all’ingestione secondaria. Le microplastiche possono inoltre rappresentare un pericolo fisico-meccanico per piccoli organismi. Una volta ingerite, possono causare effetti simili a quelli noti per l’ingestione di macroplastiche in grossi animali quali tartarughe, uccelli, ecc, ove bloccano le appendici alimentari, ostacolano il passaggio di cibo nel tratto intestinale o ancora causano fenomeni di pseudo-sazietà (Cole et al., 2011).
21
E’ stata segnalata più volte l’ingestione di piccoli frammenti di plastica in uccelli marini che sembrano essere il gruppo più colpito (Van Franeker et al., 2011), mammiferi (Fossi et al., 2012, 2014), teleostei (Boerger et al., 2010; Davison & Asch, 2011; Foekema et al., 2013; Lusher et al., 2013; Battaglia et al., 2015; Deudero & Alomar, 2015; Romeo et al., 2015a), elasmobranchi (Fossi et al., 2014) e perfino in invertebrati marini tra cui molluschi bivalvi (Browne et al., 2008), zooplancton (Cole et al., 2013) ed anfipodi (Thompson et al., 2004).
L’aspetto realmente preoccupante è che l’ingestione di microplastiche sin dai livelli più bassi della catena trofica, può determinare seri rischi in seguito al processo di biomagnificazione (Teuten et al., 2009). Infatti le microplastiche possono essere scambiate per plancton dai piccoli predatori (Derraik, 2002; Boerger, 2010; Andrady, 2011), ed una volta ingerite diventano un potenziale vettore di contaminanti lungo la catena alimentare, fino all’uomo.
• Ingestione di microplastiche e rilascio di additivi
Le microplastiche possono rilasciare additivi plastici (Browne et al., 2007; Thompson et al., 2009). Questi additivi prolungano i tempi di degradazione della plastica ed inoltre migrano dalla matrice sintetica della plastica stessa. Il grado di lisciviazione dipende dalle dimensioni dei pori della matrice polimerica, che varia in base al tipo polimero utilizzato, dalla quantità e proprietà dell'additivo ed infine dalle condizioni ambientali (Teuten et al., 2007, 2009). Gli organismi una volta ingerite le microplastiche potrebbero essere esposti direttamente a questi composti (Tanaka et al., 2013). Gli additivi più comuni sono gli ftalati, esteri dell’acido ftalico, sostanze chimiche organiche prodotte dal petrolio. Sono in genere poco solubili in acqua, molto solubili negli oli e poco volatili e si presentano come liquidi incolori. Rappresentano i plastificanti più comuni e sono utilizzati da oltre 50 anni per rendere morbido e flessibile il PVC (Ehrig, 1992). I principali effetti negativi degli
22
ftalati sulla salute degli organismi, evidenziati dalla comunità scientifica, riguardano la loro capacità di interferire con il corretto funzionamento del sistema endocrino.
• Ingestione di microplastiche ed adsorbimento di inquinanti ambientali
Le microplastiche con la loro grande superficie in rapporto al volume, sono facilmente soggette a contaminazione da parte di metalli ed inquinanti organici persistenti (POPs) che sono tra l’altro riconosciuti quali interferenti endocrini (Rios et al., 2007; Andrady, 2011; Rochman et al., 2013b, 2014). Tali sostanze per la loro bassa solubilità in acqua di mare si trovano generalmente ad elevate concentrazioni a livello della superficie del mare proprio dove le microplastiche a bassa densità sono abbondanti (Teuten et al., 2009; Cole et al., 2011), e grazie alla loro natura lipofila possono aderire concentrandosi sulla superficie idrofobica della plastica (Teuten et al., 2007, 2009; Barnes et al., 2009).
1.3.4. Microplastiche e Mediterraneo
In Mediterraneo, Fossi et al., (2012), Collignon et al., (2012, 2013), De Lucia et al., (2014) e Panti et al., (2015) hanno riportato la presenza di quantità significative di microplastiche nelle acque superficiali della zona occidentale del bacino, mentre Ogata et al., 2009; Deidun et al., (2014), Kaberi et al., (2013); Romeo et al., (2015b) hanno rilevato la presenza di microplastiche nei sedimenti del bacino orientale. Nonostante ciò, i dati pubblicati non sono sufficenti a definire la reale situazione nel Mediterraneo.
Nel Mediterraneo alcuni studi hanno confermato anche la presenza di microplastiche nei contenuti stomacali di grandi pelagici e nella specie ittica d’interesse commerciale
Trachinotus ovatus (Battaglia et al., 2015, Romeo et al., 2015a), e significativi livelli di
ftalati nello zooplancton, elasmobranchi e mammiferi marini (Fossi et al., 2012, 2013). La presenza di ftalati rilevati in campioni di zooplancton ed il ritrovamento di microplastiche nello zooplancton (Cole et al., 2013) sottolinea come le microplastiche siano
23
biodisponibili attraverso la catena alimentare: microplastiche-zooplancton-planctofagi-teleostei-top predators rappresentando un vettore per il trasferimento di contaminanti ambientali.
1.4. CLORURO DI POLIVINILE (PVC)
Il cloruro di polivinile o vinile (PVC) è la plastica più utilizzata al mondo dopo il polietilene ed il polipropilene, detenendo così un ruolo importante nel comparto delle materie plastiche. E’ un polimero termoplastico, che per le sue proprietà viene ampiamente utilizzato in diversi settori (materiali di imballaggio, giocattoli, mobili, sanitari, pavimenti e materiali da costruzione) (Guess & Haberman, 1968; Varma et al., 1999; Stringer et al., 2000).
Il PVC si ottiene da due prodotti di origine naturale, il cloruro di sodio ed il petrolio. La combinazione dell’etilene ottenuto dal petrolio con il cloro, derivante a sua volta dall’elettrolisi di una soluzione acquosa di cloruro di sodio porta alla formazione del monomero CVM o cloruro di vinile. Successivamente in seguito al processo di polimerizzazione i monomeri di cloruro di vinile formano il PVC. La sua larga diffusione dipende dai bassi costi del cloruro di vinile e dal buon rapporto costo/proprietà, risulta infatti impermeabile ai gas ed ai liquidi ed ha una buona resistenza chimica e durabilità. Inoltre il PVC non viene mai prodotto senza l’integrazione di additivi che ne migliorano le sue proprietà fisico chimiche (flessibilità, malleabilità e durezza) (Ehrig, 1992) tanto da poter essere utilizzato sia per manufatti rigidi che flessibili.
Purtroppo la sua capacità di persistere nell’ambiente e di rilasciare additivi plastici lo rendono un polimero pericoloso per l’ambiente.
Dagli alti livelli di produzione mondiale (19%) si ipotizza che insieme ad altre classi di materie plastiche sia un importante rappresentate dei plastic litter (Andrady, 2011).
24
1.4.1. Additivi nel PVC
Tra le classi di materie plastiche, il PVC richiede la maggior parte degli additivi generalmente utlizzati (il 73% della produzione mondiale di additivi in volume), seguito dalle poliolefine come il polietilene e polipropilene (10% in volume), e dai polimeri stirenici (5% volume). Il PVC quindi non viene mai prodotto senza l’integrazione di additivi che ne migliorano le sue proprietà, ha infatti bisogno di stabilizzanti al calore che ne impediscono la degradazione durante la lavorazione, e di plastificanti per essere flessibile e malleabile (Lithner et al., 2011).
La maggior parte degli additivi comprendono prodotti chimici come gli ftalati, i ritardanti di fiamma bromurati (BFR) ed il bisfenolo A (BPA) (Lambert et al., 2014).
Nel PVC gli ftalati spesso rappresentano il 50% del peso totale del polimero (Lambert et al., 2014). Gli ftalati nei prodotti in PVC soprattutto nel PVC flessibile o morbido non sono strettamente legati alla plastica, ma sono presenti come componenti mobili della matrice. La perdita di tali additivi per volatilizzazione nel corso del tempo o per contatto di superficie è infatti ormai ampiamente documentata (Stringer et al., 2000).Il più diffuso
tra gli ftalati è il di(2-etilesil)ftalato (DEHP), che rappresenta circa il 50% della produzione mondiale di ftalati e viene utilizzato come costituente del nitrato e acetato di cellulosa, cloruro di polivinile, copolimeri vinilici e polistirolo.
1.4.2. Inquinanti ambientali e PVC
Il PVC oltre a contenere elevate concentrazioni di additivi, residui di monomeri e altre sostanze potenzialmente tossiche (solventi, tensioattivi, iniziatori, catalizzatori e sottoprodotti) utilizzate durante il processo di produzione, è caratterizzato da una discreta affinità per gli inquinanti chimici.
25
Wu et al., (2001) hanno riportato, infatti, che il PVC possiede una elevata affinità per gli alchilbenzeni.
Le proprietà fisiche e chimiche di ogni tipo di plastica (superficie di scambio, idrofilia, diffusività e cristallinità), alcuni fattori ambientali (Temperatura e pH) come anche i tempi di permanenza nell’ambiente e quindi in mare possono influenzare il meccanismo e il tasso di adsorbimento di inquinanti chimici da parte della plastica (Teuten et al., 2009; Rochman, 2015).
Rochman et al., (2013a) hanno dimostrato che il PVC raggiunge velocemente l'equilibrio nell'ambiente marino rispetto ad altri tipi di plastica (HDPE, LDPE, PP) e che nello stesso tempo adsorbe IPA e PCBs a concentrazioni inferiori.
Nel PVC, infatti, è stata rilevata una veloce saturazione dei POPs, e la sua struttura vetrosa consente il solo adsorbimento, rispetto ad altre tipologie di plastica come il PE (Rochman et al., 2013a; Rochman, 2015).
I dati presenti in letteratura potrebbero indurre a pensare che a differenza delle altre tipologie di polimeri presenti in ambiente marino il PVC abbia una ridotta tossicità. In realtà seppur presenti una ridotta capacità ad adsorbire contaminanti, le elevate concentrazioni di additivi pericolosi che lo caratterizzano, ed alcuni residui come i monomeri di cloruro di vinile che risulta essere cancerogeno e/o mutageno (Lithner et al., 2011; Rochman et al., 2015), fanno sì che il PVC rappresenti un vettore di contaminati in ambiente marino.
1.5. INQUINANTI AMBIENTALI
La produzione di sostanze sintetiche e la loro immissione nell’ambiente, rappresenta un problema crescente che ha assunto nell’ultimo millennio livelli preoccupanti. L’incremento delle attività antropiche tra cui lo sviluppo industriale, la produzione di
26
energia, l’agricoltura intensiva, le attività di trasporto e ricreative hanno infatti determinato notevoli alterazioni ambientali.
Tutti gli organismi viventi risultano esposti a diversi livelli e tipologie di composti estranei all’organismo, denominati “xenobiotici”, la cui caratteristica è di possedere una struttura chimica differente da quella delle molecole naturali.
Tali sostanze possono essere di orgine naturale o sintetica, e si stima che fino ad oggi siano stati prodotti dall’industria chimica più di 100.000 composti di sintesi.
Da un punto di vista tossicologico nell’ambiente possiamo distinguere diverse classi di inquinanti:
• microinquinanti organici (pesticidi, PCB, IPA, fenoli, diossine ed idrocarburi); • alcune specie ioniche (nitriti, nitrati, fosfati, ioni ammonio, cloruri, floruri e solfati); • gli elementi minerali (macro-oligo-micro elementi) tra i quali rientrano i metalli pesanti;
Purtroppo i composti di sintesi rappresentano la classe più ampia e che maggiormente preoccupa. Le loro concentrazioni ambientali non sono molto elevate se paragonate ai composti organici di origine naturale ma, diversamente da questi risultano nocive a basse concentrazioni (microinquinanti organici).Queste molecole xenobiotiche possono infatti persistere nel comparto ambientale nel quale permagono, poiché si degradano molto lentamente. Alcune di queste, persistono quindi per decenni, ed una volta nell’ambiente possono essere trasportate a molti chilometri di distanza dal punto di immissione attraverso fenomeni di circolazione aerea ed acquatica “Long Range Transport” ed arrivare anche in ambienti remoti (Corsolini et al., 2002). Altri di questi composti, invece, non permangono molto nella biosfera e la loro pericolosità è limitata al luogo di immissione, poiché perdono le loro proprietà una volta raggiunto il comparto acqua.
27
Inoltre, la pericolosità di tali sostanze è dovuta anche alla loro capacità di legarsi alla materia organica e, in particolare, ai tessuti grassi (liposolubilità), ciò ne determina un accumulo negli organismi (bioconcentrazione) ed in seguito al fenomeno di biomagnificazione il trasferimento lungo la catena alimentare (Kelly et al., 2007).
Alcuni dei composti xenobiotici tra cuigli insetticidi organoclorurati e organofosforici, i policlorobifenili (PCBs), le diossine, ftalati, furani, vernici antifouling, sono stati individuati quali importanti Endocrine Disruptors Compounds (EDCs) o Interferenti Endocrini, poiché capaci di alterare, a vari livelli e con meccanismi diversi, la normale regolazione ormonale degli organismi. Tali composti, costituiscono un pericolo per la salvaguardia della biodiversità ed indirettamente anche per l’uomo (Tyler et al., 1998; Vos et al., 2000).
1.5.1. Inquinanti e ambiente marino
La presenza di inquinanti nell’ambiente marino, è quindi lagata principalmente all’attività antropica e diverse possono essere le vie di immissione di tali composti.
I contaminanti presenti negli oceani possono essere di origine naturale come nel caso delle tossine prodotte da organismi marini, dei metalli organici ed inorganici oppure sono prodotti di sintesi. Tra queste sostanze le più comuni che possiamo ritrovare in ambiente marino sono appunto gli idrocarburi riversati accidentalmente dalle petroliere in seguito ad incidenti (caso di inquinamento acuto), gli idrocarburi derivati dalla combustione, i pesticidi clorurati ed i composti organoalogenati scaricati da industrie, impianti zootecnici ed agricoli (inquinamento cronico).
La loro distribuzione nell’ambiente marino è influenzata da diversi fenomeni che ne determinano una diffusione anche in aree lontane dalle fonti di immissione.
28
Inoltre grazie alla liposolubilità, i composti xenobiotici entrano nella catena trofica sia per diffusione attraverso le membrane che in seguito al fenomeno di ingestione, e si accummulano lungo la catena alimentare, soprattutto a livello dei predatori di vertice (Aguilar & Borrell, 1994; Aguilar et al., 2002; Fossi et al., 2006). Infatti, i consumatori che si inseriscono a vari livelli della catena alimentare sono soggetti ad accumulare tali sostanze tossiche in quantità sempre maggiori quanto più alto è il livello che essi occupano, e ciò rappresenta un potenziale pericolo non solo per gli organismi marini, ma anche per l’uomo, in quanto consumatore finale (Ross & Birnbaum, 2003). Diversi studi hanno investigato l’impatto di tali sostanze nei confronti di organismi marini evidenziando la pericolosità dovuta al loro accumulo lungo la catena trofica, e soprattutto sulla loro capacità di fungere da Interferenti Endocrini (Geyer at al., 2000; Porte et al., 2006).
1.5.2. Additivi plastici
Gli additivi plastici sono sostanze chimiche che vengono integrate alla struttura porosa tridimensionale dei polimeri durante la manifattura, al fine di potenziarne le caratteristiche. Numerosi additivi vengono quindi impiegati per valorizzare le proprietà naturali dei diversi tipi di plastica, per ammorbidirli, colorarli, renderli più processabili o più durevoli.
Questi additivi possono essere rilasciati nell'ambiente durante il processo di fabbricazione, durante il ciclo vitale della plastica e durante le successive fasi di degradazione a cui va incontro la plastica stessa. Il grado di lisciviazione dipende dal diametro dei pori della matrice polimerica, che varia in base al tipo di polimero, dalla quantità e proprietà (basso peso molecolare) dell'additivo ed infine dalle condizioni ambientali (Teuten et al., 2009). Infatti gli additivi dal basso peso molecolare si muovono
29
più facilmente attraverso la matrice di un polimero. Diversi studi effettuati hanno rilevato la presenza di tali sostanze nell’ambiente riportando concentrazioni comprese tra ng/L a mg/L (Lambert et al., 2014).
Tra questi i più comuni e soprattutto i più pericolosi per l’ambiente includono prodotti chimici come gli ftalati, i ritardanti di fiamma bromurati (BFR) ed il bisfenolo A (BPA). Plastificanti, altri additivi plastici e residui di monomeri in quanto sostanze tossiche e pericolose rappresentano una potenziale minaccia per l’ambiente, poiché possono lisciviare dalla matrice polimerica nell’ambiente stesso (Teuten et al., 2009).
1.5.3. Ftalati e ambiente marino
Gli ftalati, sono esteri dell'acido ftalico utilizzati principalmente per migliorare la plasticità di polimeri industriali e per questo impiegati per la produzione di un certo numero di prodotti come giocattoli, vernici, adesivi, lubrificanti, materiale d'imballaggio e per la costruzione, nel campo dell’elettronica, e per i dispositivi medici (Mankidy et al., 2013).
Gli esteri dell’acido ftalico sono infatti, ampiamente utilizzati in tutto il mondo e rappresentano il 69% dei plastificanti utilizzati negli Stati Uniti, il 92% nell’Europa Occidentale e l’81% in Giappone. Nel complesso, essi rappresentano l'82% dei 2,5 milioni di tonnellate di plastificante utilizzato in queste aree. Come conseguenza del loro ampio utilizzo, sono tra le più abbondanti sostanze chimiche presenti nell'ambiente (Stringer et al., 2000).
Tali additivi non sono chimicamente legati alla resina polimerica in cui vengono integrati, tendono quindi a migrare lentamente verso la superficie del prodotto e lisciviare o evaporare dal prodotto verso l'ambiente circostante (Lambert et al., 2014). La struttura e
30
le proprietà fisiche variano tra gli ftalati, influenzando il loro comportamento nell’ambiente (Mankidy et al., 2013).
Gli ftalati non sono classificati come composti persistenti (Staples et al., 1997), ma sono stati descritti come una delle sostanze chimiche più abbondante e ubiquitaria nell'ambiente e di conseguenza rilevate anche nell’uomo, nonostante le diverse teorie riguardo la loro rapida biodegradazione in alcuni ambienti (Oehlmann et al., 2009). Residui di alcuni ftalati sono stati infatti individuati in più comparti ambientali: acque superficiali, sedimenti fluviali, fanghi di depurazione, acque reflue effluenti trattate e non, nell'acqua piovana e nei suoli agricoli (Lambert et al., 2014). Nell’uomo sono stati rilevati nel sangue, urine, saliva, liquido amniotico, latte materno e nel cordone (Mankidy et al., 2013).
Grazie alla loro idrofobicità, possiedono un discreto potenziale di bioaccumulo. Ftalati con basso peso molecolare, come dietil ftalato (DEP) hanno un fattore di bioaccumulo (BAF) elevato, mentre gli ftalati con elevato peso molcolare tra cui il di-(2-etil esil) ftalato (DEHP) tendono ad avere minori BAF (Staples et al., 1997). Tali fattori di bioconcentrazione (BCF) per plastificanti, differiscono ampiamente tra le specie. Alcune di queste differenze riguardano il tipo e la natura dei plastificanti, ma altri riguardano le differenze nei disegni sperimentali impiegati, le concentrazioni utilizzate, le caratteristiche delle specie ed il tipo di tessuto esaminati. Infatti fattori di bioconcentrazione riportati in organismi invertebrati sono generalmente più alti rispetto a quelli di vertebrati (Oehlmann et al., 2009).
Diverse indagini sui meccanismi d'azione dei plastificanti sottolineano come gli ftalati possono avere più siti di interazione in un organismo, che interessano una vasta gamma di processi biologici e che possono indurre già effetti biologici negativi nel range di concentrazione tra i ng/l-µg/l (Oehlmann et al., 2009).
31
In ambiente marino, la loro presenza è stata rilevata in diversi comparti (Magdouli et al., 2013; Mankidy et al., 2013), e soprattutto a diversi livelli della catena trofica, dallo zooplancton fino ai livelli più alti della catena alimentare (Fossi et al., 2012; 2014). In particolare molti studi si sono concentrati sul di-(2-etilesil) ftalato (DEHP) che rappresenta lo ftalato più abbondante nell'ambiente; sia in organismi invertebrati che vertebrati, che viene rapidamente metabolizzato nel suo metabolita primario, il mono-(2-etilesil) ftalato (MEHP), che può essere utilizzato come indicatore di esposizione al DEHP negli organismi (Fossi et al., 2012; Magdouli et al., 2013; Andrady et al., 2015). Nonostante un certo numero di studi etichetti gli ftalati come sostanze che non persistono nell'ambiente (Staples et al., 1997) e che mostrano molta poca tendenza al bioaccumulo (Gobas et al., 2003), non si può non considerare che il loro elevato tasso di sintesi potrebbe sostituire il tasso naturale di rimozione e degradazione, favorendo un eventuale accumulo di queste sostanze chimiche nell'ambiente e quindi negli organismi, incluso l’uomo.
Gli ftalati sono stati indicati quali uno dei principali contaminanti emergenti (EC) che oltre ad essere ormai ubiquitari nell’ambiente, alterano diversi processi biochimici negli esseri umani e fauna selvatica. Questi includono effetti sulla riproduzione, sullo sviluppo neurologico ed allergie. Poichè gli esseri umani e gli organismi possono essere esposti contemporaneamente a più ftalati, qualsiasi valutazione sui loro rischi non può prescindere dagli effetti combinati di tali plastificanti e dalle rispettive concentrazioni (Magdouli et al., 2013; Mankidy et al., 2013).
1.5.4. Inquinanti organici persistenti (POPs)
Con il nome di POPs (persistent organic pollutants) o inquinanti organici persistenti vengono considerate tutte le sostanze chimiche a base di carbonio che presentano come
32
caratteristiche principali la persistenza nell’ambiente per lunghi periodi (in quanto resistenti ai processi di degradazione chimica, biologica, fotochimica) e la capacità di accumularsi nei tessuti adiposi degli organismi compreso l’uomo (Spezzano, 2004). Inoltre essendo anche composti semivolatili, possono essere facilmente trasportati attraverso fenomeni di circolazione aerea ed acquatica “Long Range Transport” anche in aree in cui non sono utilizzati o prodotti rappresentando un serio pericolo sia in ambiente marino che terrestre (Spezzano, 2004; Abdallah, 2015). Si distinguono dagli altri composti organici per quattro caratteristiche fondamentali: persistenza, bioaccumulo, tossicità e mobilità nell’ambiente (Spezzano, 2004).
Tra i POPs più pericolosi, sono state individuate 12 molecole, 9 tipi di pesticidi e 3 tipologie di prodotti industriali tra cui i policlorobifenili (PCB), le policlorodibenzodiossine (PCDD) ed i policlorodibenzofurani (PCDF).
Tali composti sono orma stati banditi o comunque sono state attuate restrinzioni soprattutto dopo la Conferenza delle Nazioni Unite su Ambiente e Sviluppo (UNCED, United Nations Conference on Environment and Development), tenutasi a Rio de Janeiro nel 1992, durante la quale gli stati di tutto il mondo si riunirono per affrontare la questione riguardo la salvaguardia dell’ambiente e per far maturare nei Paesi industrializzati la consapevolezza di dover prevenire con maggior determinazione i fenomeni di inquinamento e nello stesso tempo fornire strumenti di gestione e controllo per mitigare gli impatti. Purtroppo i passi avanti fatti in questo senso nell’ambito dello sviluppo sostenibile non sono risultati sufficienti e ciò è stato confermato successivamente durante il summit mondiale sullo Sviluppo Sostenibile (WSSD, World Summit on Sustainable Development) tenutosi a Johannesburg nel 2002. Inoltre, con la Convenzione di Stoccolma entrata in vigore nel 2004, a cui hanno aderito 150 paesi inclusii paesi dell’Unione Europea, è stata ridotta o vietata la produzione, l’impiego e/o il
33
rilascio di 12 POPs in quanto ritenuti molto pericolosi per l’ambiente e l’uomo (Abdallah, 2015). E’ stato riportato che i POPs possono causare disfunzioni del sistema immunitario, disturbi nella riproduzione, disordini neurologici e anomalie comportamentali (ATSDR, 2003), e in alcuni casi possono essere anche mutageni e cancerogeni (Spezzano, 2004). Tutt’oggi tali sostanze a causa della loro persistenza e della loro diffusione ormai a livello globale rappresentano un pericolo per l’ambiente e per gli organismi che lo popolano.
1.5.5. POPs e ambiente marino
A causa delle loro caratteristiche (persistenza, liposolubilità, tossicità e diffusione ad ampio raggio) i POPs sono ubiquitari in ambiente marino con conseguente contaminazione anche in aree remote (Corsolini et al., 2002). Molti studi infatti, riportano la presenza di tali in composti in diverse aree e conseguentemente in molti organismi marini a differenti livelli trofici (Meador et al., 1995; Baumard et al., 1998; Marsili & Focardi, 1997; Marsili et al., 1997; Fossi et al., 2006, 2014; Pinzone et al., 2015; Bonito et al., 2016). Il comportamento dei POPs nell’ambiente appare molto complesso, poiché essendo dei composti ubiquitari e caratterizzati da facile motilità nell’ambiente caratterizzano diversi comparti che interagiscono tra di loro (Spezzano, 2004). Negli ambienti acquatici i POPs sono motivo di forte preoccupazione, poichè vanno in contro a processi di scambio con i sedimenti oppure possono essere rilasciati nell’atmosfera (Spezzano, 2004). Inoltre i POPs a causa della loro idrofobicità, presentano una notevole affinità per il particolato organico e la loro permanenza nell’ambiente può essere influenzata da diversi fattori tra cui i livelli di adsorbimento e il peso molecolare. Quando tali composti raggiungono il comparto marino tendono a distribuirsi lungo la colonna d’acqua in base al loro peso molecolare. I composti a basso peso molecolare rimangono in superficie, dove possono essere rilasciati nell’atmosfera oppure essere adsorbiti dal