Indice
Capitolo 1
Struttura dell’osso
pag. 31.1 Istologia del tessuto osseo
pag. 41.2 Rapporti tra osteoclasti ed osteoblasti
pag. 91.3 Tipi di tessuto osseo
pag. 111.4 Classificazione delle ossa
pag. 13Capitolo 2
Struttura e caratteristiche chimico-fisiche dei bifosfonati
pag. 14Capitolo 3
Farmacologia dei bifosfonati
pag. 193.1 Effetti sul tessuto osseo
3.1.1Meccanismo d’azione cellulare e tissutale pag. 22
3.1.2 Inibizione dell’attività degli osteoclasti maturi pag. 23 3.1.3 Induzione dei processi di apoptosi negli osteoclasti pag. 23 3.1.4 Inibizione del reclutamento e della formazione di nuovi osteoclasti pag. 24
3.1.5 Effetti sugli osteoblasti pag. 26
3.1.6 Meccanismi d’azione molecolare pag. 27
3.2 Farmacocinetica
pag. 293.3 Effetti avversi e interazioni
pag. 32Capitolo 4
Applicazioni terapeutiche dei bifosfonati
pag. 364.1 Osteoporosi
pag. 364.2 Metastasi ossee
pag. 404.3 Ipercalcemia neoplastica
pag. 434.4 Malattia di Paget
pag. 454.5 Uso off-label
pag. 474.6 Effetti extrascheletrici: potenziali applicazioni terapeutiche
pag. 494.6.1 Effetti sull’infiammazione in vitro pag. 49
Capitolo 5
Osteonecrosi delle ossa mascellari indotta da bifosfonati
pag.565.1 Cenni storici
pag. 585.2 Quadro clinico
pag. 625.3 Esclusività del coinvolgimento delle ossa mascellari
pag. 655.4 Bifosfonati somministrati per via endovenosa
pag. 67 5.4.1 Ruolo di cofattori di comorbidità odontoiatrici pag. 695.4.2 Fasi iniziali dell’osteonecrosi pag. 72
5.4.3 Fase conclamata dell’osteonecrosi pag. 75
5.4.4 Terapie supplementari sconsigliate pag. 77
5.5 Bifosfonati somministrati per via orale
pag. 795.5.1 Fattori di rischio medici pag. 80
5.5.2 Fattori di rischio odontoiatrici pag. 81
5.5.3 Valutazione dei rischi odontoiatrici associati allo sviluppo di
osteonecrosi pag. 82
5.6 Prevenzione dell’osteonecrosi indotta da bifosfonati per via orale
pag. 845.7 Trattamento dell’osteonecrosi dei mascellari indotta da bifosfonati
pag. 86Conclusioni
pag. 88Bibliografia
pag. 90Capitolo 1
Struttura dell’osso
L'osso è rivestito all'esterno da una membrana connettivale, detta periostio, ed è attraversato da vasi e nervi. La superficie interna, ricoperta dall'endostio, circonda la cavità intermidollare. In questa cavità è contenuto il midollo osseo che svolge la massima parte della funzione emopoietica (produzione dei globuli rossi, globuli bianchi e piastrine). Le membrane forniscono cellule per la crescita ed il rimodellamento delle ossa. Le ossa sono sede di fenomeni piezoelettrici, in cui cioè stimoli meccanici (dovuti alla mobilizzazione) vengono convertiti in potenziali elettrici. Le cariche elettriche così generate sono in grado di attivare o inibire il metabolismo dei diversi tipi di cellule ossee, favorendo la deposizione del tessuto da parte degli osteoblasti o il riassorbimento dello stesso da parte degli osteoclasti.
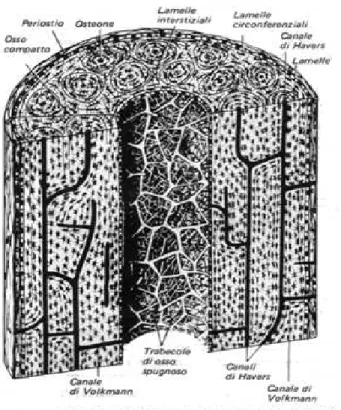
L'osso è costituito da una parete spessa (osso compatto), che diventa spugnosa (osso spugnoso) verso l’interno occupato dal midollo. Nello spessore della parete si trova un sistema di canali, denominati osteoni, che sono formati a loro volta da molti strati circolari e concentrici, cementati da cellule che sono gli osteociti. Ogni osteone è attraversato nella sua parte centrale, per tutta la sua lunghezza, da un vaso sanguigno racchiuso nel canale di Havers. Da questo si dirama una rete di vasi, contenuti nel canale di Volkmann, che raggiungono le restanti parti dell’osso (fig. 1.1). (Anatomia del Gray, 1° vol. Zanichelli, 4° edizione italiana.)
1.1 Istologia del tessuto osseo
Il tessuto osseo è una varietà di tessuto connettivo in stato di continuo rimodellamento, caratterizzato dalla mineralizzazione della matrice extracellulare, che conferisce alla struttura notevole resistenza e durezza. Esso è costituito da cellule e da una matrice extracellulare inorganica (minerale) ed organica.
La componente minerale dell’osso è costituita principalmente da calcio, combinato con ossigeno, fosforo e idrogeno a formare una molecola cristallina denominata idrossiapatite, un composto minerale che forma sottili cristalli a forma di prismi, della lunghezza di 20 nm e dello spessore di circa 2 nm.
La componente organica dell’osso è formata da una componente fibrillare costituita da fasci intrecciati di fibre e da una componente amorfa di natura proteoglicanica. Quest'ultima, tuttavia, è molto ridotta, tanto che la componente prevalente non minerale della matrice stessa (circa il 20% del suo peso secco) risulta essere il collagene di tipo I. Nell'osso adulto queste fibre sono disposte, secondo una organizzazione precisa ed ordinata, a costituire fasci che, a loro volta, formano strutture ad elica che aumentano le doti di compattezza e resistenza meccanica del tessuto. L'organizzazione tridimensionale dei fasci di fibre e delle cellule forma, nell'osso maturo, strutture di forma lamellare. Altri componenti della matrice ossea sono glicoproteine di vario tipo che svolgono soprattutto il ruolo di proteine di adesione. Fra di esse possono essere menzionate la fibronectina, la trombospondina e l'osteopontina, tutte con il compito predominante di ancorare le cellule alla matrice. Una proteina particolare della matrice ossea è invece l'osteocalcina, coinvolta presumibilmente nella sintesi del tessuto. Anche l'osteonectina è una proteina molto comune della matrice ossea, ed il suo ruolo è quello di promuovere la mineralizzazione della matrice stessa.
Le diverse componenti della matrice, quella organica e quella minerale, conferiscono al tessuto osseo proprietà diverse ed interdipendenti: la frazione calcificata è responsabile della durezza dell'osso, mentre quella fibrillare è responsabile della flessibilità e dunque della robustezza e della resistenza alla trazione del tessuto.
Fig 1.1 Disegno tridimensionale di un segmento di diafisi di un osso.
Le cellule del tessuto osseo sono gli osteoblasti, gli osteociti e gli osteoclasti. Gli osteoblasti sono cellule di forma tondeggiante che derivano dalla differenziazione delle cellule osteoprogenitrici. Sono caratterizzati da un reticolo endoplasmatico rugoso e da un apparato di Golgi molto estesi; sono cellule piuttosto grandi, con nucleo rotondo e citoplasma molto basofilo. Il citoplasma presenta un’intensa attività fosfatasica alcalina e contiene granuli PAS-positivi che costituiscono i precursori delle glicoproteine della matrice ossea. Analogamente ai fibroblasti (le cellule fondamentali del tessuto connettivo propriamente detto), gli osteoblasti sono costantemente impegnati nelle fasi di formazione dell'osso e nella sintesi dei componenti molecolari che vanno a costituire sia
le fibre che le glicoproteine della matrice. Questi composti vengono liberati dalle cellule per esocitosi, e vengono quindi assemblati nella loro forma definitiva all'esterno della cellula.
Una volta completata la sintesi della matrice ed una volta avvenuta la sua calcificazione, gli osteoblasti si sistemano in cavità ellissoidali non mineralizzate, scavate nella matrice stessa, definite lacune ossee o lacune di Howship. In questa fase prendono il nome di osteociti e, pur rimanendo cellule vitali, entrano in uno stato di quiescenza. Pertanto gli osteociti rappresentano un successivo stadio funzionale degli osteoblasti e sono caratterizzati da un apparato di Golgi e un reticolo endoplasmatico granulare poco sviluppati. Tipici di queste cellule sono i lunghi prolungamenti citoplasmatici con i quali la cellula attinge alle sostanze nutritizie e che decorrono all'interno di microgallerie denominate canalicoli ossei: al microscopio elettronico si può osservare che tra la matrice calcificata e la membrana plasmatica è presente uno spazio occupato da glicoproteine e liquido interstiziale. I canalicoli possono anche intersecarsi tra loro cosicché non solo più osteociti sono in contatto tra loro, ma anche il liquido interstiziale giunge a cellule poste a distanza dalla sorgente nutritizia.
Gli osteociti non rappresentano solo una mera evoluzione degli osteoblasti: infatti questi ultimi possono essere controllati dai primi mediante opportuni segnali qualora vi sia necessità di deporre matrice ossea. Inoltre, gli osteociti, possedendo recettori di membrana per l'ormone paratiroideo (PTH), controllano l'azione degli osteoclasti.
Gli osteoclasti sono cellule giganti plurinucleate, del diametro di 20-100 nm, contenenti decine di nuclei, che si trovano sulla superficie di trabecole ossee in via di riassorbimento. Sono gli elementi cellulari deputati a distruggere l’osso. Appaiono spesso localizzati nelle fossette di Howship, che si formano proprio per azione erosiva degli osteoclasti. Il loro citoplasma ha aspetto vacuolizzato ed è molto meno basofilo rispetto a quello degli osteoblasti o, in alcune di esse, è debolmente acidofilo.
Il microscopio elettronico rivela la presenza nel citoplasma di numerosi mitocondri, complessi di Golgi multipli, scarsi elementi appartenenti al reticolo endoplasmatico granulare, e numerosi poliribosomi liberi contenenti idrolasi acide.
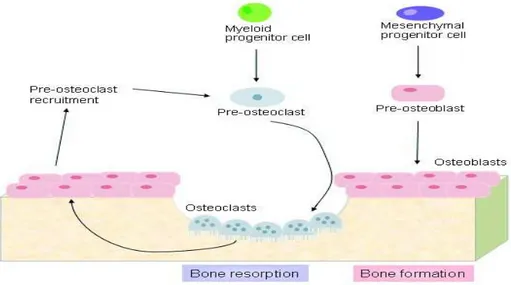
Gli osteoclasti si sviluppano da elementi cellulari precursori nel midollo osseo, i preosteoclasti, che a loro volta si sono sviluppati verso questa linea cellulare, originando dalle cellule staminali mesenchimali totipotenti non differenziate del midollo. Questi precursori lasciano il midollo osseo come cellule mononucleate circolanti e differenziate (in risposta a fattori di trascrizione come cFos e PU.1) e si fondono in cellule giganti multinucleate (osteoclasta maturo). (Jameson et al., 2006).
Nel normale ciclo di rinnovamento osseo l’osteoclasta inizia il riassorbimento osseo (in risposta allo stimolo dell’ormone paratiroideo) sviluppando un orletto increspato all’interfaccia con la superficie ossea e secernendo acido cloridrico a pH 1 in una zona sigillata e confinata che è la lacuna di Howship. L’acido forte provoca la demineralizzazione della matrice ossea, promuovendo inoltre, tramite l’enzima collagenasi, la lisi dei componenti organici della matrice ossea (costituiti per il 99% da collagene). Questa serie di eventi causa la liberazione di una proteina morfogenica ossea (BMP) e dei fattori di crescita insulino-simili 1 e 2 (IlGF1 e IlGF2), che sono proteine insolubili negli acidi che, a loro volta, promuovono la differenziazione in osteoblasti di cellule staminali locali e circolanti e stimolano la neoformazione di osso. Gli osteoblasti neodifferenziati secernono sostanza osteoide nella quale rimangono intrappolati. Con il tempo gli osteoblasti divengono osteociti maturi che mineralizzano ulteriormente la sostanza osteoide trasformandola in osso maturo. Dal punto di vista chimico l’osso maturo è formato da fasci di collagene di tipo I a elica sinistrorsa che, con l’avanzamento del processo di mineralizzazione, si interfacciano con cristalli di idrossiapatite di calcio. Il collagene all’interno dell’osso viene anche detto matrice ossea organica collagenosa. In questa matrice gli osteoblasti trasportano proteine che costituiscono la cosiddetta matrice
organica non collagenosa dell’osso, che comprende tra le altre osteocalcina, sialoproteine, BMP, IlGF1 e IlGF2. Queste proteine partecipano al mantenimento della matrice ossea e, una volta liberate a causa del riassorbimento osteoclastico, contribuiscono alla rigenerazione di nuovo osso.
In assenza di riassorbimento da parte degli osteoclasti non può avvenire la rimozione dell’osso già esistente, seguita dalla formazione di osso nuovo più elastico. I processi di riassorbimento svolti da una singola cellula osteoclastica sulla superficie ossea danno luogo alla formazione della lacuna di Howship, a forma di coppa. I fenomeni di riassorbimento di un gruppo di diversi osteoclasti formano un’area concava più ampia nota come cavità di riassorbimento. La cavità di riassorbimento seguita da una coda di osteoblasti e sostanza osteoide è nota come unità metabolica ossea (BMU) e misura da 0,2 a 0,4 mm (da 200 a 400 µm) di ampiezza e da 1 a 2 mm di lunghezza. Nell’adulto la BMU continua la sua attività per un periodo compreso tra 6 e 9 mesi, denominato sigma. Il tessuto osseo invecchiato perde gli osteociti a causa dei normali processi di morte cellulare. Ciò provoca l’arresto dei processi di rimaneggiamento della matrice mineralizzata dell’osso che diviene anelastica, fragile e si danneggia con microfratture. I vasi sanguigni nei canali di Volkmann e il sistema haversiano degenerano; l’osso diviene così non vitale e avascolare. Questo tessuto osseo deve essere riassorbito e rimpiazzato da osso neoformato, altrimenti si frattura o va incontro a esposizione.
In un individuo sano l’osso cresce fino a 18-20 anni. Tra 20 e 30 anni si completa la mineralizzazione. Successivamente si assiste ad un periodo di stabilizzazione che termina intorno a 40-50 anni con le prime perdite fisiologiche. Nell’osso normale si osserva equilibrio tra distruzione ossea mediata dagli osteoclasti e formazione ossea, promossa dagli osteoblasti. Nelle patologie ossee si manifesta un disequilibrio che favorisce un’aumentata distruzione ossea a spese di una formazione insufficiente. (Anatomia del Gray, 1° volume. 4° Ed. italiana).
1.2 Rapporti tra osteoclasti ed osteoblasti
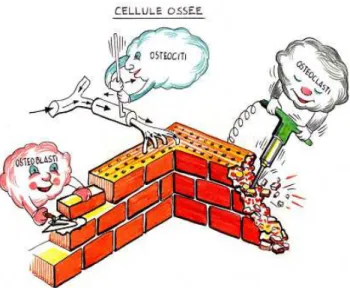
Il ruolo vitale svolto dagli osteoclasti e dagli osteoblasti nel rinnovamento osseo e nell’omeostasi dello scheletro rende queste due categorie di cellule interdipendenti nei meccanismi di controllo stimolatori ed inibitori (fig. 1.2, 1.3).
Fig. 1.2 Rappresentazione grafica del ruolo svolto da osteociti, osteoclasti ed osteoblasti.
Durante il riassorbimento osseo l’osteoclasta secerne BMP, ILG1 e ILG2, che vengono trasportati nella matrice ossea dagli osteoblasti quando questi producono la sostanza osteoide. Una volta liberate, queste proteine reclutano e promuovono la differenziazione di una seconda generazione di osteoblasti dal serbatoio di cellule staminali mesenchimali per la ripopolazione delle BMU e la rigenerazione dell’osso riassorbito. Gli osteoblasti tuttavia non sempre sono perfettamente sincronizzati con gli osteoclasti. Pertanto se il riassorbimento procede più rapidamente della neoapposizione ossea, ne può derivare un bilancio negativo con sviluppo di fratture, debilitazione e persino la morte dell’organismo. Per ostacolare questo potenziale riassorbimento incontrollato l’osteoblasta necessita di un meccanismo per controllare e, in particolare, per rallentare la velocità del riassorbimento osseo. Nel corso dell’evoluzione quindi, l’osteoblasta ha
sviluppato la capacità di produrre una proteina con funzione inibitrice diretta sulla funzione osteoclastica. Questa proteina, nota come osteoprotegerina (OPG) costituisce il principale meccanismo di controllo della velocità dello sviluppo e della funzione degli osteoclasti. OPG è un “recettore-esca” che compete con il gruppo delle proteine stimolanti gli osteoclasti, note come RANKL (ligando del recettore attivatore del fattore nucleare kB), per il legame con il recettore RANK sulla superficie della membrana cellulare dell’osteoclasta. Impedendo alle proteine RANKL di legarsi al recettore di membrana RANK, e quindi di stimolare l’osteoclasta al riassorbimento dell’osso. L’OPG inibisce la differenziazione, la funzione e la sopravvivenza dei singoli osteoclasti.
L’osteoblasta regola anche la differenziazione degli osteoclasti fornendo maggiori o minori quantità di adenosina monofosfato ciclica (cAMP), gp 130 e 1,25-diidrossivitamina D3, fattori tutti necessari per lo sviluppo dell’osteoclasta, e quindi controlla la quantità di osteoclasti disponibili. (Manolagas, 2000).
1.3 Tipi di tessuto osseo
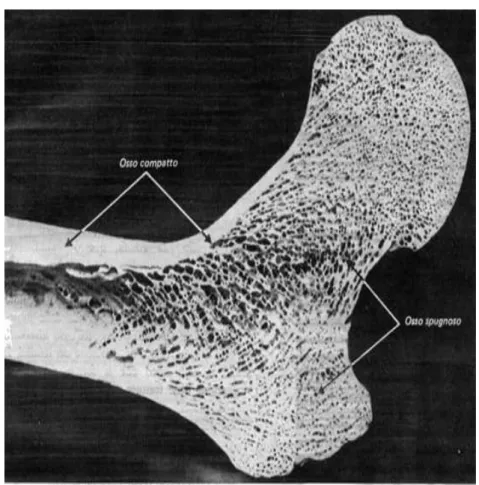
Il tessuto osseo si può suddividere in osso spugnoso ed osso compatto (fig. 1.4).
L’osso spugnoso ha un aspetto alveolare ed è costituito da sottili trabecole (o spicole), formate da lamelle addossate le une alle altre, che si ramificano e si anastomizzano in una rete tridimensionale nelle cui maglie è accolto il midollo osseo; queste cavità midollari sono spazi intercomunicanti e si continuano nelle ossa lunghe con la cavità midollare della diafisi. Mancano sistemi di Havers completi e le trabecole non sono attraversate da vasi sanguigni. I canalicoli ossei intercomunicanti delle lacune ossee si aprono nelle cavità midollari multiple al di sotto dell’endostio che le riveste; gli osteociti possono quindi ricevere il nutrimento direttamente dall’endostio, per diffusione attraverso la rete dei canalicoli.
L’osso compatto appare sotto forma di una massa solida continua. In realtà la sostanza ossea è attraversata da numerosi canali longitudinali, o talora obliqui che sono i canali di Havers. Un secondo sistema di canali, di calibro inferiore, attraversa l’osso obliquamente o perpendicolarmente al suo asse maggiore, connettendosi con i canali di Havers, aprendosi sulle superfici periostale ed endostale: sono i canali di Volkmann. Piccoli vasi sanguigni e nervi penetrano dall’endostio e dal periostio nei canali di Volkmann e da questi nei canali di Havers. I canali di Havers e di Volkmann, quindi, sono canali vascolari scavati nella matrice ossea che provvedono alla nutrizione e all’innervazione dell’osso. I canali di Volkmann di distinguono nelle sezioni dai canali di Havers, oltre che per la loro direzione trasversale od obliqua rispetto all’asse maggiore dell’osso, anche perché non sono circondati da lamelle disposte concentricamente.
I sistemi lamellari adiacenti sono tra loro separati da uno strato rifrangente, che si colora più intensamente, di matrice ossea modificata denominata linea cementante. Questo sistema di canali vascolari intercomunicanti è connesso a sua volta con la rete formata dai
canalicoli ossei e dalle lacune ossee; lungo i canalicoli diffonde il liquido interstiziale contenente le sostanze nutritive ed i metaboliti destinati alle cellule ossee contenute nelle lacune. (Anatomia del Gray, 1° volume. 4° Ed. italiana).
1.4 Classificazione delle ossa
Le ossa del corpo umano differiscono tra loro per forma e dimensioni, ricoprendo funzioni altrettanto diversificate. In base a queste loro caratteristiche vengono distinte in: ossa lunghe, quando la lunghezza prevale sulle altre dimensioni; ossa piatte o larghe, quando larghezza o lunghezza prevalgono sullo spessore; ossa brevi, quando le tre dimensioni sono pressoché uguali.
OSSA LUNGHE: sono formate da una parte centrale, detta diafisi, e da due estremità, o
teste, più grosse, dette epifisi. Le epifisi contraggono rapporti con le ossa vicine e sono provviste di superficie articolare. La massa centrale (diafisi) è costituita da tessuto compatto e, più all'interno, da una cavità in cui è generalmente contenuto il midollo osseo. Tipiche ossa lunghe sono quelle degli arti (femore, tibia, fibula, omero, radio, ulna). Talvolta, si distingue una terza, piccola, zona cartilaginea, chiamata metafisi e collocata tra epifisi e diafisi. Essa è presente nel bambino e nel giovane adolescente, mentre scompare nell'adulto; è essenziale per la crescita in lunghezza delle ossa lunghe.
OSSA CORTE O BREVI: sono caratterizzate da lunghezza e diametro di simile misura;
sono costituite da tessuto spugnoso completamente avvolto da una lamina di tessuto compatto. Esempi di ossa corte del corpo umano sono quelle del polso, del calcagno e le vertebre.
OSSA PIATTE: similmente alle ossa lunghe, le ossa piatte hanno una, seppur ridotta,
parte centrale di tessuto spugnoso (detto diploe) dove si trova il midollo osseo. Questa parte è ricoperta da due strati (uno per lato) di tessuto compatto (detti tavolati). Tipiche ossa piatte sono quelle del cranio, del bacino e dello sterno. (Cremaschi D., 1991)
Capitolo 2
Struttura e caratteristiche chimico-fisiche dei
bifosfonati
I bifosfonati sono analoghi strutturali del pirofosfato inorganico, il più semplice dei polifosfati, una sostanza normalmente presente nei liquidi biologici e capace di inibire l’aggregazione e la dissoluzione dei cristalli di fosfato di calcio in vitro (Fleisch et al. 1966) e la calcificazione ectopica in vivo. (Schibler et al., 1968)
Il pirofosfato è prodotto in varie reazioni biosintetiche dell’organismo. Veniva impiegato come agente anti-tartaro nelle paste dentifricie e come radionuclide osteospecifico nelle scintigrafie ossee. Previene la calcificazione dei tessuti molli e svolge un ruolo di regolazione nei processi di mineralizzazione ossea. Esso conserva le sue proprietà farmacologiche solo se viene somministrato per via parenterale, mentre se è somministrato per via orale viene degradato dalle pirofosfatasi contenute nell’orletto a spazzola delle cellule epiteliali di rivestimento del tratto gastrointestinale.
Grazie alla sostituzione dell’atomo di ossigeno contenuto nella struttura di base del pirofosfato (P-O-P) con un atomo di carbonio (P-C-P), si ottengono composti resistenti all’attività enzimatica delle pirofosfatasi, al calore ed a molti reagenti chimici, pur conservando le proprietà chimico-fisiche proprie del pirofosfato. (Glowacki, 2005) Come il pirofosfato (fig. 2.1), anche i bifosfonati (fig. 2.2) sono molto efficaci nell’impedire in vivo la calcificazione indotta sperimentalmente nelle arterie, nel rene, nella cute e in molti altri tessuti; (Fleisch et al. 1970; Rosenblum et al., 1977) inoltre questi composti impediscono la formazione di calcoli renali indotti da dosi elevate di vitamina D e del tartaro orale quando applicati localmente. (Briner et al., 1971)
La presenza di due soli gruppi fosfati rende ragione della denominazione “bifosfonati” conferita a questo gruppo di sostanze.
Nei bifosfonati alla struttura P-C-P sono collegate due catene laterali:
• una catena laterale lunga (R2) che determina le proprietà farmacologiche, la modalità d’azione e la potenza antiriassorbitiva (e forse la tossicità). Questa catena differisce notevolmente da composto a composto,
• una catena laterale corta (R1), responsabile della farmacocinetica del composto; partecipa al legame con l’idrossiapatite.
Fig 2.1 Struttura chimica del pirofosfato inorganico. Fig 2.2 Struttura chimica dei bifosfonati.
Il grado di attività di ciascuna molecola dipende quindi dal tipo di catene laterali legate alla struttura P-C-P. (Muchlbauer et al., 1991) Mediante esterificazione del fosfato e tramite sostituzione con diversi tipi di catene laterali legate all’atomo di carbonio sono stati sintetizzati numerosi analoghi, ciascuno dei quali presenta caratteristiche chimico-fisiche e biologiche diverse, caratterizzati da un particolare profilo di attività.
La potenza antiriassorbitiva dei bifosfonati dipende da due parametri: l’affinità di legame alla matrice ossea e la capacità di inibire l’attività osteoclastica. L’affinità di legame dei vari bifosfonati alla matrice ossea, che dipende dal gruppo molecolare presente nella catena R1, è incrementata dalla presenza di un gruppo -OH in questa posizione. Le differenti affinità dei bifosfonati condizionano la quantità di farmaco che
si accumula, la persistenza nella matrice ossea e la durata d’azione. (Reitsma et al., 1980)
La potenza dell’inibizione dell’attività osteoclastica dipende dal gruppo molecolare presente in R2. I bifosfonati che possiedono un gruppo –NH2 in questa posizione (bifosfonati) sono più potenti di quelli che ne sono sprovvisti (non amino-bifosfonati). La potenza è, inoltre, legata alla conformazione tridimensionale della catena R2, e quindi alla lunghezza della catena, alla introduzione di gruppi metilici, pentilici, imidazolici e anelli benzenici. Allungando, ad esempio, la catena alifatica nella catena R2, la potenza farmacologica aumenta per ogni atomo di carbonio aggiunto, fino a 9 atomi di carbonio, ma un ulteriore allungamento determina una riduzione dell’attività farmacologica. (Shinoda et al., 1983)
Un aumento di potenza è stato ottenuto inserendo nella catena lunga R2: • Catena alchilica (fino a 4C: alendronato)
• Gruppo amminico primario (pamidronato)
• Gruppo amminico terziario con struttura ad anello (risedronato, zoledronato)
Potenza biologica e affinità di legame sono caratteristiche strettamente connesse tra loro in quanto determinano la potenza anti-riassorbitiva in vivo. I bifosfonati con alta affinità di legame alla superficie mineralizzata vengono maggiormente ritenuti nell’osso e sono caratterizzati da un effetto farmacologico più potente. La matrice ossea, inoltre, funzionando come una spugna, è in grado di assorbire, rilasciare localmente e riassorbire nuovamente i bifosfonati in misura maggiore quanto più è alta l’affinità. (Francis et al., 1966)
Dalla fine degli anni ’80 sono stati sintetizzati composti con attività antiriassorbitiva sempre più potente, ottenuti mediante sostituzione della catena laterale R2 e mantenendo invariata la catena laterale R1. (Fig. 2.3)
Fig 2.3 Struttura chimica dei bifosfonati di prima, seconda e terza generazione.
Fondamentale è stata l’introduzione nella struttura dei bisfosfonati di gruppi amminici, con la conseguente formazione di amino-derivati che costituiscono quasi una classe distinta, sia per efficacia che per meccanismo d’azione molecolare, e per i quali la proprietà antiriassorbitiva è dissociata dall’inibizione della mineralizzazione. Tra questi l’alendronato e il pamidronato, che sono da 10 a 100 volte più potenti rispetto a clodronato e etidronato. I bisfosfonati che contengono un gruppo azotato terziario (ibandronato ed olpadronato) risultano ancora più attivi.
I bisfosfonati con maggiore capacità anti-riassorbitiva sono quelli, come risedronato e zoledronato, che contengono un gruppo amminico all’interno di un anello eterociclico, e possiedono un’attività 10.000 volte più potente rispetto all’etidronato in alcuni modelli sperimentali. La tabella 2.1 raffigura le catene laterali R1 ed R2 e la potenza relativa di alcuni bifosfonati.
A tutt’oggi sono stati sintetizzati alcune centinaia di bisfosfonati; di questi solo una dozzina è utilizzata nella pratica clinica.
Inoltre è stato accertato che solo i bifosfonati contenenti azoto possono provocare l’osteonecrosi dei mascellari.
I bifosfonati hanno affinità elevata per il Ca++, che non è proporzionale alla capacità di inibire il riassorbimento osseo.
Tabella 2.1 Componenti delle catene laterali dei bifosfonati e potenza relativa.
Catena laterale R1 Catena laterale R2 Potenza relativa
Etidronato OH CH3 1 Clodronato Cl Cl 1 Tiludronato H CH2-S-phenyl-Cl 50 Pamidronato OH (CH2)2NH2 1000-5000 Neridronato OH (CH2)5NH2 50 Alendronato OH (CH2)3NH2 1000 Risedronato OH CH2-pyridine 1000 Ibandronato OH CH2CH2N(CH3) 1000 Zoledronato OH CH2-imidazole 10000+
Capitolo 3
Farmacologia dei bifosfonati
Sulla base della loro struttura chimica i bifosfonati sono stati classificati in 2 gruppi maggiori con differente meccanismo di azione:
• gli amino-bifosfonati, contenenti un gruppo amminico –NH2 nella catena laterale lunga R2
• i non amino-bifosfonati, molecole di prima generazione, non contenenti gruppi amminici.
Gli amino-bifosfonati, più potenti, agiscono sulla via del mevalonato, inibendo l’enzima farnesil-pirofosfato sintetasi; su tale base i bifosfonati (fig. 3.1):
• Riducono la biosintesi di geranil-geranil difosfato, utile per la prenilazione di proteine GTP-dipendenti, coinvolte nel mantenimento del ciclo cellulare; le modificazioni biochimico-funzionali e morfologiche che ne conseguono comportano per gli osteoclasti l’impossibilità di formare vescicole e di organizzare il ruffled border (orletto a spazzola) e, come effetto finale, una morte cellulare programmata (apoptosi) più rapida.
• Riducono la biosintesi del colesterolo, fondamentale per la formazione di nuove membrane e per la proliferazione cellulare.
Fig 3.1Illustrazione del meccanismo d’azione degli amino-bifosfonati.
I derivati non aminici vengono invece metabolizzati all’interno degli osteoclasti e dalla loro linea cellulare di origine (monociti-macrofagi) in analoghi non idrolizzabili dell’ATP con conseguente effetto citotossico e lisi cellulare (fig. 3.2).
L’azione biologica fondamentale di tutti i bifosfonati è quindi l’inibizione del riassorbimento con conseguente riduzione del rinnovamento del tessuto osseo, e abbassamento dei livelli sierici di calcio. L’azione osteoclastica e anti-riassorbimento è sostenuta dall’effetto di inibizione sugli osteoclasti, dei quali i bifosfonati provocano la morte cellulare. Dopo somministrazione endovenosa di pamidronato o zoledronato, o dopo la somministrazione orale di uno dei bifosfonati orali caratterizzati da minore tossicità, il farmaco si lega rapidamente ai cristalli minerali di tutto il tessuto osseo. Dopo dosi ripetute il farmaco si accumula nella matrice ossea. Durante il normale rimodellamento osseo gli osteoclasti riassorbono il tessuto osseo mineralizzato e il bifosfonato viene introdotto nella cellula; l’effetto del farmaco è analogo a quello dei lipidi difosfati isoprenoidi. Questi lipidi isoprenoidi sono essenziali per la farnesilazione e la geranilgeranilazione degli enzimi della
guanosina trifosfato (GTPasi), che hanno funzione preventiva rispetto all’apoptosi degli osteoclasti. (Luckman et al., 1998) Questa via biosintetica è anche nota come “via secondaria del mevalonato”. Microscopicamente si può osservare che gli osteoclasti perdono il loro tipico orletto nelle sedi di riassorbimento delle lacune di Howship, si retraggono dalla superficie ossea e vanno incontro a necrosi. Senza il riassorbimento osseo e il concomitante rilascio di proteine induttrici dell’osteogenesi, quali la proteina morfogenica ossea (BMP) e i fattori di crescita insulino-simili 1 e 2 (ILG1 e ILG2), l’osso preesistente non viene rimosso e non viene formata nuova sostanza osteoide. Il vecchio osso, quindi, rimane presente ben oltre il suo ricambio programmato. Dal momento che l’osteocita non è una cellula immortale, anch’esso andrà incontro a necrosi lasciando presente osso non vitale. La funzione dell’osteocita non è la neoformazione ossea (che è invece funzione dell’osteoblasta), ma piuttosto è quella di agire come un meccano-recettore per il mantenimento della matrice minerale dell’osso esistente. Pertanto, se l’osteocita non provvede al controllo del normale rimodellamento osseo, si verifica una sovraproduzione di ulteriore matrice mineralizzata. Questa ipermineralizzazione viene osservata in associazione alla tossicità indotta da bifosfonati come sclerosi della lamina dura seguita da una più generalizzata osteosclerosi dell’osso alveolare. (Marx et al., 2002.b; Gorlin et al., 1990)
Fig 3.2 Schema del diverso meccanismo d’azione sugli osteoclasti da parte dei non amino-bifosfonati e degli amino-bifosfonati
3.1 Effetti sul tessuto osseo
3.1.1 Meccanismo d’azione cellulare e tissutale
In passato è stato ipotizzato che l’effetto inibitore sul riassorbimento osseo da parte dei bifosfonati fosse correlato esclusivamente alle loro proprietà chimico-fisiche. L’ipotesi più accreditata sosteneva che l’etidronato, il primo dei bisfosfonati ad essere studiato ampiamente in vivo, legandosi alla superficie dei cristalli di idrossiapatite dell’osso ne determinasse la resistenza alla dissoluzione chimica ed enzimatica. Studi successivi su composti più potenti hanno smentito questa ipotesi.
Le dosi di bisfosfonati capaci di determinare l’inibizione del riassorbimento osseo in vivo possono essere milioni di volte inferiori rispetto a quelle necessarie per bloccare, sia in vitro che in vivo, la dissoluzione dei cristalli di idrossiapatite. Si ritiene pertanto che l’azione chimico-fisica dei bifosfonati non contribuisca in maniera significativa alla loro capacità di bloccare l’attività degli osteoclasti sul riassorbimento osseo. Attualmente i meccanismi d’azione dei bisfosfonati non sono completamente noti, anche se, sin dai primi studi, è apparso evidente che il principale bersaglio cellulare di questi composti è rappresentato dall’osteoclasta. Si tratta di una cellula multinucleata, derivante dalla linea monocito-macrofagica, che svolge un ruolo di primaria importanza nei processi di rimaneggiamento osseo e dell’omeostasi fosfo-calcica, in quanto deputata al disfacimento dei cristalli di idrossiapatite e al riassorbimento della matrice organica. E’ stato ampiamente dimostrato che i bisfosfonati agiscono sugli osteoclasti, determinandone alterazioni morfologiche e funzionali, rappresentate dalla perdita dell’orletto a spazzola e dei vacuoli citoplasmatici, che sono tipici della fase attiva di riassorbimento osseo, (Jung et al., 1976; Flanagan et al., 1989) dalla riduzione della produzione di acido lattico, della sintesi di enzimi lisosomiali e di prostaglandine, di
pirofosfatasi e della fosfatasi acida, fondamentali per l’attività fagocitaria dell’osteoclasta.
Non è chiaro se i bisfosfonati agiscano direttamente o indirettamente tramite cellule che regolano il reclutamento e l’attività degli osteoclasti.
3.1.2 Inibizione dell’attività degli osteoclasti maturi
Sono stati ipotizzati vari meccanismi d’azione capaci di spiegare l’effetto inibitore dei bisfosfonati sull’osteoclasta.
L’inibizione diretta dei bifosfonati sull’attività degli osteoclasti è suggerita dalla scomparsa dell’orletto a spazzola (ruffler border), una struttura che è presente nelle cellule in fase di attività. L’alendronato induce in vitro alterazioni morfologiche e funzionali degli osteoclasti, che perdono la capacità di estrudere protoni (probabilmente tramite il blocco di una pompa protonica ATP-dipendente) e di acidificare il mezzo circostante, condizione essenziale per la dissoluzione dei cristalli di idrossiapatite e quindi per la funzione di riassorbimento osseo. Per alcuni bifosfonati è necessaria l’internalizzazione del farmaco nella cellula. Per esempio è stato dimostrato che il tiludronato distrugge la struttura ad anello di actina, e che per tale azione è necessaria la captazione intracellulare del farmaco (che avviene per mezzo di un meccanismo di transcitosi). In cellule osteclastiche alterate, che sono prive della capacità di fagocitare, il contatto con bisfosfonati non altera l’anello di actina. (Murakami et al., 1995)
3.1.3 Induzione dei processi di apoptosi negli osteoclasti
L’apoptosi è un meccanismo fisiologico di morte degli osteoclasti, la cui durata di vita è di 2-4 settimane in vivo e 2 settimane circa in vitro. Si tratta di un meccanismo di
morte cellulare programmata, differenziabile dalla necrosi cellulare per alcune specifiche caratteristiche morfologiche e biochimiche, quali la condensazione di cromatina, la frammentazione nucleare e la segmentazione internucleosomiale endonucleasi-mediata del DNA.
Segni evidenti di apoptosi sono stati osservati in cellule murine simil-macrofagiche (J774 e RAW264) dopo trattamento con aminobifosfonati (pamidronato, alendronato e ibandronato) (Makkonen et al., 1996); il clodronato si è rivelato meno potente, mentre l’etidronato sembra non indurre apoptosi. Questo suggerisce un differente meccanismo d’azione tra amino e non-amino bisfosfonati.
Fig 3.2 Meccanismo d’azione dei bifosfonati a livello degli osteoclasti.
3.1.4 Inibizione del reclutamento e della formazione di nuovi osteoclasti
I bisfosfonati possono esplicare il loro effetto antiriassorbitivo agendo non solo sugli osteoclasti già maturi, ma anche sui precursori osteoclastici di origine midollare (fig. 3.3). Riguardo a questo possibile meccanismo d’azione esistono evidenze sperimentali,
sia in vivo che in vitro, alquanto controverse. In alcuni studi è stato osservato che il trattamento con bifosfonati stimola il reclutamento osteoclastico (Muchlbauer et al., 1991; Marshall et al., 1993). In numerosi modelli sperimentali, i bifosfonati inibiscono la formazione di osteoclasti da precursori midollari (Vitte et al., 1996; Chappard et al., 1989; Flanagan et al., 1991; Hughes et al., 1989; Murakami et al., 1988). L’importanza di queste osservazioni è sostenuta dal fatto che, dopo somministrazione endovenosa di bifosfonati in pazienti con ipercalcemia maligna, la captazione scheletrica del farmaco risulta completa entro 6 ore, ma l’effetto farmacologico massimo sul tessuto osseo si osserva solo dopo 2 giorni (Nussbaum et al., 1993). Questo tipo di cinetica dell’effetto si spiega con un’inibizione del reclutamento di nuovi osteoclasti, meccanismo che necessita di un tempo prolungato per determinare l’effetto biologico antiriassorbitivo. In diversi studi è stato dimostrato che l’inibizione del reclutamento di nuovi osteoclasti si osserva solo in presenza di osteoblasti (Makkonen et al., 1996; Takahashi et al., 1988; Nishikawa et al., 1966; Sahni et al., 1993), suggerendo l’ipotesi che le cellule bersaglio principali dei bifosfonati possano essere proprio gli osteoblasti (Vitte et al., 1994).
3.1.5 Effetti sugli osteoblasti
Una mole crescente di dati sperimentali sostiene l’ipotesi che la cellula bersaglio principale dei bifosfonati sia l’osteoblasta, e che sia questa popolazione cellulare a mediare gli effetti dei bifosfonati sugli osteoclasti. I bifosfonati influenzano il metabolismo osteoblastico (Khokher et al., 1989; Klein et al., 1998; Garcìa Moreno et al., 1998; Giuliani et al., 1998 a; Plotkin et al., 1999), anche se con effetti variabili e a volte contrastanti, a seconda del tipo di farmaco utilizzato e dei modelli sperimentali impiegati. Questi farmaci inibiscono la proliferazione degli osteoblasti (Khokher et al., 1989) e riducono la secrezione osteoblastica di vari fattori solubili (Vitte et al., 1996; Ohya et al., 1985; Stronski et al., 1988), alcuni dei quali capaci di regolare sia l’osteoclastogenesi che l’attività osteoclastica (Vitte et al., 1996; Sahni et al., 1993), come per esempio IL-6, una citochina con attività osteoclasto-genica e pro-infiammatoria (Giuliani et al., 1998 b). E’ stato osservato che alcuni bifosfonati (pamidronato e zoledronato) inibiscono anche la proliferazione di altri sistemi cellulari, quali linfociti, macrofagi, cellule mielomatose e cellule derivanti da carcinoma polmonare. Tuttavia i bifosfonati stimolano la sintesi proteica totale, la secrezione di collagene di tipo I e l’attività della fosfatasi alcalina negli osteoblasti.
Queste osservazioni suggeriscono un’azione favorevole sulla differenziazione osteoblastica, con passaggio dallo stadio proliferativo a quello maturativo, tipico della fase di deposizione della matrice (Lian et al., 1999). Anche l’etidronato inibisce in vitro la proliferazione osteoblastica. Tuttavia l’effetto dell’etidronato richiede concentrazioni più elevate rispetto a pamidronato e zoledronato, probabilmente a causa di un differente meccanismo d’azione. Infatti l’etidronato agisce chelando gli ioni bivalenti nel mezzo di coltura, mentre pamidronato e zoledronato attivano altri meccanismi che coinvolgono direttamente il metabolismo cellulare (Reinholz et al., 2000).
Alcuni bifosfonati stimolano la proliferazione di cellule progenitrici osteoblastiche di derivazione midollare (Klein et al., 1998) ed inibiscono l’apoptosi di osteociti ed osteoblasti (Plotkin et al., 1999). Questi effetti contrastanti sulla proliferazione cellulare possono essere spiegati dalle differenze chimico-strutturali dei vari bifosfonati utilizzati, dalle differenti concentrazioni utilizzate, dalla durata del trattamento e dai differenti tipi cellulari su cui vengono valutati gli effetti. Nonostante vi sia una chiara evidenza in vitro degli effetti che i bifosfonati esercitano sulla cellula osteoblastica, la loro reale importanza in vivo è ancora incerta. Infatti non è ben chiaro quale dei due meccanismi (quello diretto, sugli osteoclasti, e quello indiretto, sugli osteoblasti) sia attivo in vivo o, se presenti entrambi, quale dei due sia prevalente (Reinholz et al., 2000).
3.1.6 Meccanismi d’azione molecolare
Alcuni studi hanno chiarito la modalità con cui i bifosfonati agiscono a livello molecolare. In particolare sono stati individuati due distinti meccanismi d’azione a livello intracellulare, che sembrano dipendere dalle caratteristiche chimiche dei composti esaminati.
Il clodronato, l’etidronato ed altri bifosfonati, che hanno una struttura chimica più simile al pirofosfato e che non contengono nella catena laterale R2 un residuo azotato, vengono incorporati in analoghi tossici dell’ATP, non idrolizzabili e quindi metabolicamente inutilizzabili. L’enzima chiave che determina l’incorporazione dei bifosfonati in nucleotidi non utilizzabili (tramite la sostituzione di un gruppo pirofosforico) è un’aminoaciltransferasi della classe IIC. L’effetto finale di tale sostituzione è, da una parte, l’accumulo intracellulare di analoghi dell’ATP non utilizzabili, dall’altra il depauperamento dei depositi di ATP e l’inibizione della sintesi
proteica e di altre reazioni ATP dipendenti, con conseguente morte cellulare. I bifosfonati che agiscono con questo meccanismo hanno catene laterali R1 ed R2 corte (ad eccezione del tiludronato) e presentano un’attività anti-osteoclastica relativamente minore rispetto ad altri composti (Russel et al., 1999).
I bifosfonati con attività riassorbitiva più potente sono quelli contenenti un gruppo amminico nella catena laterale R2 (come l’alendronato), che non sono metabolizzati dalla aminoaciltransferasi a causa della conformazione sterica della stessa catena laterale, che essendo più grande rispetto al sito attivo dell’enzima ne impedisce il legame. Di conseguenza questi composti mostrano un meccanismo molecolare d’azione diverso. Da studi preliminari era già emerso che i bifosfonati aminici potessero inibire una o più tappe della catena metabolica che porta alla sintesi del colesterolo ed in seguito è stato dimostrato che effettivamente i bifosfonati contenenti gruppi amminici interferiscono con il metabolismo del mevalonato, un composto intermedio della catena biosintetica del colesterolo, che viene trasformato in lipidi isoprenoidi (isopentenilpirofosfato, farnesilpirofosfato, geranilgeranilpirofosfato). Questi lipidi sono essenziali per le modificazioni post-trasduzionali, dette di prenilazione, di alcune proteine, in particolare delle GTP binding protein (GTPasi) tra cui Ras, Rho e Rac (Russel et al., 1999; Rogers et al., 1999). Le GTPasi sono importanti proteine di segnale che regolano una grande varietà di processi cellulari, fondamentali per la funzione degli osteoclasti, la cui modificazione post-traduzionale è essenziale per la loro localizzazione nelle membrane cellulari e, in definitiva, per la loro funzione biologica (Zallone et al., 1999; Marshall, 1993; Zhang et al., 1996). Pertanto l’inibizione della prenilazione causa marcate modificazioni della morfologia cellulare e altera i processi di proliferazione e di trasduzione dei segnali, inducendo come effetto finale la morte cellulare per apoptosi.
3.2 Farmacocinetica
Tutti i bifosfonati vengono somministrati per via orale, tranne pamidronato e zoledronato che sono utilizzati per infusione endovenosa.
La biodisponibilità orale dei bifosfonati è molto variabile a seconda del composto. In condizioni ideali l’assorbimento, che risente molto dell’assunzione contemporanea di cibo (in particolare di alimenti contenenti calcio) è di circa l’1-10% della dose somministrata ed avviene nell’intestino tenue.
L’emivita plasmatica dei bifosfonati per via orale e per via endovenosa varia da 30 minuti a due ore, riflettendo la rapida captazione nella matrice ossea, dove il farmaco si accumula nella misura del 30-70% della dose somministrata endovena o assorbita dopo assunzione orale. L’allontanamento dalla matrice richiede un periodo di mesi o anni. La frazione restante viene escreta in forma immodificata nelle urine.
Le dosi somministrate ripetutamente si accumulano nella matrice ossea e possono venire rimosse tramite riassorbimento mediato dagli osteoclasti, come parte del turnover osseo.
Dal momento che i bifosfonati sono tossici per gli osteoclasti e ostacolano il turnover osseo, rappresentano un esempio interessante di condizione biologica senza via d’uscita: indipendentemente da ciò che succede, il risultato è comunque negativo. Infatti l’accumulo dei bifosfonati nell’osso, in particolare nelle ossa mascellari, non è reversibile a causa del loro effetto tossico sugli osteoclasti, che aumenta ad ogni dose somministrata. Pertanto, la tossicità ossea dei bifosfonati dipende sia dalla dose somministrata che dalla durata della terapia.
Nella tabella 3.1 vengono elencate le indicazioni terapeutiche primarie, la eventuale presenza di azoto, le dosi consigliate e le vie di somministrazione dei diversi bifosfonati.
Tab 3.1 Indicazione terapeutica primaria, presenza di azoto, dose consigliata e via di somministrazione dei bifosfonati Bifosfonato Indicazione terapeutica primaria Presenza di azoto Dose consigliata Via di somministrazione Etidronato (Didronel) Malattia di Paget No 300-750 mg/dì per 6 mesi Orale Tiludronato (Skelid) Malattia di Paget No 400 mg al dì per 3 mesi Orale Alendronato (Fosamax) Osteoporosi Sì 10 mg/ al dì; 70 mg/ alla settimana Orale Residronato (Actonel) Osteoporosi Sì 5mg/ al dì; 35 mg/ alla settimana Orale Ibandronato (Boniva) Osteoporosi Sì 2,5 mg/ al dì; 150 mg/ al mese Orale Pamidronato (Aredia)
Metastasi ossee Sì 90 mg/ 3 alla
settimana
Intravenosa
Zoledronato (Zometa)
Metastasi ossee Sì 4 mg/ 3 alla
settimana
Intravenosa
I bifosfonati si legano di preferenza alla superficie ossea nei siti di rimodellamento attivo e vengono incorporati negli osteoclasti. I bifosfonati non azotati, come il clodronato e l’etidronato, mostrano buona tollerabilità ed inibiscono il riassorbimento osseo generando un analogo tossico dell’adenosin-trifosfato che interferisce con le funzioni mitocondriali e induce l’apoptosi degli osteoclasti. Gli aminobifosfonati, alendronato, risedronato, ibandronato, pamidronato e zoledronato, inibiscono la
farnesil-difosfato sintetasi, l’enzima responsabile della prenilazione delle proteine coinvolte nell’attività osteoclastica. Di conseguenza il reclutamento e la differenziazione dei precursori degli osteoclasti risultano inibiti, l’adesione degli osteoclasti all’osso è limitata e le unità di rimodellamento osseo vengono diminuite. L’apoptosi degli osteoclasti deriva principalmente dal mancato riassorbimento osseo.
3.3 Effetti avversi e interazioni
In seguito alla somministrazione di aminobifosfonati si possono manifestare effetti collaterali, rappresentati da rialzo transitorio della temperatura corporea, mialgie e cefalea, associate o meno ad alcune modificazioni bioumorali (aumento degli indici di flogosi, riduzione della conta leucocitaria, linfocitopenia) (Thiebaud et al., 1997; Harinck et al., 1987; Wuster et al., 1993; Gallacher et al., 1989; Fenton et al., 1991; Schweitzer et al., 1995; Sauty et al., 1996) che possono essere considerati espressione di una reazione di fase acuta, che si manifesta solo dopo la prima somministrazione. Questa reazione è dose-dipendente, insorge nelle 10-12 ore seguenti alla somministrazione del farmaco, raggiunge il picco di intensità dopo 28-36 ore e scompare dopo 3-4 giorni nonostante il trattamento venga protratto (Adami et al., 1987). Essa inoltre non è legata al tipo e alla gravità della malattia ossea di base (Schweitzer et al., 1995), anche se la risposta dei soggetti sani può essere diversa rispetto ai pazienti con elevata attività osteoclastica (Cantrill et al., 1990). La reazione di fase acuta provocata degli amino-bifosfonati è probabilmente attribuibile ad un aumento temporaneo della produzione di IL-1, IL-6 e TNF-α nei monociti-macrofagi o negli osteoclasti (Adami et al., 1987; Pioli et al., 1990). Tuttavia i risultati degli studi in vitro e in vivo sono ampiamente discordanti. Studi in vivo hanno dimostrato che una singola somministrazione di pamidronato (60 mg) non modifica i livelli sierici di IL-1. Al contrario è stato osservato un incremento dei livelli di IL-1 e TNF-α indotti dal pamidronato e dal dimetilaminoidrossi-propilidene (Thiebaud et al., 1997; Schweitzer et al., 1995; Bijvoet et al., 1980).
Nessuna delle suddette reazioni è stata osservata in seguito a somministrazione di clodronato (Berenson et al., 1996), che al contrario sembrerebbe invece promuovere effetti opposti. E’ stato dimostrato (Endo et al., 1993) che gli amino-bifosfonati
potenziano l’attività della istidina-decarbossilasi, un enzima che catalizza la formazione dell’istamina, un potente mediatore della flogosi, e alcuni di questi composti possono stimolare l’attività di macrofagi e granulociti. La linfopenia che si può osservare in seguito alle infusioni endovenose di aminobifosfonati potrebbe essere la conseguenza di una disregolazione dell’espressione di molecole di adesione, con conseguente ridistribuzione dei linfociti ad alcuni distretti, come per esempio il piccolo intestino (Pietschmann et al., 1988).
I pricipali effetti avversi indotti dai bifosfonati sono rappresentati da diarrea, nausea, dolori addominali. Con alcuni aminobifosfonati, quali alendronato e residronato, sono stati osservati casi di infiammazione ed erosione dell’esofago. Per tale motivo è bene rimanere in posizione seduta od eretta per 30 minuti dopo l’assunzione e si sconsiglia l’uso di questi prodotti in persone con disturbi esofagei.
Un uso continuativo di etidronato può interferire con la normale mineralizzazione dell’osso. Questo fenomeno è assai contenuto con gli altri bifosfonati e si osserva solo in caso di dosaggi molto elevati.
L’ipocalcemia transitoria è un effetto secondario della terapia con bifosfonati: infatti questi farmaci inibiscono il riassorbimento osseo mediato dagli osteoclasti, riducendo così la concentrazione sierica di calcio. L’iperparatiroidismo compensatorio secondario evita l’instaurarsi di un’ipocalcemia significativa aumentando il riassorbimento renale di calcio, la produzione di 1,25-OH-vitamina D, e il riassorbimento osseo da parte degli osteoclasti. Tuttavia in alcuni casi (per es. paratiroidectomia, livelli bassi di vitamina D, ipoparatiroidismo ipomagnesico) questo meccanismo di compensazione può essere bloccato e possono quindi svilupparsi gravi ipocalcemie. (Nguyen et al., 2004; Rajesh et al., 2004). La mancanza di vitamina D subclinica colpisce una larga parte della popolazione anziana e la sua esistenza deve essere riconosciuta prima dell’inizio della
terapia con bifosfonati, in modo che adeguate somministrazioni di calcio e vitamina D possano favorire una riduzione degli episodi ipocalcemici.
L’uso di dosi elevate di bifosfonati di prima generazione, come etidronato (Bounameaux et al., 1983) o di aminobifosfonati come zoledronato (Chang et al., 2003), può essere associato ad insufficienza renale acuta. Due studi clinici di lunga durata, condotti su pazienti con cancro e ad elevato rischio di metastasi ossee, hanno rilevato la comparsa di un effetto tossico sul rene in corso di terapia con zoledronato, somministrato alla dose di 8 mg ogni tre settimane. Successivamente, la dose di farmaco impiegata nella terapia è stata ridotta a 4 mg, con conseguente aumento della tollerabilità renale. (Saad et al., 2002; Rosen et al., 2004) L’ibandronato presenta, invece, una minore tossicità renale e un profilo di sicurezza che accosta i risultati ottenuti dalla terapia a base di questo bifosfonato con quelli ottenuti dalla somministrazione del placebo in pazienti con metastasi ossee (Lyubimova et al., 2003). Un possibile evento avverso associato all’assunzione cronica di bifosfonati è l’osteonecrosi della mandibola (incidenza da 0,8 al 12%), complicanza che verrà ampiamente discussa più avanti in questa tesi. (Ruggiero et al. 2004; Migliorati et al., 2005)
Prima di iniziare il trattamento con bifosfonati in pazienti con fattori di rischio concomitanti (cancro, chemioterapia, radioterapia, corticosteroidi, scarsa igiene orale) deve essere presa in considerazione la necessità di un esame odontoiatrico completo, seguito dall’attuazione di appropriate procedure dentistiche preventive.
Per questa classe di farmaci sono state descritte, seppur raramente, reazioni avverse oculari, anche gravi. Inizialmente si riteneva che questi effetti avversi fossero imputabili solo agli amino-bifosfonati come alendronato, pamidronato e risedronato. Tuttavia sono stati descritti anche con clodronato, etidronato, zoledronato e tiludronato. (Bisphosphonates and ocular inflammation. 2004). Il rischio sembra più elevato in caso
di somministrazione endovenosa (pamidronato, zoledronato). Gli effetti avversi oculari comprendono congiuntiviti, uveiti, iriti, scleriti/episcleriti, emorragie, neurite ottica, difetti del campo visivo, scotoma, glaucoma, cecità e degenerazione maculare, con un periodo di comparsa molto variabile: generalmente questi eventi avversi compaiono entro 3 settimane dopo l’inizio della terapia ma, in alcuni casi, si sono manifestati anche più precocemente (entro 2 giorni) mentre in altri dopo molto tempo (3 anni o più di trattamento). (Bisphosphonates and ocular disorders, 2003; Mbekeani, 1999)
A volte (es. sclerite) la risoluzione della patologia infiammatoria richiede la sospensione del trattamento, mentre le forme infiammatorie meno gravi tendono a risolversi spontaneamente, pur proseguendo l’assunzione del farmaco. (Bisphosphonates, 33rd edition)
In caso di uso dei bifosfonati per via endovenosa si possono verificare effetti avversi in meno del 2% dei casi: infiammazione sistemica (spesso autolimitante) simil-influenzale (febbre, mialgia, artralgia, dolore scheletrico), insufficienza renale, sindrome nefrotica (dovute spesso ad un’infusione troppo rapida), alterazioni elettrolitiche (soprattutto ipocalcemia).
I bifosfonati sono controindicati in corso di gravidanza ed allattamento, anomalie esofagee o dello svuotamento gastrico, insufficienza renale, presenza di ipocalcemia. L’assunzione di antiacidi, di sali di calcio o di ferro in concomitanza con l’assunzione di bifosfonati può limitarne l’assorbimento.
L’associazione con gli antibiotici aminoglicosidici può aumentare il rischio di ipocalcemia e di nefrotossicità. L’uso di indometacina può aumentare la biodisponibilità dell’acido tiludronico.
Capitolo 4
Applicazioni terapeutiche dei bifosfonati
4.1 Osteoporosi
L’osteoporosi è una malattia che si manifesta principalmente sopra i 45 anni di età. Insorge sia negli uomini che nelle donne, ma è più frequente e più grave nelle donne dopo la menopausa, probabilmente per l’effetto della perdita degli effetti degli estrogeni sulla differenziazione delle cellule staminali. E’ utile ricordare che anche nell’uomo si producono estrogeni, sebbene non a livelli così elevati da evidenziare un declino correlato all’età così significativo come si osserva nelle donne dopo la menopausa.
Fig 4.1 Differenza tra un osso normale e un osso osteoporotico
La conseguenza dell’osteoporosi consiste nell’aumento del midollo fibroso e adiposo a spese della densità di osso trabecolare. L’osso diviene progressivamente più poroso con la diminuzione di spessore delle trabecole e la perdita delle interconnessioni tra esse (fig. 4.1). L’effetto clinico è rappresentato dalla perdita della resistenza compressiva
che provoca la diminuzione dell’altezza corporea per compressione vertebrale e l’aumento del rischio di sviluppare fratture in seguito a traumi minori o spontaneamente. Queste fratture guariscono lentamente o possono non guarire. Il meccanismo fisiopatologico principale dell’osteoporosi non riguarda il metabolismo del calcio, ma il ricambio e il rinnovamento del tessuto osseo (fig. 4.1). Questo spiega perché in studi controllati è stato evidenziato che non vi sono benefici a lungo termine con la supplementazione di calcio per la correzione della densità minerale ossea (BMD) e la prevenzione delle complicanze (Marx et al., 2003 a). Lo stesso meccanismo sostiene inoltre il razionale per l’uso dei bifosfonati nella terapia dell’osteoporosi.
Fig 4.2 Processo fisiologico di un normale osso rapportato con quello di un osso osteoporotico
Il test per la valutazione dell’entità dell’osteopenia e dell’osteoporosi più ampiamente utilizzato è la densitometria a raggi X a doppia energia (DEXA) che permette di calcolare i valori di BMD. Quasi tutti i grandi studi clinici hanno adottato questo tipo di misurazione come standard per determinare l’efficacia dei bifosfonati o di terapie alternative. Il test viene anche utilizzato nei grossi studi epidemiologici per valutare il rischio di sviluppare fratture del bacino o delle vertebre e, in ambito clinico, per la diagnosi dell’osteopenia e dell’osteoporosi. Il valore standard di riferimento, noto come
densità ossea di picco, è specifico per il genere e la razza ed è basato sui valori riscontrati nei giovani adulti all’età di 20-24 anni.
La diagnosi di osteopenia e di osteoporosi viene posta arbitrariamente quando si osserva una certa velocità di decremento del picco di BMD. I valori specifici di BMD in mg/cm² per razza e genere vengono tabulati e resi graficamente come una classica curva gaussiana.
Fig 4.3 Grafico che rappresenta la distribuzione della densità minerale ossea e il suo declino con l’età
Il BMD misura solo ciò che la definizione del termine indica: la massa ossea mineralizzata; pertanto questo parametro non misura né le interconnessioni tra le trabecole ossee, né la resistenza alle fratture, che è funzione dell’elasticità dell’osso e della quantità di interconnessioni nell’osso trasecolare (fig. 4.3). Dal momento che l’efficacia dei bifosfonati per via orale viene valutata in base alla capacità di stabilizzare o migliorare i valori di BMD, essi risultano di efficacia limitata. E’ necessario ricordare che i bifosfonati non inducono la neoformazione ossea: essi al contrario inibiscono la formazione di nuovo osso. Il loro meccanismo d’azione consiste nella preservazione e nel rafforzamento dell’osso esistente aumentando la sua mineralizzazione e da questo consegue il miglioramento dei valori di BMD. Il BMD è in effetti un parametro piuttosto grossolano per valutare la presenza di osteopenia e di osteoporosi.
La tabella 4.1 indica le terapie a base di bifosfonati approvate dal Food and Drug Administration per la cura dell’osteoporosi.
E’ stato stimato che nel 2005 più di 14 milioni di donne negli Stati Uniti siano state trattate per osteoporosi con un bifosfonato orale. Un’ampia serie di studi sostiene l’efficacia della terapia orale con bifosfonati per il trattamento dell’osteoporosi (Marx et al., 2003 b; Tonino et al., 2001). Per esempio, uno studio sull’impiego di alendronato per più di 10 anni ha evidenziato l’aumento dei valori di BMD e la diminuita incidenza di fratture vertebrali durante i primi tre anni di terapia (Black et al., 2000). Nel sottogruppo di pazienti in terapia protratta con alendronato seguiti per 10 anni è stato evidenziato un ulteriore aumento dei valori di BMD. Il dato non costituisce una sorpresa, dal momento che ora sappiamo che l’effetto dell’assunzione a lungo termine dei bifosfonati è cumulativo e che l’osteonecrosi dei mascellari si manifesta dopo più di 3 anni di terapia per via orale.
Di maggior interesse è l’analisi del sottogruppo di pazienti che ha interrotto la terapia con alendronato dopo 3 anni; questi pazienti hanno evidenziato una diminuzione molto graduale dei valori di BMD senza significativi aumenti nell’incidenza di patologie correlate all’osteoporosi, sottolineando la lunga emivita di tutti i bifosfonati e suggerendo che verosimilmente la somministrazione continuata di questi farmaci non è necessaria per il controllo dell’osteoporosi.
4.2 Metastasi ossee
La maggior parte dei tumori maligni non è in grado di determinare autonomamente il riassorbimento del tessuto osseo. Essi sono, però, in grado di reclutare gli osteoclasti per svolgere questo compito. Recenti studi hanno dimostrato che i tessuti maligni possono reclutare i precursori degli osteoclasti del midollo osseo e stimolarli al riassorbimento dell’osso nel quale poi il tumore può proliferare. La secrezione propria di RANKL e altri fattori stimolanti gli osteoclasti è un meccanismo locale con cui le cellule tumorali maligne inducono il riassorbimento osseo (fig. 4.4). L’osteoclasta non è in grado di riconoscere che la sua attivazione è frutto di un processo patologico e non fisiologico. La costante secrezione di citochine osteoattive da parte del tessuto tumorale stimola gli osteoclasti al riassorbimento di quantità significative di osso in cui poi le metastasi del cancro possono svilupparsi. Questo riassorbimento indotto prevale su tutti i tentativi di neoformazione ossea e conseguentemente aumenta la massa tumorale con perdita dell’integrità ossea, grave dolore osseo, fratture patologiche ed eventuale decesso del paziente.
Il tumore maligno può provocare anche una sindrome paraneoplastica e agire con meccanismo sistemico attraverso la secrezione di un peptide paratormone-correlato che induce riassorbimento osseo. Questo fenomeno è più comune nel cancro polmonare a piccole cellule e meno frequentemente è associato ai carcinomi squamo-cellulari orofaringei.
Nella maggior parte dei casi le sindromi paraneoplastiche provocano riassorbimento osseo diffuso nello scheletro con conseguente ipercalcemia; a differenza delle localizzazioni metastatiche, tuttavia, si sviluppano cavità di riassorbimento focali solo nei casi molto gravi.
La strategia che è stata sviluppata per inibire l’attivazione degli osteoclasti che rispondono a questi messaggi chimici è molto valida. Infatti pamidronato e zoledronato sono in grado di diminuire la popolazione degli osteoclasti in modo che sia ridotto il numero di quelli disponibili per rispondere ai segnali di attivazione. Dal momento che non si sviluppano cavità di riassorbimento, il tumore viene confinato e limitato nel suo accrescimento. (Berenson et al., 1996; Hortobagyi et al., 1996; Berenson et al., 2001) I vantaggi terapeutici conferiti dai bifosfonati in questo contesto superano il rischio di osteonecrosi dei mascellari. Attualmente i pazienti con mieloma multiplo, metastasi da cancro della mammella, metastasi da cancro della prostata e altri tipi di cancro traggono notevoli benefici dal trattamento con pamidronato e zoledronato. Tuttavia l’appropriatezza della dose, la frequenza di somministrazione e la dose totale cumulabile sono tuttora oggetto di studio. Attualmente si raccomanda di non infondere più di 60 mg/ora di pamidronato (1 mg/min).
La dose raccomandata di zoledronato nella prevenzione di eventi correlati all’apparato scheletrico in pazienti affetti da tumori maligni allo stadio avanzato che interessano l’osso è invece di 4 mg come soluzione per infusione ricostituita e diluita ulteriormente con 100 ml di soluzione salina allo 0,9% o soluzione glucosata al 5%, somministrata
per infusione endovenosa in almeno 15 minuti ogni 3 o 4 settimane. Ai pazienti deve essere somministrato anche un supplemento di 500 mg/die di calcio per via orale e 400 UI/die di vitamina D. (Flitch et al., 2009)
4.3 Ipercalcemia neoplastica
Sebbene molti tipi di tumore possano provocare ipercalcemia, quelli che più frequentemente inducono questa manifestazione sono il carcinoma polmonare a piccole cellule, il mieloma multiplo, il carcinoma della prostata e, più raramente, il carcinoma squamocellulare orale e faringeo. Non è infrequente per i pazienti affetti da questi tumori avere livelli di calcio serici che raggiungono valori tra 14 e 18 mg/dl (i valori normali sono compresi tra 8,7 e 11 mg/dl nell’uomo e tra 8,4 e 10,5 mg/dl nella donna). I sintomi dell’ipercalcemia comprendono confusione mentale, letargia, dolore osseo profondo, costipazione, dolori addominali e talvolta morte per arresto cardiaco (Marx et al., 2003 a). I tumori maligni possono provocare l’ipercalcemia con due meccanismi principali. Il primo, che non necessita la presenza di metastasi, è costituito dalla secrezione in circolo di un peptide analogo al paratormone da parte del tessuto del tumore primitivo. Questo peptide mima l’attività biologica dell’ormone paratiroideo fisiologico e quindi aumenta l’assorbimento di calcio nell’intestino tenue, diminuisce l’escrezione renale del calcio e aumenta significativamente il riassorbimento osseo per il rilascio in circolo di ioni calcio (fig. 4.6). Dei tre effetti, che conducono all’aumento della calcemia, il più pronunciato è senza dubbio l’aumento dei fenomeni di riassorbimento osseo osteoclastico. Questo meccanismo di tipo simil-endocrino è quello che provoca l’ipercalcemia in presenza di tumori polmonari a piccole cellule e tumori orofaringei.
Il secondo meccanismo ipercalcemizzante si realizza attraverso la secrezione di proteine simili al RANKL che stimolano il riassorbimento osseo osteoclastico nei siti metastatici (fig. 4.7). L’effetto globale del riassorbimento osseo in molteplici sedi porta alla liberazione in circolo di una quantità significativa di calcio ionizzato. Con questo meccanismo si produce l’ipercalcemia associata al mieloma multiplo, al cancro metastatico della mammella, al cancro della prostata e ad altri tumori; in questo caso l’effetto è di tipo simil-paracrino.
Fig 4.7 Disegno del secondo meccanismo con cui un tumore maligno può portare a ipercalcemia.
Poiché il comune denominatore nei due meccanismi descritti è il riassorbimento osteoclastico, i farmaci con azione antiosteoclastica correggono rapidamente l’ipercalcemia. Una dose di 4 mg di zoledronato provoca il ritorno dei livelli di calcemia tra 8,5 e 9,5 mg/dl entro 24 ore. Questa marcata inversione dell’ipercalcemia con normalizzazione dei sintomi correlati entro breve tempo testimonia il rapido effetto di inibizione degli osteoclasti indotto dai bifosfonati per via endovenosa e conferma la dipendenza dei normali livelli di calcemia dai fenomeni di riassorbimento della matrice ossea mineralizzata. Dal momento che sono sufficienti solo una o due dosi per la normalizzazione della calcemia, questa modalità d’uso dei bifosfonati non ha provocato la comparsa di osteonecrosi dei mascellari. (Flitch et al., 2009)