VALUTAZIONE E GESTIONE DELLE INNOVAZIONI
NEL SETTORE BIOMEDICALE”
XIX CICLO 2004 - 2006
< VALUTAZIONE ECONOMICA E
TECNOLOGIE IN SANITA’ >
Presidente del corso di dottorato:
Candidata:
Prof.
Andrea
Pietrabissa
Barbara
Labella
Relatore:
Prof. Giuseppe Turchetti
1. Introduzione ... 4
1.1 Inquadramento scientifico del lavoro... 5
1.2 Obiettivi della ricerca ... 5
1.3 Sommario ... 7
2. Lo stato dell’arte di riferimento ... 9
2.1 Il razionale della valutazione economica in sanità... 9
2.2 Stato dell’arte delle tecniche di valutazione economica ... 11
2.3 Stato dell’arte dell’Health Technology Assessment ... 20
2.3.1 Tecnologie biomediche e innovazione ... 20
2.3.2 Origine e evoluzione dell’HTA ... 26
2.3.3 I principali progetti finanziati dalla Commissione Europea; gli organismi nazionali e internazionali operanti nell’ambito dell’HTA ... 32
2.4 La situazione italiana... 38
3 Un esempio di protocollo di valutazione delle tecnologie biomediche e un data base di fonti informative... 42
4. Alcuni limiti delle metodologie di valutazione economica in sanità... 46
5. Il caso di una tecnologia di frontiera con forti implicazioni di carattere bioetico: la chirurgia fetale ... 51
5.1 Un quadro generale degli aspetti clinici e tecnologici della chirurgia fetale ... 51
5.2. Una chiave di lettura diversa del progresso della chirurgia fetale ... 57
5.3 Il prezzo dell’aborto ... 59
5.4 I numeri dell’aborto... 63
5.5 Alcune promettenti linee di ricerca sulla chirurgia fetale ... 65
5.6 Una possibile roadmap per la chirurgia fetale... 68
6. Il caso di una tecnologia innovativa per la diagnostica e il trattamento pediatrico .... 70
6.1 L’Hirschprung desease... 70
6.2 Tecnologie innovative per la diagnosi e il trattamento dell’Hirschprung desease ... 72
6.3 Alcune considerazioni economiche... 75
7. Metodi progettuali e accettabilità a confronto: il caso dei progetti MIAS e PICO .... 79
8. I concetti di rischio e incertezza e la risposta regolatoria: il principio di precauzione per le tecnologie biomediche... 86
8.1 Rischio e incertezza nella letteratura economica. Il caso delle tecnologie biomediche... 86
8.2 Il principio di precauzione e i sistemi sanitari ... 88
9. Proposte e conclusioni ... 92
9.1 Un approccio precauzionale alle tecnologie biomediche: l’Early Health Technology Assessment ... 92
9.2 L’approccio globale: l’esempio di EndoCAS ... 97
9.3 Integrazione tra sistemi gestionali complementari: l’HTA e il Risk Management... 104
9.5 Conclusioni ... 113
Pubblicazioni della candidata ... 115
Bibliografia ... 116
APPENDICE I: Cenni sulla regolamentazione europea delle tecnologie mediche... 126
APPENDICE II: Data base e fonti informative HTA... 132
1. Introduzione
Il settore delle tecnologie biomediche rappresenta una componente di importanza fondamentale nella gestione e nella promozione della salute e la sua importanza è destinata a crescere ulteriormente nei prossimi anni a fronte del rapido progredire della ricerca scientifica in bioingegneria e la conseguente applicazione all’innovazione in sanità per la comprensione dei diversi processi patologici e la definizione di nuovi metodi e strumenti di diagnosi e terapia.
Il significato e il valore attribuiti alle tecnologie biomediche, pertanto, sono oggetto di un profondo processo di revisione. Accanto ai più tradizionali criteri di efficacia e di tollerabilità, infatti, si è resa necessaria l’introduzione di nuovi parametri di utilità e di convenienza economica, di etica, di accettabilità e di sicurezza che di fatto modificano e in qualche modo arricchiscono il significato tipicamente attribuito alle pratiche diagnostiche e alle terapie chirurgiche e mediche. La razionalizzazione delle risorse disponibili per la spesa sanitaria, in uno scenario di spesa in costante crescita, impone che le decisioni di politica sanitaria siano“informate” e “consapevoli” circa le implicazioni cliniche, economiche, legali e organizzative inerenti l’adozione delle tecnologie sanitarie.
L’Health Technology Assessment e le tecniche di valutazione economica forniscono metodi e strumenti a supporto dei decision makers in ambito sanitario e tuttavia: a) il loro utilizzo non è ancora sufficientemente diffuso e consolidato e la situazione italiana manifesta particolari ritardi in tal senso; b) nei suddetti strumenti sono ravvisabili alcuni limiti che rendono dubbia l’applicabilità degli stessi a tecnologie sanitarie di frontiera o con forti implicazioni etiche e sociali o in fasi molto precoci del loro processo di sviluppo; c) ancora embrionale risulta lo loro integrazione con altri strumenti gestionali che si ritengono complementari.
Il presente lavoro intende apportare un contributo al dibattito in merito al ruolo della valutazione economica delle tecnologie sanitarie da un lato e dei limiti della stessa dall’altro, proponendo una prospettiva di analisi globale, un approccio “precoce” alla valutazione dell’innovazione nel settore biomedicale e delineando le competenze dei profili professionali a ciò preposti.
1.1 Inquadramento scientifico del lavoro
Il lavoro di ricerca svolto nel corso di dottorato in “Tecnologie della salute:
valutazione e gestione delle innovazioni nel settore biomedicale” si inserisce nel
settore scientifico di economia e gestione delle imprese, con particolare riferimento al settore sanitario, con collegamenti alle discipline di bioingegneria e medicina.
La ricerca si inquadra nel filone del Health Technology Assessment, delle metodologie di valutazione economica o efficiency evaluation (Drummond, O’Brien, Stoddart and Torrance, 1997) e delle tecnologie biomediche.
La possibilità offerta dal dottorato sperimentale in “Tecnologie della salute: valutazione e gestione delle innovazioni nel settore biomedicale” di sfruttare le sinergie derivanti da competenze fortemente interdisciplinari (bioingegneri, medici, economisti) ha permesso di affrontare sin dall’inizio la materia oggetto dello studio con un approccio multidisciplinare e ha consentito di approfondire l’analisi su alcuni casi di tecnologie sanitarie di frontiera di particolare interesse ai fini del conseguimento degli obiettivi del presente lavoro.
Il Centro di Eccellenza EndoCas, i laboratori INSAT (Innovazione nei sistemi
aziendali e territoriali), CRIM (Center for Applied Research in Micro and Nano Engineering), ARTS (Advanced Robotics Technology and Systems Laboratory) e il
centro E-TX-MAN (European Transplantation Management Centre) della Scuola Superiore Sant'Anna e il Laboratorio di Robotica Biomedica dell’Università Campus Biomedico di Roma, hanno costituito la fonte prima dei dati e delle informazioni contenute nello studio e la sede fisica in cui l’attività di ricerca è stata condotta.
1.2 Obiettivi della ricerca
L’obiettivo generale della ricerca è la verifica dell’applicabilità tout court delle tecniche di valutazione economica e più in generale dei metodi di HTA, a tutte le tecnologie biomediche, ivi compresi i casi estremi e di frontiera. Il quesito a cui si è inteso trovare una risposta è il seguente: i metodi consolidati di valutazione delle tecnologie biomediche sono sufficientemente generali da poter essere applicati a tutte
grado di maturità e di sviluppo, dalla loro tipologia, dal livello di rischio ad esse associato e dalle considerazioni di ordine bioetico che esse comportano?
Il raggiungimento di tale obiettivo è stato perseguito mediante lo svolgimento delle seguenti principali attività:
a) analisi dello stato dell’arte delle tecniche di valutazione economica e dell’HTA, a livello internazionale e nazionale;
b) studio di alcuni casi di tecnologie biomediche di frontiera,
c) analisi del rischio tecnologico associato all’uso delle nuove tecnologie quale fattore limitante/abilitante per lo sviluppo e l’introduzione nella pratica clinica di nuove tecnologie biomediche.
Più in generale il presente lavoro mira a approfondire le tematiche di valutazione economica applicata alle tecnologie biomediche in risposta a esigenze provenienti dalla ricerca scientifica-tecnologica universitaria e industriale, dagli operatori sanitari, dai policy maker e da quanti altri sono a diverso titolo interessati al settore biomedicale.
La ricerca nel campo delle tecnologie biomediche: si avverte l’esigenza di criteri e/o parametri di riferimento che, al momento del raggiungimento delle fasi applicative, orientino le decisioni circa la prosecuzione o l’ abbandono del processo di progettazione e sviluppo di nuove tecnologie; sovente, infatti, si è giunti alla prototipazione di tecnologie risultate, ad una analisi tardiva, non competitive nella loro dimensione di costo-efficacia o della usabilità o eccessivamente rischiose. Ciò risulta tanto più vero se riferito ad apparecchiature biomediche, dispositivi, impianti e relativi software piuttosto che a farmaci e sostanze medicali per i quali i metodi di valutazione economica sono pressoché consolidati.
L’exploitation dei risultati della ricerca: in seguito al recente sviluppo di nuovi modelli di organizzazione e gestione delle attività di ricerca universitaria ha assunto rilevanza, sempre crescente, lo sfruttamento industriale dei risultati della ricerca, di particolare interesse per il settore tecnologico. Presupposto essenziale al
trasferimento tecnologico e a eventuali piani di sfruttamento industriale delle tecnologie è l’analisi economica delle stesse, preliminarmente intesa quale valutazione dei benefici e dell’efficacia incrementali in riferimento agli standard tecnologici del settore.
Le decisioni in ambito di politiche sanitarie locali e nazionali: l’introduzione di nuove tecnologie nei processi di cura e di erogazione di prestazioni sanitarie è finora avvenuta in maniera considerevole tuttavia associata alla convinzione che l’assorbimento delle risorse destinate alla spesa sanitaria - peraltro sempre più limitate -, che l’acquisizione e la gestione di tali tecnologie comporta, sia eccessivo rispetto ai benefici che esse apportano a livello socio economico.
E’ opportuno in questa fase sottolineare che, da una indagine effettuata su sette paesi europei è risultato che su 69 studi di valutazione economica realizzati in tali paesi, solo nel 22% dei casi essi hanno inciso sui processi decisionali e sulle politiche a livello locale e nazionale (Drummond et al. 1992). Studi più recenti attribuiscono il limitato utilizzo dei risultati delle analisi di valutazione economica da parte dei decisori politici alla crescente complessità dei modelli di rappresentazione sviluppati (Drummond et al, 2003) (Hoffman et al, 2000).
I temi della valutazione economica in riferimento alle tecnologie biomediche si ritengono, pertanto, non completamente maturi e di notevole interesse per ulteriori approfondimenti.
1.3 Sommario
Il lavoro è così organizzato: nel capitolo successivo viene presentato la stato dell’arte di riferimento per l’Health Technology Assessment e per la valutazione economica nel settore sanitario; nel terzo capitolo è proposto un protocollo di valutazione delle tecnologie sanitarie, fondato sui metodi consolidati in letteratura e su una raccolta di fonti informative web based; il quarto capitolo contiene alcune riflessioni critiche circa le problematiche riscontrate nell’applicazione dei metodi HTA a settori tecnologici innovativi e controversi: la chirurgia fetale, l’endoscopia per la diagnostica e il trattamento pediatrico, la progettazione di strumentazioni
capitoli cinque, sei e sette. L’ottavo capitolo approfondisce i concetti di rischio e incertezza e analizza l’impatto del principio normativo della precauzione sul settore sanitario e delle tecnologie biomediche. Il nono capitolo è dedicato ad alcune proposte, metodologiche e operative, avanzate con l’obiettivo di superare le criticità riscontrate nelle tecniche HTA e che si ritiene ne limitino l’applicabilità diffusa.
2. Lo stato dell’arte di riferimento
2.1 Il razionale della valutazione economica in sanità
Il momento storico attuale è caratterizzato da una progressiva riduzione delle risorse disponibili per gli investimenti in sanità pubblica, fenomeno riconducibile ad una più generale razionalizzazione della spesa sanitaria e che conduce ad una - auspicata - ottimizzazione dei costi associati all’erogazione delle prestazioni sanitarie.
Nel 2003 i Paesi OCSE hanno consumato in media l'8,8% del PIL in spese mediche, con un incremento del 7,1% dal 1990 e del 5% dal 1970. La porzione di PIL allocata nel 2003 alla spesa sanitaria varia considerevolmente tra i Paesi, partendo dal 15% degli Stati Uniti per arrivare a meno del 6% nella Repubblica Slovacca e la Corea. Dopo gli Stati Uniti nel 2003 figurano la Svizzera e la Germania con, rispettivamente, una spesa del 11,5% e 11,1% del PIL (OCSE, 2005)
L'incremento della spesa sanitaria deriva da diversi fattori; il progresso che la medicina ha ottenuto nella prevenzione, diagnosi e cura dello stato di salute rappresenta certamente uno dei principali fattori di incrementi dei costi per la sanità. Anche l'invecchiamento della popolazione contribuisce all’aumento delle spese sanitarie. La percentuale della popolazione con più di 65 anni è aumentata in tutti i Paesi OCSE e continuerà a crescere nei prossimi decenni, soprattutto in funzione dell’invecchiamento della generazione del "baby-boom" (che raggiungerà i 65 anni nel 2010 e oltre). Poiché una popolazione più anziana tende a consumare più prestazioni sanitarie, l’invecchiamento continuerà a sospingere verso l’alto la spesa sanitaria pubblica.
L’ultimo decennio, dal punto di vista delle spesa pubblica per la sanità nei Paesi OCSE, può essere diviso in due periodi. Il periodo 1992-1997 ha visto una crescita economica uguale o maggiore rispetto alla crescita della spesa sanitaria pubblica. Tuttavia, negli ultimi anni la spesa pubblica per la sanità è aumentata in tutti Paesi OCSE più velocemente rispetto alla crescita economica. In alcuni Paesi, quali Regno Unito e Canada, recenti incrementi nella spesa sanitaria pubblica risultano funzionali ad una scelta deliberata nel tentativo di diminuire la pressione della domanda di
salute derivante dalle politiche di contenimento dei costi attuate durante i primi anni ’90.
Negli ultimi anni l'incremento delle spesa per medicinali (in media oltre 5% l’anno dal 1997) ha rappresentato un volano chiave per l’aumento della spesa sanitaria complessiva. Infatti, la maggior parte dei Paesi OCSE ha sperimentato un incremento della spesa farmaceutica superiore all'aumento della spesa sanitaria. Negli Stati Uniti e in Australia la spesa farmaceutica è lievitata con una velocità pari a più del doppio della crescita delle spese sanitarie totali. Simili incrementi sono stati riscontrati anche in Irlanda e in Corea, sebbene a partire da una base pro-capite iniziale relativamente più bassa nello stesso periodo. La percentuale d’incremento è stata molto più contenuta in Giappone.
In media, nei Paesi OCSE il 60% della spesa farmaceutica è assorbita da fondi pubblici, il rimanente dai cittadini e, in misura minore, da assicurazioni private. Tuttavia, questa media nasconde delle varianze molto ampie, da un minimo del 11% in Messico e del 21% negli Stati Uniti ad un massimo del 86% in Irlanda. Una delle ragioni di queste oscillazioni dipende dalle modalità con cui i farmaci sono eventualmente garantiti nell’ambito di programmi sanitari nazionali e da assicurazioni sanitarie pubbliche.
Nel 2003, la spesa farmaceutica pro-capite più elevata si è registrata negli Stati Uniti (oltre 700 USD ad personam), seguiti dalla Francia (poco più di 600 USD), Canada e Italia (più o meno 500 USD). Le spese pro-capite più basse- circa 100 USD- riguardano invece il Messico e la Turchia. Le variazioni nella spesa farmaceutica tra i Paesi riflettono eterogeneità nei volumi, nelle modalità di consumo e nei livelli di prezzo; le differenze di livello retributivo fra Paesi incidono altresì sulla spesa farmaceutica .
Al fenomeno della progressiva crescita della spesa sanitaria che conduce al perseguimento di obiettivi di razionalizzazione si associa un progressivo aumento degli stakeholder della sanità e delle tecnologie sanitarie in particolare.
L’introduzione di tecnologie innovative nell’ambito dei percorsi di cura infatti viene spesso indicata come uno degli elementi che contribuiscono ad accrescere, anziché contenere, i costi sanitari a fronte di benefici certi ma raramente o mai esattamente quantificati. Ciò ha portato ad un ampliamento dell’insieme dei soggetti
interessati all’impatto delle tecnologie biomediche principalmente sui costi finali a carico della sanità; non più solo i produttori delle tecnologie biomediche (industria) e gli utilizzatori (medici/ospedali) ma anche pazienti, finanziatori, governi locali e centrali chiedono sempre più insistentemente informazioni concrete e ben fondate a sostegno delle decisioni inerenti le tecnologie: proseguire o interrompere il processo di sviluppo; immetterle sul mercato; acquistarle o noleggiarle?
2.2 Stato dell’arte delle tecniche di valutazione economica
La valutazione economica può sinteticamente definirsi come l’analisi comparativa di procedure alternative effettuata in base ai loro costi e alle loro conseguenze (“thecomparative analysis of alternative courses of action in termsof
both their costs and consequences”; Drummond et al.,1987).
L’obiettivo principale delle valutazione economica in sanità è garantire l’efficienza nell’allocazione delle risorse tramite il confronto tra i costi e i benefici risultanti da programmi sanitari alternativi così da assicurare che i benefici risultanti dai programmi sanitari sviluppati siano maggiori dei costi opportunità degli stessi – se non si investe nel programma sanitario X qual è il migliore investimento alternativo per quel denaro? Ossia, a quale benefici si rinuncia investendo nel programma sanitario X?
In tal senso la valutazione economica può essere intesa come il fondamento delle decisioni di politica sanitaria che pressoché sempre devono far fronte alla scarsità di risorse e ai conseguenti costi opportunità.
I decisori politici del settore sanitario sono chiamati a prendere decisioni circa l’allocazione delle risorse di cui dispongono tra una ampia gamma di interventi tra di loro spesso molto differenti. Ciò comporta inevitabili e complessi giudizi di valore in merito ad alcune linee sanitarie su cui investire. La valutazione economica mira a rendere più “informate” tali decisioni relative all’allocazione delle risorse disponibili per la spesa sanitaria
L’esigenza di introdurre elementi di valutazione economica nel settore sanitario è la principale conseguenza dell’imperfezione del mercato sanitario stesso che
manifesta i seguenti principali fallimenti (in riferimento alla teoria neoclassica e all’ipotesi di concorrenza perfetta):
• il paziente sperimenta una sostanziale carenza di informazioni (asimmetria informativa)
• i medici sono chiamati a prendere delle decisioni in posizione di “agente”per il paziente (rapporto di agenzia tra medico e paziente: sul mercato delle prestazioni sanitarie la domanda è mediata da un medico in grado di stabilire quali sono le reali necessità del paziente e quali possono essere i rimedi per ripristinare il suo stato di salute);
• il soggetto “pagante” è un terzo differente dai due principali attori sopra identificati.
Esiste vasta letteratura in tema di valutazione economica in sanità, soprattutto per quanto attiene casi applicativi di analisi Cost-Effectiveness, Cost-Utility, Cost-Benefit: Si citano a tale proposito alcune recenti pubblicazioni che, nell’ambito della Chirurgia Minimamente Invasiva propongono studi di valutazione economica basati sulla letteratura edita (studi di review) o su dati originali (clinical trials).
Clinical and cost-effectiveness of new and emerging technologies for early localised prostate cancer: a systematic review
S. Hummel, S. Paisley, A. Morgan, E. Currie, N. Brewer, Health Technology Assessment 2003; Vol 7: No.33
Objectives
This report is a review of the clinical and cost effectiveness of new and emerging technologies for early, localised prostate cancer. A systematic review was undertaken to identify new and emerging technologies and to evaluate clinical and cost effectiveness through assessment of the best available evidence. The review aimed to assess clinical effectiveness in terms of survival, disease-free survival, quality of life (QoL), including complications and adverse events and acceptability.
Of the new treatments included in the analyses, only cryotherapy appeared potentially not to be cost-effective compared with traditional treatments, owing to the associated high incidence of impotence.
Lo studio si propone di valutare alcune tecnologie innovative per il trattamento del cancro alla prostata. L’analisi effettuata con il metodo costo-efficacia sulla base delle evidenze cliniche presenti in letteratura,
Cost effectiveness analysis of laparoscopic hysterectomy compared with standard hysterectomy: results from a randomised trial
Mark Sculpher, Andrea Manca, Jason Abbott, Jayne Fountain, Su Mason, Ray Garry, British Medical Journal 2006
Objective To assess the cost effectiveness of laparoscopic hysterectomy compared with conventional hysterectomy (abdominal or vaginal).
Design Cost effectiveness analysis based on two parallel trials: laparoscopic (n = 324) compared with vaginal hysterectomy (n = 163); and laparoscopic (n = 573) compared with abdominal hysterectomy (n = 286).
Participants 1346 women requiring a hysterectomy for reasons other than malignancy. Main outcome measure One year costs estimated from NHS perspective. Health outcomes expressed in terms of QALYs based on women’s responses to the EQ-5D at baseline and at three points during up to 52 weeks’ follow up.
Results Laparoscopic hysterectomy cost an average of £401 ($708; €571) more (95% confidence interval £271 to £542) than vaginal hysterectomy but produced little difference in mean QALYs (0.0015, − 0.015 to 0.018). Mean differences in cost and QALYs generated an incremental cost per QALY gained of £267 333 ($471 789; €380 437)
Laparoscopic hysterectomy cost an average of £186 ($328; €265) more than abdominal hysterectomy, there was little difference in mean QALYs (0.007, − 0.008 to 0.023).
Conclusions Laparoscopic hysterectomy is not cost effective relative to vaginal hysterectomy. Its cost effectiveness relative to the abdominal procedure is finely balance
L’obiettivo dello studio consiste nella valutazione di tecniche alternative per l’intervento di isterectomia. La tecnica tradizionale (open) è comparata con la tecnica laparascopica tramite l’analisi cost- effectiveness e i dati sono raccolti attraverso trial clinici.
Cost comparison for laparoscopic nephrectomy and open nephrectomy: analysis of individual parameters
Yair Lotan, Matthew T. Gettman, Claus G. Roehrborn, Margaret S. Pearle, And Jeffrey A. Cadeddu, Urology 2002; 59 (6)
Objectives. To identify the cost components of laparoscopic nephrectomy (LN) that could be targeted to reduce the cost of the procedure. LN is typically more costly than open nephrectomy (ON) because of longer operative times and the use of disposable equipment. Methods. We compared the overall cost and individual cost centers for uncomplicated LN (n _ 11) and ON (n _ 8) at a large metropolitan county hospital. A model was created using the DATA program (TreeAge software, version 3.5) to compare the costs of treatment with either ON or LN. We conducted a series of one-way sensitivity analyses to evaluate the effect of varying individual probabilities and costs. Two-way sensitivity analyses were performed to evaluate the costs of ON and LN while varying the hospital length of stay, operative time, and cost of laparoscopic equipment.
Results. LN was less costly overall than ON by $1211 (P _ 0.037), despite significant differences favoring ON in overall operating room costs and operating room supply costs. The cost superiority of LN was a consequence of statistically significant differences in the cost of hospitalization, including room and board, that favored the laparoscopic group. One-way sensitivity analyses showed that LN was less costly if (a) the operative time of LN was less than 281 minutes; (b) the length of hospitalization after LN was less than 5.8 days; (c) the operating room costs for LN were less than $3439; (d) the laparoscopic equipment costs were less than $2129; (e) the ON time exceeded 78 minutes; (f) the length of hospitalization for ON was more than 3.6 days; or (g) the operating room costs for ON were greater than $1333.
Conclusions. The sensitivity analyses enable individual surgeons and institutions to determine the cost impact of ON and LN, given their unique clinical scenarios. At our institution, key cost centers in determining cost effectiveness include length of operating time, hospitalization, and cost of laparoscopic instrumentation for ON and LN. LN is cost effective compared with ON if short operating times and brief length of stays are achieved.
Lo studio si propone di valutare i costi di un intervento di nefrectomia realizzato con la tecnica tradizionale (open) e con la tecnica laparoscopica tramite raccolta di dati originali provenienti direttamente dall’organizzazione sanitaria in cui gli interventi vengono realizzati.
Si ritiene opportuno citare i principali lavori di introduzione alla valutazione economica in sanità che vengono ancora oggi considerati e utilizzati quali veri e propri manuali:
Drummond MF, Stoddart GL, Torrance GW. Methods for the economic
evaluation of health care programmes. Oxford, England: Oxford University Press;
1987
Luce B., Elixhauser A., (1990) Standards for socioeconomic evaluation for
healthcare products and services, Springer;
Kamlet M.,S., (1992) The comparative benefits modeling project: a framework for cost-utility analysis of government health care program, US Department of Health and Human Service, Public Health Service;
Gold M., R., Siegel J., E., Russel L., B., Weinstein M.C., (1996) Cost-effectiveness in health and medicine, Oxford University Press;
Di seguito si propone una panoramica sintetica delle principali tecniche di valutazione economica utilizzate in sanità.
Esistono cinque principali e ormai consolidati approcci alla valutazione economica in sanità e che comparano due o più strategie, programmi, trattamenti e tecniche di cui alcuni si limitano a mettere a confronto i costi, altri unicamente l’efficacia costituendo pertanto approcci cosiddetti parziali; altri invece, definiti approcci completi (full) prendono in considerazione sia i costi che i risultati delle soluzioni alternative.
1. l’analisi Cost-of-Illness 2. l’analisi Cost-Minimization 3. l’analisi Cost-Effectiveness
4. l’analisi Cost-Utility
5. l’analisi Cost-Benefit
1. Analisi Cost-of-Illness (COI)
L’analisi Cost-of-Illness (letteralmente “costo della malattia”) è stata la prima tecnica di valutazione economica introdotta in sanità con l’obiettivo di “misurare” in termini economici il costo totale che la società è chiamata a sostenere per una determinata patologia e per eventuali trattamenti alternativi. La COI costituisce un metodo descrittivo e qualitativo che mira a identificare le seguenti categorie di costo associate alla patologia e ai trattamenti oggetto dello studio:
• costi diretti: si riferiscono ai costi sostenuti direttamente dal sistema sanitario, dalla comunità e dalla famiglia in relazione alla patologia/trattamento; costituiscono esempi di costi diretti i costi per la degenza ospedaliera e per le visite ambulatoriali, i farmaci e gli ausili;
• costi indiretti: tale categoria include i costi non propriamente sanitari conseguenti alla patologia/trattamento, quali ad esempio la perdita di produttività (assenza prolungata dal lavoro, prepensionamento) dell’individuo malato e dei suoi familiari;
• costi intangibili: si riferiscono principalmente al dolore, allo stress e agli effetti psicologici della patologia/trattamento e al deterioramento della qualità della vita.
Il limite principale della tecnica Cost-of-Illness, oltre alla già menzionata prospettiva parziale è la mancanza di elementi quantitativi; essa si configura come una analisi meramente descrittiva che non permette comparazioni tra soluzioni alternative.
2. Analisi Cost-Minimization (CMA)
Tale tecnica è utilizzata nell’ipotesi e nei casi in cui l’efficacia medica di due trattamenti alternativi sia identica sebbene i costi di essi differiscano. Unico elemento di analisi sono pertanto i costi e la soluzione individuata come migliore è quella risultante meno costosa. Si pensi a tale proposito al day surgery in alternativa a un ricovero con degenza prolungata per interventi di ernia, alla psicoterapia in alternativa agli psicofarmaci per la depressione, all’utilizzo di MRI in alternativa a strumentazioni a ultrasuoni.
Sebbene tale tecnica risulti sufficientemente semplice da utilizzare e interpretare, presenta il limite di fondarsi sull’ipotesi di risultati medici identici per soluzioni/trattamenti alternativi, condizione riscontrabile molto raramente in situazioni reali.
3. Analisi Cost Effectiveness (CEA)
L’analisi Cost Effectiveness risulta attualmente lo strumento economico maggiormente utilizzato nel settore sanitario e si pone l’obiettivo di rispondere alla seguente domanda: quale tra due programmi (o tecnologie) alternativi rappresenta il mezzo migliore per raggiungere un dato fine corrispondente a un determinato livello di recuperata salute? La CEA confronta i costi incrementali con i risultati medici incrementali di ciascuna alternativa, esprimendo i costi in termini monetari e gli effetti in unità naturali quali ad esempio gli anni di vita guadagnati nel caso di trapianti cardiaci, numero di attacchi cardiaci evitati per programmi anticolesterolemia, pressione sanguigna media, ecc.
L’analisi Cost Effectiveness viene principalmente impiegata qualora si necessiti di confrontare un nuovo programma/tecnologia con lo standard di riferimento e indirizza le decisioni in base al rapporto costo-efficacia risultante:
Terapia A Vs. Terapia B
Costo (B) - Costo (A) = ---
Se tale rapporto si rivela inferiore ad un prefissato valore la Terapia A risulta economicamente vantaggiosa.
La CEA presenta numerosi punti di forza: gli effetti vengono misurati in maniera oggettiva e sono agevolmente rilevabili o ricavabili dalla letteratura medica ed è di semplice utilizzo e comprensione per gli operatori sanitari. Alcuni limiti vanno tuttavia evidenziati e principalmente l’impossibilità di confrontare con questa tecnica interventi trasversali a diversi ambiti patologici oltre alla mancanza totale di considerazione del valore che i pazienti attribuiscono agli effetti dei trattamenti/soluzioni alternative.
4. Analisi Cost-Utility (CUA)
L’analisi Cost-Utility presenta significative analogie con l’analsi Cost
Effectiveness principalmente nella possibilità che essa fornisce di mettere a confronto
programmi/tecnologie per i quali sia i costi che gli effetti differiscono. La differenza sostanziale tra le due tecniche risiede nel fatto che nella CUA i risultati sono misurati in termini di “health-related utility” (soddisfazione o benessere) anziché in unità naturali pertanto i costi incrementali sono confrontati con i miglioramenti incrementali (in termini di salute) di un determinato programma/tecnologia dove i costi sono espressi in termini monetari e gli effetti in “Quality Adjusted Life Years” (QALY’s). QALYs rappresentano gli anni di vita successivi all’intervento sanitario ponderati con la qualità della vita che di cui il paziente ha goduto in quegli anni (Torrance and Feeny 1989).
Per la valutazione della qualità della vita nel QALY’s viene impiegata una scala compresa tra un minimo di 0.0 (morte) a un massimo di 1.0 (salute perfetta).
L’analisi Cost-Utility può essere quindi considerata come una tipologia specifica di analisi Cost-Effectiveness nell’ipotesi in cui le conseguenze (effectiveness) vengano espresse in QALY’s.
Sebbene la CUA consenta di confrontare programmi e tecnologie trasversali a diversi ambiti patologici e/o diversi interventi richiede che vengano valutate le preferenze del paziente che risultano di difficile interpretazione e misurazione.
L’analisi Cost-Benefit valuta programmi/tecnologie sanitarie nell’ottica del loro effetto di massimizzazione dei benefici partendo dalle risorse disponibili. Pertanto nella CBA i costi incrementali sono confrontati con i benefici – in termini di salute – incrementali, dove per benefici si intendono sia gli effetti che la willingness to pay (l’ammontare massimo che un individuo è disposto a pagare per una particolare terapia o per determinato effetto della stessa) che i risparmi in termini di assorbimento delle risorse. I costi e i benefici sono espressi in termini monetari e un programma/tecnologia risulta valutato positivamente in termini costo-beneficio qualora il beneficio netto risulti positivo:
– Costi > benefici – programma/tecnologia non vantaggiosa
– Costi < benefici – programma/tecnologia vantaggiosa
ossia se il rapporto BENEFICI/COSTI >1 conviene investire in quel programma/tecnologia
Sebbene il beneficio netto ricavabile tramite l’analisi Cost-Benfit risulti di agevole interpretazione esso non è generalmente accettato dai decisori in ambito sanitario principalmente per le implicazioni di ordine etico, il che rende questa tecnica scarsamente utilizzata.
La decisione in merito alla tecnica da utilizzare dipende essenzialmente dall’obiettivo dello studio e dall’importanza che per questo riveste la tipologia di risultati (o benefici) o dalla misurabilità degli stessi. Allo stato attuale l’approccio maggiormente utilizzato per gli studi di valutazione economica in sanità risulta l’analisi Cost-Effectiveness.
Tabella 1. Le principali tecniche di valutazione economica: rilevazione e valutazione di costi e conseguenze
Tipologia di analisi
Misura/ Valutazione dei costi per le soluzioni alternative Identificazione degli effetti/conseguenze Misura/ Valutazione degli effetti
Punti di forza Punti di
debolezza
Analisi
Cost-Minimization
in termini monetari sostanzialmente identici no – parte
dall’assunto che siano uguali
Semplicità di esecuzione Utilizzabile solo se gli effetti delle alternative sono identici
Analisi
Cost-Effectiveness
in termini monetari considera un solo effetto comune a entrambe la alternative; la differenza riguardo il grado di raggiungimento di esso
Unità naturali Comprensibile e di semplice utilizzo per gli operatori sanitari Non consente comparazioni tra interventi trasversali a diverse aree patologiche Analisi Cost-Benefit
in termini monetari considera effetti singoli o multipli non necessariamente comuni a entrambe le alternative (gli effetti comuni possono essere conseguiti a livelli differenti)
in termini monetari Buone fondamenta teoriche Poco accettata dai decisori in ambito sanitario ; la valutazione dei benefici risulta complessa Analisi Cost-Utility
in termini monetari considera effetti singoli o multipli non necessariamente comuni a entrambe le alternative (gli effetti comuni possono essere conseguiti a livelli differenti)
giorni guadagnati in salute o, più spesso Quality Adjusted Life Years
consente comparazioni tra interventi trasversali a diverse patologie; prende in considerazione la qualità della vita dei pazienti Richiede la valutazione delle preferenze dei pazienti; di difficile interpretazione
2.3 Stato dell’arte dell’Health Technology Assessment
2.3.1 Tecnologie biomediche e innovazione
Le tecnologie biomediche, e la ricerca applicata che presuppone il loro sviluppo, continuano ad acquisire crescente importanza sia in relazione al contributo apportato al processo di miglioramento dello stato di salute della popolazione che al loro impatto sulla spesa sanitaria globale.
Da un recente rapporto1 pubblicato dalla Commissione Europea risulta che il mercato europeo dei dispositivi medici è secondo, per dimensioni, a quello statunitense e precede il mercato giapponese.
Figura 1. Il mercato mondiale delle tecnologie mediche
Il mercato mondiale delle tecnologie mediche (Billion Euro ) USA; 79 Europa; 55,2 Altri; 29,8 Giappione; 20 Fonte dati: Eucomed.
In alcuni paesi la spesa pubblica per i dispositivi medici è già superiore a quella riferita ai prodotti farmaceutici.
Da una stima pubblicata da Eucomed2 nel 2003 risulta che l’industria europea delle tecnologie mediche, con l’esclusione del settore farmaceutico, è costituita da
1
Communication from the Commission to the Council and the European Parliament on medical
devices, 2003.
2
circa 8.500 entità legali, delle quali circa l’80% piccole e medie imprese, e da più di 386.000 addetti.
Il settore delle tecnologie biomediche si caratterizza, in quanto comparto fortemente knowledge based - risultato di un processo spontaneo di trasferimento di
know how dalle università e dai centri di ricerca - per la dinamicità e per l’elevato
tasso di innovazione (settore innovation driven).
L’innovazione nelle tecnologie sanitarie rappresenta, e il trend futuro sembra accentuare tale aspetto, la sintesi del progresso conseguito in numerosi campi delle scienze, dalla bioingegneria ai biomateriali, dalla genomica all’informatica e alle telecomunicazioni, e applicato alla prevenzione, alla diagnosi e al trattamento delle malattie. E’ sufficiente citare a tale proposito l’esempio della chirurgia assistita da calcolatore e tutte le discipline scientifiche coinvolte nel suo sviluppo – medicina, chirurgia, radiologia, micromeccanica, robotica, informatica, ottica – o l’esempio dei trapianti di cellule ed organi e il ruolo assunto dai progressi nel campo dell’ingegneria tissutale, della microingegneria e della farmacologia nella diffusione di essi.
L’analisi di alcuni principali indicatori3 del tasso di innovazione nel settore biomedicale, quali il numero di brevetti concessi dalle autorità competenti e gli investimenti effettuati in attività di ricerca e sviluppo, conferma la vivacità del settore e il trend positivo dell’innovazione in esso generata.
I brevetti a copertura di nuove invenzioni relative ai soli dispositivi medici rilasciati dall’autorità competente degli Stati Uniti, l’US Patent and Trademark
Office, sono più che raddoppiati nel periodo 1989-2003.
3Indicators of knowledge creation, TrendChart, Innovation Policy in Europe (The European
TrendChart on Innovation is an initiative of the European Commission, Enterprise & Industry Directorate General, Innovation Policy Development Unit).
2.1 Public R&D expenditures (% of GDP)/EUROSTAT (R&D statistics); OECD 2.2 Business expenditures on R&D (% of GDP)/EUROSTAT (R&D statistics); OECD 2.3.1 EPO high-tech patent applications (per million population)/EUROSTAT 2.3.2 USPTO high-tech patents granted (per million population)/EUROSTAT 2.4.1 EPO patent applications (per million population)/EUROSTAT
2.4.2 USPTO patents granted (per million population) / EUROSTAT
Figura 2. Brevetti relativi a dispositivi medici rilasciati negli Stati Uniti nel periodo 1989- 2003.
Numero brevetti per dispositivi medici rilasciati negli USA 4.178 4.500 4.737 5.554 6.010 7.943 8.196 9.091 0 1.000 2.000 3.000 4.000 5.000 6.000 7.000 8.000 9.000 10.000 1989 1991 1993 1995 1997 1999 2001 2003 Fonte: AdvaMed 2004.
La spesa in R&D relativa al settore dei dispositivi medici e intesa in termini percentuali delle vendite è passata, negli Stati Uniti, dal 5,4% del 1990 al 11,4% del 2002, con picchi del 12,9% e del 12,3% rispettivamente nel 1998 e nel 2001.
Figura 3. Spesa in attività di ricerca e sviluppo nel settore dei dispositivi medici.
Spesa in R&D settore dispositivi medici, USA 1990-2002 9,60% 11,10% 12,90% 10,10%10,90% 12,30% 11,40% 5,40% 5,50% 6,00%6,80% 7,20% 8,40% 0,00% 2,00% 4,00% 6,00% 8,00% 10,00% 12,00% 14,00% 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 percent delle vendite Fonte: AdvaMed 2004.
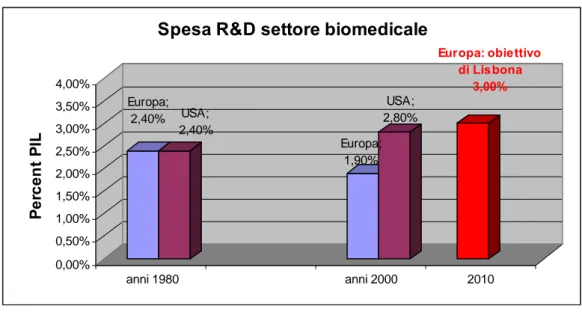
Nonostante il panorama europeo degli investimenti in ricerca e sviluppo in campo biomedico non si presenti, allo stato attuale, molto positivo soprattutto se paragonato agli Stati Uniti dove la spesa globale in ricerca biomedica, pubblica e privata, in termini di percentuale del PIL, è salita dal 2,4 al 2,8 negli ultimi venti anni (in Europa, nello stesso periodo, essa è calata dal 2,4 al 1,9%) la ricerca in ambito biomedico è ritenuta strategica sia dalla Commissione Europea, che ha allocato un budget di 2.525 milioni di euro per le attività di ricerca nell’ambito del Sesto Programma Quadro (2002-2006) nelle aree tematiche di life sciences, genomics and
biotechnology for health, che dallo stesso Piano Nazionale della Ricerca che ha
inserito, in Italia, la salute e le nuove applicazioni dell’industria biomedicale tra i dieci settori considerati strategici per il periodo 2005-2007. Nel Settimo Programma Quadro, recentemente lanciato dalla Commissione Europea per il periodo 2007-2013, sono stati allocati 6020 milioni di euro per l’obiettivo Health all’interno del Programma Cooperation.
Figura 4. Spesa globale in ricerca e sviluppo nel settore biomedicale
Europa; 2,40% USA; 2,40% Europa; 1,90% USA; 2,80% Europa: obiettivo di Lisbona 3,00% 0,00% 0,50% 1,00% 1,50% 2,00% 2,50% 3,00% 3,50% 4,00% Pe rc e n t PI L anni 1980 anni 2000 2010
Spesa R&D settore biomedicale
Fonte: AstraZeneca, 2004.
Peraltro, in tema di evoluzione tecnologica bisogna distinguere le innovazioni che, in quanto alle performance, hanno un impatto sostitutivo (andando a rimpiazzare corrispondenti tecnologie di generazione precedente e/o altri fattori produttivi),
identificate come disruptive innovation, dalle innovazioni che hanno un impatto
incrementale sui fattori (andando ad aggiungersi a quelli già impiegati in processi
produttivi preesistenti o consentendo nuovi processi e risultati).
L’innovazione è pertanto una caratteristica intrinseca e un driver fondamentale del settore delle tecnologie biomediche.
Innovazione si traduce in nuove tecnologie sanitarie introdotte nella pratica medica per le attività di prevenzione, diagnostica, terapia, screening e riabilitazione.
I vantaggi derivanti dal crescente utilizzo della tecnologia in ambito sanitario, in termini di outcome clinico e, quindi, di miglioramento del livello generale di salute sono fondati su evidenze scientifiche e pressoché universalmente riconosciuti.
A titolo di esempio si cita il tasso di mortalità per malattie cardiache che, negli Stati Uniti, si è ridotto, da circa 586,8/100.000 abitanti nel 1950 a 246,8/100.000 abitanti nel 2001 in seguito all’introduzione di progressive innovazioni nelle tecniche chirurgiche per il trattamento di patologie cardiache (AdvaMed, 2004).
Da uno studio pubblicato sul New England Journal of Medicine risulta che tra i pazienti colpiti da attacchi cardiaci con conseguente ridotta capacità di pumping, il rischio di morte si è ridotto del 31% per coloro che vengono trattati tramite impianto di defibrillatore rispetto ai pazienti trattati con terapie convenzionali (Moss AJ et al., 2002).
Gli interventi di colicistectomia praticati con tecniche minimamente invasive hanno ridotto la durata del ricovero ospedaliero a circa 2,6 giorni contro i 7,5 richiesti per gli interventi con tecnica tradizionale (open) (Cohen MM et al., 1996).
Diagnosi precoci, trattamenti meno invasivi, e conseguente riduzione del tempo di ospedalizzazione, maggiori tassi di sopravvivenza alle malattie, efficaci terapie riabilitative e rapido reinserimento nella vita sociale e produttiva, miglioramento della qualità della vita, costituiscono i principali benefici apportati dall’innovazione tecnologica in sanità.
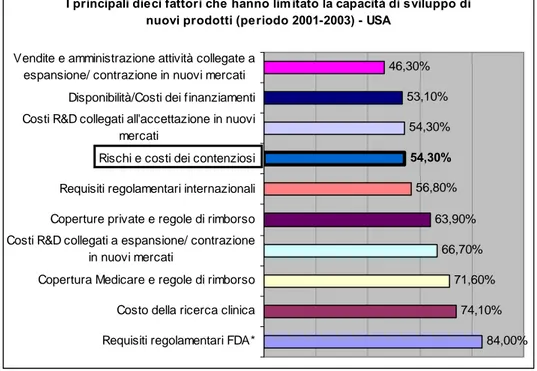
E tuttavia non bisogna omettere i numerosi casi di tecnologie mai introdotte sul mercato perché rivelatesi, in fase prototipale o in fasi di sviluppo più avanzate, “non convenienti” in una prospettiva di analisi di costo-efficacia o addirittura immesse nei
sistemi sanitari e successivamente abbandonate per i suddetti motivi (si pensi a titolo di esempio, al semplice caso dell’allattamento artificiale a lungo suggerito e preferito a quello materno (Grimes D.A., 1986) e rivelatosi poi, ad un esame comparato dei benefici e degli svantaggi, significativamente meno efficace4.; nè è opportuno trascurare alcuni effetti “collaterali” derivanti dal massiccio utilizzo della tecnologia nella pratica clinica5. In primo luogo l’impatto che la tecnologia, soprattutto se fortemente innovativa e ancora in fase sperimentale, può avere sul livello generale di rischio collegato all’attività di erogazione delle prestazioni sanitarie.
4
Tabella 1 Allattamento al seno versus allattamento artificiale.
Allattamento al seno materno Allattamento artificiale
Effetti nutrizionali
Perfetto equilibrio dei principi nutrizionali Non assimilato come il latte materno
Elevato livello di principi nutritivi Contenuto nutrizionale condizionato da corretta preparazione
Facilmente digeribile ed assimilabile Mal tollerato da alcuni neonati Le dosi variano con la crescita e il modificarsi
delle esigenze nutrizionali; il neonato decide le dosi
Il pediatra determina il dosaggio
Costi
Gratuito Variabile (circa € 34,00 al Kg in Italia)
Vantaggi
Sempre alla temperatura perfetta Il neonato può essere allattato da chiunque Non è richiesto tempo di preparazione
E’ disponibile in ogni momento e in ogni luogo
Svantaggi
E’ richiesta sempre la presenza della mamma Deve essere riscaldato
La madre potrebbe dover ricorrere al tiraggio Il tempo di preparazione è variabile Le prime poppate possono essere spiacevoli
Alcuni trattamenti farmacologici possono interromperlo
5
Una delle implicazioni più dibattute in letteratura economica della evoluzione della innovazione tecnologica in sanità è quella relativa all’impatto che l’avanzamento della conoscenza avrebbe sui costi della sanità. Il tema, molto studiato e caratterizzato da evidenze empiriche anche contrastanti,
2.3.2 Origine e evoluzione dell’HTA
L’Health Technology Assessment è un’area di ricerca multidisciplinare volta a rendere “informate” le decisioni di politica sanitaria (a livello istituzionale, delle singole organizzazioni sanitarie e della pratica clinica) tramite la valutazioni delle implicazioni cliniche, economiche, etiche, legali e organizzative inerenti l’adozione delle tecnologie sanitarie.
Le definizioni nel tempo attribuite all’Health Technology Assessment hanno seguito il percorso evolutivo della disciplina stessa:
“We shall use the term assessment of a medical technology to denote any process of examining and reporting properties of a medical technology used in health care, such as safety, efficacy, feasibility, and indications for use, cost, and cost-effectiveness, as well as social, economic, and ethical consequences, whether intended or unintended”
(Institute of Medicine 1985)
Technology assessment (TA) is a category of policy studies, intended to provide decision makers with information about the possible impacts and consequences of a new technology or a significant change in an old technology. It is concerned with both direct and indirect or secondary consequences, both benefits and disbenefits, and with mapping the uncertainties involved in any government or private use or transfer of a technology. TA provides decision makers with an ordered set of analyzed policy options, and an understanding of their implications for the economy, the environment, and the social, political, and legal processes and institutions of society
(Coates 1992)
Technology assessment is a form of policy research that examines short- and long-term social consequences (for example, societal, economic, ethical, legal) of the application of technology. The goal of technology assessment is to provide policy-makers with information on policy alternatives
Più recentemente l’HTA è stato definito come “a multidisciplinary field of policy
analysis. It studies the medical, social, ethical,and economic implications of development, diffusion, and use of health technology”
(International Network of Agencies for Health Technology Assessment 2002)
e come:
“Health technology assessment considers the effectiveness, appropriateness and
cost of technology. It does this by asking four fundamental questions: does the technology work, for whom, at what cost and how does it compare with alternatives?
(UK National Health Service R&D Health Technology Assessment Programme 2003)
L’esigenza di analizzare e valutare l’impatto delle tecnologie non è prerogativa dei nostri tempi ma ha iniziato a manifestarsi nel momento stesso in cui la tecnologia ha assunto un ruolo considerevole nella società e, insieme ad essa, hanno avuto manifestazione i primi effetti collaterali e/o indesiderati (fenomeno, quest’ultimo che ha interessato per primo in ordine cronologico il settore chimico).
L’origine del Technology Assessment può farsi risalire alla metà degli anni ’60 a seguito della necessità, manifestatasi in modo pressante, di valutare l’impatto degli impianti nucleari, degli aerei supersonici, degli impianti petroliferi, dei pesticidi, del cuore artificiale. Esso fu concepito come uno strumento finalizzato all’individuazione dei principali effetti “desiderati” della tecnologia e, soprattutto, degli effetti sociali, economici e ambientali indesiderati. (Brooks and Bowers 1970).
Le tecnologie biomediche sono state uno dei primi campi di applicazione del
Technology Assessment la cui nascita fu definitivamente sancita nel 1965 quando,
durante una assemblea della Commissione delle Scienze e dell’Astronautica della Camera dei Rappresentanti del Congresso degli Stati Uniti, Emilio Daddario, membro del Congresso, sottolineò l’importanza del Technology Assessment ai fini delle decisioni di politica economica e sociale:
“Technical information needed by policymaking is frequently not available, or not in the right form. A policymaker cannot judge the merits or consequencies of a technological program within a strictly technical context. He has to consider social,
economic, and legal implications of any course of action “ (U.S. Congress, House of
Representatives 1967).
Dopo aver commissionato studi indipendenti a numerosi centri di ricerca (National Academy of Sciences, National Accademy of Enigeering, e Legislative Reference Service of the Library of Congress), nel 1973 il Congresso degli Stati Uniti autorizzò l’istituzione di un apposito ufficio, l’OTA, Office of Technology
Assessment, che divenne operativo dal 1974.
Lo sviluppo del Technology Assessment quale attività di ricerca e di studio sistematico, è coinciso, negli anni ’60 e ’70, con l’introduzione di tecnologie sanitarie innovative e fortemente dibattute dagli operatori del settore e dall’opinione pubblica.
Le tecnologie biomediche oggetto di valutazione dei primi studi sperimentali sono state quelle che maggiormente hanno destato interesse e clamore per le loro implicazioni sociali, etiche, legali e politiche e quindi i farmaci contraccettivi, i trapianti di organi, gli organi artificiali, le terapie per i malati terminali e, più recentemente, i test e le terapie genetiche.
Nonostante l’approccio “globale” inizialmente assegnato alle attività di Health
Technology Assessment, nella pratica si è affermato l’utilizzo di valutazioni
“parziali” focalizzate su singoli aspetti interessati dall’introduzione di una specifica tecnologia sanitaria.
E’ necessario rilevare, preliminarmente alla presentazione degli obiettivi delle attività di HTA, che per tecnologie biomediche si intendono diverse e differenti categorie di prodotti sanitari:
– Farmaci: quali ad esempio aspirina, beta-bloccanti, antibiotici.
– Preparati biologici: quali vaccini, emoderivati, terapie cellulari e geniche.
– Dispositivi, attrezzature e presidi: es. pacemaker cardiaci, macchine per tomografia computerizzata, guanti chirurgici, kit per test diagnostici.
– Procedure mediche e chirurgiche: es. psicoterapia, angiografia coronarica, asportazione della cistifellea.
– Sistemi di supporto: es. sistemi elettronici di registrazione o monitoraggio del paziente, sistemi di telemedicina, prontuari farmaceutici, emoteche, altri software e data base.
– Sistemi organizzativi e gestionali: es. sistemi di finanziamento basati sui DRG (Diagnosis Related Group), Qualità Totale, sistemi di prenotazione delle prestazioni ambulatoriali, percorsi clinici.
Le tecnologie biomediche possono essere classificate, oltre che per la loro natura, in base alla funzione che esse svolgono nell’ambito dell’organizzazione delle attività sanitarie.
Prevenzione: in questa categoria rientrano le tecnologie sanitarie preposte a prevenire l’insorgere della patologia o ridurne il rischio di insorgenza o limitarne l’entità o i postumi;
Screening:la tecnologia è impiegata in questo caso per rilevare una patologia, un’anomalia o i fattori di rischio in fasi precoci e/o in individui asintomatici;
Diagnosi: è il caso delle tecnologie biomediche utilizzate al fine di identificare le cause, la natura e l’entità della patologia in individui presentanti sintomi clinici;
Trattamento: il fine dell’utilizzo della tecnologia è costituito dall’introduzione di terapie finalizzate a migliorare o a conservare lo stato di salute o ad evitare ulteriore deterioramenti o a attenuare i sintomi;
Riabilitazione: tecnologie impiegate per ristabilire, conservare o migliorare le funzionalità fisiche e mentali e il benessere di individui lesi e/o disabili; la riabilitazione può comunque farsi rientrare nella categoria funzionale dei trattamenti.
TECNOLOGIE BIOMEDICHE SCREENING PREVENZIONE DIAGNOSI TRATTAMENTO RIABILITAZIONE Farmaci Preparati biologici Sistemi Organizzativi e gestionali Sistemi di supporto Procedure Mediche e Chirurgiche Dispositivi, Attrezzature, Presidi N A T URA FU ZI O N I
Nell’affrontare l’analisi delle tecnologie sanitarie nella prospettiva del HTA i seguenti principali aspetti inerenti la tecnologia stessa devono essere considerati e valutati:
1. Caratteristiche tecniche
2. Sicurezza
3. Efficacia e/o efficienza
4. Impatto economico
5. Impatto sociale, legale, etico e/o politico.
Più in dettaglio:
1. Caratteristiche tecniche: tale elemento si riferisce alla performance della tecnologia e alla conformità con le specifiche per quel che attiene la progettazione, la produzione, la tolleranza (scarto consentito), l’affidabilità, la semplicità d’uso, la manutenzione.
2. Sicurezza: la valutazione della sicurezza esprime il giudizio in merito all’accettabilità del rischio (ossia alla misura della probabilità di un effetto avverso e/o indesiderato e della sua gravità) associato all’utilizzo della tecnologia in condizioni/situazioni date (contestualizzazione).. Si considera ad esempio il rischio associato all’utilizzo di una tecnologia per il trattamento
di un paziente con una particolare patologia da parte di un medico con una determinata formazione e/o in uno specifico ambiente sanitario.
3. Efficacia ed efficienza: entrambe si riferiscono al contributo apportato dalla tecnologia al miglioramento dello stato di salute del paziente, misurato sulla base dei cambiamenti risultanti finali (endpoint) di uno o più parametri pertinenti, tuttavia mentre l’efficacia si riferisce al beneficio derivante dall’utilizzo di una tecnologia biomedica per una particolare patologia in condizioni “ideali” (ad esempio nell’ambito del protocollo di una sperimentazione clinica controllata -randomized controlled trial), l’efficienza considera il beneficio derivante dall’utilizzo della tecnologia in condizioni normali e routinarie.
4. Impatto economico: la valutazione è focalizzata su costi, prezzi, oneri e livelli di pagamento associati alla singola tecnologia; frequenti sono le comparazioni tra diverse tecnologie (in genere lo standard di riferimento e l’innovazione) per una particolare applicazione clinica, in base all’assorbimento di risorse e risultati clinici (benefici); è questo il caso delle tecniche costo-efficacia, costo-utilità e costo beneficio descritte nel paragrafo precedente.
L’impatto economico viene considerato anche dal punto di vista macroeconomico e in questo caso le politiche di protezione della proprietà intellettuale, la regolamentazione, i sistemi di finanziamento e di rimborso delle prestazioni sanitarie, insieme alle più generali politiche di innovazione tecnologica o della competitività e del trasferimento tecnologico costituisco oggetto dell’analisi.
5. Impatto sociale, legale etico e/o politico: nonostante i metodi applicabili per la valutazione delle implicazioni etiche e sociali, in primo luogo, delle tecnologie sanitarie rimangono sostanzialmente inadeguati (Goodman, 2004)o inesistenti, non si può prescindere dalla considerazione di tali aspetti principalmente per alcune tecnologie. Si pensi al caso della chirurgia fetale, ai test genetici, alle cellule staminali, ai trapianti di organi e ai sistemi di supporto alla vita per i pazienti con gravi patologie croniche. La valutazione
non sarebbe in alcun modo globale qualora si omettesse l’analisi di tali implicazioni.
2.3.3 I principali progetti finanziati dalla Commissione Europea; gli organismi nazionali e internazionali operanti nell’ambito dell’HTA
Di seguito è presentata una review dei principali progetti di ricerca finanziati dalla Commissione Europea a partire dagli anni ’90 per stimolare e coordinare lo sviluppo dell’HTA in Europa, degli organismi internazionali e delle agenzie, nazionali e internazionali, operanti nell’ambito del HTA.
• Progetto EUR- ASSESS (1994-1997) : 15 Paesi coinvolti
• Progetto HTA- EUROPE (1996-1997) – obiettivo: definire un modello di sviluppo di HTA in Europa.
La proposta conclusiva del progetto prevedeva il coordinamento tramite:
-un board con rappresentanti di tutti gli stati membri
-un centro amministrativo per il supporto logistico
-sistema di scambio di informazioni ed expertise
Particolarmente interessanti risultano le pubblicazioni, essenzialmente monografiche, curate dal HTA.
• Progetto ECHTA – ECAHI (The European Collaboration for Health
Technology Assessment -Assessement of Health Intervention) (2000-2003) –
obiettivo: creare un network europeo di HTA al fine di sostenere i governi nella pianificazione e sviluppo dei sistemi sanitari nazionali.
• Progetto EunetHTA (European Network for HTA) (2005-2008) a cui partecipano 59 organizzazioni europee coordinate dal Danish Centre for Evaluation
and HTA (DACEHTA) di Copenahagen, collegare le agenzie locali di HTA, i centri
di ricerca e i ministeri della sanità così da consentire un efficace scambio di informazioni e supportare le decisioni di politica sanitaria degli Stati Membri. Per l’Italia partecipano l’Agenzia Sanitaria Regionale – Regione Lazio, l’Unità di
Valutazione delle Tecnologie dell’Università Cattolica del Sacro Cuore di Roma e la Regione Veneto.
PRINCIPALI ORGANISMI INTERNAZIONALI
• ISTAHC (International Society of Technology Assessment in Health Care): Società Scientifica Internazionale che, dal 1985, raggruppa organizzazioni pubbliche e private operanti nell’ambito dell’HTA (attualmente circa 1.400 membri in tutto il mondo). Organizza annualmente un importante convegno. Nel 2003 l’ISTAHC è stata sciolta ed è stata creata una nuova società: HTAi (Healt Technology Assessment International)
• INAHTA (International Network of Agencies for Health Technology
Assessement): network internazionale (circa 39 agenzie appartenenti a 20 Paesi di
tutto il mondo – nessuna italiana) fondato nel 1993 per coordinare le attività di HTA e definire metodologie condivise.
In collaborazione con l’Università di York ha creato un database dei rapporti prodotti dagli affiliati.
• HEALTH TECHNOLOGY ASSESSMENT ON THE NET: fornisce corsi a distanza (tramite web), curati congiuntamente dalla University of Victoria e il British Columbia Health Research Foundation (British Columbia, Canada).
• COCHRANE COLLABORATION: network creato per raccogliere e diffondere in circa 40 Paesi del mondo le informazioni relative all’efficacia dei trattamenti sanitari nell’ottica dell’Evidence Based Medicine. Vengono delineati anche i criteri più opportuni per la valutazione dell’efficacia clinica.
Con lo stesso obiettivo è stata creato nel 1994 il CENTRO COCHRANE ITALIANO (CCI)
Caratteristiche comuni ai principali organismi internazionali:
- creati tra la fine degli anni ’80 e gli anni ‘90
- finanziati da enti pubblici (spesso governi locali)
- attività di tipo consultivo (ad eccezione del francese AFFSAPS e degli istituti olandesi le cui valutazioni sono vincolanti)
CENTRI DI RICERCA/AGENZIE NAZIONALI (ADERENTI A INAHTA)- EUROPA
• Agence Nationale d’Accreditation et d’Evaluation en Santè (ANAES)
L’ANEAS è una organizzazione pubblica creata nell’ambito della riforma del sistema sanitario francese. La mission dell’ANEAS è valutare le conoscenze su cui si fonda l’evidence based medicine e le prassi seguite dagli erogatori delle prestazioni sanitarie in ambito di prevenzione, diagnosi, terapie e biotecnologie.
• Agenzia de Evaluaciòn de Tecnologìas Sanitarias (AETS)
AETS risponde alla necessità del sistema sanitario spagnolo di oggettivare l’impatto clinico, sociale, etico ed economico delle tecnologie e delle procedure mediche.
• Catalan Agency for Health Technology Assessment (CAHTA)
CAHTA è un organismo pubblico, no – profit, affiliato al servizio sanitario catalano. Il suo obiettivo principale è fornire supporto ai “decision maker” così da consentire che l’introduzione, l’utilizzo e la diffusione delle tecnologie biomediche avvenga sulla base di ben provati criteri di efficienza, efficacia e sicurezza.
• Agencia de Evaluación de Tecnologias Sanitarias de Andalucia (AETSA) L’AETSA è stata istituita dal Governo dell’Andalusia nel 1996 al fine di promuovere l’utilizzo di analisi costo-benificio e l’ evidence-based medicine all’interno del servizio sanitario regionale.
• Center for Medical Technology Assessment (CMT)
Il CMT è un centro di ricerca svedese, costituito presso la Linkoping University. Il suo obiettivo è realizzare studi di valutazione delle tecnologie biomediche dal punto di vista medico, sociale, economico ed etico
• Danish Institute for Health Services Research and Development (DSI)
DSI è un centro di ricerca indipendente che realizza studi ed analisi valutative per conto del governo, enti locali ed altri organismo governativi, principalmente in Danimarca ma spesso anche in altri Paesi, operando tramite collaborazioni internazionali.
• Danish Institute for Health Technology Assessment (DIHTA)
Il DIHTA è l’Istituto Nazionale Danese appositamente istituito per valutare le condizioni e le conseguenze dell’utilizzo delle tecnologie sanitarie.
• Department of Medical Technology Assessment University of Nijmegen &
University Hospital Nijmegen St. Radboud Nijmegen, the Netherlands
L’attività principale del MTA è supportare i ricercatori del University Hospital Nijmegen St. Radboud e della Facoltà di Medicina nella valutazione degli outcome della loro attività medica.
• The European Agency for the Evaluation of Medicinal Products (EMEA) L’EMEA è una organizzazione europea, istituita nel 1995 al fine di autorizzare l’introduzione di prodotto medicinali. L’attività di tale organizzazione è basata sulla cooperazione tra le autorità nazionali degli Stati Membri e la sede centrale dell’EMEA situata a Londra. L’EMEA opera come coordinatore di un network costituito da 2.000 esperti europei.
• Finnish Office for Health Care Technology Assessment (FinOHTA)
FinOHTA è una agenzia di valutazione pubblica ed indipendente che opera come parte integrante di Stakes, il National Research and Development Centre for Welfare and Health, coordinando le attività si Health technology Assessment in Finlandia.
• German Institute for Medical Documentation and Information
L’attività principale dell’Istituto che opera nell’ambito del German Federal
Ministry of Health (BMG) è dare rapido ed agevole accesso, ai soggetti interessati,
alle informazioni più recenti inerenti le scienze e le attività mediche.
• ITA - Institute for Technology Assessment of the Austrian Academy of
Sciences
L’ITA è una struttura di ricerca dell’Austrian Academy of Sciences (AAS) il cui compito consiste nell’analizzare le innovazioni tecnologiche, esaminarne le conseguenze a livello sociale e elaborare linee di azione per i decisori politici, operando con un approccio interdisciplinare.
SMM è un centro promosso e finanziato dal Ministero Norvegese della Sanità e degli Affari Sociali, all’interno del SINTEF Unimed, una organizzazione di ricerca no-profit, con lo scopo di analizzare sistematicamente le metodologie utilizzate per la valutazione delle tecnologie sanitarie.
• OSTEBA - Basque Office for Health Technology Assessment
OSTEBA è stata creata nel 1992 e dipende dalla Organisation and Evaluation
Directorate del Dipartimento della Salute dei Paesi Baschi. La sua missione è
contribuire a diffondere un utilizzo appropriato delle tecnologie biomediche, già consolidate ed innovative.
• Swedish Council on Technology Assessment in Health Care (SBU)
La mission del SBU consiste nel valutare, in maniera critica, i costi, i rischi e i benefici delle tecnologie utilizzate in sanità
• TNO'S HTA GROUP - The Netherlands Organization for Applied Scientific
Research
TNO’S HTA GROUP è una organizzazione di ricerca indipendente, parzialmente finanziata dal governo olandese, la cui mission consiste nel contribuire ad una appropriata applicazione della tecnologia, intesa nel senso più ampio, all’attività di erogazione delle prestazioni sanitarie.
• CVZ - College voor Zorgverzekeringen/Health Care Insurance
Le attività del CVZ consistono nel sovrintendere, coordinare e migliorare il sistema finanziario e assicurativo in ambito sanitario al fine di garantire servizi sanitari accessibili ed appropriati. Parte integrante della sua mission è costituita dalla valutazione delle tecnologie sanitarie, sia di quelle consolidate che di quelle nuove e/o innovative.
• Swiss Science Council/Technology Assessment (SWISS/TA)
SSC (Swiss Science Council) è l’organo consultivo del Consiglio Federale per tutte le materie inerenti alle scienze politiche
CENTRI DI RICERCA/AGENZIE NAZIONALI - AMERICA
• Alberta Heritage Foundation for Medical Research (AHFMR) • Academy for Health Services Research and Health Policy
• British Columbia Office of Health Technology Assessment (BCOHTA) • Canadian Coordinating Office Health Technology Assessment (CCOHTA) • Conseil d’Evaluation des technologies de la santé (CETS)
• ECRI
• ETESA (Unidad de Evaluación de Tecnologías de Salud) • Institute for Clinical Evaluative Sciences (ICES)
• Harvard Program on the Economic Evaluation of Medical Technology
(PEEMT)
• Health Services Utilization and Research Commission (HSURC) • Institute of Medicine U.S.
• Manitoba Centre for Health Policy and Evaluation
• Medical Technology and Practice Patterns Institute (MTPPI)
• National Information Center on Health Services Research and Health Care
Technology (NICHSR)
• Oregon Health Resources Commission (HRC), Medical Technology
Assessment Program
• Pan American Health Organization/Division of Health Systems and Services
and Development (PAHO/HSP), Technology Assessment in Health Care
• RAND
• University HealthSystem Consortium (UHC)
• VA Research and Development Service - Technology Assessment Programme • Unidad De Technologias De Salud (ETESA)