UNIVERSITÁ DI PISA
FACOLTÁ DI MEDICINA VETERINARIA
Corso di Laurea Magistrale in Medicina Veterinaria
Valutazione dello stress ossidativo nel
plasma e liquido sinoviale di cani affetti da
patologie articolari
Candidato:
Relatori:
Tacchi Serena
Prof. Modenato Mario
RIASSUNTO...5
INTRODUZIONE...6
CAPITOLO1 L’ARTICOLAZIONE SINOVIALE: CARATTERISTICHE ANATOMO-FISIOLOGICHE E MICROSCOPICHE...6
1.1 La membrana sinoviale... 7
1.2 La cartilagine articolare ... 9
1.3 Il liquido sinoviale ... 14
1.3.1 Esame del liquido sinoviale ... 16
1.3.2 Caratteristiche fisiche ... 18
1.3.3 Caratteristiche chimiche ... 19
1.3.4 Test biochimici ... 20
1.3.5 Esame citologico... 21
CAPITOLO 2 LE ARTROPATIE DEL CANE ...24
2.1 Classificazione delle artropatie ... 24
2.2 Osteoartrite o degenerative joint disease (DJD) ... 26
2.2.1 Alterazioni del liquido sinoviale in corso di osteoartrite. ... 28
2.3 Artropatie infiammatorie infettive ... 29
2.3.1 Alterazioni del liquido sinoviale in corso di artropatie infiammatorie infettive ... 31
2.4 Artropatie infiammatorie non infettive immunomediate ... 32
2.4.1- Alterazioni del liquido sinoviale in corso di artropatie infiammatorie immunomediate ... 35
CAPITOLO 3 I RADICALI LIBERI...37
3.5 Fattori esterni nella genesi dei radicali liberi ... 50
3.6 Agenti antiossidanti... 52
3.6.1 Antiossidanti preventivi... 53
3.6.2 Antiossidanti che agiscono inattivando specie reattive già formate ... 57
3.6.3 Antiossidanti che agiscono dopo che il danno da radicale si è instaurato... 59
3.6.4 Agenti di adattamento... 60
3.7 Equilibrio ossidanti-antiossidanti: lo stress ossidativo ... 61
3.7.1 Effetti dello stress ossidativo sulle malattie organiche ... 63
CAPITOLO 4 LO STRESS OSSIDATIVO NELLE ARTICOLAZIONI ...67
CAPITOLO 5 IL RUOLO DEL LABORATORIO NELLA VALUTAZIONE DELLO STRESS OSSIDATIVO ...74
5.1 Il d-ROMs test ... 76
5.2 Finalità del d-ROMs test ... 80
5.2.1 Punti di forza del d-ROMs test ... 81
5.3 Il BAP test ... 82 5.4 Il Sistema FREE ... 84 PARTE SPERIMENTALE...86 MATERIALI E METODI ...87 RISULTATI ...98 DISCUSSIONE ...109 CONCLUSIONI...113
Parole chiave: ROMs, antiossidanti, patologie articolari, d-ROMs test, BAP test.
L’aumento dello stress ossidativo dovuto ad una sovrapproduzione di specie reattive dell’ossigeno e ad un’alterata capacità antiossidante risulta implicato nella patogenesi delle patologie articolari .
L’obiettivo del presente studio è stato quello di comparare la capacità ossidoriduttiva del plasma e del liquido sinoviale di cani affetti da osteoartrite e da patologie articolari infiammatorie con un gruppo di cani di controllo senza alcuna patologia e, se possibile di individuare una eventuale correlazione tra lo stato ossidativo e l’aspetto citologico del liquido sinoviale dei pazienti. Il profilo ossido riduttivo di 11 cani affetti da osteoartrite e di 10 cani affetti da patologie infiammatorie è stato valutato utilizzando il d-ROMs test e il BAP test, due metodi di determinazione colorimetrica dei metaboliti reattivi dell’ossigeno (ROMs) e dei componenti antiossidanti del plasma e del liquido sinoviale. Dallo studio è emerso che i ROS nel liquido sinoviale aumentano in maniera statisticamente significativa nei soggetti affetti da patologie articolari di tipo infiammatorio rispetto al gruppo di controllo.
ABSTRACT
Keywords: ROMs, antioxidants, joint disease, d-ROMs test, BAP test
The increment of the oxidative stress due to overproduction of reactive oxygen species, coupled with altered antioxidant capacities, has been implicated in the pathogenesis of joint diseases. The aim of the present study was to compare the redox properties of plasma and synovial fluid of dogs with osteoarthritis and inflammatory joint diseases to a control group of healthy dogs and to find out an eventual correlation between oxidative status and cytological appearance of synovial fluid. Oxidant-antioxidant profile in 11 dogs affected by osteoarthritis and in 10 dogs affected by inflammatory joint diseases were estimated using d-ROMs test and BAP test, two colorimetric determination of reactive oxygen metabolites (ROMs) and antioxidant components in plasma and synovial fluid. We found that ROS in synovial fluid from subjects with inflammatory joint diseases have more high values than control group and that this difference is statistically significant
INTRODUZIONE
Capitolo1
L’ARTICOLAZIONE SINOVIALE:
CARATTERISTICHE ANATOMO-FISIOLOGICHE E
MICROSCOPICHE
Le articolazioni rappresentano il mezzo di congiunzione tra due ossa contigue. Esistono diversi tipi di articolazioni con caratteristiche ben diverse (William G.et al., 2001). Le articolazioni cartilaginee (nuclei di accrescimento, sinfisi mandibolare) e le articolazioni fibrose (cranio, denti) presentano tessuto fibroso e cartilagineo come connessione tra i due capi ossei e per questo consentono solo movimenti molto scarsi, se non nulli. Le articolazioni di nostro interesse sono quelle sinoviali caratterizzate, per la loro particolare struttura, dalla capacità di permettere un ampio movimento tra due capi ossei (Ann L.et al., 2004)
In queste particolari articolazioni distinguiamo tre componenti principali:
• una cavità articolare, contenente una modesta quantità di liquido
• una cartilagine articolare, che riveste i due capi ossei contrapposti
• una capsula articolare, rivestita al suo interno dalla membrana sinoviale, che rappresenta la struttura fibrosa che tiene insieme le due superfici articolari .
comprendono altri componenti come i legamenti intrarticolari, i menischi e i cuscinetti adiposi.
Questa particolare struttura permette alle superfici articolari di rimanere in contatto, anche se parzialmente distanziate grazie alle strutture fibrose e legamentose presenti e consente, inoltre, movimenti che dipendono dalla forma delle superfici articolari e dalle strutture che le contengono.
1.1 La membrana sinoviale
Il ruolo principale della membrana sinoviale è quello di produrre liquido sinoviale; inoltre svolge un ruolo fondamentale nella fisiologia dell’articolazione, rivestendo internamente la capsula articolare e rimanendo adesa al periostio dei capi articolari nel punto dove termina la cartilagine articolare. Dal punto di vista macroscopico questa appare come una struttura di colore rosa pallido, anche se molto vascolarizzata, e nel suo margine interno presenta microvilli e pieghe che ne permettono l’adattamento ai movimenti (detti a fisarmonica) di flessione ed estensione della capsula articolare, oltre che l’espansione quando aumenta la pressione intraarticolare.
Al microscopio vediamo che tale struttura è costituita da un epitelio di cellule mesenchimali modificate, i sinoviociti, che formano quattro strati che a loro volta si dispongono su un connettivo lasso, formato da monociti interposti a fibre di elastina, scarse fibre collagene e numerose fibre reticolari (William G.et al ., 2001).La matrice extracellulare è ricca di acido ialuronico e contiene i due glicosamminoglicani principali, il
la diffusione e sono responsabili del nutrimento della cartilagine articolare priva, invece, di vasi.
I nervi della membrana sinoviale sono responsabili della sensibilità dolorifica e della propriocezione. Nella membrana sinoviale troviamo tre tipi di cellule: quelle più abbondanti sono i sinoviociti di tipo B, che si trovano nello strato più interno della membrana, costituiscono il 70-80% dell’intera popolazione cellulare e sono responsabili della sintesi e modificazione della matrice liquido sinoviale. Inoltre, tali cellule sono responsabili della produzione di acido ialuronico.
Nello spessore della membrana sinoviale troviamo i sinoviociti di tipo A, o di tipo fagocitario; essi secernono Interleuchina-1 (IL-1), Prostaglandina E (PGE) e contengono gli enzimi atti a sintetizzare le PGE2 e PGE2α.
In seguito a lesioni della membrana sinoviale i sinoviociti A stimolano un aumento della sintesi di proteoglicani da parte dei sinoviociti B. William G.et al ., 2001). Il terzo tipo di cellule sono i sinoviociti di tipo C, o cellule dendritiche, così chiamate per la loro forma a stella, e che in realtà sono cellule B in fase precoce o cellule mesenchimali indifferenziate. Parte di queste cellule dendritiche, responsabili dell’identificazione antigenica, si trovano a contatto con i linfociti timo-dipendenti che occupano lo strato più profondo dello stroma.
1.2 La cartilagine articolare
La cartilagine articolare è una cartilagine di tipo ialino e si presenta come un tessuto connettivo bianco, denso, liscio e traslucido, spesso pochi millimetri, privo di vasi sanguigni e linfatici e di terminazioni nervose, dipendente per il nutrimento dal liquido sinoviale. Il suo ruolo è quello di distribuire i carichi meccanici proteggendo l’osso subcondrale da sollecitazioni dannose, grazie al suo elevato coefficiente di deformazione elastica e l’assenza di attriti superficiali.
Microscopicamente la cartilagine articolare è costituita da una piccola percentuale (10%) di cellule di origine
mesenchimale immerse nella matrice extracellulare, che presenta un elevato stato di idratazione. Strutturalmente la cartilagine articolare non si presenta omogenea, ma risulta divisa in quattro zone ben distinte tra loro e con specifiche caratteristiche (William G. et al., 2001),(Ann L.et al., 2004). Le zone sono (dall’interno all’esterno):
1) zona di cartilagine calcificata 2) zona profonda o radiale
3) zona di transizione o intermedia
4) zona superficiale o strato tangenziale o di scivolamento
La zona di cartilagine calcificata: rappresenta la zona di transizione dalla cartilagine ialina all’osso subcondrale e serve da ancoraggio alla cartilagine sull’osso. Essa inoltre svolge un importante ruolo nel processo di ossificazione encondrale durante la crescita e il rimodellamento (William G.et al., 2001),( Robert J.W., 2001) e limita la diffusione di acqua e soluti
La zona profonda: è quella con il maggiore spessore; le sue cellule sono piccole e rotonde e tendono a disporsi in modo verticale, in colonne corte e irregolari, perpendicolari alla superficie articolare. Nella sua parte più profonda contiene quantità maggiori di proteoglicani e minori di acqua. Subito sotto questa zona troviamo una linea ondulata detta tidemark, che appare bluastra alla colorazione ematossilina –eosina .
Tale linea appare con la maturità scheletrica e rappresenta il confine tra e la cartilagine articolare e l’osso subcondrale.
La zona di transizione: presenta grosse cellule ovoidali disposte irregolarmente, è più spessa della superficiale e presenta fibre collagene più grandi.
La zona superficiale: è formata da cellule appiattite o ovoidali, disposte con l’asse maggiore parallelo alla superficiale articolare; questa è la zona più sottile, e la parte più superficiale di questa è formata solo da matrice extracellulare in modo da formare una superficie perfettamente scorrevole. Le cellule della cartilagine articolare traggono nutrimento da un doppio sistema di diffusione, perché i nutrienti prima devono diffondere dal lume vasale nel fluido sinoviale e poi da questo alla cellula attraverso la matrice cartilaginea.
La matrice extracellulare della cartilagine è composta da un insieme di macromolecole che interagiscono tra loro e non presentano un andamento casuale, ma hanno un orientamento, diverso a seconda della sede, che rispecchia quello della componente cellulare: parallelo alla superficie negli strati più esterni, trasversale in quelli intermedi e verticale in quelli più profondi.
Le fibrille di collagene formano la struttura portante che determina lastruttura della cartilagine e rappresentano la fonte primaria di robustezza. Circa il 50% del peso secco della cartilagine è dato dal collagene, e di questo quello predominante è il collagene di tipo II.
I proteoglicani sono secondi, per quantità, tra le molecole strutturali della cartilagine articolare e contribuiscono alla determinazione del peso secco della cartilagine per una percentuale compresa tra il 30-35%.
Sono grosse molecole costituite da catene polisaccaridiche di glicosamminoglicani (GAG) che si attaccano ai lati di una proteina lineare (core proteico) in una conformazione detta “a spazzola di bottiglia”; i GAG sono distinti in tre diversi tipi: il condroitin-6-fosfato, il condroitin 4solfato e il cheratin-solfato. La loro distribuzione varia con l’età, con il tipo di cartilagine e in presenza di patologie.
I proteoglicani sono inseriti tramite un peptide su un filamento lungo e sottile di acido ialuronico, formando così degli aggregati. (William G.et al., 2001), (Robert J.W., 2001)
Se l’articolazione è sana i proteoglicani sono in uno stato dinamico, cioè vengono sintetizzati e degradati costantemente e in modo equilibrato da un sistema di rimodellamento interno.
I GAG e l’acido ialuronico, essendo carichi negativamente, si respingono tra loro ed aiutano a mantenere la forma e la rigidità della cartilagine; inoltre aumentano la capacità elastica della struttura e sostengono il rigonfiamento molecolare e l’idratazione della cartilagine stessa.
Le glicoproteine svolgono la funzione di interazione e ancoraggio tra condrociti e la matrice cellulare.
La cartilagine articolare, se sottoposta a carichi meccanici presenta un comportamento visco-elastico, le manifestazioni principali sono la
deformazione viscosa e il rilasciamento sotto stress.
La deformazione viscosa si osserva quando l’articolazione è sottoposta a carico per lungo tempo: in questo caso la superficie di contatto aumenta progressivamente col tempo, così che il carico compressivo è distribuito su una superficie via via più ampia.
In questo modo il fluido interstiziale è spinto verso i tessuti circostanti imbibendoli e può così provvedere alla naturale nutrizione delle cellule e alla lubrificazione dell’articolazione.
Il rilassamento sotto stress è oltremodo importante per lo scorrimento dei fluidi attraverso la matrice.
Visto che è difficile sostenere per lunghi periodi alti livelli di sollecitazione meccanica sulla matrice extracellulare, la deformazione che ne consegue può essere tenuta costante fino a quando il livello di tensione non inizia a scendere. Allo stesso modo la deformazione dovuta alla sollecitazione meccanica può essere mantenuta costante solo per un certo periodo, poi si ha una progressiva diminuzione della tensione. Da ciò risulta che il fluido è ridistribuito e lo stress sulla matrice decresce progressivamente nel tempo. Le lesioni a livello della cartilagine articolare possono riguardare solo la matrice extracellulare, con perdita di macromolecole strutturali, oppure essere caratterizzate dalla disgregazione meccanica delle cellule e della sostanza fondamentale. A volte, specialmente nei casi cronici, questi due tipi di lesione possono essere presenti contemporaneamente. La perdita di macromolecole strutturali può derivare da situazioni in cui si ha la distruzione della membrana sinoviale, come in caso di infezione o di altre
Se il processo patologico persiste e non viene immediatamente interrotto, è probabile che la lesione della cartilagine divenga permanente o addirittura irreversibile.
Le cellule della cartilagine possono essere distrutte e la matrice extracellulare disgregata in vari tipi di insulti fisici, come un trauma penetrante o un’abrasione. La capacità riparativa della cartilagine dipende dalla profondità e dall’estensione del danno, tuttavia in soggetti adulti la capacità rigenerativa degli elementi della cartilagine articolare è estremamente scarsa ed è rara una restituito ad integrum in seguito a lesione. Inoltre la mancanza di vasi sanguigni determina un’anomala guarigione della cartilagine poiché la risposta infiammatoria di origine vasale, che normalmente si verifica negli altri tessuti facilitandone molto il processo di riparazione, verrà a mancare in questo particolare tessuto (Stephen B.et al., 2001),(Ann L.et al., 2004)
1.3 Il liquido sinoviale
Il liquido sinoviale è un dializzato del plasma, prodotto dalle cellule di rivestimento della membrana sinoviale e modificato da un processo di essudazione e trasudazione ad opera dell’endotelio vascolare e dell’interstizio sinoviale (Piermattei D.L. e Flo G.L., 1999).
Normalmente appare come un fluido viscoso trasparente, di colore giallo chiaro, che risulta essere fondamentale per la lubrificazione dei tessuti articolari (Ann L.et al., 2004) La viscosità di tale fluido è data dall’alto contenuto di mucopolisaccaridi, in particolare acido ialuronico, secreti dalle cellule sinoviali. Le altre parti costituenti derivano dal plasma e comprendono alcune proteine, elettroliti, enzimi e acqua (Robert J.W., 2001),(Ann L.et al., 2004) Quello che si crea è in realtà un continuo scambio di costituenti tra il liquido sinoviale, la rete vascolare e quella linfatica della membrana sinoviale.
L’ossigeno e l’anidride carbonica diffondono liberamente sia attraverso le membrane cellulari sia attraverso gli interstizi, mentre le proteine e le macromolecole vengono filtrate a livello dell’endotelio vascolare e della membrana basale.
Le molecole di piccole dimensioni, con peso molecolare <10.000, possono invece diffondere liberamente nell’endotelio, ma la loro diffusione è comunque limitata allo spazio interstiziale.
L’urea, la creatinina e il saccarosio si muovono liberamente tra il plasma e il liquido sinoviale per semplice diffusione cinetica.
Il glucosio raggiunge il cavo articolare per diffusione facilitata, ma ne viene rimosso per diffusione cinetica.
Dobbiamo ricordare, inoltre, che gli spazi intraarticolari delle articolazioni sane sono spazi virtuali per cui il volume di liquido sinoviale è fisiologicamente ridotto, al massimo 1 o 2 ml nel ginocchio di un cane di grossa taglia.
Quando l’articolazione viene colpita da una noxa patogena vengono disturbati il normale equilibrio e la funzione della membrana sinoviale, e questo si manifesta anche attraverso una alterazione del liquido sinoviale stesso. Nell’infiammazione, per esempio, si ha un aumento della componente idrica; il versamento che si viene a creare diminuisce la viscosità del liquido articolare, sia per diluizione dell’acido ialuronico che per azione diretta della ialuronidasi prodotta dalle cellule infiammatorie, che rompe la catena di questa molecola.
L’arrivo di cellule infiammatorie nell’articolazione porta altri problemi; ad esempio, i neutrofili degenerati liberano enzimi lisosomiali che agiscono sulla cartilagine, determinando lesioni più o meno estese a carattere erosivo. Tutto ciò è aggravato anche dalla perdita di viscosità del liquido sinoviale, che non è più in grado di ostacolare il contatto diretto tra le superfici cartilaginee e quindi non riduce il loro inevitabile logorio per abrasione (Robert J.W., 2001)
Quindi possiamo dire che ogni alterazione a livello articolare si ripercuote rapidamente e gravemente su tutte le sue componenti, portando modificazioni irreversibili alla sua struttura.
1.3.1 Esame del liquido sinoviale
Figura 1 Liquido sinoviale normale
L’esame del liquido sinoviale prelevato dalle articolazioni coinvolte nelle diverse sindromi cliniche è un mezzo diagnostico utile per stabilire la causa, la terapia e la prognosi delle diverse artropatie. Questo esame prevede la valutazione delle caratteristiche fisiche del fluido prelevato, esami di laboratorio per la valutazione delle caratteristiche chimiche e biochimiche, e lo studio citologico del campione, che è l’aspetto più significativo dell’analisi. Il prelievo è una procedura mininvasiva, che non comporta problemi per l’animale e rappresenta uno strumento utile nello studio delle patologie articolari.
Durante il prelievo del liquido sinoviale l’animale deve restare immobile, per evitare traumi iatrogeni e possibile contaminazione ematica del campione; per questo può essere utile il ricorso alla sedazione o all’anestesia. Il punto dove si effettua la centesi viene preparato chirurgicamente; subito dopo si inserisce un ago da 22G montato su una siringa da 2,5 o 5 ml e si aspira delicatamente il liquido (Ann L.et al.,
Figura 2 Approccio cranio-laterale al carpo l’ago viene introdotto a livello della fossetta intercarpica
Figura 3 Approccio laterale al ginocchio, l’ago viene introdotto lateralmente al legamento patellare,a metà strada tra rotula e cresta tibiale
1.3.2 Caratteristiche fisiche
Subito dopo il prelievo il liquido viene valutato per una serie di parametri fisici quali:
Volume: la quantità di liquido varia in funzione dell’articolazione e della
taglia dell’animale; da un’articolazione sana di un cane di grossa taglia si possono prelevare da 0,1 a 1 ml di liquido (Boon G., 2000).
Colore: il colore normale è giallo chiaro. Se c’è stata una contaminazione
iatrogena il fluido presenterà delle striature ematiche, che dovranno essere differenziate da una emorragia vera e propria. In corso di patologie articolari si possono avere notevoli cambiamenti del colore del liquido, dal giallo scuro, allo xantocromico, all’emorragico.
Torbidità: di solito il liquido si presenta trasparente in relazione alla scarsa
quantità di cellule presenti. Se il numero delle cellule aumenta il liquido presenta una torbidità più o meno accentuata; questo accade soprattutto in caso di fenomeni infiammatori, sia settici sia no.
La torbidità può essere data anche dalla presenza di flocculi di fibrina, che si possono avere nei fenomeni sia infiammatori sia degenerativi (Fernandez F.R.et al., 1983).
Viscosità: l’elevata viscosità è una caratteristica fisiologica del liquido
sinoviale ed è dovuta in particolare alla presenza dell’acido ialuronico. Questo parametro viene valutato mettendo una goccia del liquido prelevato tra pollice ed indice e osservando il grado di distendibilità del filamento che si forma tra le dita separandole. Un filamento di 2 cm e oltre è indice di una viscosità normale.
L’elevata viscosità del liquido può essere apprezzata anche microscopicamente sul preparato citologico, perché proprio a causa di questa caratteristica le cellule tendono a disporsi sul vetrino in filiere molto regolari, dette a “fila indiana”(Fernandez F.R.et al., 1983), (Gibson N.R.et al., 2002) La diminuzione della viscosità è un riscontro patologico, che si verifica se nel liquido sinoviale è presente l’enzima ialuronidasi in grado di degradare l’acido ialuronico. Tale enzima è liberato sia dai batteri che dai neutrofili in degenerazione; la diminuzione di viscosità si può riscontrare quindi in corso di patologie infiammatorie, sia settiche sia non (Robert E., 2001).
1.3.3 Caratteristiche chimiche
Gli esami che di solito sono eseguiti per valutare le caratteristiche chimiche sono il mucin clot test e la misurazione della concentrazione proteica totale. Il mucin clot test viene eseguito per valutare indirettamente la qualità dell’acido ialuronico. La mucina sinoviale è una glicoproteina acida che rappresenta la parte polisaccaridica acida dell’acido ialuronico e viene coagulata dagli enzimi che precipitano le proteine.
Il test si esegue aggiungendo liquido sinoviale, in rapporto di 1:4, a una soluzione di acido acetico glaciale al 2,5% e mantenuto a temperatura ambiente per 20-30 minuti.
Nel liquido sinoviale normale la mucina precipita portando alla formazione di un coagulo solido, compatto e ben visibile in una soluzione trasparente. In corso di patologie infiammatorie troveremo un coagulo non compatto o addirittura assente, mentre in caso di patologie degenerative questo si presenterà normale o solo leggermente alterato. Le proteine totali si misurano tramite l’uso di un refrattometro. Queste sono presenti in scarsa quantità in un liquido sinoviale normale, con valori compresi tra 2 e 4 gr/dl. Nel corso di patologie infiammatorie aumenta la permeabilità della membrana sinoviale, per cui si ha anche un incremento di questo valore. E’ stato visto che un aumento delle proteine sinoviali si verifica anche in corso di malattie infiammatorie di tipo degenerativo, come l’osteoartrite.
1.3.4 Test biochimici
Nel liquido sinoviale sono presenti diversi metaboliti come urea, acido urico, azoto e glucosio, che di solito si trovano in questa sede in una concentrazione praticamente identica a quella ematica.
Tra tutti questi risulta di particolare interesse il glucosio, dal momento che è un metabolita utilizzato come substrato sia dai batteri che dai granulociti neutrofili; per questo motivo una diminuzione del rapporto Glucosio ematico/Glucosio sinoviale può essere indicativa di un fenomeno infiammatorio infettivo o non infettivo. Tuttavia non è un esame specifico perché, qualora dia risultati anomali, deve essere sempre associato all’esame colturale batteriologico per confermare un’eventuale causa infettiva.
1.3.5 Esame citologico
L’esame citologico è senz’altro tra gli esami che danno maggiori informazioni riguardo allo stato dell’articolazione. Per questo motivo, qualora la quantità di campione prelevato sia molto scarsa, è necessario allestire un vetrino privilegiando questo esame rispetto agli altri.
Di solito, se la fase di prelievo è stata eseguita correttamente, un liquido sinoviale normale non presenta globuli rossi, anche se spesso una piccola quantità di questi è presente e dipende da una contaminazione iatrogena. In altri casi la presenza di eritrociti può essere associata a emorragie acute o croniche (emartro), fenomeni questi che si riscontrano non solo in corso di patologie infiammatorie settiche di tipo erosivo, ma anche in presenza di malattie croniche degenerative caratterizzate da continue microemorragie. La conta cellulare delle cellule nucleate del liquido articolare può essere eseguita in camera conta globuli tramite conta manuale oppure con contaglobuli elettronico previa trattamento con enzima ialuronidasi che è in grado di scindere la catena polisaccaridica dell’acido ialuronico in piccoli frammenti e quindi di eliminare completamente la viscosità del liquido. Come riportato in bibliografia vengono utilizzate a questo proposito due gocce di soluzione enzimatica alla concentrazione di 150 Unità/ml per sciogliere 0,25 cc di liquido.(Moreno M.J.,et al 2000)
Fisiologicamente la quantità di cellule è molto scarsa, inferiore alle 3000 cellule/µl, ma spesso si contano meno di 500 cellule/µl.
Normalmente, osservando un vetrino ad un ingrandimento di 400X si notano da 1 a 3 cellule per campo per cui, stimando una media, già con
Un aumento significativo della cellularità si riscontra in corso di patologie infiammatorie, per la forte abbondanza di neutrofili, anche se un certo aumento lo si può riscontrare, con presenza di altri tipi cellulari, anche in corso di patologie croniche degenerative come l’osteoartrite.
In uno striscio normale troviamo le seguenti cellule:
Neutrofili: costituiscono al massimo il 10% delle cellule totali; di questi è
importante valutare non solo il numero ma anche le alterazioni morfologiche, dato che queste variano nel corso delle diverse artropatie. Come già detto il numero dei neutrofili aumenta in corso di patologie infiammatorie, settiche e non.
L’attività fagocitaria è indice di necrosi tissutale ed è quindi presente sia in corso di patologie degenerative che in corso di patologie infiammatorie. La segmentazione nucleare è legata all’età della cellula; si può riscontrare picnosi in corso di malattie immunomediate o cariolisi in corso di processi settici. In corso di artropatie possono inoltre essere presenti altri particolari tipi di neutrofili: Le cellule LE, neutrofili grandi e rotondi che hanno fagocitato materiale nucleare su cui hanno agito anticorpi antinucleo, e che si presenta come abbondante materiale citoplasmatico che forma corpi ematossilinici. Il loro riscontro è indicativo, anche se non patognomonico, di Lupus Eritematoso Sistemico. I fagociti, neutrofili che contengono numerose inclusioni citoplasmatiche di colore nerastro formate da immunocomplessi, che derivano dalla combinazione di IgG, IgM, complemento e fattore reumatoide. Questo reperto è raro in Medicina Veterinaria perché la loro osservazione richiede particolari attenzioni, quali un esame citologico condotto su vetrini non colorati e a bassa intensità luminosa. Le tart cell, neutrofili che hanno fagocitato materiale nucleare
Linfociti: in media si trovano in percentuale del 40%, anche se c’è molta
variabilità e in bibliografia si trovano valori che oscillano dal 20% al 60%. Queste cellule sono abbastanza piccole, con un nucleo grande che occupa quasi tutto il volume cellulare e citoplasma ridotto ad una striscia intorno ad esso.
Un aumento di queste cellule si riscontra in genere in corso di patologie infiammatorie, ma anche in quelle di tipo degenerativo, come l’osteoartrite (Colosio., 2001).
Sinoviociti: normalmente si presentano in quantità del 20%-30%, distribuiti
nel preparato, come segno di una normale esfoliazione della membrana sinoviale in seguito al suo fisiologico turn-over. Presentano un nucleo reniforne.
Tali cellule aumentano di numero e tendono a presentarsi non più isolate ma a disporsi in clusters di 6-10 elementi nel corso di patologie articolari degenerative o autoimmunitarie erosive.(Robert J.W., 2001)
Clasmatociti: sono cellule basofile, tondeggianti, che si ritrovano di solito
in una percentuale del 5 -10%. Derivano dai macrofagi tissutali, dai monociti ematici e da alcune cellule della membrana sinoviale che possono assumere attività fagocitaria.
Queste cellule si presentano attivate, cioè con superficie deformata dalla presenza di pseudopodi e con un citoplasma particolarmente ricco di vacuoli e di granuli di materiale fagocitato, in caso di artropatie caratterizzate da degenerazione articolare.(Fernandez F.R.et al., 1983); (Gibson N.R.et al., 1999)
Capitolo 2
LE ARTROPATIE DEL CANE
2.1 Classificazione delle artropatie
In letteratura le patologie articolari vengono classificate in due categorie, le patologie infiammatorie e quelle non infiammatorie, anche se spesso, analizzando le alterazioni del liquido articolare in corso di artropatie, si osserva che nonostante si abbia una netta prevalenza di una componente sull’altra spesso i due quadri coesistono.
Nell’elenco seguente viene rappresentata la suddivisione classica delle patologie articolari come riportato in letteratura.(Brian S.et al., 2001)
I) NON INFIAMMATORIE
Osteoartrite o degenerative joint disease (DJD) a. primitiva b. secondaria Artropatie traumatiche Artropatie Neoplastiche II) INFIAMMATORIE 1)Infettive a)Virali b)Batteriche
2)Non infettive immunomendiate a)Erosive
• Artrite reumatoide
• Poliartrite cronica felina
• Poliartrite erosiva del Greyhound
b) Non erosive
• Lupus Eritematoso Sistemico
• Artrite non erosiva associata alla malattia cronica
• Artrite enteropatica
• Artrite associata alla malattia neoplastica
• Poliartrite idiopatica di tipo I, II, III
• Artrite farmaco indotta
• Sinovite linfoplasmocitaria
• Sinovite villo-nodulare
• Sindrome poliartrite-polimiosite
• Periarterite nodosa
• Poliartrite ereditaria degli Akita inu
• Amiloidosi renale familiare dello Shar pei
• Artrite iatrogena
• Reazioni vaccinali
• Gonite Linfoplasmocitaria
2.2 Osteoartrite o degenerative joint disease (DJD)
L’osteoartrite è una delle patologie più frequenti e invalidanti che colpiscono le articolazioni del cane.
E’ un processo progressivo, autoaggravante e distruttivo che induce alterazioni a tutti i livelli: membrana sinoviale, liquido sinoviale, cartilagine articolare, tessuto periarticolare. Quando le lesioni colpiscono la cartilagine, provocano un danno irreversibile che determina un handicap motorio.
Macroscopicamente possiamo notare l’ispessimento della capsula e la formazione di osteofiti periarticolari.
A differenza di quanto accade nell’uomo, nel cane l’osteoartrite non è una malattia tipica dell’invecchiamento, ma si manifesta anche in età assai giovane come conseguenza degenerativa di malattie articolari dello sviluppo, prime fra tutte le displasie (Brian S.et al., 2001)
Esistono perciò due “osteoartriti”: quella del cane giovane e quella dell’anziano.
Comunque sia quello che osserviamo è la perdita della normale omeostasi del tessuto cartilagineo che in condizioni fisiologiche assicura il bilanciamento tra degradazione e produzione di matrice cartilaginea.
In corso di osteoartrite sono i processi degradativi a prendere il sopravvento su quelli produttivi, con conseguente perdita di cartilagine (Brian S.et al., 2001), (Ann L.et al., 2004)
Ancora oggi non è chiaro il meccanismo attraverso il quale si stabilisce il danno alla cartilagine; infatti non è noto se la osteoartrite è indotta da un danno diretto sulla cartilagine, dalla sinovite o da un insieme delle due
Nonostante questa patologia sia classificata come artropatia non infiammatoria, l’infiammazione svolge un ruolo importante nella patogenesi e nel perpetuarsi del danno articolare, e quello che si osserva è la coesistenza delle componenti degenerative e flogistico-ossidative
(Bennet D., 2004), (Brian S.et al., 2001)
E’ proprio l’insulto alla cartilagine articolare a stimolare il rilascio da parte di questa di proteoglicani, collagene e frammenti cartilaginei, che stimolano l’infiammazione della membrana sinoviale.
Una volta innescata, la sinovite procede mediante cicli di auto perpetuazione, provocando un danno continuo alla cartilagine, attraverso la sintesi, da parte dei sinoviociti, sia di metallo proteinasi (MMP) sia di citochine, in particolare l’interleuchina-1 (IL-1), e il Tumor necrosis factor (TNF). Queste citochine a loro volta stimolano la produzione di altri MMP, amplificando lo sbilanciamento totale del normale equilibrio tra sintesi e degradazione della matrice cartilaginea (Brian S.et al., 2001).
Sono stati fatti numerosi studi riguardo all’osteoartrite secondaria a varie patologie, come la rottura del legamento crociato craniale, ed è stato visto che il grado di infiammazione in questi casi è talmente elevato da far sospettare che questa artropatia abbia patogenesi infiammatoria, o addirittura immunomediata. (Niebauer G.W.et al., 1982)
Nel caso particolare della rottura del legamento crociato craniale è stata osservata la presenza, a livello del liquido sinoviale, di immunocomplessi, del fattore reumatoide, e di anticorpi anti-collagene.
2.2.1 Alterazioni del liquido sinoviale in corso di osteoartrite.
Figura 6 Esempio di alterazione macroscopica del liquido sinoviale in corso di osteoartrite
La valutazione del liquido sinoviale è un metodo indiretto per determinare la salute della cartilagine, della capsula articolare e della membrana sinoviale in caso di osteoartrite sospetta o evidente (Colosio M., 2001). Il liquido può presentarsi trasparente o leggermente torbido, il colore può cambiare da giallo chiaro a lievemente xantocromico, il volume spesso è normale ma può risultare anche molto aumentato, per esempio in stati avanzati della malattia, la viscosità di solito appare normale o più o meno diminuita.
Queste alterazioni del liquido sinoviale determinano una ridotta capacità di lubrificazione e un’inadeguata diffusione di nutrienti verso la cartilagine articolare.
La conta cellulare totale è leggermente aumentata, raramente eccede le 4000 cellule/ml e spesso è inferiore a 500 cellule/ml.
La maggior parte della popolazione cellulare è rappresentata da mononucleati come nel liquido sinoviale normale; quello che si osserva è
dei linfociti. Se è presente erosione cartilaginea si può osservare la presenza di osteoblasti e osteoclasti.
In corso di osteoartrite la componente neutrofilica è la stessa che ritroviamo nel liquido sinoviale normale e cioè inferiore al 5% senza segni di degenerazione; gli eritrociti non sono presenti a meno che non sia presente emartro. (Brian S.et al., 2001)
2.3 Artropatie infiammatorie infettive
Le artropatie infettive possono essere di due tipi: chiuse e aperte e molti sono gli agenti infettivi conosciuti come responsabili di tali patologie.
Nelle infezioni chiuse i microrganismi arrivano a livello articolare attraverso il circolo sistemico, provenendo a volte da organi o tessuti localizzati anche molto lontano dalle articolazioni.
Gli agenti infettivi che le provocano sono spesso le rickettsie (Ehrlichia canis e Rickettsia rickettsiae), le spirochete (Borrelia bugdorferi), i protozoi (Leishmania donovani infantum) e, molto di rado, miceti e virus.
L’infezione interessa di solito più articolazioni, si parla di poliartriti, anche se talvolta la sintomatologia è presente in una sola.
Nelle infezioni articolari aperte i microrganismi penetrano dall’esterno direttamente in cavità articolare, a seguito di traumi penetranti o procedure chirurgiche durante le quali non è stata rispettata una corretta asepsi. In questo caso si tratta di infezioni monoarticolari spesso di origine batterica; gli agenti infettivi più frequenti sono: Stafilococchi, Corinebacterium, Salmonella, Brucella.(Bennet D.et al., 1988), (Robert E.et al., 2001).
In caso di artriti batteriche le lesioni dipendono molto dall’agente in causa, e si potranno avere infezioni di gravità variabile, a partire da quelle più lievi fino ad arrivare all’osteomielite epifisaria, dato che alcuni microorganismi sono particolarmente dannosi per la loro capacità di produrre enzimi litici, che causano un danno diretto sulla cartilagine.
I batteri determinano alterazioni a livello della membrana sinoviale e questo provoca un versamento articolare.
Inoltre i capillari sinoviali divengono permeabili alla fibrina, al complemento e ai fattori di coagulazione del sangue che attraggono neutrofili e altre cellule dell’infiammazione nel liquido sinoviale.
Così i neutrofili, i monociti e i sinoviociti esplicheranno la loro funzione fagocitaria sui batteri che, rompendosi, libereranno i loro enzimi lisosomiali nel versamento articolare. Questi enzimi andranno ad attaccare la matrice cartilaginea provocando danni più o meno gravi, fino ad una vera e propria erosione penetrante.
2.3.1 Alterazioni del liquido sinoviale in corso di artropatie infiammatorie infettive
L’esame del liquido è molto importante perché ci può aiutare a diagnosticare un’artrite settica. Il volume aumenta molto, la torbidità è molto evidente, la viscosità risulta notevolmente diminuita; il colore può variare dal giallo chiaro allo xantocromico fino a divenire addirittura grigio-verde in corso di fenomeni suppurativi.
Il contenuto di glucosio diminuisce tanto che il rapporto con il glucosio ematico può arrivare a valori inferiori a 0,5. Le proteine totali aumentano notevolmente fino a valori 4-5 volte superiori alla norma; anche la conta delle cellule nucleate aumenta molto fino a valori superiori alle 200.000 cellule/ml.
Queste cellule sono per il 90% neutrofili, che presentano numerosi segni di degenerazione, mentre il restante 10% è costituito da cellule mononucleate. A volte è possibile individuare direttamente i batteri o altri agenti eziologici nel preparato citologico con una colorazione di Wright.
(Stephen B.et al., 2001), (Fernandez F.R.et al., 1983).
2.4 Artropatie infiammatorie non infettive immunomediate
Le patologie articolari immunomediate comprendono tutte le patologie, ad eziologia nota e non, in cui le caratteristiche citologiche e istologiche testimoniano un coinvolgimento del sistema immunitario. (Robert L.et al., 2001) Di solito si tratta di poliartriti, raramente di patologie che coinvolgono poche articolazioni o una soltanto.
I meccanismi immunopatogenetici alla base di queste artriti non sono completamente noti, ma sembrano essere coinvolti sia fenomeni autoimmunitari che fenomeni di ipersensibilità di tipo III, dovuti alla formazione di immunocomplessi (Carter S.D.et al., 1989)
Gli immunocomplessi possono formarsi direttamente all’interno dell’articolazione e/o a livello sistemico, e raggiungere solo dopo la localizzazione articolare; in questa sede gli immunocomplessi fissano il complemento a livello della membrana sinoviale e del liquido articolare. La cascata del complemento che si è innescata causa un danno locale al tessuto e libera sostanze ad azione chemiotattica per i polimorfonucleati. Queste cellule migrano in massa all’interno dell’articolazione, dove fagocitano gli immunocomplessi e rilasciano sostanze biologicamente attive che causano ulteriore danno al tessuto.
I fenomeni suddetti, che si hanno nella risposta immunitaria fisiologica volta all’eliminazione di antigeni estranei, nel caso di patologie immunomediate danno origine a un processo che non si interrompe e provoca così danno alle strutture articolari.
Il danno articolare che consegue si può manifestare con una sintomatologia acuta oppure cronica.
In questa seconda eventualità dobbiamo ricercare la causa in una continua o ricorrente presenza dello stimolo antigenico, oppure in qualche fenomeno che coinvolga un’alterazione dei meccanismi di feedback negativo del sistema di difesa immunitaria, che normalmente entrano in gioco una volta che l’antigene è stato eliminato.
In alcuni casi un danno iniziale al tessuto articolare può essere la causa dell’esposizione o dell’alterazione di determinati autoantigeni, con rottura della tolleranza del sistema immunitario e formazione di autoanticorpi. Poiché gli autoanticorpi non possono essere eliminati, ci può essere un’ulteriore formazione di immunocomplessi con l’istaurarsi di uno stato di infiammazione cronica (Bennet D., 2004).
Nelle artropatie infiammatorie del cane si riscontrano in genere molti autoanticorpi come il fattore reumatoide, gli anticorpi antinucleo e quelli anticollagene. Lo stimolo che innesca il meccanismo sopra descritto sembra essere costituito da un agente infettivo, che può essere localizzato in una qualsiasi altra sede del corpo rispetto alle articolazioni, e che stimola la formazione di immunocomplessi circolanti.
E’ possibile che, in seguito ad infezione articolare e successiva eliminazione dell’agente patogeno, si verifichi il persistere dei suoi antigeni in cavità articolare, i quali forniscono una continua stimolazione della risposta immunitaria.
Nel cane e nel gatto sappiamo poco per quel che riguarda la predisposizione genetica a queste patologie; è stato però osservato che patologie articolari immunomediate si ritrovano più comunemente in alcune razze come Spaniel, Pastore Tedesco, Akita inu e altre.
Studi svolti sulle poliartriti canine immunomediate hanno fatto supporre un coinvolgimento del virus del cimurro nell’avvio del processo patologico. Antigeni del cimurro sono stati osservati all’interno dei precipitati di
immunocomplessi rinvenuti in liquidi sinoviali di articolazioni affette dalla patologia, e negli stessi liquidi sinoviali è stata mostrata la presenza di elevati livelli di anticorpi anti-cimurro .In questi studi sul liquido sinoviale la conta cellulare dei polimorfonucleati, indice dell’infiammazione articolare, era direttamente proporzionale con i livelli di anticorpi anti-cimurro. Infine, analisi immunoistochimiche mostravano la presenza di antigeni anti-cimurro all’interno di macrofagi delle articolazioni patologiche studiate (Bennet D., 2004).
Spesso, nella poliartrite, oltre alle manifestazioni locali di infiammazione articolare quali zoppia, tumefazione e dolorabilità, si osservano segni sistemici come febbre, letargia, inappetenza e interessamento di organi e tessuti extra articolari, con dermatiti, glomerulonefriti, meningiti, miositi, anemia. Animali affetti da poliartrite spesso sono portati alla visita per una febbre di origine sconosciuta. In alcuni casi non è evidenziabile clinicamente il coinvolgimento articolare.
Le artropatie immunomediate sono divise in due categorie, quelle erosive e quelle non erosive, a seconda che il quadro radiografico presenti o meno segni di distruzione ossea.
Tuttavia, dato che la patogenesi è spesso la stessa, è possibile che in realtà si tratti solo di espressioni diverse di una stessa patologia, e che la diversa manifestazione clinica dipenda dal soggetto in causa (Bennet D., 2004), (Robert L.et al., 2001)
2.4.1- Alterazioni del liquido sinoviale in corso di artropatie infiammatorie immunomediate
Per fare diagnosi di poliartrite immunomediata è necessario eseguire artrocentesi da più articolazioni, anche se clinicamente apparentemente indenni, ed esaminare le cellule presenti.
In corso di tali patologie il liquido sinoviale si presenta generalmente aumentato di volume, torbido, con un colore alterato e viscosità diminuita. La conta cellulare appare aumentata e la popolazione di cellule che appare predominante è costituita da granulociti neutrofili.
Per la maggior parte queste cellule non presentano alterazioni picnotiche, diversamente da quanto osservato in corso di artriti settiche (Robert L.et al., 2001).Nelle patologie croniche si osserva la presenza di un numero più elevato di cellule mononucleate, che possono arrivare a costituire la popolazione predominante nel campione.
Questo possiamo dire essere il quadro citologico “di base” a cui possono aggiungersi caratteristiche peculiari delle diverse patologie, come la presenza delle già citate cellule LE nel Lupus Eritematoso Sistemico, e dei ragociti nell’artrite reumatoide.
Queste cellule, che rappresentano neutrofili modificati, se messe in evidenza nei preparati citologici sono fondamentali per l’identificazione del particolare tipo di artropatia immunomediata in corso. (Bennet D., 2004), (Robert L.et al., 2001)
Quanto detto fino adesso mostra come l’esame citologico del liquido sinoviale sia un aiuto prezioso nella formulazione della diagnosi in corso di
Tuttavia, l’analisi microscopica non permette la differenziazione delle diverse popolazioni cellulari presenti nel campione, lasciando dei dubbi nella classificazione di elementi che presentano caratteristiche morfologiche simili.
I linfociti, ad esempio, possono talvolta essere confusi con i sinoviociti o con macrofagi non attivati, con il rischio di non effettuare la stima corretta delle popolazioni presenti nel campione
Capitolo 3
I RADICALI LIBERI
I radicali liberi son definiti come atomi o raggruppamenti di atomi aventi, negli orbitali esterni, uno o più elettroni spaiati, indipendentemente dalla carica elettrica espressa. La natura dell’atomo al quale appartiene l’orbitale con l’elettrone spaiato costituisce uno dei criteri delle specie reattive.
La capacità delle specie chimiche reattive di ossidare, cioè di sottrarre uno o più equivalenti riducenti ad un gran numero di atomi (Iorio E.L., 2004), spiega l’attitudine di tali agenti ad indurre un danno ossidativo a carico di componenti strutturali e/o funzionali degli organismi viventi.
In ambito biologico esiste un gran numero di specie reattive che derivano dal metabolismo cellulare a vari livelli,
ma senza dubbio quelle di maggior interesse sono quelle contenenti ossigeno, conosciute come ROS (reactive oxygen specie).
L’ossigeno, elemento tra i più importanti della materia vivente, è direttamente coinvolto nei meccanismi di sintesi energetica alla base della sopravvivenza degli organismi aerobi viventi.
Le cellule eucariote aerobie usano l’ossigeno molecolare come accettore finale di elettroni nella catena respiratoria mitocondriale; in questo processo circa il 5% (Ogino T.et al., 1999) dell’ossigeno viene convertito in radicali liberi.
Le specie reattive, oltre che esito fisiologico di alcuni processi metabolici stimoli, come radiazioni ionizzanti, elevate tensioni di ossigeno, sostanze chimiche di varia natura. Oltre ai ROS ci sono anche altri radicali liberi di interesse biologico, tra cui quelli incentrati sul carbonio, sull’azoto, sul cloro e sullo zolfo.
La tossicità dei radicali liberi è legata alla loro reattività, dovuta alla loro tendenza ad esistere come entità aventi gli elettroni disposti in coppie, alla loro emivita brevissima (10-9 secondi); e alla diffusione a breve distanza nell’ambiente circostante.
Ne deriva che, tanto più un radicale è reattivo, tanto più tenderà a raggiungere la propria stabilità strappando elettroni a qualsiasi altra specie chimica con la quale verrà a contatto, ossidandola.
Questo può innescare reazioni a catena che determinano la formazione di altri radicali liberi che possono danneggiare irreversibilmente le diverse strutture cellulari (Krhre J., 1993).
3.1 Le specie reattive di maggior interesse biologico
Tabella 1 Forme dell’ossigeno presenti negli organismi viventi
Tra le specie reattive dell’ossigeno, l’ossigeno singoletto rappresenta una varietà radicalica che origina dall’eccitazione dell’ossigeno molecolare per assorbimento di una certa quota di energia, che comporta una transizione all’orbitale più esterno, o una loro inversione all’orbitale più esterno, o una loro inversione di spin. Il nuovo stato dell’ossigeno si comporta come un radicale libero estremamente reattivo, in grado di attaccare e danneggiare molecole ad alta densità elettronica, quali gli acidi grassi polinsaturi (come
SPECIE REATTIVE DELL’OSSIGENO: Radicaliche
radicale idrossilico OH•
radicale superossido O2
•
-radicale ossido nitrico NO•
radicale perossido lipidico LOO•
Non radicaliche
perossido di idrogeno H2O2
ossigeno singoletto
acido ipocloroso HOCL
L’anione perossido risulta dall’addizione, ad una molecole di ossigeno, di un elettrone, il quale può provenire da diverse vie metaboliche.
Una volta generatosi, l’anione perossido può andare in contro alla reazionedi Fenton, generando il radicale molto istolesivo idroperossido, oppure dismutare a perossido di idrogeno, meno tossico.
Il radicale idrossile, molto istolesivo, può derivare da numerose reazioni, tra le quali la catena respiratoria, la fotolisi dell’acqua, la decomposizione del perossido di idrogeno e la reazione dell’ozono con i nitriti.
Infine il perossido di idrogeno viene generato soprattutto attraverso meccanismi di tipo enzimatico, e per via enzimatica è generalmente inattivato o dà luogo alla formazione di specie chimiche più ossidanti. È da ricordare che le specie reattive dell’ossigeno possono attaccare qualsiasi substrato organico, generando specie reattive secondarie (metaboliti reattivi dell’ossigeno).
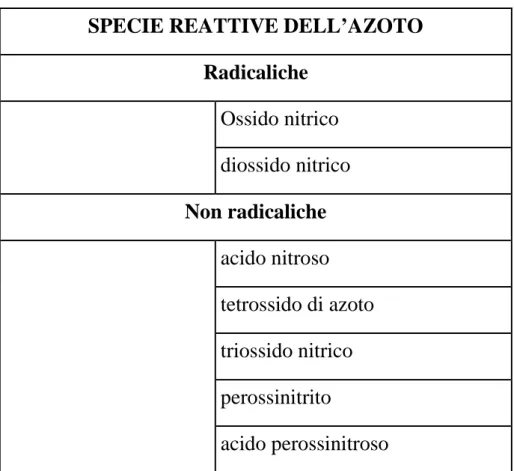
SPECIE REATTIVE DELL’AZOTO Radicaliche Ossido nitrico diossido nitrico Non radicaliche acido nitroso tetrossido di azoto triossido nitrico perossinitrito acido perossinitroso
Tabella 2 Forme dell'azoto reattivo presenti negli organismi viventi
L’ ossido nitrico viene prodotto a partire dall’aminoacido L-arginina, in
una reazione catalizzata dall’enzima ossido nitrico sintetasi (NOS) il quale ha due domini ad azione catalitica, uno reduttasico e uno ossigenasico, e richiede come cofattore NADPH e pteridina ridotta.
L’ossido nitrico agisce come importante messaggero intra e intercellulare, regolando molte funzioni, e gioca un ruolo determinante nella difesa dalle infezioni batteriche e nella prevenzione dei tumori. Possedendo elettroni spaiati nell’orbitale più esterno è considerato una specie chimica radicalica e quindi reagisce rapidamente con altre specie aventi elettroni spaiati.
dell’NO e innesco di effetti tossici, con alterazioni cellulari funzionali e/o strutturali.
L’NO, essendo un radicale libero, può anche svolgere un’attività antiossidante, e la prevalenza di una o dell’altra azione dipende dalle concentrazioni relative delle singole specie reattive implicate.
3.2 Processi chimici e biologici che danno origine ai radicali liberi
Le specie chimiche reattive possono essere generate attraverso meccanismi enzimatici e non enzimatici. Una volta formatesi queste, possono dare inizio ad un processo propagativo caratterizzato da una serie di reazioni a catena nel corso delle quali il sito radicalico può essere trasferito o inattivato.
Origine specie radicaliche:
L’origine dei radicali può avvenire o per scissione omolitica o per interazione con metalli di transizione.
Scissione omolitica: Si assiste alla divisione di una molecola, a livello di
uno dei suoi legami covalenti, per effetto della somministrazione di energia, con la generazione di due nuove specie chimiche, ciascuna con un elettrone spaiato tipico dei radicali. Un esempio è la radiolisi o la fotolisi dell’acqua, che genera un atomo di idrogeno e un radicale idrossile.
Interazione con i metalli di transizione: Un altro meccanismo che ci porta
alla formazione di radicali liberi è l’interazione di molecole con metalli di transizione (Fe2+, Fe3+, Cu2+, Zn2+, Mn2+…). Dobbiamo ricordare che quasi tutti gli enzimi conosciuti richiedono la presenza di ioni metallici per esprimere la propria attività catalitica.
Gli ioni metallici partecipano a reazioni di ossido-riduzione modificando in modo irreversibile il loro numero di ossidazione; si ottengono così elettroni in grado di spezzare il legame covalente di una molecola bersaglio, che si separa in un radicale libero e in un anione. Il metallo di transizione può anche ridursi in forma ionica richiedendo un elettrone, che viene estratto dal legame covalente di una molecola che si separa in un radicale libero e in un catione.
Tra i metalli di transizione, una notevole importanza biologica è rivestita dal ferro.
Nella reazione di Haber Weiss si osserva che, a partire da un radicale perossido e dal perossido di idrogeno derivato dalla propria dismutazione (reazione intramolecolare nella quale avviene un’ossido-riduzione interna, con la formazione di due distinti prodotti da un unico substrato), si ottiene una molecola di radicale idrossilico (HO●) ad alto potere ossidante.
H
2O
2+ O
2HO
•-= OH
•+ OH
-+ O
2Questa reazione è poco veloce, in modo tale da precludere una rilevanza biologica.
Il ferro è in grado di catalizzare la reazione con un meccanismo che è stato descritto per la prima volta da Fenton.
Lo ione ferroso (Fe2+), ossidandosi a ferrico (Fe3+), cede il suo elettrone ad una molecola di perossido di idrogeno (H2O2) scindendo uno dei legami
covalenti, generando un radicale libero (il radicale idrossilico HO•) e un anione, ione ossidrile (Verna F. et al., 2005).
A sua volta lo ione ferrico si riduce a ione ferroso strappando un elettrone da una seconda molecola di perossido di idrogeno, che è scissa in un radicale libero (un radicale peridrossile HOO•) e un catione (uno ione idrogeno).
O2
•-+ Fe
3+= Fe
2++ O2
H
2O
2+ Fe
2+
= OH
•+ OH
-+ Fe
3+Negli organismi superiori, il ferro non è mai ferro libero o debolmente legato; esso viene trasportato nello stato ferrico dalla transferrina, in un complesso difficilissimo da ridurre. Allo stesso modo viene depositato nello stato ferrico mediante la ferritina, proteina ubiquitaria nei tessuti e nel plasma.
Il radicale in grado di ridurre allo stato ferroso il ferro legato alla ferritina, che viene poi rilasciato, è il radicale superossido. E’ questo ferro, liberato dalla produzione patologica di superossido, che è in grado di catalizzare la reazione di Haber Weiss. Il radicale idrossilico così prodotto può iniziare la perossidazione lipidica, che porta alla modificazione strutturale e funzionale delle membrane o può attaccare macromolecole e causare rotture del DNA. Se il ferro liberato può esacerbare la parte di danno tissutale dovuta alla produzione di radicali liberi, ha senso chiedersi se lo stato nutrizionale del ferro corporeo possa essere un fattore predisponente nelle patologie legate allo stress ossidativo (Flora S.J.et al., 2007),
Propagazione della specie radicalica:
Una volta che una reazione radicalica a catena viene innescata questa tende a propagarsi attraverso alcuni meccanismi, tra cui quello più comune è caratterizzato dal trasferimento del sito radicalico ad una molecola alla quale viene sottratto uno dei suoi atomi. Con questo meccanismo, ad esempio, il radicale ossidrile (HO●), attaccando una molecola organica (R-H), strappa a questa un atomo di idrogeno, generando, accanto ad una molecola d’acqua, un radicale alchilico (R●) (Iorio E.L., 2004).
HO
●+ R-H = H2O + R
●Interruzione della propagazione radicalica:
Una reazione a catena può arrestarsi per disproporzione o per combinazione, in cui si assiste alla reazione tra due radicali liberi che, interagendo, danno origine ad una molecola non più reattiva. Così il primo radicale agisce da ossidante, mentre il secondo da antiossidante.
Nei processi metabolici cellulari vengono continuamente generate specie chimiche reattive, ma la loro sintesi può essere incrementata da numerosi fattori esogeni di varia natura.
3.3 Siti fisiologici di formazione delle specie radicaliche
In questo capitolo esamineremo più nel dettaglio i diversi comparti cellulari che rappresentano siti di sintesi dei radicali liberi.
I mitocondri sono la fonte primaria di ROS perché, sulle loro
creste, sono situati i complessi enzimatici della catena respiratoria deputati alla fosforilazione ossidativa. Negli organismi aerobi gli elettroni provenienti da molecole energetiche ridotte vengono
rappresenta energia libera la quale viene conservata e poi usata per la produzione di ATP.
Gli elettroni rilasciati dall’ossidazione del glucosio vengono trasferiti a coenzimi NAD+ (nicotamide adenin di nucleotide) e FAD (flavin adenin di nucleotide), trasportatori di elettroni e, da questi, passano poi ad una catena di trasporto di elettroni attraverso una serie di ossido- riduzioni. Infine, per azione del citocromo C ossidasi, si ha l’ossidazione di quattro molecole di citocromo C e la riduzione di una molecola di O2 con produzione di ATP e
H2O.
Tale processo però è soggetto ad una certa percentuale di errore, in seguito alla quale una quota di elettroni (1-2%) sfugge al sistema di trasporti dei coenzimi e reagisce direttamente con l’ossigeno molecolare, generando un anione superossido (nel caso sia trasferito all’ossigeno un solo elettrone) e/o perossido di idrogeno (nel caso di aggiunta di un altro elettrone).
In caso di fosforilazione ossidativa la produzione di radicali liberi avviene senza l’intervento di enzimi.
Questi metaboliti dell’ossigeno, molto reattivi, hanno un ruolo importante nel determinare il danno tissutale in corso di diverse situazioni patologiche (Van Holde M., 1998). La quantità di superossido prodotta dai mitocondri aumenta con la concentrazione dell’ossigeno nell’organismo
(es. nell’iperventilazione), in caso di ridotta efficienza della catena respiratoria in cui il flusso di elettroni è limitato dalla mancanza di substrato da fosforilare (assenza di ADP e presenza di substrato e ossigeno), o per azione di tossici e agenti disaccoppianti la fosforilazione ossidativa che riducono l’utilizzo dell’ossigeno.
uccidono i microrganismi, mostrano una esplosione del consumo di ossigeno non mitocondriale, dovuta alla produzione di perossido di idrogeno.
Nella membrana di queste cellule sono localizzati diversi enzimi come la NADPH ossidasi e le lipossigenasi, la cui attivazione si accompagna alla produzione, rispettivamente, di anione superossido e di intermedi metabolici con caratteristiche simili ai perossidi. Il ruolo battericida dei radicali e dei loro metaboliti (H2O2 e HOCl) si basa su di una NADPH
ossidasi (l’unico enzima dell’organismo a produrre superossido in modo non casuale ma programmato), che catalizza la formazione di anione superossido da NADPH(H+) e ossigeno molecolare, in seguito a stimolazione specifica dei polimorfonucleati da parte di endotossine, batteri, anticorpi,ecc.
La produzione dei ROS a livello della membrana plasmatica dei PMN avviene in corso di processi reattivi (infezioni, immunoreazioni patogene, infiammazioni, allergie), ed i segni tipici della flogosi sono i risultati dell’attivazione radicalica dei neutrofili richiamati in situ.
Questo meccanismo è molto importante tanto che l’incapacità genetica a produrre superossidi causa la condizione nota come malattia granulomatosa cronica, nella quale i neutrofili hanno grosse difficoltà a uccidere i microrganismi fagocitati, con il risultato di infezioni ricorrenti e spesso setticemie.
Anche i perossisomi rappresentano una fonte importante di ROS. In questi organuli cellulari avviene un particolare processo di ß ossidazione degli acidi grassi in cui la flavoproteina estrae una coppia di atomi di idrogeno da una molecola di acido grasso attivato
Nel reticolo endoplasmatico la produzione di specie reattive passa attraverso il citocromo P450, il quale agisce come donatore immediato di elettroni in molte reazioni di idrossilazione, in particolare quelle che avvengono all’interno degli epatociti e che sono finalizzate all’inattivazione di ormoni e composti non fisiologici come gli xenobiotici.
3.4 Sintesi di radicali liberi nei processi reattivi
Da quanto scritto sopra è chiaro che i ROS rappresentano intermedi obbligati del metabolismo e, in alcuni casi, la loro produzione rappresenta un passaggio essenziale per l’esplicazione di importanti meccanismi fisiologici.
3.4.1 Produzione di radicali liberi in corso di flogosi:
In ogni distretto cellulare la produzione di specie reattive ha una sua specifica funzione non solo nel fisiologico metabolismo, ma anche nei processi reattivi, quali infezioni e infiammazioni, e in particolare per quanto riguarda i radicali liberi prodotti a livello della membrana dei PMN. Questo tipo di attività immunologica si estrinseca non solo nei confronti di componenti estranei, ma anche contro componenti self quali tessuti o organi trapiantati (reazioni di rigetto), e nei processi di guarigione di organi e tessuti traumatizzati. Accade che i leucociti migrino nelle aree lese, si attivino, inizino a bombardare le cellule danneggiate con i radicali liberi i quali accelerano la loro distruzione, l’allontanamento dei prodotti di lisi e il
Poiché i PMN sono coinvolti in quasi tutti i processi patologici, indipendentemente dal meccanismo patogenetico e poiché i PMN rappresentano la fonte maggiore di produzione dei radicali liberi, quest’ultimi sono comuni a tante patologie.
3.5 Fattori esterni nella genesi dei radicali liberi
La produzione di radicali liberi è influenzata anche da fattori esterni quali agenti fisici, chimici e biologici, da soli o in combinazione tra loro.
Questi possono indurre direttamente la generazione di ROS o aumentarne la fisiologica produzione attraverso una specifica stimolazione metabolica. Tra gli agenti fisici segnaliamo:
le radiazioni ionizzanti raggi UV
Entrambi possono indurre il fenomeno della scissione omolitica dell’acqua, nella quale l’acqua assorbe energia e la utilizza per scindere uno dei suoi legami covalenti con l’idrogeno: i prodotti saranno due radicali liberi, il radicale idrossile e l’atomo di idrogeno. Tenendo conto che gli esseri viventi sono costituiti per la maggior parte di acqua, e che sono costantemente esposti ai raggi solari, si capisce come tale fonte di produzione di radicali liberi sia determinante.
Tra gli agenti chimici in grado di produrre ROS, si ricordino:
l’ozono, che genera direttamente radicali perossidrilici per interazione con composti fenolici
gli idrocarburi aromatici policiclici, che attivano il sistema del citocromo P450 e quindi la produzione di radicali.
Agenti biologici che tipicamente aumentano la produzione di radicali sono: i batteri, nell’ambito del fisiologico processo di difesa dalle infezioni
taluni anticorpi, nell’ambito di alcune reazioni immunopatogene (in questi casi sono chiamati in causa i PMN).
Infine è necessario tener presente che si ha aumento dei ROS anche in corso delle seguenti situazioni:
• intenso sforzo muscolare
• in corso di flogosi
• in corso di ischemia/riperfusione
3.6 Agenti antiossidanti
Nel corso del tempo, le specie viventi hanno sviluppato un insieme di meccanismi di difesa nei confronti delle specie reattive ossidanti. Si tratta di agenti antiossidanti chimicamente eterogenei (enzimi, vitamine, oligoelementi) in grado di prevenire o annullare l’azione ossidante delle specie chimiche reattive.
Il sistema di difesa è distribuito nell’organismo sia a livello extracellulare che intracellulare.
Nel plasma si trova la cosiddetta barriera antiossidante rappresentata dall’insieme delle sostanze potenzialmente in grado di cedere equivalenti riducenti così da stabilizzare i radicali liberi.
Ne fanno parte tutte le proteine e in particolar modo, l’albumina, la bilirubina, l’acido urico, il colesterolo e i vari antiossidanti esogeni introdotti con l’alimentazione. Molto importanti sono i gruppi tiolici.
Un antiossidante ideale dovrebbe:
• legare i radicali in modo specifico;
• chelare metalli riducenti;
• interagire con altri antiossidanti: alcuni antiossidanti sono capaci di rigenerare altri antiossidanti recuperandone la funzione originale. Questo processo è chiamato “antioxidant network” (Sies H. et al., 2005);
• avere un effettivo positivo sull’espressione genica
• essere presente nei tessuti e nei fluidi biologici in concentrazioni fisiologicamente rilevanti;