CAPITOLO 2: GLI ENZIMI ISTONE DEACETILASI (HDAC)
2.1. STRUTTURA DELLA CROMATINA E CODICE ISTONICO
Nel nucleo delle cellule eucariote il genoma è impaccato in una ordinata quanto complicata superstruttura chiamata cromatina. La cromatina è formata da DNA, avvolto su gruppi di proteine basiche dette istoni, che formano il nucleosoma, e da proteine non-istoniche.
Le proteine non istoniche, proteine neutre o acide, sono legate poco stabilmente al DNA e possono avere funzione strutturale nella formazione dei cromosomi (contribuiscono al mantenimento della struttura della cromatina o della conversione di questa dallo stato decondensato allo stato altamente compatto), oppure sono enzimi coinvolti nella sintesi e trascrizione del DNA.
Gli istoni sono proteine tipiche degli organismi eucarioti, anche se alcuni tipi di cellule eucariotiche ne sono prive; sono assenti, al contrario, nei procarioti, eccetto alcuni gruppi. Sono una delle famiglie di proteine evolutivamente meglio conservate in tutti gli eucarioti. Sono carichi positivamente poiché posseggono un gran numero di amminoacidi con catena laterale basica, soprattutto lisina ed arginina, che interagiscono con il DNA, che è carico negativamente per l'abbondanza di gruppi fosfato, per formare strutture dette nucleosomi [6].
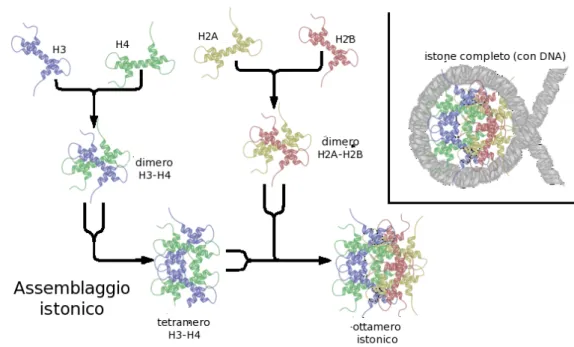
sua funzione è quella di compattare il DNA all'interno del nucleo cellulare. È costituito da nove molecole istoniche, e dal DNA che si avvolge attorno ad esse in modo sinistroso per 1,65 giri corrispondenti a 146 coppie di basi, che interagiscono con gli istoni tramite legami ad idrogeno.
Le nove molecole istoniche sono costituite da un istone H1, e da un ottamero formato a sua volta da: due istoni H2a, due H2b, due H3 e due H4. Nell'assemblaggio dell'ottamero istonico prima si formano i dimeri, H3-H4 e H2a-H2b, poi due dimeri H3-H4 si combinano tra loro formando un tetramero e infine ciascun tetramero si combina con due dimeri H2a-H2b (Figura 1).
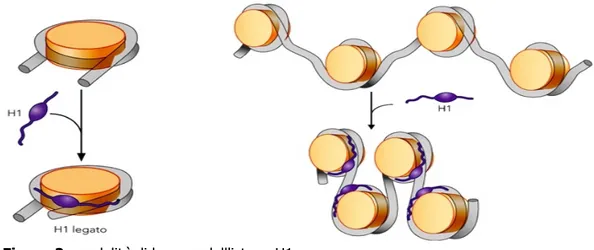
L'istone H1 funziona da linker e permette l'assemblaggio della cromatina ad un livello di organizzazione successivo e più complesso (Figura 2).
Esistono infatti diversi livelli di organizzazione della cromatina.
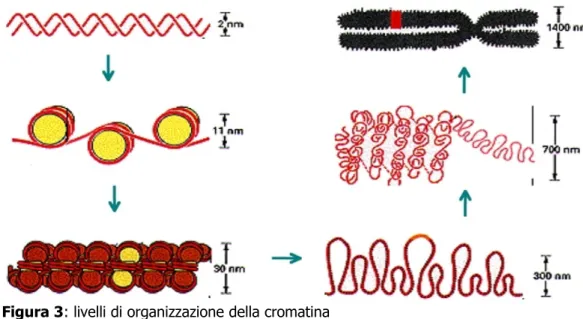
Il primo livello è lo stadio detto "filo a collana di perle” per il suo aspetto, costituito da una fibra di 11 nm di diametro. In tale fibra il DNA è avvolto attorno ai nucleosomi, intervallati l'uno dall'altro da un tratto di DNA linker di lunghezza variabile da poche coppie a circa 80 nucleotidi, senza ulteriori ripiegamenti. La formazione dei nucleosomi converte una molecola di DNA in un filo di cromatina lungo circa un terzo della lunghezza iniziale. Questo stadio non necessita della presenza dell'istone H1.
Il secondo livello è la fibra da 30 nm di diametro, in esso la cromatina assume un aspetto sinusoidale grazie alle interazioni che gli istoni H1 formano fra di loro; è lo stadio in cui si trova la cromatina attiva in interfase, periodo compreso fra due divisioni cellulari, quando cioè, la cromatina viene
trascritta. La fibra si avvolge su se stessa, con una periodicità di 6 nucleosomi per ogni giro.
Il terzo livello è quello della “fibra ad ansa” cioè la fibra da 300 nm di diametro, in questo stadio la cromatina si ripiega ulteriormente su se stessa grazie anche all'aiuto di altre proteine.
Il quarto livello è la formazione dei cromatidi: la cromatina si superavvolge in una fibra da 700 nm di diametro.
Il quinto ed ultimo livello sono i cromosomi metafasici; è il livello di condensazione massimo che costituisce la fibra da 1400 nm di diametro (Figura 3)
Gli istoni ed i nucleosomi da loro formati, non vanno pensati come entità completamente passive le cui funzioni sono puramente strutturali. Gli istoni infatti sono soggetti ad un gran numero di modificazioni post-traduzionali.
Ciascun istone dell'ottamero presenta una lunga coda N-terminale che si estende fuori dal nucleosoma; queste code possono subire numerose modificazioni facilitando la trascrizione di un gene oppure contribuendo alla sua inibizione. Sono note molte modificazioni post-traduzionali che interessano gli istoni: acetilazioni e deacetilazioni su residui di lisina, metilazioni su residui di arginina e di lisina, ad opera della istone metiltransferasi o HMT; ulteriori modificazioni comprendono: fosforilazioni su residui di serina e treonina, l'attacco di ubiquitina, in genere tutte reversibili. È ormai evidente l'esistenza di un vero e proprio "codice istonico", questo stabilisce, ad esempio, quali siano le regioni di DNA accessibili dall'apparato trascrizionale, ed è quindi di fondamentale importanza nei meccanismi di regolazione dell'espressione genica. Tale regolazione è permessa in parte anche dalla capacità dei domini delle proteine associate alla cromatina, di riconoscere i residui istonici modificati; fatto che, successivamente, comporta il reclutamento di altri complessi proteici che influenzano l'accessibilità alla cromatina stessa e di conseguenza regolano l'attività genica.
Insieme al “codice del DNA” il “codice istonico” crea una grande rete di interazioni che permettono di regolare finemente l'espressione genica secondo le varie necessità della cellula [7].
Un ruolo importante è svolto dagli enzimi istone acetiltransferasi (HAT) e istone deacetilasi (HDAC) responsabili rispettivamente della acetilazione e deacetilazione di specifici residui di lisina con la conseguente e rispettiva
attivazione ed inibizione della trascrizione. La funzione degli HDAC verrà trattata in modo più specifico nei capitoli successivi essendo l'argomento principale di questa discussione.
2.2. CLASSIFICAZIONE DEGLI HDAC E LORO STRUTTURA GENERALE [6]
Gli HDAC svolgono molte funzioni fisiologiche e la loro azione è ben lontana dall'essere completamente chiarita, tuttavia la relazione tra le anomalie della loro funzionalità e l'origine di tumori ha motivato il crescente interesse verso questi enzimi e di conseguenza anche verso i loro inibitori.
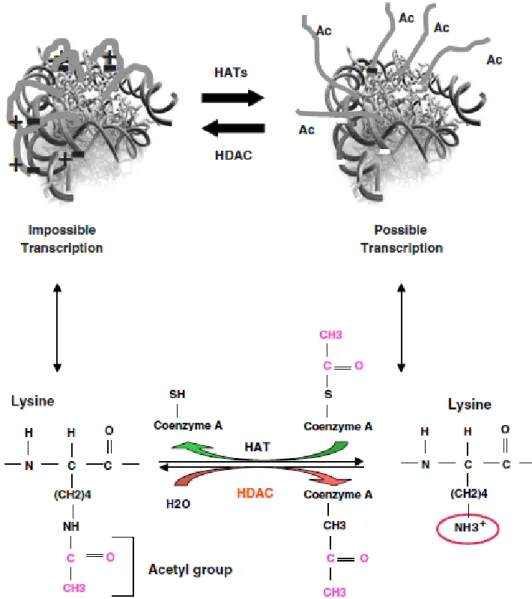
Gli HDAC si trovano in batteri, funghi, piante ed animali e sono componenti di complessi multiproteici contenenti anche altre proteine coinvolte nell'inibizione della trascrizione genica. Appartengono alla famiglia delle metalloproteasi che rimuovono i gruppi acetilici dagli ε-amino gruppi dei residui di lisina presenti all'interno delle estensioni N-terminali degli istoni nucleosomali. L'idrolisi dei gruppi acetilici ha come effetto un aumento di densità della carica positiva sui gruppi N-terminali degli istoni, rafforzando le interazioni con le cariche negative del DNA e bloccando l'accesso al meccanismo di trascrizione dello stampo del DNA (Figura 4).
La deacetilazione degli istoni nucleosomali gioca un ruolo importante anche in altre funzioni del genoma come l'assemblaggio della cromatina, la riparazione e la ricombinazione del DNA. Numerose altre proteine non istoniche si sono
rivelate come il substrato degli HDAC compresi fattori di trascrizione, proteine citoscheletriche ed alcuni importanti fattori nucleari. Questo espande e complica le funzioni degli HDAC e indica che la regolazione della loro attività può essere utile in molte terapie come cancro, infezioni virali, malattie neurodegenerative, infiammazioni, etc...
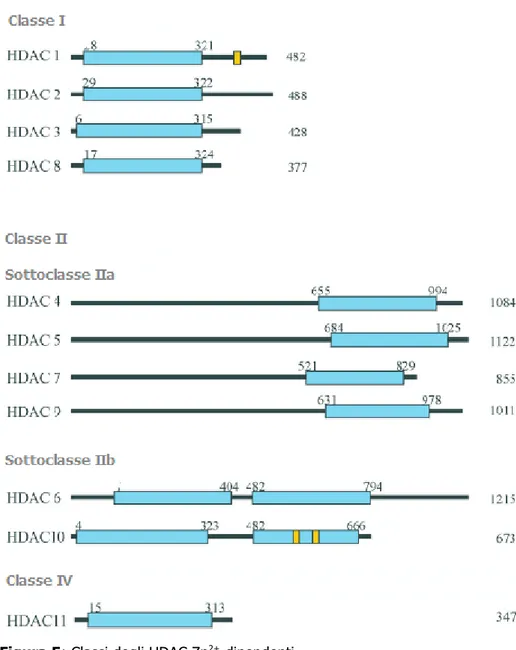
Finora sono stati identificati diciotto tipi di HDAC suddivisi in quattro classi principali (classe I, II, III e IV) in base alle loro analogie con gli HDAC del lievito Saccharomyces cerevisiae (RPD3 per le classi I/IV, HDA1 per la classe II e SIR2 [=Silent Information Regulator 2] per la classe III).
La Classe I degli HDAC comprende gli HDAC 1, 2, 3 e 8; questi enzimi sono prevalentemente nucleari, ubiquitariamente espressi e funzionano come corepressori della trascrizione.
La Classe II degli HDAC comprende gli HDAC 4, 5, 6, 7, 9 e 10; è ulteriormente suddivisa in due sottoclassi IIa (HDAC 4, 5, 7 e 9), in cui è presente un solo dominio deacetilasico, e IIb (HDAC 6 e 10), in cui ne sono presenti due. Questi enzimi fanno da spola tra il nucleo ed il citoplasma in risposta a determinati segnali cellulari; gli HDAC della classe IIb hanno una maggiore localizzazione citoplasmatica e, a differenza degli HDAC di classe I, sono presenti solo in alcuni tipi di cellule. Gli enzimi della classe IIa si trovano prevalentemente nel cuore, nella muscolatura scheletrica e nel cervello; quelli della classe IIb prevalentemente nella milza, nel rene e nel fegato, svolgendo funzioni distinte coinvolte nella differenziazione e nello sviluppo dei processi cellulari.
La Classe IV degli HDAC, recentemente scoperta, comprende il solo HDAC 11 che presenta caratteristiche simili agli HDAC di classe I e II, ma non tali da includerlo in tali classi.
fanno parte sono tutti Zn2+-dipendenti. (Figura 5)
Nettamente diversa è invece la Classe III degli HDAC: gli enzimi di questo gruppo sono le Sirtuine strutturalmente e funzionalmente distinte dagli altri HDAC perché NAD+-dipendenti. Sono enzimi che hanno differenti
localizzazioni cellulari: citoplasmatica, mitocondriale e nucleare e sono strutturalmente e meccanicisticamente distinte dagli altri HDAC.
2.2.1. SIRTUINE [7]
Le sirtuine contengono un dominio catalitico di circa 300 amminoacidi, altamente conservato, che catalizza una reazione che richiede NAD+ come cofattore. Il meccanismo di reazione di questi enzimi si può
schematizzare in una reazione che comprende due momenti distinti. Il primo, è la scissione del legame glicosidico nicotinammide-ribosio del NAD+, il rilascio di
nicotinammide e la formazione di un intermedio immido-peptidico; il secondo è il trasferimento del gruppo acetilico dal substrato all'ADP-ribosio con la formazione di O-acetil-ADP-ribosio.
Riguardo alla loro funzione si può accennare brevemente che questa classe di enzimi è implicata in reazioni cellulari che coinvolgono i telomeri e il DNA ribosomale. SIR2 ed i suoi omologhi hanno ottenuto una considerevole attenzione per la capacità di imitare, la dieta nota come “restrizione calorica” che aumenta le aspettative di vita in molti organismi, compresi i primati. Gli enzimi SIR2-like hanno proprietà deacetilasiche anche nei confronti di proteine non istoniche, fra cui il fattore p53. È stato anche chiarito che, gli enzimi umani (SIRT1), sono coinvolti in altri vari processi fisiologici importanti come la risposta infiammatoria, il metabolismo degli acidi grassi, la sopravvivenza cellulare; per cui trovare molecole che modulano questi enzimi è considerato dagli studiosi un nuovo approccio al trattamento delle patologie correlate.
2.2.2. HDAC Zn2+-DIPENDENTI [6].
Dai numerosi studi condotti, attualmente la struttura degli HDAC risulta essere ben definita. Le prime informazioni strutturali sugli HDAC derivano dagli studi condotti sulla struttura cristallina della HDLP (= istone deacetilasi proteina simile, presente nel batterio Aquifex aelicus), complessata con il SAHA e trichostatin A (TSA), farmaci suoi inibitori. Un altro importante passo avanti nella definizione della struttura degli HDAC è stato fatto nel 2004, da due gruppi di studio che hanno pubblicato, indipendentemente l'uno dall'altro ma raggiungendo risultati simili, la struttura dell'HDAC8 umano cocristallizzato con cinque differenti inibitori.
Si deve precisare che, generalmente, gli HDAC non si trovano mai come singoli monomeri, fatta eccezione per l'HDAC8, ma formano generalmente grossi complessi multiproteici dove diversi sottotipi sono associati con specifici coregolatori o con altri enzimi modificatori della cromatina.
Dallo studio della struttura cristallina dell'HDAC8 e dalla sua comparazione con l'HDLP, è emerso che, nonostante le grosse differenze tra i vari tipi di HDAC, esiste in tutti un dominio catalitico estremamente conservato che probabilmente è alla base del loro meccanismo d'azione.
La struttura generale di un HDAC comprende un singolo dominio compatto α/β, che comprende otto foglietti β centrali, situati tra le α eliche
negli elementi della struttura secondaria e l'altra metà forma loops che congiungono i vari elementi di questa struttura.
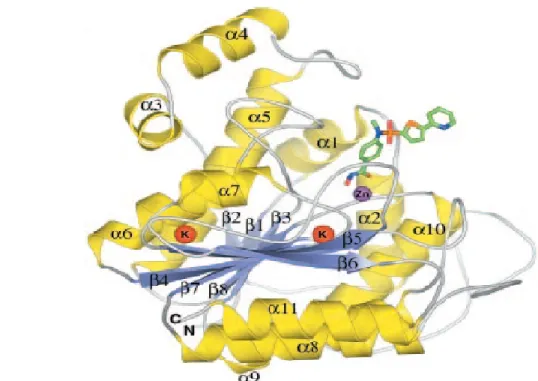
Il sito attivo dell'enzima consiste in un tunnel lipofilo lungo circa 12 Å, in fondo al quale si trova il sito catalitico. Durante la deacetilazione il tunnel è presumibilmente occupato dai quattro gruppi metilenici delle lisine acetilate, mentre nelle interazioni con gli HDACi il tunnel è occupato dalle catene idrofobiche degli inibitori. Le pareti del tunnel sono formate da Phe152, Phe208, His180, Gly151, Met274 e Tyr306. Questi residui sono propri della classe I, fatta eccezione per la Met274 che è sostituita dalla leucina in tutte le altre classi. Le due fenilalanine sono parallele tra loro e formano una sorta di alloggiamento, sito di interazione di alcuni HDACi (Figura 6).
Figura 6: struttura dell'HDAC8 umano complessato con un suo ipotetico inibitore. L'inibitore
è rappresentato schematicamente (rosso per l'ossigeno, blu per l' azoto, arancione per lo zolfo e verde per il carbonio).
Alla fine del canale è presente lo ione Zn2+, il centro del sito catalitico; lo Zn2+
è penta-coordinato con tre siti occupati da Asp178, His180 e Asp267 e con altri due siti occupati dagli ossigeni della porzione acetilica e dell'acqua presente normalmente nel substrato.
Recentemente è stata evidenziata una tasca sotto il sito attivo dell'enzima che può essere il bersaglio selettivo per alcuni tipi di inibitori di HDAC (ad esempio HDAC 3, ma non HDAC 1 e 2).
Confrontando la struttura complessiva dell'HDAC8 con la HDLP è stato messo in evidenza che, le maggiori differenze di struttura tra i vari HDAC risiedono invece nei loops, in particolar modo il loop L1 sembra importante nella specificità di substrato. Il loop L1 delinea una larga porzione su una parete del sito attivo e si estende fino alla superficie della proteina. Questo comporta un aumento della larghezza del sito attivo vicino alla sua apertura, rispetto agli HDLP (simili tra l'altro agli HDAC 1, 2 e 3), rendendo l'HDAC8 capace di idrolizzare molti più substrati rispetto agli altri HDAC della classe I. Queste diversità giocano un ruolo cruciale nella selettività degli HDAC e nella loro interazione proteina-proteina.
Recentemente sono stati studiati HDAC batterici, omologhi degli HDAC6, che hanno chiarito meglio la struttura ed il meccanismo d'azione degli HDAC di classe IIb. La principale differenza strutturale con gli HDAC di classe I consiste nelle regioni del loops specialmente in prossimità dell'apertura del sito attivo confermando l'importanza selettiva di questa regione.
2.3. FUNZIONI SVOLTE DAGLI HDAC
L'esatto ruolo fisiologico degli HDAC nelle cellule non è stato ancora del tutto compreso, ma rimane attualmente, uno dei maggiori campi di studio.
Come per altri vitali regolatori cellulari, la loro attività è strettamente correlata ad una moltitudine di meccanismi tra i quali sono di rilevante importanza, il reclutamento in diversi complessi come corepressori e la modulazione dell'attività deacetilasica. L'attività biologica degli HDAC può essere separata in due aree distinte, ma non sempre indipendenti: l'attività enzimatica, che consiste nella capacità di deacetilare gli istoni o altre proteine non istoniche, e quella funzionale, che comprende la capacità di regolare la trascrizione e altri processi biologici; e non sempre le funzioni biologiche degli HDAC sono legate alla loro funzione enzimatica [8].
La classificazione delle distinte funzioni dei vari membri degli HDAC è stata messa in evidenza usando varie tecniche di indagine biologica, come tecniche di inibizione dell'RNA, esperimenti sui “topi knockout”, oppure farmacologica utilizzando piccole molecole inibitrici. La sperimentazione sui “topi knockout” è il tipo di indagine che ha fornito maggiori
informazioni. Un topo knockout è un topo geneticamente modificato, nel quale uno o più geni sono stati “spenti” attraverso l'aggiunta nel
knockout. Gli studi sui topi knockout rappresentano importanti modelli per studiare il ruolo di geni che sono stati sequenziati, ma hanno funzioni ignote, infatti la comparsa di eventuali anomalie nelle normali funzionalità dell'animale fornisce importanti informazioni circa la funzione svolta dal gene silenziato e dalle molecole derivanti dalla sua traduzione [9].
In tali studi si è notato che la mancata espressione degli HDAC1, causa difetti di proliferazione e ritardo nello sviluppo con conseguente morte embrionale, ciò mette in evidenza l'importanza dell'enzima nella regolazione della crescita cellulare.
La silenziazione del gene codificante l'HDAC2, causa la morte delle cavie nel periodo prenatale, per la comparsa di difetti cardiaci, correlando evidentemente questo enzima alla regolazione delle funzioni cardiache. Anche gli HDAC 5 e 9 sono coinvolti nello sviluppo cardiaco e una loro mancata espressione causa ipertrofia cardiaca.
Infine è emerso che gli HDAC3 sono regolatori critici della mitosi, indipendenti dai processi trascrizionali.
Su cavie da laboratorio prive dell'HDAC4, si manifesta ipertrofia dei condrociti che porta a una formazione ectopica dell'osso. È stato inoltre dimostrato che l'HDAC4 è un mediatore della morte delle cellule neuronali.
L'HDAC7 risulta essere un sistema timo-specifico, inibisce l'espressione del gene Nur77 coinvolto nell'apoptosi e nella regolazione negativa dello sviluppo dei timociti.
L'HDAC6 citoplasmatico risulta appartenere alla categoria degli chaperones molecolari [9]. Questi sono una classe funzionale di famiglie proteiche, la cui
funzione predominante è la prevenzione di associazioni non corrette tra catene polipeptidiche non ripiegate, sia in condizioni fisiologiche che in condizioni di stress. L'azione degli HDAC6 è cruciale per la formazione degli aggresomi [9],
organelli necessari alla rimozione di alcune proteine citoplasmatiche tossiche. L'HDAC6 funziona, inoltre, come enzima specifico che può deacetilare sia la tubulina che i microtubuli e stimolare la motilità cellulare dipendente dai microtubuli stessi, spesso associato agli HDAC di classe III.
L'HDAC10, agisce sia nel nucleo che nel citoplasma dove svolge attività deacetilasica.
L'HDAC8 è stato individuato nelle cellule muscolari lisce umane associato all'actina del citoscheletro con la quale regola la capacità contrattile.
Infine per l'HDAC11, essendo l'ultimo individuato, non è ancora stata chiarita del tutto la funzione svolta [7] [10].
2.4. RUOLO DEGLI HDAC NEL CANCRO [6]
Gli HDAC giocano un ruolo importante nella regolazione della trascrizione dell'espressione genica e nella crescita e proliferazione cellulare, per cui la loro disregolazione può causare molte malattie, tra le quali il cancro è la più temibile. Quando gli HDAC sono sovraespressi o la loro funzione
deacetilasica è aumentata in modo anomalo, si ha uno sbilanciamento dell'equilibrio tra l'acetilazione, dovuta agli HAT e la deacetilazione, in favore di quest'ultima con una conseguente disregolazione dell'espressione genica.
È stato dimostrato che la ipoacetilazione dell'istone H4 è una caratteristica comune nel cancro e che cambiamenti nell'acetilazione dell'istone H4 iniziano precocemente nella genesi tumorale. Inoltre, l'alterata espressione di singoli HDAC è stata evidenziata in molti campioni di tumore. Per esempio la sovraespressione dell'HDAC1 si osserva nei tumori prostatici, al colon e alla mammella; quella dell'HDAC2 nei tumori del colon retto, e gastrici; l'HDAC3 è sovraespresso nei tumori del colon e l'HDAC6 nel carcinoma della mammella. Prove evidenti di laboratorio hanno dimostrato che gli HDAC sono coinvolti nell'arresto del ciclo cellulare, e nell'inibizione della differenziazione cellulare. Ad esempio, nel linfoma a cellule B l'oncogene BCL6 è un fattore di trascrizione che è sovraespresso nel 40% dei linfomi correlati. BCL6 recluta l'HDAC2 che reprime il gene CDKN1A che a sua volta codifica per gli inibitori del ciclo cellulare p21 e WAF1 i quali sono degli oncosoppressori, favorendo così l'insorgere della malattia mancando, appunto, il controllo negativo di questi fattori. È stato messo in evidenza che anche lo stesso BCL6 può essere deacetilato dagli HDAC, quindi un inibitore degli HDAC agisce iperacetilando il BCL6 annullando la sua capacità di richiamare altri HDAC.
Gli HDAC sono coinvolti anche nei meccanismi che regolano l'apoptosi cellulare. La deacetilazione di Ku70 da parte degli HDAC accresce la
sua associazione con le proteine pro-apoptotiche Bax non facendole entrare nel mitocondrio, proteggendo in questo modo la cellula dall'apoptosi cellulare. Inoltre attraverso l'azione su proteine non istoniche e sugli istoni nucleosomali gli HDAC possono sia promuovere che reprimere l'espressione di alcune proteine, molte delle quali coinvolte nell'apoptosi. Gli HDAC sono inoltre coinvolti in altre funzioni del genoma come la riparazione del DNA.
Un altro aspetto che coinvolge gli HDAC nel cancro è il loro collegamento con l'angiogenesi; questa può essere scatenata tramite l'induzione di fattori angiogenici in condizioni ipossiche. Uno di questi fattori, il H1F1 (fattore ipossia inducibile), stimola l'espressione del fattore di crescita dell'endotelio vascolare, VEGF, coinvolto nell'angiogenesi; per cui gli HDAC giocano un ruolo significativo nella angiogenesi ipossia-indotta, fortemente correlata alla tumorigenesi. È stato dimostrato che l'HDAC7 in condizioni di ipossia, passa dal citoplasma al nucleo dove si associa all'H1F1 incrementando la sua attività trascrizionale ed aumentando l'espressione dei suoi geni bersaglio come quello che codifica per il VEGF, con un aumento significativo dell'angiogenesi.
La sovraespressione degli HDAC sembra anche coinvolta nell'aumento della proliferazione cellulare e nella formazione di metastasi. I ruoli di HDAC nei processi di migrazione, invasione e metastasi possono essere correlati a molti aspetti della regolazione cellulare. In primo luogo gli HDAC modulano la composizione della matrice extracellulare (ECM), mezzo attraverso
il quale le cellule cancerose possono propagarsi, influenzando la regolazione dell'espressione genica di alcune proteine presenti nell'ECM stessa. In secondo luogo, gli HDAC inibiscono l'espressione di molti fattori soppressori delle metastasi come KAI1 e RECK. Il KAI1 è un oncosoppressore, la cui espressione è promossa dal gene p53, questo codifica la sintesi della CD82, una proteina integrale di membrana appartenente alla superfamiglia delle tetraspanine. Le tetraspanine, controllano l’adesività e la crescita cellulare e sono capaci inibire la progressione delle metastasi. La down-regulation di KAI1 coinvolge anche l'azione inibitrice di una β-catenina che necessita della presenza dell'HDAC1. In terzo luogo gli HDAC svolgono la funzione di up-regulation nei confronti di molte proteine che promuovono la migrazione, l'infiltrazione e la metastasi delle cellule cancerose come le proteine MMP2 e MTA1. Quest'ultima forma con l'HDAC1 un complesso proteico che svolge un importante ruolo nella deacetilazione degli istoni e nel controllo trascrizionale per cui è correlato alla comparsa di malignità del tumore. Inoltre la sovraespressione degli HDAC promuove la vasodilatazione dei vasi situati vicino alla massa tumorale, aumentandone la permeabilità, favorendo il passaggio delle cellule maligne nel sangue e, di conseguenza, la formazione di metastasi.