5. ANALISI CONFORMAZIONALE E CONFIGURAZIONALE
DEGLI ADDOTTI-1,4 E -1,2 DERIVATI
DAGLI EPOSSIDI 4.1α E 4.1β
La caratterizzazione regio- e stereochimica dei prodotti di addizione 1,4 e 1,2 derivati dagli allil epossidi diasteroisomeri 4.1α e 4.1β è stata condotta, previa attribuzione strutturale delle risonanze protoniche (vedi parte sperimentale), tramite analisi delle interazioni dipolari intramolecolari prodotte tra protoni dipolarmente accoppiati ovvero spazialmente vicini (< 4Å) nelle mappe 2D NOESY (Nuclear Overhauser Effect SpectroscopY) o negli spettri 1D NOESY.
La determinazione della configurazione relativa dei composti ottenuti nelle reazioni di addizione agli epossidi 4.1α e 4.1β non può prescindere dall’esame dell’equilibrio conformazionale esistente nei prodotti stessi e quindi nell’individuazione del conformero ragionevolmente più stabile.
Così per un generico nucleofilo Nu- (da HNu) avremo queste possibili popolazioni conformazionali: da epossido 4.1α: HO HO HO HO Nu Nu Nu Nu BnO BnO BnO BnO BnO O + HNu addizione 1,4 addotto 1,4-sin addotto 1,4-anti = = BnO BnO BnO BnO HO HO Nu Nu HO HO Nu Nu A B 1 1
BnO BnO BnO O HO HO + HNu addizione 1,2
addotto 1,2-anti addotto 1,2-sin
Nu Nu HO Nu OBn HO Nu OBn BnO HO addotto 1,2-anti Nu BnO HO addotto 1,2-sin Nu = = OBn OBn Nu Nu OH OH C D 3 3
Per tutti i prodotti di addizione-1,4 e -1,2 ottenuti dall’epossido 4.1α, la conformazione preferenziale presente in soluzione (A-D) è determinata dalla preferenziale disposizione equatoriale del sostituente (-CH2OBn) sul C(5). Ne segue che il gruppo ossidrilico presente sul C(4) e derivante dal processo di apertura dell’epossido, assume necessariamente anch’esso una disposizione equatoriale.
a) da epossido 4.1β: HO HO HO Nu Nu Nu BnO BnO BnO BnO O + HNu addizione 1,4
addotto 1,4-anti addotto 1,4-sin
=HO Nu Nu HO BnO BnO BnO E 1
BnO BnO BnO O HO HO + HNu addizione 1,2
addotto 1,2-anti addotto 1,2-sin
Nu Nu HO Nu OBn HO Nu OBn BnO HO addotto 1,2-sin Nu BnO HO addotto 1,2-anti Nu = = Nu HO OBn OBn Nu HO G H 3 3
Per tutti i prodotti di addizione-1,4 e -1,2 ottenuti dall’epossido 4.1β, la conformazione preferenziale presente in soluzione (E-H) è determinata dalla preferenziale disposizione equatoriale del sostituente (-CH2OBn) sul C(5). Ne segue che il gruppo ossidrilico presente sul C(4) e derivante dal processo di apertura dell’epossido, assume necessariamente, in questo caso, una disposizione assiale.
Per quanto riguarda la determinazione degli stereocentri C(1) negli addotti-1,4 e C(3) negli addotti 1,2, essa è stata condotta sulla base dell’analisi delle interazioni dipolari generate dal protone H1 e/o dai protoni dei gruppi sostituenti legati a tali atomi di carbonio e confermata dall’analisi spettrale. In assenza di sovrapposizione spettrale misure di effetti NOE monodimensionali, caratterizzate da maggiore risoluzione spettrale, sono state preferite alle corrispondenti misure bidimensionali.
Tenendo conto dell’assetto conformazionale preferenzialmente assunto in soluzione e determinato dalle posizioni dei sostituenti agli atomi di carbonio C(4) e C(5) precedentemente discussa, in Tabella 1 sono riportati, per i prodotti di addizione 1,4 e 1,2, derivati dall’epossido 4.1α i vincoli di vicinanza spaziale tra selezionati nuclei e gli effetti NOE attesi per i due stereoisomeri.
Tabella 1. Vincoli di vicinanza spaziale tra selezionati nuclei ed effetti NOE attesi per i due stereoisomeria derivati dall’epossido 4.1α
addotti-1,4
addotto 1,4-sin addotto 1,4-anti
H1 Nu H1 Nu
H5 1,3-axeq (-) 1,3-diax (+) 1,3-diax (+) 1,3-axeq (-)
H6ax 1,2-axeq (+) 1,2-diax (-) 1,2-diax (-) 1,2-axeq (+)
H6eq 1,2-dieq (+) 1,2-eqax (+) 1,2-eqax (+) 1,2-dieq (+)
addotti-1,2
addotto 1,2-sin addotto 1,2-anti
H3 Nu H3 Nu
H5 1,3-axeq (-) 1,3-diax (+) 1,3-diax (+) 1,3-axeq (-)
aax = assiale; eq = equatoriale; (+) = presenza di NOE; (-) = assenza di NOE
Come mostrato in Tabella 1, per gli addotti-1,4, il protone H1 in assetto β (assiale) è atteso produrre NOE sul protone H5 ad esso affacciato (1,3-diassiali) e soltanto su uno dei protoni metilenici (quello equatoriale), mentre nell’addotto 1,4-sin tale protone (equatoriale) è atteso produrre NOE su entrambi i protoni metilenici ad esso adiacenti (H6/H6’). Nel caso in cui il sostituente rechi nuclei protonici osservabili, gli effetti NOE attesi sono, ovviamente, speculari rispetto a quelli del nucleo H1 (Tabella 1).
Tali assetti sono confermati dall’analisi dei valori delle costanti di accoppiamento del doppio doppio doppietto generato dal protone metilenico H6’, assiale. Esse sono tutte elevate (J > 10 Hz) nel caso dell’addotto 1,4-anti, infatti H6’ è diassiale sia al protone H5 sia al protone H1, che, quindi, devono essere rispettivamente cisoidi. Nel caso dell’addotto 1,4-sin, due costanti di accoppiamento sono elevate e una è intono a 4 Hz in accordo ad un accoppiamento scalare assiale-equatoriale tra il protone H6’ e il protone H1, che in questo caso, è equatoriale.
Prodotti di addizione-1,2 e -1,4 derivati dall’epossido 4.1α
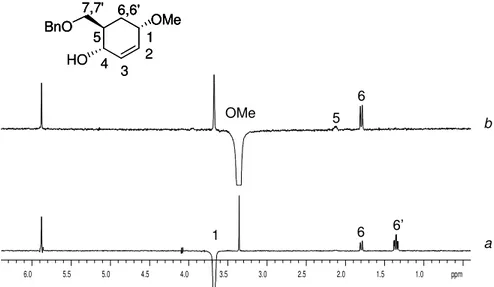
La configurazione relativa al C(1) degli addotti 1,4-sin 4.27 (Nu= OMe) e 4.42 (Nu= Cl) è stata determinata come qui di seguito descritti in dettaglio per il metossi derivato 4.27.
In accordo con quanto atteso (Tabella 1), per lo stereoisomero
H6' H6 H 1 HO H4
H1, essendo un doppio doppio doppietto con due costanti scalari elevate (J6’6= 13.9 Hz, J65= 13.1 Hz) e una più piccola imputabile ad un accoppiamento assiale-equatoriale (J6’1= 4.2 Hz).
ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 a b 1 OMe 6 6’ 6 5 HO BnO OMe 1 2 3 4 5 6,6' 7,7' ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 a b 1 OMe 6 6’ 6 5 HO BnO OMe 1 2 3 4 5 6,6' 7,7' HO BnO OMe 1 2 3 4 5 6,6' 7,7'
Figura 1. Spettri 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativi all’inversione del protone H1 (a) e dei
protoni del gruppo OMe (b) di 4.27.
La configurazione relativa al C(1) degli addotti 1,4-anti 4.28 (Nu= OMe), 4.32 (Nu= N3), 4.44 (Nu= Me) è stata determinata come qui di seguito descritti in dettaglio per il metossi derivato
4.28. Nel diasteroisomero 4.28 è il gruppo metossi (Nu= OMe) a
produrre NOE su entrambi i protoni H6 (1.98 ppm) e H6’ (1.21 ppm) (Figura 2b), mentre il protone H1 produce NOE su H5 (1.95 ppm) e sul protone H6, che risuona a frequenze più alte (Figura 2a). Tale conclusione è confermata dalle costanti di accoppiamento scalare del doppio doppio doppietto generato dal protone H6’, che risuona a frequenze più basse: tali costanti sono tutte elevate (J6’6=12.5 Hz, J65=J6’1=10.6 Hz) ad indicare che il protone H6’ è in assetto assiale rispetto al protone H5 e al protone H1. H 6' H 6 H1 Nu H 5 HO H 4 BnO addotto 1,4-anti
Figura 2. Spettri 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativi all’inversione del protone H1 (a) e dei
protoni del gruppo OMe (b) di 4.28.
Sono qui sotto riportati, Figure 3-5, gli spettri 1D NOESY relativi ai prodotti di addizione 1,4 derivati dall’epossido 4.1α.
ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 5 HO BnO N3 1 2 3 4 5 6,6' 7,7' ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 5 HO BnO N3 1 2 3 4 5 6,6' 7,7'
Figura 3. Spettro 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativo all’inversione del protone H1 di 4.32.
1 6 6’ TMSO BnO Cl 1 2 3 4 5 6,6' 7,7' 1 6 6’ TMSO BnO Cl 1 2 3 4 5 6,6' 7,7' ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 ppm 1.98 ppm 1.98 HO BnO OMe 1 2 3 4 5 6,6' 7,7' a b 6 5 5 6’ 6 6 6 1 OMe ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 ppm 1.98 ppm 1.98 HO BnO OMe 1 2 3 4 5 6,6' 7,7' a b 6 5 5 6’ 6 6 6 1 OMe
ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 a b 1 Me 6 6’ 6 5 HO BnO Me 1 2 3 4 5 6,6' 7,7' ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 a b 1 Me 6 6’ 6 5 HO BnO Me 1 2 3 4 5 6,6' 7,7'
Figura 5. Spettri 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativi all’inversione del protone H1 (a) e dei
protoni metilici (b) di 4.44.
Nell’addotto 1,2-anti 4.31 (Nu= N3) e -1,2-sin 4.41 (Nu= Cl) la
configurazione al C(3) è definita sulla base delle interazioni generate dal protone H3 sul protone H5 per il composto 4.31 e sui protoni H2 e H4, i soli protoni vicinali, per il composto 4.41.
Prodotti di addizione-1,2 e -1,4 derivati dall’epossido 4.1β
Lo studio configurazionale sugli addotti derivati dell’allil epossido 4.1β è stato condotto seguendo gli stessi criteri adottati precedentemente nel caso dei derivati dell’epossido 4.1α.
Gli addotti 1,4-anti esaminati 4.22 (Nu= OAc), 4.25 (Nu= OMe)
4.35 (Nu= N3) e 4.47 (Nu= Me), mostrano NOE generato dal protone H1 su entrambi i protoni metilenici H6/H6’, mentre i protoni del nucleofilo, nel caso di 4.25 e 4.47, producono NOE sul protone H5 e su un solo protone metilenico (H6’).
Il protone H1 dell’unico addotto 1,4-sin esaminato, il metossi alcool 4.24 (Nu= OMe) genera NOE sul protone H5 e sul protone metilenico in posizione equatoriale H6, mentre i protoni del gruppo metossi producono NOE sui protoni metilenici H6/H6’.
H6 H6' H 5 H 4 OH BnO Nu H1 addotto 1,4-anti H6' H 6 H OH Nu H 4 HO Nu H 3 H 5 H 6 H 6' OBn addotto 1,2-sin H 4 HO H 3 Nu H 5 H 6 H 6' OBn addotto 1,2-anti
Sono qui sotto riportati, Figure 6-10, gli spettri 1D NOESY relativi ai prodotti di addizione 1,4 derivati dall’epossido 4.1β.
ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 a b OMe 6’ 6 6 5 ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 a b OMe 6’ 6 6 5 1 2 3 4 5 6,6' 7,7' HO BnO OMe
Figura 6. Spettri 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativi all’inversione del protone H1 (a) e dei
protoni del gruppo OMe(b) di 4.24.
ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 a b c OMe 5 5 6’ 6’ 6 6’ 4 HO BnO OMe 1 2 3 4 5 6,6' 7,7' OMe ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 a b c a b c OMe 5 5 6’ 6’ 6 6’ 4 HO BnO OMe 1 2 3 4 5 6,6' 7,7' OMe
ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 5 6’ Me ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 5 6’ Me HO BnO Me 1 2 3 4 5 6,6' 7,7'
Figura 8. Spettro 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativo all’inversione dei protoni metilici di 4.47. ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 5 6’ 6’ 6 1 a b HO BnO OAc 1 2 3 4 5 6,6' 7,7' ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 5 6’ 6’ 6 1 a b ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 5 6’ 6’ 6 1 a b HO BnO OAc 1 2 3 4 5 6,6' 7,7'
Figura 9. Spettri 1D NOESY (600 MHz, CDCl3, 25 °C, mix 1 s) relativi all’inversione del protone H1 (a) e del
protone H5 (b) di 4.22. ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 6 6’ HO BnO N3 1 2 3 4 5 6,6' 7,7' ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 6 6’ ppm 1.0 1.5 2.0 2.5 3.0 3.5 4.0 4.5 5.0 5.5 6.0 1 6 6’ HO BnO N3 1 2 3 4 5 6,6' 7,7'
La configurazione relativa al C(3) dei composti derivati dall’addizione 1,2 all’epossido 4.1β è stata determinata sulla base di interazioni dipolari generate dai protoni del sostituente in C(3), se presenti, e dal protone H3. Inoltre per l’addotto 1,2-anti, quali i composti 4.34 (Nu= N3) e 4.38 (Nu= Cl) il protone H3 produce NOE solo sui protoni vicinali H2 e H4, mentre l’analisi del composto 4.39 (addotto 1,4-sin, Nu= Cl), ha portato alla determinazione della relazione cis tra il gruppo –OH ed il nucleofilo in quanto il protone H3 produce NOE sul protone H5. OH H 4 Nu H 3 H 5 H6 H 6' OBn addotto 1,2-anti OH H4 H 3 Nu H5 H 6 H6' OBn addotto 1,2-sin