Dipartimento Scienze Veterinarie
Corso di Laurea Magistrale in Scienze e Tecnologie delle Produzioni Animali
Tesi di Laurea:
VALUTAZIONE DELLA SOPRAVVIVENZA DI LEPTOSPIRA SPP IN LATTE CRUDO E LATTE PASTORIZZATO UHT
Candidato: Relatore: Dott.ssa Martina Ferrone Prof. Domenico Cerri
Correlatore: Dott. Filippo Fratini
Alla famiglia,
all’amicizia,
all’amore,
a chi soffre e combatte ogni giorno,
a chi cade ed è pronto a rialzarsi e ricominciare,
a chi non smette di credere nel bello della vita,
alle persone coraggiose,
alle persone sagge,
alle persone che sanno dare amore incondizionatamente.
Riassunto
pag. 7Introduzione
pag. 81. LEPTOSPIRA
pag. 101.1 Cenni storici pag. 10
1.2 Classificazione pag. 11
1.2.1 Classificazione sierologica pag. 11
1.2.2 Classificazione genetica pag. 12
1.3 Eziologia pag. 15
1.4 Epidemiologia pag. 18
1.4.1 Resistenza nell’ambiente e negli alimenti pag. 19
1.4.2 Riferimenti epidemiologici internazionali,
europei e nazionali pag. 21
1.5 Patogenesi pag. 23
1.6 La leptospirosi pag. 25
1.6.1 La malattia nelle diverse specie animali pag. 26
1.7.1 Coltivazione in laboratorio pag. 35
1.7.2 Esame sierologico pag. 37
2. LA LEPTOSPIROSI BOVINA
pag. 412.1 Infezione da serovar Icterohaemorragiae pag. 42
2.2 Infezione da serovar Bratislava pag. 42
2.3 Infezione da serovar Hardjo pag. 44
2.4 Infezione da serovar Pomona pag. 45
2.5 Infezione da serovar Grippotyphosa pag. 47
2.6 Infezione da serovar Ballum pag. 48
3. LA LEPTOSPIROSI NEGLI ALLEVAMENTI BOVINI
pag. 493.1 Quadro epidemiologico pag. 49
3.1.1 Situazione Mondiale pag. 49
3.1.2 Situazione Europea pag. 51
3.1.3 Situazione Nazionale pag. 52
3.2 Profilassi vaccinale pag. 54
4. LEPTOSPIRA VEICOLATA CON GLI ALIMENTI DI
6. MATERIALI E METODI
pag. 61 6.1 Ceppi di Leptospira impiegati nelle prove sperimentali pag. 616.2 Latte impiegato nelle prove e valutazione del profilo
mi-crobiologico pag. 62
6.3 Ricerca di L. interrogans sensu lato nei latti mediante
PCR pag. 64
6.4 Valutazione della vitalità dei ceppi e loro titolazione pag. 65 6.5 Valutazione estemporanea della vitalità dei ceppi di
Lep-tospira a contatto con le diverse tipologie di latte pag. 66 6.6 Inoculo dei ceppi in latte crudo e latte U.H.T. a diverse
temperature (4°C, temperatura ambiente, 30°C) e semi-ne degli inoculi dopo tempi diversi di incubaziosemi-ne (20’, 45’, 1 h, 1 h e 30’) in terreno EMJH
pag. 67
7. RISULTATI
pag. 757.1 Valutazione microbiologica dei latti impiegati pag. 75 7.2 Ricerca di L. interrogans sensu lato nei latti mediante
PCR pag. 78
7.3 Valutazione estemporanea della vitalità dei ceppi di
lepto-spira a contatto con le differenti tipologie di latte pag. 79 7.4 Valutazione delle semine degli inoculi incubati a tre
diver-se temperature (4°C, temperatura ambiente, 30°C) dopo tempi diversi di incubazione (20’, 45’, 1 h, 1 h e 30’) in terreno EMJH
Bibliografia
Sitografia
Scopo: Lo scopo di questo Studio è stato quello di valutare il rischio potenziale di contaminazione del latte crudo bovino destinato al consumo alimentare e del latte U.H.T. da parte di Leptospira in-terrogans serovar Hardjo, Leptospira inin-terrogans serovar Pomona, Leptospira inin-terrogans serovar Icterohaemorragiae, Leptospira interrogans serovar Grippotyphosa, Leptospira interrogans serovar Bratislava, Leptospira Borgpetersenii serovar Ballum, valutando la sopravvivenza dell’agente in un campione sperimentalmente contaminato.
Materiali e Metodi: I campioni di latte crudo e latte pastorizzato U.H.T. entrambi refrigerati, nega-tivi per Leptospira interrogans in PCR (Woo et al., 1997) ed in isolamento, sono stati contaminati con sei ceppi di riferimento presenti nella ceppoteca del Dipartimento di Scienze Veterinarie dell’Università di Pisa. Al fine di saggiare l’idoneità igienico sanitaria del latte, su ogni campione è stato effettuato il controllo microbiologico. Per testare la vitalità è stata attuata dapprima una valuta-zione estemporanea al microscopio in campo oscuro delle diverse colture a contatto con le differenti tipologie di latte; successivamente è stato eseguito l’inoculo dei ceppi in latte crudo e latte U.H.T. seminando una sospensione standardizzata di ciascun ceppo a diverse temperature di incubazione (4±2°C, temperatura ambiente, 30°C) e dopo tempi diversi (20’, 45’, 1 h, 1 h e 30’) in terreno EMJH. Risultati e Discussione: Alcuni dati non recenti presenti in letteratura riportano che il latte bovino è in grado di inattivare la leptospira. Anche in questo studio è stata dimostrata la perdita di vitalità del microrganismo sia a contatto diretto con le diverse tipologie di latte, che dopo l’isolamento in coltu-ra. L’incapacità di leptospira di sopravvivere nel latte è probabilmente dovuta ad alcune componenti intrinseche del latte stesso con proprietà battericida. Alla luce di quanto è emerso dalla nostra inda-gine, e in netto contrasto con un recente studio condotto presso l’Istituto Zooprofilattico delle Vene-zie, sembrerebbe alquanto improbabile considerare il latte come un prodotto particolarmente perico-loso per il consumatore relativamente alla contaminazione da leptospira.
Parole Chiave (max 5): Leptospira, sopravvivenza, latte crudo, latte U.H.T.
ABSTRACT
Thesis title: Evaluation of survival of Leptospira spp in raw milk and in ultra high temperature (U.H.T.) pasteurized milk.
Aim: The aim of this Study was to evaluate the potential risk associated with the presence of Lepto-spira interrogans serovar Hardjo, LeptoLepto-spira interrogans serovar Pomona, LeptoLepto-spira interrogans serovar Icterohaemorragiae, Leptospira interrogans serovar Grippotyphosa, Leptospira interrogans serovar Bratislava, Leptospira Borgpetersenii serovar Ballum in bovine raw milk for food consump-tion and Ultra high temperature milk, evaluating the survival of leptospira in experimentally contam-inated milk sample.
Materials and Methods: Cooled samples of raw and U.H.T. pasteurized milk, negative for Lepto-spira interrogans, both by PCR (Woo et al., 1997) and culture, were contaminated with six reference strains from the Department of Veterinary Science (University of Pisa) collection. In order to ensure the suitability of milk hygienic profile, each sample was subjected to microbiological analysis. To observe the vitality of leptospira strains in different types of milk, a first instantly evaluation by dark-field microscope was performed. Subsequently, contaminated raw milk and U.H.T. milk sam-ples were spread in EMJH medium and incubated at different temperatures (4±2 °C, room tempera-ture, 30 °C) and for different incubation times (20 ', 45', 1 h, 1 h and 30 ').
Results and Discussion: Some studies reported in literature have shown that bovine milk is able to inactivate leptospira. Our study confirms the loss of vitality of the microorganism, both after direct contact with the different types of milk and after isolation in culture. The inability of leptospira to survive in milk is probably related to some intrinsic components of milk provided with bactericidal activity. On the basis of our results, and in contrast with a recent study performed by the Zoopro-filattico delle Venezie Institute, is highly improbable to consider milk as a particularly dangerous product for the consumer concerning leptospira contamination.
Keywords (max 5): Leptospira, survival, raw milk, U.H.T. milk.
Leptospira nel bovino rappresenta un importante agente infettivo che può causare
aborti, natimortalità, infertilità, riduzione della produzione di latte, e riveste inoltre un possibile ruolo zoonosico, con serbatoi nelle diverse popolazioni animali; il coinvolgimento dell’uomo avviene in particolari circostanze, alcune delle quali legate all’attività lavorativa (Levett, 2001; Manahan et al, 2009).
Figura 1: Leptospira interrogans (fonte: http://www.pasteur.fr/ip/easysite/pasteur/en/press/press-releases/20 07/leptospirosis-the-first-virulence-gene-identified).
Il latte crudo destinato al consumo alimentare rappresenta un potenziale veicolo per la trasmissione di agenti patogeni considerati pericolosi, come anche la leptospira. Per questo motivo un’Ordinanza emessa dal Ministero del Lavoro, della Salute e
delle Politiche Sociali rende obbligatoria la bollitura di tale prodotto prima del con-sumo, al fine di garantirne la salubrità (Ordinanza del Ministero della Salute 10/12/2008).
È importante che sull’etichetta o sull’erogatore, tra le informazioni per il consuma-tore, sia specificato che trattasi di latte crudo non sottoposto a pastorizzazione, in quanto il latte crudo pronto al consumo potrebbe rappresentare un rischio igienico-sanitario per il consumatore.
Fondamentale per garantire la sicurezza del latte è perciò l’analisi del rischio, consi-stente nell’esame sistematico di tutta la filiera produttiva, dalle materie prime ai processi di lavorazione, conservazione e distribuzione, per determinarne i rischi e definirne correttamente le necessarie misure preventive. Il latte crudo infatti conser-va intatta tutta la flora microbica dericonser-vante dallo stato di salute dell’animale e dalle fasi di mungitura.
Dimostrare il rischio che può rappresentare il latte bovino crudo destinato al consumo alimentare e il latte pastorizzato U.H.T. nel caso questi fossero infetti da
Leptospira spp, e valutare la sopravvivenza dell’agente infettante al suo interno,
1. LEPTOSPIRA
1.1 Cenni storici
La Leptospirosi è una zoonosi cosmopolita trasmessa da batteri dell’ordine Spirochaetales, famiglia Leptospiraceae, genere Leptospira. Era conosciuta in Cina fin da tempi antichissimi come malattia professionale dei coltivatori di riso. La leptospirosi è stata certamente riconosciuta come un rischio professionale di raccolta del riso nella Cina antica e il nome che le venne attribuito dai giapponesi “akiyami”, o febbre d'autunno, persiste ancora nella medicina moderna.
Si pensa che essa sia stata introdotta in Europa nel XVIII secolo con l’invasione dei ratti provenienti dall’Asia per estensione verso ovest del Rattus norvegicus dall'Eurasia. La prima descrizione di febbre gialla, nel nostro continente, fu fatta nel 1812 dal Barone Dominique Jean Larrey, chirurgo dell’esercito napoleonico. Nel 1887 Adolf Weil descrisse il quadro clinico della forma itterica, poi denominata malattia di Weil (Levett, 2001).
L'eziologia della leptospirosi è stata dimostrata in modo indipendente nel 1915 in Giappone e in Germania. In Giappone, Inada e Ido (1916) rilevarono entrambe le spirochete e gli anticorpi specifici dal sangue di minatori giapponesi con ittero infettivo e due gruppi di medici tedeschi studiarono soldati afflitti da "mal francese" nelle trincee del nord-est della Francia. Uhlenhuth e Fromme (1915), Hubener e Reiter (1915) individuarono spirochete nel sangue di cavie inoculate con il sangue dei soldati infetti.
Stimson (1907) dimostrò la presenza di ciuffi di spirochete nei tubuli renali di un paziente che si diceva morto di febbre gialla. Le spirochete avevano estremità uncinate e Stimson le ribattezzò spirocheta interrogans a causa della loro somiglianza con un punto di domanda. Purtroppo, questa osservazione sentinella fu trascurata per molti anni.
L' importanza dei fattori di rischio collegati a tale malattia fu presto riconosciuta. Il ruolo del ratto come fonte di infezione umana venne scoperto nel 1917, mentre
per il riconoscimento della leptospirosi nei cani con chiara distinzione tra i sierotipi Icterohaemorrhagiae e Canicola di L. interrogans, sono occorsi diversi anni. Sempre nel 1917 viene registrato il primo caso di Leptospirosi umana in Italia (Fenga et al., 2000).
La leptospirosi nel bestiame, invece, fu menzionata solo alcuni anni dopo (Levett, 2001).
1.2 Classificazione
Nel 1989 il genere Leptospira è stato diviso in due specie: Leptospira interrogans e
Leptospira biflexa, che comprende specie saprofite (Faine, 1994). Tradizionalmente
le leptospire sono state classificate secondo i determinanti antigenici (Dikken e Kmety, 1978), ma più recentemente si è affiancata anche una classificazione di tipo molecolare che ha suddiviso il genere Leptospira in diverse geno-specie sulla base delle omologie nel DNA (Adler e de la Peña Moctezuma, 2010). La riclassificazione su base genetica fornisce utili informazioni dal punto di vista tassonomico, ma è indipendente dalla classificazione sierologica su base antigenica tuttora ampiamente utilizzata per studi di tipo epidemiologico e nella diagnostica di routine (Bharti et al., 2003).
1.2.1 Classificazione sierologica
Il genere Leptospira appartiene alla famiglia Leptospiraceae e prima del 1989 annoverava due sole specie: L. interrogans, che comprendeva tutti i ceppi patogeni e L. biflexa, contenente i ceppi saprofiti, isolati dall'ambiente ( Levett, 2001).
Mediante test di microagglutinazione e di adsorbimento crociato delle agglutinine si possono riconoscere nell’ambito del genere Leptospira diverse sierovarianti (serovar), caratterizzate ciascuna da un antigene principale oppure da un insieme di epitopi non presenti in altri ceppi di leptospire. A loro volta le sierovarianti vengono raggruppate e classificate in sierogruppi che hanno antigeni immunodominanti in comune. La classificazione su base antigenica comprende oggi più di 250 sierovarianti nella specie patogena Leptospira interrogans e circa 60 sierovarianti nella specie saprofita
Nella Tabella 1 sono riportati alcuni sierogruppi di L. interrogans e i sierotipi più comuni.
Tabella 1: Sierogruppi e alcune tra le sierovarianti principali di L. interrogans ( Levett, 2001).
1.2.2 Classificazione genetica
Un’ulteriore e più recente classificazione, su base genetica, descrive attraverso metodiche di biologia molecolare 12 specie patogene e 4 specie saprofite (Adler e de la Peña Moctezuma, 2010). Secondo questa classificazione, ceppi diversi di Leptospira vengono definiti come appartenenti alla stessa specie se presentano un’omologia nel DNA maggiore del 70% e divergenze nelle sequenze omologhe uguali o inferiori al 5% (Bharti et al., 2003). La continua e rapida evoluzione degli studi biomolecolari ha creato qualche confusione nella denominazione delle nuove specie via via identificate, nominandole provvisoriamente talvolta genospecie, altre volte genomospecie e identificandole con un numero progressivo, in attesa di una nomenclatura di specie definitiva, che progressivamente viene attribuita dai comitati scientifici (Smythe et al.,
2012).
La classificazione su base genetica (con suddivisione in geno/genomospecie) è indipendente da quella su base antigenica (con suddivisione in specie, sierogruppi e sierovarianti (Tabella 2), per cui leptospire appartenenti allo stesso sierogruppo e sierovariante possono essere attribuite a geno/genomospecie diverse, così come sierovarianti patogene, non patogene e intermedie possono cadere nella stessa geno/genomospecie (Hines, 2007), così come evidenziato in Tabella 3.
1.3 Eziologia
Le leptospire sono spirochete, appartenenti all’ordine delle Spirochaetales, nell’ambito del quale sono oggi classificate due famiglie: quella delle Leptospiraceae, con il genere Leptospira, e quella delle Spirochetaceae.
Sono esili microrganismi provvisti di sottile e delicata spiralatura, a estremità ripiegate a guisa di uncino in maniera caratteristica (Farina, 2002).
Il diametro è compreso tra 60 e 120 nm e la lunghezza, oltremodo variabile, oscilla ordinariamente fra 3-12 µm nelle colture più recenti, mentre in quelle più vecchie fra 6 e 20 µm e include specie sia saprofite che patogene del genere Leptospira (Faine et al., 1999).
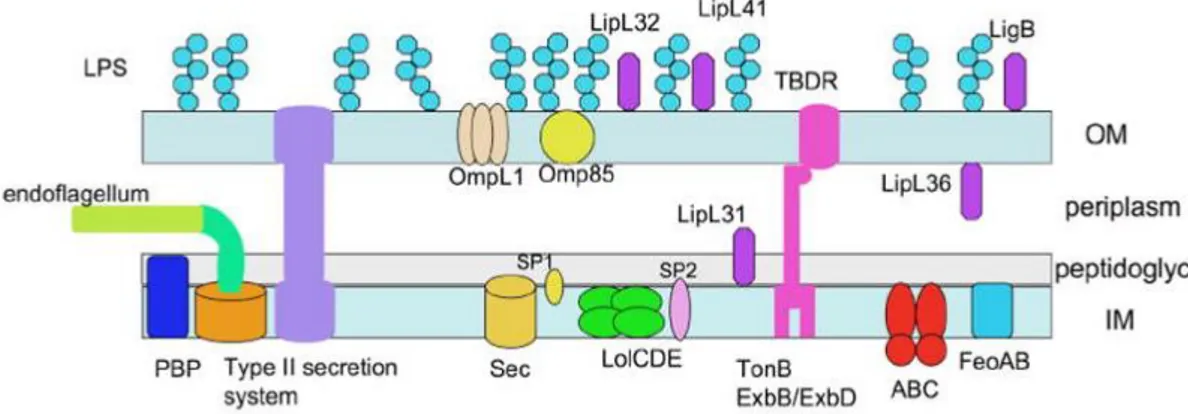
Le osservazioni al microscopio elettronico hanno permesso di chiarirne la struttura interna. La leptospira possiede un rivestimento simile alla parete cellulare dei Gram-negativi, formato da una membrana citoplasmica, uno strato di peptidoglicano e una membrana esterna. Tuttavia, lo strato di peptidoglicano è associato con la membrana citoplasmatica piuttosto che con quella esterna, un arrangiamento che è esclusivo delle spirochete (Picardeau, 2001). Della membrana esterna fanno parte lipopolisaccaridi e proteine srutturali. Gran parte di tali proteine sono lipoproteine relativamente abbondanti sulla superficie delle cellule: LipL32>LipL21>LipL41. Inoltre la porina è un’ulteriore proteina di membrana che ha dimostrato avere funzione antigenica (Adler et al., 2009). Al di sotto di queste strutture si trova uno strato di peptidoglicano ed una membrana citoplasmatica molto esile che avvolge un cilindro protoplasmatico, contenente citoplasma e acido nucleico.
Attorno al cilindro protoplasmatico si avvolge un endoflagello, detto anche “filamento assiale”, che si inserisce con le due estremità a ciascuno dei due poli del cilindro protoplasmatico (Figura 3).
Figura 3: Architettura di Leptospira (fonte:http//leptospira.org).
Questo flagello, pur non esteriorizzandosi, determina i vivaci movimenti ben visibili in preparati a fresco in campo oscuro di cui le leptospire sono dotate.
lenti, si accompagnano ai secondi molto veloci, dai quali paiono anzi essere provocati. La traslazione avviene in direzione rettilinea e indifferentemente nei due sensi, con inversione talvolta brusca dello spostamento. La moltiplicazione si compie per scissione binaria ma, a seguito di condizioni particolari, quali la carenza di sostanze nutritive, le leptospire diventano incapaci di dividersi e formano perciò lunghe catene.
A causa delle loro esigue dimensioni, le leptospire non sono apprezzabili al normale microscopio ottico e si rende necessario l’impiego del microscopio in campo oscuro oppure l’applicazione di colorazioni particolari, quali Giemsa o impregnazione argentica (Levaditi e Warthin-Starry), che ne ispessiscono la parete.
L’impiego della microscopia elettronica ha permesso di apprezzare l’ultrastruttura e le caratteristiche morfologiche più dettagliate, quali la tipica spiralatura destrogira con passo costante di 0,5 µm e la ripiegatura ad uncino delle estremità. Grazie alle immagini ottenute con la microscopia elettronica è stata apprezzata la presenza di bande elettrondense sulla membrana esterna in numero variabile da 3 a 5 secondo le diverse tecniche di fissaggio impiegate, costituite da proteine, lipidi e lipopolisaccaridi che, protundendo sulla superficie esterna, andrebbero a costituire le principali molecole ad azione antigenica.
Figura 4: Leptospire al microscopio ottico, impregnazione argentica (http://itg.content-e.eu /Generated /pubx/161/leptospirosis/diagnosis.htm).
Le leptospire sono microaerofile, ma sviluppano bene anche in condizioni di completa aerobiosi. Nonostante crescano abitualmente a 37°C, la temperatura ottimale è compresa tra 28 e 30°C. Notevole importanza ha la reazione del terreno, essendo particolarmente sensibili specie agli spostamenti verso l’acidità: il pH ottimale varia fra 7,2 e 7,4 (Faine, 1994; Farina, 2002).
1.4 Epidemiologia
La leptospirosi è presente in tutto il mondo, in ambiente rurale e urbano, nei climi temperati e tropicali (Picardeau, 2013). Essa si presume essere la zoonosi più diffusa e rappresenta un tipico esempio di infezione i cui agenti causali, dotati di scarsissima resistenza nell'ambiente esterno e incapaci di moltiplicarvisi, affidano la loro possibilità di sopravvivenza ad animali vertebrati, domestici e selvatici, compreso l'uomo, che ne divengono più o meno durevoli serbatoi e come tali provvedono alla conservazione della specie ed alla perpetuazione del contagio. I
selvatici occupano una posizione di preminenza quali indispensabili anelli della lunga catena epidemiologica dell'infezione. I roditori, soprattutto i muridi, rimangono i portatori più diffusi e pericolosi (Levett, 2001; Farina, 2002).
1.4.1 Resistenza nell'ambiente e negli alimenti
La resistenza delle leptospire è piuttosto modesta. Nell'ambiente esterno non rimangono vitali molto a lungo, essendo indispensabili alla loro sopravvivenza speciali condizioni di umidità, di temperatura, di composizione minerale del terreno. L'esposizione alla luce solare diretta, la disidratazione e la putrefazione ne causano rapidamente la morte, così come l'acqua salmastra, che può neutralizzarle in breve tempo, non tollerando in genere concentrazioni di NaCl superiori al 2,5%. Vengono distrutte entro brevissimo tempo dal succo gastrico e dalla bile. Nelle urine, specie se acide, muoiono già nello spazio di pochissime ore; la loro sopravvivenza però aumenta in modo considerevole (fino a 3-6 settimane) se le urine vengono a diluirsi in raccolte di acqua piovana o se sono emesse in terreno imbevuto di pioggia. I più comuni disinfettanti, soprattutto se contenenti cloro e tensioattivi cationici, anche a basse concentrazioni (1 ppm) sono in grado di inattivarle in soli 3 minuti. Alcuni tensioattivi cationici hanno un elevato potere antimicrobico che deriva dalla possibilità di fissarsi, grazie alla loro carica positiva, alle membrane delle cellule batteriche, determinandone la rottura. A temperature basse i tempi di sopravvivenza si allungano considerevolmente; nello sperma di toro o di verro per esempio esse mantengono il loro potere patogeno per almeno 3 mesi a temperature comprese fra 3°C e – 23°C e per almeno 3 anni a – 196°C (Faine et al., 1999).
L'estrema sottigliezza del microrganismo e la vivace motilità che lo caratterizzano permettono allo stesso di penetrare agevolmente nell'organismo dell'ospite attraverso abrasioni o tagli della pelle o della congiuntiva, dalle labbra, dalle narici, dalla parte distale degli arti (Farina, 2002).
Raramente invece l'infezione può seguire a morsi di animali e la trasmissione diretta fra gli esseri umani è stata dimostrata solo occasionalmente (Levett, 2001).
Sia negli animali domestici che nei selvatici lo stato di portatore è conseguenza di una localizzazione renale delle leptospire e, più esattamente, a livello delle strutture tubulari.
L'infezione di solito è acquisita in tenera età e la prevalenza di un'escrezione cronica nelle urine aumenta con l'età dell'animale.
É certa l'esistenza di una fase di leptospiremia, sia pure transitoria, nella quale le leptospire sono reperibili in ambito renale e più precisamente nel connettivo inter-tubulare. Migreranno poi alla loro sede definitiva: le strutture tubulari del nefrone inferiore. La loro escrezione con le urine, anche se rappresenta un evento pressoché costante, non avviene in ogni caso con uguale persistenza, continuità ed intensità. Per dare un'idea di rilevanza in termini epidemiologici è sufficiente affermare che nell'urina di certi portatori, soprattutto muridi, sono costantemente reperibili fino a 106-107 leptospire/ml e che nell'urina di bovino e di suino possono essere presenti sino a 2x108 leptospire/ml (serovar pomona) (Farina, 2002).
L'abbondante e persistente eliminazione di L. interrogans con le urine da parte di serbatoi naturali rappresenta quindi il caposaldo epidemiologico delle leptospirosi in generale.
Per quanto riguarda gli animali domestici vi è stata peraltro l'importante scoperta di una localizzazione delle leptospire nell'apparato genitale maschile e femminile: testicoli, epididimo, vescicole seminali, prostata, ghiandole bulbouretrali di tori e verri; utero e vagina di bovine e scrofe. Poiché la presenza delle leptospire nell'apparato genitale femminile può protrarsi a lungo (da 83 a 147 giorni), la trasmissione venerea del contagio viene agevolata e ciò può costituire ulteriore motivo di rischio per l'uomo (Farina, 2002).
Alcuni Autori hanno ammesso la possibilità di trasmissione della leptospirosi attraverso gli artropodi ematofagi, in particolare le zecche. Dopo l'assunzione con il sangue, le leptospire passerebbero nell'emocele della zecca attraverso la parete intestinale; dopo un'intensa moltiplicazione, le leptospire migrerebbero verso le ghiandole salivari, il liquido coxale, gli organi genitali e le zecche sembrerebbero rimanere portatrici fino a 518 giorni e infettanti fino a 232 (Farina, 2002).
La maggior parte dei casi di leptospirosi è imputabile all'ingestione di acqua o alimenti contaminati. La porta di ingresso più comune è l'apparato digerente, limitatamente al cavo orofaringeo, anche se non si deve escludere la possibilità, nel caso dei poligastrici, che la penetrazione avvenga all'altezza delle vie digerenti più profonde (prestomaci in particolare).
Le infezioni umane possono essere acquisite attraverso attività lavorative e momenti ricreativi. L'occupazione è un pericolo significativo per gli esseri umani. L'allevamento del bestiame rappresenta un importante fattore di rischio occupazionale in tutto il mondo. Il rischio più elevato associato ai caseifici è ascrivibile al sierotipo Hardjo, in particolare il momento della mungitura delle bovine. Secondo alcuni Autori le leptospire vengono inattivate entro 45 minuti per l’attività battericida di cui il latte stesso è dotato (Kirschner e Maguire, 1955; Stalheim, 1965; Farina, 2002). Tuttavia tali studi sono datati e meritano di essere confermati o smentiti alla luce di segnalazioni di contagio umano da serovar Hardjo derivante da latte bovino infetto con conseguente trasmissione interumana per allattamento (Bolin e Koellner, 1988); il latte è inoltre considerato una possibile fonte di infezione, in particolare per serovar Hardjo, per alcune professioni a rischio oltre ai mungitori, quali veterinari ed allevatori (Levett, 2001). La serovar Hardjo può provocare focolai di mastite e aborti (Levett, 2001; Farina, 2002; Bharti et al., 2003).
1.4.2 Riferimenti epidemiologici internazionali, europei e nazionali Le leptospirosi presentano una distribuzione a livello mondiale, con una maggiore incidenza nei Paesi tropicali e subtropicali, che va da 10 a 100 casi umani ogni 100.000 persone (Guerra, 2013).
L'incidenza della leptospirosi è significativamente più elevata nei paesi caldi anziché nelle regioni temperate principalmente a causa della più lunga sopravvivenza delle leptospire in ambienti umidi ed in cui prevale acqua stagnante. Infatti, nei paesi tropicali, che sono anche i paesi in via di sviluppo, vi sono maggiori opportunità che la popolazione umana possa essere esposta al contatto diretto o indiretto con l'urina di animali infetti.
La malattia è stagionale e il picco di incidenza si verifica in estate o nelle regioni temperate, dove la temperatura è il fattore limitante per la sopravvivenza delle leptospire, durante la stagione delle piogge.
Negli Stati Uniti annualmente sono stati segnalati dai 100 ai 200 casi umani di leptospirosi fino al 1994, quando la malattia ha cessato di essere soggetta a denuncia. Tuttavia, le più alte incidenze si sono registrate soprattutto nelle isole Hawaii, in Texas, in California e a Puerto Rico. Ci sono inoltre indicazioni sul fatto
rischio. I recenti casi negli Stati Uniti sono stati associati alla partecipazione a gare d'avventura in acqua.
Focolai di leptospirosi si verificano regolarmente durante la stagione delle piogge nelle baraccopoli o nelle "favelas" di megalopoli brasiliane o in Asia, per esempio. Attualmente, un miliardo di persone vive in baraccopoli in tutto il mondo e questa popolazione sembra destinata ad aumentare di due volte nei prossimi 20 anni (Victoriano et al., 2009; Guerra, 2013; Picardeau, 2013).
In Francia oggi l'incidenza della malattia è stimata in 0,5 casi su 100.000 abitanti (circa 300 casi notificati ogni anno), ma è da 10 a 100 volte maggiore nei territori francesi d'oltremare.
Secondo uno studio condotto nel 2011 la Francia ha appunto una delle più alte incidenze della malattia tra i paesi industrializzati con il maggior numero di casi durante il periodo estate/autunno (soprattutto da agosto a ottobre). Nel 2011 il sierogruppo predominante era Icterohaemorrhagiae (il 36 % dei casi era dovuto a questo sierogruppo), seguito dal sierogruppo Grippotyphosa (21 %) , Australis (8 %) e Canicola (7 %).
Di interesse notevole è il fatto che il 10% dei casi è stato importato dopo un viaggio in una zona endemica (America Latina, India occidentale, Sud-Est Asia, Nord Africa) (Picardeau, 2013).
In Italia la leptospirosi è una zoonosi inserita nella lista delle malattie infettive da notificare all’OIE (Office International des Epizooties) e contemplata nel Regolamento di Polizia Veterinaria (D.P.R. 320/54). In caso di riscontro della malattia, è prevista la dichiarazione di apertura del focolaio e la messa in atto di misure finalizzate all’estinzione dello stesso (O.M. 26/03/1970; O.M. 04/09/1985) (Colavita e Paoletti, 2007).
Secondo i dati riportati dal Ministero della Salute si va dai 66 casi ufficialmente notificati nel 1993, ai 38 del 2004.
Per valutare il rischio professionale negli allevamenti, uno studio sierologico, condotto in 12 aziende della provincia di Mantova, ha messo in evidenza una positività nel 32% degli allevatori (Ghinzelli et al., 2000).
In Sicilia, si è voluto indagare sulla presenza e diffusione di Leptospira spp. in alcuni gruppi di lavoratori (6 veterinari, 34 allevatori e 28 macellatori di suini). Il
23,5% dei lavoratori è risultato positivo. Lo studio ribadisce l’importanza della sorveglianza di tale malattia nelle persone esposte per ragioni professionali, come precedentemente detto, e l’eventuale necessità di adottare programmi di controllo per le attività ad alto rischio (Fenga et al., 2004).
Recentemente in Friuli, tra dicembre 2004 e gennaio 2005, casi di Leptospirosi sono stati segnalati tra il personale di un salumificio. All’interno dell’azienda non sono state riscontrate tracce di roditori e gli esami sierologici effettuati su campioni di sangue dei suini macellati e da cui provenivano le carni lavorate, hanno evidenziato delle partite positive con titoli da l:200 a l:400 per Leptospira interrogans sierotipo Bratislava (Colavita e Paoletti, 2007).
Da una valutazione delle schede di dimissione ospedaliera (SDO) effettuata nel corso del progetto di Ricerca dell’ IZSVe 8/2005 negli anni 2002-2005 nel Triveneto, sono state effettuate 126 ospedalizzazioni e 88 notifiche di casi di leptospirosi: tale situazione però potrebbe essere sottostimata se si osservano i dati relativi alla siero-prevalenza negli animali domestici, che farebbero ragionevolmente ipotizzare prevalenze decisamente superiori.
1.5 Patogenesi
Le leptospire penetrano nell'organismo attraverso piccoli tagli o abrasioni, attraverso le vie mucosali come la congiuntiva o attraverso la cute macerata da lunga permanenza in acqua (Adler, 2010).
Qualunque sia la porta d'ingresso dell'organismo, le leptospire guadagnano ben presto il torrente circolatorio. Ciò avviene con estrema rapidità, con ogni probabilità a causa dell'estrema sottigliezza del loro corpo e in parte anche per i vivaci movimenti di cui sono dotate (Farina, 2002).
Pervenute in circolo, vi iniziano un'intensa moltiplicazione, la quale porta, in un periodo più o meno lungo, alla comparsa delle prime manifestazioni.
Con la fase batteriemica, circolano nel flusso sanguigno fino a 7 giorni, raggiungono un numero critico e provocano lesioni dovute all'azione indefinita della tossina da loro prodotta e a componenti cellulari tossici. Le tossine prodotte sono rappresentate
da:
• GLP: complesso lipidico di una glicoproteina batterica; • LPS: frazione liposaccaridica.
La frazione lipopolisaccaridica (LPS) è coinvolta nel processo di patogenesi indotta dai batteri patogeni, svolgendo un ruolo di riconoscimento dell’organismo ospite tramite la propria porzione polisaccaridica.
Il lipopolisacaride (LPS) leptospirale ha mostrato però una bassa attività come endotossina (Levett, 2001).
L’immunità anti-leptospira, di tipo essenzialmente umorale, è prioritariamente rivolta verso l’antigene LPS e risulta protettiva, anche se esistono evidenze di altri possibili meccanismi immunologici in grado di proteggere gli animali dalla malattia. L’immunità è ovviamente sierovariante-specifica, con possibilità di protezione crociata nei confronti di altre sierovarianti purché appartenenti allo stesso sierogruppo (Levett, 2001; Nardelli, 2004).
All’azione delle tossine si associa anche un effetto autoimmune.
Inizialmente la lesione primaria è il danneggiamento dell'endotelio dei piccoli vasi sanguigni che porta ad ischemia localizzata in vari organi, con conseguente necrosi delle cellule del tubulo renale, danno polmonare, epatico, meningite, miosite e placentite (Adler, 2010).
Nei casi in cui l'infezione sfocia in malattia conclamata già in questa fase di esordio, si rilevano, oltre alla febbre elevata, anoressia, profondo abbattimento, iperemia congiuntivale, bradicardia (Farina, 2002).
Casi di emorragia si verificano quando si riscontra ittero e carenza piastrinica. Una volta che gli anticorpi circolanti compaiono, le leptospire sono rimosse dalla circolazione e dai tessuti ed il danno tissutale, anche se grave, può essere reversibile e seguito da riparazione completa (Levett, 2001).
Per esempio, leptospire virulente hanno mostrato di aderire alle cellule epiteliali tubulari renali in coltura (Ballard et al., 1986).
Con la fine della leptospiremia inizia la seconda fase o fase delle localizzazioni. Il quadro clinico è in tale periodo dominato dal grave e costante interessamento epatico e renale, con ittero. Quando l'infezione decorre invece in forma subclinica, alla fase di leptospiremia segue una persistente localizzazione renale e, con essa,
nefrite interstiziale cronica.
Figura 5: Rene bovino, nefrite interstiziale da leptospirosi (fonte: http://www.fao.org/docrep/003/t0 756e/T0756E03 .htm).
L'aborto costituisce un evento molto frequente nel corso di leptospirosi suina e bovina ed è noto come tale fenomeno rappresenti spesso l'unica manifestazione dell'infezione. Le leptospire infatti, durante la fase di setticemia materna, passano attraverso il filtro placentare, invadono e infettano il feto, di cui determinano la morte in tempi variabili in rapporto al potere patogeno della sierovariante in causa (Levett, 2001; Farina, 2002).
1.6 Leptospirosi
La leptospirosi è una malattia sistemica che colpisce esseri umani e animali domestici e selvatici, soprattutto cani, bovini e suini, caratterizzata da febbre, insufficienza renale ed epatica, manifestazioni polmonari e problemi riproduttivi. I segni clinici si presentano molto variabili; la maggior parte dei casi sono probabilmente inapparenti e associati a sierotipi adattati agli agenti ospitanti, come
Canicola nei cani , Bratislava nei cavalli e nei suini, Hardjo nei bovini e Australis e Pomona sempre nei suini. Tuttavia, altri sierotipi possono essere coinvolti nei casi di malattia grave.
Nei bovini e nei suini i segni di leptospirosi includono problemi riproduttivi, aborto, mortalità alla nascita, mummificazione fetale, suinetti o vitelli disvitali e agalassia. Animali che hanno superato la leptospirosi possono diventare portatori asintomatici che ospitano leptospire virulente nei tubuli renali per periodi estesi con pericolo di diffusione di leptospire infettive nell’ambiente. Animali sensibili si infettano per contatto diretto o indiretto con l'urina o tessuti di animali infetti. Altre specie, come topi e ratti fungono da serbatoi per i loro sierotipi ospite-correlati (topi per Ballum e Icterohaemorrhagiae, ratti per Copenhageni). Questi di solito non mostrano segni evidenti, ma presenza di leptospire nei reni, diventando un'importante fonte di infezione per esseri umani e altri animali (Adler et al, 2009).
1.6.1 La malattia nelle diverse specie animali
Leptospirosi del cane.
Per leptospirosi del cane si intende da sempre lo stato infettivo essenzialmente de-terminato da tre siero-varianti: Leptospira interrogans serovar Icterohaemorrhagiae,
Leptospira interrogans serovar Copenhageni e Leptospira interrogans serovar
Ca-nicola, riconoscendo alle prime due la responsabilità di una sindrome ittero-emorragica acuta, nota anche sotto la denominazione di “ Weil canino” per la perfet-ta analogia anatomoclinica con la corrispondente affezione dell’uomo e la terza co-me causa di un complesso quadro morboso altrico-menti definito “Malattia di Stoccar-da” o “tifo canino”, fondamentalmente caratterizzato, nei casi tipici, da nefrite inter-stiziale, nonché da gastroenterite emorragica e stomatite ulcerosa.
L’impiego generalizzato della vaccinazione preventiva in atto da anni ha determina-to una sensibilissima rarefazione delle infezioni da Canicola, essendosi drastica-mente ridotte le possibilità di contagio per il cane che di tale sierovariante rappre-senta il principale serbatoio naturale.
Ad oggi sono state riconosciute patogene per il cane molte altre sierovarianti, tra le quali ricordiamo Pomona, Grippotyphosa, Ballum, Serjroe, Tarassovi e Bataviae e soprattutto quelle appartenenti al sierogruppo Australis, in particolare la
sierovarian-te Bratislava, che è stata anche a più riprese isolata dall’urina e dai reni di soggetti sieropositivi. Le indagini fin qui svolte inducono a ritenere che il cane sia divenuto uno degli ospiti di mantenimento di questa sierovariante, in particolare del genotipo B2a, la cui attività patogena sembra analogabile a quella di L. Canicola (Farina, 2002).
Alcuni campioni appartenenti ad una popolazione canina francese sono stati trovati sieropositivi anche alla serovar Mozdok, sierogruppo Australis. Un caso particolare è stato quello di un campione di siero trovato positivo unicamente a Mozdok (Ellis, 2010; Renaud et al, 2013)
La leptospirosi nel cane ha diffusione universale anche se la sua frequenza un tempo notevole è andata mano a mano riducendosi per il largo uso della vaccinazione. Colpisce senza distinzione i cani di qualunque età e razza di entrambi i sessi; pre-senta carattere di stagionalità con punte massime nella tarda estate ed in autunno in coincidenza dell’inizio dell’attività venatoria e delle abbondanti precipitazioni at-mosferiche tipiche di quel periodo. Il contagio è nella maggioranza dei casi indiretto e si realizza per lo più in seguito all’ingestione di acqua ed alimenti contaminati dal-le urine di cani o assai più frequentemente di ratti portatori che, deldal-le serovar Icte-rohaemorrhagiae e Copenhageni sono gli ospiti di mantenimento. Per tale ragione ricorre spesso in cani da caccia, avendo questi maggiori occasioni di abbeverarsi in acque stagnanti inquinate.
Il quadro clinico renale, benché più scarso di segni obiettivi, non è pur tuttavia me-no significativo. Nei casi lievi si può osservare oliguria con ipostenuria, nei casi gravi più o meno prolungata anuria, quale espressione dell’insufficienza renale de-terminata dalle lesioni intrinseche e da un grave crollo della pressione arteriosa. Precoci e costanti sono le alterazioni urinarie che accompagnano il decorso della malattia. Le urine appaiono giallo cariche, torbide oppure, quando vi si trova biliru-bina in forte quantità, color marsala. I disturbi a carico dell’apparato digerente sono per lo più di modico grado; oltre al vomito può manifestarsi diarrea emorragica. Gli animali, notevolmente dimagriti, vengono a morte in 8-10 giorni in stato comatoso e in ipotermia (Faine, 1994; Farina, 2002).
Leptospirosi del suino
Per leptospirosi suina si intende l'infezione sostenuta da Leptospira interrogans rovar Pomona, Leptospira noguchii serovar Pomona, Leptospira borgpetersenii se-rovar Tarassovi e Leptospira interrogans sese-rovar Tarassovi, delle quali il maiale rappresenta l'ospite di mantenimento.
Le sierovarianti Pomona e Tarassovi permangono a livello dei tubuli renali, renden-do gli animali colpiti dall'infezione eliminatori urinari permanenti. Inoltre interferi-scono sulla gravidanza determinando aborti e nascita di suinetti disvitali ed il loro eventuale passaggio ad ospiti diversi dal suino, per esempio il bovino, può portare in questi ultimi all'insorgenza di gravi patologie a carattere sistemico o interferenti sulla sfera riproduttiva. La serovar Bratislava è capace di colonizzare l'apparato ge-nitale di scrofe e di verri e di persistere in questa sede più a lungo che in ambito re-nale.
La leptospirosi del suino riveste considerevole importanza economico-sociale per numerosi Paesi, compreso il nostro e la sua area di distribuzione permane ampia a causa della industrializzazione degli allevamenti e quindi degli intensi scambi commerciali di animali che determinano la continua accensione di nuovi focolai. Specialmente nei suini all'ingrasso l'infezione diffonde con estrema rapidità, favori-ta dai rapporti di stretfavori-ta convivenza tra gli animali. La disseminazione di leptospire si realizza con meccanismo diretto quando maiali sani vengono a contatto immedia-to con urina infettante, oppure indiretimmedia-to tramite l'urina sparsa al suolo, l'acqua di be-vanda e l'alimento contaminato (Faine, 1994; Farina, 2002).
Leptospirosi degli equini
Negli equini la leptospirosi è una malattia che si incontra molto raramente in forma conclamata, infatti è spesso del tutto asintomatica. Può essere sostenuta da numero-se specie di Leptospira, ma le più riscontrate sono: Leptospira interrogans sierotipi Icterohemorrhagiae e Pomona, Leptospira noguchii sierotipo Pomona, Leptospira
interrogans sierotipi Bratislava e Grippotyphosa e Leptospira kirschneri sierotipo
Grippotyphosa.
La leptospirosi equina è un'infezione diffusa a livello mondiale. Può esplicarsi in una classica sindrome ittero-emorragica o abortigena oppure nella cosiddetta
oftal-mite periodica. Quest'ultima è rappresentata da flogosi recidivante del sistema uvea-le degli equini, con progressivo interessamento dell'intero globo oculare, fino a giungere alla vera e propria cecità.
La via di trasmissione più frequente è rappresentata dal contatto diretto o indiretto con urina, feti abortiti, placenta e in questa specie non è mai stata documentata la trasmissione venerea (Faine, 1994; Farina, 2002).
Leptospirosi degli ovini.
Casi isolati o piccoli focolai di malattia, sono generalmente sostenuti dalla sierova-riante Hardjo. In Italia sono state riscontrate positività sierologiche negli ovini nei confronti delle serovar Icterohemorrhagiae, Pomona, Ballum, Bratislava, Canicola, Tarassovi. Alla pecora, per molto tempo considerata ospite accidentale della siero-variante Hardjo, è oggi riconosciuto il ruolo di secondo ospite di mantenimento, es-sendo portatrice renale fino a 11 mesi (Pinzauti et al., 2006). Gli ovini sono consi-derati animali scarsamente recettivi. Si deve ricordare però la non trascurabile fre-quenza con la quale l'infezione stessa si manifesta in forme lievi o asintomatiche, difficilmente diagnosticabili. La pecora si infetta soprattutto attraverso l'assunzione di alimenti e acqua di bevanda contaminati dalle urine di animali leptospirurici. Ol-tre alle urine, anche gli aborti, gli invogli fetali e gli scoli vaginali rappresentano dei prodotti morbosi in grado di propagare l'infezione (Faine, 1994; Farina, 2002).
Leptospirosi nei caprini
La recettività di questi animali è molto limitata. I pochi episodi segnalati riguardano soggetti giovani e le sierovarianti Pomona e Grippotyphosa, le quali portano solo ad un'infezione asintomatica di breve durata. Le inchieste sierologiche e le indagini microbiologiche realizzate in alcuni Paesi portano ad affermare che la capra deve essere considerata un ospite puramente accidentale e, come tale, un ospite privo di particolare significato epidemiologico (Farina, 2002).
1.6.2 Zoonosi di importanza globale
La leptospirosi è una zoonosi di importanza globale. Negli ultimi anni, emorragie polmonari gravi, endemiche ed epidemiche, vengono sempre più riconosciute come manifestazioni di infezioni da Leptospira. La leptospirosi è stata anche classificata come la malattia del “viaggiatore all’avventura”, che colpisce soprattutto coloro che praticano degli sport acquatici. È distribuita in tutto il mondo, ma è più comune nelle zone tropicali dove le condizioni per la trasmissione sono particolarmente favorevoli. Tuttavia, la malattia continua a verificarsi nei paesi sviluppati, per esempio, tra i villeggianti nelle isole Hawaii o sporadicamente in centro città. Nel corso degli anni si sono compiuti importanti progressi concernenti diversi aspetti di questa malattia infettiva emergente. Anche se la leptospira non ha il potenziale per poter essere utilizzata come arma biologica, le sue manifestazioni cliniche possono mimare quelle delle febbri emorragiche virali, le quali meritano particolare attenzione (Bharti et al., 2003).
Le condizioni ambientali influenzano pesantemente la trasmissione della leptospirosi andando a modificare la biologia delle popolazioni recettive, il comportamento ed anche l’ecologia stessa delle spirochete e dei loro ospiti (Bharti
et al., 2003).
Nel corso degli anni, infatti, in seguito alle precarie condizioni igienico-sanitarie dovute ad alcuni eventi, quali cambiamenti climatici associati a calamità naturali, si è verificata sempre maggiormente la diffusione di malattie contagiose come la leptospirosi.
La leptospirosi negli esseri umani viene sempre contratta grazie ad un animale ospite di mantenimento, il quale costituisce una riserva naturale di un sierotipo in un particolare ecosistema. All’interno di ciascun ecosistema, l’ospite di mantenimento costituisce la nicchia ecologica per quel particolare sierotipo; cioè la particolare posizione funzionale al mantenimento dell’equilibrio ambientale che il sierotipo occupa all’interno dell’ecosistema in rapporto con gli altri esseri viventi (Tolari et
al., 1987).
Le leptospire patogene vivono nei tubuli prossimali dei reni dei portatori anche se possono essere fonte di infezione altri tessuti e organi. Dai reni, le leptospire sono escrete nelle urine e possono quindi contaminare il suolo, le acque superficiali, i
torrenti e i fiumi.
Le infezioni di animali o di esseri umani si verificano dal contatto diretto con l'urina o indirettamente da contaminazione delle acque. I vettori possono essere animali selvatici o domestici, in particolare roditori e piccoli marsupiali, bovini, maiali e cani (Fig. 6).
Figura 6: Epidemiologia della Leptospirosi negli animali e nell'uomo http://leptospira.org).
Quasi tutti i mammiferi (tra cui mammiferi acquatici) e marsupiali di tutto il mondo sono stati dimostrati essere portatori di leptospire. Gli esseri umani non diventano quasi mai portatori cronici, ma presentano infezioni acute, a volte con conseguenze a lungo termine.
La leptospirosi nell'uomo può variare di gravità, a seconda del sierotipo infettante di
uno stadio lieve, malattia simil-influenzale, ad una grave infezione con insufficienza renale ed epatica, insufficienza polmonare e morte (la classica malattia di Weil). Esistono caratteristiche associazioni di particolari sierotipi con determinate specie animali a supporto, ma le associazioni non sono specifiche e sempre verificabili. Lo stato del portatore renale è quindi una componente fondamentale centrale per la persistenza e l'epidemiologia della leptospirosi.
Le leptospire non sopravvivono bene nelle urine acide, ma rimangono vitali in urina alcalina. Di conseguenza, gli erbivori e gli animali la cui dieta produce urine alcaline sono relativamente più importanti rispetto ai produttori di urina acida (Adler et al., 2009).
La leptospirosi nell'uomo inizia improvvisamente con mal di testa, febbre (in genere a 39°C), malessere e mialgia.
Successivamente, la malattia può essere lieve e autolimitante o grave e mortale. Il tipo lieve può essere grave e invalidante, ma raramente porta a insufficienza epatica o renale, emorragie o morte.
Le serovar coinvolte maggiormente negli episodi umani sono: prima tra tutte serovar Icterohaemorrhagiae, leptospira più pericolosa e virulenta, seguono Hardjo, Pomona, Copenhageni, Canicola, Bataviae, Grippotyphosa, Hyos, Sejroe ed Australis.
La malattia dovuta all’infezione da parte dei sierotipi sopra citati può portare occasionalmente a leptospirosi gravi che possono condurre anche a morte. L’infezione umana da serovar Pomona può causare insufficienza renale, mentre gravi problemi alla colecisti sono stati segnalati per le infezioni da Hardjo. I sintomi iniziali possono essere seguiti da remissione transitoria, che può quindi procedere ad una riacutizzazione e includono meningite asettica, insufficienza renale e dolori addominali o al torace.
Il recupero è di solito completo, ma debolezza, stanchezza, depressione, e anche psicosi possono impedire un ritorno alla vita normale per settimane o mesi.
Le leptospirosi più gravi sono osservate oltre che nelle infezioni da sierotipo Icterohaemorrhagiae, anche da sierotipo Copenhageni. Le fonti di infezione sono più comunemente ratti o altri roditori. Un aggravarsi della malattia solitamente avviene subito dopo l’insorgenza, di modo che l’insufficienza renale può verificarsi
entro 7-10 giorni.
Sono stati segnalati tassi di mortalità che si avvicinano al 20% ed è stata recentemente riconosciuta una manifestazione respiratoria associata a Leptospira che comporta grave edema ed emorragia polmonare, causa principale di morte in alcune epidemie. Leptospirosi croniche e in gravidanza, inoltre, portano rischi di infezione intrauterina e morte fetale (Levett, 2001; Bharti et al., 2003).
Gli esseri umani possono essere infettati:
dopo il contatto diretto con l’animale infetto;
indirettamente attraverso l’acqua, il cibo o il terreno contaminato con batteri;
quando i batteri penetrano nella cute abrasa o nelle mucose della bocca, del naso o attraverso la congiuntiva;
contagio proveniente da un feto abortito o da placenta, dovuto all’assistenza durante il parto senza un’adeguata protezione per il personale.
La sala mungitura, tra gli schizzi di urina ed il contatto tra le vacche e i mungitori, è un ambiente molto favorevole perché l’infezione si verifichi. La leptospira infatti è riversata nel latte quando le vacche sono malate. Per questi motivi si ritiene che i produttori di latte, le loro famiglie e le persone che lavorano nelle aziende lattiero-casearie siano sottoposte a maggior rischio di contrarre l’infezione.
Si sono verificati più di 70 casi umani in Australia segnalati alla New South Wales (NSW) Public Health Unit nel 2001 e circa 40 casi umani segnalati tra il 2003 e il 2004. La tendenza decrescente potrebbe essere associata al fatto che con gli anni si è instaurata una maggiore consapevolezza del rischio di contrarre leptospirosi in ambiente rurale.
Tuttavia, si ritiene che il numero reale di esseri umani infettati da Leptospira sia molto maggiore del numero di casi citati, poiché molti infettati non si rivolgono alle autorità sanitarie o gli viene erroneamente diagnosticata una sindrome influenzale. Norme di salute e sicurezza sul lavoro richiedono agli agricoltori di fornire un ambiente sicuro per i loro dipendenti.
Il modo più efficace è proteggere gli esseri umani vaccinando regolarmente tutte le vacche da latte ed evitando che materiale infetto venga a contatto con il corpo, e con i dispositivi di protezione individuale compresi guanti, grembiuli, impermeabili e stivali.
Le misure preventive da adottare negli allevamenti sono le seguenti:
applicare le barriere in capannoni lattiero-caseari, come paraspruzzi e coprire i canali di drenaggio;
periodiche visite veterinarie;
allontanarsi quando gli animali urinano;
il letame e i liquami devono subire una buona maturazione prima di essere usati come fertilizzanti;
bere solo latte pastorizzato o crudo preventivamente bollito;
tenere i bambini lontani da capannoni da latte e i bovini dai cantieri;
lavarsi sempre accuratamente dopo il contatto con il bestiame;
porre attenzione a scarichi e a zone paludose;
effettuare una costante lotta ai roditori ed ai suini selvatici;
separare il bestiame da maiali, porcilaie, dagli effluenti di porcilaie e dalla fauna selvatica;
prevedere adeguate procedure di quarantena per prevenire l’introduzione di leptospire;
adottare precauzioni igieniche per tutti gli addetti ai lavori: indossare stivali quando si va in stalla e i guanti impermeabili quando si rischia di entrare in contatto con deiezioni animali e soprattutto con materiale patologico (es. feti, placente, carcasse ecc.);
cambiarsi e lavarsi le mani prima di rientrare a casa (Bolin, 2003; Colavita et
al., 2007; Zelski, 2007).
1.7 Diagnosi di laboratorio
A causa della grande diversità dei segni clinici la diagnosi di leptospirosi è difficile e dipende da una varietà di test di laboratorio.
Gli esami di laboratorio sono diretti alla dimostrazione della presenza dell'infezione mediante esame istologico di organi e tessuti, osservazione microscopica dei liquidi organici, isolamento in coltura, inoculazione di animali da esperimento ed indagine sierologica (Adler, 2010).
1.7.1 Coltivazione in laboratorio
Le leptospire sono microrganismi microaerofili, la cui coltivazione richiede particolari accorgimenti.
Prove di laboratorio hanno dimostrato che la soglia massima di temperatura a cui le leptospire riescono a sopravvivere è pari a 41-42°C, mentre sono inattivate in soli 45 minuti a temperature di 50-55°C. Appaiono invece ben più resistenti alle basse temperature, al punto che un ottimo sistema di conservazione è rappresentato dalla loro immissione in azoto liquido a -196°C, utilizzando come crioprotettore il DMSO (dimetilsulfossido) al 5% o il classico glicerolo. Un altro metodo adatto per la conservazione è la liofilizzazione che permette di preservarle per lungo tempo. Nonostante alcune sierovarianti crescano bene a 37°C e numerose specie saprofite a temperature di 11-13°C, l'ottimale temperatura a cui si moltiplicano è compresa tra 28 e 30°C.
L'acqua salmastra può neutralizzarle in breve tempo, non tollerando in genere concentrazioni di NaCl superiori al 2,5%; esistono comunque alcune sierovarianti definite alofile, che necessitano per lo sviluppo della presenza dello ione Na+. Notevole importanza ha la reazione del terreno, essendo sensibilissime soprattutto agli spostamenti verso l'acidità: il pH ottimale varia fra 7,2 e 7,6 (Ellinghausen, 1973; Faine, 1994; Farina, 2002).
Per la coltivazione si può ricorrere a terreni semisolidi, liquidi o solidi.
Negli appropriati terreni liquidi di coltura la loro curva di crescita è simile a quella della maggior parte dei batteri, ma richiede solitamente tempi molto più lunghi. Infatti i tempi di duplicazione si aggirano intorno alle 6-8 ore per le sierovarianti patogene, mentre le acquicole necessitano di tempi ridotti. Per lo sviluppo in coltura le leptospire utilizzano prevalentemente gli acidi grassi a lunga catena (più di C15) da cui, tramite processi di ß-ossidazione, ricavano carbonio ed energia. Concentrazioni elevate di acidi grassi risultano tuttavia tossiche per questi microrganismi, per cui, è importante l'associazione nel medium di sostanze ad azione detossificante, che agiscono assorbendo gli acidi grassi in questione, rilasciandoli nel terreno di coltura a basse concentrazioni. Tra le sostanze maggiormente impiegate si sono dimostrate indispensabili il siero emolizzato di coniglio al 4% e la frazione V di albumina bovina. Le sierovarianti apatogene sono
in grado di utilizzare indistintamente gli acidi grassi saturi e insaturi con catene formate da 12-18 atomi di carbonio, mentre le sierovarianti patogene appaiono in genere maggiormente selettive, necessitando di catene sature a 15 atomi di carbonio e potendosi servire delle catene insature solo in presenza di quelle sature. Esistono alcune linee mutanti di leptospira che possono crescere e moltiplicarsi anche in assenza di sostanze detossificanti ed alcuni ceppi produttori di lipasi, che nei terreni solidi provocano la formazione di placche di lisi ben evidenti, con conseguente saturazione del terreno che perde così la sua capacità detossificante (Faine, 1994). Oltre al substrato energetico possono essere aggiunti al terreno molti altri composti per favorire la crescita di questi microrganismi: il piruvato di sodio e il glicerolo. É stato altresì accertato che la presenza di alcuni aminoacidi (arginina, prolina, lisina, asparagina, acido aspartico o glutammico), di acidi grassi (formico e tartarico) e di vitamine (tiamina, riboflavina, cobalamina, acido nicotinico) incrementa la crescita senza che però tali sostanze, singolarmente o in varia associazione tra loro, siano in alcun modo capaci di sostituire il siero di sangue di coniglio o l'albumina bovina. I metalli pesanti, se presenti nel terreno di coltura, hanno effetto tossico. Il ferro, che invece risulta essenziale per lo sviluppo, influenza positivamente la patogenicità (Levett, 2001; Farina, 2002).
Nei terreni di coltura viene impiegato il 5-fluorouracile come agente selettivo, in virtù del fatto che le leptospire possono incorporare nel loro DNA le basi puriniche, ma non quelle pirimidiniche (Faine, 1994; Levet, 2001).
La possibilità di coltivare le leptospire su terreni solidi è conosciuta fin dal 1957; solo in epoca recente però si sono allestiti terreni di questo tipo contenenti, oltre alla frazione V di albumina bovina e siero di coniglio, anche sostanze ad azione tensioattiva come i tween che, se aggiunti al terreno, rendono disponibili gli acidi grassi in forma non tossica, complessati con esteri del poliossietilene sorbitano. Per il primo isolamento delle leptospire si fa solitamente ricorso a terreni liquidi e la crescita, in questo caso, è sempre piuttosto lenta e può richiedere fino a 24-26 settimane, a causa delle difficoltà di adattamento dei microrganismi al terreno. Nei passaggi succesivi invece la crescita si evidenzia in soli 4-6 giorni. Ad ogni modo i terreni liquidi sono quelli maggiormente impiegati per l'isolamento e per il mantenimento delle colture da utilizzare come antigene per i test sierologici di
microagglutinazione.
Tra i terreni liquidi maggiormanete impiegati troviamo: il terreno di
Ellinghausen-McCullogh-Johnson-Harris (EMJH) contenente tween 80 e albumina serica bovina
(BSA), il terreno di Korthof-Babudieri e quello di Stuart contenenti siero parzialmente emolizzato di coniglio.
Tra i terreni semisolidi, che contengono lo 0,1-0,2% di agar, ricordiamo l'EMJH
medium ed il terreno di Flethcher. In essi la crescita delle leptospire si manifesta
con un intorbidimento superficiale dello spessore di 1-2 cm di altezza e può richiedere fino a 26 settimane.
I terreni solidi, come già detto poco frequentemente impiegati, contengono agar in percentuale variabile da 1,2% a 2%, Tween 80, siero di coniglio o BSA e piruvato di sodio. Le colonie si presentano di forma rotondeggiante di varie dimensioni e si rendono evidenti in 20-30 giorni dall'avvenuta semina. Più che per l'isolamento e la conservazione degli stipiti, i terreni solidi possono rivelarsi utili per lo studio di eventuali variazioni di fase e di mutazioni (Faine et al., 1999; Farina, 2002).
La conservazione a lungo termine in azoto liquido sta producendo buoni risultati ed appare il miglior metodo di “memorizzazione” perchè possa essere mantenuta la virulenza del ceppo (Adler et al., 2010).
1.7.2 Esame sierologico
La diagnosi sierologica è uno strumento fondamentale non solo per accertare in un animale la presenza di anticorpi specifici verso una determinata sierovariante qualora si abbiano sospetti in seguito a manifestazioni cliniche come l’aborto, ma anche per controllare periodicamente i capi presenti in un allevamento e quelli di nuova introduzione (Cerri et al., 2003).
Il rilevamento di anticorpi specifici è possibile tramite il test di agglutinazione microscopica (MAT), il saggio indiretto di emoagglutinazione (IHA) e il test immuno-enzimatico (ELISA ) (Faine et al, 1999; Levett, 2001; Bharti et al, 2003). MAT è la prova sierologica di più largo impiego ed ha il vantaggio di essere specifica per i sierotipi, o almeno per i sierogruppi. Tale microagglutinazione è in grado di rilevare gli anticorpi specifici nei confronti delle diverse sierovarianti. L'antigene è rappresentato da colture di leptospire vive in terreno liquido. Ogni
siero in esame viene posto a contatto con diverse sierovarianti alla diluizione iniziale di 1:100. Se questa prima prova dà risultato positivo, si allestiscono diluizioni scalari del siero che si saggiano poi con la sierovariante o le sierovarianti agglutinate. La reazione positiva è svelata al microscopio in campo oscuro da quadri più o meno netti di agglutinazione.
La lettura della prova si considera positiva quando si ha il 50% o più di agglutinati rispetto a leptospire libere sul campo e su più campi di osservazione al microscopio osservati (Figura 7).
La concentrazione di leptospire libere deve essere paragonabile al controllo antigene, costituito dalla coltura diluita 1:2 in soluzione fisiologica. Dal punto di vista pratico, è necessario valutare il numero di leptospire libere e non di quelle agglutinate, che sono difficilmente misurabili a causa di agglutinazione e precipitazione. Per questo motivo è importante utilizzare per la prova un ceppo la cui concentrazione sia nota (generalmente 2x108 leptospire/ml), e le cui condizioni colturali in termini di purezza e vitalità siano ottimali.
Gli anticorpi agglutinanti sono svelabili nel siero a partire da 7-10 giorni dall’infezione; il loro tasso poi aumenta rapidamente fino a un massimo di 5 x 105
- 1 x 106 (Farina, 2002; Suepaul et al., 2011).
Sono tuttavia dimostrabili per molti mesi e, spesso, anche per anni. La valutazione dei risultati è quindi in funzione del tempo intercorrente fra inizio dell’infezione ed accertamento sierologico. Nelle forme conclamate di malattia il titolo è solitamente molto basso, così che la diagnosi può essere confermata solo dopo sieroconversione. Le agglutinine sono dimostrabili, seppur con tassi nettamente inferiori rispetto al sangue, anche nel liquor, nelle urine, nel latte, nel muco cervico-vaginale delle bovine e negli umori oculari dei cavalli.
Il più grande pregio del test di microagglutinazione risiede nella sua alta specificità e nel fatto di consentire quasi sempre l’esatta individuazione della sierovariante in causa. Si dimostra estremamente utile per inchieste sieroepidemiologiche e rende ancora oggi valido aiuto alla tipizzazione degli stipiti. Al pari di tutti gli altri test sierologici fallisce, e non di rado, nella individuazione dei portatori renali cronici di leptospire (suini e in particolare bovini) (Farina, 2002).
impiegata come prova di screening su quantità numerose di sieri, in modo tale da ridurre al minimo il ricorso alla microagglutinazione. Rispetto a quest’ultima ha lo svantaggio di essere meno sensibile, di non svelare anticorpi a basso titolo e di non consentire il riconoscimento della sierovariante o delle sierovarianti responsabili dell’infezione.
L’ELISA (enzyme-linked immunosorbent assay) indiretta è stata impiegata a partire dagli anni ottanta, inizialmente in medicina umana dove anche oggi trova un più largo utilizzo. Solo in un secondo momento questo test è stato impiegato anche in medicina veterinaria, sebbene più a scopo di ricerca che di diagnosi routinaria (Farina, 2002).
Figura 7: Immagini al microscopio ottico in campo scuro. Diverse reattività al test di microagglutinazione (MAT): reazioni positive decrescenti a partire da agglutinazione al 100% (A) fino ad arrivare ad assenza di agglutinazione (F). In corrispondenza di D si ha reazione pari al 50 di agglutinazione, corrispondente alla soglia di positività (Manual of Diagnostic Tests and Vaccines for Terrestrial Animals, 2008).
2 . LA LEPTOSPIROSI BOVINA
La leptospirosi bovina è un'infezione cosmopolita che può estrinsecarsi in forme clinicamente manifeste, caratterizzate da febbre, anemia, ittero, emoglobinuria e, nelle femmine, agalassia, mastite atipica ed aborto, oppure in forme lievi o del tutto asintomatiche, che sfuggono alla diagnosi e spesso passano del tutto inosservate. Si tratta di un'infezione a diffusione universale, i cui aspetti epidemiologici variano a seconda delle sierovarianti che la sostengono (Faine, 1994; Farina, 2002).
Per leptospirosi bovina si intende l'infezione da Leptospira borgpetersenii serovar Hardjo e serovar Hardjo-bovis, Leptospira interrogans serovar Hardjo, Leptospira
meyeri serovar Hardjo e Leptospira interrogans serovar Hardjo-prajitno, delle quali
il bovino è l'ospite di mantenimento. Responsabile di frequenti focolai in varie parti del mondo, compresa l'Italia, risulta la serovar Pomona, mentre sono piuttosto rare le infezioni ad eziologia diversa (Canicola, Tarassovi). La serovar Grippotyphosa, non di rado, causa episodi morbosi in Europa centro-orientale. Occorre infine ricordare, in quanto riportato in letteratura, il coinvolgimento di altre sierovarianti, quali Bratislava.
La malattia può colpire indifferentemente animali di qualunque razza, età, sesso e attitudine, pur notandosi di solito una più spiccata recettività nelle vacche da latte e nei vitelli, tra i quali si assiste ad una mortalità più elevata. Sul piano clinico l'infezione si manifesta con sintomi diversi e di diversa intensità (aborti, natimortalità, infertilità e riduzione della produzione di latte) in rapporto anche alla sierovariante (Ellis et al., 1985; Levett, 2001).
Nonostante nel bovino siano state segnalate infezioni da diversi sierotipi: Hardjo, Pomona, Ballum, Tarassovi, Copenagheni, Bratislava, i sierotipi patogeni che in Italia, e non solo, infettano con più frequenza il bovino e hanno possibilità di indurre malattia, sono la serovar Pomona e la serovar Hardjo. La prima ha maggiore evidenza clinica nel vitello, la seconda nell'adulto. Non sono tuttavia da trascurare altre sierovarianti quali la Icterohaemorragiae e la Grippotyphosa, causa di mastiti e aborti (Buonaccorsi, 1987; Tolari, 1987; Colavita e Paoletti, 2007).