Capitolo 3
Parte sperimentale
PARTE SPERIMENTALE
Materiale vegetale
Le foglie di Ruprechtia polystachya Griseb. sono state raccolte presso El Zoharia Research Garden al Cairo in Egitto nel maggio del 2007. Un campione di materiale vegetale (n.2211 Ruprechtia polystachya/1) è stato depositato presso l’Herbarium Horti Botanici Pisani, Erbario generale, Flora Aegyptiaca.
Il materiale vegetale (900 g) è stato sottoposto a essiccamento all’aria e quindi opportunamente macinato per poter passare al processo di estrazione dei metaboliti con vari solventi.
Estrazione
Le foglie essiccate e macinate di R. polystachya (900 g) sono state estratte a temperatura ambiente con solventi a polarità crescente, in ordine: n-esano, cloroformio, miscela di cloroformio e metanolo in proporzione 9:1 e, infine, metanolo. Il materiale vegetale è stato lasciato macerare in ogni solvente per circa 3 settimane, durante questo periodo il solvente è stato rinnovato ogni 72 ore circa per un totale di 4 volte per ogni tipo di solvente. A ogni cambio di solvente l’estratto ottenuto è stato evaporato a pressione ridotta e a temperatura compresa fra i 35 e i 40°C, utilizzando un rotavapor. Ad estrazione terminata si sono ottenute le seguenti rese:
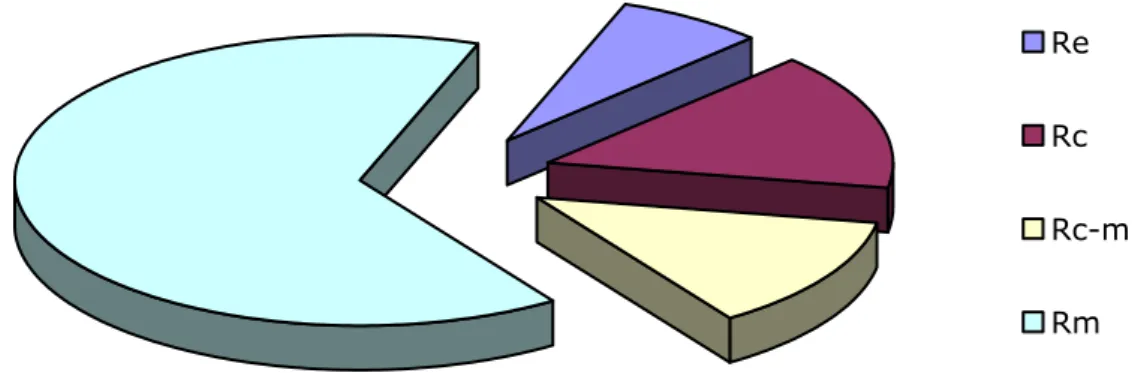
Estratto esanico (RE): 7.863 g
Estratto cloroformico (RC): 17.558 g
Estratto cloroformio-metanolico (RC-M): 14.583 g Estratto metanolico (RM): 74.136 g
Figura 3.1 Procedura di estrazione delle foglie di R. polystachya.
Re Rc Rc-m Rm
Figura 3.2 Risultati delle estrazioni di R. polystachya.
In base ai precedenti studi sul genere e a un’analisi preliminare condotta
D DRROOGGAA E ESSSSIICCCCAATTAA 9 90000 gg Macerazione n-esano Macerazione CHCl3 Macerazione CHCl3:MeOH (9:1) Macerazione MeOH RE 7.863 g RC 17.558 g RC-M 14.583 g RM 74.136 g
Studio dell’estratto cloroformico R
CIl residuo cloroformico (RC) ottenuto per completa evaporazione del
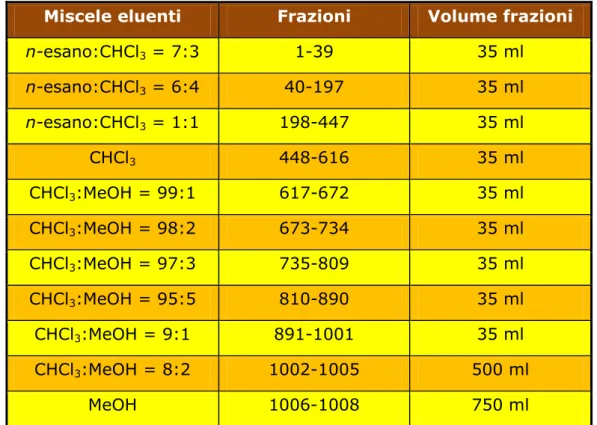
solvente, presentava un peso complessivo di 17.558 g. Una parte di questo residuo (9.6 g circa) è stata disciolta nella minima quantità possibile di una miscela di n-esano-cloroformio in proporzione 7:3 e successivamente centrifugata. Il sopranatante ottenuto è stato sottoposto a cromatografia flash, realizzata in una colonna di gel di silice (25 x 9 cm), con flusso approssimativo di 20 ml/min. Sono state raccolte, in beute, 1008 frazioni utilizzando, come eluenti, miscele di solventi a polarità crescente, come illustrato in Tabella 3.a.
Miscele eluenti Frazioni Volume frazioni
n-esano:CHCl3 = 7:3 1-39 35 ml n-esano:CHCl3 = 6:4 40-197 35 ml n-esano:CHCl3 = 1:1 198-447 35 ml CHCl3 448-616 35 ml CHCl3:MeOH = 99:1 617-672 35 ml CHCl3:MeOH = 98:2 673-734 35 ml CHCl3:MeOH = 97:3 735-809 35 ml CHCl3:MeOH = 95:5 810-890 35 ml CHCl3:MeOH = 9:1 891-1001 35 ml CHCl3:MeOH = 8:2 1002-1005 500 ml MeOH 1006-1008 750 ml
Tabella 3.a Cromatografia flash di RC, miscele eluenti, frazioni raccolte e loro volumi.
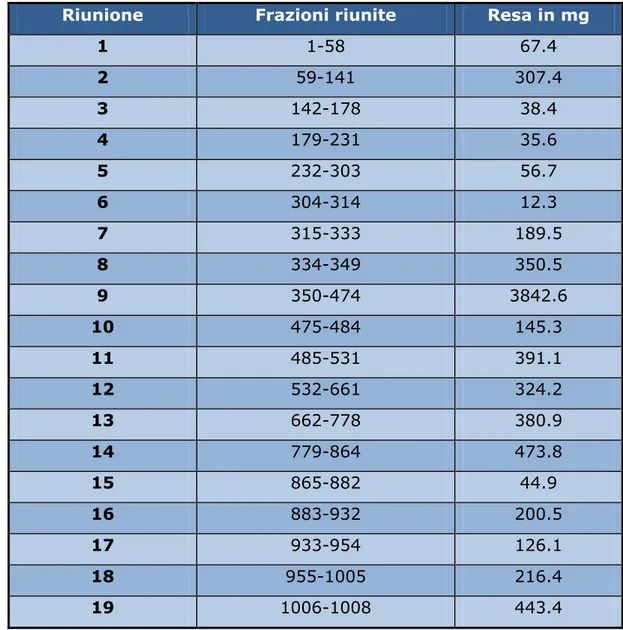
Le frazioni ottenute sono state successivamente riunite in 19 frazioni principali sulla base delle caratteristiche cromatografiche evidenziate da cromatografia su strato sottile (TLC) su lastra di gel di silice 60 F254,
utilizzando come fase mobile cloroformio, differenti miscele di n-esano-cloroformio (8:2, 7:3 e 1:1) e di n-esano-cloroformio-metanolo (97:3, 95:5 e 9:1),
rivelate con il reattivo spray solfato di cerio. Al termine si è ottenuto lo schema di riunione presentato in Tabella 3.b.
Riunione Frazioni riunite Resa in mg
1 1-58 67.4 2 59-141 307.4 3 142-178 38.4 4 179-231 35.6 5 232-303 56.7 6 304-314 12.3 7 315-333 189.5 8 334-349 350.5 9 350-474 3842.6 10 475-484 145.3 11 485-531 391.1 12 532-661 324.2 13 662-778 380.9 14 779-864 473.8 15 865-882 44.9 16 883-932 200.5 17 933-954 126.1 18 955-1005 216.4 19 1006-1008 443.4
Analisi della frazione RC/8
La frazione RC/8 (350.5 mg), sottoposta a TLC su lastra di gel di silice 60
F254, usando come miscela eluente n-esano-cloroformio, in rapporto 1:1,
ha fornito una singola macchia di colore arancione scuro. La conferma della purezza del composto è stata ottenuta tramite analisi spettro-scopiche che hanno permesso di identificare il composto 1, brevifolina, un acetofenone.
I dati chimico-fisici del composto 1 sono i seguenti:
Composto 1 solido cristallino giallo crema; 1H-NMR e 13C-NMR vedi
Tabella 2.1, capitolo 2; ESI-MS m/z 197 [M+H]+.
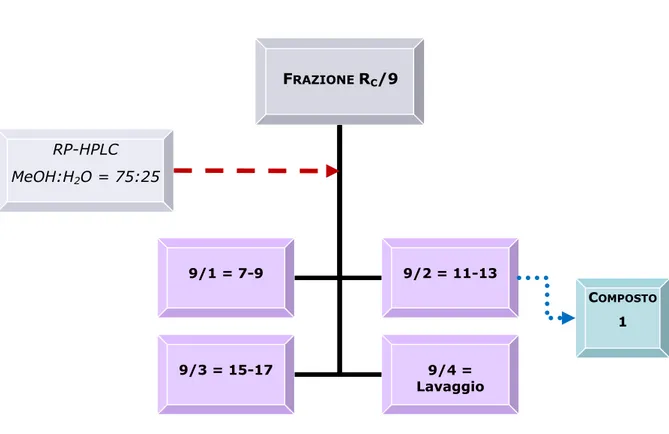
Analisi della frazione RC/9
Una parte della frazione RC/9 (715.4 mg) è stata disciolta in 7 ml di una
soluzione di metanolo-acqua (75:25) e centrifugata. Il sopranatante è stato sottoposto a cromatografia ad alta pressione (HPLC) su una colonna semipreparativa µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata
condizionata ed eluita con una miscela di metanolo-acqua (75:25) operando nelle seguenti condizioni:
Attenuazione: 8x
Eluente: MeOH:H2O (75:25)
Iniettata: 100 µl
Numero di iniettate: 15
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 18 frazioni più il lavaggio della colonna che, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254, usando come fase mobile una miscela di
cloroformio-metanolo (98:2) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state quindi compiute 4 riunioni, come mostrato in Figura 3.3.
FRAZIONE RC/9 9/1 = 7-9 9/2 = 11-13 RP-HPLC MeOH:H2O = 75:25 9/3 = 15-17 9/4 = Lavaggio COMPOSTO 1
La frazione 9/2 (1.9 mg, tR= 10 min), cromatografata con TLC, ha rivelato
una singola macchia di colore arancione scuro. La purezza del composto è stata confermata dalle analisi spettroscopiche che hanno permesso di identificare la molecola come brevifolina, già isolata nella frazione RC/8
(composto 1).
Analisi della frazione RC/11
La frazione RC/11 (391 mg) è stata disciolta in 3.9 ml di metanolo e
centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna semipreparativa µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata
condizionata ed eluita con una miscela di metanolo-acqua (85:15) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (85:15)
Iniettata: 100 µl
Numero di iniettate: 12
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 14 frazioni più il lavaggio della colonna che, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di
cloroformio-metanolo (98:2) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state quindi compiute delle riunioni, come mostra la Figura 3.4.
La frazione 11/10 (26.5 mg, tR= 38 min), sottoposta a TLC, ha mostrato
una singola macchia di colore giallo chiaro. Le analisi spettroscopiche hanno permesso di identificare la molecola come acido palmitico (composto 2), un acido grasso saturo.
I dati chimico-fisici del composto 2 sono i seguenti:
Composto 2 solido cristallino bianco; 1NMR δ 0.89 (3H, t, J= 6.5 Hz,
H-16), 1.57 (2H, m, H-15), 1.27 (24H, m, H-3-14), 2.26 (2H, t, J= 7.5 Hz, H-2), 13C-NMR δ 14.0 (C-16), 25.7 (C-15), 30.2 (C-3-14), 34.6 (C-2), 172.1 (COOH); ESI-MS m/z 255 [M-H]-, 511 [2M-H]-.
FRAZIONE RC/11 11/7 = 22+23 11/8 = 25 RP-HPLC MeOH:H2O = 85:15 11/9 = 27+31 11/10 = 28-30 COMPOSTO 2 11/3 = 7-8 11/6 = 21+24 11/5 = 14-20 11/4 = 9-13 11/2 = 3-4 11/1 = 2 11/11 = 32 11/12 = 33-35
Studio dell’estratto cloroformio-metanolico R
C-MIl residuo cloroformio-metanolico (RC-M), ottenuto dopo la completa
evaporazione dei solventi a temperatura ambiente, presentava un peso complessivo di 14.583 g. Una parte di questo estratto (9.723 g) è stata disciolta nella minima quantità possibile di metanolo e centrifugata.
Il sopranatante è stato sottoposto a cromatografia di esclusione molecolare su una colonna di Sephadex LH 20 (diametro = 5 cm, V = 19.6 ml/cm), eluendo con metanolo al flusso costante di 0.8 ml/min.
Sono state raccolte 198 provette, del volume di circa 15 ml ciascuna, che sono state riunite in 20 frazioni principali, sulla base delle caratteristiche cromatografiche evidenziate in seguito a TLC su lastra di gel di silice 60 F254.
Come fase mobile è stata usata una miscela di CMW (cloroformio-metanolo-acqua in proporzione 80:18:2), mentre la rivelazione è stata condotta con il reattivo spray solfato di cerio e, quando necessario, con il reattivo spray NTS/PEG.
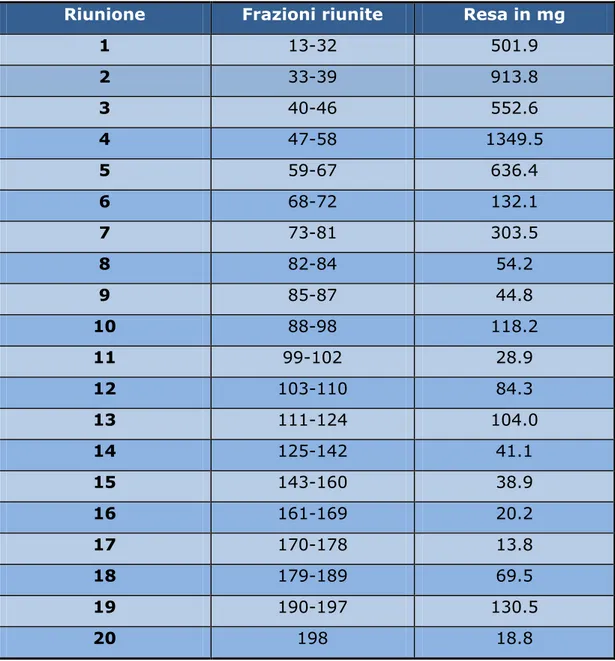
Al termine si è ottenuto lo schema di riunione riportato in Tabella 3.c. Le frazioni non riunite sono state eliminate.
Riunione Frazioni riunite Resa in mg 1 13-32 501.9 2 33-39 913.8 3 40-46 552.6 4 47-58 1349.5 5 59-67 636.4 6 68-72 132.1 7 73-81 303.5 8 82-84 54.2 9 85-87 44.8 10 88-98 118.2 11 99-102 28.9 12 103-110 84.3 13 111-124 104.0 14 125-142 41.1 15 143-160 38.9 16 161-169 20.2 17 170-178 13.8 18 179-189 69.5 19 190-197 130.5 20 198 18.8
Analisi della frazione RC-M/5
Fin dalle prime analisi su TLC la frazione RC-M/5 è risultata molto
complessa per poter essere immediatamente sottoposta a separazione tramite RP-HPLC. Si è così deciso di semplificarla avvalendosi di una ulteriore tecnica cromatografica semipreparativa, la SPE (Solid Phase Extraction).
La frazione RC-M/5 (636.4 mg) è quindi stata disciolta in 1.5 ml di una
miscela di metanolo-acqua (1:9) e centrifugata. Il sopranatante è stato caricato su colonna SPE (Lichroprep® RP18, fase inversa),
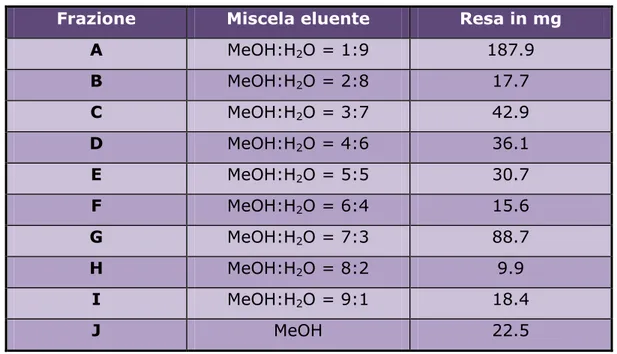
precedentemente condizionata con la stessa miscela metanolo–acqua (1:9). La cromatografia è stata eseguita a gradiente di polarità decrescente raccogliendo frazioni di 100 ml ciascuna secondo quanto riportato in Tabella 3.d. Il solvente è stato poi evaporato a pressione ridotta e temperatura inferiore a 40°C.
Frazione Miscela eluente Resa in mg
A MeOH:H2O = 1:9 187.9 B MeOH:H2O = 2:8 17.7 C MeOH:H2O = 3:7 42.9 D MeOH:H2O = 4:6 36.1 E MeOH:H2O = 5:5 30.7 F MeOH:H2O = 6:4 15.6 G MeOH:H2O = 7:3 88.7 H MeOH:H2O = 8:2 9.9 I MeOH:H2O = 9:1 18.4 J MeOH 22.5
Tabella 3.d Frazioni, miscele eluenti e rese della SPE della frazione RC-M/5.
Le 10 frazioni raccolte sono state quindi sottoposte a TLC su lastra di gel di silice 60 F254 usando come eluenti sia una miscela di
cloroformio-metanolo 9:1 sia una miscela di CMW (80:18:2) e rivelate usando il solfato di cerio come reattivo spray.
Analisi della frazione RC-M/5/D
La frazione RC-M/5/D (36.1 mg) è stata disciolta in 400 µl di metanolo e
centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata condizionata ed
eluita con una miscela di metanolo-acqua (40:60) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (40:60)
Iniettata: 100 µl
Numero di iniettate: 3
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 28 frazioni più il lavaggio della colonna che, dopo completa evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di
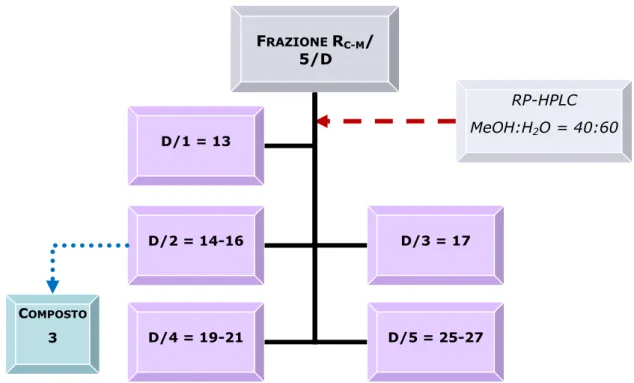
CMW (80:18:2) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state quindi compiute 5 riunioni, come mostrato nella Figura 3.5.
La frazione D/2 (2.3 mg, tR= 24 min), cromatografata con TLC, ha rivelato
una singola macchia di colore marrone scuro. La purezza del composto è stata confermata dalle analisi spettroscopiche che hanno permesso di identificare la molecola come alcol diidrodeidrodiconiferilico, un derivato fenolico della classe dei lignani (composto 3).
I dati chimico-fisici del composto 3 sono i seguenti:
Composto 3 solido amorfo arancio-bruno; 1H-NMR e 13C-NMR vedi
FRAZIONE RC-M/ 5/D D/2 = 14-16 D/3 = 17 RP-HPLC MeOH:H2O = 40:60 D/4 = 19-21 D/5 = 25-27 COMPOSTO 3 D/1 = 13
Figura 3.5 HPLC della frazione RC-M/5/D.
Analisi della frazione RC-M/7
Una parte della frazione RC-M/7 (107.1 mg) è stata disciolta in 1 ml di
metanolo e centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata
condizionata ed eluita con una miscela di metanolo-acqua (60:40) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (60:40)
Iniettata: 100 µl
Numero di iniettate: 8
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 31 frazioni più il lavaggio della colonna. Dopo completa evaporazione del solvente le frazioni sono state disciolte nella minima quantità possibile di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di
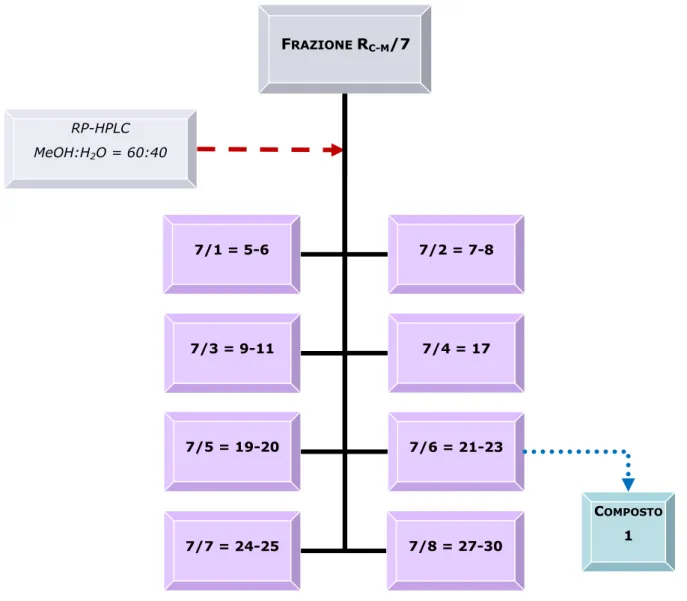
CMW (80:18:2) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state effettuate le 8 riunioni presenti in Figura 3.6.
FRAZIONE RC-M/7 7/7 = 24-25 RP-HPLC MeOH:H2O = 60:40 7/3 = 9-11 7/6 = 21-23 7/5 = 19-20 7/4 = 17 7/2 = 7-8 7/1 = 5-6 7/8 = 27-30 COMPOSTO 1
Figura 3.6 HPLC della frazione RC-M/7.
La frazione 7/6 (11.2 mg, tR= 24 min), cromatografata con TLC, ha
mostrato una singola macchia di colore arancione scuro. Studiata ulteriormente con tecniche spettroscopiche è stata identificata con il composto 1, brevifolina, già isolato in due frazioni dell’estratto cloroformico, RC/8 e RC/9.
Eluente: MeOH:H2O (40:60)
Iniettata: 100 µl
Numero di iniettate: 4
Velocità di flusso: 2.0 ml/min
Dalla cromatografia sono state ottenute 42 frazioni più il lavaggio della colonna che, dopo la completa evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e sottoposte a TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di
CMW (80:18:2) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche evidenziate sono state effettuate 17 riunioni, come mostrato nella Figura 3.7.
La frazione 8/4 (0.3 mg, tR= 8 min), cromatografata con TLC, ha rivelato
la presenza di una singola macchia di colore bruno. La purezza del composto è stata confermata da ulteriori studi spettroscopici, che hanno permesso l’identificazione del composto in esame come metilgallato (composto 4).
La frazione 8/7 (1.0 mg, tR= 11 min), cromatografata con TLC, ha
mostrato una singola macchia gialla. In seguito ad analisi spettroscopiche, il composto, puro, è stato identificato come etilgallato (composto 5).
La frazione 8/14 (0.6 mg, tR= 32 min), cromatografata con TLC, ha
mostrato una singola macchia di colore giallo. La purezza del composto è stata accertata da ulteriori analisi spettroscopiche che hanno permesso di identificare il composto come 2-O-metilfloroacetofenone (composto 6). I dati chimico-fisici dei composti 4, 5 e 6 sono i seguenti:
Composto 4 solido amorfo bianco; 1H-NMR δ 7.04 (2H, s, H-2 e H-6),
3.82 (3H, s, OCH3).
Composto 5 solido amorfo bianco; 1H-NMR e 13C-NMR vedi Tabella 2.3,
capitolo 2; ESI-MS m/z 197 [M-H]-, 169 [M-H-28]-.
Composto 6 solido amorfo bianco; 1H-NMR e 13C-NMR vedi Tabella 2.1,
FRAZIONE RC-M/8 8/8 = 19+25 8/9 = 20 RP-HPLC MeOH:H2O = 40:60 8/10 = 21-22 8/11 = 23-24 COMPOSTO 4 8/15 = 37 8/4 = 9-10 8/7 = 16-18 8/6 = 14-15 8/5 = 11 8/3 = 5-6 8/14 = 34-35 8/2 = 3-4 8/12 = 31-32 8/13 = 33 +36 8/1 = 1-2 COMPOSTO 5
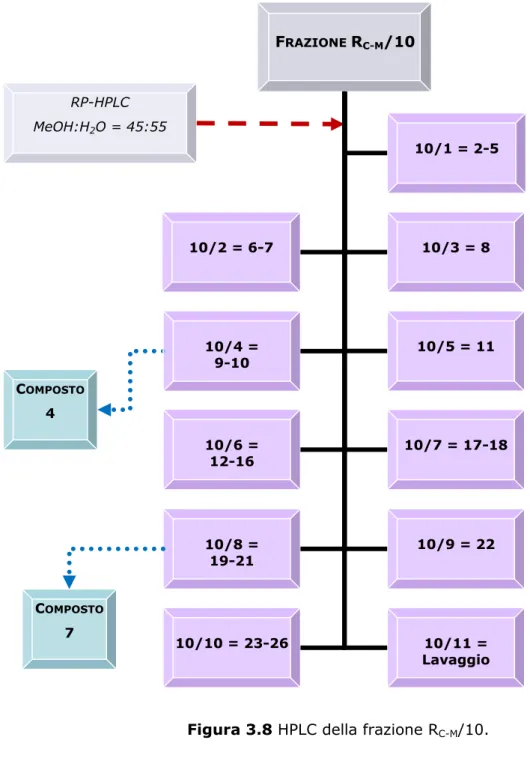
Analisi della frazione RC-M/10
Una parte della frazione RC-M/10 (79.8 mg) è stata disciolta in 800 µl di
una miscela di metanolo-acqua (45:55) e quindi centrifugata. Il soprana-tante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm
x 7.8 mm). La colonna è stata condizionata ed eluita con una miscela di metanolo-acqua (45:55) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (45:55)
Iniettata: 100 µl
Numero di iniettate: 7
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 26 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(80:18:2) e come reattivo spray solfato di cerio e il reattivo NTS/PEG. Sulla base delle caratteristiche cromatografiche sono state eseguite 11 riunioni come mostrato nella Figura 3.8.
La frazione 10/4 (5.8 mg, tR= 8 min) ha mostrato, cromatografata con
TLC, una singola macchia di colore bruno. Successive analisi spettroscopiche hanno permesso di identificare questo composto puro come metilgallato, già isolato nella frazione RC-M/8 (composto 4).
La frazione 10/8 (8.6 mg, tR= 17 min), cromatografata con TLC, ha
rivelato la presenza di una sola macchia di colore marrone. Proseguendo lo studio della riunione con analisi spettroscopiche si è confermata la purezza del campione e lo si è caratterizzato come (2R, 3R)-diidro-kaempferolo-3-O-α-L-arabinopiranoside, un diidroflavonolo (composto 7). I dati chimico-fisici del composto 7 sono i seguenti:
Composto 7 solido amorfo arancione; 1H-NMR e 13C-NMR vedi Tabella 2.8, capitolo 2; ESI-MS m/z 419 [M-H]-, 839 [2M-H]-, 443 [M+Na]+, 863
FRAZIONE RC-M/10 10/8 = 19-21 10/9 = 22 RP-HPLC MeOH:H2O = 45:55 10/10 = 23-26 10/11 = Lavaggio COMPOSTO 4 10/4 = 9-10 10/7 = 17-18 10/6 = 12-16 10/5 = 11 10/3 = 8 10/2 = 6-7 10/1 = 2-5 COMPOSTO 7
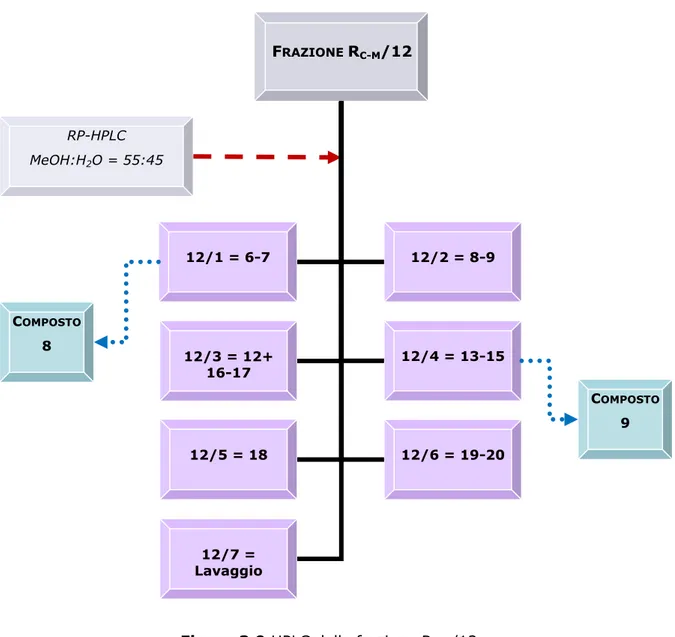
Analisi della frazione RC-M/12
La frazione RC-M/12 (84.3 mg) è stata disciolta in 900 µl di una miscela di
metanolo-acqua (55:45) e centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è
stata condizionata ed eluita con una miscela di metanolo-acqua (55:45) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (55:45)
Iniettata: 100 µl
Numero di iniettate: 8
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 21 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(80:18:2) e come reattivo spray solfato di cerio e il reattivo NTS/PEG. Sulla base delle caratteristiche cromatografiche sono state eseguite 7 riunioni come mostrato nella Figura 3.9.
La frazione 12/1 (3.5 mg, tR= 7 min), cromatografata con TLC, ha
mostrato una singola macchia di colore marrone. Successive analisi spettroscopiche hanno confermato la purezza del composto, identificato come (2R, 3R)-taxifolina-3-O-α-L-arabinofuranoside, un diidroflavonolo (composto 8).
La frazione 12/4 (5.3 mg, tR= 12 min), cromatografata con TLC, ha
evidenziato un’unica macchia di colore giallo. Proseguendo lo studio della riunione tramite analisi spettroscopiche è stato identificato il flavonolo puro quercitrina o quercetina-3-O-α-L-ramnoside (composto 9).
I dati chimico-fisici dei composti 8 e 9 sono i seguenti:
Composto 8 solido amorfo arancione; 1H-NMR e 13C-NMR vedi Tabella
2.9, capitolo 2; ESI-MS m/z 435 [M-H]-, 871 [2M-H]-, 303 [M-H-132]-. Composto 9 solido amorfo giallo intenso; 1H-NMR vedi Tabella 2.5,
-FRAZIONE RC-M/12 12/7 = Lavaggio RP-HPLC MeOH:H2O = 55:45 12/3 = 12+ 16-17 12/6 = 19-20 12/5 = 18 12/4 = 13-15 12/2 = 8-9 12/1 = 6-7 COMPOSTO 9 COMPOSTO 8
Figura 3.9 HPLC della frazione RC-M/12.
Analisi della frazione RC-M/13
Una parte della frazione RC-M/13 (58.2 mg) è stata disciolta in 500 µl di
una miscela di metanolo-acqua (45:55) e centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8
mm). La colonna è stata condizionata ed eluita con una miscela di metanolo-acqua (45:55) operando nelle seguenti condizioni:
FRAZIONE RC-M/13 13/2 = 16-18 13/3 = 19-20 RP-HPLC MeOH:H2O = 45:55 13/4 = 21-22 13/5 = 23-24 13/1 = 8-10 MISCELA 1
colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(80:18:2) e come reattivo spray solfato di cerio e il reattivo NTS/PEG. Sulla base delle caratteristiche cromatografiche sono state eseguite 5 riunioni come mostrato nella Figura 3.10.
La frazione 13/3 (0.3 mg, tR= 20 min), cromatografata con TLC, ha
mostrato una singola macchia di colore giallo scuro. La colorazione giallo intenso al reattivo spray NTS/PEG ha fatto supporre la presenza di un derivato fenolico della classe dei flavonoidi. Successive analisi spettroscopiche non hanno però confermato la purezza del composto, che si è rivelato essere in realtà una miscela di glicosidi della quercetina, non meglio identificati (Miscela 1).
Analisi della frazione RC-M/15
La frazione RC-M/15 (38.9 mg) è stata disciolta in 400 µl di una miscela di
metanolo-acqua (50:50), e centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm).
La colonna è stata condizionata ed eluita con una miscela di metanolo-acqua (50:50) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (50:50)
Iniettata: 100 µl
Numero di iniettate: 4
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 32 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(80:18:2) e come reattivo spray solfato di cerio e il reattivo NTS/PEG. Sulla base delle caratteristiche cromatografiche sono state eseguite 7 riunioni come mostrato nella Figura 3.11.
La frazione 15/6 (0.6 mg, tR= 28 min), cromatografata con TLC, ha
mostrato una singola macchia di colore marrone chiaro. Ulteriori indagini spettroscopiche hanno confermato la purezza del composto, caratterizzato come luteolina, un flavone (composto 10), i cui dati chimico-fisici sono i seguenti:
Composto 10 solido amorfo giallo; 1H-NMR vedi Tabella 2.4, capitolo 2;
FRAZIONE RC-M/15 15/1 = 19-21 RP-HPLC MeOH:H2O = 60:40 15/4 = 26-27 15/7 = Lavaggio 15/6 = 30 15/5 = 28-29 15/3 = 24-25 15/2 = 22-23 COMPOSTO 10
Analisi della frazione RC-M/16
La frazione RC-M/16 (20.2 mg), cromatografata con TLC su lastra di gel di
silice 60 F254, impiegando come fase mobile una miscela di CMW
(80:18:2) e come reattivo spray solfato di cerio, ha rivelato una singola macchia di colore marrone rossastro. Ulteriori analisi spettroscopiche hanno consentito di caratterizzare il composto come kaempferolo, un flavonolo (composto 11), i cui dati chimico-fisici sono i seguenti:
Composto 11 solido amorfo giallo; 1H-NMR vedi Tabella 2.4, capitolo 2;
ESI-MS m/z 285 [M-H]-.
Analisi della frazione RC-M/18
La frazione RC-M/18 (69.5 mg), cromatografata con TLC su lastra di gel di
silice 60 F254, impiegando come fase mobile una miscela di CMW
(80:18:2) e come reattivo spray solfato di cerio, ha rivelato una singola macchia di colore marrone. Ulteriori analisi spettroscopiche hanno permesso l’identificazione del composto 12 come quercetina, un comune flavonolo.
I dati chimico-fisici del composto 12 sono i seguenti:
Composto 12 solido cristallino giallo; 1H-NMR vedi Tabella 2.4, capitolo 2.
Studio dell’estratto metanolico R
MIl residuo metanolico (RM), ottenuto per completa evaporazione del
solvente a temperatura ambiente, presentava un peso complessivo di 74.136 g. Per facilitare lo studio dei metaboliti secondari, l’estratto in questione è stato ripartito, tramite l’impiego di un imbuto separatore, in una porzione n-butanolica, RB (22.984 g), e in una acquosa, RW (51.098
g), così da riuscire a eliminare la porzione zuccherina di scarso interesse per il nostro lavoro di studio.
Figura 3.12 Ripartizione dell’estratto metanolico, RM.
Una parte del residuo n-butanolico, RB (10.08 g), è stata disciolta nella
minima quantità possibile di metanolo e centrifugata. Il sopranatante è stato quindi sottoposto a cromatografia di esclusione molecolare su una colonna di Sephadex LH 20 (diametro = 5 cm, V = 19.6 ml/cm), eluendo con metanolo al flusso costante di 0.8 ml/min. Sono state raccolte 275 provette, di circa 15 ml di volume, che sono state riunite in 18 frazioni principali, dopo analisi delle caratteristiche cromatografiche evidenziate tramite TLC su lastra di gel di silice 60 F254. Come fase mobile sono stati
impiegati sia una miscela di CMW (cloroformio-metanolo-acqua in proporzione 80:18:2), sia una miscela di BAW (n-butanolo-acido
acetico-ES T R A T T O RM
74.136 g
RB
22.984 g 51.098 g RW
acqua, 60:15:25). Per la rivelazione si è utilizzato come reattivo spray solfato di cerio e, quando necessario, il reattivo NTS/PEG. Al termine si è ottenuto lo schema di riunione presentato in Tabella 3.e. Le frazioni non riunite sono state eliminate.
Riunione Frazioni riunite Resa in mg
1 4-28 887.5 2 29-40 502.8 3 41-49 417.3 4 50-62 511.6 5 63-65 115.2 6 66-69 171.1 7 70-76 275.3 8 77-81 253.4 9 82-85 241.2 10 86-90 345.4 11 91-95 248.6 12 96-108 371.8 13 109-126 521.0 14 127-144 468.3 15 145-150 160.0 16 151-177 431.1 17 178-252 568.9 18 253-275 400.3
Analisi della frazione RB/3
Una parte della frazione RB/3 (223.0 mg) è stata disciolta in 2.3 ml di
metanolo. Dopo centrifugazione il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata
condizionata ed eluita con una miscela di metanolo-acqua (30:70) operando nelle seguenti condizioni:
Attenuazione: 8x
Eluente: MeOH:H2O (30:70)
Iniettata: 100 µl
Numero di iniettate: 9
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 21 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(70:30:3) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 10 riunioni come mostrato nella Figura 3.13.
La frazione 3/1 (17.8 mg, tR= 5 min), dopo cromatografia con TLC, ha
mostrato una singola macchia di colore arancio-rossastro. Ulteriori analisi spettroscopiche hanno confermato la purezza del campione che al momento è ancora in corso di caratterizzazione (composto a).
La frazione 3/7 (2.5 mg, tR= 23 min) ha rivelato, dopo cromatografia con
TLC, una singola macchia di colore marrone. Analisi spettroscopiche successive hanno confermato la purezza del campione di cui è ancora in corso la caratterizzazione (composto b).
La frazione 3/10 (1.9 mg, tR= 28 min), dopo cromatografia con TLC, ha
mostrato un’unica macchia di colore marrone. La purezza è stata confermata dalle successive analisi spettroscopiche, ma anche di questo composto è ancora in corso la caratterizzazione (composto c).
FRAZIONE RB/3 3/7 = 15-16 3/8 = 17 RP-HPLC MeOH:H2O = 30:70 3/9 = 18 COMPOSTO a 3/3 = 7 3/6 = 11-12 3/5 = 10 3/4 = 8-9 3/2 = 4 3/1 = 3 COMPOSTO b 3/10 = 19-20 COMPOSTO c
Analisi della frazione RB/4
La frazione RB/4 (511.6 mg), dopo analisi preliminare con TLC, è risultata
molto complessa, tanto da non poter essere subito sottoposta a RP-HPLC. Si è così scelto di semplificarla tramite una tecnica cromatografica semipreparativa, la SPE (Solid Phase Extraction).
La frazione RB/4 è stata disciolta in 1 ml di una miscela di metanolo-acqua
(1:9) e centrifugata. Il sopranatante è stato caricato su colonna SPE (Lichroprep® RP18, fase inversa), precedentemente condizionata con la
stessa miscela metanolo–acqua (1:9).
La cromatografia è stata eseguita a gradiente di polarità decrescente raccogliendo 16 beute di 100 ml ciascuna secondo quanto riportato in Tabella 3.f. Il solvente è stato poi evaporato a pressione ridotta e temperatura inferiore a 40°C.
Miscela eluente Beute raccolte
MeOH:H2O = 1:9 1 MeOH:H2O = 2:8 2-3 MeOH:H2O = 3:7 4-6 MeOH:H2O = 5:5 7-10 MeOH:H2O = 7:3 11-13 MeOH:H2O = 9:1 14-15 MeOH 16
Tabella 3.f Miscele eluenti e beute raccolte della SPE della frazione RB/4.
Le 16 frazioni raccolte sono state quindi sottoposte a TLC su lastra di gel di silice 60 F254 usando come eluenti sia una miscela di
cloroformio-metanolo 9:1, sia una miscela di CMW (80:18:2), sia una miscela di BAW (60:25:15) e rivelate usando solfato di cerio come reattivo spray. In base alle caratteristiche cromatografiche riscontrate sono state pertanto compiute 6 riunioni, secondo lo schema di Tabella 3.g.
Riunione Beute riunite Resa in mg A 1 85.1 B 2-3 106.7 C 4 29.6 D 7 48.7 E 8-9 138.6 F 11+14 149.9
Tabella 3.g Riunioni e loro rese della SPE della frazione RB/4.
Analisi della frazione RB/4/B
La frazione RB/4/B (106.7 mg) è stata disciolta in 1.1 ml di metanolo e
centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata condizionata ed
eluita con una miscela di metanolo-acqua (25:75) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (25:75)
Iniettata: 100 µl
Numero di iniettate: 8
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 26 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
B/14 = 25 FRAZIONE RB/4/B RP-HPLC MeOH:H2O = 25:75 COMPOSTO d B/3 = 7-8 B/6 = 13-14 B/5 = 12 B/4 = 11 B/2 = 5-6 B/13 = 23-24 B/1 = 4 B/11 = 21 B/12 = 22 B/7 = 15-16 B/8 = 17-18 B/9 = 19 B/10 = 20
momento della pubblicazione del presente lavoro di tesi, è ancora in corso la caratterizzazione (composto d).
Analisi della frazione RB/6
La frazione RB/6 (171.1 mg) è stata disciolta in 1.7 ml di metanolo. Dopo
centrifugazione il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata condizionata ed
eluita con una miscela di metanolo-acqua (40:60) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (40:60)
Iniettata: 100 µl
Numero di iniettate: 6
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 26 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(70:30:3) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 9 riunioni come mostrato nella Figura 3.15.
La frazione 6/4 (2.5 mg, tR= 8 min), dopo cromatografia con TLC, ha
mostrato una singola macchia di colore marrone rossastro. Ulteriori analisi spettroscopiche hanno confermato la purezza del campione e ne hanno permesso la caratterizzazione come catechina-3-O-α-L-arabinopiranoside (composto 13), i cui dati chimico-fisici sono i seguenti:
Composto 13 solido amorfo arancione; 1H-NMR e 13C-NMR vedi Tabella
2.10, capitolo 2; ESI-MS m/z 435 [M-H]-, 871 [2M-H]-, 437 [M+H]+.
FRAZIONE RB/6 6/7 = 22-23 6/8 = 24-25 RP-HPLC MeOH:H2O = 40:60 6/9 = Lavaggio COMPOSTO 13 6/3 = 7 6/6 = 20-21 6/5 = 18-19 6/4 = 8 6/2 = 6 6/1 = 5 COMPOSTO 7
Analisi della frazione RB/7
Una parte della frazione RB/7 (148.3 mg) è stata disciolta in 1.5 ml di
metanolo e centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata
condizionata ed eluita con una miscela di metanolo-acqua (40:60) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (40:60)
Iniettata: 90 µl
Numero di iniettate: 7
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 34 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(70:30:3) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 11 riunioni come mostrato nella Figura 3.16.
La frazione 7/5 (3.1 mg, tR=8 min), dopo cromatografia con TLC, ha
rivelato una macchia singola di colore marrone rossastro. In seguito ad analisi spettroscopiche il composto, puro, è stato caratterizzato come catechina-3-O-α-L-arabinopiranoside (composto 13) già isolato nella frazione RB/6/4.
La frazione 7/6 (1.2 mg, tR=13 min), cromatografata con TLC, ha
mostrato un’unica macchia di colore marrone. Ulteriori analisi spettroscopiche hanno permesso di caratterizzare il composto puro, come
del composto presente, identificato come (2R, 3R)-diidrokaempferolo-3-O-α-L-arabinopiranoside (composto 7), già isolato nelle frazioni RC-M/10/8 e
RB/6/5+6.
La frazione 7/9 (2.7 mg, tR=23 min), dopo cromatografia con TLC, ha
rivelato una singola macchia di colore giallo marroncino. Successive analisi spettroscopiche hanno accertato la purezza del composto e ne hanno permesso l’identificazione come (2R, 3S)-diidrokaempferolo-3-O-α-L-arabinopiranoside (composto 15).
Le frazioni 7/10 (1.8 mg, tR=40 min) e 7/11 (1.5 mg, tR=41 min), dopo
cromatografia con TLC, davano ciascuna una singola macchia di colore giallo, molto simili fra loro, e sono state quindi riunite e investigate ulteriormente con analisi spettroscopiche che hanno portato alla caratterizzazione della quercitrina, un flavonolo già isolato nella frazione RC-M/12/4 (composto 9).
I dati chimico-fisici dei composti 14 e 15 sono i seguenti:
Composto 14 solido amorfo arancione; 1H-NMR e 13C-NMR vedi Tabella 2.9, capitolo 2; ESI-MS m/z 435 [M-H]-, 871 [2M-H]-, 303 [M-H-132]-. Composto 15 solido amorfo arancione; 1H-NMR e 13C-NMR vedi Tabella
2.8, capitolo 2; ESI-MS m/z 443 [M+Na]+, 863 [2M+Na]+, 311
FRAZIONE RB/7 RP-HPLC MeOH:H2O = 40:60 7/10 = 30 7/11 = 31-32 7/3 = 4-5 7/2 = 3 7/1 = 2 COMPOSTO 9 COMPOSTO 15 COMPOSTO 7 7/8 = 21-24 7/9 = 26-27 COMPOSTO 14 7/4 = 6 7/7 = 18-20 7/6 = 13-14 7/5 = 7-8 COMPOSTO 13
Analisi della frazione RB/11
La frazione RB/11 (248.0 mg) è stata disciolta in 2.5 ml di metanolo e
centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata condizionata ed
eluita con una miscela di metanolo-acqua (40:60) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (40:60)
Iniettata: 100 µl
Numero di iniettate: 6
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 38 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(70:30:3) e una miscela di BAW (60:15:25) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 11 riunioni illustrate nella Figura 3.17.
La frazione 11/4 (8.1 mg, tR=6 min), dopo cromatografia con TLC, ha
rivelato una singola macchia di colore marrone scuro. In seguito a studi spettroscopici il composto, puro, è stato identificato come catechina (composto 16).
La frazione 11/6 (3.7 mg, tR=19 min), cromatografata con TLC, ha
mostrato un’unica macchia di colore marrone. Ulteriori studi spettroscopici hanno confermato la purezza del composto, caratterizzato come miricitrina o miricetina-3-O-α-L-ramnoside, un flavonolo (composto 17). La frazione 11/7 (8.3 mg, tR=27 min), cromatografata con TLC, ha
mostrato una singola macchia di colore marrone chiaro. Successivi studi spettroscopici hanno confermato la purezza del composto, identificato come quercetina-3-O-α-L-arabinopiranoside, un flavonolo (composto 18). Infine la frazione 11/10 (4.5 mg, tR=35 min), dopo analisi cromatografica
successivi di natura spettroscopica hanno accertato la purezza del composto e permesso la sua identificazione come quercetina-3-O-α-L-arabino-furanoside, un flavonolo (composto 19).
I dati chimico-fisici dei composti 16, 17, 18 e 19 sono i seguenti:
Composto 16 solido cristallino rosa; 1H-NMR vedi Tabella 2.9, capitolo 2; ESI-MS 291 [M+H]+, 273 [M+H-18]+, 255 [M+H-18-18]+, 289 [M-H]-,
578 [2M-H]-.
Composto 17 solido amorfo giallo scuro; 1H-NMR vedi Tabella 2.5,
capitolo 2; ESI-MS m/z 463 [M-H]-, 926 [2M-H]-, 316 [M-H-146]-.
Composto 18 solido amorfo giallo; 1H-NMR vedi Tabella 2.6, capitolo 2; ESI-MS m/z 433 [M-H]-, 866 [2M-H]-, 301 [M-H-132]-, 457 [M+Na]+, 891
[2M+Na]+, 325 [M+Na-132]+.
Composto 19 solido amorfo giallo; 1H-NMR e 13C-NMR vedi Tabella 2.6,
capitolo 2; ESI-MS m/z 457 [M+Na]+, 891 [2M+Na]+, 325 [M+Na-132]+,
FRAZIONE RB/11 11/8 = 31+ 34-35 11/9 = 32 RP-HPLC MeOH:H2O = 40:60 11/10 = 33 11/11 = 36-38 COMPOSTO 16 11/4 = 9-12 11/7 = 29-30 11/6 = 22-24 11/5 = 13-14 11/3 = 7-8 11/2 = 5-6 11/1 = 3-4 COMPOSTO 19 COMPOSTO 17 COMPOSTO 18
Analisi della frazione RB/13
La frazione RB/13 (521.0 mg) è stata disciolta in 5.0 ml di una miscela di
metanolo-acqua (50:50). Dopo centrifugazione il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm).
La colonna è stata condizionata ed eluita con una miscela di metanolo-acqua (50:50) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (50:50)
Iniettata: 100 µl
Numero di iniettate: 10
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 23 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(70:30:3) e una miscela di BAW (60:15:25) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 9 riunioni illustrate nella Figura 3.18.
La frazione 13/4 (0.6 mg, tR=22 min), dopo cromatografia con TLC, ha
rivelato una singola macchia di colore giallo. In seguito a studi spettroscopici il composto, puro, è stato identificato come quercetina-3-O-(3’’-galloil)-α-L-ramnopiranoside o, più brevemente, 3’’-O-galloil-quercitrina, un estere dell’acido gallico e del flavonolo quercitrina (composto 20).
La frazione 13/8 (2.9 mg, tR=27 min), cromatografata con TLC, ha
FRAZIONE RB/13 13/7 = 18 13/8 = 19 RP-HPLC MeOH:H2O = 50:50 13/9 = 20-21 COMPOSTO 20 13/3 = 6 13/6 = 17 13/5 = 16 13/4 = 15 13/2 = 5 13/1 = 4 COMPOSTO 21
I dati chimico-fisici dei composti 20 e 21 sono i seguenti:
Composto 20 solido amorfo giallo; 1H-NMR e 13C-NMR vedi Tabella 2.7,
capitolo 2; ESI-MS m/z 599 [M-H]-, 1199 [2M-H]-, 301 [M-H-152-146]-,
623 [M+Na]+, 1123 [2M+Na]+.
Composto 21 solido amorfo giallo; 1H-NMR e 13C-NMR vedi Tabella 2.7, capitolo 2; ESI-MS m/z 599 [M-H]-, 1199 [2M-H]-, 301 [M-H-152-146]-,
623 [M+Na]+, 1123 [2M+Na]+.
Analisi della frazione RB/15
La frazione RB/15 (160.2 mg) è stata disciolta in 1.6 ml di metanolo e
centrifugata. Il sopranatante è stato sottoposto a HPLC su una colonna µ-Bondapack RP18 (30 cm x 7.8 mm). La colonna è stata condizionata ed
eluita con una miscela di metanolo-acqua (50:50) operando nelle seguenti condizioni:
Attenuazione: 16x
Eluente: MeOH:H2O (50:50)
Iniettata: 100 µl
Numero di iniettate: 10
Velocità di flusso: 2.0 ml/min
Dalla cromatografia si sono ottenute 20 frazioni più il lavaggio della colonna che, dopo l’evaporazione del solvente, sono state disciolte nella minima quantità possibile di metanolo e cromatografate con TLC su lastra di gel di silice 60 F254, impiegando come fase mobile una miscela di CMW
(70:30:3) e una miscela di BAW (60:15:25) e come reattivo spray solfato di cerio. Sulla base delle caratteristiche cromatografiche sono state eseguite 6 riunioni illustrate nella Figura 3.19.
La frazione 15/3 (8.3 mg, tR=6 min), dopo cromatografia con TLC, ha
rivelato una singola macchia di colore marrone. In seguito a studi spettroscopici il composto, puro, è stato identificato come epicatechina-3-O-gallato, una catechina (composto 22), i cui dati chimico-fisici sono di seguito riportati:
Composto 22 solido amorfo giallo; 1H-NMR e 13C-NMR vedi Tabella 2.9,
capitolo 2; ESI-MS m/z 441 [M-H]-, 883 [2M-H]-, 289 [M-H-152]-, 905
Figura 3.19 HPLC della frazione RB/15. FRAZIONE RB/15 15/3 = 7-8 15/4 = 15 RP-HPLC MeOH:H2O = 50:50 15/5 = 17-18 15/6 = 19 COMPOSTO 22 15/1 = 4 15/2 = 5