MATERIALI E METODI
1.
TRATTAMENTO DEGLI ANIMALIGiovani ratti sani maschi Wistar di 50 giorni (200-300gr), appartenenti alla stessa nidiata, alloggiati in ambiente a temperatura costante di 22°C, sono stati giornalmente trattati con iniezioni intraperitoneali di Acetil-L-Carnitina (ALC, Sigma Tau Laboratories, Pomezia, Italy; 100 mg/kg di peso corporeo) per 21 giorni. Ratti di controllo sono stati trattati con equivalenti volumi di soluzione salina (0,9% NaCl). Dopo il trattamento, gli animali sono stati sacrificati tramite decapitazione. I loro cervelli sono stati isolati in condizioni sterili a bassa temperatura e immediatamente congelati in azoto liquido e conservati a -80°C.
2
. ESTRAZIONE DELL’RNAL’RNA totale è stato isolato dal cervello degli animali di controllo e trattati, dopo asportazione del cervelletto, come descritto da Traina et al., (2004). Per minimizzare la contaminazione da RNasi, sono state utilizzate soluzioni trattate con DEPC (dietilpirocarbonato). La vetreria è stata tenuta una notte a 180°C, le botticelle e il materiale plastico utilizzato sono stati autoclavati a 121°C per 20 min.
I campioni sono stati omogeneizzati con un omogenizzatore Ultra-Turrax, immediatamente dopo essere stati immersi nel tampone GITC. L’omogenato è
stato stratificato su un cuscinetto di CsCl 5,7M. Il gradiente è stato centrifugato in ultracentrifuga Beckman L8-70M con rotore Kontron TY65 a 40.000 rpm a 20 °C per 24 ore.
Il pellet è stato solubilizzato in H20DEPC e precipitato con 0,1 volumi di Sodio
Acetato 3 M pH 6,4 e 2,2 volumi di Etanolo Assoluto per una notte a –20 °C. In seguito il campione è stato centrifugato a 13.000 rpm in centrifuga con rotore Kontron A8.24 per 30 min e il pellet lavato con Etanolo al 70% per eliminare i sali residui. L’RNA è stato quindi solubilizzato in un opportuno volume H20DEPC. I campioni sono stati conservati a -80°C per le analisi
successive. SOLUZIONI UTILIZZATE: Tampone GITC • guanidina tiocianato 4 M • sodio citrato 25 mM pH 7,0 • β-mercaptoetanolo 0,1 M • N- lauril sarcosinato 0,5% (p/v) Cloruro di Cesio 5,7M • cloruro di cesio 5,7 M
•
sodio acetato 25 mM pH 6,43
. ISOLAMENTO DELL’mRNA poliA+Per l'isolamento dell’mRNA poliA+ è stato usato il PolyATtract® mRNA Isolation Systems (Promega). Il sistema utilizza un primer oligo(dT) biotinilato che ha la capacità di ibridare ad alta efficienza con la regione al 3' poliA+ presente nella maggior parte dei mRNA maturi eucariotici. Gli ibridi possono poi essere recuperati usando streptavidina (che ha la capacità di legarsi alla biotina) associata a particelle paramagnetiche (PMP), ed un supporto magnetico. Circa 1 mg di RNA totale in un volume di 500 µl di H2ODEPC è stato denaturato per 10 min a 65°C; sono stati aggiunti 3 µl di
Biotinylated Oligo(dT) Probe e 13 µl di SSC 20x (NaCl 3 M; Na-citrato 0,3 M); il tutto è stato incubato a temperatura ambiente fino a raffreddamento per permettere la reazione di appaiamento. Contemporaneamente le particelle PMP sono state lavate e risospese in SSC 0,5x ed aggiunte poi alla reazione di appaiamento lasciando incubare a temperatura ambiente per circa 10 min per permettere il legame tra la biotina e la streptavidina. Catturate le particelle PMP e lavate con SSC 0,1x, sono stati in seguito eluiti gli mRNA risospendendo le particelle PMP in H2ODEPC e catturandole con il magnete, è
stata recuperata e trasferita la fase acquosa, contenente mRNA, in una nuova provetta priva di RNase. L’mRNA è stato poi precipitato e risospeso in 10 µl di H2O DEPC.
4
. CONTROLLO DELLA QUALITÀ DELL’mRNA poliA+Gli mRNA poliA+ sono stati utilizzati per la costruzione delle banche sottrattive di cDNA utilizzando la tecnica dell’ibridazione sottrattiva soppressiva (SSH). Al fine di rendere la sottrazione efficiente è necessario valutare il grado di contaminazione dell’mRNA da parte dell’rRNA (Sävenstrand et al., 2000).
Per valutare la contaminazione dell’mRNA è stata effettuata una retrotrascrizione-reazione a catena della polimerasi (RT-PCR) su una piccola quantità di ciascun mRNA poliA+, utilizzando 2 set di primers specifici per l’rDNA di ratto (5,8 S; 18 S), le cui sequenze sono state trovate in banca dati EMBL.
5
. COSTRUZIONE DELLE BANCHE SOTTRATTIVE SOPPRESSIVEPer ottenere sequenze di cDNA differenzialmente espresse è stato utilizzato il PCR-Select
™
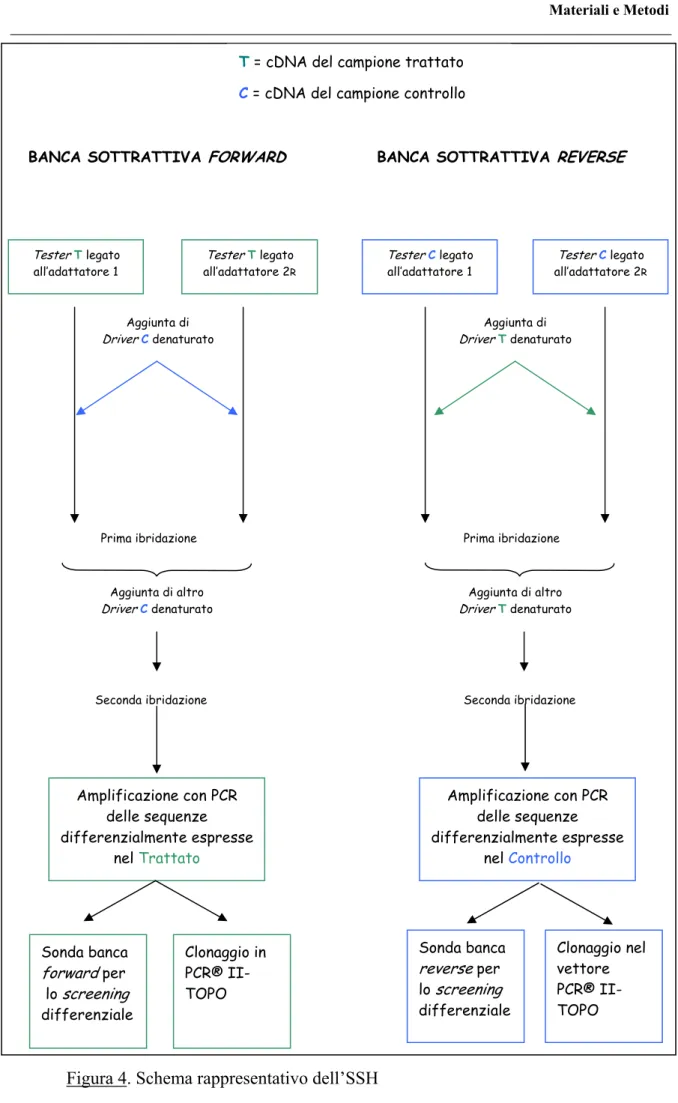
cDNA Subtraction Kit (BD Biosciences) partendo da 2µg di mRNA poliA+, isolati dai cervelli di ratti trattati con ALC e da quelli di controllo. Questa metodologia si basa sul principio della SSH secondo Diatchenko et al., (1996). Il metodo permette di ottenere banche di cDNA arricchite di trascritti presenti solo in uno dei due campioni comparati, ed è particolarmente efficiente nell’isolare sequenze rare o poco espresse. Una rappresentazione schematica del processo è mostrata nella figura 4.
TesterT 1 TesterT 2R TesterC 1 TesterC 2R
Figura 4. Schema rappresentativo dell’SSH
Seconda ibridazione Amplificazione con PCR delle sequenze differenzialmente espresse nel Trattato Seconda ibridazione Amplificazione con PCR delle sequenze differenzialmente espresse nel Controllo Sonda banca reverse per lo screening differenziale Sonda banca forward per lo screening differenziale Clonaggio in PCR® II-TOPO Clonaggio nel vettore PCR® II-TOPO Prima ibridazione Aggiunta di altro DriverC denaturato Prima ibridazione Aggiunta di altro DriverT denaturato Aggiunta di DriverC denaturato
T = cDNA del campione trattato
C = cDNA del campione controllo
BANCA SOTTRATTIVA FORWARD BANCA SOTTRATTIVA REVERSE
TesterT legato
all’adattatore 1 all’adattatore 2TesterT legato R
TesterC legato
all’adattatore 1 all’adattatore 2TesterC legato R
Aggiunta di
Ci riferiremo al tester per indicare l’mRNA isolato dal cervello di ratto trattato e al driver per indicare l’mRNA del controllo. Il cDNA è stato sintetizzato a partire da 2µg di mRNA di entrambi i campioni ed è stato digerito con l’enzima di restrizione RSA I.
Il cDNA del tester è stato suddiviso in due aliquote e a ciascuno è stato legato un diverso adattatore: 1 e 2R. Gli adattatori, mancando del gruppo fosfato al 5’, si legano solo all’estremità 5’ del cDNA.
Sono seguite due ibridazioni sottrattive successive, la prima è stata effettuata aggiungendo a ciascun tester denaturato, driver denaturato in eccesso. Durante questa fase la maggior parte dei trascritti del tester, non differenziali, si lega al driver e la rimanente frazione di tester che rimane a singolo filamento risulta arricchita di sequenze differenzialmente espresse. Inoltre in questo passaggio la concentrazione delle sequenze poco e molto espresse viene normalizzata, perché, essendo la cinetica di ibridazione di secondo ordine, la riassociazione delle molecole concentrate è più veloce.
La seconda ibridazione è stata effettuata unendo, senza denaturare, i campioni della prima ibridazione e aggiungendo driver denaturato in eccesso. Durante questo passaggio, oltre ad arricchirsi di sequenze differenzialmente espresse, la frazione a singolo filamento del tester 1 ibriderà con la stessa frazione nel tester 2R, formando una popolazione di sequenze differenzialmente espresse a doppio filamento caratterizzate dal fatto di essere asimmetricamente fiancheggiate dai due adattatori. Questo, insieme all’effetto soppressivo,
rende possibile la loro amplificazione selettiva tramite due PCR successive utilizzando come primers sequenze complementari ai due adattatori.
L’utilizzo di questa tecnica ha permesso la costruzione di due banche sottrattive di cDNA:
• banca forward, dove il campione trattato è stato utilizzato come tester e il campione di controllo come driver. Questa banca è costituita dai trascritti dei geni la cui espressione è modulata positivamente o attivata dal trattamento con ALC .
• banca reverse, dove il campione di controllo è stato utilizzato come tester e il campione trattato come driver. Questa banca è costituita dai trascritti dei geni la cui espressione è modulata negativamente o spenta dal trattamento con ALC.
Entrambe le librerie sono state inserite nel vettore di clonaggio PCR® II-TOPO utilizzando il II-TOPO TA Cloning® kit (Invitrogen); dopo aver valutato l’efficienza di sottrazione in vari modi, quali:
a) Southern Blotting : gli amplificati delle banche sottrattive sono stati cross-ibridati con le sonde costituite dal cDNA delle banche sottrattive.
b) PCR con primer della gliceraldeide-3-fosfato deidrogenasi (G3PDH), gene costitutivo, come suggerito dal protocollo del PCR-Select
™
cDNA Subtraction Kit (BD Biosciences);c) Spot Blot : gli amplificati delle banche sottrattive sono stati ibridati con la
sonda ottenuta marcando la G3PDH.
I cloni positivi provenienti dalle colonie bianche sono poi stati recuperati in microtitraplates da 96 pozzetti contenenti 65 µl di LB A+. Sono stati messi a crescere una notte in agitazione orizzontale a 37°C, sono stati aggiunti 50 µl glicerolo, e conservati a –20°C.
Per verificare che le nostre banche fossero rappresentative, sono stati presi 10 cloni positivi per ogni banca. E’ stata effettuata una PCR (vedi par. 6.1) e il prodotto è stato analizzato su gel di agarosio ( 2%).
Sequenze dei primers utilizzati
PCR primer 1 5’ –CTAATACGACTCACTATAGGGC- 3’ NESTED primer 1 5’ –TCGAGCGGCCGCCCGGCAGGT- 3’ NESTED primer 2R 5’ –AGCGTGGTCGCGGCCGAGGT- 3’
6
. SCREENING PRIMARIO DELLE BANCHE DI cDNA6.1
. AMPLIFICAZIONE DELLE SEQUENZE DIFFERENZIALI1µl di colonia è stato messo a crescere per 2 ore in 50 µl di LB A+ liquido a
37°c su agitatore orizzontale.
La coltura è stata amplificata mediante PCR utilizzando AmpliTaq Gold (Applied Biosystems), in un volume 15µl usando le seguenti condizioni: 1µl della coltura è stato utilizzato come stampo, poi sono stati aggiunti 1,5µl di
tampone 10x PCR Gold; 0,3 µl di dNTP Mix 10mM; 0,6µl di Nested PCR primer 1 10µM; 0,6 µl di Nested PCR primer 2R 10µM; 2,1µl di soluzione 25mM di MgCl2; 0,75µl di AmpliTaqGold DNA Polymerase, 5U/µl; H2O
sterile a volume.
La reazione così composta è stata posta nel termociclizzatore (Applied Biosciences GeneAmp PCR System 2700) ed è stata iniziata l’amplificazione con la denaturazione dello stampo (hold) a 94°C per 7 min seguito da 33 cicli così composti: 94°C per 40 sec, 65°C per 30 sec, 72°C per 90 sec; al termine dei cicli è stata fatta seguire una estenzione dei primers (extention) a 72°C per 10 min.
I prodotti di PCR sono stati analizzati su gel di agarosio al 2%.
6.2
. SPOT BLOT DEL PRODOTTO DI PCR1 µl del prodotto di PCR di ciascun clone è stato denaturato (95oC per 1 min) e spottato su membrana Hybond N+ grigliata (Amersham Biosciences). Le membrane così ottenute sono state fissate mediante Hoefer™ UVC 500 cross-linker (Amersham Biosciences).
Lo screening primario, mediante la tecnica degli Spot Blot, ha permesso di eliminare i cloni falsi positivi, interpretando i risultati secondo il protocollo descritto nel PCR Select Differential Screening kit User Manual (BD Biosciences).
Dopo aver individuato i cloni differenzialmente espressi si è passati all’isolamento del DNA plasmidico e quindi al sequenziamento, con sequenziatore automatico.
6.3
. MARCATURA DELLE SONDELe membrane sono state ibridate utilizzando come sonde i cDNA che costituiscono le banche forward e reverse marcate con marcatura non radioattiva, utilizzando DIG DNA Labelling Kit (ROCHE),
Per la marcatura del cDNA circa 0,1-1µg del prodotto della seconda PCR sono stati digeriti con Rsa I per eliminare gli adattatori 1 e 2R da ogni sequenza di cDNA .
Per la marcatura del cDNA sono stati denaturati circa 0,1-1 µg di DNA in 15 µl di H2O (100°C) e dopo averli raffreddati in ghiaccio sono stati aggiunti:
2 µl di esanucleotidi, 2 µl di dNTP, 1 µl di Klenow. Dopo aver incubato tutta la notte a 37°C, la reazione polimerasica è stata interrotta aggiungendo: 2 µl di Na2EDTA 0,2 M (pH 8,0).
Il DNA è stato precipitato con 2,5 µl di LiCl 4 M, 75 µl di Etanolo Assoluto freddo; questa reazione è stata lasciata per 1 ora a -80°C. Successivamente il DNA è stato centrifugato a 12.000 g per 40 min a 4°C ed il pellet è stato lavato 2 volte con etanolo al 70%. Dopo i lavaggi il pellet, asciugato all'aria, è stato solubilizzato in 50 µl di H2O sterile.
6.4
. IBRIDAZIONE SU FILTROLa membrana è stata preibridata per circa 3 ore nell'apposito termostato (20 ml di soluzione di preibridazione per circa 100 cm2 di membrana) alla temperatura di 68°C.
La sonda marcata è stata denaturata in H2O a 100°C per 10 min e poi
immediatamente in ghiaccio. Successivamente è stata aggiunta la sonda marcata (25 ng/ml) a nuova soluzione di preibridazione, ottenendo la soluzione di ibridazione. Si è proceduto quindi con l’ibridazione.
Nella soluzione di preibridazione e in quella di ibridazione sono stati aggiunti i “competitori”, ovvero le stesse sequenze di DNA utilizzate sia come adattatori, (nella costruzione delle banche sottrattive), sia come primers (per l’amplificazione delle PCR), ad una concentrazione finale pari a 0,1 µM. Questo è stato necessario al fine di evitare ibridazioni tra eventuali adattatori rimasti nella sonda e il DNA in esame.
La sonda è stata recuperata e le membrane sono state sottoposte ad una serie di lavaggi a diverso potere stringente, in dipendenza dell'omologia della sonda e della sua composizione (% in G+C).
La membrana è stata lavata due volte in SSC 2x/SDS 0,1% per 20 min a temperatura ambiente, in agitatore orizzontale.
Poi, aumentando la stringenza, è stata lavata due volte in SSC 0,1x/SDS 0,1% per 20 min a 68°C, in agitatore orizzontale. Quindi è stata equilibrata per 5 min con il tampone 1 e incubata per 1 ora in lenta agitazione con il tampone
2. Successivamente è stata posta per 30 min in lenta agitazione in una soluzione contenente l'anticorpo anti-digossigenina, diluito 1:10.000 nel tampone 2. In seguito sono stati effettuati, 3 lavaggi di 15 min nel tampone 1 a cui è stato aggiunto Tween 20 ad una concentrazione finale pari allo 0,3%; quindi la membrana è stata equilibrata per 5 min con il tampone 3.
Utilizzando il metodo della visualizzazione chemioluminescente si è proceduto in camera oscura cospargendo la membrana, adagiata in una pellicola trasparente, con Lumigen CSPD (ROCHE) diluito 1:100 nel tampone 3 (circa 1 ml per membrane di 100 cm2).
Il tutto è stato lasciato al buio per 5 min a temperatura ambiente, quindi è stata tolta la soluzione in eccesso (senza seccare la membrana) e la membrana è stata incubata per 10 min a 37°C in modo da far attivare la reazione. Sulla membrana è stata posta una lastra radiografica Hyperfilm β-max (Amersham Biosciences). Questa è stata lasciata in esposizione per circa 4 ore. Successivamente la lastra radiografica è stata sviluppata e fissata con le soluzioni Kodak (seguendo le istruzioni fornite dalla ditta).
SOLUZIONI UTILIZZATE:
Tampone 1
• NaCl 0,15M • Acido maleico 0,1M Portare a pH 7,5 con NaOH e autoclavare
Blocking stock solution
• Sciogliere il Blocking reagent fornito dalla ditta nel tampone 1 Conservare a -20°C Soluzione di preibridazione • SSC 5x • Blocking reagent 1% • SLS 0,1% • SDS 0,02% Tampone 2
• Blocking Stock Solution, diluita 1:10 nel tampone 1
Tampone 3 • Tris-HCl 100 mM, pH=9,5 • NaCl 100 mM SSC 20x • NaCl 3 M • Na-Citrato 0,3 M
• Portare a pH 7,0 con acido citrico e autoclavare
SDS 10%
7.
PREPARAZIONE DEL DNA PLASMIDICO SU PICCOLA SCALA (MINIPREP)Il DNA plasmidico è stato estratto e purificato utilizzando High Pure Plasmid Isolation Kit (Roche).
I cloni sono stati inoculati in bottigliette Macarty contenenti 10 ml di LB liquido e ampicillina alla concentrazione di 50µg/ml e fatti crescere a 37°C su agitatore rotante per una notte. Le colture, dopo essere state trasferite in provette da 2ml (suddividendo per motivi di capienza, il campione in più aliquote), sono state centrifugate a 11.500 rpm per 1 min e 30 sec, in centrifuga da tavolo ALC 4226 in un rotore ALC 5531 (questo tipo di centrifuga viene utilizzato per tutta la preparazione). Successivamente le cellule sono state risospese delicatamente in 200µl di Suspension buffer, fornito nel kit. I campioni provenienti dallo stesso clone, sono stati riuniti in un’unica provetta e a questa sono stati aggiunti 250µl. di Lising buffer, fornito nel kit; il campione è stato delicatamente mescolato per inversione, e lasciato a temperatura ambiente per 5 min. Sono stati aggiunti 350µl di Binding buffer, fornito nel kit, precedentemente raffreddato in ghiaccio. Il campione è stato centrifugato a 12.000 g per 12 min. Il surnatante così ottenuto è stato posto delicatamente sulle colonnine fornite nel kit (provviste al loro interno di una resina alla quale si legherà il nostro DNA), e centrifugato a 12.000 g per 1 min. Sono stati aggiunti 700µl di Washing buffer, fornito nel kit, e
centrifugato a 12.000 g per 1 min. Le colonnine sono state poste in provette sterili e si è proceduto all’eluizione del DNA con 50µl di H2O sterile.
L’operazione è stata ripetuta una seconda volta, sostituendo le provette. Si è proceduto alla quantizzazione del materiale allo spettrofotometro e su gel di agarosio.
SOLUZIONI UTILIZZATE:
Ampicillina
• soluzione stock 10mg/ml solubilizzata in Etanolo 70%
LB (Luria-Bertani) liquido
• Triptone 1,0%
• Yeast extract 0,5%
• NaCl 1,0%
• pH 7,0 con NaOH
8
. ANALISI DELLE SEQUENZELe sequenze nucleotidiche dei cloni differenziali ottenute con sequenziatore automatico, sono state analizzate mediante comparazione con le sequenze depositate nella banca dati (GenBank, EMBL) con i programmi:
FASTA (http://www.ebi.ac.uk/fasta33/),
BLASt (http://www.ch.embnet.org/software/aBLAST.html?)
ADVANCED BLAST (http://www. ch.embnet.org/software/aBLAST.html?) che sono disponibili in rete.
9
. ANALISI DI ESPRESSIONE9.1
. ELETTROFORESI DI RNA IN CONDIZIONI DENATURANTI, NORTHERN BLOTTING E IBRIDAZIONEL’RNA è stato separato e analizzato su gel denaturante di agarosio/formaldeide secondo Sambrook et al., 1989. Ai campioni di RNA è stata aggiunta la soluzione denaturante in rapporto 1:3 e 3 µl di saccarosio (soluzione satura). I campioni sono stati incubati per 10 min a 65°C e quindi messi in ghiaccio.
Prima di caricare i campioni è stata fatta una precorsa del gel per circa 30 min. Il gel è stato fatto correre a 40V per circa un’ora e mezzo, quindi colorato con bromuro di etidio e fotografato.
Per quanto concerne il trasferimento del materiale su membrana (Northern Blotting), dopo elettroforesi, l’RNA è stato trasferito su membrana Hybond N+ (Amersham) utilizzando l’apparato VacuGene (Pharmacia LKB), seguendo le istruzioni della ditta. Dopo aver fatto il vuoto è stato versato sul gel un velo di acqua per 5-10 min, il gel è stato quindi sommerso con SSC 20x per circa 2 ore. Terminato il trasferimento la membrana è stata lavata con SSC 2x e l’RNA è stato fissato al Hoefer™ UVC 500 cross-linker (Amersham Biosciences).
Le membrane sono state poi ibridate con le sonde ottenute marcando il DNA dei cloni differenzialmente espressi, per confermare questo risultato e analizzarne l’espressione.
La marcatura del DNA plasmidico è avvenuta tramite PCR usando come stampo 10 ng del vettore estratto contenente l’inserto di DNA del clone da analizzare, seguendo le istruzioni fornite dalla ditta.
Il DNA è stato amplificato e contemporaneamente marcato mediante PCR in un volume di 50 µl usando le seguenti condizioni: 5µl di tampone 10x PCR Gold, 4µl di dNTP labeling Mix 10mM [2 mM dATP, 2 mM dCTP, 2 mM dGTP, 1.3 mM dATP, 0.75 mM digossigenina-11-dUTP, (ROCHE)], 2µl di Nested PCR primer 1 (10µM), 2µl di Nested PCR primer 2R (10µM), 7µl di soluzione di MgCl2 (25mM), 0,25 µl di AmpliTaqGold DNA Polymerase,
5U/µl; H2O a volume .
La membrana è stata preibridata per circa 2 ore nell'apposito termostato alla temperatura di 50 °C in 10 ml di soluzione DIG Easy-Hyb hybridization buffer (ROCHE).
La sonda marcata è stata denaturata in H2O a 100°C per 10 min e poi
immediatamente in ghiaccio. Quindi è stata aggiunta alla soluzione di preibridazione per avere una concentrazione finale della soluzione di ibridazione 25 ng/ml.
Si è proceduto quindi con l’ibridazione per 12 ore a 50°C, sostituendo la soluzione di preibridazione.
Le membrane sono state sottoposte ad una serie di lavaggi a diverso potere stringente (vedi par. 6.4). Per la rivelazione del segnale è stato utlizzato il
Lumigen CSPD* (ROCHE) (circa 1 ml per membrane di 100 cm2) che non richiede l’attivazione per 10 min a 37°C.
Al fine di confermare la validità dei risultati le membrane sono state strippate e ibridate con la sonda del gene costitutivo G3PDH.
SOLUZIONI UTILIZZATE:
Gel di agarosio (1,3%) - formaldeide (6%):
• Agarosio 1,3 g • H2O 62 ml • Formaldeide 37% 18 ml • MOPS 5X 20 ml Soluzione denaturante: • MOPS 5X 200 µl • Formaldeide 37% 150 µl • Formammide deionizzata 500 µl Tampone di corsa • MOPS 5X 200 ml • H2O 800 ml
MOPS 5x
• MOPS 0,2 M pH 7,0
• Na-Acetato 50 mM
• Na2EDTA 5 mM
Soluzione di preibridazione
• Dig Easy Hybridation Solution (Roche)
9.2
. RT-PCR RELATIVALa retrotrascrizione è stata eseguita partendo dall’RNA totale (4 µg) isolato dal cervello di ratto trattato e di controllo utilizzando il kit SuperScript™ II RNase H- Reverse Transcriptase (Invitrogen) e con Oligo(dT)12-18 Primer (Invitrogen) seguendo le istruzioni fornite dalla
ditta.
Al fine di evitare errori di quantificazione dovuti ad una diversa concentrazione di RT o errori di pipettamento, è stato opportuno utilizzare un controllo interno. La G3PDH, che presenta un’uguale espressione nel trattato e nel controllo, è stata utilizzata come gene costitutivo.
1 µl del primo filamento di cDNA è stato utilizzato come stampo per ogni reazione di amplificazione. Come primers sono stati utilizzati delle sequenze
gene-specifiche complementari a regioni nel 5’ e 3’ del clone da analizzare e della G3PDH; le sequenze sono riportate nella tabella1.
I primers sono stati scelti in modo da amplificare un frammento di 663 pb per la G3PDH, di 410 pb per il clone 3BC5 e di 430 pb per il clone 3BE3.
Per ogni reazione di amplificazione da 50 µl è stato usato 1 µl di stampo; 5 µl del tampone di reazione 10x; 1.7 µl di soluzione di MgCl2 50mM; 1µl di
dNTP Mix 10mM; 1µl di ogni primer 10µM, 0.5µl Euro Taq (EuroClone) 5U/µl, H2O sterile a volume.
La reazione così composta è stata posta nel termociclizzatore ed è stata iniziata l’amplificazione con la denaturazione dello stampo a 94°C per 4 min seguito da 24 cicli così composti: 94°C per 30 sec, 59°C per 30 sec, 72°C per 30 sec; al termine dei cicli è stata fatta seguire una estensione a 72°C per 7 min.
TABELLA 1 PRIMER SEQUENZE 3BC5 5' 5'-CCCATTAAACTGCTAAAAATAGTGGTGCG-3' 3BC5 3' 5'-CACACCTACGTGAAAGGGACGG-3' 3BE3 5' 5'-TTCATGAGTCATATTTAAATGGGCAGAACC-3' 3BE3 3' 5'-AGCATCATTTAACTCAGTGTGCAGGTTCG-3' G3PDH 5' 5'-GGAGAAGGCTGGGGCTCACCTG-3' G3PDH 3' 5'-TACAGCAACAGGGTGGTGGA-3'