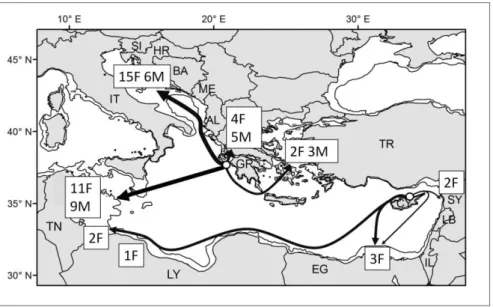
1
Università degli studi di Pisa
Dipartimento di Biologia
Corso di Laurea Magistrale in Conservazione ed Evoluzione
Comportamento migratorio e uso dello
spazio in femmine di tartaruga comune
Relatori: Prof. Paolo Luschi
Dott.ssa Resi Mencacci
Candidato: Giulia Cerritelli
2
Sommario
Riassunto 2
Abstract 3
1. Introduzione 4
1.1 Distribuzione della specie 4
1.2 Ciclo vitale 6
1.3 Metodi di marcatura e telemetria 11
1.4 La Caretta caretta nel Mar Mediterraneo 15
1.5 Scopo dello studio 20
2. Materiali e Metodi 21
2.1 Tartarughe dello studio 21
2.2 Filtraggio dei dati 24
2.3 Analisi delle rotte 25
2.4 Permanenza ai foraging ground: calcolo dell’home range
26
2.5 Permanenza ai foraging ground: confronto dati ambientali tra siti estivi ed invernali
28
3. Risultati 35
3.1 Analisi delle rotte 35
3.2 Permanenza ai foraging ground: calcolo dell’home range
54
3.3 Permanenza ai foraging ground: confronto dati ambientali tra siti estivi ed invernali
57
3
4
Riassunto
La tartaruga comune è la specie di tartaruga marina più diffusa nel Mar Mediterraneo. Gli individui adulti vivono per la maggior parte del tempo in aree di foraggiamento in ambiente neritico, da cui le femmine ogni 2-3 anni si spostano verso le aree riproduttive, compiendo migrazioni anche a lunga distanza. Gli adulti mostrano una fedeltà sia alle zone di riproduzione che a quelle di alimentazione.
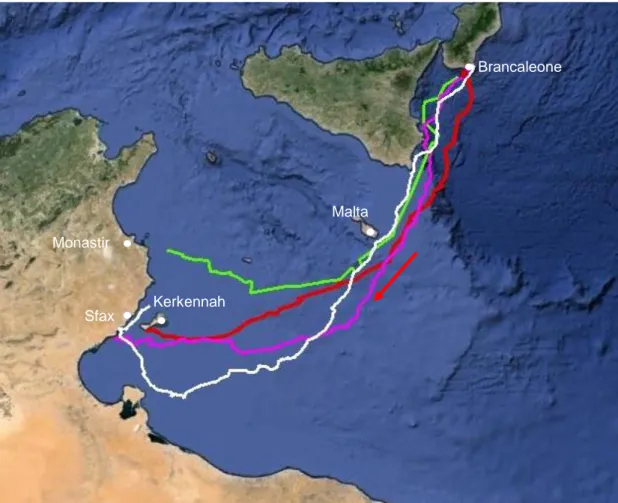
Nel presente studio sono stati seguiti gli spostamenti di 6 femmine adulte nidificanti in Calabria applicando al loro carapace trasmittenti collegate al sistema satellitare Argos. Le tartarughe, marcate in anni diversi, sono state seguite per periodi compresi tra 5 e 36 mesi, per cui è stato possibile ricostruire i movimenti compiuti tra nidificazioni successive (periodo di internesting), le migrazioni post-riproduttive dirette alle aree di foraggiamento, i movimenti a breve scala compiuti durante il soggiorno nelle zone di foraggiamento e, per due individui, anche la migrazione pre-riproduttiva diretta verso le coste calabre. In questo modo sono stati definiti gli home range occupati nei siti di foraggiamento in Tunisia, cercando anche di interpretare i comportamenti degli animali in queste zone attraverso l’analisi di parametri ambientali rilevati nell’area ottenuti dal database online Movebank.
Per ricostruire la rotta seguita dagli animali, i dati ottenuti da Argos sono stati filtrati per eliminare localizzazioni erronee e poco plausibili. Questo processo si è basato su criteri predeterminati che valutano le classi di accuratezza delle localizzazioni assegnate da Argos e la presenza di elevate velocità di spostamento tra localizzazioni successive, che risultino superiori a una soglia di velocità calcolata per ogni singolo individuo. Per determinare gli home range occupati dalle tartarughe nelle aree di foraggiamento sono state impiegate tecniche basate sul metodo Kernel con fattore di smussamento h ad hoc. A questo scopo, è stato utilizzato il pacchetto “adehabitat” del programma R. Infine, dopo aver identificato le due aree di foraggiamento annuali per ogni individuo, si sono confrontate le variabili ambientali (temperatura, batimetria, clorofilla, carbonio organico), che sono state rilevate nei due siti nello stesso periodo dell’anno.
I risultati ottenuti mostrano che le tartarughe nidificanti in Calabria frequentano siti di foraggiamento individualmente specifici in ambiente neritico, localizzati lungo le coste tunisine, vicino al golfo di Gabés. La migrazione post-riproduttiva segue una rotta abbastanza lineare e diretta verso tali siti, mentre nelle migrazioni pre-riproduttive le
5
tartarughe non raggiungono in modo diretto le coste calabre. Nei due casi studiati, una tartaruga ha prima raggiunto le coste siciliane, circumnavigando l’isola prima di fare rotta diretta verso la Calabria, mentre l’altra si è inizialmente spinta quasi fino in Grecia, per poi cambiare direzione e raggiungere le coste calabresi settentrionali, che poi ha costeggiato fino al sito di riproduzione. Nel periodo di internesting le tartarughe studiate hanno compiuto fino a 2-3 movimenti circolari in alto mare per ogni stagione riproduttiva. Nei siti di foraggiamento ciascuna tartaruga ha frequentato due aree principali, distanti circa 70 km tra loro, tra le quali si spostano sempre nello stesso periodo dell’anno. L’ampiezza degli home range occupati durante il soggiorno ai luoghi di foraggiamento tunisino è risultata differente tra i diversi individui studiati e il sito invernale è risultato generalmente più grande di quello estivo. Infine, l’analisi delle variabili ambientali ha rilevato come, sia in inverno che in estate, le tartarughe selezionino sempre l’area in cui la temperatura è più elevata, fornendo indicazioni sul ruolo della temperatura dell’acqua come elemento determinante nella scelta del sito di foraggiamento.
6
Abstract
Loggerhead sea turtles are widely distributed in the Mediterranean sea. Adults spend most of their time in neritic foraging grounds, from where they migrate towards their breeding areas every 2-3 years. Adults show a high fidelity to both their foraging sites and nesting beaches.
In the present study we tracked through Argos satellite telemetry the movements of 6 adult female loggerheads nesting along the Calabrian Ionian coasts, in the south of Italy. The turtles were marked in different years and monitored for a period ranging from 5 to 36 months, and this allowed us to reconstruct the female movements during the inter-nesting period, the post nesting migration, their stay at foraging grounds and, for two animals, the pre-breeding migration back towards Calabria. We also estimated the turtles home ranges during their stay at the foraging grounds and examined the role of environmental parameters, obtained from Movebank databases, in determining the choice of the foraging grounds in different periods of the year.
The data received from Argos have been filtered to exclude improbable locations and to reliably reconstruct the routes followed by the animals. To this aim we relied on a standard filtering process removing implausible locations determining movement speed exceeding a pre-determined speed threshold determined for each animal. Individual home ranges were calculated using Kernel methods with an h ad hoc, with the “adehabitat” package in the software R. Since each animal occupied two foraging sites during the year, we compared several environmental parameters (temperature, bathymetry, chlorophyll, organic carbon) between the two sites in the same period.
The results show that during the post nesting migration all females followed a rather direct route towards their individually-specific, neritic foraging grounds located in the Tunisian shelf, near the Gulf of Gabès. Here each turtle occupied two different areas during the year, one in the winter season and one in spring-summer, with all females moving from one area to another in the same period. The pre-breeding migration tracked in two turtles was much less direct than the post nesting one: in one case the female first reached Sicily and then circumnavigated it to reach the Calabria nesting beaches, while the second turtle nearly reached Greece before changing her direction to reach Calabria’s northern coast. During the inter nesting period, tracked female carried out 2 or 3 long-distance loops in the high seas. The home range size at the foraging areas varied between animals, and three
7
animals occupied larger home ranges during the winter than in summer. Finally, the comparison of environmental parameters in the two foraging sites showed that females chose to stay in the foraging ground with the highest sea surface temperature both in summer and during winter, providing indication for a role of water temperature in inducing turtles to move from a foraging area to another.
8
1. Introduzione
1.1 Distribuzione della specie
Le tartarughe marine si dividono in due grandi famiglie: Dermochelidi e Chelonidi. La famiglia dei Dermochelidi è rappresentata soltanto da una specie, la tartaruga liuto (Dermochelys coriacea), mentre le restanti specie di tartarughe marine, tra cui la tartaruga comune (Caretta caretta), rientrano nella famiglia dei Chelonidi.
La tartaruga comune è presente in tutti gli oceani e nel Mar Mediterraneo (Bolten & Witherington, 2003). Questa sua ampia distribuzione (Fig. 1.1) può essere spiegata con il fatto che si tratta di una specie piuttosto generalista che quindi riesce a vivere e ad alimentarsi sia in aree tropicali che temperate. La nidificazione è essenzialmente limitata alle aree tropicali e subtropicali, anche se si tratta della specie di tartaruga che si riproduce alle più alte latitudini (ad esempio nel Mediterraneo).
Nell’Oceano Atlantico C. caretta è distribuita dal Brasile fino al Canada ma la più alta concentrazione di tartarughe si trova per lo più nelle zone neritiche del Nord e Centro America; altri siti di foraggiamento sono lungo le coste africane (Senegal, Angola e Golfo di Guinea) mentre non ci sono evidenze che le tartarughe adulte sfruttino le coste europee per alimentarsi
Figura 1.1: Distribuzione della Caretta caretta nel mondo (zone di alimentazione)
(http://www.nmfs.noaa.gov/pr/pdfs/rangemaps/loggerhead_turtle.pdf)
9
(Ehrhart et al., 2003). Per quanto riguarda la riproduzione, la più alta concentrazione di nidi è in Florida con più di 67.000 nidi all’anno, anche se l’attività riproduttiva è presente anche in altre zone degli Stati Uniti, nel Messico, nei Caraibi e in Brasile. In Africa occidentale il principale sito di nidificazione è presso le isole di Capo Verde, con 1000 femmine nidificanti per anno, tuttavia si rilevano anche altri siti, con un minor numero di deposizione, in Marocco, Senegal, Cameron e Namibia (Ehrhart et al., 2003). In Nord America i siti di foraggiamento sono distribuiti lungo tutta la piattaforma continentale, con aree maggiormente frequentate quali il Golfo del Messico, Cuba e le Bahamas; le tartarughe vengono avvistate generalmente in aree neritiche con profondità inferiore ai 60 metri (Bolten & Witherington, 2003).
Nell’Oceano Pacifico le tartarughe comuni si riproducono soprattutto in Giappone e in Australia. Le tartarughe che nidificano lungo le coste del Giappone poi si spostano per foraggiare lungo le coste cinesi, coreane, giapponesi e dell’isola di Taiwan (Kamezaki et al., 2003). Le tartarughe che invece nidificano lungo la costa orientale dell’Australia presentano siti di foraggiamento ampiamente distribuiti sia lungo le coste australiane che in Nuova Caledonia e sporadicamente anche in Nuova Zelanda (Limpus & Limpus, 2003). Le coste del continente americano sono invece usate come aree di sviluppo e foraggiamento giovanili ma non dalle tartarughe adulte.
Le tartarughe comuni sono distribuite in modo più o meno esteso anche nell’Oceano Indiano (Baldwin et al., 2003) e in particolare sono state identificate tre aree principali di nidificazione: l’area sud occidentale (in Sud Africa, Mozambico e Madagascar), l’area più settentrionale (in Oman, India e Sri Lanka) e l’area orientale (in Australia occidentale). I siti con il maggior numero di nidificazioni si trovano in Oman con 20.000-40.000 femmine nidificanti ogni anno (Baldwin et al., 2003). Le tartarughe che nidificano in Sud Africa migrano soprattutto lungo la costa orientale africana, fino al Kenia e al Madagascar, mentre le tartarughe che nidificano in Oman migrano a nord verso il Golfo di Kutch, il Golfo di Oman e il Golfo Persico, e a sud verso il Golfo di Aden (Baldwin et al., 2003). Per quanto riguarda le tartarughe nidificanti in Australia, esse per la maggior parte non si allontanano dalle coste australiane: alcune sono state ricatturate in aree vicine alle spiagge di nidificazione mentre altre si sono spostate verso l’Australia orientale (Baldwin et al., 2003) .
10
1.2 Ciclo vitale
Come le altre specie di tartarughe marine, Caretta caretta vive per la maggior parte della sua vita in ambiente marino, sia in zone neritiche che oceaniche, e presenta un ciclo vitale abbastanza complesso (Fig. 1.2).
Il ciclo vitale inizia con la deposizione di 50-100 uova da parte della femmina sulla spiaggia di nidificazione. Dopo aver ricoperto con la sabbia le uova appena deposte in una cavità (camera delle uova), la femmina torna in mare senza prestare alcuna cura parentale. Al termine del periodo di incubazione i piccoli (hatchling), fuoriescono dalle uova e raggiungono il mare, spostandosi rapidamente nella zona oceanica. Qui si alimentano e si accrescono, e vi rimangono finché non raggiungono una dimensione che varia dai 40 ai 60 cm CCL (Curved Carapace Length), dopo di che i giovani si spostano in aree di foraggiamento neritiche, dove continuano a crescere fino a raggiungere la maturità sessuale. Gli adulti soggiornano per la maggior parte del tempo in queste aree di foraggiamento neritiche, in genere individualmente specifiche, da cui intraprendono ogni 2-3 anni, a seconda della popolazione di riferimento, una migrazione verso le aree di riproduzione (Bolten & Witherington, 2003). Quindi possiamo osservare 4 stadi vitali ben distinti: hatchling, giovani in ambiente oceanico, giovani in ambiente neritico e adulti.
Figura 1.2: Schema del ciclo vitale di C. caretta .
11
Hatchling
Dopo un periodo di incubazione, che in base alla temperatura ambientale varia tra i 42 e i 91 giorni (Miller, 1985), dalle uova fuoriescono gli hatchling. Generalmente, una volta rotto l’uovo, gli hatchling rimangono quiescenti per circa un giorno in modo da riassorbire il vitello, raddrizzare e rafforzare il piastrone; questo determina una riduzione del volume delle uova all’interno della camera del nido, creando uno spazio maggiore e favorendo il processo di emersione. Quindi i piccoli fuoriescono dalle uova e iniziano a risalire verso la superficie, un’attività stimolata dalle basse temperature e anche dai movimenti dei fratelli circostanti. Poiché le temperature più basse nella sabbia si raggiungono durante le ore notturne, la maggior parte delle emersioni degli hatchling sulla superficie della sabbia avviene di notte, il che consente loro di attraversare la spiaggia quando il rischio di ipertermia e di predazione è ridotto.
Una volta raggiunta la superficie, gli hatchling devono identificare la direzione verso cui dirigersi per avvicinarsi al mare. E’ stato dimostrato che per questo processo essi impiegano principalmente stimoli visivi: i piccoli identificano così la zona più luminosa dell’orizzonte (che in spiagge non antropizzate rappresenta la direzione del mare) presente all’interno di un “cono di accettazione”, che comprende solo una parte del campo visivo (Lohmann & Lohmann, 2003). Oltre a stimoli visivi gli hatchling possono anche riferirsi alla pendenza della spiaggia, che in genere indica la direzione del mare. Raggiunto il mare, i piccoli continuano ad allontanarsi dalla costa, seguendo due stimoli diversi, che vengono utilizzati in modo sequenziale in differenti momenti durante il movimento di allontanamento dalla costa. In una prima fase, quando sono appena entrati in acqua, i piccoli nuotano contro le onde, che in prossimità della costa tendono sempre a disporsi parallelamente alla stessa, riuscendo a percepire il movimento circolare associato alla propagazione delle onde e orientandosi perpendicolarmente rispetto ad esse (Lohmann et al., 1996). In una seconda fase, quando ormai sono in mare aperto, non potendo più fare affidamento sulla direzione delle onde come stimolo orientante, si riferiscono ad una bussola magnetica per mantenere la direzione che avevano assunto nelle fasi precedenti in modo tale da allontanarsi il più possibile dalla costa (Lohmann et al., 1996). L’intero comportamento viene definito “swim frenzy” in quanto i piccoli nuotano freneticamente perché, dal momento in cui emergono dall’uovo a quando raggiungono il mare aperto, sono bersaglio di moltissimi predatori. Durante tutta questa fase i piccoli non si alimentano ma dipendono esclusivamente dal vitello (Bolten et al., 2003). L’obiettivo finale di questa serie di movimenti orientati è il raggiungimento della correnti oceaniche al largo che facilitano il loro allontanamento dalla spiaggia di nascita e, soprattutto, forniscono loro protezione dai predatori e cibo per accrescersi.
12
Giovani in ambiente oceanico
Quando i piccoli hanno raggiunto l’ambiente oceanico iniziano ad alimentarsi ed entrano in un nuovo stadio vitale. Durante questa fase le tartarughe si spostano soprattutto in modo passivo, trasportate dalle grandi correnti oceaniche superficiali. Spesso ci si riferiva a questa fase, che può durare dai 6 agli 11 anni, come “lost years” in quanto non si conosceva di preciso cosa facessero i giovani e dove si spostassero. Oggi le informazioni a riguardo sono molto aumentate, soprattutto nell’Oceano Atlantico, grazie a catture accidentali di individui molto giovani nei pressi delle Azzorre, a ricatture lungo le coste americane di individui marcati in zone oceaniche, a studi con marcatori genetici (Bolten, 2003) e, recentemente, anche a studi in cui si sono marcati piccoli con trasmittenti satellitari (Mansfield et al., 2014). Le tartarughe in ambiente oceanico mostrano un comportamento alimentare epipelagico, ovvero rimangono nei primi 5 metri della colonna d’acqua e solo raramente effettuano immersioni ad alte profondità (Bolten, 2003).
In generale le tartarughe in questa fase sembrano muoversi in modo erratico, senza effettuare spostamenti tra due aree ben precise, come invece si osserva negli adulti, e i loro spostamenti devono essere considerati come una migrazione di sviluppo perché durante questo periodo accrescono la loro dimensione. Gli spostamenti dei giovani possono anche essere molto ampi e coprire interi bacini oceanici, in genere con un movimento da ovest verso est nell’emisfero settentrionale in accordo con il decorso delle correnti oceaniche.
Ad esempio, gli hatchling nati sulle coste dell’Atlantico occidentale intraprendono una migrazione di sviluppo all’interno della Corrente del Golfo, ricca di cibo, che li trasporta verso l’Oceano Atlantico orientale e le coste europee. I giovani possono rimanere per alcuni anni nell’oceano centro-orientale (ad esempio nelle vicinanze delle Isole Azzorre e Madeira) oppure anche entrare, attraverso lo Stretto di Gibilterra, nel Mar Mediterraneo (Bowen, 2003). Questo scenario è supportato sia da ricatture di animali marcati, sia da analisi genetiche che dimostrano la provenienza dal Nord America di tartarughe ritrovate a Madeira o alle Azzorre, o anche nel Mediterraneo occidentale. I giovani, prima di diventare maturi sessualmente e riprodursi, migreranno poi da queste aree verso le zone di foraggiamento in ambiente neritico, in genere lungo le coste americane o caraibiche, presumibilmente effettuando movimenti attivi (Bolten, 2003), come indicato da alcuni casi di movimenti ricostruiti via satellite (Eckert et al., 2008).
Anche nella popolazione giapponese di Caretta del Pacifico si osserva un comportamento molto simile; gli hatchling raggiungono la corrente del Kuroshio a est delle isole giapponesi e
13
con questa si spostano verso zone di foraggiamento e di sviluppo nel Pacifico nord-occidentale e lungo la costa degli Stati Uniti e del Messico. Giovani e adulti migrano poi nuovamente verso ovest, per raggiungere le coste del Giappone, della Cina, di Taiwan e della Corea, dove stabiliscono i loro siti di foraggiamento neritici. Questa ipotesi è stata confermata non solo da catture di animali marcati (Uchida & Teruya, 1988; Resendiz et al., 1998) e analisi genetiche (Bowen et al., 1995), ma anche da monitoraggi con telemetria satellitare, in particolare sono stati registrati i movimenti di una tartaruga adulta, cresciuta in cattività e rilasciata nella Baja California, verso le coste del Giappone (Nichols et al., 2000). Dalle analisi su marcatori genetici è stato dimostrato che l’origine delle tartarughe presenti nella Corrente Nord Pacifica e nella Baja California deriva per il 95 % dal Giappone e solo per il 5% dall’Australia (Bowen et al., 1995). Per questo motivo si era ipotizzato che gli hatchling australiani migrassero verso altre aree; recenti analisi genetiche e studi sulle dimensioni degli individui, hanno però dimostrato che i piccoli australiani attraversano anch’essi l’oceano, migrando verso le coste del Sud America, in Perù (Boyle et al., 2009).
Giovani in ambiente neritico
Come descritto sopra, quando gli individui giovani raggiungono dimensioni tra i 40 e i 60 cm CCL si spostano da un ambiente oceanico ad una zona neritica dove inizia un secondo periodo giovanile. In questa fase i giovani mostrano un’elevata fedeltà per il sito di foraggiamento neritico prescelto e, per alcune popolazioni, le aree occupate dai giovani coincidono con quelle degli adulti (Bolten, 2003). I giovani, quando vengono a trovarsi in ambiente neritico, modificano il loro comportamento alimentare che diventa epibentonico, cioè iniziano a nutrirsi sul fondo.
I giovani rimangono in ambiente neritico tra gli 8 e i 10 anni (Limpus, 1990), dove completano il loro sviluppo, raggiungendo la maturità sessuale e diventando adulti.
Adulti
Gli individui adulti rimangono per la maggior parte del tempo nei siti di foraggiamento neritici utilizzati nella fase finale dello sviluppo, da cui si allontanano solo ogni 2-5 anni (in base alla popolazione e all’età dell’individuo considerato), quando effettuano la migrazione verso le aree di riproduzione, dove avviene sia l’accoppiamento che la nidificazione (Schroeder et al.,
2003). Il periodo trascorso nei siti di foraggiamento è fondamentale soprattutto per le femmina
14
alla riproduzione come la vitellogenesi, la produzione delle uova, la deposizione delle uova e la migrazione sia di andata verso le zone riproduttive che di ritorno (Miller et al., 2003).
L’attività riproduttiva è limitata nel tempo e nello spazio: nel tempo poiché ciascuna comunità riproduttiva in genere ha una stagione di nidificazione ben definita (ad esempio tra maggio e agosto nell’emisfero boreale, e tra ottobre e marzo nell’emisfero australe); la limitazione nello spazio invece è dovuta al fenomeno del “natal homing”, cioè la tendenza della le femmine a riprodursi nella regione (o anche nel sito specifico) in cui sono nate (Miller et al., 2003). Una volta scelta una spiaggia dove deporre le uova, ciascuna femmina effettuerà successive deposizioni nella stessa stagione riproduttiva, in genere sulla stessa spiaggia o in zone adiacenti (Miller et al., 2003).
L’accoppiamento avviene una settimana prima dell’ovulazione e quindi le femmine immagazzinano gli spermatozoi, da utilizzare per la fecondazione, negli ovidotti (Miller et al., 2003). Le femmine si accoppiano con diversi individui e infatti spesso ci sono casi di paternità multipla nella stessa nidiata (Zbinden et al., 2007).
Nelle aree riproduttive osserviamo un comportamento diverso tra i due sessi:
- I maschi, che possono riprodursi anche ogni anno, arrivano per primi e rimangono attivi sessualmente per circa un mese o anche meno. Dopo essersi accoppiati con diverse femmine lasciano la zona precocemente nella stagione riproduttiva e ritornano direttamente ai siti di foraggiamento (Bolten et al., 2003);
- Le femmine sono attive sessualmente per circa 7-10 giorni e possono accoppiarsi con più maschi. Esse rimangono invece più a lungo nelle aree riproduttive, compiendo varie nidificazioni successive. Dopo qualche settimana dall’accoppiamento, esse emergono dall’acqua e risalgono la spiaggia di nidificazione, in genere di notte, raggiungendo la zona più lontana dalla battigia. Qua iniziano a scavare una buca, che può essere profonda dai 25 ai 60 cm, dove depongono le uova, infine ricoprono il nido e ritornano in mare. L’intero processo può richiedere anche svariate ore. Generalmente le femmine depongono tra i 2 e i 7 nidi ogni stagione riproduttiva, separate da intervalli temporali (“internesting”) della durata di 10-15 giorni, per cui si trattengono nella regione di riproduzione per alcuni mesi. Durante l’internesting le femmine generalmente rimangono nelle immediate vicinanze della spiaggia di nidificazione o comunque vicino alla costa, per riacquistare le forze necessarie alla successiva nidificazione (Bolten et al.,2003).
15
Gli adulti, a differenza dei giovani, mostrano una grande fedeltà sia verso le aree di riproduzione che verso i siti di foraggiamento per cui compiono migrazioni dirette verso luoghi determinati. In alcuni casi anche il percorso migratorio effettuato dai siti di nidificazione ai siti di foraggiamento risulta molto simile anche se compiuto in anni diversi (Broderick et al., 2007).
Altro comportamento peculiare degli adulti è rappresentato dagli spostamenti stagionali tra siti di foraggiamento, mostrato soprattutto dalle tartarughe che vivono in zone sub-tropicali o temperate. In autunno, quando le acque diventano fredde, le tartarughe che si trovano a medie latitudini si spostano verso un’altra area a latitudini più basse e con acque più calde, che viene generalmente indicata col nome di “over-wintering site” (Zbiden et al., 2008). Questo comportamento è presente anche nel Mar Mediterraneo: ad esempio, le tartarughe nidificanti a Zacinto (Grecia) che si alimentano nel nord Adriatico, nei pressi dell’Istria, nei mesi invernali si spostano alcune centinaia di km più a sud vicino alle coste albanesi e greche (Zbinden et al., 2008). Anche le tartarughe che nidificano a Cipro e si alimentano nel Golfo di Bomba, in Libia, compiono questi spostamenti stagionali, seppur di minor raggio (Broderick et al., 2007). E’ stato inoltre osservato come queste tartarughe occupino e utilizzino aree di foraggiamento più piccole in inverno che in estate, probabilmente perché riducono le attività e i movimenti nella stagione fredda (Broderick et al., 2007).
1.3 Metodi di marcatura e telemetria
Cattura-marcatura-ricattura
I primi studi sui movimenti delle tartarughe marine venivano effettuati con il sistema di cattura-marcatura-ricattura che permetteva di ottenere informazioni di base sugli spostamenti degli animali. Il metodo consisteva nel catturare l’animale, applicare una targhetta alle natatoie e poi rilasciarlo. In questo modo, se l’animale veniva ricatturato e riconosciuto dal numero della targhetta, oltre a rilevare la presenza di quel determinato individuo nella zona di cattura, si poteva conoscere anche l’area di provenienza.
Questo metodo è risultato sicuramente importante negli studi iniziali sull’argomento (Meylan et al., 1995), tuttavia presenta degli svantaggi non indifferenti: in primo luogo, esso fornisce informazioni solo sul punto di partenza e di arrivo di un certo spostamento ma rimangono sconosciute altre importanti informazioni come il percorso seguito dall’animale,
16
la sua velocità di movimento, la profondità di immersione, etc. In secondo luogo è un sistema poco efficiente poiché i tassi di ricattura sono in genere molto bassi. Per questo motivo quando lo sviluppo tecnologico ha prodotto nuovi strumenti capaci di rilevare in tempo reale gli spostamenti degli animali, l’uso esclusivo di questo metodo è stato in gran parte abbandonato.
Telemetria animale tramite il sistema Argos
La telemetria animale include tutti i metodi che consentono di ottenere informazioni su un animale libero sfruttando sistemi remoti. Il tracking rappresenta una parte della telemetria e costituisce l’insieme dei sistemi che permettono di localizzare geograficamente un animale così da ricostruirne i movimenti nello spazio. Esistono diverse tecniche per conoscere la posizione dell’animale e nel caso delle tartarughe marine la più usata è il radiotracking satellitare (Luschi, 2013).
Il radiotracking satellitare è basato sul sistema Argos (www.argos-sistem.org). Questo sistema fu creato negli anni ’70 dalla collaborazione tra il CNES (Centre National d’Etudes Spatiales, l’agenzia spaziale francese), la NASA (National Aeronautics and Space Administration, USA) e il NOAA (National Oceanic and Atmospheric Administration, USA) che misero a disposizione satelliti a bassa quota, a circa 850 km di altitudine per rilevare segnali radio provenienti da apposite radiotrasmittenti di cui può essere determinata la localizzazione. Ogni satellite segue un’orbita polare,ovvero ad ogni rotazione intorno alla terra sorvola i due poli, e ha un’area di visibilità di circa 5000 km di diametro. All’inizio il sistema veniva utilizzato per raccogliere dati meteorologici e oceanografici ma oggi è impiegato anche per molte altre applicazioni, tra cui gli studi di telemetria animale, inclusi quelli sulle tartarughe marine.
Affinché il sistema Argos funzioni è necessario applicare sull’animale, solitamente sul carapace, una trasmittente chiamata PTT (Platform Transmitter Terminal) che invia un segnale radio ogni 40-50 secondi che può essere recepito da un satellite Argos se in sorvolo sull’area in cui si trova la trasmittente. Il satellite riceve il segnale e re-invia le informazioni rilevate in tempo reale a stazioni riceventi dislocate in 40 punti diversi sulla Terra. Queste stazioni convogliano poi le informazioni a due stazioni di elaborazione delle informazioni (ground stations), una a Washington e una a Tolosa, dove le informazioni vengono raccolte, processate e infine inviate agli utenti (Fig. 1.3).
17
Nel sistema Argos, non sono i PTT a stabilire la propria collocazione nello spazio ma è il sistema satellitare a compiere il processo di localizzazione, elaborando i dati ricevuti dai satelliti (essenzialmente il tempo di ricezione e la frequenza del segnale radio in arrivo) e identificando il punto in cui l’animale si trova con procedure complesse basate sul calcolo dell’effetto Doppler della frequenza di trasmissione del segnale (Luschi, 2013).
Il processo di localizzazione ha un certo grado di imprecisione, e Argos stesso attribuisce ad ogni localizzazione una classe che codifica la qualità della localizzazione, soprattutto in termini di precisione. La classe di localizzazione attribuita dipende soprattutto dal numero di contatti avuti tra il satellite e il PTT e consente di determinare qual è l’errore compiuto nel posizionamento del PTT. Infatti le prime tre classi di localizzazione (3, 2, 1) vengono assegnate quando ci sono stati più di 4 contatti con il satellite ed hanno un errore di posizionamento stimato in circa 1-1,5 km. Le altre classi (0, A e B) invece sono attribuite quando i contatti con il satellite sono stati inferiori a 4 e non viene stimata la loro accuratezza, che però si ritiene sia attorno a 1-2 km (Hays et al., 2001; Witt et al., 2010); infine la classe Z rappresenta localizzazioni considerate non valide.
Figura 1.3: Schema sul funzionamento del sistema Argos. I PTT
inviano i segnali al satellite (freccia rossa) e il satellite a sua volta invia le informazioni raccolte alle ground stations (frecce blu). Queste infine le elaborano e mandano i dati finali all’utente (Da:
18
Questo sistema presenta vantaggi notevoli, tra cui il più importante è quello di poter seguire quasi in tempo reale gli spostamenti dell’animale e di poter ricostruirne i percorsi compiuti. L’informazione principale fornita dal satellite è la posizione del PTT (latitudine, longitudine, data e ora del contatto con il PTT) con le relative classi di localizzazione, ma si possono ricevere ulteriori informazioni da particolari sensori integrati nelle trasmittenti. Inoltre, una volta ottenuta la posizione dell’animale, l’utente può aggiungere al dato di localizzazione una serie di informazioni ambientali, quali ad esempio il tasso di clorofilla nel punto di trasmissione, la temperatura dell’acqua, la profondità del mare etc., che sono rilevate per la maggior parte tramite remote sensing. Questi dati sono messi a disposizione degli utenti da parte di varie organizzazioni e si trovano in siti web specializzati in cui sono riportati questi dati (es. http://oceancolor.gsfc.nasa.gov/ ).
Il sistema Argos può inoltre essere utilizzato come canale di informazioni. Se si associa al PTT un data logger, ovvero uno strumento in grado di registrare e mantenere in memoria determinate informazioni, i dati raccolti dal data logger possono essere inviati al satellite così da pervenire all’utente. Ad esempio si può applicare al PTT un registratore di profondità (Time Depth Recorder) e così ottenere informazioni sulla profondità e i tempi di immersione dell’animale seguito via satellite.
Il sistema però presenta anche alcuni svantaggi, quali:
- il PTT non può inviare segnali utili alla localizzazione quando l’animale si trova sott’acqua per cui negli animali marini la trasmissione avviene solo quando l’animale emerge per respirare;
- nell’insieme i satelliti non permettono una copertura continua globale della superficie terrestre, per cui esiste la possibilità che il segnale emesso di un PTT non sia captato dai satelliti se essi non stanno sorvolando l’area d’interesse;
- il sistema ha un costo non indifferente, derivante soprattutto dall’acquisto delle trasmittenti.
Nonostante questi svantaggi, il sistema Argos è comunque molto utilizzato e rimane il sistema migliore per seguire gli animali nei loro spostamenti e negli ultimi anni si sono ottenute moltissime informazioni sui movimenti e sul comportamento delle tartarughe marine (Luschi & Casale, in stampa; Godley et al., 2008). Ad esempio nelle tartarughe comuni sono state seguite le migrazioni post-riproduttive delle femmine sia in ambiente
19
oceanico (ad es. Hawkes et al., 2006; Hatase et al., 2002) che nel Mar Mediterraneo (ad es. Zbinden et al., 2008; Zbinden et al., 2011) ma sono stati ricostruiti anche gli spostamenti tra siti di alimentazione estivi ed invernali e i movimenti nei siti di foraggiamento (Godley et al., 2008). Recentemente, Mansfield e collaboratori sono riusciti a marcare con trasmittenti satellitari tartarughe comuni di 9 mesi, riuscendo a seguire i loro movimenti nella prima parte della migrazione di sviluppo all’interno della Corrente del Golfo, e confermando le teorie sui “lost years” proposte negli ultimi anni (Mansfield et al., 2014).
1.4 Caretta caretta nel Mar Mediterraneo
Nel Mar Mediterraneo sono presenti tre specie di tartarughe marine: Caretta caretta, Chelonia mydas e Dermochelys coriacea, ma soltanto le prime due vi si riproducono. La tartaruga comune è ampiamente distribuita sia nel bacino occidentale che orientale ed è in quest’ultima area che sono concentrate le aree di deposizione.
Bacino occidentale
Il Bacino occidentale (a ovest della penisola italiana) è un’importante area di foraggiamento, in particolare per gli individui giovani, che provengono sia dal bacino orientale del Mediterraneo che dalle spiagge di nidificazione dell’Oceano Atlantico. Prove della presenza di individui atlantici in Mediterraneo derivano sia da ricatture di individui marcati nell’Atlantico occidentale (Manzella et al., 1988; Bolten et al., 1992) che da analisi di marcatori molecolari. Queste ultime hanno dimostrato che gli individui di origine atlantica (dai Caraibi soprattutto) sono molto numerosi nel bacino occidentale del Mediterraneo, in alcune zone anche in numero superiore rispetto alla popolazione mediterranea. Ad esempio è stato messo in evidenza da studi sugli aplotipi che gli individui atlantici frequentano soprattutto la piattaforma continentale africana, il Mare di Alboran e le Isole Baleari mentre gli individui di origine mediterranea si trovano soprattutto nel bacino orientale del Mediterraneo ma possono anche sostare nella parte settentrionale del bacino occidentale, lungo le coste francesi (Carreras et al., 2006). Si ipotizza che questa differenza nella distribuzione dei giovani si verifichi a causa delle correnti superficiali presenti nel Mediterraneo che impediscono un interscambio tra le due popolazioni poiché le tartarughe atlantiche e mediterranee sfruttano correnti differenti per spostarsi (Carreras et al., 2006).
20
Molte informazioni sui movimenti dei giovani di Caretta in Mediterraneo occidentale sono state ottenute da dati di cattura, marcatura e ricattura e solo recentemente sono iniziati studi che utilizzano marcature con trasmittenti satellitari di individui medio-grandi in fase avanzata di sviluppo. In generale, i loro movimenti sono essenzialmente erratici e non hanno gli spostamenti stagionali, presenti invece negli adulti (Fig.1.4). Non mancano tuttavia i casi in cui gli animali prediligono soprattutto alcune aree; ad esempio da uno studio con tracking satellitare (Revelles et al,. 2007) è emerso che gli individui mostravano una certa fedeltà verso aree come il Mare di Alboran, dove la distribuzione delle tartarughe sembra dipendere dalla batimetria e dalle correnti superficiali. In un altro esempio (Cardona et al., 2005) sono stati marcati con trasmittenti 5 giovani catturati alle Baleari, poi seguiti nei loro spostamenti verso la costa algerina dopo il rilascio; studiando i movimenti si è ipotizzato che gli individui in parte si muovessero attivamente controcorrente e in parte sfruttassero due correnti superficiali, la corrente algerina e la corrente catalana, per essere trasportati prima lungo la costa algerina e poi nuovamente verso l’arcipelago delle Baleari.
Studi di tracking satellitare sui giovani presenti lungo la costa spagnola hanno messo in evidenza un comportamento degli individui diverso in base alla grandezza dell’animale (Eckert et al., 2008): le tartarughe con un CCL< 57 cm sono rimaste nel bacino occidentale del Mediterraneo, nei pressi delle Baleari, oppure si sono spostate a est, verso il Mar Ionio e il Mar Tirreno; gli individui con un CCL>57cm hanno mostrato movimenti più diversificati, infatti alcuni si sono comportati come le tartarughe più piccole, mentre altri hanno addirittura lasciato il Mediterraneo e sono entrati nell’Oceano Atlantico fino a raggiungere le coste Americane. Altri autori (Hochscheid et al., 2007) hanno rilevato che gli individui presenti nella parte centrale del Mediterraneo, con un CCL > 45 cm, possono anche mostrare una certa fedeltà verso aree di foraggiamento neritico, come la piattaforma continentale tunisina, la Libia e l’Italia meridionale. Oltre a individui giovani il Mediterraneo occidentale è frequentato anche da adulti provenienti dalle aree riproduttive in Grecia e Turchia. Da dati di tracking satellitare si sono seguiti gli spostamenti di adulti nel Mar Tirreno lungo le coste italiane (Luschi et al., 2013).
21
Bacino orientale
Il Bacino orientale ospita i siti di nidificazione di Caretta nel Mediterraneo, che sono i più settentrionali tra i siti di riproduzione della tartaruga comune nel mondo (Casale & Margaritoulis, 2010). La maggior parte delle nidificazioni hanno oggi luogo in Grecia, con oltre 3400 nidi ogni anno, e in Turchia, con circa 2200 nidi l’anno. Altre importanti zone di nidificazione sono in Siria, Libano, Israele, Cipro, Libia, Egitto e Tunisia (Casale & Margaritoulis et al., 2010). Non sono state registrate nidificazioni in Adriatico orientale, in Algeria e Marocco e anche Malta recentemente non ha più ospitato nidi. Analisi genetiche su maschi e femmine adulti del Mediterraneo hanno evidenziato la presenza di 4 popolazioni indipendenti, caratterizzate da aplotipi esclusivi in Grecia, Turchia, Cipro e Israele tra le quali il flusso genico è ridotto o assente (Carreras et al., 2007). In Italia il principale e più importante sito di nidificazione è rappresentato dalla costa ionica centro-meridionale della Calabria e, in particolare, il settore compreso tra Capo Bruzzano e Melito Porto Salvo (circa 40 km) dove si concentra il 60% dei nidi deposti annualmente a livello nazionale (Mingozzi et al., 2007; Mingozzi, 2010). Altre aree in cui è stata documentata un’attività di nidificazione, anche se con frequenze inferiori, sono le isole pelagie siciliane, la costa meridionale della Sicilia e la rimanente parte della costa calabrese, sia ionica che tirrenica. Infine vengono pure rilevate nidificazioni sporadiche in Puglia, Basilicata, Campania, Sardegna (Casale & Margaritoulis, 2010; Mingozzi, 2010) e addirittura in Toscana nell’estate 2013 (fonte Internet:
Figura 1.4: Movimenti di giovani di C. caretta. Le aree evidenziate con cerchi
tratteggiati indicano i siti di foraggiamento di tartarughe che non hanno intrapreso migrazioni a lunga distanza. (Luschi & Casale, in stampa)
22
http://www.ansa.it/web/notizie/canali/energiaeambiente/natura/2013/10/03/Caretta-caretta-nati-47-esemplari-un-giorno_9403140.html).
I dati a disposizione sui movimenti compiuti dagli adulti di Caretta nel Mediterraneo orientale sono essenzialmente limitati agli individui in fase riproduttiva. I primi studi vennero compiuti marcando femmine sulle spiagge di nidificazione con targhette alle pinne, e dai dati di ricattura si rilevò la presenza di adulti in tutto il bacino orientale, in particolare nella piattaforma continentale tunisina e libica (area del Golfo di Gabés, Tunisia) e nel Mare Adriatico settentrionale, pertanto si ipotizzarono movimenti post riproduttivi diretti soprattutto verso queste aree (Bolten, 2003). Questa prima indicazione è stata poi confermata dagli studi con trasmettitori satellitari applicati su femmine nidificanti e su maschi catturati in acqua nella fase riproduttiva.
La maggior parte delle informazioni si riferisce agli adulti di poche colonie riproduttive, soprattutto quelle dell’isola di Zacinto, in Grecia e a Cipro. Le tartarughe nidificanti a Zacinto migrano verso il Mare Adriatico settentrionale e in altri siti della piattaforma continentale tunisina (Golfo di Gabés) e aree limitrofe (Zbinden et al., 2008; Zbinden et al., 2011), mentre le tartarughe che nidificano a Cipro si spostano lungo la costa africana fino a raggiungere la piattaforma continentale antistante l’Egitto, la Libia e la Tunisia (Broderick et al., 2007) (Fig.1.5). A causa delle difficoltà nel catturare e marcare i maschi riproduttori, si hanno meno informazioni sugli spostamenti di questi individui; solo recentemente stanno aumentando gli studi con trasmittenti satellitari, che mostrano come la maggior parte dei maschi permanga nello Stretto di Sicilia, nel Golfo del Gabès (Tunisia) e nel Mar Egeo, lungo la costa greca (Fig.1.6). Ad esempio in un lavoro recente di Schofield et al. (2010) sono stati seguiti gli spostamenti di 10 maschi, che si riproducevano vicino Zacinto, verso le aree di foraggiamento situate nel nord e sud Adriatico, nel Mar Egeo, vicino alla Turchia, e lungo la costa greca, nei pressi di Zacinto (Schofield et al., 2010).
Una volta raggiunte le zone di foraggiamento, le tartarughe adulte sono tendenzialmente stanziali, anche se è stato osservato che possono effettuare spostamenti stagionali a breve distanza verso zone di foraggiamento a latitudini inferiori e con acque più calde. L’esempio più tipico è quello delle tartarughe che si alimentano nell’Adriatico settentrionale nei mesi estivi che poi si spostano nel mar Ionio e vicino alle coste albanesi in inverno (Zbiden et al., 2007). Allo stesso modo, Broderick et al. (2007) hanno rilevato che femmine che foraggiano sulla piattaforma continentale libica durante i mesi invernali utilizzano aree neritiche più ridotte
23
rispetto a quelle utilizzate nei mesi estivi e si spostano in acque più profonde, pur mantenendosi nella stessa area generale di alimentazione.
Nel bacino orientale sono presenti anche individui giovani. Dalle catture accidentali sappiamo che individui molto piccoli (CCL < 40cm e a volte anche <20cm) frequentano il Mare Adriatico (Casale & Margaritoulis, 2010), il che fa ipotizzare che questa sia un’importante area di sviluppo soprattutto per i giovani provenienti dai siti di nidificazione in Grecia (Casale et al., 2012), che possono anche cibarsi di animali bentonici nel Nord Adriatico (Lazar et al., 2008). Anche il Mar Ionio sembrerebbe essere un’importante area di sviluppo, soprattutto per le tartarughe provenienti dalla Grecia e dalla Turchia (Casale & Margaritoulis, 2010). Inoltre
Figura 1. 5: Movimenti post riproduttivi di femmine dalle aree di
nidificazione. (Luschi & Casale, in stampa)
Figura 1.6: Movimenti post riproduttivi di maschi. (Luschi & Casale, in
24
Casale et al. (2012) mostrano come anche l’area dello stretto di Sicilia, vicino all’isola di Lampedusa, sia una zona frequentata da individui immaturi; le tartarughe, marcate con trasmittenti satellitari e rilasciate in mare vicino Lampedusa, si spostavano tra la piattaforma continentale tunisina, la parte occidentale della Libia e Malta, muovendosi tra zone oceaniche e neritiche (Casale et al., 2012).
1.5 Scopo dello studio
Nella presente tesi sono stati elaborati i dati ottenuti via satellite relativi agli spostamenti di 6 femmine adulte nidificanti in Calabria. Le tartarughe sono state equipaggiate con trasmittenti collegate al sistema satellitare Argos nelle stagioni riproduttive 2010, 2011, e 2013 e sono state seguite per periodi compresi tra 5 e 36 mesi. Per le tartarughe marcate nel 2013 ho partecipato alla ricerca notturna delle femmine in nidificazione e all’applicazione di trasmittenti satellitari.
In questo modo è stato possibile ricostruire i movimenti compiuti tra nidificazioni successive (internesting), le migrazioni post-riproduttive dirette alle aree di foraggiamento, i movimenti compiuti durante il soggiorno nelle zone di foraggiamento e, per due individui, anche la migrazione pre-riproduttiva della stagione successiva diretta verso le coste calabre. I dati di localizzazione ottenuti sono stati filtrati ed elaborati anche associando alle localizzazioni valori di alcuni specifici parametri ambientali (batimetria, temperatura delle acque superficiali, clorofilla ecc.) in modo da interpretare i comportamenti seguiti dagli individui soprattutto durante la permanenza ai siti di foraggiamento tunisini.
25
2. Materiali e Metodi
2.1
Tartarughe dello studio
Le tartarughe impiegate per il presente studio sono state localizzate durante la deposizione nell’ambito del progetto di ricerca “TARTACare Calabria”, progetto promosso e coordinato sin dal 2000 dal Dipartimento di Biologia, Ecologia e Scienze della Terra dell’ Università della Calabria (responsabile Prof. Antonio T. Mingozzi). Tale progetto è, in particolare, finalizzato allo studio e alla tutela della popolazione di tartarughe marine nidificanti lungo i 39 km di costa ionica reggina compresi tra Capo Bruzzano e Melito Porto Salvo, principale area di nidificazione italiana (Mingozzi, SHI 2010).
Le tartarughe venivano avvicinate dagli operatori TARTACare sulla spiaggia di nidificazione dopo aver aspettato che terminassero l’attività di deposizione e camuffamento del nido o dopo un tentativo di nidificazione andato a vuoto; quindi venivano bloccate durante il loro percorso per tornare in mare e confinate in un recinto di legno composto da 4 pannelli che venivano assemblati sul momento (Fig.2.1). Ogni femmina, a cui è stato assegnato un nome (Tabella 2.1), veniva marcata con targhette numerate applicate sulle pinne anteriori e la trasmittente veniva fissata al carapace con delle resine epossidiche, seguendo procedure standard comunemente usate negli esperimenti di tracking satellitare. L’intero procedimento può durare dalle due alle tre ore in quanto si deve aspettare che la resina si asciughi e solo allora l’animale viene rilasciato e può tornare in mare.
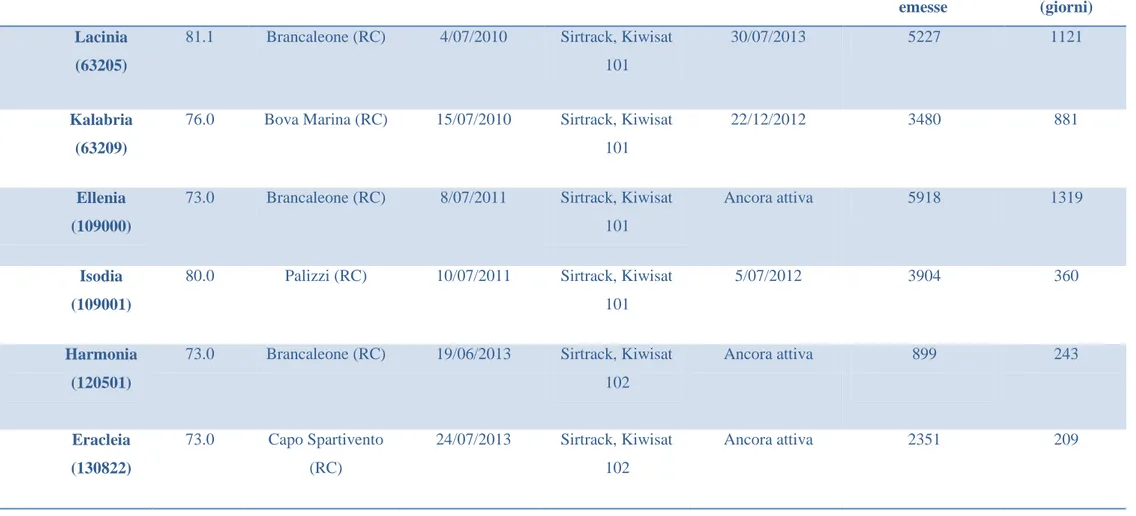
I 6 individui analizzati sono stati marcati in anni differenti, due nel 2010, due nel 2011 e due nel 2013 (Tabella 2.1). I PTT utilizzati sono tutti della ditta Sirtrack (Havelock North, Nuova Zelanda) e nessuno rileva parametri ambientali.
26
Figura 2.1: La tartaruga Eracleia durante la notte di applicazione del PTT. Nella foto a sinistra la tartaruga ha terminato la deposizione e si sta muovendo verso il mare (Foto
27
Tartaruga (N° PTT)
CCL (cm) Luogo marcatura Data marcatura Tipo trasmittente Data ultima trasmissione Numero localizzazioni emesse Durata tracking (giorni) Lacinia (63205)
81.1 Brancaleone (RC) 4/07/2010 Sirtrack, Kiwisat 101
30/07/2013 5227 1121
Kalabria (63209)
76.0 Bova Marina (RC) 15/07/2010 Sirtrack, Kiwisat 101
22/12/2012 3480 881
Ellenia (109000)
73.0 Brancaleone (RC) 8/07/2011 Sirtrack, Kiwisat 101
Ancora attiva 5918 1319
Isodia (109001)
80.0 Palizzi (RC) 10/07/2011 Sirtrack, Kiwisat 101
5/07/2012 3904 360
Harmonia (120501)
73.0 Brancaleone (RC) 19/06/2013 Sirtrack, Kiwisat 102 Ancora attiva 899 243 Eracleia (130822) 73.0 Capo Spartivento (RC) 24/07/2013 Sirtrack, Kiwisat 102 Ancora attiva 2351 209
28
2.2 Filtraggio dati
Il filtraggio dei dati ottenuti da Argos è la fase preliminare dell’analisi e ricostruzione delle rotte. Le localizzazioni (o fix) delle tartarughe determinate dal sistema Argos non possono infatti essere utilizzate direttamente per ricostruire le rotte, in quanto alcune di esse possono essere erronee e poco plausibili (ad esempio si possono avere due localizzazioni successive rilevate nella stessa data e ora, oppure due localizzazioni successive con latitudine e longitudine coincidenti anche se rilevate in orari differenti). E’ quindi necessario prima eliminare questi fix dal dataset iniziale.
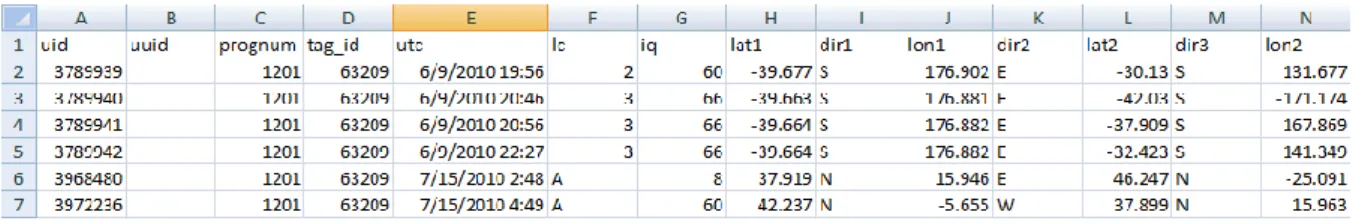
I dati Argos iniziali sono stati gestiti attraverso il programma STAT (Satellite Tracking and Analysis Tool, Coyne & Godley, 2005), disponibile gratuitamente sul sito www.seaturtle.org, tramite il quale è anche possibile associare alle localizzazioni dell’animale informazioni di tipo ambientale (batimetria, clorofilla, etc.). STAT accede al server del sistema Argos ogni giorno e scarica tutte le localizzazioni disponibili, provvedendo inoltre ad associare a ogni fix valori di parametri ambientali predeterminati ottenuti da altri server. Questi dati vengono poi conservati in un database da cui gli utenti possono prelevare i dati già tabulati, ad esempio in fogli di lavoro Excel (Fig.2.2).
Per il mio studio ho quindi scaricato da STAT i dati ricevuti organizzati in tabelle (Fig.2.2) che comprendevano i dati sulla localizzazione (data, ora, latitudine, longitudine) e la corrispondente classe di localizzazione.
In seguito si calcolava il tempo intercorso e la distanza in chilometri tra localizzazioni successive tramite apposite formule inserite nel foglio di lavoro; e da questi si derivava la velocità tenuta tra due fix successivi, calcolata dal rapporto tra la distanza percorsa tra di essi e il tempo intercorso (Fig. 2.3).
29
Una volta ordinati i dati si poteva quindi procedere con il filtraggio. Innanzitutto vengono eliminati i punti sulla terraferma ad eccezione delle localizzazioni ottenute nei periodi in cui la tartaruga sta nidificando. Per filtrare le altre localizzazioni invece veniva utilizzato come criterio una soglia di velocità, che era determinata stimando la velocità massima a cui ogni individuo poteva viaggiare. La velocità di soglia veniva calcolata per ogni femmina facendo la media delle velocità tra le localizzazioni di classe di accuratezza 3, 2 e 1 (le più affidabili), e aggiungendo al risultato il 20% del suo valore. Veniva quindi valutato se la velocità risultante tra due localizzazioni successive era superiore rispetto a quella di soglia: in questo caso veniva eliminato uno dei due fix che avevano prodotto questa velocità sopra soglia. La scelta di quale dei due fix era da eliminare teneva conto della loro classe di localizzazione (si cerca di mantenere soprattutto i fix di classe 3, 2 e 1 rispetto alle altre classi) ed anche del percorso seguito dall’animale (si cerca di ricostruire una rotta il più possibile lineare, senza tratti a zig-zag con angoli acuti molto piccoli).
Per ricostruire le rotte delle singole tartarughe i dati filtrati sono stati visualizzati con Google Earth.
2.3 Analisi delle rotte
Per analizzare i dati, i movimenti ricostruiti delle femmine sono stati suddivisi in successive fasi: i) periodo/i di internesting, ii) migrazione post riproduttiva, iii) permanenza ai siti di alimentazione (foraging ground) e iv) migrazione pre-riproduttiva. Per ognuna di queste fasi è stata calcolata la velocità media mantenuta dai singoli individui e analizzati eventuali cambiamenti di velocità durante le migrazioni post- e pre-riproduttive e durante i movimenti di internesting utilizzando la media delle velocità giornaliere calcolate tra fix filtrati successivi. Per le migrazioni pre e post riproduttive è stato inoltre analizzato lo
Figura 2.3: Esempio di tabella finale dei dati di localizzazione. In questa tabella sono contenuti il numero
progressivo della localizzazione, la data e l’ora, la classe di localizzazione, latitudine, longitudine e i valori calcolati sulla distanza, il tempo e la velocità tra due localizzazioni successive.
30
Straightness Index (SI, Batschelet 1981), calcolato come rapporto tra la distanza in linea d’aria tra il punto di partenza e quello di arrivo e la lunghezza del percorso seguito dall’individuo. Lo SI misura quindi quanto lineare è la rotta seguita dall’animale rispetto al punto di arrivo, dando così un’indicazione sull’efficienza del percorso migratorio. Lo SI può assumere valori da 0 a 1, più il risultato è vicino a 1 maggiore sarà l’efficienza dell’animale nel raggiungere il punto di arrivo della migrazione, pertanto questo indice è inversamente correlato alla tortuosità del percorso.
2.4 Permanenza ai foraging ground: calcolo dell’home range
In ambito etologico l’home range di un animale viene definito come quell’area frequentata dall’individuo nelle sue normali attività di raccolta del cibo, accoppiamento e cura della prole (Burt, 1943). Ci sono vari modi per determinare e calcolare l’home range di un animale; tra questi, quello più valido si basa sulla cosiddetta “Utilizzation distribution” (UD), proposta da Van Winkle nel 1975. Secondo questo metodo, l’uso dello spazio dell’animale può essere descritto come una densità di probabilità che restituisce una frequenza relativa di presenza dell’animale su un piano bidimensionale.
Worton (1989) propose poi di utilizzare il metodo kernel per stimare la UD con le localizzazioni dell’animale. Il principio alla base del metodo prevede di applicare a ogni localizzazione una funzione bivariata kernel, i cui valori risultanti serviranno per fare una media e ottenere il valore finale. In ogni funzione bivariata viene considerato il fattore di smussamento (h) che controlla l’ampiezza della funzione posta in ogni punto. E’ quindi molto importante scegliere l’h migliore per una corretta stima dell’home range.
Il calcolo dell’home range nel nostro caso è stato effettuato utilizzando il pacchetto “adehabitatHR” di R, gestito attraverso il software “R studio”, utilizzando il metodo kernel standard e cercando di identificare il migliore tra i vari fattori di smussamento e una idonea ampiezza della griglia. In particolare, i dati delle singole tartarughe sono stati testati con 3 diversi fattori di smussamento (href, LSCV e h ad hoc) prima di scegliere il migliore (Fig. 2.4). L’href (fattore di smussamento di riferimento) presuppone che i dati siano distribuiti normalmente, quindi se le localizzazioni sono raggruppate piuttosto che distribuite normalmente, questo fattore di smussamento tende a sovrastimare l’home range; il fattore
31
LSCV, calcolato con il sistema Least Square Cross Validation, molto spesso tende a creare home range composti da poligoni multipli e sottostimati. Quindi per riuscire a delineare un unico poligono che rappresenti realmente l’home range dell’animale, si è scelto di utilizzare un fattore di smussamento definito “h ad hoc” (Kie, 2013). Questo h viene calcolato per ogni tartaruga moltiplicando l’href del singolo individuo progressivamente con valori da 0.9 a 0.1(es. href 0.9, href 0.8…..,href 0.1); il principio alla base di questo metodo è quello di identificare il più piccolo incremento di href che permetta di creare un unico home range al 95% non disgiunto e senza nessuna lacuna al suo interno (Fig.2.5).
L’altro parametro da definire nell’analisi è l’ampiezza della griglia su cui calcolare la UD, in questo caso è stata scelta una ampiezza della griglia di 200 celle.
La prima operazione è stata calcolare la UD con l’h e la griglia scelte. La UD viene stimata al centro di ogni pixel di una griglia sovrapposta alle localizzazioni, in modo da ottenere una densità di probabilità di trovare l’animale in un certo punto dello spazio. Dalla UD si determina poi l’home range, ovvero l’area minima in cui c’è una certa probabilità di trovare l’animale. Ad esempio un home range al 95% corrisponde alla più piccola area in
Figura 2.4: Confronto fra home range al 95% con diversi fattori di smussamento: href (a), LSCV (b), h ad
hoc (c).
a b
32
cui la probabilità di trovare l’animale è pari a 0.95. Nel mio caso è stato calcolato l’home range delle varie tartarughe al 95% e al 50%.
2.5 Permanenza ai foraging ground: confronto dati ambientali tra
siti estivi e invernali
Lo studio degli home range ai foraging ground ha mostrato che le tartarughe studiate si spostavano tra due aree ben precise e distinte, sempre nello stesso periodo, e anno dopo anno nelle tartarughe seguite in anni successivi, occupando quindi un’area di foraggiamento invernale e una estiva, situate a poca distanza tra loro (vedasi sotto per i dettagli). E’ stata quindi effettuata una successiva analisi confrontando per ogni individuo una serie di parametri ambientali tra i foraging ground invernali e quelli estivi nello stesso periodo dell’anno, in modo da cercare di comprendere perché gli individui utilizzassero queste due aree distinte.
A questo scopo è stato necessario rilevare i parametri ambientali presenti in una data area frequentata dalla tartaruga in un determinato periodo dell’anno, confrontandoli con quelli dell’area non frequentata dallo stesso individuo nello stesso periodo. Sono stati cioè confrontati i parametri rilevati in inverno nell’area invernale con i parametri rilevati sempre
Figura 2.5: Esempio di scelta per l’h ad hoc di Lacinia. Dopo aver moltiplicato
progressivamente l’href con valori da 0.1 a 0.9, si sceglie il fattore di smussamento migliore che identifica home range non disgiunto e senza nessuna lacuna al suo interno. In questo caso href 0.5.
33
in inverno nell’area estiva, e viceversa. Per ottenere le informazioni ambientali per i foraging ground nei mesi in cui l’individuo non era presente sono state create delle tartarughe ‘fittizie’ che occupavano le aree non frequentate nelle varie stagioni. Per queste tartarughe quindi si è creato un nuovo dataset di localizzazioni in cui le coordinate dei fix rimanevano uguali a quelle dei dati reali mentre la data della rilevazione veniva spostata di 6 mesi, immaginando quindi che gli individui rimanessero nei foraging ground estivi durante il periodo invernale e nei foraging ground invernali nel corso dei mesi estivi. Si è così creata una ‘tartaruga falsa’ per ogni individuo.
Questi set di dati, sia delle tartarughe vere che fittizie, sono stati poi caricati su Movebank (www.movebank.org), un database online gratuito in cui si possono caricare dati di tracking animale, organizzarli, condividerli, analizzarli e anche archiviali. Nel nostro caso è stato utilizzato lo strumento Env-DATA disponibile in Movebank, che consente di associare le localizzazioni degli animali a informazioni ottenute da dataset ambientali. Questi dataset forniscono milioni di dati ambientali di vario genere e su scala globale con molte misurazioni disponibili dal 1970 ad oggi.
Le informazioni ambientali utilizzate nella nostra analisi sono:
la temperatura sulla superficie marina (misurata dagli strumenti MODIS presenti a bordo di satelliti EOS AM e EOS PM, http://oceancolor.gsfc.nasa.gov/);
la concentrazione della clorofilla-a sulla superficie marina rilevata da foto satellitari da parte di strumenti MODIS, che consentono di stimare questa concentrazione con risoluzione di 4 km in base al colore del mare in quel punto,
la concentrazione di carbonio organico calcolate allo stesso modo della clorofilla dagli strumenti MODIS;
la batimetria delle singole localizzazioni ricavata dal database ETOPO2 (www.ngdc.noaa.gov/mgg/global/global.html).
Una volta ottenuti i dati da Movebank, questi sono stati ripartiti in due stagioni: inverno, che comprende i mesi da novembre all’aprile dell’anno successivo, ed estate, che include i mesi da maggio ad ottobre; non sono stati considerati per l’analisi statistica i mesi in cui l’animale si è spostato da un sito di foraggiamento all’altro. Infine, per ogni parametro
34
ambientale, è stata calcolata la media mensile per ogni anno di monitoraggio, nei singoli foraging ground invernali ed estivi in cui la presenza della tartaruga era reale e fittizia.
L’analisi statistica sui parametri ambientali è stata svolta su due livelli: intra- e inter- individuale.
Per l’analisi statistica intra-individuale sono state confrontate, per ogni individuo, le medie mensili di ogni parametro ambientale tra i siti reali e quelli fittizi sia nella stagione invernale che estiva. Nel caso della batimetria invece sono state paragonate le medie mensili nelle due stagioni dei due siti realmente frequentati dagli animali. Per questi confronti è stato impiegato il test t-Student e il test t-Student per dati appaiati in presenza di dati distribuiti normalmente; o il test non parametrico equivalente, il test Mann-Whitney e il test di Wilcoxon, nel caso di distribuzioni non normali.
Per effettuare un’analisi più completa che considerasse tutti gli individui è stata utilizzata la procedura Generalized Estimating Equation (GEE; Fitzmaurice et al., 2004), in modo tale da tenere in considerazione il fatto che i nostri dati non sono indipendenti, in quanto derivanti da misure ripetute sullo stesso individuo (pseudo replicazione). Questo metodo viene definito semi-parametrico in quanto prevede assunzioni parametriche per la media e la varianza/covarianza, mentre non richiede assunzioni sul tipo di distribuzione dei dati. Per utilizzare la GEE bisogna definire 3 elementi: un modello che metta in relazione la variabile indipendente con le covariate (nella nostra analisi è stata scelta una funzione gaussiana), la varianza dei dati e una struttura di correlazione dei dati, definita a priori.
Nel mio caso i dati sono stati raggruppati in cluster rappresentati dall’abbinamento individuo-anno, considerando cioè indipendentemente i dati ottenuti monitorando lo stesso individuo in anni successivi. Inoltre all’interno di ogni cluster è stata introdotta una correlazione temporale tra punti contigui, considerando quindi che misurazioni effettuate in successione sono correlate tra loro. In questo modo per ogni parametro ambientale considerato sono stati creati due modelli, uno per la stagione estiva e uno per la stagione invernale.
Anche per l’analisi interindividuale della batimetria sono stati confrontati i dati tra i due siti reali, e pertanto si è scelto di utilizzare per l’analisi un test ANOVA che risultava più semplice rispetto al GEE ma più potente di un test t-Student.
35
3. Risultati
Per le tartarughe le cui trasmittenti hanno smesso di inviare segnali sono stati analizzati tutti i dati ottenuti, mentre per le tartarughe i cui PTT sono ancora in funzione sono stati analizzati i dati ottenuti fino al 17 febbraio 2014.
3.1 Analisi delle rotte
Cinque delle 6 tartarughe hanno esibito un comportamento spaziale piuttosto uniforme, e per queste abbiamo suddiviso le attività monitorate in diverse fasi: internesting, migrazione post-riproduttiva, permanenza ai siti di alimentazione e migrazione pre- riproduttiva, come descritto di seguito. La tartaruga Harmonia ha invece mostrato un comportamento completamente diverso dalle altre femmine e verrà trattata separatamente.
Periodo di Internesting
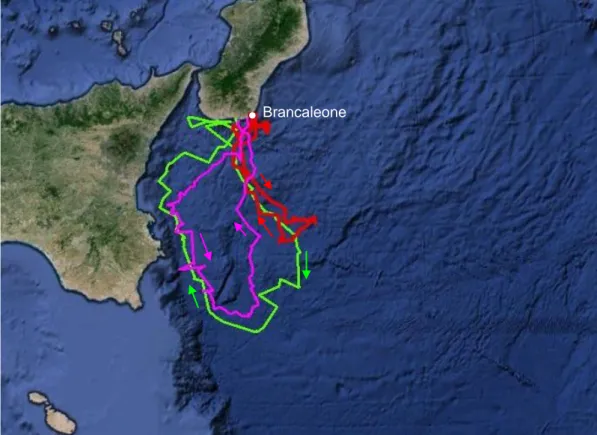
In 3 tartarughe monitorate (Isodia, Kalabria e Lacinia) sono stati ricostruiti i movimenti compiuti durante la fase di internesting tra nidificazioni successive, o nella stessa stagione in cui è stato applicato il PTT o nella stagione riproduttiva successiva. Queste tartarughe hanno compiuto movimenti a larga scala facilmente distinguibili dagli altri tipi di spostamento, effettuando spesso un ampio loop in ambiente pelagico, prima allontanandosi dalla zona di nidificazione e poi facendovi ritorno con rotta diretta (Fig.3.2, Fig.3.3, Fig.3.4).
L’unico caso in cui non è stato monitorata questa fase è quello di Ellenia la quale, dopo la marcatura con trasmittente, ha immediatamente abbandonato la Calabria per migrare verso le aree di foraggiamento tunisine. Nella tartaruga Eracleia, infine, risulta difficile indicare un preciso periodo di internesting in quanto questa femmina ha mostrato un comportamento riproduttivo particolare (Fig.3.1). Infatti, dopo aver nidificato a Capo Spartivento (RC) il 23 luglio, Eracleia è rimasta dal 24 al 29 luglio davanti alla costa di Melito Porto Salvo (RC), effettuando movimenti a piccola scala e a bassa velocità (media 1.2 km/h). In seguito si è spostata in Sicilia, nella zona tra Siracusa e Pozzallo, dove è rimasta dall’8 al 13 agosto, compiendo piccoli loop davanti alla costa con una velocità media di 1.8 km/h (Fig.3.1). Non abbiamo elementi per stabilire se Eracleia ha nidificato anche in questa occasione.